-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaAnalytický systém online extrakce na pevné fázi ve spojení s tandemovou spektrometrií a jeho klinické využití
Online solid phase extraction analytical system coupled to tandem mass spectrometry for clinical applications.
Objective:
Introduction to the online solid-phase extraction system coupled to tandem mass spectrometry (SPE-MS/MS). Assessment of the suitability of this system for clinical laboratories as an alternative to liquid chromatography coupled to tandem mass spectrometry (LC-MS/MS).Methods:
Characterization of functional principle of the online SPE-MS/MS system. Description of crucial parameters that has to be followed and evaluated during method development. Brief summary of so-far published methods based on utilization of this technique from the fields of toxicology, therapeutic drug monitoring and clinical biochemistry.Results and discussion:
The online SPE-MS/MS system enables fast determination of analytes in common biological matrices. The system ensures extensive cleaning of the sample. High sensitivity is provided by utilization of multiple reaction monitoring (MRM) mode in tandem mass spectrometer. The analysis of one sample takes usually around 15 sec. This leads to significant speeding of the analytical process in comparison to methods based on LC-MS/MS. At the same time all requirements for validation of bioanalytical methods are met. The key parameters assessed during method development process are the matrix effect, carry-over, potential isobaric interferences and fragmentation of labile conjugates in the ion source.Conclusion:
The online SPE-MS/MS system can be used advantageously in the range of clinical applications, particularly in the case of exogenous analytes occurring in the sample at relatively high concentrations. Nevertheless, this system cannot be exploited for all types of analytes. In many cases, it can, however, significantly speed up and cheapen the analytical process and suitably complement the LC-MS/MS systems.Keywords:
SPE-MS/MS, RapidFire, mass spectrometry, solid phase extraction, quantitative analysis.
Autoři: I. Vrobel 1,2; D. Friedecký 1,2; T. Adam 1,2
Působiště autorů: Ústav molekulární a translační medicíny, Univerzita Palackého v Olomouci 1; Oddělení klinické biochemie, Fakultní nemocnice a Univerzita Palackého v Olomouci 2
Vyšlo v časopise: Klin. Biochem. Metab., 26, 2018, No. 1, p. 11-17
Souhrn
Cíl:
Seznámení se systémem online extrakce na pevné fázi ve spojení s tandemovou hmotnostní spektrometrií (SPE-MS/MS). Posouzení vhodnosti jeho použití v klinických laboratořích jako alternativa ke konvenčním separačním technikám.Metodika:
Popis principu funkce online SPE-MS/MS systému. Uvedení klíčových parametrů, jež je nutné sledovat a vyhodnocovat při vývoji metody. Souhrn dosud publikovaných prací založených na této technologii z oblasti toxikologie, terapeutického monitorování léčiv a klinické biochemie.Výsledky a diskuse:
Online SPE-MS/MS systém umožňuje rychlé stanovení analytů v obvyklých biologických matricích. Systém využívá extrakci na pevné fázi v on-line uspořádání pro přečištění vzorku. Následná vysoká selektivita detekce je dosažena použitím tandemového hmotnostního spektrometru na principu trojitého kvadrupólu v režimu monitorování vybraných reakcí (MRM). Obvyklý čas analýzy jednoho vzorku se pohybuje okolo 15 sek, což vede k výraznému zrychlení analytického procesu ve srovnání s LC-MS/MS metodami při dodržení validačních parametrů bioanalytických metod. Klíčové parametry vyhodnocované v průběhu vývoje metody jsou matricové efekty, „carry-over“ efekt, potenciální izobarické interference a fragmentace labilních konjugátů v iontovém zdroji. Publikované práce založené na použití online SPE-MS/MS systému popisují analýzy imunosupresiv, busulfanu, tyrosin kinázových inhibitorů a dalších látek.Závěr:
Online SPE-MS/MS systém lze s výhodou použít u řady klinických aplikací, zejména v případech exogenních analytů vyskytujících se ve vzorku v relativně vysokých koncentracích. Nicméně, nemůže být použit pro všechny typy analytů. V mnoha případech však může výrazně urychlit a zlevnit analytický proces a vhodně tak doplnit LC-MS/MS systémy.Klíčová slova:
SPE-MS/MS, RapidFire, hmotnostní spektrometrie, extrakce na pevné fázi, kvantitativní analýza.Úvod
Hmotnostní spektrometrie (MS) patří v současnosti mezi časté vybavení klinických laboratoří, a to zejména z důvodů širokého spektra použití, od terapeutického monitorování léčiv („therapeutic drug monitoring“; TDM), přes klinickou proteomiku či toxikologii až po mikrobiologii [1]. Limitací této technologie však stále zůstává její vysoká pořizovací cena a u některých metod i časová náročnost. Analýza jednoho vzorku pomocí rutinně používaných metod založených na spojení vysokoúčinné kapalinové chromatografie s tandemovou hmotnostní spektrometrií (LC-MS/MS) může trvat mezi 2 a 30 min, v závislosti na aplikaci. Dále je nutné vzít v potaz i náročnost přípravy vzorků, která se odvíjí od sledovaných analytů i použitého biologického materiálu. Může se jednat o jednoduché vysrážení proteinů organickým činidlem obsahujícím interní standard nebo o komplexní několikastupňové postupy jako například extrakce z kapaliny do kapaliny („liquid-liquid extraction“; LLE). Analýza jedné série vzorků tak může trvat i několik hodin. Pro zachování přijatelných časových intervalů od odběru vzorku po odevzdání výsledků lékaři („turn-around time“; TAT) může být pro laboratoř někdy nutné využívat více těchto drahých přístrojů současně. Nebo lze u určitých aplikací za účelem zrychlení analytického procesu použít níže popisovaný online SPE-MS/MS systém.
Princip online SPE-MS/MS
Online SPE-MS/MS je automatizovaný přístroj spojený s hmotnostním spektrometrem, nejčastěji typu trojitého kvadrupólu (QqQ) nebo hybridního analyzátoru Q-TOF (kvadrupól s analyzátorem doby letu), který je využíván pro detekci analytů. Extrakce vzorku probíhá po jeho aspiraci z 96jamkové destičky do systému na SPE patroně („cartridge“). Nasávání vzorku a plnění SPE patrony obvykle netrvá déle než 4 sek (fáze „Aspirate“, obr. 1). Přístroj při tom nasaje z destičky zhruba 15 až 20 µl vzorku, které stačí k naplnění smyčky pro vzorek („sample loop“, obr. 1). Ta má objem přesně 10 µl, přebytečný vzorek je odplaven do odpadu. Tím je zaručena opakovatelnost nástřiku. Po naplnění smyčky dojde k posunutí ventilu (fáze „Load/Wash“, obr. 1) a vymytí vzorku ze smyčky v proudu vodné mobilní fáze (v případě použití SPE patrony s reverzní stacionární fází) na SPE patronu. Balastní látky, které nejsou zadržovány na stacionární fázi SPE patrony, jsou vymyty do odpadu. Sledované analyty zůstávají zachyceny a v dalším kroku (fáze „Elute“, obr. 1) jsou eluovány pomocí zpětného toku organické mobilní fáze B do hmotnostního spektrometru, ve kterém jsou detekovány. Poté, před nasátím dalšího vzorku, následuje fáze re-ekvilibrace, v níž se polohy ventilů a toky mobilních fází vrátí do výchozího nastavení (fáze „Re-equilibrate“, obr. 1). V průběhu vývoje metody jsou optimalizovány časy jednotlivých fází: aspirace vzorku, plnění SPE patrony, eluce analytů a re-ekvilibrace. Stejně tak se optimalizují průtoky (obvykle 0,5 – 1,5 ml/min) mobilních fází A, B i C. Mobilní fáze C (čistící roztok) má většinou podobné složení jako B a slouží k promytí kapilár systému. Trvání celého cyklu závisí na chemické struktuře analytů, stacionární fázi patrony, složení mobilních fází a na jejich průtoku. SPE patrony jsou určeny k mnohonásobnému použití a je běžné, že jsou schopné snést i více než 4000 nástřiků. Podobně jako v kapalinové chromatografii, je pro SPE patrony dostupná celá řada stacionárních fází zahrnující C18, C8, C4, fenyl, kyano nebo HILIC. Komerčně dostupný online SPE-MS/MS systém RapidFire (Agilent) pojme do zásobníku s automatickou výměnou až šest patron. Jedná se o jednokanálový přístroj neumožňující paralelní zapojení patron. Nicméně, jejich výměna probíhá v průběhu analýzy dle nastavení metody a nevyžaduje přerušení měření. To zvyšuje efektivitu jak při vývoji metody, tak i při rutinním provozu.
Obr. 1. Diagram of the online SPE-MS/MS system (adapted from RapidFire documentation, Agilent, USA). 1) Aspirate: samples are aspirated in to the sample loop by applying a vacuum through valves V4 and V1. 2) Load/Wash: Valve V1 switches the positions and the sample is loaded from the sample loop onto the SPE cartridge in the flow of mobile phase A. Analytes are captured on the stationary phase. Other samples constituents that are not retained on the cartridge are washed into waste. 3) Valves V2 and V3 switch their positions and the analytes are back-washed from the cartridge to the mass spectrometer in the flow of the mobile phase B and detected. In the same time the cleaning solution (mobile phase C) flows and washes the tubing including sample loop. 4) All valves switch back to the initial positions and the system is re-equilibrated before the aspiration of the next sample. 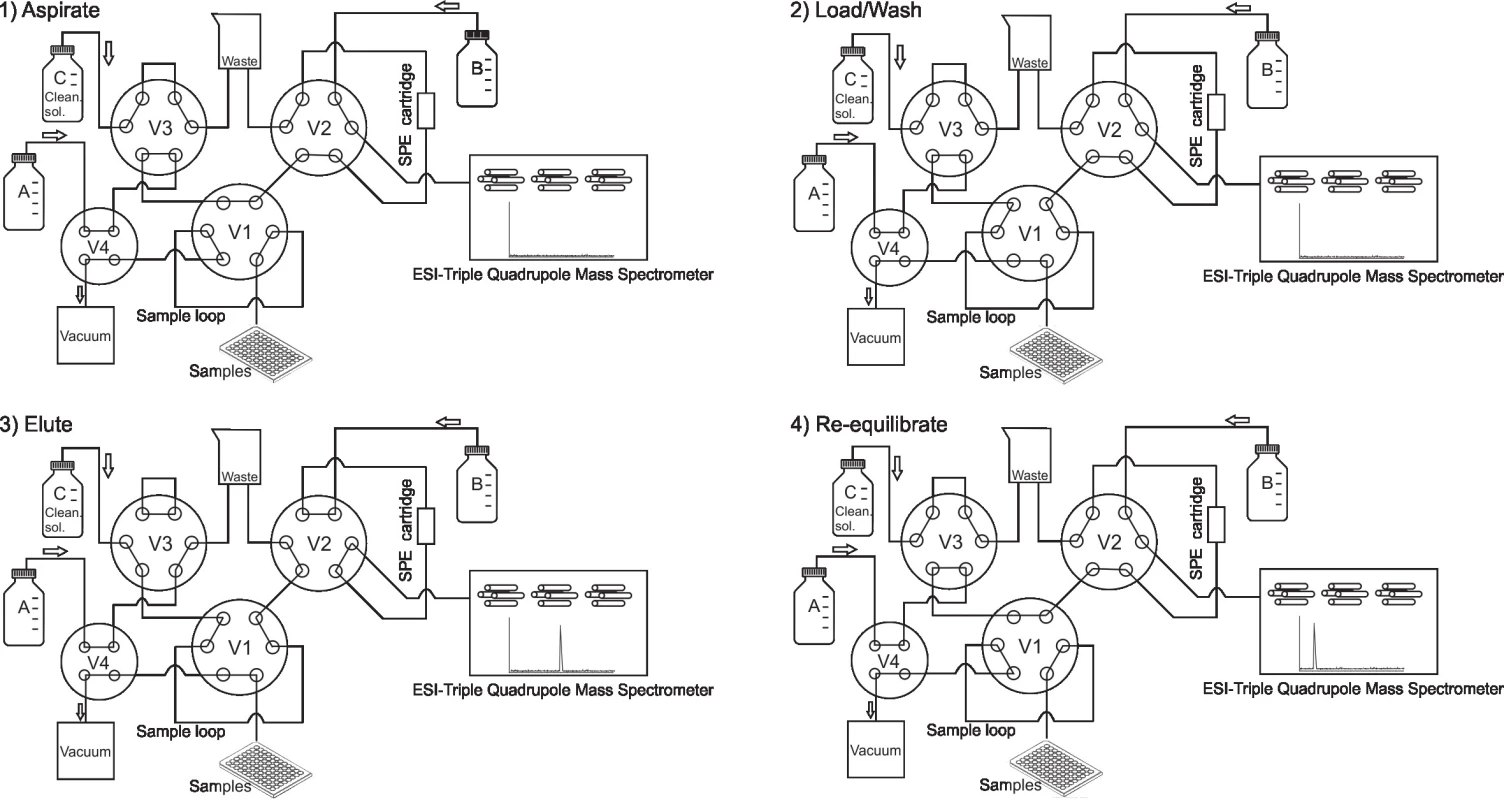
Analýzy vzorků jedné sekvence se ukládají do jednoho chromatografického záznamu. Signály pocházející z po sobě následujících vzorků jsou od sebe odděleny úseky, kdy je tok mobilní fáze do hmotnostního spektrometru přerušen, což usnadňuje následnou integraci ploch pod píky. Po skončení analýzy celé sekvence (jedné či více destiček), se chromatografické píky integrují za pomocí software, který také rozdělí záznam podle sekvence.
Online SPE zajišťuje přečištění vzorku od interferentů, které se na patroně nezadrží. Ve srovnání s kapalinovou chromatografií však u online SPE nedochází k separaci analytů a dalších látek zachycujících se na SPE patroně. Do hmotnostního spektrometru jsou vyplaveny současně ve fázi eluce. Při použití online SPE s patronami na principu reverzní fáze, dochází zejména k odstranění anorganických solí, velmi polárních látek a iontů. Právě ty jsou však často zodpovědné za signifikantní matricové efekty v iontovém zdroji hmotnostního spektrometru, v případě, že vstupují současně se sledovanými analyty.
Ve srovnání s průtokovou vstřikovací analýzou („flow injection analysis“, FIA), která také nevyužívá chromatografickou separaci a je založena na přímém nástřiku vzorků do hmotnostního spektrometru, zajišťuje technika online SPE zejména částečné snížení vlivu matricových efektů. Dále nedochází k znečištění hmotnostního spektrometru a oddaluje se potřeba častého čištění iontového zdroje. To je u FIA metod nevyhnutelné z důvodu přímé aplikace nepřečištěných vzorků. Na druhou stranu, použití LC-MS/MS umožňuje při vhodném nastavením separace a přepínání ventilů i úplné odstranění vlivu matricových efektů i snížení potřebnosti častého čištění iontového zdroje, ovšem za cenu delšího času analýzy.
Nejvýznamnější předností online SPE-MS/MS systému je jeho rychlost, s čímž souvisí zvýšení prostupnosti vzorků („throughput“). Při průměrném čase 15 sec na vzorek, trvá analýza jedné 96jamkové destičky méně než 30 min.
Vývoj a optimalizace metod
Smysl použití online SPE-MS/MS spočívá v urychlení a zjednodušení analytických postupů při zachovaní vysoké míry spolehlivosti a robustnosti. Bioanalytické metody určené pro stanovování koncentrací endogenních či exogenních látek v klinických vzorcích musí být před zavedením do rutinní praxe validovány. Cílem validace je důkaz, že vyvinutá metoda je vhodná pro zamýšlené použití. Často se při validaci vychází ze směrnic amerického Úřadu pro kontrolu potravin a léčiv („Food and Drug Administration“, FDA) [2] či Evropské lékové agentury („European Medicines Agency“, EMA) [3]. Mezi základní validační parametry patří: selektivita, přesnost, správnost, opakovatelnost, linearita, citlivost, mez detekce a mez stanovitelnosti, vliv matrice vzorku, stabilita analytů, carry-over a robustnost [4]. V případě online SPE-MS/MS techniky patří mezi kritické parametry zejména carry-over, vliv matrice vzorku a selektivita, kterými se budeme podrobněji zabývat dále. Validované metody jsou vhodné pro rutinní použití k analýze velkých souborů vzorků. U již validovaných metod se doporučuje, pro zajištění vysoké správnosti a spolehlivosti, provádět kalibraci s každou sérií vzorků.
Příprava vzorků
Analýze předchází příprava vzorků spočívající v odstranění balastních endogenních látek ze vzorku. Lze použít obvyklé metody přípravy vzorků jako v případě LC-MS/MS metod, včetně LLE či off-line SPE. Nicméně, časově náročné postupy se v případě on-line SPE-MS/MS používají spíše výjimečně. Běžnější v praxi je využití jednodušší a rychlejší deproteinace následované centrifugací. Analyty ze vzorku jsou při tom extrahovány do použitého deproteinačního činidla. V případě analýzy léčiv ve vzorcích krevní plazmy dochází navíc při deproteinaci k jejich uvolnění z vazby na plazmatické bílkoviny. Tím je umožněno stanovení jejich celkové koncentrace. Mezi nejrozšířenější deproteinační činidla patří organická rozpouštědla mísitelná s vodou (metanol, acetonitril), soli těžkých kovů (síran zinečnatý), silné kyseliny (kyselina trichloroctová) či jejich kombinace [5].
Pokud výsledný supernatant získaný po centrifugaci obsahuje vysoký podíl organické fáze (v případě použití SPE patron s reverzní fází) je vhodné jej ještě před analýzou naředit vodnou fází. A to z toho důvodu, že pokud je nasát přímo neředěný organický supernatant, nemusí dojít k dostatečnému zachycení analytů na stacionární fázi, ale k jejich vymytí organickým rozpouštědlem. Při ředění však může dojít ke ztrátě citlivosti v případě nízko koncentrovaných analytů. Pak je nutností zakoncentrování vzorků, např. odpařením a následným rozpuštěním v odpovídajícím množství vodné mobilní fáze. Na druhou stranu pro tento typ analytů může být vhodnější spíše použít LC-MS/MS systém, který i když je časově náročnější, dosahuje při vhodně zvolené separaci vyšší citlivosti.
Alternativně lze k deproteinaci použít vodný alkalický roztok síranu zinečnatého či silných kyselin. Při použití patron s reverzní fází lze aplikovat neředěný supernatant. Hmotnostní spektrometr nebude deproteinačním činidlem kontaminován, jelikož není, na rozdíl od analytů, zadržován na SPE patroně a ve fázi „Load/Wash“ dojde k jeho vymytí do odpadu.
Carry-over
Jako u jiných metod, které pracují v online režimu, je potenciál pro carry-over při použití online SPE-MS/MS poměrně vysoký a je nezbytné jej vyhodnotit v průběhu vývoje metody. Carry-over nastává při nedostatečné eluci analytu z SPE patrony pocházející z jednoho vzorku. Jeho zbývající část je vyplavena až při eluci vzorku následujícího. To má za následek falešné zvýšení intenzity analytu. Některé, hlavně lipofilní analyty se mohou též adsorbovat na stěny kapilár, které se používají pro transport mezi LC a MS. Postupně jsou pak vymývány a ovlivňují výsledky dalších analýz. Vyhodnocení tohoto fenoménu se obecně provádí analýzou vysoko koncentrovaného vzorku následovaného několika slepými („blank“) vzorky. Předcházet carry-over efektu lze použitím silnější eluční mobilní fáze (mobilní fáze B), a čistícího roztoku (mobilní fáze C), nebo prodloužením časů eluce a re-ekvilibrace. Výjimečně je nutné, za účelem kompletní eliminace analytů z předcházejícího vzorku, nechat nastřikovat slepé vzorky po každém měřeném vzorku. Vzhledem k rychlosti samotné analýzy to však může být přijatelný způsob řešení.
Použití interních standardů a matricové efekty
Za účelem zajištění minimálních rozdílů v účinnosti extrakce a pro spolehlivou kvantifikaci analytů se v hmotnostní spektrometrii používají interní standardy. Obvykle se používají strukturní analoga analytů či izotopem značené analyty, které se strukturně neliší od sledovaných látek, až na přítomnost stabilních těžších izotopů vodíku, uhlíku či dusíku. To změní jejich molekulární hmotnost a hodnotu poměru hmotnosti k náboji („mass to charge ratio“ m/z) detekovanou hmotnostním spektrometrem. Fyzikálně-chemické vlastnosti a stejně tak i retenční chování zůstávají však téměř identické s analyty [6]. Tyto interní standardy bývají také prakticky stejně ovlivněny matricovými efekty.
Matricové efekty v hmotnostní spektrometrii jsou důsledkem různé účinnosti ionizace, která je závislá na přítomnosti látek (anorganické soli, lipidy, apod.) vstupujících současně s analyty do hmotnostního spektrometru. Často se projevují jako snížení intenzity sledovaných látek („iontová suprese“), což může mít nepříznivý vliv na citlivost metody. Pozorované však bývá i zvýšení odezvy analytů („iontový enhancement“) [7]. Online SPE zajistí částečné pročištění vzorku a dokáže tak do určité míry snížit negativní vliv matricových efektů na analýzu. V některých případech to však není dostatečné a kvůli nízké citlivosti je pak nezbytné použít kapalinovou chromatografii.
Matricové efekty se v případě online SPE-MS/MS systému hodnotí kvantitativně obvykle následujícím způsobem: Vzorek připravený v několika opakováních se standardním přídavkem analytu i interního standardu po extrakci se porovnává se vzorkem připraveným v roztoku bez matrice. Je důležité provést větší množství opakovaných analýz, aby byl odhalen případný kumulativní matricový efekt, který může být způsoben případnou pomalou elucí vysoce zadržovaných látek z předchozích nastříknutých vzorků. Přítomnost kumulativního matricového efektu se projeví postupným snižováním intenzit analytů. Analýzou vzorků pocházející z různých zdrojů (např. rozdílní dárci krevní plazmy), lze vyhodnotit tzv. relativní matricový efekt. Jeho podstatou je rozdílný obsah látek ovlivňujících ionizaci analytu v jednotlivých vzorcích [8]. Pokud nelze matricové efekty odstranit, je nutné pro spolehlivou analýzu zajistit jejich kompenzaci, aby nedocházelo k negativnímu ovlivnění přesnosti, správnosti a dalších parametrů metody. Za tímto účelem by měl být vybrán interní standard, který bude vždy ovlivněn matricovým efektem ve stejné míře jako analyt. V tom případě dochází ke kompenzaci vlivu matricového efektu a poměr analyt/interní standard zůstává neovlivněn. Tuto podmínku nejlépe splňují právě izotopicky značené standardy. Jian a kol. ve svém hodnocení online SPE-MS/MS systému ukázali, že použití strukturně podobných interních standardů vede k vyšší variabilitě poměru analyt/interní standard. Tak variační koeficient poměru propranolol/tolbutamid po analýze šesti různých šarží krysí plazmy byl 12,28 %. Zatímco při použití izotopicky značeného D7-propranololu byla variabilita mezi vzorky výrazně nižší (variační koeficient 1,21 %) [9]. I když jsou izotopem značené interní standardy vhodnější, vzhledem k jejich vysoké ceně a možné nedostupnosti, není použití strukturně podobných interních standardů v online SPE-MS/MS metodách vyloučené. Jen je důležité vyhodnotit výše uvedené parametry a zajistit tak spolehlivost analýzy.
Interference izobarickými látkami
Absence chromatografické separace a její nahrazení extrakcí na pevné fázi je hlavním faktorem umožňujícím několikanásobné zrychlení analýzy. Na druhou stranu právě tato okolnost má za následek i vyšší riziko interferencí, pocházejících z izobarických látek či polohových izomerů, které mají stejnou hodnotu m/z. To znamená, že například morfin a hydromorfon či kodein a hydrokodon nemohou být při použití online SPE-MS/MS od sebe rozlišeny.
Dostatečnou selektivitu ve většině případů dokáže zajistit sledování dvou a více tranzicí analytů v režimu monitorování vybraných reakcí („multiple reaction monitoring“; MRM) v hmotnostním spektrometru typu QqQ. Princip MRM režimu spočívá v izolaci vybraného iontu na prvním kvadrupólu, jeho fragmentaci v kolizní cele na druhém kvadrupólu, následné izolaci vybraného produktového iontu na třetím kvadrupólu a jeho detekci. Vhodné je zejména sledování poměru intenzit mezi tranzicemi, který by měl zůstávat konstantní. I přesto se doporučuje důkladně ověřit selektivitu při vývoji metody. Izobarické interference pocházející z endogenních látek odhalí analýza dostatečného množství slepých vzorků pocházejících od různých jedinců. Potenciální exogenní izobary mohou pocházet např. z jiných léků, které pacienti užívají. Před analýzou je vhodné ověřit anamnézu pacientů a zjistit, jaké další léky používají. Danou metodou jsou potom analyzovány standardy těchto léků. Interference se projeví jako signál ve vzorku, ve kterém se kromě testovaného léčiva nenachází žádný analyt. Daná metoda pak nemůže být pro vzorky obsahující interferující látky použita. Interferovat mohou i látky, které mají rozdílnou hodnotu m/z než sledované analyty a to tehdy, pokud tvoří adukty se složkami mobilní fáze, či produkují fragmenty v iontovém zdroji, které již stejnou hodnotu m/z mají a navíc v MRM režimu tvoří produktové ionty o stejné m/z jako analyty (mají identické tranzice). Při použití hmotnostního spektrometru typu QqQ mohou interferovat i látky neizobarické, ale s blízkou hodnotou m/z. A to z toho důvodu, že šířka izolačního okna kvadrupólu se pohybuje mezi 0,4 a 1,0 Da. V těchto případech by mohlo být řešením použití hmotnostního spektrometru s vysokým rozlišením (Orbitrap, TOF), který dokáže takovéto látky rozlišit [9].
Fragmentace v iontovém zdroji
S problémem izobarických interferencí úzce souvisí i správné nastavení iontového zdroje hmotnostního spektrometru. Především u metod určených pro sledování hladin léčiv v biologických materiálech má velký význam optimální nastavení deklastračního potenciálu. Důvodem je potenciální, ve zdroji probíhající, fragmentace méně stabilních látek, například labilních glukuronidů léčiv, vznikajících ve druhé fázi biotransformace. Příliš vysoký deklastrační potenciál vede k jejich fragmentaci v iontovém zdroji a vzniku parentní molekuly [10]. V případě vysokého výskytu těchto konjugátů ve vzorku to může mít za následek falešné zvýšení pozorovaných intenzit sledovaných léků. Na druhou stranu nastavení příliš nízkého deklastračního potenciálu může způsobit pokles citlivosti. Vzorky s vysokým obsahem labilních konjugátů a nízkým obsahem samotného analytu je pak vhodnější analyzovat pomocí LC-MS/MS. Zde dojde před analýzou v hmotnostním spektrometru k jejich separaci na koloně a interference se tak neprojeví.
Aplikace online SPE-MS/MS systému
Nelze říci, že by online SPE-MS/MS systém byl univerzálně vhodný pro všechny typy analytů a matricí. Je obecně použitelný především k analýze exogenních látek, které se ve vzorcích nachází ve vyšších koncentracích. V laboratoři tak může nalézt místo zejména při terapeutickém monitorování léčiv anebo v toxikologii. Dosud publikované práce i aplikační listy se zaměřují právě těmito směry.
Danso a kol. vyvinuli metodu pro stanovení busulfanu založenou na použití online SPE-MS/MS systému [11]. Busulfan je alkylační činidlo, používané k ablaci buněk kostní dřeně před provedením transplantace krvetvorných buněk. Vzhledem k jeho variabilní farmakokinetice a úzkému terapeutickému indexu je doporučováno monitorování jeho plazmatických hladin [12]. Pro zajištění přesnosti kvantifikace busulfanu byl použit deuterovaný standard d4-busulfan. Nová metoda je vysoce citilivá, mez stanovitelnosti („limit of quantification“, LOQ) je 25 µg/L. Analýza jednoho vzorku trvá pouze 20 sek.To umožňuje rychlejší vyhodnocení správnosti dávkování a jeho případné upravení za účelem snížení toxicity (např. veno-hepatální okluze, inter-sticiální plicní fibróza) a zachování účinnosti.
Podobně i Grote-Koska a kol. popisují aplikaci online SPE-MS/MS systému pro stanovení skupiny čtyř imunosupresiv (cyclosporine A, takrolimus, everolimus, sirolimus) [13]. Ty se používají za účelem zachování imunosuprese po provedení orgánové transplantace. Podobně jako busulfan vykazují úzké terapeutické rozmezí. Kromě zkrácení času analýzy jednoho vzorku na 13 sek při zachování dostatečné citlivosti (LOQ cyclosporinu A: 21 µg/L, takrolimu: 1,36 µg/l, everolimu: 1,35 µg/l a sirolimu 1,52 µg/l), správnosti (81 – 116 %) a přesnosti (mezidenní přesnost, CV < 8,4 %), uvádí autoři i další výhody nové metody. Na jejich pracovišti je denně analyzováno až 350 pacientských vzorků, k čemuž jsou zapotřebí tři plně vytížené LC-MS/MS systémy. Při použití RapidFire by stačil pouze jeden přístroj. Nehledě na nižší spotřebu rozpouštědel do mobilních fází a levnější pořizovací cenu SPE patron ve srovnání s chromatografickými kolonami. Celkem 1172 analýz, provedených na obou systémech, ukázalo, že online SPE-MS/MS poskytuje srovnatelné výsledky jako měření pomocí LC-MS/MS.
Dále byla publikována online SPE-MS/MS metoda pro stanovení antiepileptika lacosamidu v séru [14]. Linearita metody byla v rozmezí 0,5 – 50,0 mg/l a mez detekce 0,05 mg/l. Variační koeficienty intradenní a mezidenní přesnosti byly lepší než 7 %. Bylo testováno 24 nejčastěji předepisovaných léčiv a dalších antikonvulziv, z nichž žádné neinterferovalo s analýzou lacosamidu. Analytické parametry metody splňovaly požadavky směrnic pro validaci bioanalytických metod a čas pod 10 sek na vzorek z této metody činí přitažlivou alternativu konvenčním metodám.
Na našem pracovišti provádíme terapeutické monitorování tyrosin kinázových inhibitorů používaných v léčbě chronické myeloidní leukémie a rakoviny prsu. Udržování plazmatických hladin těchto léčiv nad určité stanovené hranice je spojováno s dosažením optimální odpovědi na léčbu [15]. Za účelem zvýšení efektivity jsme vyvinuli novou metodu pro měření plazmatických hladin imatinibu, nilotinibu a lapatinibu založenou na RapidFire přístroji [16]. Vzhledem k poměrně vysoké hydrofobicitě analyzovaných látek jsme využili SPE patronu s C4 stacionární fází, prodloužili jsme časy jednotlivých fází analytického cyklu a použili jsme čistící nástřik čistého acetonitrilu v krátkém 8 sek cyklu. Analýza jednoho vzorku tak trvala 29 sek, což je stále výrazně méně ve srovnání s konvenčními LC-MS/MS metodami. Metoda byla validována podle směrnic FDA pro validaci bioanalytických metod a její výsledky porovnány se zavedenou LC-MS/MS metodou analýzou celkem 176 klinických vzorků (obr. 2).
Obr. 2. Comparison between LC-MS/MS and online SPE-MS/MS. Extracted ion chromatograms from the analysis of standard samples containing three tyrosine kinase inhibitors and their deuterated internal standards by conventional LC-MS/MS system (A) and online SPE-MS/MS system (B). In the former case the analytes were separated from each other on a chromatographic column so only one sample was analysed in 6 min. In the latter case analytes were eluted from the SPE cartridge at the same time. The analysis of one sample took less than 30 sec and 8 samples were analysed in less than 6 min. 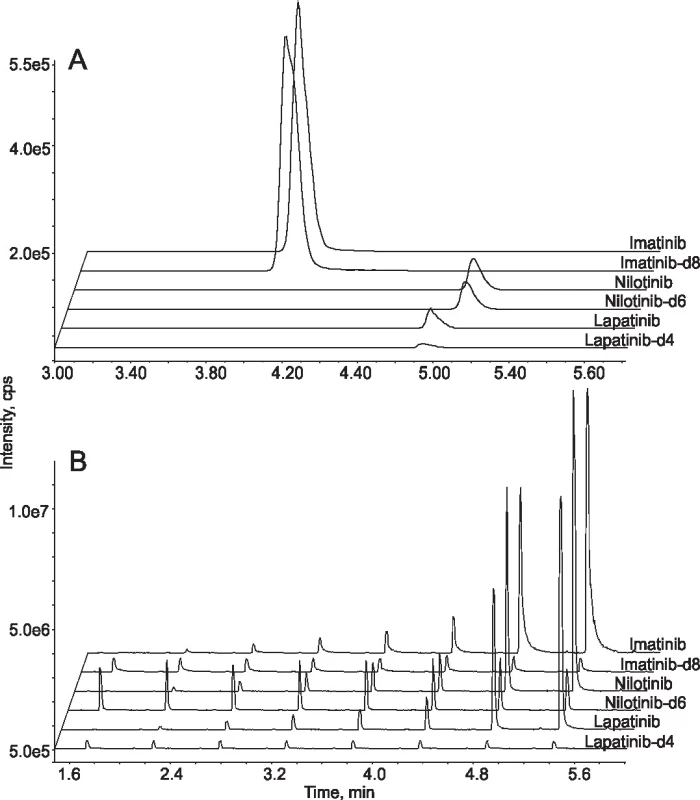
Se zajímavým využitím rychlosti online SPE-MS/MS sytému přišel Veach a kol. Jejich práce o vývoji a validaci metody (20 sek/vzorek) pro screening 12 sulfonamidových antibiotik ve včelím medu vyšla v prestižním časopise Analytical Chemistry [17].
V již citované práci Jian a kol, ve které hodnotili online SPE-MS/MS systém pro použití v in vivo bio-analytických studiích, použili více než deset strukturně odlišných látek pro hodnocení analytických parametrů, včetně iontové suprese a carry-over efektu [9]. Vliv matrice na intenzitu signálu byl u některých testovaných látek poměrně vysoký. Například odezva diklofenaku v plazmě (n = 96) byla 27 % oproti jeho odezvě v čistém rozpouštědle (100 %). Na druhou stranu vliv matrice na jeho deuterovaný interní standard byl prakticky stejný (26 %). To znovu ukazuje, že matricové efekty při použití izotopicky značeného standardu nemusí mít vliv na kvantifikaci analytu. Silné matricové efekty však mohou způsobovat problémy s citlivostí. Správnost a přesnost určení koncentrací stanovovaných látek však byla srovnatelná se standardními LC-MS/MS metodami. Doba měření se zkrátila více než dvacetinásobně. Podle těchto výsledků má online SPE-MS/MS technologie velký potenciál zvýšit prostupnost vzorků v klinických aplikacích.
Závěr
I přestože je online SPE-MS/MS ve světě rozšířen zejména v laboratořích farmaceutických firem a výzkumných ústavů, postupně se rozvíjí i jeho klinické využití. V České republice je podle dostupných informací zatím pouze jediný přístroj tohoto typu. Ačkoli online SPE-MS/MS systém nelze použít pro všechny analyty, u mnohých se však může stát vhodnou a rychlejší alternativou metod založených na LC-MS/MS. Dle Jian a kol. je online SPE-MS/MS systém vhodný zejména pro analyty s následujícími vlastnostmi: a) nemají izobarické interference; b) netvoří labilní metabolity, které se mohou rozpadat v iontovém zdroji; c) neváží se příliš pevně na stacionární fázi SPE patrony a nejsou náchylné na carry-over; d) suprese jejich odezvy kvůli matricovým efektům není kritická [9]. Obvyklá doba analýzy jednoho vzorku, pohybující se okolo 15 sek, umožňuje analyzovat i více než 200 vzorků za hodinu. Ve výsledku dojde také ke snížení nákladů. Vysokoprostupný online SPE-MS/MS systém pro rutinní použití jistě nalezne využití v klinické laboratoři. V každém případě je důležité individuální posouzení, je-li vhodným vybavením konkrétní laboratoře.
Poděkování
Práce byla podpořena granty IGA MZ ČR NT 12218 (Ministerstvo zdravotnictví České republiky) a IGA_LF_UP_2017_015 (Univerzita Palackého v Olomouci). Infrastrukturální část projektu (Ústav molekulární a translační medicíny) byla podpořena Národním programem udržitelnosti I (LO1304).
Střet zájmů: Autoři prohlašují, že nejsou ve střetu zájmů.
Do redakce došlo 17. 7. 2017
Adresa pro korespondenci
Mgr. Ivo Vrobel
Ústav molekulární a translační medicíny
Lékařská fakulta, Univerzita Palackého Olomouc
Hněvotínská 5
775 15 Olomouc
Zdroje
1. Jannetto, P. J., Fitzgerald, R. L. Effective use of mass spectrometry in the clinical laboratory. Clin. Chem. 2016, 62, 92-8.
2. Food and Drug Administration, Guidance for Industry: Bioanalytical Method Validation, 2001, http://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/ucm070107.pdf (25.08.2017)
3. European Medicines Agency, Guideline on bioanalytical method validation, 2011, http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2011/08/WC500109686.pdf (25.08.2017)
4. Friedecký, B., Šprongl, L., Kratochvíla, J., Plzák, Z. Doporučení k provádění validace a verifikace analy-tických metod v klinických laboratořích. Klin. Biochem. Metab. 2011, 19 (40), No. 1, p. 36-44.
5. Niessen, W. M. A. Liquid Chromatography - Mass Spectrometry, 3rd edition, CRC Press, 2007, p. 15-16. ISBN-13 : 978-0-8247-4082-5.
6. Wang, S., Cyronak, M., Yang, E. Does a stable isotopically labeled internal standard always correct analyte response? A matrix effect study on a LC/MS/MS method for the determination of carvedilol enantiomers in human plasma. J. Pharm. Biomed. Anal. 2007, 43, 701-707.
7. Klapková, E., Uřinovská, R., Průša, R. Vliv matricových efektů při vývoji a validaci metod pomocí vysokoúčinné kapalinové chromatografie ve spojení s hmotnostní spekt-rometrií. Klin. Biochem. Metab. 2011, 19 (40), No. 1, p. 5-8.
8. Matuszewski, B. K., Constanzer, M. L., Chavez-Eng, C. M. Strategies for the Assessment of Matrix Effect in Quantitative Bioanalytical Methods Based on HPLC-MS/MS. Anal. Chem. 2003, 75, 3019-3030.
9. Jian, W., Romm, M. V., Edom, R. W., et al. Evaluation of a High-Throughput Online Solid Phase Extraction – Tandem Mass Spectrometry System for In Vivo Bioanalytical Studies. Anal. Chem. 2011, 83, 8259-8266.
10. Yan, Z., Caldwell, G. W., Jones, W. J., Masucci, J. A. Cone voltage induced in-source dissociation of glu-curonides in electrospray and implications in biological analyses. Rapid Commun. Mass Spectrom. 2003, 17, 1433-1442.
11. Danso, D., Jannetto, P. J., Enger, R., Langman, L. J. High-throughput validated method for the quantification of busulfan in plasma using ultrafast SPE-MS/MS. Ther. Drug Monit. 2015, 37, 319-24.
12. Slattery, J. T., Risler, L. J. Therapeutic monitoring of busulfan in hematopoietic stem cell transplantation. Ther. Drug Monit. 1998, 20, 543-9.
13. Grote-Koska, D., Czajkowski, S., Brand, K. Performance of the new RapidFire system for therapeutic monitoring of immunosuppressants. Ther. Drug Monit. 2015, 37, 400-4.
14. Korman, E., Langman, L. J., Jannetto, P. J. High-throughput method for the quantification of lacosamide in serum using ultrafast SPE-MS/MS. Ther. Drug Monit. 2015, 37, 126-31.
15. Widmer, N., Bardin, C., Chatelut, E., et al. Review of therapeutic drug monitoring of anticancer drugs part two – Targeted therapies. Eur. J. Cancer. 2014, 50, 2020-36.
16. Vrobel, I., Janečková, H., Faber, E., et al. Ultrafast online SPE-MS/MS method for quantification of 3 tyrosine kinase inhibitors in human plasma. Ther. Drug Monit. 2016, 38, 516-24.
17. Veach, B. T., Mudalige, T. K., Rye, P. RapidFire mass spectrometry with enhanced throughput as an alternative to liquid-liquid salt assisted extraction and LC/MS analysis for sulphonamides in honey. Anal. Chem. 2017, 89, 3256-60.
Štítky
Biochemie Nukleární medicína Nutriční terapeut
Článek Odešel doc. Kollár
Článek vyšel v časopiseKlinická biochemie a metabolismus
Nejčtenější tento týden
2018 Číslo 1- GLP-1RA a PCOS: Je to „jenom“ o hmotnosti?
- Moderní přístupy zvyšující efektivitu antibiotické léčby v nemocniční praxi
- Farmakologická léčba obezity u pacientek se syndromem polycystických ovarií – systematický přehled a klinická doporučení
- Zpracované masné výrobky a červené maso jako riziko rozvoje kolorektálního karcinomu u žen? Důkazy z prospektivní analýzy
- Efektivita léčby a možné indikace liraglutidu v gynekologii
-
Všechny články tohoto čísla
- Analytický systém online extrakce na pevné fázi ve spojení s tandemovou spektrometrií a jeho klinické využití
- Úvodní studie měření FGF 23 metodou LIAISON FGF 23
- Limitácie využitia sliny ako diagnostickej tekutiny v klinickej praxi
- Vitamin K a jeho význam v laboratorní medicíně
- Pár řádků o problémech a záhadách hodnocení kvality vědecké práce
- Stanovení karbohydrát-deficientního transferinu (CDT) různými analytickými technikami
- Stabilizace glukózy v krevní plazmě citrátem – pro a proti
-
Česká diabetologická společnost ČLS JEP, Česká nefrologická společnost a Česká společnost klinické biochemie ČLS JEP
Doporučené postupy při diabetickém onemocnění ledvin - Odešel doc. Kollár
- Stanovisko výboru České společnosti pro aterosklerózu k doporučením ESC/EAS pro diagnostiku a léčbu dyslipidemií z roku 2016
- Těhotenská hypercholesterolemie - málo známý fenomén způsobený zvýšenou endogenní syntézou cholesterolu
- Klinická biochemie a metabolismus
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Stanovení karbohydrát-deficientního transferinu (CDT) různými analytickými technikami
- Stabilizace glukózy v krevní plazmě citrátem – pro a proti
- Vitamin K a jeho význam v laboratorní medicíně
- Analytický systém online extrakce na pevné fázi ve spojení s tandemovou spektrometrií a jeho klinické využití
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



