-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Boj s rezistencí mikroorganismů na antibiotika
Fight against antimicrobial resistance
Antimicrobial and antibiotic resistance is ever increasing and the fight against it is a battle that can never be won. Nevertheless, some possibilities exist to improve this situation, at least in part. The present review article discusses some approaches that can be used to control microbial resistance. Possible strategies are (1) designing new vaccines against resistant bacterial strains; (2) investigation of the potential of both traditional and non-traditional sources of natural substances for use as new antibiotics; (3) search for genes specifying biosynthesis of antibiotics; (4) use of forgotten natural compounds and their transformation, and (5) investigation of new antibiotic targets in pathogenic bacteria. Particular attention is paid to the search for new compounds that would be able to inhibit pathogenic bacteria resistant to existing antibiotics.
Keywords:
sepsis – septic shock – organ dysfunction – definition – criteria
Autoři: J. Spížek
Působiště autorů: Mikrobiologický ústav AV ČR, v. v. i., Praha
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 67, 2018, č. 2, s. 74-80
Kategorie: Souhrnné sdělení
Souhrn
Rezistence mikroorganismů na působení antimikrobiálních látek včetně antibiotik trvale narůstá a boj proti ní je válka, která se nedá nikdy vyhrát. Přesto však existují určité možnosti, jak tuto situaci alespoň částečně zlepšit. Předložený přehledný článek diskutuje o některých postupech, které je možno k potlačení rezistence využít. Může to být:
- příprava nových vakcín proti rezistentním bakteriálním kmenům;
- hledání nových antibiotik v tradičních i netradičních zdrojích přírodních látek;
- hledání genů specifikujících biosyntézu antibiotik;
- využití zapomenutých přírodních sloučenin a jejich transformace a
- hledání nových zásahových míst pro antibiotika.
Zvláštní pozornost je věnována hledání nových sloučenin, které budou inhibovat patogenní bakterie rezistentní vůči současným antibiotikům.
Klíčová slova:
sepse – septický šok – orgánové dysfunkce – definice – kritériaÚVOD
Klinická účinnost penicilinu a streptomycinu vzbudila pozornost veřejnosti, neboť se ukázalo, že tyto sloučeniny opravdu zachraňují lidské životy. Termín antibiotikum se stal přirozenou součástí vědecké terminologie i běžného slovníku. Toto slovo bylo v angličtině původně použito jako přídavné jméno. Teprve v roce 1947 Selman A. Waksman publikoval definici antibiotika jako podstatného jména, která zněla: „Antibiotikum je chemická látka, která má schopnost inhibovat růst nebo i ničit bakterie a další mikroorganismy“. Waksman zdůrazňoval, že antibiotika nejsou pouze antimikrobiální sloučeniny, ale že jsou to také produkty mikrobního metabolismu. Stojí za povšimnutí, že původně vlastně vylučoval sloučeniny produkované rostlinami, živočichy nebo vyráběné chemickou syntézou. Současná terminologie tento rozdíl neuznává. Mnoho dosavadních definicí pokračuje ve Waksmanově tradici a soustřeďuje se na antimikrobiální aktivitu sloučenin a nikoli na jejich selektivní účinky. Podle Joan Bennett je důležité porozumět tomu, jak se slovo „antibiotikum“ používá v různých souvislostech tak, aby současní vědci v oboru mohli těžit z rozsáhlé vědecké a patentové literatury [1].
V naší práci vycházíme z mírně modifikované Waksmanovy definice. Původně se za antibiotika považovaly nízkomolekulární látky s hmotností nižší než 2 000 Da. Později se mezi antibiotika zařadily i látky s vyšší hmotností, jako jsou peptidické látky (např. neokarcinostatin, nisin, tendamistat). Za antibiotika jsou dnes pokládány i bakteriociny produkované různými bakteriemi, jako jsou kolicin (Escherichia coli), megacin (Bacillus megaterium) a pyocin (Pseudomonas aeruginosa), což jsou látky bílkovinné povahy, které se váží na specifické receptory v bakteriálních buňkách.
PŘIROZENÁ A MODIFIKOVANÁ ANTIBIOTIKA
Antibiotika jsou sekundární metabolity, které se kromě použití proti patogenním mikroorganismům používají také v terapii nádorových onemocnění, při ochraně rostlin jako herbicidy nebo defolianty (např. streptomycin, oxytetracyklin nebo gentamycin) a dále jako insekticidy, pesticidy, akaricidy, nematocidy apod. Přirozená antibiotika se často chemicky modifikují, nebo jsou pomocí biotransformace přeměňována na nové látky s novými biologickými účinky. Množinu přirozených a modifikovaných antibiotik je třeba rozšířit o sloučeniny připravené chemickou syntézou. Díky kombinatorní chemii bylo dosud popsáno odhadem 8–10 milionů syntetických chemických sloučenin. Celkový počet přírodních látek se odhaduje na 300 000–600 000. Z toho je 60 000–80 000 antibiotik produkovaných mikroorganismy i vyššími organismy (tab. 1).
Tab. 1. Hlavní producenti antibiotik
Table1. Major producers of antibiotics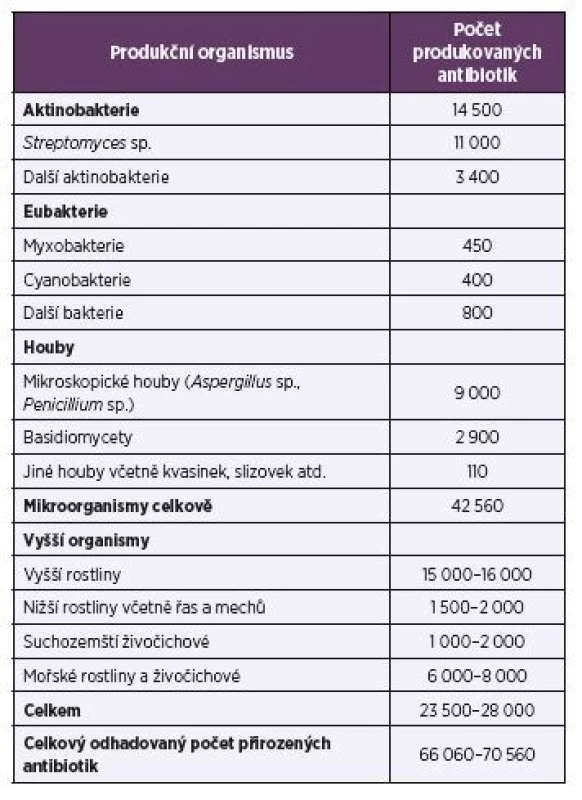
BAKTERIE, KTERÉ PŮSOBÍ ZÁVAŽNÉ ZDRAVOTNÍ PROBLÉMY
Patří sem zejména patogeny „ESKAPE“ – Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa a druhy rodu Enterobacter, kterým je v současné lékařské diagnostice věnována maximální pozornost [2]. Methicilin--rezistentní kmeny Staphylococcus aureus jsou zvláště nebezpečné. Seznam bakterií (viz tab. 2), které působí závažné onemocnění, zahrnuje také Streptococcus pneumoniae, Mycobacterium tuberculosis, streptokoky skupiny A, Salmonella pneumoniae, Escherichia coli 0157-H7, Legionella pneumophila, Borrelia burgdorferi, Helicobacter pylori a další.
Tab. 2. Vybrané patogenní mikroorganismy a viry
Table 2. Selected pathogenic microbes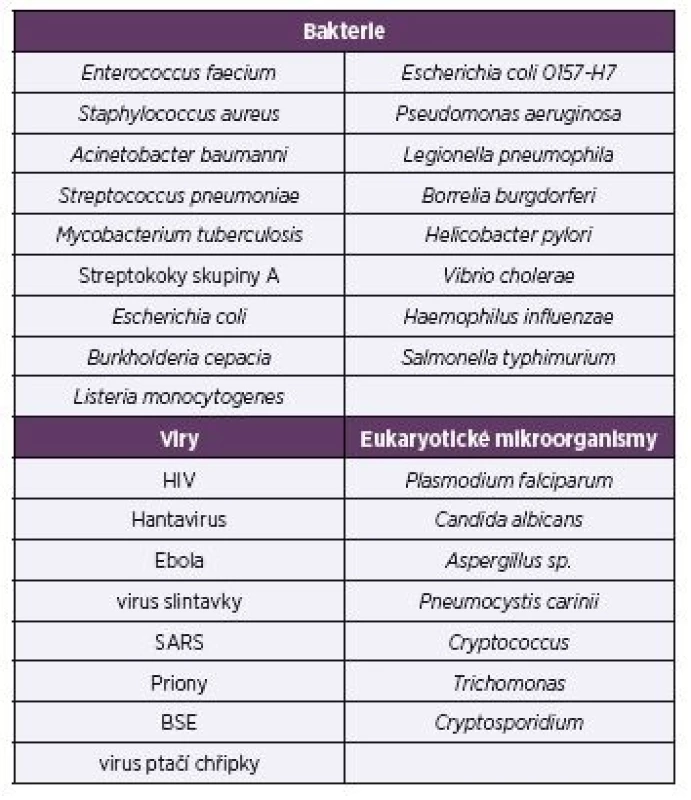
Dlouho se zdálo, že antibiotika jsou všemocná a že jejich použití proti patogenním bakteriím vymýtí infekční nemoci. Toto období se nazývalo „zlatý věk“ antibiotik [3] a během něho byla izolována i většina běžně používaných antibiotik. Dlouho se také zdálo, že válka proti infekčním mikroorganismům skončila. Například vedoucí chirurg USA William H. Stewart konstatoval v roce 1967 [4], že „je možné zavřít knihu o infekčních nemocech, prohlásit válku proti infekcím za vyhranou a přesunout zdroje na chronické nemoci, jako jsou rakovina a kardiovaskulární problémy“. To bylo velmi optimistické. Již v té době řada vědců upozorňovala, že mikroorganismy se rychle reprodukují, mutují a snadno se přizpůsobují na nové hostitele. Zlaté období let 1940–2000, kdy byla objevena většina antibiotik, bylo již u konce, když i sám William H. Stewart musel přiznat, že jeho výrok byl úplně špatný [4].
Bakterie žijí na Zemi již několik miliard let a během této doby se v přírodě setkaly s velmi širokým spektrem přirozeně se vyskytujících antibiotik. Je tedy zřejmé, že bychom měli vyvíjet aktivity, které by nás měly ochránit před nebezpečím mikroorganismů rezistentních na antibiotika [5]. Zdá se také, že trvale potřebujeme vyvíjet nová antibiotika (tab. 2) tak, abychom se ubránili selekci rezistentních patogenů. Novější přehled léčiv, jejich základ tvoří přírodní látky, byl publikován v roce 2016 [6].
PŘÍPRAVA NOVÝCH VAKCÍN PROTI REZISTENTNÍM BAKTERIÁLNÍM KMENŮM
Antibiotika velmi často nestačí na ochranu proti šíření infekcí způsobených vícenásobně rezistentními bakteriemi [7]. Vývoj nových vakcín řeší tento problém jen částečně. Účinnost vakcín může být vysoká, ale není 100%. Terapie duálních infekcí, které jsou extrémně vzácné, je obvykle založena na kombinaci antibiotik podle jejich spektra.
Byly zavedeny vakcíny například proti kapavce způsobené bakterií Neissseria gonorrhoeae [8], proti Streptococcus pneumoniae, Haemophilus influenzae a pomocí reverzní vakcinologie proti Streptococcus pyogenes, Chlamydia pneumonia, Chlamydia trachomatis, Streptococcus agalactiae, Escherichia coli a Leishmania major [9]. Genové biotechnologie a integrativní biologie snad urychlí přípravu nových vakcín, jejichž vývoj byl zatím neúspěšný [10]. Nyní se diskutuje o nižší účinnosti očkování proti černému kašli. Jedním z důvodů je patrně i změna cílových struktur této bakterie a snížení účinnosti očkování.
HLEDÁNÍ NOVÝCH ANTIBIOTIK
V předchozím přehledném článku [11] autoři stručně diskutovali o několika postupech, které je možno používat při hledání nových antibiotik: tj. např. výzkum nových antibiotik z netradičních nebo méně tradičních zdrojů, studium sekvencí mikrobiálních genomů, hledání genů specifikujících biosyntézu antibiotik, analýza DNA v prostředí, studium zapomenutých přirozených látek a jejich transformace a hledání nových zásahových míst pro antibiotika v patogenních bakteriích. Následující část článku se bude zabývat nově schválenými antibiotiky a antibiotiky, jejichž výroba se připravuje.
NOVĚ SCHVÁLENÁ ANTIBIOTIKA A ANTIBIOTIKA VE VÝVOJI
Jako příklady látek ve fázi III klinického testování nebo hodnocené NDA/MAA (NDA – New Drug Application, USA; MAA – Marketing Authorization Application – EU) mohou sloužit fidaxomycin, amacyklin, oritavancin, dalbavancin a cethromycin, všechny odvozené z přírodních látek. Ve svém posledním přehledném článku Butler et al. konstatovali [12], že hledání a vývoj antibiotik s novým mechanismem účinku jsou nezbytně nutné pro léčení infekcí způsobených multirezistentními bakteriemi. Autoři ve svém článku zahrnuli 22 nových antibiotik získaných od roku 2 000 a akcentovali mj. dvě slibná antibiotika, fidaxomycin a bedakvilin.
Fidaxomycin je úzkospektré makrocyklické antibiotikum, produkované aktinomycetou Dactylosporangium aurantiacum s aktivitou proti patogennímu Clostridium difficile. Zatím se pro léčení infekcí způsobených touto bakterií používaly pouze metronidazol a vankomycin. Fidaxomicin vykazuje lepší léčivé účinky než vankomycin a také menší výskyt recidivy. Bedakvilin je diaryl-chinolonové antituberkulózní léčivo. Je to po 40 letech první lék proti tuberkulóze (TB), který je vhodný pro léčení TB pacientů infikovaných bakteriemi rezistentními vůči rifampicinu a isoniazidu.
Boucher et al. shrnuli vývoj nových antibiotik a schvalování systémových antibiotik ve Spojených státech od počátku roku 2013 [13]. Od zprávy Americké společnosti pro infekční nemoci (Infectious Diseases of America – IDSA) za rok 2009 byla schválena pouze dvě nová antibiotika a počet každoročně schvalovaných antibiotik ve Spojených státech se trvale snižuje. Autoři popsali sedm léčiv v klinickém vývoji pro léčení gramnegativními bakteriemi (GNB). Žádná z těchto sloučenin nebyla původně zahrnuta v jejich seznamu antibakteriálních sloučenin ve fázi II nebo pozdější fázi vývoje v roce 2009. Autoři uzavřeli, že je sice možno pozorovat určitý pokrok ve vývoji nových antibakteriálních léčiv proti GNB, ale že je pořád znepokojivě pomalý.
Gould a Bal shrnuli vyvíjené sloučeniny včetně aminoglykosidů nové generace, chinolonů, nových β-laktamů a monobaktamů, ketolidů, nových glykopeptidů a inhibitorů efluxních pump [14]. Z neoglykosidů se plazomicin zdá být velmi dobrým kandidátem. Inhibuje bakteriální proteosyntézu a má baktericidní aktivitu. Očekává se, že brzy budou dostupné údaje o výsledcích klinických testů fáze II. Ve vývoji je rovněž řada chinolonů, které si ponechávají aktivitu proti kmenům rezistentním vůči současným chinolonovým sloučeninám, jako jsou např. delafloxacin a nemonomyxin vykazující aktivitu proti Staphylococcus aureus, zejména proti methicilin-rezistentním kmenům (MRSA). Další příbuzná sloučenina ACH 702, která patří mezi isothiazolo-chinolony, je vysoce účinná proti MRSA a také proti Mycobacterium tuberculosis, což je velmi důležité při léčení komplikované tuberkulózy rezistentní na současné léky. Ve skupině nových oxazolidinových derivátů autoři popsali tedisolid a radesolid, které mají vyšší aktivitu proti stafylokokům, streptokokům a enterokokům než linesolid. Kromě těchto sloučenin jsou některé látky z této skupiny vyvíjeny jako antimykobakteriální léčiva, např. sutesolid.
Ve skupině nových betalaktamů a monobaktamů je třeba jmenovat ceftarolin, což je cefalosporin páté generace s aktivitou proti MRSA a vankomycin-rezistentním kmenům Staphylococcus aureus, přičemž je tato vlastnost výjimečná. Mezi nimi má avibaktam široké spektrum aktivity proti karbapenemázám. Nové ketolidy zahrnují cetromycin a solitromycin. Cetromycin byl schválen FDA (U.S. Food and Drug Administration) jako prostředek proti možným bio-teroristickým agens, jako jsou např. antrax a mor. Na základě studií in vitro se solitromycinem je možno doufat, že jeho hlavní aplikace by mohly být při léčení kůže a měkkých tkání nebo i pneumonie na jednotkách intenzivní péče.
Mezi tetracykliny je tigecyklin širokospektrý glycylglycin, který byl již schválen pro klinické použití. Je možno jej používat při léčení různých smíšených infekcí způsobených patogeny rezistentními na běžné tetracykliny. Jeho hlavní výhodou je to, že není substrátem pro efluxní rezistenci nebo ochranné ribozomální proteiny. V různém stadiu klinického testování se nacházejí také zástupci druhé generace glykopeptidů, jako jsou oritavancin a dalbavancin, antibiotika slibná kromě jiného také proto, že si zachovávají účinnost proti kmenům enterokoků a stafylokoků rezistentních k první generaci (vankomycin, teikoplanin).
HLEDÁNÍ NOVÝCH ANTIBIOTIK V MÉNĚ TRADIČNÍCH ZDROJÍCH
Nové zdroje antibiotik se hledají v půdě, která obsahuje velká množství mikroorganismů produkujících přírodní látky včetně antibiotik [15]. Nejúčinnějšími producenty účinných látek použitelných v medicíně jsou příslušníci sporulujících vláknitých bakterií aktinomycet. Aktinomycety byly dlouho detegovány v mořské vodě, ale soudilo se u nich, že tam byly přeneseny ze suchozemských stanovišť [16]. Později však bylo zjištěno, že se skutečně jedná o producenty v mořské vodě. Mořské hlubiny poskytují nové chemické struktury, které nenacházíme v tradičním suchozemském prostředí. Subramani a Aalbersberg v přehledném článku o mořských aktinomycetách [17] uvádějí více než 30 nových metabolitů. Mezi nimi jsou hlavně sloučeniny antibakteriální, ale také protinádorové. Fenical a Jensen [18] ukázali, že mořské aktinomycety, některé žijící v sedimentech tisíce metrů pod hladinou tropických a subtropických moří, mezi nimi příslušníci rodu Salinispora, produkují zajímavé sloučeniny s neobvyklými chemickými strukturami. Mezi ně patří např. salinosporamid A, který má protinádorové účinky.
Využívání nových zdrojů biologicky aktivních látek zasluhuje zvláštní pozornost zejména vzhledem k obrovské různorodosti mořských mikroorganismů a jejich metabolických produktů [19]. Mořské organismy mají některé vlastnosti, které je v mnoha ohledech odlišují od organismů suchozemských, jako jsou metabolismus, chování, přenos informace a adaptační strategie. Dosud získané údaje byly zpracovány statisticky Hu et al., kteří zjistili, že na rozdíl od pozemních organismů se mořské organismy musí adaptovat na extrémní podmínky prostředí, jako jsou vysoký tlak, vysoká koncentrace solí, nízká koncentrace živin, nízká, ale stálá teplota a že tyto rozdíly jsou zodpovědné za různorodost sekundárního metabolismu mořských organismů [20]. Z mořských řas byla izolována např. řada halogenovaných sloučenin s významnou biologickou aktivitou. Průmyslová kultivace a aplikace genové technologie jsou nyní relativně snadné, proto jsou mořské mikroorganismy nejslibnější oblastí pro vývoj nových léčiv. Oceány, které hostí přibližně 87 % života na Zemi, mají tedy i vysoký potenciál pro získávání farmaceuticky významných látek [21].
Kamjam et al. [22] v aktuálním přehledném článku shrnuli některé hlubokomořské aktinomycety a jejich sekundární metabolity popisované v letech 2006–2016. Seznam zahrnuje 21 druhů ze 13 rodů. Mezi nejčetnější patří rod Microbacterium následovaný rody Dermatococcus, Streptomyces a Verrucosispora. Osm rodů aktinomycet produkuje sekundární metabolity, mezi nimi je Streptomyces nejvýznamnější producent. V přehledné tabulce autoři uvedli 37 hlubokomořských aktinomycet produkujících více než 70 sekundárních metabolitů s významnými terapeutickými účinky včetně účinků antibakteriálních a protinádorových.
GENOVÉ SEKVENCE MIKROORGANISMŮ – HLEDÁNÍ GENŮ ZODPOVĚDNÝCH ZA BIOSYNTÉZU ANTIBIOTIK
Informace o složení mikrobiálních genomů je možno využívat pro získávání nových sekundárních metabolitů včetně antibiotik [23]. V této práci autoři definují „vytěžení“ mikrobiálních genomů jako proces převádění genových sekvencí zodpovědných za biosyntézu sekundárních metabolitů až na purifikované molekuly ve zkumavkách. Z neznámých důvodů jsou aktinomycety nesmírně plodné v počtu antibiotik, která produkují. Více než 42 % antibiotik je produkováno aktinomycetami, z toho asi 16 % jediným rodem Streptomyces [24]. Tyto údaje je však třeba brát s jistou rezervou, protože určitě nejsou přesné a navíc se literární údaje v tomto ohledu dosti liší. Kmeny Streptomyces hygroscopicus produkují téměř 200 antibiotik. Jeden kmen rodu Micromonospora může produkovat až 48 aminoglykosidů a kmeny Streptomyces griseus produkují více než 40 různých antibiotik [25]. Počty genů zodpovědných za tvorbu polyketid syntáz (PKS), neribozomálních peptidových syntáz (NRPS) nebo jejich kombinací (PKS-NRPS) v produkčním mikroorganismu je možno využívat jako měřítko potenciálu pro tvorbu sekundárních metabolitů včetně antibiotik. Z toho jasně vyplývá, že aktinomycety jsou mezi mikroorganismy s velkými genomy nejproduktivnější [26]. Bylo zjištěno, že počet funkčních NRPS metabolických drah je možno odhadnout podle počtu homologů mbtH v mikrobiálním genomu [27]. Díky tomuto zajímavému přístupu bylo možno klasifikovat zvláště „nadané“ aktinomycety produkující sekundární metabolity [28]. Podle posledně citované práce je zřejmé, že za posledních 50 let bylo z více než 1026 jednotek tvořících kolonie a obývajících horních 10 cm půdy dosud pouze asi 107 testováno na produkci sekundárních metabolitů a že je tedy ještě pořád možno velkou většinu aktinomycet „vytěžit“ [29].
Nyní se asi pouze 200 antibiotik užívá v humánní medicíně. V souhrnu Světové zdravotnické organizace z roku 2016 [30] se ve skupině “Kriticky důležitých sloučenin” uvádí: aminoglykosidy (asi 15 sloučenin), ansamyciny (5 sloučenin), karbapenemy a další penemy (asi 7 sloučenin), cefalosporiny třetí a čtvrté generace (23 sloučenin), deriváty fosfonové kyseliny (1 sloučenina), glykopeptidy (5 sloučenin), glycylglyciny (1 sloučenina tigecyklin), lipopeptidy (1 sloučenina daptomycin), makrolidy a ketolidy (14 sloučenin), monobaktamy (2 sloučeniny), oxazolidiny (linezolid), peniciliny (25 sloučenin), polymyxiny (2 sloučeniny), chinolony (26), sloučeniny používané výlučně proti tuberkulóze (14 sloučenin). V této skupině je zahrnuto 100 sloučenin, které můžeme uvádět jako „pravá antibiotika“, jak je definujeme v tomto článku, zatímco sloučeniny uvedené kurzivou jsou sloučeniny syntetické.
Ve skupině „Vysoce důležitých antimikrobních sloučenin“ jsou zahrnuty amidinopeniciliny (2 sloučeniny), amfenikoly (2 sloučeniny), cefalosporiny 1. a 2. generace a cefamyciny (26 sloučenin), linkosamidy (2 sloučeniny), peniciliny proti stafylokokům (5 sloučenin), pleuromutiliny (retapamulin), pseudomonádové kyseliny (mupirocin), riminofenaziny (fusidová kyselina), streptograminy (2 sloučeniny), sulfonamidy, inhibitory reduktázy dihydrolistové kyseliny a jejich kombinace (28 sloučenin), sulfony (2 sloučeniny) a tetracykliny (13 sloučenin). V této skupině je tedy 55 sloučenin, které můžeme pokládat za „pravá antibiotika“, zatímco sloučeniny uvedené kurzivou jsou látky syntetické.
Ve skupině „Důležitých antimikrobních látek“ jsou zařazeny spektinomycin (1 sloučenina), cyklické polypeptidy (1 sloučenina bacitracin), nitrofurantoiny (4 sloučeniny) a nitroimidazoly (34 sloučenin). V této skupině tedy můžeme za „pravá antibiotika“ pokládat dvě sloučeniny. Když tedy sečteme „pravá antibiotika“, ze všech tří skupin dostaneme číslo 157. Veškeré výše uvedené údaje nepochybně nejsou úplně přesné, ale nedopustíme se žádné dramatické chyby, když budeme počet „přirozených antibiotik“ uvádět jako 150–160. Z výše uvedeného přehledu také vyplývá, že počet „syntetických antibiotik“ je 110. Dohromady je tedy počet používaných antibiotik asi 260.
Analýza genů řídících biosyntézu antibiotik by se měla využívat při vývoji nových derivátů antibiotik, které by byly účinné proti bakteriálním kmenům rezistentních na současně používaná antibiotika. Podle údajů databáze komparativní analýzy mikrobiálních genomů [31] bylo již sekvenováno celkem 18 genomů rodu Streptomyces: S. albus, S. collinus, S. davawensis, S. flavogriseus, S. fulvissimus a různých kmenů S. hygroscopicus, S. venezuelae a S. violaceusniger. Tyto rozsáhlé znalosti je zcela jistě možno využít při hledání nových antibiotik. Jako příklad je možno uvést genový klastr, který řídí biosyntézu antibiotika linkomycinu (obr. 1). Linkomycin a jeho deriváty jsou antibiotika, která vykazují aktivitu proti grampozitivním bakteriím. Klindamycin, chlorovaný derivát linkomycinu, se používá v klinické praxi při léčení infekcí způsobených anaerobními bakteriemi. Produkty genů lmbH–lmbK se podobají genům metabolismu aminokyselin. Produkty genů lmbL – lmbQ jsou pravděpodobně enzymy metabolismu cukrů. Znalost struktury genových klastrů umožňuje připravit jejich modifikace a tak také i modifikovaná antibiotika.
Obr. 1. Linkomycinový genový klastr
Červeně jsou vyznačeny geny kódující rezistenci na antibiotika. Šrafovaně jsou vyznačeny geny kódující S-adenosyl-dependentní metyltransferázu. Šipky ukazují směr transkripce jednotlivých genů. Produkty genů lmbA–lmbK se podobají enzymům metabolismu aminokyselin. Produkty genů lmbL–lmbQ jsou pravděpodobně enzymy cukerného metabolismu.
Figure 1. Lincomycin gene cluster
Genes encoding resistance to antibiotics are highlighted in red. Genes encoding S-adenosyl-dependent methyltransferase are hatched. Arrows indicate the direction of transcription for individual genes. Gene products lmbA–lmbK are similar to enzymes for amino acid metabolism. Gene products lmbL–lmbQ are most probably sugar metabolism enzymes.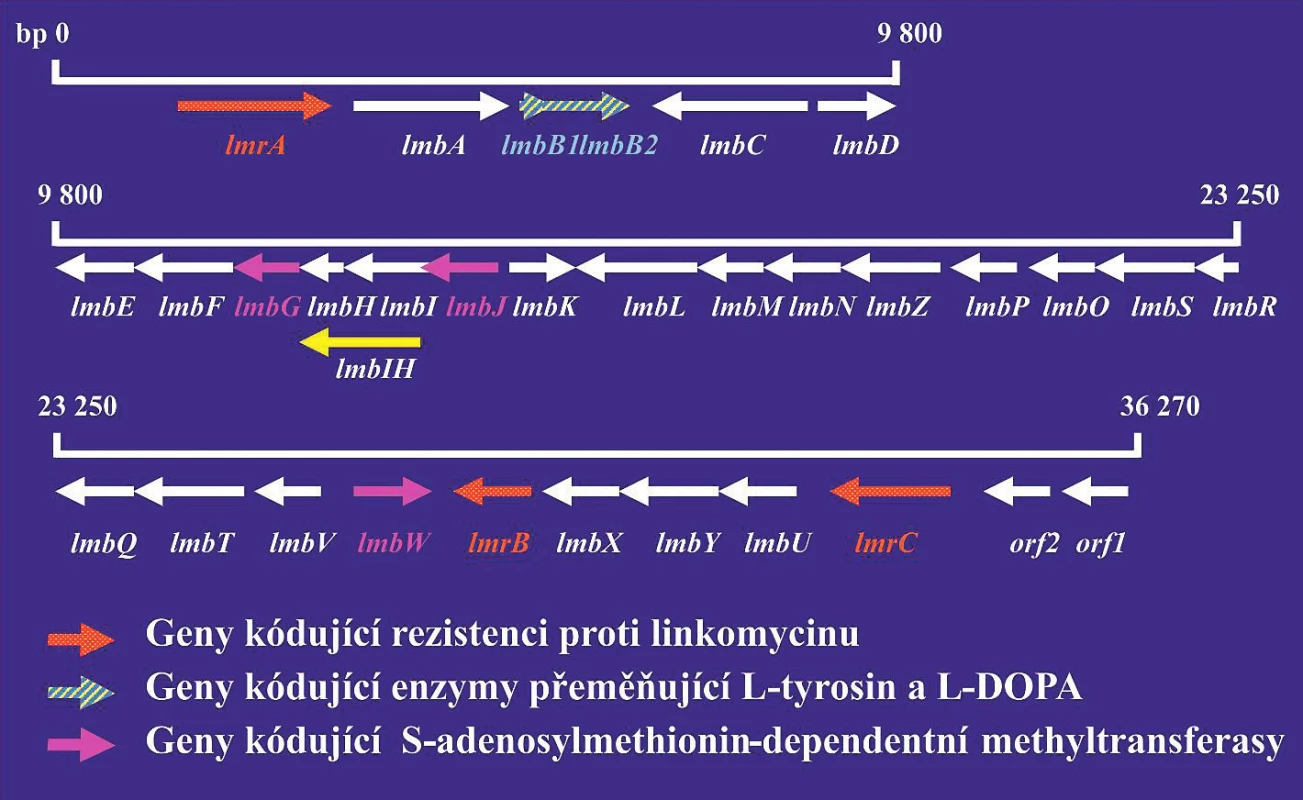
REVITALIZACE ANTIBIOTIK
Během „zlatého věku“ antibiotik byly objeveny tisíce biologicky aktivních sloučenin. Mnohé z nich však nebyly využity buď proto, že v té době byly již k dispozici lepší sloučeniny, nebo protože z nich nemohla být vyvinuta léčiva vzhledem k jejich nepříznivým farmakologickým vlastnostem. Pulcini et al. ve svém souhrnném článku [32] navrhují, že bychom měli obrátit pozornost na některá dříve používaná antibiotika. Zvláště laciná generika, o kterých se ví, že jsou dobře tolerována a že jsou bezpečná, by mohla být i dostupnější. Příkladem jsou temocilin a mecilinam, které by mohly být užitečné proti bakteriím produkujícím beta-laktamázy. Bylo by také možné použít fosfomycin a kolistin při léčení infekcí způsobených gramnegativními bacily rezistentními na karbapenem. Tak je například 31 zvláště užitečných antibiotik v omezených množstvích dostupných v některých studovaných zemích. Autoři se domnívají, že je třeba „zajistit lepší dostupnost těchto antibiotik v globálním měřítku a provádět další výzkum, který by se týkal výhodnosti těchto antibiotik při léčení současných klinických infekcí“.
Freire-Moran et al. shrnuli sloučeniny, které jsou v klinickém vývoji a které by se mohly dostat na trh v příštích 5–10 letech [33]. Popsali 66 nových aktivních sloučenin, z nichž 27 mělo nový mechanismus účinku nebo nové zásahové místo. Zbývajících 39 látek náleželo ke známým antimikrobiálním sloučeninám nebo skupinám sloučenin, jako např. chinolonům (15 sloučenin), beta-laktamům (6), oxazolidinům (3), diaminopyrimidinům (2), makrolidům (2), pleuromutilinům (2), aminoglykosidům (1), ansamicinům (1), inhibitoru FabI (1), glykopeptidům (1), kovovým iontům (1) streptograminu (1), tetracyklinu (1) a hybridním látkám typu oxazolidinon/chinolon a rifamycin/fluorochinolon (2). Uvažovalo se o nich tak, že účinkují na stejné zásahové místo jako alespoň jedna již dříve produkovaná antibakteriální sloučenina. Tyto sloučeniny proto nebyly používány v dalších studiích.
Z 27 nových aktivních sloučenin s novým mechanismem účinku nebo s novým zásahovým místem se ukazuje 15 sloučenin, které by mohly být systematicky užívány při léčení vážných invazivních infekcí. Z těchto 15 sloučenin se o 13 uvažovalo, že vykazují aktivitu proti nejméně jedné z vybraných grampozitivních bakterií rezistentních na antibiotika a 8 proti nejméně jedné z vybraných gramnegativních bakterií rezistentních na antibiotika. Infekce způsobené MRSA se daly těmito sloučeninami nejčastěji léčit (13 z 15), zatímco infekce způsobené vankomycin-rezistentními enterokoky mohly být jimi nejméně často léčeny (5 z 15). Z 8 sloučenin s aktivitou proti gramnegativním bakteriím rezistentním na antibiotika měly 4 předpokládanou aktivitu založenou na známých vlastnostech této třídy nebo na známých mechanismech účinku. Ze 4 sloučenin s aktivitou proti gramnegativním bakteriím rezistentním na antibiotika 2 sloučeniny účinkovaly na nová nebo pravděpodobně nová zásahová místa anebo měly nové mechanismy účinku.
NOVÁ ZÁSAHOVÁ MÍSTA PRO ANTIBIOTIKA
Informace o genomech důležitých patogenních bakterií, jako jsou Bacillus anthracis, Listeria monocytogenes a Staphylococcus aureus, by nám určitě měly pomoci při hledání nových zásahových míst pro antibiotika u těchto patogenů. Sekvence mnoha set genomů patogenních mikroorganismů jsou již známé a mnoho dalších projektů probíhá. Boucher et al. shrnuli výhledy při vývoji nových sloučenin proti patogenním mikroorganismům včetně nových zásahových míst [13]. Podle těchto autorů se frekvence infekcí způsobených bakteriemi rezistentními na antibiotika, zejména tzv. ESKAPE patogeny, trvale zvyšuje a tyto patogeny způsobují výraznou morbiditu a mortalitu. Nové antimikrobiální sloučeniny jsou nejvíce potřebné pro léčení infekcí způsobených GNB rezistentními proti současným antibiotikům.
Americká společnost pro infekční choroby (IDSA) navrhuje legislativní, kontrolní a finanční řešení této pokračující krize. IDSA zdůrazňuje přesvědčení Bouchera et al., že problém antibiotik ve vývoji (in the pipe-line) může být řešen na základě spolupráce globálních hráčů s cílem stimulovat výzkum a vývoj nových antibakteriálních antibiotik [13]. Podle těchto autorů by měl být podporován udržitelný globální výzkum antibakteriálních látek a rozvoj podnikání v této oblasti s cílem vyvinout do roku 2020 deset nových, bezpečných, účinných a systematicky aplikovatelných antibiotik podle iniciativy „IDSA 10 x 20“.
Bakheet a Doig analyzovali 48 zásahových proteinů pro antibiotika ze všech bakterií, 22 zásahových proteinů pouze z E. coli a 4 243 zásahových míst jiných než pro antibiotika rovněž u E. coli, s cílem identifikovat rozdíly v jejich vlastnostech a předpovědět nová potenciální zásahová místa pro antibiotika [34]. Zjistili, že ve srovnání s „nezásahovými“ jsou bakteriální „zásahové“ proteiny pro antibiotika dlouhé, mají vysoký obsah β-listu a nízký obsah α-helixu, jsou polární, nacházejí se více v cytoplazmě než v membráně a jsou to obvykle enzymy, velmi často ligázy. Autoři použili sekvenční vlastnosti těchto proteinů a vytvořili model proteinů u E. coli, který umožňuje zařazení jakékoli sekvence do třídy „zásahové“ a „nezásahové“ s přesností 94 %. Identifikovali 319 proteinů v „nezásahové“ sadě, které mají „zásahové“ vlastnosti a z nichž některé mají neznámou funkci. Z těchto proteinů má 63 významnou a nežádoucí podobnost s proteiny lidskými, což ponechává 256 „zásahových“ proteinů, které se nenacházejí u lidí. Autoři se domnívají, že vyhledávací programy na nová antibiotika by mohly být úspěšnější, kdyby se vybrala nová zásahová místa z této sady proteinů podobných „zásahovým“ nebo jejich homologům. Bylo nalezeno 64 esenciálních genů, jejichž inzerční poškození je pro buňku letální.
DISKUSE A ZÁVĚRY
Rezistence mikroorganismů na antibiotika trvale narůstá a představuje celosvětové ohrožení lidského zdraví. Podle Amábile-Cuevas [35] výskyt a šíření bakterií rezistentních na antibiotika odráží jak postupnou, zcela Darwinovskou evoluci, která vede k mírnému poklesu citlivosti na antibiotika s fenotypy, které není možno přesně charakterizovat jako “rezistenci“, tak náhlé změny od úplné citlivosti k úplné rezistenci, poháněné mnoha mechanismy horizontálního genového přenosu. Antibiotika selektují více než jen rezistenci na antibiotika, ale také zvýšenou virulenci a vyšší schopnost pro výměnu genů. Mnohé neantibiotické sloučeniny nebo také podmínky selektují nebo udržují znaky rezistence na antibiotika jako důsledek složité sítě často se překrývajících mechanismů genetické výměny. Je proto třeba, aby vývoj nových antibiotik a promyšlené anti-infekční strategie byly v souladu s dlouhodobým bojem proti rezistenci na antibiotika, jak nyní, tak i v budoucnosti. Podle Daviese a Daviesové [36] se důležitost a hodnota antibiotik pořád ještě nedoceňují, při léčení infekčních nemocí jsme na nich přitom zcela závislí a neměli bychom je pokládat za pouhé komodity. Kromě jejich využití při léčení infekčních nemocí jsou antibiotika nezbytná pro pokročilé chirurgické výkony včetně transplantace orgánů a umělých kloubních náhrad.
Podle starého, ale zajímavého modelu Watveho et al. by mělo být ještě pořád možné nalézt 294 300 antibioticky aktivních sloučenin, které dosud nebyly popsány [37], a dokonce i podle mnohem konzervativnějších odhadů by pořád ještě mohlo být izolováno 150 000 sloučenin s antibiotickou aktivitou. I když je tento model některými matematiky zpochybňován, můžeme zcela realisticky odhadovat, že se dosud podařilo izolovat pouze asi 3 % antibiotik produkovaných streptomycetami. Je zřejmé, že v patogenních mikroorganismech jsou ještě zásahová místa, která dosud nebyla studována. Podle Daviese a Daviesové bychom měli obnovit soustředěné úsilí v boji proti rezistenci na antibiotika, aby se naši potomci nakonec nemuseli vrátit do „pre-antibiotického“ období [36].
Poděkování
Ministerstvo školství, mládeže a tělovýchovy České republiky (LO1509).
Do redakce došlo dne 3. 8. 2017.
Adresa pro korespondenci:
prof. RNDr. Jaroslav Spížek, DrSc.
Mikrobiologický ústav AV ČR v.v.i.
Vídeňská 1083
142 20 Praha 4
e-mail: spizek@biomed.cas.cz
Zdroje
1. Bennett JW. What is an Antibiotic? Norfolk, UK: Caister Academic Press; 2015 : 1–18.
2. Leung LM, Fondrie WE, Doi Y, et al. Identification of the ESKAPE pathogens by mass spectrometric analysis of microbial membrane glycolipids. Sci Rep, 2017;7(1):6403.
3. Prichystal J, Schug KA, Lemr K, et al. Structural Analysis of Natural Products. Anal Chem, 2016;88(21):10338–10346.
4. Davies SC, Fowler T, Watson J, et al. Annual report of the Chief medical officer: infection and the rise of antimicrobial resistance. Lancet, 2013;381(9878):1606–1609.
5. Walsh CT, Wencewicz TA. Prospects for new antibiotics: a molecule-centered perspective. J Antibiot, 2014;67(1):7–22.
6. Newman DJ, Cragg GM. Natural Products as Sources of New Drugs from 1981 to 2014. J Nat Prod, 2016;79(3):629–661.
7. Mishra RPN, Oviedo-Orta E, Prachi P, et al. Vaccines and antibiotic resistance. Cur Opin Mircobiol, 2012;15(5):596–602.
8. Jerse AE, Bash MC, Russell MW. Vaccines against gonorrhea: Current status and future challenges. Vaccine, 2014;32(14):1579–1587.
9. Finco O, Rappuoli R. Designing vaccines for the twenty-first century society. Front Immunol, 2014;5(číslo článku 12).
10. Bagnoli F, Baudner B, Mishra RPN, et al. Designing the next generation of vaccines for global public health. Omics J Integrat Biol, 2011;15(9):545–566.
11. Spizek J, Novotna J, Rezanka T, et al. Do we need new antibiotics? The search for new targets and new compounds. J Ind Microbiol Biotechnol, 2010;37(12):1241–1248.
12. Butler MS, Blaskovich MA, Cooper MA. Antibiotics in the clinical pipeline in 2013. J Antibiot, 2013;66(10):571–591.
13. Boucher HW, Talbot GH, Benjamin DK, Jr, et al. 10 x '20 Progress-development of new drugs active against Gram-negative bacilli: an update from the infectious diseases society of America. Clin Infect Dis, 2013;56(12):1685–1694.
14. Gould IM, Bal AM. New antibiotic agents in the pipeline and how they can help overcome microbial resistance. Virulence, 2013;4(2):185–191.
15. Daniel R. The soil metagenome – a rich resource for the discovery of novel natural products. Cur Opin Biotechnol, 2004;15(3):199–204.
16. Hopwood DA. Therapeutic treasures from the deep. Nature Chem Biol, 2007;3(8):457–458.
17. Subramani R, Aalbersberg W. Marine actinomycetes: An ongoing source of novel bioactive metabolites. Microbiol Res, 2012;167(10):571–580.
18. Fenical W, Jensen PR. Developing a new resource for drug discovery: marine actinomycete bacteria. Nat Chem Biol, 2006;2(12):666–673.
19. Doshi GV, Aggarwal GV, Martis EA, et al. Novel antibiotics from marine sources. Int J Pharmaceut Sci Nanotechnol, 2011;4 : 1446–1461.
20. Hu G-P, Yuan J, Sun L, et al. Statistical research on marine natural products based on data obtained between 1985 and 2008. Mar Drugs, 2011;9(4):514–525.
21. Gulder TAM, Moore BS. Chasing the treasures of the sea - bacterial marine natural products. Cur Opin Microbiol, 2009;12(3):252–260.
22. Kamjam M, Sivalingam P, Deng ZX, et al. Deep Sea Actinomycetes and Their Secondary Metabolites. Frontiers in Microbiology, 2017;8 (article number 160).
23. Bachmann BO, Van Lanen SG, Baltz RH. Microbial genome mining for accelerated natural products discovery: is a renaissance in the making? J Ind Microbiol Biotechnol, 2014;41(2):175–184.
24. Katz L, Baltz RH. Natural product discovery: past, present, and future. J Ind Microbiol Biotechnol, 2016;43(2–3):155–176.
25. Demain AL. Importance of microbial natural products and the need to revitalize their discovery. J Ind Microbiol Biotechnol, 2014;41(2):185–201.
26. Baltz RH. Strain improvement in actinomycetes in the postgenomic era. J Ind Microbiol Biotechnol, 2011;38(6):657–666.
27. Baltz RH. Function of MbtH homologs in nonribosomal peptide biosynthesis and applications in secondary metabolite discovery. J Ind Microbiol Biotechnol, 2011;38(11):1747–1760.
28. Baltz RH. MbtH homology codes to identify gifted microbes for genome mining. J Ind Microbiol Biotechnol, 2014;41(2):357–369.
29. Baltz RH. Antibiotic discovery from actinomycetes: will a renais-sance follow the decline and fall? SIM News, 2005;55 : 186–196.
30. WHO. Critically important antimicrobials for human medicine, 5th revision 2016. World Health Organization, Geneva, Switzerland, 2017.
31. Uchiyama I. MBGD: microbial genome database for comparative analysis. Nucleic Acids Res, 2003;31(1):58–62.
32. Pulcini C, Bush K, Craig WA, et al. Forgotten antibiotics: an inventory in Europe, the United States, Canada, and Australia. Clin Infect Dis, 2012;54(2):268–274.
33. Freire-Moran L, Aronsson B, Manz C, et al. Critical shortage of new antibiotics in development against multidrug-resistant bacteria-Time to react is now. Drug Res Updates, 2011;14(2):118–124.
34. Bakheet TM, Doig AJ. Properties and identification of antibiotic drug targets. BMC Bioinformatics, 2010;11(číslo článku 195).
35. Amabile-Cuevas CF. Antibiotic resistance: from Darwin to Lederberg to Keynes. Microb Drug Resist, 2013;19(2):73–87.
36. Davies J, Davies D. Origins and evolution of antibiotic resistance. Microbiol Mol Biol Rev, 2010;74(3):417–433.
37. Watve MG, Tickoo R, Jog MM, et al. How many antibiotics are produced by the genus Streptomyces? Arch Microbiol, 2001;176(5):386–390.
Štítky
Hygiena a epidemiologie Infekční lékařství Mikrobiologie
Článek vyšel v časopiseEpidemiologie, mikrobiologie, imunologie
Nejčtenější tento týden
2018 Číslo 2- Stillova choroba: vzácné a závažné systémové onemocnění
- Diagnostika virových hepatitid v kostce – zorientujte se (nejen) v sérologii
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- Stav imunitního systému u pacientů se subklinickou formou urogenitální tuberkulózy
- Molekulární epidemiologie tuberkulózy v hlavním městě Praha v letech 2013 a 2014
- Surveillance invazivního meningokokového onemocnění založená na sekvenaci celého genomu (WGS), Česká republika, 2015
- Boj s rezistencí mikroorganismů na antibiotika
- Streptokokový syndrom toxického šoku – život ohrožující stav vyvolaný různými druhy streptokoků
- Bakteriémie vyvolaná Staphylococcus aureus – význam správného přístupu k diagnostice a léčbě
- Aktualizace českých doporučených postupů pro laboratorní diagnostiku infekcí vyvolaných Clostridium difficile
- Epidemiologie, mikrobiologie, imunologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Streptokokový syndrom toxického šoku – život ohrožující stav vyvolaný různými druhy streptokoků
- Bakteriémie vyvolaná Staphylococcus aureus – význam správného přístupu k diagnostice a léčbě
- Boj s rezistencí mikroorganismů na antibiotika
- Aktualizace českých doporučených postupů pro laboratorní diagnostiku infekcí vyvolaných Clostridium difficile
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



