-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Prehľad a návrh klasifikácie vrodených anomálií týmusu u detí
Review and proposal for classification of the congenital anomalies of thymus in children
Thymus is a central lymphoid organ with an important endocrine function located in the superior mediastinum, but in newborns it caudally reaches to anterior mediastinum. Thymic morphology varies greatly even in the same age group. For instance, in young adults, it is typically bilobed and V-shaped, with two small processes extending into the neck. Anomalies of the thymic shape, size and localization are explained by the disruption of thymic primordia formation and/or disruption of its descent from the neck to the mediastinum. The most common thymic anomalies include anomalies in number of the thymic lobes, ectopic thymus, accessory thymic tissue, thymic aplasia, thymoparathyroid aplasia (DiGeorge syndrome), thymic hypoplasia and hyperplasia. In a case of ectopic thymus, the whole thymus is (most often) located in the midline neck, and no thymic tissue is located in the normal position in the mediastinum. The presence of accessory thymic tissue reflects a failed migration of the whole thymic primordia from the third pharyngeal pouches. It may be found at any level of the pathway of normal thymic descent, from the angle of the mandible to the superior mediastinum. The prevalence of foci of accessory thymic tissue varies according to several authors from 1.8% up to more than 50%.
A great controversy about the terms being used in the classification of thymic anomalies arises in current literature. Most of the recent articles use the term “ectopic thymus” in a confusing way, because they call cervical extension of the thymus, accessory cervical lobes of the thymus or accessory thymic tissue also “ectopic thymus”. The “genuine” ectopic thymus is a distinct entity from accessory thymic tissue localized in the neck. The term “ectopic thymus” should be reserved for states where only ectopic thymic tissue is present, while no thymus tissue is localized in the normal, mediastinal position. These two entities are differentiated also according to the recommendation of the Terminologia Embryologica (ectopia thymi versus textus thymicus accessorius). A cystic version of accessory thymic tissue localized in the neck is called “congenital cervical thymic cyst”. The cystic version of aberrant thymic tissue is more often described in the literature than the “classical” solid form. Thymopharyngeal duct cyst is another special and extremely rare variant of cystic accessory thymic tissue. Only circa 5 cases are described in the literature. Relatively common and asymptomatic anatomical variation is the fusion of thymus with one or more parathyroid glands - much common with the inferior due to common embryonic origin of both organs.
Key-words:
accessory thymic tissue, DiGeorge syndrome, ectopic thymus, embryonic development, human thymus, Terminologia Embryologica
Autoři: I. Varga 1
; L. Plank 2; V. Mešťanová 3; L. Zábojníková 4
Působiště autorů: Ústav histológie a embryológie, Lekárska fakulta, Univerzita Komenského, Bratislavaprednosta doc. MUDr. Š. Polák, CSc. 1; Ústav patologickej anatómie, Jesseniova lekárska fakulta v Martine, Univerzita Komenského, Bratislavavedúci prof. MUDr. L. Plank, CSc. 2; Ústav histológie a embryológie, Jesseniova lekárska fakulta v Martine, Univerzita Komenského, Bratislavavedúci prof. MUDr. M. Adamkov, CSc. 3; Klinika detskej chirurgie, Detská fakultná nemocnica s poliklinikou a Lekárska fakulta, Univerzita Komenského, Bratislavaprednosta doc. MUDr. J. Trnka, CSc. 4
Vyšlo v časopise: Čes-slov Pediat 2014; 69 (3): 178-190.
Kategorie: Přehledový článek
Souhrn
Týmus je primárny lymfatický orgán s dôležitou endokrinnou funkciou. Lokalizovaný je v hornom mediastíne, u novorodencov zasahuje do predného mediastína. Morfológia týmusu sa značne líši dokonca v rovnakej vekovej kategórii. U mladých jedincov je tvorený dvoma asymetrickými lalokmi a má tvar písmena „V“, pričom výbežky kraniálne siahajú do krčnej oblasti. Anomálie tvaru, veľkosti a lokalizácie týmusu možno vysvetliť narušením vývinu základu týmusu v hltanovej oblasti embrya a/alebo narušením jeho zostupu z oblasti krku do mediastína. Medzi najčastejšie anomálie týmusu zaraďujeme odchýlky v počte lalokov, ektopický týmus, prídavné tkanivo týmusu, apláziu týmusu, kombinovanú apláziu týmusu a prištítnych teliesok (DiGeorgeov syndróm), hypopláziu a hyperpláziu týmusu.
V súčasnej literatúre je značná nejednota v klasifikácii anomálií týmusu, na ktoré v našom príspevku poukazujeme. Opierame sa pri tom o poznatky o vývine týmusu a postupujeme podľa odporúčania medzinárodnej Terminologia Embryologica. Cystická forma akcesórneho tkaniva týmusu lokalizovaného na krku sa označuje ako „vrodená krčná cysta týmusu“. Týmofaryngová krčná cysta je ďalší špeciálny a veľmi vzácny variant akcesórneho cystického tkaniva týmusu. Pomerne častá a asymptomatická anatomická variácia je fúzia týmusu s jedným alebo s viacerými prištítnymi telieskami.
Kľúčové slová:
DiGeorgeov syndróm, ektopický týmus, embryonálny vývin, prídavné tkanivo týmusu, Terminologia Embryologica, týmusÚvod
Týmus je primárny lymfatický orgán s dôležitou endokrinnou funkciou. Vo vnú-tri orgánu dochádza k mnohonásobnému mitotickému deleniu progenitorových buniek, k ich selekcii a diferenciácii na zrelé T-lymfocyty. Dozrievanie T-lymfocytov v týmuse je spojené s komplikovanou vnútrobunkovou prestavbou ich genetického materiálu sprostredkovanou medzibunkovými kontaktmi medzi vyvíjajúcimi sa lymfocytmi a ďalšími bunkami tvoriacimi špecifické mikroprostredie týmusu (epitelové bunky vytvárajúce nosnú sieťovinu pre lymfocyty, myoidné bunky, makrofágy a dendritové bunky prezentujúce antigény). Schopnosť rozoznať telu vlastné antigény a cudzie antigény nie je geneticky zakódovaná, ale získava sa v týmuse. Preto možno týmus považovať za univerzitu T-lymfocytov. Lymfocyty, ktoré neprešli prísnou selekciou v týmuse a môžu byť potencionálne autoreaktívne, zanikajú procesom apoptózy. Predpokladá sa, že vo vnútri týmusu programovanou bunkovou smrťou zaniká až 98 % lymfocytov, ktoré sú následne odstránené makrofágmi [1–7].
Týmus možno zároveň zaradiť aj medzi endokrinné orgány, nakoľko epitelové bunky týmusu produkujú rôznorodé peptidy. V súčasnosti rozoznávame minimálne 4 skupiny týmusových peptidov, ktoré sa odlišujú svojou chemickou povahou aj imunologickými vlastnosťami. Sú to tymozín, tymo-poetín, tymulín a týmusový humorálny faktor. Hormóny týmusu vo všeobecnosti ovplyvňujú proces množenia a dozrievania T-lymfocytov a regulujú ich funkcie. Môžu však ovplyvňovať aj ďalšie zložky imunitného systému, napríklad migráciu makrofágov. Aplikácia hormónov týmusu v klinickej praxi otvára nové možnosti liečby tých chorôb, ktorých podstatou je porucha imunity. Okrem niektorých infekčných, autoimunitných a onkologických chorôb je potrebné zdôrazniť aj potencionálnu možnosť ich využitia v geriat-rii s cieľom spomaliť proces starnutia [8–11].
Cieľom našej prehľadovej práce je stručne zhrnúť najnovšie poznatky o normálnom vývine a anatomickej stavbe týmusu, ako aj poskytnúť odbornej verejnosti prehľad vývinových chýb týmusu. Vychádzame pri tom z najnovšej, oficiálnej a medzinárodne schválenej embryologickej terminológie, pomocou ktorej sa snažíme vniesť poriadok do klasifikácie vrodených anomálií týmusu u detí. Prinášame aj praktické klinické využitie teoretických poznatkov na príklade konkrétnych kazuistík, s ktorými sme sa buď osobne stretli alebo pochádzajú z príspevkov uverejnených v medzinárodne uznávaných odborných časopisoch.
Poznámky k anatómii týmusu
Týmus človeka je uložený v mediastinum superius, pričom u detí siaha kaudálne až do mediastinum anterius a kraniálne až na krk. Veľkosť a mikroskopická stavba týmusu je značne variabilná a závisí predovšetkým od veku jedinca. Týmus dosahuje svoju najväčšiu veľkosť v čase pôrodu, prípadne v prvých mesiacoch života, keď má zároveň aj najväčšiu relatívnu hmotnosť. Podľa Weerkampa et al. [12] vrchol aktivity dosahuje týmus približne 6 mesiacov po narodení, kedy obsahuje najväčší celkový počet vyvíjajúcich sa T-lymfocytov. Vekom podmienená (fyziologická) involúcia týmusu začína už po 1. roku života dieťaťa a pokračuje postupne počas celého života jedinca. Až do stredného veku stráca týmus ročne 3 až 5 % zo svojej celularity, v druhej polovici života sa tento progres spomaľuje na 1 % ročne [13]. Podiel vody v týmuse klesá zo 72 % v 10. roku života na 30 % v 50. roku života, pričom podiel tukových buniek a kolagénu s pribúdajúcim vekom stúpa na úkor lymfatického tkaniva [14]. Avšak mikroskopické zbytky lymfatického tkaniva týmusu s početnými lymfocytmi možno nájsť aj u vyše 100-ročných jedincov [15]. Faktory ovplyvňujúce vekom podmienenú involúciu nie sú dostatočne preskúmané. Fyziologickú ako i patologickú involúciu týmusu ovplyvňuje endokrinný systém, napríklad pohlavné hormóny, ale aj rastové faktory a cytokíny. Dôkazom je regenerácia involvovaného týmusu po chirurgickej, alebo hormonálne vykonanej kastrácii dospelých jedincov (na animálnych modeloch u potkanov a myší) [16]. Vo vývine a pri udržiavaní homeostázy lymfocytov týmusu zohrávajú dôležitú úlohu glukokortikoidy. U geneticky modifikovaných myší so zníženou citlivosťou na glukokortikoidy totiž k involúcii týmusu dochádza neskôr [17].
Makroskopický vzhľad týmusu je značne variabilný aj v skupine jedincov rovnakého veku. U mladých jedincov je typicky dvojlaločnatým orgánom. Laloky majú mäkkú konzistenciu, preto sú formované aj kontaktom s okolitými útvarmi. Týmus človeka má približne pyramídovitý, zľahka sploštený tvar, pričom zaoblené bázy smerujú kaudálne k osrdcovníku a štíhle hroty vybiehajú kra-niálne na krk [18]. Avšak bežne sa vyskytujú aj týmusy s jedným lalokom, prípadne trojlaločnaté, alebo môžu mať tvar podobný písmenu X či tvar obráteného písmena V [19].
Stručný prehľad vývinu týmusu
Nakoľko sme už v minulosti publikovali aj na stránkach Česko-slovenskej pediatrie rozsiahlejšiu prácu o ontogenéze týmusu človeka [20], na tomto mieste sa len stručne zmienime o základných faktoch potrebných pre porozumenie vzniku jeho anomálií. U človeka sa párové základy týmusu objavujú spoločne so základmi dolných prištítnych teliesok počas 5. týždňa po oplodnení. Zdrojom pre nosnú sieťovinu epitelových buniek týmusu je endoderma faryngového čreva (párové 3. faryngové vačky), do ktorej v ďalších týždňoch vycestujú progenitorové bunky budúcich T-lymfocytov (mezenchýmový pôvod) aj bunky neurálnej lišty, ktoré sú zdrojom pre väzivové súčasti týmusu (neuroektodermový pôvod). Rýchly rast embrya počas 7. a 8. týždňa vývinu spôsobuje migráciu (descensus) základov týmusu aj prištítnych teliesok kaudálnym smerom. Priame spojenie so stenou embryonálneho hltana týmto zväčša úplne zaniká. Ku koncu embryonálneho obdobia sa párové základy týmusu spoja pred osrdcovníkom a pred veľkými cievami srdca. Laloky však celý život ostanú od seba oddelené tenkou vrstvičkou väziva. Inervácia, krvné zásobenie aj lymfatická drenáž jednotlivých lalokov zostávajú od seba úplne oddelené [1, 2, 20–26].
Vrodené anomálie týmusu
Anomálie v tvare, veľkosti a lokalizácii týmusu možno vysvetliť narušením vývinu základov týmusu, alebo narušením migrácie základov týmusu z oblasti hltana až do mediastína. Genetické dôkazy potvrdili, že proces migrácie základov týmusu je riadený bunkami neurálnej lišty, ktoré sú prítomné na povrchu týchto orgánových základov. Jedinci s deléciou v skupine génov HOX3, exprimovaných bunkami neurálnej lišty, majú štruktúru týmusu síce nezmenenú, avšak s ektopickým umiestnením [27].
Medzi najčastejšie vrodené anomálie týmusu patria: 1. anomálie v počte lalokov, 2. ektopický týmus, 3. akcesórne tkanivo týmusu, 4. aplázia týmusu, 5. hypoplázia týmusu, 6. hyperplázia týmusu, 7. fúzia týmusu s jedným alebo viacerými prištítnymi telieskami (tab. 1).
Tab. 1. Prehľad anomálií týmusu aj s vyzdvihnutím ich klinického významu. 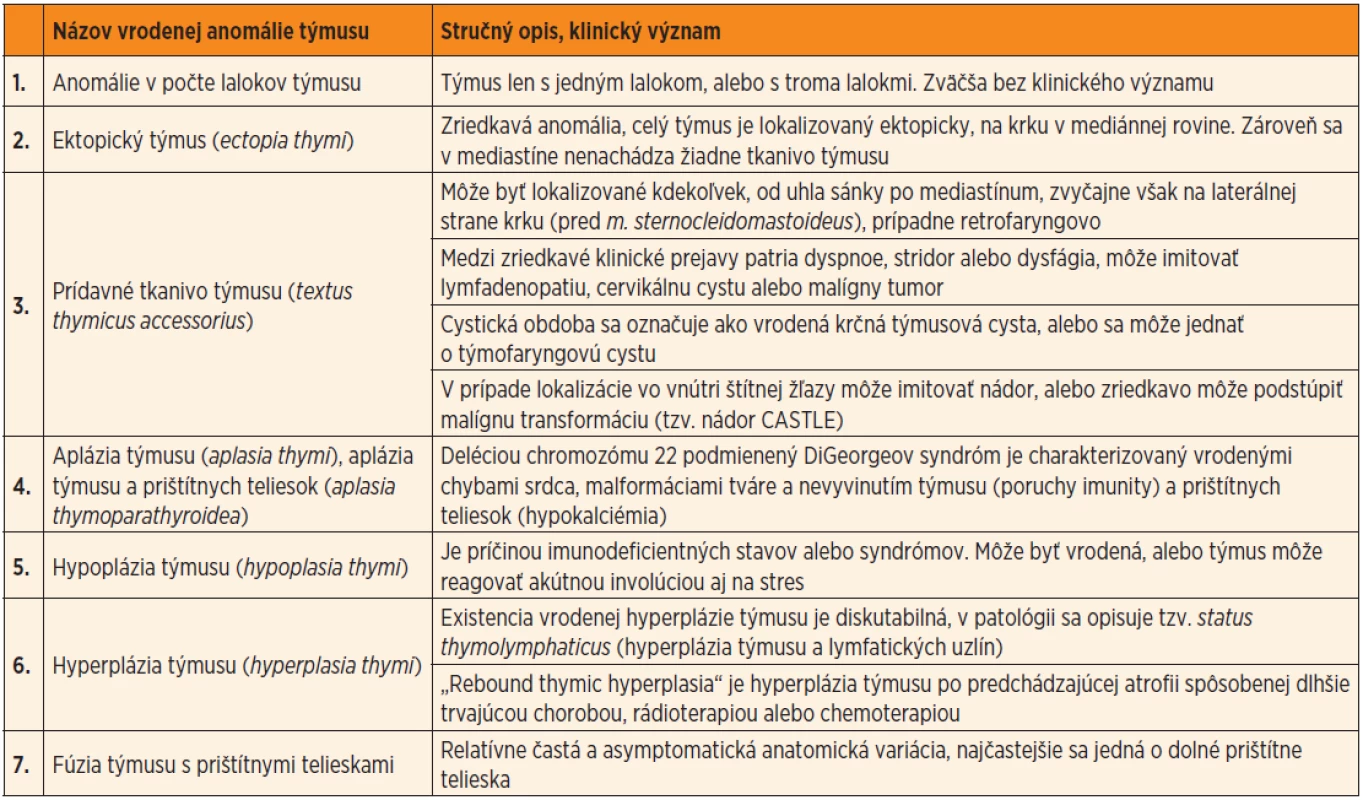
Anomálie v počte lalokov týmusu. Varga et al. [18] počas ultrasonografického vyšetrenia týmusu u 212 donosených novorodencov z južného Slovenska zaznamenali anomálie v počte lalokov trikrát. Dvaja novorodenci mali prídavný tretí lalok, ktorý vystupoval do oblasti krku. V prípade tretieho novorodenca sa jednalo o úplné chýbanie ľavého laloka týmusu. Ani jedna z týchto anomálií nemala klinický význam.
Ektopický týmus (ectopia thymi). Veľmi zriedkavá anomália, pri ktorej je týmus lokalizovaný najčastejšie na krku (v mediánnej rovine) a zároveň sa v mieste jeho normálnej lokalizácie (v mediastíne) nenachádza žiadne tkanivo týmusu [28]. Správna diagnostika ektopického týmusu je dôležitá, ak nespôsobuje útlakový syndróm, nevyžaduje si chirurgickú intervenciu. Pred prípadnou totálnou exstirpáciou takéhoto ektopického týmusu treba mať na zreteli aj jeho jedinečnú a dôležitú funkciu vo vývine imunitného systému u detí. A to obzvlášť v prípadoch, keď je ektopické tkanivo týmusu jediným funkčným týmusovým tkanivom v organizme jedinca [29].
Prídavné (akcesórne) tkanivo týmusu lokalizované ektopicky (textus thymicus accessorius). Je príkladom narušenia zostupu celých párových základov týmusu z hltanovej oblasti do mediastína. Väčšie, či menšie ostrovčeky lymfatického tkaniva týmusu sa môžu nachádzať kdekoľvek, od uhla sánky až po horné mediastínum. Publikované údaje o frekvencii prítomnosti akcesórneho tkaniva týmusu v bežnej populácii značne kolíšu od hodnôt 1,8 % (v prípade ak sa prídavné tkanivo týmusu hľadalo pri pitve len makroskopicky) až po vyše 50 % (pri dôkladnom mikroskopickom vyšetrení tukového väziva z oblasti krku a mediastína) (tab. 2).
Tab. 2. Výskyt prídavného tkaniva týmusu (od najnižšej hodnoty po najvyššiu), podľa viacerých autorov. 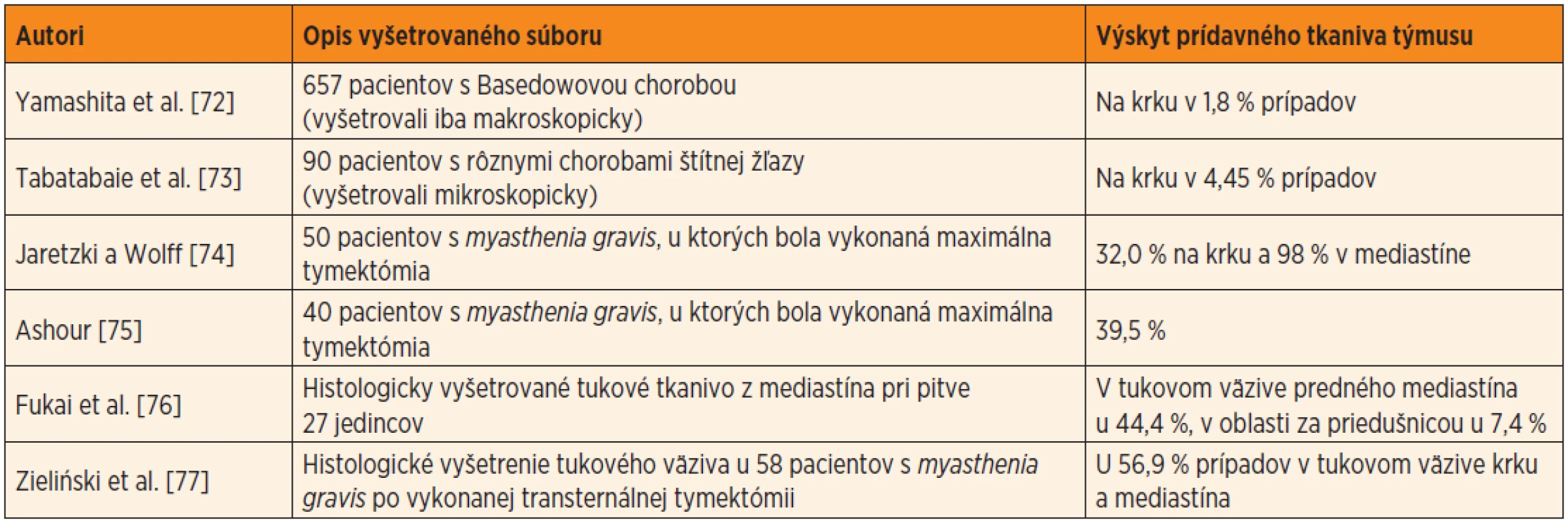
Aplázia týmusu (aplasia thymi), prípadne aplázia týmusu a prištítnych teliesok (aplasia thymoparathyroidea, tzv. DiGeorgeov syndróm). Delécia chromozómu 22q11.2 patrí medzi najčastejšie príčiny narušeného vývinu hltanovej oblasti embrya. Tieto delécie spôsobujú aj DiGeorgeov syndróm charakterizovaný vrodenými chybami srdca, malformáciami tváre a nevyvinutím týmusu (poruchy imunity) a prištítnych teliesok (hypokal-ciémia) [30]. Spoločným faktorom narušenia vývinu týmusu, srdca, prištítnych teliesok a tváre je geneticky spôsobená narušená migrácia buniek neurálnej lišty do hltanovej oblasti embrya a srdca. Imunodeficiencia je jedným z kľúčových nálezov u pacientov s DiGeorgeovým syndrómom a je spôsobená narušeným procesom vývinu T-lymfocytov v nevyvinutom, resp. nedostatočne vyvinutom týmuse [31–33].
Hypoplázia týmusu (hypoplasia thymi). Je zvyčajne príčinou imunodeficientných stavov alebo syndrómov (napr. Nezelofov syndróm, retikulárna dysgenéza). Hypoplázia týmusu však nemusí byť len vrodená. Lymfatické tkanivo týmusu detí reaguje akútnou involúciou na stres. Stresom podmienenú involúciu týmusu môžu spustiť rozličné faktory ako napríklad infekcie, horúčka, popáleniny, hladovanie alebo exogénne steroidy. Nie všetky faktory ovplyvňujúce veľkosť týmusu sú dokonale známe [34].
Hyperplázia týmusu, tymomegália (hyperplasia thymi). Skutočná existencia vrodenej hyperplázie týmusu je nejasná, aj napriek tomu, že sa v staršej (najmä ruskej a sovietskej) literatúre pravidelne stretávame s takouto nozologickou jednotkou [napr. 35–37]. Nesprávne interpretované nálezy „zväčšeného“ týmusu detí sa na začiatku minulého storočia dávali dokonca do vzťahu s ich náhlym úmrtím (jednalo sa pritom o týmusy normálnej veľkosti, nakoľko ich majú zdravé deti zdanlivo väčšie v porovnaní s dlhodobo chorými jedincami, ktorých týmusy prešli stresom – podmienenou involúciou). Z prvej polovice minulého storočia sú dokonca známe „preventívne“ vykonávané tymektómie a ožarovania týmusov, aby sa zabránilo úmrtiam detí s takto fiktívne „zväčšeným“ týmusom [38, 39]. Našťastie sú už dnes tieto mýty vyvrátené. Napriek tomu v patológii koncept tzv. týmolymfatického stavu (hyperplázia týmusu a lymfatických uzlín) ako reakcie novorodenca na postnatálne akvirovanú infekciu nie je tak jednoznačne zavrhnutý (ako možný pitevný nález).
Zaujímavým javom z pohľadu dynamickosti morfológie týmusu je jeho hyperplázia po predchádzajúcej atrofii. V niektorých prípadoch totiž dochádza po atrofii týmusu spôsobenej dlhšie trvajúcou chorobou, rádioterapiou alebo chemoterapiou až k jeho nárastu do 150 % pôvodnej veľkosti [40, 41]. V takýchto prípadoch môže byť diferenciálno-diagnostickým problémom odlíšiť takúto dočasnú hyperpláziu (angl. rebound thymic hyperplasia) od malignity týmusu [42].
Terminologická poznámka
V súčasnej odbornej literatúre existuje veľká diskrepancia pri používaní termínov opisujúcich anomálie týmusu. Väčšina súčasných publikácií používa termín „ektopický týmus“ nesprávne a mätúco. Mnohí autori týmto termínom označujú aj prídavné laloky týmusu dosahujúce na krk, prípadne prídavné lymfatické tkanivo týmusu lokalizované mimo mediastína, a to aj napriek tomu, že súčasne je v mediastíne uložený na svojej anatomicky „normálnej“ pozícii aj „normálny“ týmus (tab. 3). Termín „pravého“ ektopického týmusu by mal byť vyhradený len pre tie prípady, keď je celý týmus lokalizovaný mimo horného mediastína a na jeho normálnom mieste nemožno nájsť žiadne štruktúry tkaniva týmusu. Ektopický týmus od prídavného (akcesórneho) tkaniva týmusu lokalizovaného mimo mediastína od seba odlišuje aj medzinárodne akceptovaná Terminologia Embryologica (ectopia thymi – textus thymicus accessorius) [43].
Tab. 3. Ukážka niekoľkých príkladov nesprávneho používania termínov „ektopický týmus” alebo „cervikálny týmus”. Jedná sa o prípady, pri ktorých sa súčasne v mediastíne nachádzal aj normálne uložený týmus. 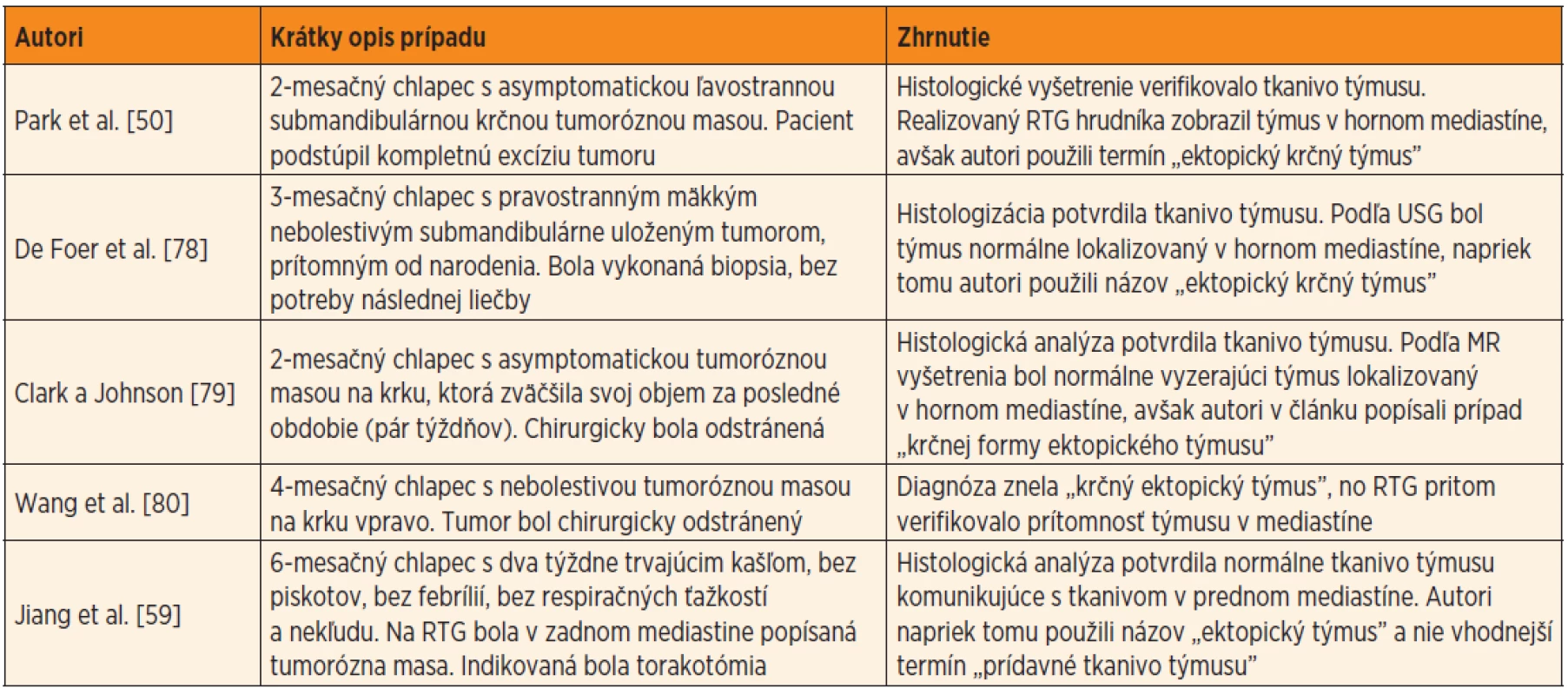
Klinický význam ektopicky lokalizovaného tkaniva týmusu
Znalosti o lokalizácii prípadných akcesórnych ostrovčekov tkaniva týmusu majú význam najmä pre hrudných chirurgov, a to v prípade nutnosti vykonania maximálnej tymektómie u pacientov s myasthenia gravis [44]. Jaretzki [45] identifikoval peroperačne akcesórne tkanivo týmusu u pacientov s myasthenia gravis v tukovom väzive mediastína až v 32 %, v tukovom väzive krku v 22 %, v priestore za štítnou žľazou v 6 % a v priestore za vena brachiocephalica v 3 % prípadov. Samotný autor dokonca uvádza, že sa nejedná o variácie v lokalizácii tkaniva týmusu, ale definuje prídavné tkanivo týmusu aj mimo mediastína ako „normálny jav“.
Klinicky dôležitá môže byť lokalizácia akcesórneho tkaniva týmusu vo vnútri štítnej žľazy. To môže imitovať benígne, ale aj malígne lézie štítnej žľazy [46, 47]. Podľa výsledkov sonografického vyšetrenia štítnej žľazy u 3195 detí je prevalencia intrathyroidálneho výskytu akcesórneho tkaniva týmusu na úrovni 0,4 % [48]. Ektopicky lokalizované tkanivo týmusu vo vnútri štítnej žľazy môže v ojedinelých prípadoch podľahnúť aj malígnej transformácii (typicky v dospelosti, v piatej dekáde života). Vzniká tak zriedkavý nádor CASTLE (Carcinoma Showing Thymus-Like Elements), morfologicky aj imunohistochemicky podobný karcinómu týmusu [49, 50]. CASTLE sa dlho považoval za karcinóm nejasného pôvodu, recentná WHO klasifikácia nádorov pľúc a mediastína (z roku 2013) ju už akceptuje ako nezávislú, samostatnú nádorovú jednotku.
Prídavné tkanivo týmusu lokalizované na krku je zväčša náhodným nálezom a môže byť mylne považované za nádor alebo infekciu [51]. V odbornej literatúre sa stretneme asi so stovkou opísaných anomálií týmusu, pri ktorých je tkanivo týmusu lokalizované najmä na laterálnej strane krku, prípadne retrofaryngovo. Z týchto prípadov je asi 10 % diagnostikovaných u novorodencov, v ostatných prípadoch sa jedná najmä o deti, zriedkavejšie o dospelých (tab. 3). Ektopické prídavné tkanivo týmusu sa častejšie vyskytuje u chlapcov, s prevládajúcou lokalizáciou na ľavej strane krku [52]. Prídavné tkanivo týmusu je lokalizované zväčša pred kývačom hlavy (musculus sternocleidomastoideus), asi v strednej tretine priebehu svalu. V hĺbke môže byť v priamom spojení s väzivovým obalom krčného nervovo-cievneho zväzku (vagina carotica) a často zasahuje až do retrofaryngového priestoru. Približne v polovici prípadov sa vyskytuje priame spojenie medzi prídavným cervikálnym tkanivom týmusu a týmusom lokalizovaným v mediastíne (obr. 1) [53].
Obr. 1. Vyšetrenie magnetickou rezonanciou zobrazuje ľavostrannú tumoróznu masu na krku (akcesórne tkanivo týmusu) priamo spojenú s normálne uloženým týmusom v mediastíne u 7-ročného chlapca. Fig. 1. Examination by magnetic resonance images the left-side tumor mass on the neck (accessory thymus tissue) directly connected to normally positioned thymus in mediastinum in a 7-year-old boy. 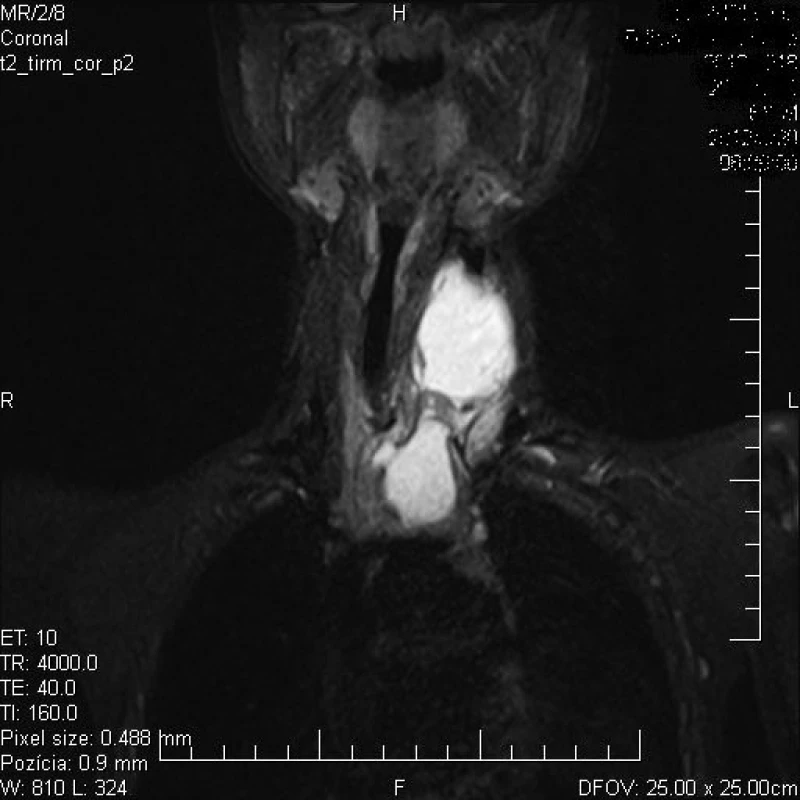
Cervikálne lokalizované tkanivo týmusu sa zväčša manifestuje ako opuch, resp. tumorózny útvar na krku pripomínajúci lymfadenopatiu. V rámci diferenciálnej diagnostiky musí byť odlíšené od frekventovanejšej cervikálnej cysty, angiómu a malígnych tumorov [54]. Prídavné tkanivo týmusu zväčša nespôsobuje žiadne klinické príznaky, až 80–90 % prípadov tejto anomálie je asymptomatických. Ak sa vyskytnú nejaké symptómy, tie sú väčšinou spôsobené priamym útlakom okolitých štruktúr krku tkanivom týmusu [5]. Medzi zriedkavé klinické prejavy tkaniva týmusu lokalizovaného na krku patria dyspnoe, stridor alebo dysfágia [55–57], prípadne chrápanie počas spánku [58]. V niektorých prípadoch môže takéto cervikálne lokalizované tkanivo imitovať zväčšenie štítnej žľazy [59], alebo subgloticky uložený vrodený hemangióm [60].
Ďalším atypickým miestom výskytu prídavného tkaniva týmusu je zadné mediastínum, o ktorom sa v odbornej literatúre píše menej ako v 20 kazuistikách [61].
Vrodené týmusové cysty a týmofaryngové cysty
Cystická obdoba na krku lokalizovaného prídavného tkaniva týmusu sa označuje ako vrodená krčná týmusová cysta (angl. congenital cervical thymic cyst). Cystická podoba krčného tkaniva týmusu je podľa literárnych zdrojov početnejšia ako „klasická“ solídna forma. Podľa nášho názoru to však môže byť spôsobené tým, že cystické útvary na krku sú nápadnejšie a spôsobujú viac komplikácií ako ostrovčeky lymfatického tkaniva týmusu bez veľkých dutinových priestorov. Chirurgická exstirpácia cysty s následným histologickým vyšetrením je často jediným spôsobom správneho diagnostikovania tejto benígnej anomálie [19, 56, 62, 63]. Pôvod a príčiny vzniku cystických útvarov vo vnútri týmusového tkaniva nie sú doposiaľ exaktne vysvetlené. Zaujímavosťou je, že u niektorých subhumánnych živočíchov (obojživelníky a plazy) sa takéto degeneratívne cystické útvary vyskytujú ako normálne súčasti týmusov [64, 65]. Podľa Orsa et al. [66] vznikajú u človeka takéto cystické útvary premenou Hassallových teliesok, ktoré sú normálnou súčasťou drene týmusu. Táto úvaha však nevysvetľuje, prečo sa tieto cysty tvoria najmä v tkanive týmusu lokalizovaného na krku a nie v mediastíne. Histologicky možno dokázať, že vo vnútri cystických útvarov v tkanive týmusu lokalizovaného na krku sa nachádzajú obrovské viacjadrové fagocytujúce bunky a cholesterolové kryštáliky. Tento obraz pripomína granulomatózny zápal (obr. 2 a 3).
Obr. 2. Mikrofotografia týmusovej cysty z akcesórneho tkaniva týmusu lokalizovaného na krku 7-ročného chlapca. Cystický útvar je lemovaný retikuloepitelovými bunkami týmusu a je vyplnený cholesterolovými kryštálikmi a viacjadrovými fagocytujúcimi bunkami (hematoxylín a eozín, mierka v obrázku = 100 μm). Fig. 2. Microphotography of the thymus cyst from accessory thymus tissue localized on the neck of a 7-year-old boy. The cystic formation is lined by reticuloepithelial cells of thymus and filled with cholesterol crystals and multinuclear phagocyte cells (hematoxylin and eosin, line = 100 μm). 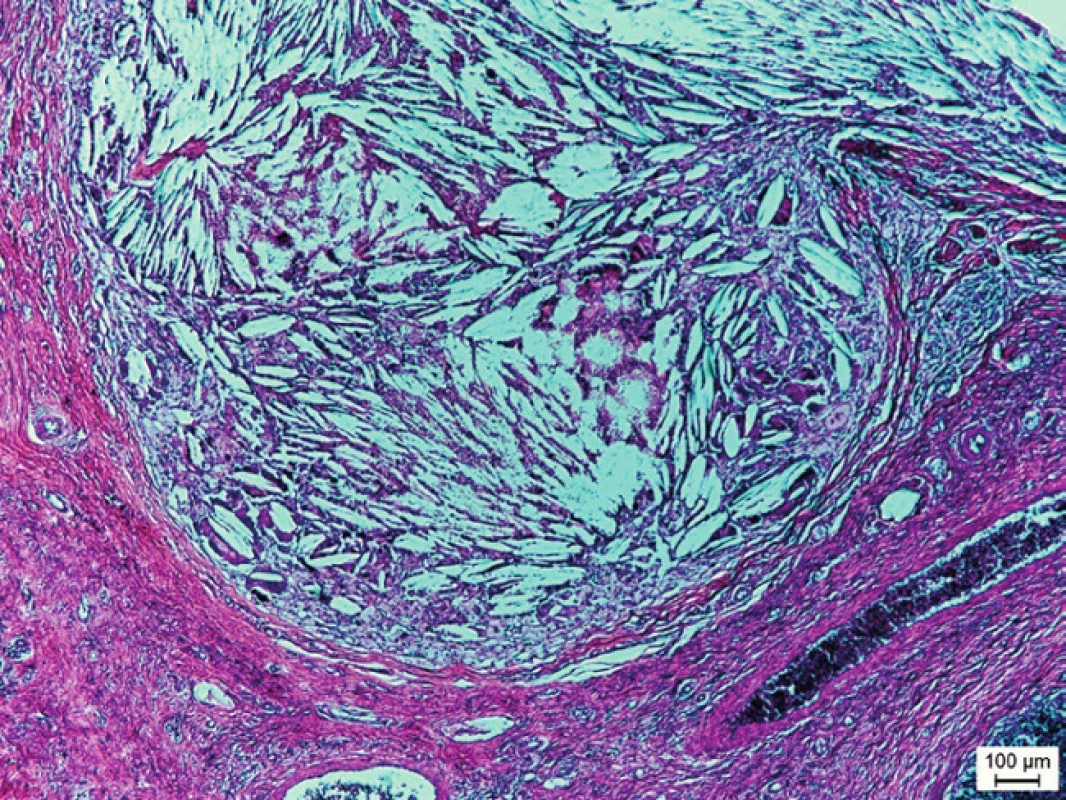
Obr. 3. Detailný záber na viacjadrové fagocytujúce bunky vzniknuté pravdepodobne splývaním monocytov vo vnútri týmusovej cysty (hematoxylín a eozín, mierka = 100 μm). Fig. 3. A detailed view of multinucleated phygocytic cells originated probably from fusion of monocytes within the thymus cyst (hematoxylin and eosin, line = 100 μm). 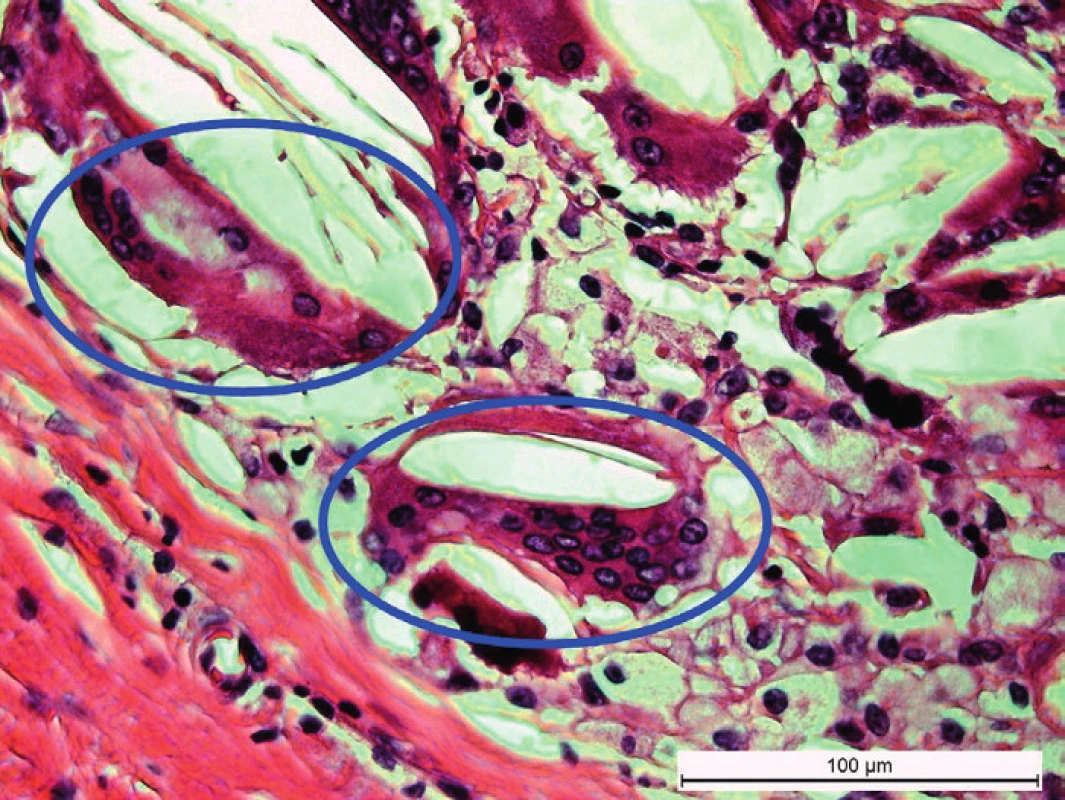
V zahraničnej odbornej literatúre sa spomína aj ďalšia obdoba cystického týmusového tkaniva lokalizovaného na krku, tzv. týmofaryngová cysta (angl. thymopharyngeal duct cyst). Doteraz je vo svete referovaných asi 5 prípadov výskytu [67]. Autori sa opierajú o to, že sa jedná o embryonálny pozostatok spojenia týmusu a steny hltana. Pri ňom sa zachováva „vývod“ vo vnútri týmusu, ktorý za normálnych okolností počas jeho migrácie do mediastína zaniká [68]. Iní autori sa však aj v tomto prípade opierajú o hypotézu cystickej premeny Hassallových teliesok [69]. Diferenciálna diagnostika medzi vrodenou krčnou týmusovou cystou a týmofaryngovou cystou neexistuje, preto je možné, že obe nozologické jednotky sú vlastne tou istou anomáliou.
Fúzia prištítnych teliesok a týmusu
Relatívne častou a asymptomatickou anatomickou variáciou je fúzia týmusu s jedným, prípadne viacerými prištítnymi telieskami (obr. 4). Najčastejšie sa jedná o dolné prištítne telieska, nakoľko tie majú s týmusom rovnaký embryonálny pôvod [70]. Podľa Hojaija et al. [71] je v bežnej populácii prevalencia ektopického výskytu prištítnych teliesok vo vnútri týmusu alebo na inom mieste mediastína na úrovni 19,6 %.
Obr. 4. Mikrofotografia zachytáva ektopicky lokalizované tkanivo prištítneho telieska vo vnútri týmusu normálnej stavby. Náhodný nález pri histologickom vyšetrení involvovaného týmusu u 56-ročného muža (hematoxylín a eozín, mierka = 100 μm). Fig. 4. Microphotograph captures an ectopically localized tissue of parathyroid gland within a thymus with a normal structure. An accidental finding during histological examination of involuted thymus of a 56-year-old man (hematoxylin and eosin, line in figure = 100 μm). 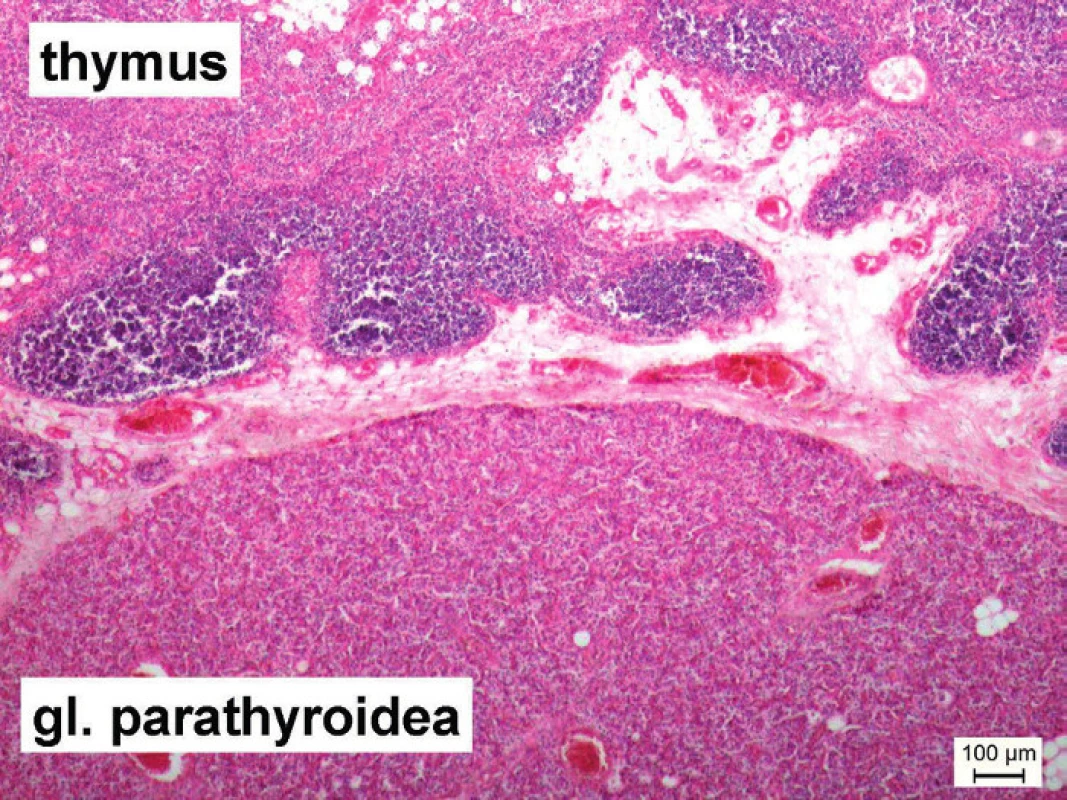
Záverečné poznámky autorov
Naša klasifikácia anomálií týmusu vychádza z embryologických poznatkov a z medzinárodne schválenej Terminologia Embryologica [43]. Táto prvá embryologická terminológia sa zrodila po 17. Medzinárodnom anatomickom kongrese v Kapskom Meste v roku 2009. Vypracovala ho expertná skupina Federative International Committee on Anatomical Terminology. Terminologia Embryologica a je prvým pokusom o ustanovenie oficiálnej terminológie po-užívanej v embryológii, ktorá sa bude zrejme rokmi upravovať a vyvíjať podobne, ako prešla vývojom aj anatomická terminológia.
Poďakovanie
Štúdia bola podporená grantom VEGA Ministerstva školstva, vedy, výskumu a športu Slovenskej republiky č. 1/0902/11 „Týmus v ontogenéze človeka“. Podporené projektmi Centra excelencie na Jesseniovej LF UK v Martine CEPVII (ITMS 26220120036) a MBRKM (ITMS 26220220113), ktoré sú spolufinacované zo zdrojov Európskej Únie.
Došlo: 19. 9. 2013
Přijato: 28. 2. 2014
doc. RNDr. Ivan Varga, PhD.
Ústav histológie a embryológie
Lekárska fakulta, Univerzita Komenského v Bratislave
Sasinkova ulica 4
811 08 Bratislava
Slovenská republika
e-mail: ivan.varga@fmed.uniba.sk
Zdroje
1. Dorko F, Varga I. Vývin a inervácia týmusu. Týmus z pohľadu anatómie, histológie a embryológie. Bratislava: Asklepios, 2011 : 1-136. ISBN 978-80-7167-156-5.
2. Polák Š, Varga I. Funkčná histológia, vývin a evolúcia lymfatického systému človeka (s klinicko - anatomickými koreláciami). Učebné texty pre pregraduálne a postgraduálne štúdium na lekárskych a prírodovedeckých fakultách. Bratislava: Univerzita Komenského, 2013 : 1–130. ISBN 978-80-223-3358-0.
3. Polák Š, Varga I. Lymphatic tissue and organs. In: Adamkov M (Ed). Introduction to Functional Histology. Martin: P+M Turany, 2013 : 271–300. ISBN 978-80--89410-25-5.
4. Varga I, Mikušová R, Pospíšilová V, et al. Morphologic heterogeneity of human thymic nonlymphocytic cells. Neuroendocrinol Lett 2009; 30 (3): 275–283.
5. Rezzani R, Nardo L, Favero G, et al. Thymus and aging: morphological, radiological, and functional overview. Age (Dordr) 2014. 36 (1):313–351.
6. Rezzani R, Bonomini F, Rodella LF. Histochemical and molecular overview of the thymus as site for T-cells development. Prog Histochem Cytochem 2008; 43 : 73–120.
7. Manley NR, Richie ER, Blackburn CC, et al. Structure and function of the thymic microenvironment. Front Biosci (Landmark Ed) 2011; 16 : 2461–2477.
8. Ventevogel MS, Sempowski GD. Thymic rejuvenation and aging. Curr Opin Immunol 2013; 25 (4): 516–522.
9. Wolf E, Milazzo S, Boehm K, et al. Thymic peptides for treatment of cancer patients. Cochrane Database Syst Rev 2011; (2): CD003993.
10. Lunin SM, Novoselova EG. Thymus hormones as prospective anti-inflammatory agents. Expert Opin Ther Targets 2010; 14 (8): 775–786.
11. Bodey B. Thymic reticulo-epithelial cells: key cells of neuroendocrine regulation. Expert Opin Biol Ther 2007; 7 (7): 939–949.
12. Weerkamp F, De Haas EFE, Naber BAE, et al. Age related changes in cellular composition of the thymus in children. J Allergy Clin Immunol 2005; 115 (4): 834–840.
13. Bodey B, Bodey B Jr, Siegel S, Keiser HE. Involution of the mammalian thymus, one of the leading regulators of aging. In Vivo 1997; 11 : 421–440.
14. Kendall MD, Johnson HR, Singh J. The weight of the human thymus gland at necropsy. J Anat 1981; 131 : 483–485.
15. Steinmann GG. Changes in the human thymus during aging. In: Müller-Hermelink HK (Ed). The Human Thymus. Histophysiology and Pathology. Berlin: Springer-Verlag, 1986 : 43–88. ISBN 3-540-15311-X.
16. Dorko F, Kluchová D, Boleková A, et al. Influence of surgical and chemical orchidectomy on weight and distribution of AChE-nerve fibres in thymuses of adult rats. Eur J Histochem 2011; 55 (3): e22.
17. Pazirandeh A, Jondal M, Okret S. Glucocorticoids delay age-associated thymic involution through directly affecting the thymocytes. Endocrinol 2004; 145 (5): 2392–2401.
18. Varga I, Uhrinova A, Toth F, Mistinova J. Assessment of the thymic morphometry using ultrasound in full-term newborns. Surg Radiol Anat 2011; 33 (8): 689–-695.
19. Nasseri F, Eftekhari F. Clinical and radiologic review of the normal and abnormal thymus: pearls and pitfalls. Radiographics 2010; 30 (2): 413–428.
20. Pospíšilová V, Varga I, Gálfiová P, Polák Š. Morfologický pohľad na ontogenézu týmusu človeka. Čes-slov Pediat 2008; 63 (4): 201–208.
21. Gordon J, Manley NR. Mechanisms of thymus organogenesis and morphogenesis. Development 2011; 138 (18): 3865–3878.
22. Bodey B, Siegel SE, Kaiser HE. Embryology of the mammalian thymus. In: Bodey B, Siegel SE, Kaiser HE. Immunological Aspects of Meoplasia – The Role of the Thymus. Dordrecht: Kluwe Academic Publishers, 2004 : 5–14. ISBN 1-4020-2184-4.
23. Varga I, Pospíšilová V, Gmitterová K, Gálfiová P, Polák Š, Galbavý Š. The phylogenesis and ontogenesis of the human pharyngeal region focused on the thymus, parathyroid, and thyroid glands. Neuroendocrinol Lett 2008; 29 (6): 837–845.
24. Varga I, Pospisilova V, Jablonska V, Gálfiová P, Polak S. The thymus: Picture review of human thymus prenatal development. Bratisl lek Listy 2011; 112 (7): 368–372.
25. Varga I, Jablonska-Mestanova V, Galfiova P, Polak S, Adamkov M. Some aspects of early development of thymus: embryological basis for ectopic thymus and thymopharyngeal duct cyst. Rev Arg de Anat Clin 2011; 3 (1): 22–31.
26. Boehm T. Thymus development and function. Curr Opin Immunol 2008; 20 : 178–184.
27. Manley NR, Blackburn CC. A development look at thymus organogenesis: where do the non-hematopoietic cell in the thymus come from? Curr Opin Immunol 2003; 15 (2): 225–232.
28. Shashiraj, Aggarwal A. Undescended thymus presenting as midline neck swelling. Indian J Pediatr 2005; 72 (1): 86.
29. Liu D, Kitajima M, Awai K, et al. Ectopic cervical thymus in an infant. Radiat Med 2006; 24 (6): 452–455.
30. Wurdak H, Ittner LM, Sommer L. DiGeorge syndrome and pharyngeal apparatus development. Bioessays 2006; 28 (11): 1078–1086.
31. Gennery AR. Immunological aspects of 22q11.2 deletion syndrome. Cell Mol Life Sci 2012; 69 (1): 17–27.
32. Carneiro-Sampaio M, Moraes-Vasconcelos D, Kokron CM, et al. Primary immunodeficiency diseases in different age groups: a report on 1,008 cases from a single Brazilian reference center. J Clin Immunol 2013; 33 (4): 716–724.
33. Fomin AB, Pastorino AC, Kim CA, et al. DiGeorge Syndrome: a not so rare disease. Clinics (Sao Paulo) 2010; 65 (9): 865–869.
34. Varga I, Pospíšilová V, Tóth F, et al. Factors affecting child thymus size and involution. Čes-slov Pediat 2008; 93 (4): 209–214.
35. Zajratjanc OV, Serov VV, Kuzmenko LG. The pathogenesis of congenital thymus hyperplasia in children with immune defects. Zentralbl Allg Pathol 1990; 136 (7–8): 689–702.
36. Zaĭrat‘iants OV. The thymo-lymphatic system in congenital thymomegaly (clinico-morphological study). Arkh Patol 1988; 50 (4): 17–25.
37. Tertychnyĭ AS, Talalaev AG, Zaĭrat‘iants OV. Syndrome of enlarged thymus gland in children with congenital heart defects. Arkh Patol 2001; 63 (2): 39–43.
38. Jacobs MT, Frush DP, Donelly LF. The right place at the wrong time: historical perspective of the relation of the thymus gland and pediatric radiology. Radiology 1999; 210 : 11–16.
39. Nishino M, Ashiku SK, Kocher ON, Thurer RL, Boiselle PM, Hatabu H. The thymus: a comprehensive review. RadioGraphics 2006; 26 : 335–348.
40. Choyke PL, Zeman RK, Gootenberg JE, et al. Thymic atrophy and regrowth in response to chemotherapy: CT evaluation. Am J Roentgenol 1987; 149 (2): 269–272.
41. Yarom N, Zissin R, Apter S, et al. Rebound thymic enlargement on CT in adults. Int J Clin Pract 2007; 61 (4): 562–568.
42. Scheinpflug K, Schmitt J, Jentsch-Ullrich K, et al. Thymic hyperplasia following successful treatment for nodular-sclerosing Hodgkin‘s disease. Leuk -Lymphoma 2003; 44 (9): 1615–1617.
43. Federative International Programme on Anatomical Terminology. Terminologia Embryologica: International Anatomical Terminology. Thieme, 2013 : 1–312. ISBN-10 : 3131701412.
44. Anastasiadis K, Ratnatunga C (eds). The thymus gland. Diagnosis and surgical treatment. Berlin: Springer--Verlag, 2007 : 1–112. ISBN 978-3-540-33425-5.
45. Jaretzki A 3rd. Thymectomy for myasthenia gravis; analysis of controversies regarding technique and results. Neurology 1997; 48 (Suppl 5): S52–S63.
46. Durmaz E, Barsal E, Parlak M, et al. Intrathyroidal ectopic thymic tissue may mimic thyroid cancer: a case report. J Pediatr Endocrinol Metab 2012; 25 (9–10): 997–1000.
47. Sapthavee A, Kulbersh B, Maddalozzo J, Bogard A. Pathology quiz case 1: ectopic intrathyroidal thymic tissue. JAMA Otolaryngol Head Neck Surg 2013; 139 (1): 87–88.
48. Kim HG, Kim MJ, Lee MJ. Sonographic appearance of intrathyroid ectopic thymus in children. J Clin Ultrasound 2012; 40 (5): 266–271.
49. Yerly S, Lobrinus JA, Bongiovanni M, et al. A carcinoma showing thymus-like elements of the thyroid arising in close association with solid cell nests: evidence for a precursor lesion? Thyroid 2013; 23 (4): 511–516.
50. Roka S, Kornek G, Schüller J, et al. Carcinoma showing thymic-like elements - a rare malignancy of the thyroid gland. Br J Surg 2004; 91 (2): 142–145.
51. Nolder AR, Agarwal A, Howard E, Richter GT. Ectopic thymus presenting as a retropharyngeal mass: surgical approach. Ear Nose Throat J 2013; 92 (1): 41–43.
52. Park JJ, Kim JW, Kim JP, et al. Two cases of ectopic cervical thymus: case reports and a review of the literature. Auris Nasus Larynx 2006; 33 (1): 101–105.
53. Saggese D, Ceroni Compadretti G, Cartaroni C. Cervical ectopic thymus: a case report and review of the literature. Int J Pediatr Otorhinolaryngol 2002; 66 : 77–80.
54. Mizia-Malarz A, Sobol G, Maldyk J, et al. Cervical ectopic thymus in a 9-month-old girl: diagnostic difficulties. J Pediatr Hematol Oncol 2009; 31 (8): 599–601.
55. Bistritzer T, Tamir A, Oland J, et al. Severe dyspnea and dysphagia resulting from an aberrant cervical thymus. Eur J Pediatr 1985; 144 : 86–87.
56. Felgentreff K, Schupp W, Otten JE, et al. Inspiratory stridor and dysphagia in two newborn infants caused by ectopic thymus tissue. Eur J Pediatr 2009; 168 (9): 1141–1145.
57. Shah SS, Lai SY, Ruchelli E, et al. Retropharyngeal aberrant thymus. Pediatrics 2001; 108 : 94–97.
58. Prasad TRS, Chui CH, Ong CL, Meenakshi A. Cervical ectopic thymus in an infant. Singapore Med J 2006; 47 : 68–70.
59. Conwell LS, Batch JA. Aberrant cervical thymus mimicking a cervical mass. J Paediatr Child Health 2004; 40 : 579–580.
60. Pai I, Hegde V, Wilson PO, et al. Ectopic thymus presenting as a subglottic mass: diagnostic and management dilemmas. Int J Pediatr Otorhinolaryngol 2005; 69 (4): 573–576.
61. Jiang L, Sun B, Zheng Y, Du L. Posterior mediastinal thymus: case report and literature review. Iran J Pediatr 2011; 21 (3): 404–408.
62. Cigliano B, Baltogiannis N, De Marco M, et al. Cervical thymic cysts. Pediatr Surg Int 2007; 23 (12): 1219–1225.
63. Meyer E, Mulwafu W, Fagan JJ, et al. Ectopic thymic tissue presenting as a neck mass in children: a report of 3 cases. Ear Nose Throat J 2010; 89 (5): 228–231.
64. Saad AH, Zapata A. Reptilian thymus gland: an ultrastructural overview. Thymus 1992; 20 (3): 135–152.
65. Bigaj J, Plytycz B. Cytoarchitecture of the thymus gland of the adult frog (Rana temporaria). Folia Histochem Cytobiol 1984; 22 (1): 63–69.
66. Ors U, Dagdeviren A, Kaymaz FF, Muftuoglu SF. Cysts in human thymus: maturational forms of Hassal´s corpuscles? Okajimas Folia Anat Jpn 1999; 76 : 61–69.
67. Burton EM, Mercado-Deane MG, Howell CG, et al. Cervical thymic cysts: CT appearance of two cases including a persistent thymopharyngeal duct cyst. Pediatr Radiol 1995; 25 : 363–365.
68. Zarbo RJ, McClatchey KD, Areen RG, Baker SB. Thymopharyngeal duct cyst: a form of cervical thymus. Ann Otol Rhinol Laryngol 1983; 92 : 284–289.
69. Kaufman MR, Smith S, Rothschild MA, Som P. Thymopharyngeal duct cyst: an unusual variant of cervical thymic anomalies. Arch Otolaryngol Head Neck Surg 2001; 127 : 1357–1360.
70. Noussios G, Anagnostis P, Natsis K. Ectopic parathyroid glands and their anatomical, clinical and surgical implications. Exp Clin Endocrinol Diabetes 2012; 20 (10): 604–610.
71. Hojaij F, Vanderlei F, Plopper C, et al. Parathyroid gland anatomical distribution and relation to anthropometric and demographic parameters: a cadaveric study. Anat Sci Int 2011; 86 (4): 204–212.
72. Yamashita H, Murakami N, Noguchi S, et al. Cervical thymoma and incidence of cervical thymus. Acta Pathol Jpn 1983; 33 (1): 189–194.
73. Tabatabaie SA, Hashemi SM, Sanei B, Sanei MH. The frequency of ectopic thymic tissue in the necks of patients without any thymic disease. Med Sci Monit 2007; 13 (6): CR283–285.
74. Jaretzki A 3rd, Wolff M. „Maximal“ thymectomy for myasthenia gravis. Surgical anatomy and operative technique. J Thorac Cardiovasc Surg 1988; 96 (5): 711–716.
75. Ashour M. Prevalence of ectopic thymic tissue in myasthenia gravis and its clinical significance. J Thorac Cardiovasc Surg 1995; 109 (4): 632–635.
76. Fukai I, Funato Y, Mizuno T, et al. Distribution of thymic tissue in the mediastinal adipose tissue. J Thorac Cardiovasc Surg 1991; 101 (6):1099–1102.
77. Zieliński M, Kuzdzal J, Szlubowski A, Soja J. Comparison of late results of basic transsternal and extended transsternal thymectomies in the treatment of myasthenia gravis. Ann Thorac Surg 2004; 78 : 253–258.
78. De Foer B, Vercruysse JP, Mariën P, et al. Cervical ectopic thymus presenting as a painless neck mass in a child. JBR-BTR 2007; 90 (4): 281–283.
79. Clark JJ, Johnson SM. Solid cervical ectopic thymus in an infant. J Pediatr Surg 2009; 44 (7): e19–21.
80. Wang J, Fu H, Yang H, et al. Clinical management of cervical ectopic thymus in children. J Pediatr Surg 2011; 46 (8): e33–36.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek Opožděné dospívání u chlapce
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2014 Číslo 3- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Monitorovanie diagnostiky a epidemiológia RSV infekcií na Slovensku
- Výskyt anemie a význam měření hladiny hepcidinu metodou ELISA u dětí s nespecifickými střevními záněty
- Nemoc ze střádání esterů cholesterolu (CESD): klinická, laboratorní a histologická charakteristika šesti pacientů
-
Za doc. MUDr. Evou Pařízkovou, CSc.
29. 3. 1942 – 27. 6. 2014 - 70 let methotrexátu v léčbě autoimunitních a nádorových onemocnění
- Asymptomatická hyperurikémia pri hypertenzii u mladistvých
- Prehľad a návrh klasifikácie vrodených anomálií týmusu u detí
- Předčasný vývoj genitálu u chlapce
- Opožděné dospívání u chlapce
- Gynekomastie (zduření prsní žlázy u chlapce)
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Gynekomastie (zduření prsní žlázy u chlapce)
- Opožděné dospívání u chlapce
- Prehľad a návrh klasifikácie vrodených anomálií týmusu u detí
- 70 let methotrexátu v léčbě autoimunitních a nádorových onemocnění
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



