-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Imunoglukan P4H® v prevencii recidivujúcich infekcií dýchacích ciest v detskom veku
Imunoglukan P4H® in the Prevention of Recurrent Respiratory Infections in Childhood
Background:
Respiratory diseases are among the most common ailments in paediatric clinical practice. Children often present with recurrent upper or lower respiratory tract infections. Beta-glucans are potent natural immunomodulators that have been proven effective in multiple studies for the treatment and prevention of various conditions caused by disturbances in the immune system.Aim:
The aim of our open clinical trial was the evaluation of the effect of Imunoglukan P4H® syrup on the frequency and some selected characteristics of recurrent respiratory infections in childhood.Patients and methods:
Our study group consisted of 215 children (mean age 4.7±1.9 years) selected by 28 paediatricians from the Slovak and Czech Republics. The enrolment criterion was at least 5 infections of the upper airways in the last year. The paediatricians filled out the case report form for each study subject, providing baseline and end-of-study data. Patients took Imunoglukan P4H® syrup at the standard once-daily dose of 1 mL/5 kg body weight for at least 3 months.Results:
A positive response to the Imunoglukan P4H® syrup, i.e. a ≥50% reduction of the frequency of recurrent respiratory infections, was observed in 153 children (71.2%). The average annual incidence of respiratory infections in children with a positive response to Imunoglukan P4H® therapy was 3.6 and was significantly lower compared to that in unresponsive patients (3.6 vs. 8.9, p<0.001). The therapy did not show statistically significant effect on the frequency of febrile episodes, need for antibiotics or duration of infection. No adverse effects of Imunoglukan P4H® syrup were reported, with the therapy being very well tolerated.Conclusions:
The results of our open clinical trial proved the therapeutic and preventive effects of Imunoglukan P4H® syrup on the frequency of recurrent respiratory infections in childhood. Its potent, targeted and broad immunomodulatory effect involving various immune pathways and its safety make Imunoglukan P4H® syrup suitable for use in many indications in childhood.Key words:
children, Imunoglukan P4H®, immunomodulation, prevention, recurrent respiratory infections
Autoři: M. Jeseňák 1
; L. Sanislo 2; R. Kuniaková 3; Z. Rennerová 4; J. Buchanec 1; Peter Bánovčin 1
Působiště autorů: Klinika detí a dorastu, Centrum experimentálnej a klinickej respirológie, Univerzita Komenského ; Jesseniova lekárska fakulta v Martine, Univerzitná nemocnica Martin prednosta prof. MUDr. P. Bánovčin, CSc. 1; Onkologický ústav sv. Alžbety, s. r. o., Bratislava prednosta doc. MUDr. J. Kaušitz, CSc. 2; Pleuran, s. r. o., Bratislava riaditeľ JUDr. J. Gabriž 3; Pneumo-Alergo Centrum, n. z. z., Bratislava prednosta doc. MUDr. M. Brezina, CSc. 4
Vyšlo v časopise: Čes-slov Pediat 2010; 65 (11): 639-647.
Kategorie: Původní práce
Souhrn
Úvod:
Respiračné ochorenia patria medzi najčastejšie v klinickej praxi každého pediatra. Veľmi často sa u detí stretávame s recidivujúcimi ochoreniami horných alebo dolných dýchacích ciest. Glukány sú efektívne imunomodulátory prírodného pôvodu, ktorých účinok v liečbe a prevencii viacerých chorobných stavov vznikajúcich najmä na podklade porúch v imunitnom systéme bol potvrdený v mnohých štúdiách.Cieľ:
Cieľom našej otvorenej štúdie bolo vyhodnotiť efekt sirupu Imunoglukan P4H® na frekvenciu a niektoré vybrané charakteristiky recidivujúcich infekcií dýchacích ciest v detskom veku.Pacienti a metódy:
Našu študovanú populáciu tvorilo 215 detských pacientov (vek 4,7 ± 1,9 roka) z 28 ambulancií praktických lekárov pre deti a dorast na Slovensku a v Českej republike. Podmienkou pre zaradenie bolo prekonanie minimálne 5 infekcií horných ciest dýchacích v ostatnom roku. Každý pediater vyplnil pri každom pacientovi vstupný protokol na začiatku a na konci sledovania. Deti následne užívali Imunoglukan P4H® sirup v dĺžke minimálne 3 mesiace v štandardnej dávke 1 ml sirupu/5 kg hmotnosti v jednej dennej dávke.Výsledky:
Pozitívnu odpoveď na užívanie sirupu Imunoglukan P4H®, za ktorú sme považovali následný pokles početnosti respiračných infekcií o minimálne 50 %, sme zaznamenali u 153 detí (71,2 %). Priemerný počet infekcií horných ciest dýchacích v priebehu roka u detí s pozitívnou odpoveďou na preparát bol 3,6 infekcií/rok, čo bolo štatisticky signifikantne nižšie ako u detí bez terapeutickej odpovede (3,6/rok vs. 8,9/rok, p <0,001). Podávanie preparátu nemalo štatisticky významný vplyv na výskyt febrilných reakcií, počet antibiotických kúr či trvanie infekcií. Nezaznamenali sme žiadne nežiaduce účinky a liečba bola výborne tolerovaná.Závery:
Výsledky našej otvorenej štúdie dokázali liečebný a preventívny účinok sirupu Imunoglukan P4H® na frekvenciu recidivujúcich infekcií dýchacích ciest v detskom veku. Jeho potentný, cielený a široký imunomodulačný účinok na úrovni mnohých imunitných ciest a bezpečnosť liečby predurčuje použitie sirupu Imunoglukan P4H® v mnohých indikáciách v detskom veku.Kľúčové slová:
dieťa, Imunoglukan P4H®, imunomodulácia, prevencia, recidivujúce infekcie dýchacích ciestÚvod
Respiračné ochorenia patria medzi najčastejšie v klinickej praxi každého pediatra. Veľkú časť tvoria tie, na ktorých vzniku, pretrvávaní, exacerbáciách či recidívach sa priamo či nepriamo podieľajú rôzne dysregulácie v imunitnom systéme (IS) dieťaťa. Akútne infekcie respiračného traktu sú najčastejšou a najdôležitejšou príčinou morbidity v detskom veku. Predstavujú podstatnú príčinu návštevy praktického lekára vo všetkých vekových kategóriách, a to obzvlášť vo veku detskom, kedy sa často stretávame s recidivujúcimi ochoreniami dýchacích ciest (RIDC). Prevažujú najmä opakované infekcie horných ciest dýchacích a asi u 10–30 % detí pozorujeme aj postihnutie dolných ciest dýchacích [1]. Recidivujúce infekcie dýchacích ciest možno definovať na základe viacerých aspektov ako infekčné ochorenia dýchacích ciest, pri ktorých sme vylúčili iné vážnejšie príčiny (cystická fibróza, primárne poruchy imunity, vrodené ciliárne dyskinézy, vrodené malformácie dýchacích ciest) a spĺňajú aspoň jedno z nasledujúcich kritérií [2]:
- 6 a viac ochorení za rok spojených s infekciou dýchacích ciest,
- 1 a viac respiračných infekcií za mesiac v čase od októbra do februára,
- 3 a viac infekcií dolných dýchacích ciest za rok.
Práve v detskom veku predstavujú opakované infekcie dýchacích ciest problém, s ktorým sa každý pediater musí vedieť adekvátne vysporiadať. Udáva sa, že 6–10 % detí pred dovŕšením 6. roku života trpí na RIDC, pričom rozoznávame dva hlavné vrcholy ich výskytu: vek 6–12 mesiacov a vek v čase zaradenia dieťaťa do detského kolektívu. Ak sú infekcie vážnejšie, môžu u malej časti pacientov signalizovať závažnú primárnu či sekundárnu imunodeficienciu, a preto je nevyhnutné zaujať správny diagnostický i terapeutický prístup v manažmente takto chorých detí [3,4]. Nemenej dôležité je však aj zadefinovať, čo znamená pojem recidivujúce infekcie dýchacích ciest, keďže pohľad rodiča a pohľad lekára sa môžu výrazne líšiť. Pri posudzovaní RIDC je okrem ich samotnej frekvencie oveľa dôležitejší ich priebeh, trvanie, odpoveď na konvenčnú liečbu, kultivačný nález kauzálneho patogénu ako aj vznik komplikácií. Zároveň treba brať do úvahy aj tzv. „fyziologickú“ chorobnosť dieťaťa, za ktorú považujeme [4–7]:
- u mladších detí (3.–5. rok): 6–8 (10) epizód infekcií dýchacích ciest s ľahším priebehom, dobrou odpoveďou na liečbu v priebehu jesenných a zimných mesiacov,
- u starších detí (6.–12. rok): 2–4 epizódy infekcií dýchacích ciest s ľahším priebehom a dobrou odpoveďou na liečbu v priebehu jesenných a zimných mesiacov.
V súčasnosti máme k dispozícii viacero dostupných liekov a účinných látok určených na liečbu a prevenciu RIDC. S cieľom predchádzať vzniku RIDC boli postupne realizované mnohé štúdie, počas ktorých boli deťom podávané vitamínové prípravky (najmä s obsahom vitamínu C a E), stopové prvky (najmä selén a zinok), preventívne podávanie antibiotík, intranazálnych alebo celkových imunoglobulínov, ako aj mnohých prírodných či syntetických prípravkov s imunomodulačným účinkom (fytopreparáty, baktériové imunomodulátory, prebiotiká, probiotiká). Dôležité je aj zdôrazniť, že rôzne (a dnes široko predpisované) imunomodulanciá, ktoré sú aplikované s cieľom reštituovať chybnú časť IS a zabezpečiť účinnú ochranu organizmu pred recidívami, ak sú indikované a aplikované v nesprávnych indikáciách, môžu spôsobiť viac škody ako úžitku [8–11].
Funkcie imunitného systému možno ovplyvniť dvomi smermi, a to buď stimulovať (→ imunostimulanciá), alebo potlačiť (→ imunosupresíva). Vzhľadom na to, že v mnohých prípadoch nie je možné vymedziť ostrú hranicu medzi týmito terapeutickými postupmi, je vhodnejšie a správnejšie hovoriť o imunomodulanciách, čiže o liekoch či prípravkoch, ktoré ovplyvňujú rôzne zložky IS. Jeden prípravok môže totiž napr. popri supresii jednej zložky imunity priamo či nepriamo stimulovať inú časť IS.
Imunomoduláciu možno teda definovať ako terapeutické či preventívne zásahy do činnosti IS s cieľom ich ovplyvnenia v prospech homeostázy organizmu. Vzhľadom na komplexnosť siete reakcií imunitného systému je zrejmé, že tieto terapeutické zásahy sú mnohokrát nie jednoznačne indikované a priaznivé, keďže môžu byť sprevádzané alebo nasledované inou neočakávanou alebo dokonca nežiaducou reakciou. Najmä pre zložitosť siete imunitných reakcií, postupnú maturáciu imunitného systému a komplexnosť terapeutických zásahov do imunitného systému by mala byť imunomodulačná liečba v detskom veku aplikovaná len v indikovaných prípadoch spolu s adekvátnym sledovaním klinického stavu a laboratórnych parametrov imunity u takto liečených detských pacientov [7, 12, 13].
Imunomodulačnú liečbu RIDC možno schematicky rozdeliť na lokálnu a systémovú (celkovú). Ide o preparáty nešpecifickej imunomodulácie, ktoré sú určené najmä na úpravu sekundárnych (získaných) porúch imunity. V prípade vrodených porúch majú tieto prípravky len obmedzenú alebo žiadnu účinnosť a možno ich použiť len u miernejších foriem porúch s cieľom stimulovať zostávajúce nepoškodené časti imunitného systému. Ide v zásade o prípravky syntetické (napr. methisoprinol), produkty imunitného systému získané purifikáciou alebo rekombinantnými metodikami (transfer faktor, týmové hormóny a iné), baktériové imunomodulátory alebo iné účinné látky na prírodnej báze (napr. glukány, vitamíny, stopové prvky, systémová enzýmoterapia, Echinacea species a iné) (schéma 1) [7, 13–17].
Schéma 1. Možnosti imunomodulácie pri recidivujúcich infekciách dýchacích ciest v detskom veku. 
Glukány (biologicky aktívne polysacharidy) sú efektívne imunomodulátory prirodzene sa vyskytujúce najmä v hubách. Objav tejto skupiny aktívnych látok na prírodnej báze s minimom nežiaducich vedľajších účinkov použiteľných aj v detskom veku je z pohľadu súčasnej medicíny veľmi dôležitý. V mnohých klinických ako aj experimentálnych štúdiách bola opakovane dokázaná účinnosť prípravkov na báze týchto látok v liečbe a prevencii viacerých chorobných stavov vznikajúcich najmä na podklade získaných porúch v imunitnom systéme [18–21].
Cieľom našej otvorenej štúdie bolo vyhodnotiť efekt prípravku Imunoglukan P4H® sirup obsahujúceho prírodný imunoglukan na frekvenciu a niektoré vybrané charakteristiky recidivujúcich infekcií dýchacích ciest v detskom veku.
Pacienti a metódy
Našu študovanú populáciu tvorilo celkovo 215 detských pacientov (priemerný vek 4,7 ± 1,9 rokov). Z pôvodných 243 detí sme pre nesplnenie všetkých vstupných podmienok museli vylúčiť 26 pacientov a dve deti boli vyradené v priebehu štúdie pre odmietanie sirupu z chuťových dôvodov. Študovaná populácia detí pozostávala z pacientov z 28 ambulancií praktických lekárov pre deti a dorast (18 zo Slovenska a 10 z Českej republiky), ktorí sa zapojili do štúdie. Podmienkou pre zaradenie bolo prekonanie minimálne 5 infekcií horných ciest dýchacích v priebehu ostatného roka, pričom jeden a viac infekcií bolo v čase od októbra do februára, čím bola splnená druhá podmienka definujúca RIDC uvedená v úvode článku. Každý pediater vyplnil pri každom pacientovi dotazník obsahujúci jeho anagrafické údaje, počet infekcií v predchádzajúcom roku a v priebehu roka, v ktorom bolo dieťa zaradené do štúdie, dĺžku trvania infekcií, prítomnosť sprievodnej febrilnej reakcie, nutnosť antibiotickej liečby, zhodnotenie priebehu danej infekčnej epizódy, dĺžku užívania sirupu Imunoglukan P4H® ako aj zhodnotenie tolerancie liečby a výskyt nežiaducich účinkov. Súčasťou dotazníka boli aj základné údaje z osobnej, rodinnej, epidemiologickej a alergiologickej anamnézy. Pacienti následne užívali Imunoglukan P4H® sirup v dĺžke minimálne 3 mesiace v štandardnej dávke 1 ml sirupu/5 kg hmotnosti v jednej dennej dávke. V priebehu sledovania pacienti neužívali inú imunomodulačnú liečbu, ale mohli užívať iné lieky ako antibiotiká, analgetiká, antipyretiká či vitamíny. U každého dieťaťa bol získaný informovaný súhlas pre zaradenie dieťaťa do štúdie.
Výsledky sme analyzovali pomocou štatistických programov SPSS (verzia 9.0, Inc. Chicago, IL, USA) a Primer (verzia 1.0, McGraw-Hill Libri s.r.l., Taliansko). Jednotlivé hodnoty sme porovnali pomocou párového a nepárového Študentovho t-testu a chí-kvadratického testu (χ2). Hodnoty p ≤0,05 vyjadrili štatisticky významný rozdiel medzi porovnávanými hodnotami.
Výsledky
V skupine 215 detských pacientov sme sledovali účinok sirupu Imunoglukan P4H® na frekvenciu a niektoré vybrané charakteristiky recidivujúcich infekcií dýchacích ciest. Priemerný vek detí bol 4,7 ± 1,9 roka (prevažne zastúpené deti medzi 3.–7. rokom života). Priemerná frekvencia prekonaných RIDC študovanej populácie bola 5,25 infekcií/rok. Priemerná dĺžka užívania sirupu Imunoglukan P4H® bola 6,8 mesiaca, pričom prevažná väčšina zo súboru začala prípravok užívať v jesenných mesiacoch. U detí, ktoré užívali prípravok dlhšie, sme pozorovali výraznejší pokles početnosti respiračných infekcií, hoci tento rozdiel nedosiahol štatistickú významnosť v porovnaní s deťmi, ktoré užívali sirup kratšie (avšak minimálne 3 mesiace). V celom súbore sme nezaznamenali žiadny nežiaduci účinok prípravku, ktorý bol výborne tolerovaný (s výnimkou dvoch detí, ktoré odmietli užívať sirup z chuťových dôvodov a boli zo štúdie vyradené).
Ako pozitívnu odpoveď na užívanie prípravku sme hodnotili zníženie frekvencie RIDC o viac ako 50 %. Po dlhodobom užívaní sirupu Imunoglukan P4H® (priemerne 6,8 mesiaca) sme zaznamenali pozitívnu odpoveď u 71,2 % detí (153/215), pričom u zvyšku detí sa frekvencia RIDC nezmenila alebo ľahko zvýšila (graf 1). Priemerná dĺžka užívania sirupu v skupine detí s pozitívnou odpoveďou na liečbu sa nelíšila od dĺžky užívania v skupine bez pozitívnej terapeutickej odpovede. U detí s pozitívnou odpoveďou na preparát bol v priebehu roka priemerný počet infekcií horných ciest dýchacích 3,6 infekcií/rok, čo bolo štatisticky signifikantne nižšie ako u detí bez terapeutickej odpovede na užívanie sirupu (3,6 infekcií/rok vs. 8,9 infekcií/rok, p <0,001) (graf 2). U detí s pozitívnou odpoveďou na liečbu došlo k poklesu početnosti infektov o 32 % oproti priemeru, u detí bez odpovede na Imunoglukan P4H® sa frekvencia infekcií nezmenila, prípadne nesignifikantne stúpla oproti pôvodnému výskytu. Obe skupiny detí sa navzájom nelíšili priemernou dĺžkou užívania sirupu.
Graf 1. Rozdelenie detí v študovanom súbore na základe odpovede na užívanie sirupu Imunoglukan P4H<sup>®</sup>. Ako pozitívna odpoveď bol hodnotený pokles počtu infekcií horných ciest dýchacích v priebehu roka o viac ako 50 %. 
Graf 2. Porovnanie frekvencie respiračných infekcií u detí s odpoveďou a bez odpovede na podávanie sirupu Imunoglukan P4H<sup>®</sup>. 
Priemerná dĺžka trvania epizódy infekcie dýchacích ciest u pacientov s pozitívnou odpoveďou na Imunoglukan P4H® bola 7,2 dňa, čo bolo kratšie ako u detí bez odpovede na preparát, ale tento pozorovaný rozdiel nebol štatisticky významný (7,2 dňa vs. 8,2 dňa, p = n.s.). U 48,5 % detí boli respiračné infekcie sprevádzané teplotou, pričom u detí s pozitívnou odpoveďou na preparát sme pozorovali sprievodnú febrilnú reakciu zriedkavejšie oproti deťom bez terapeutickej odpovede, hoci tento rozdiel nedosiahol štatistickú významnosť (45,2 % vs. 51,8 %, p = n.s.). Obe skupiny detí sa nelíšili v počte antibiotických kúr respiračných infekcií.
Diskusia
V našej štúdii sme sledovali vplyv užívania sirupu Imunoglukan P4H® na frekvenciu a iné charakteristiky infekcií dýchacích ciest u detí s opakovanými infekciami dýchacích ciest. Ide o jednu z prvých štúdií hodnotiacu efekt prípravku s obsahom biologicky aktívneho polysacharidu (glukánu) na RIDC u detí. Zaznamenali sme štatisticky významný pokles počtu infekcií u viac ako 70 % sledovaných detí. Liečba mala vplyv aj na dĺžku trvania infektov a výskyt sprievodných febrilných reakcií, ale tento rozdiel nedosiahol štatistickú významnosť. Nezaznamenali sme žiadne nežiaduce účinky liečby, pričom u dvoch detí bola liečba prerušená pre odmietanie sirupu dieťaťom z chuťových dôvodov.
Metabolity a zložky húb sa používajú v medicíne už po mnohé stáročia s cieľom využitia vlastností viacerých ich aktívnych zlúčenín. Mnohé z týchto látok prirodzene obsiahnutých v hubách majú dokázateľný vplyv na jednotlivé zložky imunitného systému, pričom medzi najdôležitejšie skupiny týchto imunomodulačných látok patria: polysacharidy (obzvlášť glukány), polysacharidopeptidy, polysacharidové proteíny a proteíny. Okrem nich boli izolované aj ďalšie zložky húb s biologickým účinkom, ako napr. triterpény, fenoly alebo rôzne lipidy. Hlavným mechanizmom je mitogénny a aktivačný vplyv na jednotlivé populácie imunokompetentných buniek ako napr. hemopoetické kmeňové bunky, lymfocyty, makrofágy, NK-bunky s následnou produkciou rôznych cytokínov. Práve preto sa v mnohých klinických aj experimentálnych štúdiách skúmal efekt týchto látok na prevenciu a liečbu onkologických ochorení, vrodených aj získaných porúch imunity, autoimúnnych či alergických ochorení [22]. Glukány sa v prírode vyskytujú ako typická stavebná zložka bunkových stien húb. Tvoria veľkú skupinu prírodných látok s imunomodulačným účinkom, z ktorých mnohé majú dobre opísanú štruktúru a známy mechanizmus účinku. Ide o homopolyméry glukózy buď s lineárnou molekulou obsahujúcou (1-3)-β-D-glykozidové väzby alebo s rozvetvenou štruktúrou s postrannými reťazcami viazanými typickou (1-6)-β-D-glykozidovou väzbou. Jednotlivé preparáty sa líšia intenzitou imunomodulačného účinku, pričom za najúčinnejší sa považuje imunoglukan (pleuran) získaný z Pleurotus ostreatus [19, 23, 24]. Treba zdôrazniť, že imunostimulačný účinok možno pozorovať až po purifikácii účinnej látky a odstránení balastných látok. Počas výrobného procesu dochádza k aktivácii a uvoľneniu imunoglukanu z bunkových stien huby, pričom platí priama závislosť medzi stupňom purifikácie a imunostimulačným účinkom [25].
Z pediatrického hľadiska je z tejto skupiny prírodných liečiv najvýznamnejším prípravok Imunoglukan P4H® dostupný vo forme sirupu a kapsúl (obe formy obsahujú aj vitamín C), ako aj v podobe krému. Účinnou látkou je imunoglukan, ktorý pôsobí na imunitný systém na mnohých úrovniach, pričom efektívne ovplyvňuje tak zložky nešpecifickej ako aj špecifickej imunity. Receptory pre glukány boli nájdené na mnohých imunokompetentných bunkách ako aj na bunkách, ktoré nepatria medzi typické zložky imunitného systému: neutrofilné a eozinofilné leukocyty, NK-bunky, monocyty, makrofágy, endoteliálne bunky, keratinocyty, fibroblasty, alveolárne epitelové bunky, mikrogliálne bunky a iné [26, 27]. Spomedzi všetkých receptorov pre glukány (dektín-1, toll-like receptory, komplementový receptor 3, tzv. scavenger-receptory, laktozylceramid a iné) je potrebné vyzdvihnúť dektín-1, ktorý predstavuje primárny receptor pre glukány minimálne na povrchu leukocytov a hrá centrálnu rolu v imunomodulácii [22, 26, 28–30].
Beta-glukány pôsobia na imunitný systém na mnohých úrovniach, pričom spomedzi všetkých známych mechanizmov treba zdôrazniť najmä [20, 28–40] (schéma 2):
Schéma 2. Mechanizmy pôsobenia imunoglukanu na imunitný systém. 
- ↑ metabolickú a funkčnú aktivitu imunokompetentných buniek (špecifická aj nešpecifická imunita),
- ↑ proliferáciu a diferenciáciu T - aj B-lymfocytov,
- ↑ aktivitu T-cytotoxických lymfocytov a NK-buniek → antikancerogénny účinok (terapeutický aj preventívny),
- ↑ obsah sekrečných IgA protilátok v slinách → ↑ lokálnu obranyschopnosť slizníc,
- ↑ fagocytózu → ↑ efektivitu imunitnej odpovede na endogénne aj exogénne podnety,
- ↑ baktericídnu aktivitu monocytov aj neutrofilov,
- ↑ alternatívnou ako aj klasickou cestou aktivujú komplementovú kaskádu s následným vznikom mnohých zlúčenín s priamym alebo nepriamym imunomodulačným účinkom,
- ↑ uvoľňovanie a aktivitu mnohých enzýmov (napr. lyzozým, elastáza, kolagenáza, syntáza oxidu dusnatého), zložiek komplementu, cytokínov (IL-1β, IL-10, IL-12, IL-18, TNF-α, IFN-γ, GM-CSF), iných signálnych molekúl (oxid dusnatý a iné nitrozlúčeniny) → proliferácia imunokompetentných buniek, ich migrácia, ↑ baktericídny a cytocídny účinok,
- vykazujú priamy aj nepriamy (cez IFN-γ z makrofágov) stimulačný účinok na NK-bunky → ↑ obranu proti intracelulárnym vírusovým, baktériovým alebo parazitárnym infekciám,
- modulujú hemopoetickú aktivitu kostnej drene → prostredníctvom granulocyty-makrofágy kolónie stimulujúceho faktora → ↑ proliferáciu kmeňových hemopoetických buniek kostnej drene,
- ↑ fenotypovú a funkčnú maturáciu dendritických buniek (DC), potencujú stimulačný efekt DC na proliferáciu T-lymfocytov a zvyšujú expresiu viacerých diferenciačných znakov na povrchu DC (napr. MHC I, MHC II, CD-86, CD-80, a iné) → zefektívnenie prezentácie cudzorodých antigénov,
- majú regulačný vplyv na diferenciáciu Th1/Th2 lymfocytov → ↑ Th1 imunitnej odpovede → ↑ IL-10, IL-2, IL-18 → zmiernenie príznakov alergických ochorení a prevencia rozvoja atopie,
- ↑ Th1 cytokínovú odpoveď pri súčasnom potlačení Th2 odpovede → perspektívne použitie jednak pri ochoreniach a stavoch s insuficientnou Th1 odpoveďou (napr. diabetes mellitus II. typu, starnutie), ako aj pri tých, kde dochádza k neprimeranej stimulácii Th2 odpovede (napr. alergické ochorenia),
- ↑ antioxidačný účinok → spomalenie procesov starnutia tkanív → rádioprotektívny účinok,
- prostredníctvom inhibície inducibilnej syntázy oxidu dusnatého, cyklooxygenázy, tvorby IL-1β a iných cytokínov → protizápalový účinok → liečba endotoxémie alebo sepsy.
Glukány pôsobia na mnohé populácie imunokompetentných buniek, avšak majú dokázateľný vplyv aj na bunky, ktoré nie sú súčasťou imunitného systému. Na základe rôznorodosti mechanizmov pôsobenia možno vyvodiť široké klinické uplatnenie tejto skupiny aktívnych látok. Medzi klinicky najdôležitejšie biologické účinky glukánov patrí účinok [19, 21, 23]:
- imunostimulačný/imunomodulačný (→ ovplyvnenie špecifickej aj nešpecifickej imunity),
- antiinfekčný (→ parazity, baktérie, vírusy, plesne),
- protinádorový/antikancerogénny (→ prevencia vzniku a diseminácie nádoru),
- antimutagénny/antigenotoxický (→ ochrana genetickej informácie),
- hemopoetický (→ potenciácia delenia krvných buniek),
- mitogénny (→ delenie buniek imunitného systému),
- regeneračný (→ prostredníctvom vplyvu na keratinocyty a fibroblasty),
- antitrombogénny/antikoagulačný (→ vplyv na koagulačný systém),
- protialergický (→ priaznivý vplyv na priebeh alergických ochorení),
- protizápalový (→ modulácia zápalovej odpovede organizmu),
- antioxidačný (→ zmiernenie ischemicko/reperfúzneho poškodenia),
- rádioprotektívny (→ zmiernenie účinkov radiačného žiarenia).
Práve na základe vymenovaných účinkov našli prípravky obsahujúce imunoglukan uplatnenie pri mnohých indikáciách (tab. 1). Imunoglukan P4H® možno použiť pri opakovanom podávaní antibiotík, recidivujúcich infekciách dýchacích ciest, sekundárnych imunodeficientných stavoch rôznej etiológie, pri zvýšenom psychickom či fyzickom strese, chemoterapii alebo rádioterapii (s cieľom znížiť ich nežiaduce účinky). Výsledky na animálnom modeli priniesli dôkaz, že podávanie tohto prípravku má adjuvantný účinok pri vakcinácii a potenciuje a urýchľuje tvorbu špecifických postvakcinačných protilátok [42]. Sirup je vhodný pre malé deti od 1. roku (1 ml/5 kg hmotnosti), kapsuly pre staršie deti od 3 rokov (obyčajne 1 cps denne). Z hľadiska užívania sú významné najmä „imunostimulačné“ kúry v trvaní cca 2–3 mesiace 1–2-krát počas roka. Ďalšou možnosťou je jeho krátkodobé podávanie pri akútnych infekciách počas 14 dní vo zvýšenej (dvojnásobnej) dávke, pričom pri týchto stavoch je jeho účinok skôr doplnkový, keďže samotné akútne infekčné ochorenie predstavuje samo o sebe významný imunostimulačný podnet. V prípade akútnych ochorení má význam aj vitamín C, ktorý sa v prípravku Imunoglukan P4H® nachádza.
Tab. 1. Možnosti využitia prípravkov Imunoglukan P4H<sup>®</sup> v pediatrii. 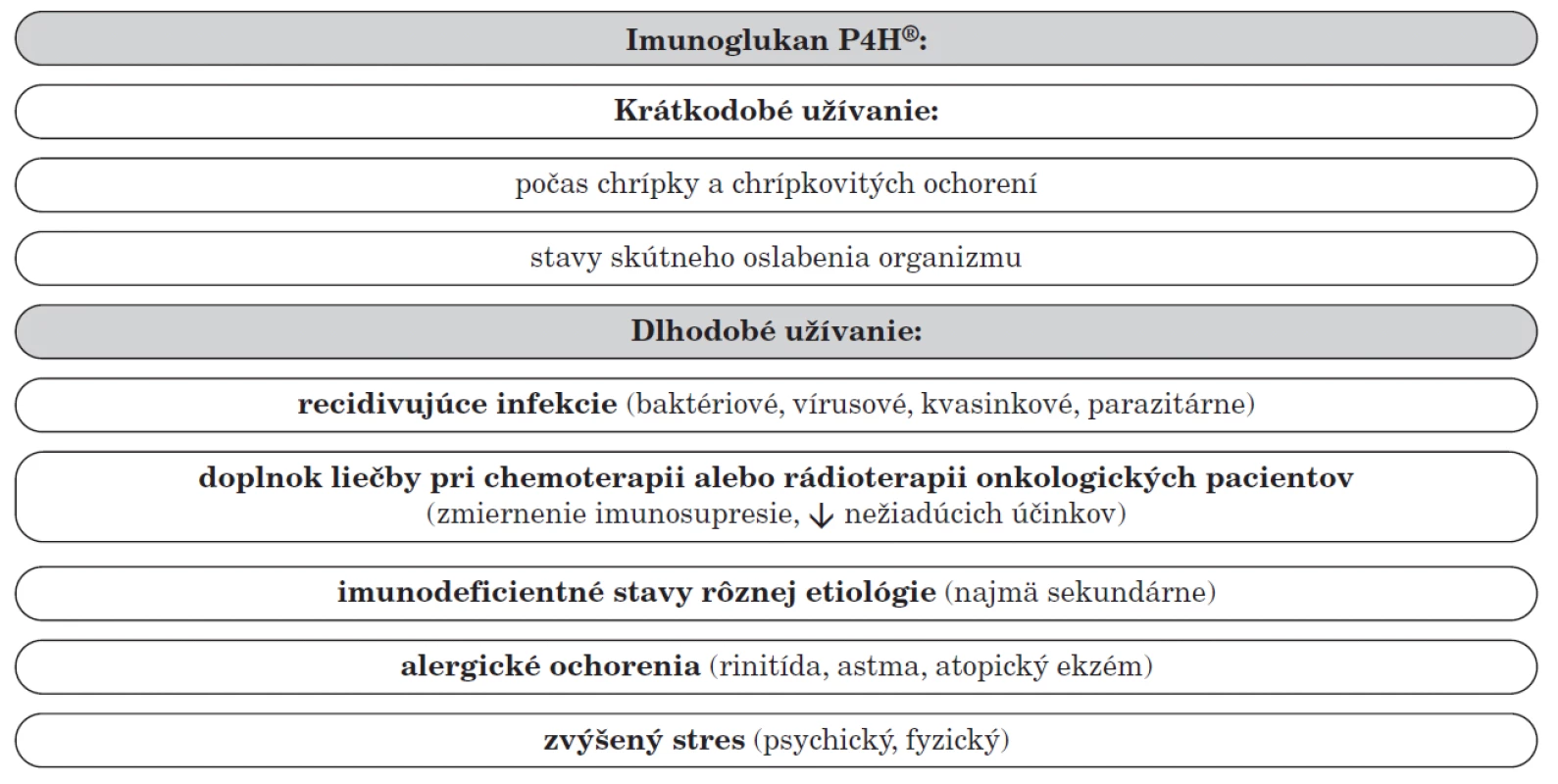
Imunoglukan P4H® obsahuje okrem prírodného glukánu aj vitamín C, ktorý vhodne synergicky dopĺňa imunomodulačné pôsobenie biologicky aktívneho polysacharidu. Vitamín C zvyšuje proliferáciu T-lymfocytov v podmienkach in vitro [43] a zvyšuje syntézu interferónu [44]. Podieľa sa na regulácii funkcie B - aj T-lymfocytov a stimuluje tvorbu antimikróbových molekúl počas respiračného vzplanutia makrofágov. Počas infekcie alebo akútneho zápalu sa spotreba vitamínu C zvyšuje, a preto je vhodný jeho zvýšený príjem najmä počas týchto stavov. Preventívny účinok samotného vitamínu C na vznik respiračných infekcií je slabý, ale dokázateľne skracuje trvanie už vzniknutej choroby. Na základe synergizmu s inými látkami (napr. zinok, glukány) sa môže podieľať tiež na liečbe akútnych, ako aj recidivujúcich respiračných infekcií [45]. Koncepcia našej štúdie neumožnila určiť podiel samotného vitamínu C popri glukáne na konečnej pozitívnej terapeutickej odpovedi na podávanie sirupu.
Dodnes neboli zistené žiadne vážnejšie vedľajšie nežiaduce účinky prípravkov Imunoglukan P4H® v porovnaní s placebom. Z kontraindikácií podávania prípravku treba spomenúť osoby s transplantovanými orgánmi alebo užívanie imunosupresívnej liečby.
Závery
Glukány sú efektívne imunomodulátory s mnohými potenciálnymi klinickými aplikáciami. Objav tejto skupiny aktívnych látok na prírodnej báze s minimom nežiaducich vedľajších účinkov použiteľných aj v detskom veku je z pohľadu súčasnej medicíny veľmi dôležitý. V mnohých klinických ako aj experimentálnych štúdiách bola opakovane dokázaná účinnosť týchto prípravkov v liečbe a prevencii viacerých chorobných stavov vznikajúcich najmä na podklade porúch v imunitnom systéme. V súčasnosti poznáme presné ciele ich pôsobenia v organizme ako aj mechanizmus ich účinku.
Indikačné kritériá pre ich aplikáciu sa rozširujú čoraz viac. Ide o skupinu prípravkov so širokým a potentným imunomodulačným účinkom na viaceré cesty imunitných reakcií, z čoho možno odvodiť široké spektrum možností ich klinického použitia tak u detí, ako aj v dospelom veku. Aj výsledky našej otvorenej štúdie dokázali liečebný a preventívny účinok sirupu Imunoglukan P4H® na frekvenciu recidivujúcich infekcií dýchacích ciest v detskom veku.
Poďakovanie: Autori štúdie ďakujú všetkým praktickým lekárom pre deti a dorast, ktorí sa aktívne zúčastnili tohto klinického pozorovania.
Zoznam skratiek:
DC – dendritické bunky
IS – imunitný systém
RIDC – recidivujúce infekcie dýchacích ciest
Došlo: 13. 5. 2010
Přijato: 18. 10. 2010
MUDr. Miloš Jeseňák, PhD., MBA
Centrum experimentálnej a klinickej respirológie
Klinika detí a dorastu UK JLF a UNM
Kollárova 2
036 59 Martin
Slovenská republika
e-mail: jesenak@gmail.com
Zdroje
1. Woroniecka M, Ballow M. Office evaluation of children with recurrent infection. Pediatr. Clin. North Am. 2000; 47 : 1211–1224.
2. De Martino M, Ballotti S. The child with recurrent respiratory infections: normal or not? Pediatr. Allergy Immunol. 2007; 18(Suppl. 18): 13–18.
3. Galli L, De martino M, Muccioli AT. Biological response modifiers in children with recurrent respiratory infections. J. Chemother. 1991; 3 : 196–202.
4. Couriel J. Assessment of the child with recurrent chest infections. Br. Med. Bul. 2002; 61 : 115–132.
5. De Vries E. Immunological investigations in children with recurrent respiratory infections. Pediatr. Res. Rev. 2001; 2 : 32–36.
6. Jeseňák M, Rennerová Z, Pohanka V, Bánovčin P. Prevencia recidivujúcich infekcií respiračného traktu u detí. 1. časť – Baktériové imunomodulátory. Pediatria (Bratisl.) 2009; 4 : 67–72.
7. Bystroň J. Imunomodulace u recidivujících infekcí dýchacích cest. Klin. Farmakol. Farm. 2005; 19 : 235–238.
8. Bousquet J, Olivieri D. Role of Ribomunyl® in the prevention of recurrent respiratory tract infections in adults: overview of clinical results. Treat. Respir. Med. 2006; 5 : 317–324.
9. Bystroň J. Perorální bakteriální imunomodulátory a medicína založená na důkazech. Alergie 2003; 5 : 284–290.
10. Hrubiško M. Imunomodulátory z baktérií – prirodzená podpora telu vlastných obranných mechanizmov. Ambulantná Terapia 2008; 2 : 3–6.
11. Steurer-Stey C, Lagler L, Straub DA, et al. Oral purified bacterial extracts in acute respiratory tract infections in childhood: a systematic quantitative review. Eur. J. Pediatr. 2007; 166 : 365–376.
12. Bartůňková J, Vernerová E. Postavení imunomodulátorů v léčbě respiračních a alergických onemocnění. Medicina po Promoci 2007; 8(Suppl. 1): 73–79.
13. Čáp P. Imunológia pre prax – význam imunomodulačnej terapie. Medinews 2008; 4 : 165–166.
14. Jeseňák M, Rennerová Z, Havlíčeková Z, et al. Prevencia recidivujúcich infekcií respiračného traktu u detí. 2. časť – Ostatné doplnkové farmakologické i nefarmakologické možnosti. Pediatria (Bratisl.) 2009; 4 : 167–173.
15. Honzíková M, et al. Systémová enzymoterapie v komplexní léčbě recidivujících zánětů dýchacích cest u dětí – postregistrační retrospektivní multicentrické hodnocení. Čes.-slov. Pediat. 2004; 54 : 513–521.
16. Slatter MA, Gennery AR. Clinical immunology review series: An approach to the patient with recurrent infections in childhood. Clin. Exp. Immunol. 2008; 152 : 389–396.
17. Wood P, Peckham D. Investigating recurrent respiratory infections in primary care. Br. Med. J. 2009; 339 : 1141–1143..
18. Bergendiová-Sedláčková K, Ferenčík M, Tibenská E, et al. Vplyv športovej záťaže na imunitný systém. Čes.-slov. Pediat. 2000; 7 : 442–447.
19. Jeseňák M, Rennerová Z, Bánovčin P. Možnosti použitia Imunoglukánu® v pediatrii. Pediatria (Bratisl.) 2009; 4 : 237–243.
20. Novak M, Vetvicka V. Beta-glucans, history, and the prezent: immunomodulatory aspects and mechanisms of action. J. Immunotoxicol. 2008; 5 : 47–57.
21. Sanisló Ľ. Imunoglukán. Revue Medicíny v Praxi 2009; 7 : 5–7.
22. Li C, Ha T, Kelley J, et al. Modulating Toll-like receptors mediated signalling by (1→3)-beta-D-glucan rapidly induces cardioprotection. Cardiovasc. Res. 2004; 61 : 538–547.
23. Dalmo RA, Bogwald J. β-glucans as conductor of immune symphonies. Fish Shellfish Immunol. 2008; 25 : 384–396.
24. Chen J, Seviour R. Medicinal importance of fungal β-(1→3), (1→6)-glucans. Myc. Res. 2007; 111 : 635–652.
25. Procházka Z, Végh V, Kuniaková R. Beta-glukán alebo hliva ustricovitá? Lekárnik 2008; 13 : 32.
26. Brown GD. Dectin-1: a signalling non-TLR pattern-recognition receptor. Nat. Rev. Immunol. 2006; 6 : 33–43.
27. Brown GD, Gordon S. Immune recognition of fungal β-glucans. Cell. Microbiol. 2005; 7 : 471–479.
28. Bobek P, Nosalova V, Cerna S. Effect of pleuran (beta-glucan from Pleuritis ostreatus) in diet or dribling fluid in colitis in rats. Nahrung 2001; 45 : 360–363.
29. Lull C, Wichers J, Savelkoul HF. Anti-inflammatory and immunomodulating properties of fungal metabolites. Mediators Inflam. 2005; 2 : 63–80.
30. Hong F, Yan J, Baran JT, et al. Mechanism by which orally administered beta-1,3-glucans enhance the tumoricidal activity of antitumor monoclonal antibodies in murine tumor models. J. Immunol. 2004; 173 : 797–806.
31. Jin M, Jung HJ, Choi JJ, et al. Activation of selective transcription factors and cytokines by water-soluble extract from Lentinus lepideus. Exp. Biol. Med. (Maywood) 2003; 228 : 749–758.
32. Kodama N, Komuta K, Sakai N, et al. Enhancement of cytotoxicity of NK cells by D-fraction, a polysaccharide from Grifola frondosa. Oncol. Rep. 2005; 13 : 497–502.
33. Lehne G, Haneberg B, Gaustad P, et al. Oral administration of a new soluble branched beta-1,3-D-glucan is well tolerated and can lead to increased salivary concentrations of immunoglobulin A in healthy volunteers. Clin. Exp. Immunol. 2006; 143 : 65–69.
34. Majtan J, Kumar P, Koller J, et al. Induction of metalloproteinase 9 secretion from human keratinocytes by pleuran (β-glucan from Peurotus ostreatus). Z. Naturforsch. C. 2009; 64 : 597–600.
35. Mantovani MS, Bellini MF, Angeli JPF, et al. β-glucans in promoting health: Prevention against mutation and cancer. Mut. Res. 2008; 658 : 154–161.
36. Mizuno M, Shiomi Y, Minato K, et al. Fucogalactan isolated from Sarcodon aspratus elicits release of tumor necrosis factor-α and nitric oxide from murine macrophages. Immunopharmacology 2000; 46 : 113–121.
37. Murata Y, Shimamura T, Tagami T, et al. The skewing to Th1 induced by lentinan is directed through the distinctive cytokine production by macrophages with elevated intracellular glutathione content. Int. Immunopharmacol. 2002; 2 : 673–689.
38. Rossi GD, Vetvicka V, Yan J, et al. Therapeutic intervention with complement and beta-glucan in cancer. Immunopharmacology 1999; 42 : 61–74.
39. Šemberová J, Paulovičová E, Jelemenská A, et al. Indukcia TNF-α imunomodulačnou liečbou s obsahom β-glukánu u detských pacientov so zväčšenou nosohltanovou mandľou. Klin. Imunol. Alergol. 2009; 19 : 15–17.
40. Shimizu S, Kitada H, Yokota H, et al. Activation of the alternative complement pathway by Agaricus blazei Murill. Phytomedicine 2002; 9 : 536–545.
41. Volman JJ, Ramakers JD, Plat J. Dietary modulation of immune system by β-glucans. Physiol. & Behaviour. 2008; 94 : 276–284.
42. Haladová E, Mojžišová J, Smrčo P, et al. The effect of β (1,3/1,6)D-glucan on sellected non-specific and specific immunological parameters in dogs after vaccination. Folia Veterinaria 2009; 63 : 43–46.
43. Smith MJ, Andreson R. Inhibition of mitogen-activated proliferation of human lymphocytes by hypochlorous acid in vitro: protection and reversal by ascorbate and cysteine. Agents Actions 1990; 30 : 338–343.
44. Siegler BV. Enhancement of interferon procution by poly(rl)-poly(rC) in mousecell culture by ascorbic acid. Nature 1975; 254 : 531–532.
45. Cohen HA, Varsano I, Kahan E, et al. Effectiveness of an herbal preparation containing echinacea, propolis, and vitamin C in preventing respiratory tract infections in children: a randomized, double-blind, placebo-controlled multicenter study. Arch. Pediatr. Adolesc. Med. 2004; 157 : 217–221.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek Oznámení
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2010 Číslo 11- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Prenatální kardiologie v České republice
- Vrozené srdeční vady a jejich rizikové faktory
- Současné trendy v léčbě invaginací u dětí
- Imunoglukan P4H® v prevencii recidivujúcich infekcií dýchacích ciest v detskom veku
-
Hemolyticko-uremický syndrom – nejčastější příčina akutního renálního selhání u dětí
Komplexnost patofyziologie a nové možnosti diagnostiky a terapie atypických forem - Projekt screeningu a krátké intervence v ordinaci praktického lékaře pro děti a dorost, vedoucí k snížení zneužívání návykových látek v adolescenci
- Henochova-Schönleinova purpura – diagnostika a léčba z pohledu současných poznatků
- Oznámení
- Infuzní roztoky a historie jejich objevitelů (1)
- Prof. MUDr. Miroslav Anton Šašinka, DrSc. – 75-ročný
- Gratulace k 75. narozeninám panu profesorovi MUDr. Miroslavu Šašinkovi, DrSc.
- Spomienka na Angela M. Di Georgea (1921–2009)
- Česko-slovenská konference laboratorní hematologie
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Henochova-Schönleinova purpura – diagnostika a léčba z pohledu současných poznatků
-
Hemolyticko-uremický syndrom – nejčastější příčina akutního renálního selhání u dětí
Komplexnost patofyziologie a nové možnosti diagnostiky a terapie atypických forem - Současné trendy v léčbě invaginací u dětí
- Imunoglukan P4H® v prevencii recidivujúcich infekcií dýchacích ciest v detskom veku
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



