-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Karcinom z Merkelových buněk se skvamózní diferenciací – kazuistika
Merkel cell carcinoma with squamous differentiation – case report
We report a case of 81-year old female with Merkel cell carcinoma of skin with squamous differentiation and aberrant immunohistochemical profile. Primary skin tumor of left preauricular area was incompletely removed 6 months ago and diagnosed as poorly differentiated squamous cell carcinoma. After 6 months patient returns with relapse and new biopsy is made. Microscopically, mostly solid structures of poorly differentiated neoplasia with focal squamous differentiated are found. Neoplastic cells were small, polygonal, with scant cytoplasm and irregular oval dark nuclei with high mitotic activity. Immunohistochemically, tumor cells showed positivity for AE1/AE3, p63, CD56, chromogranin A, synaptophysin and in squamous parts p40. CK20 and other markers examined were negative. Merkel cell carcinoma is rare and highly aggressive skin tumor with characteristic expression of epithelial and neuroendocrine markers. In this report we want to point out that caution should be taken in excluding diagnosis of Merkel cell carcinoma from differential diagnosis based on atypical histological and immunohistochemical findings, especially the risk of confusion with less aggressive skin tumors.
Keywords:
Merkel cell carcinoma – squamous differentiation – aberrant immunohistochemical profile
Autoři: Ondrej Savka; Aleš Pastrňák
Působiště autorů: Oddělení patologie Nemocnice Kyjov
Vyšlo v časopise: Čes.-slov. Patol., 56, 2020, No. 3, p. 177-180
Kategorie: Původní práce
Souhrn
Prezentujeme případ 81-leté ženy s kožním karcinomem z Merkelových buněk se skvamózní diferenciací a aberantním imunoprofilem. Před 6 měsíci byl původní kožní tumor levé preaurikulární oblasti nekompletně odstraněn a popsán jako nízce diferencovaný spinocelulární karcinom. Pacientka je po této době vyšetřována pro recidivu tumoru v jizvě, ze které byla provedena probatorní excize průbojníkem. V mikroskopickém obrazu byla zachycena nízce diferencovaná neoplazie převážně solidní stavby, s fokusy skvamózní diferenciace. Nádorové buňky byly menší, polygonální, s úzkým lemem cytoplazmy a nepravidelnými oválnými tmavými jádry a vysokou mitotickou aktivitou. Imunohistochemicky byl v nádorových buňkách pozitivní průkaz AE1/AE3, p63, CD56, chromograninu A, synaptophysinu a ve skvamózních partiích p40. Exprese CK20 ani dalších markerů nebyla zastižena. Karcinom z Merkelových buněk je vzácný a vysoce agresivní kožní tumor s charakteristickou expresí epitelových a neuroendokrinních markerů. Tato práce chce poukázat na riziko vyloučení karcinomu z Merkelových buněk z diferenciální diagnózy na základě netypického histologického a imunohistochemického nálezu, zejména pak na riziko záměny za méně agresivní kožní tumor.
Klíčová slova:
karcinom z Merkelových buněk – skvamózní diferenciace – aberantní imunohistochemický profil
Karcinom z Merkelových buněk (MCC) je vzácný a vysoce maligní kožní tumor, který se klinicky projevuje jako zduření kůže či červenorůžový až nafialovělý, někdy ulcerovaný uzel v oblastech vystavených slunečnímu záření, nejčastěji na hlavě a krku či končetinách (1,2). Podobně mohou vypadat i jiné primární kožní nádory či metastázy, nelze proto z klinického vyšetření určit přesnou diagnózu. Nádor se vyskytuje zejména v dospělém věku, nejvyšší incidence je u mužů starších 75 let (3). Histologicky je tvořen solidními čepy, hnízdy a pruhy bazaloidních buněk, lokalizovaných v dermis. Jádra jsou kulatá až oválná, s jemnou distribucí chromatinu charakteru „sůl a pepř“, s nevýrazným jadérkem a úzkým lemem cytoplazmy. (4,5) Četné jsou mitotické figury a nekrotické buňky. V diferenciální diagnostice je nutné odlišit bazocelulární karcinom, melanom, Ewingův sarkom, neuroblastom, nízce diferencovaný karcinom či lymfom (6). Vzhledem k široké diferenciální diagnostice je vhodné diagnózu potvrdit imunohistochemickým vyšetřením (7). Nádorové buňky zpravidla exprimují CK20 a neurofilamenta, při negativní expresi CK7 a TTF-1. Charakteristická je exprese i dalších neuroendokrinních markerů chromograninu, synaptophysinu a CD56. Karcinom z Merkelových buněk je agresivní nádor se špatnou prognózou, zejména u pacientů se vzdálenými metastázami v době diagnózy (8).
POPIS PŘÍPADU
Klinický nález
81-letá žena byla přijata k hospitalizaci na oddělení ORL s recidivou palpačně bolestivého tumoru preaurikulárně vlevo. Tumor byl nafialovělý, bochánkovitého tvaru s ulcerovaným povrchem a v největším rozměru dosahoval 4 cm. (Obr 1.) Na vyšetření CT a MRI byla popsána invaze do příušní žlázy. Vyšetření PET-CT neprokázalo vzdálené metastázy. Prvotní chirurgická excize byla provedena před 6 měsíci na jiném pracovišti. Histologický nález byl v té době uzavřen jako nízce diferencovaný spinocelulární karcinom, dosahující resekčních okrajů.
Obr. 1. Částečně ulcerovaný nafialovělý objemný uzel preaurikulárně vlevo, zčásti infiltrující tragus. 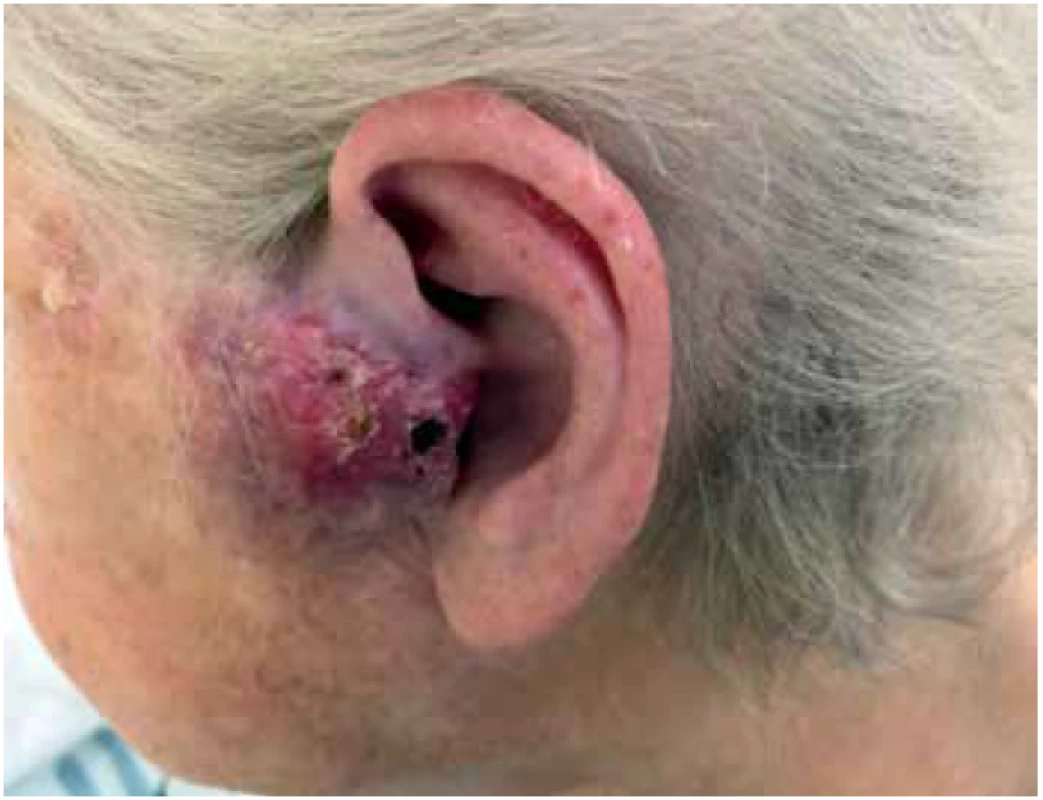
Mikroskopický nález
Průbojníkem byl z centra léze odebrán vzorek o velikosti 4x4 mm a dodán k histologickému vyšetření na našem pracovišti. Materiál byl po důkladné fixaci v 10 % formalínu zpracován standardním způsobem a zalitý do parafinu. V následujícím kroku byly zhotoveny histologické řezy obarveny základním barvením hematoxylinem – eozinem. Imunohistochemické vyšetření bylo provedeno manuálně. Nejprve proběhlo odmaskování antigenních epitopů v tkáňových řezech pomocí přístroje PT Link (Dako Denmark A/S) a na takto ošetřené řezy byly aplikovány primární protilátky. Byly použity následující protilátky od firmy Dako Denmark A/S: CK7 (klon OV-TL 12/30), CK20 (klon KS20.8), TTF 1 (klon 8G7G3/1), CD56 (klon 123C3), Chromogranin A (klon DAK-A3), Synaptophysin (klon DAK SYNAP), p63 (klon DAK-p63), Pan Cytokeratin (klon AE1/AE3), EMA (klon E29), CD3 (polyklonální králičí protilátka), CD20 (klon L26), MelanA (klon A103), Ki-67 (klon MIB-1) a od firmy DCS: p40 (klon 1.1). Následně byl aplikován detekční systém EnVisionTM FLEX+ (Dako Denmark A/S) k vizualizaci proběhlé reakce. V posledním kroku byla buněčná jádra dobarvena Mayerovým hematoxylinem. V rozsahu dermis byl pod intaktním epidermálním krytem zachycen nízce diferencovaný maligní tumor solidní až trabekulární stavby s desmoplastickým stromatem a drobnými hnízdy naznačeně skvamózní diferenciace, která se po prokrájení materiálu dále zvýraznila (Obr.2 A, B). Nádorové buňky byly menší až střední velikosti, polygonální, s nepravidelně kulatými až oválnými jádry, převážně hyperchromními, místy s hrubým chromatinem, poněkud užším dvorcem cytoplazmy a hojnými mitotickými figurami. Sporadicky byly zastiženy roztroušené nekrotické buňky. Imunohistochemicky vykazovaly expresi p63, CD56, synaptophysinu, chromograninu A, EMA, slabě AE1/AE3, při vysokém proliferačním indexu Ki-67 (obr.3 A-D). Ve skvamózních partiích byla patrná silná pozitivita AE1/AE3 a p40. Negativní byla exprese CK7, CK20, TTF-1, Melan A, CD3, CD20. Histologický obraz, včetně imunoprofilu, odpovídal karcinomu z Merkelových buněk, původní nález, 6 měsíců zpátky, byl však uzavřen jako nízce diferencovaný spinocelulární karcinom, proto byly příslušné bloky a skla vyžádány k zapůjčení. Z dodaného materiálu byly zhotoveny nové řezy barvené hematoxylinem a eozinem. Mikroskopický obraz byl obdobný, s četnějšími a zřetelnějšími ložisky skvamózní diferenciace (Obr. 4 A, B). Po doplnění obdobného imunohistochemického vyšetření byl nález uzavřen jako recidiva karcinomu z Merkelových buněk. Pacientka byla následně odeslána k další terapii z ORL oddělení na vyšší pracoviště.
Obr. 2. Intradermální solidně trabekulární nádorový infiltrát tvořený drobnými hyperchromními elementy. Epidermální kryt je atrofický, ale intaktní (A – barvení hematoxylinem eozinem, zvětšení 100x). Drobné ložisko skvamózní diferenciace (B – barvení hematoxylinem eozinem, zvětšení 200x). 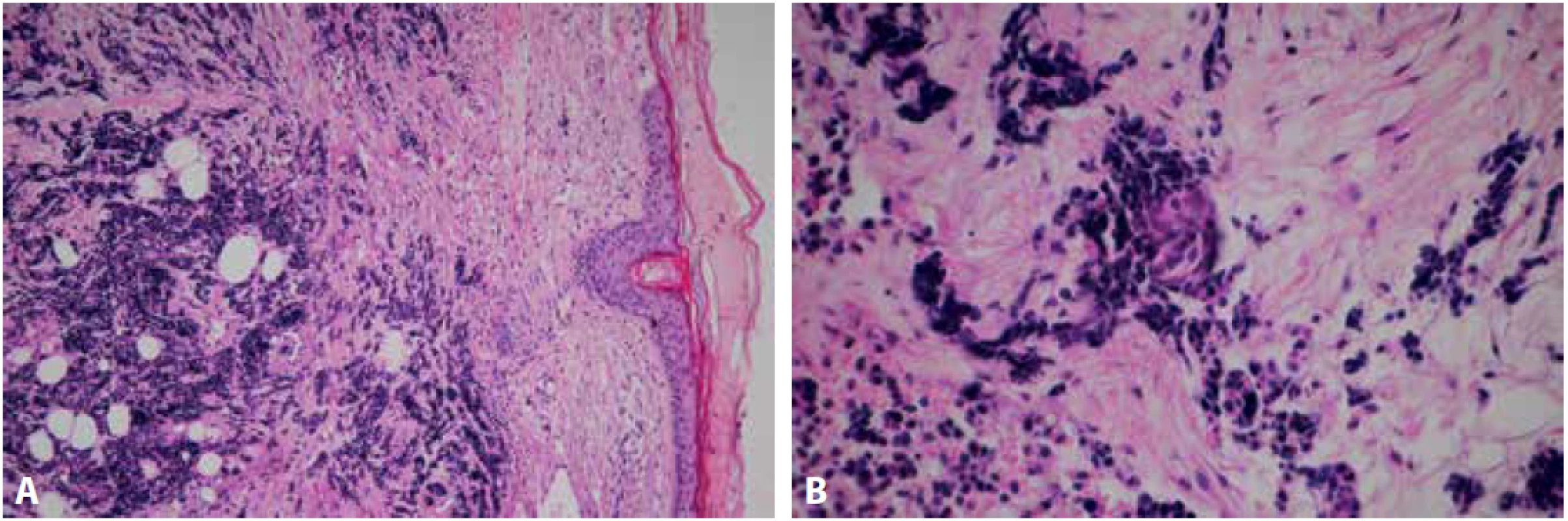
Obr. 3. Imunohistochemický průkaz neuroendokrinní diferenciace: Silná pozitivita CD56 (A – zvětšení 100x) a silná cytoplazmatická pozitivita synaptophysinu (B – zvětšení 200x). Silná cytoplazmatická exprese AE1/AE3 v partiích se skvamózní diferenciací a slabá exprese v ostatních buňkách (C – zvětšení 200x). Negativní průkaz CK20 (D – zvětšení 100x). 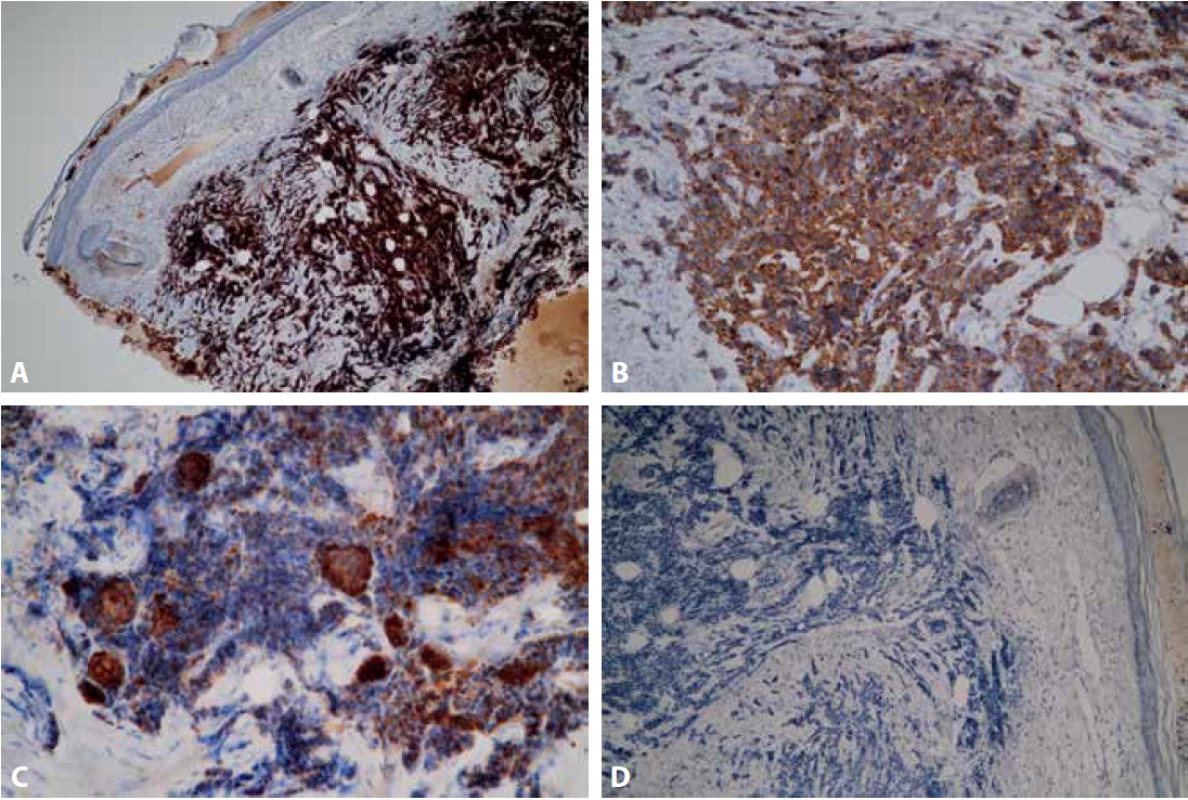
Obr. 4. Mikroskopický obraz primárního tumoru s četnějšími skvamózními partiemi (A – barvení hematoxylin eozin, zvětšení 100x). Silná cytoplazmatická exprese AE1/AE3 v epidermis a skvamózních partiích (B – zvětšení 100x). 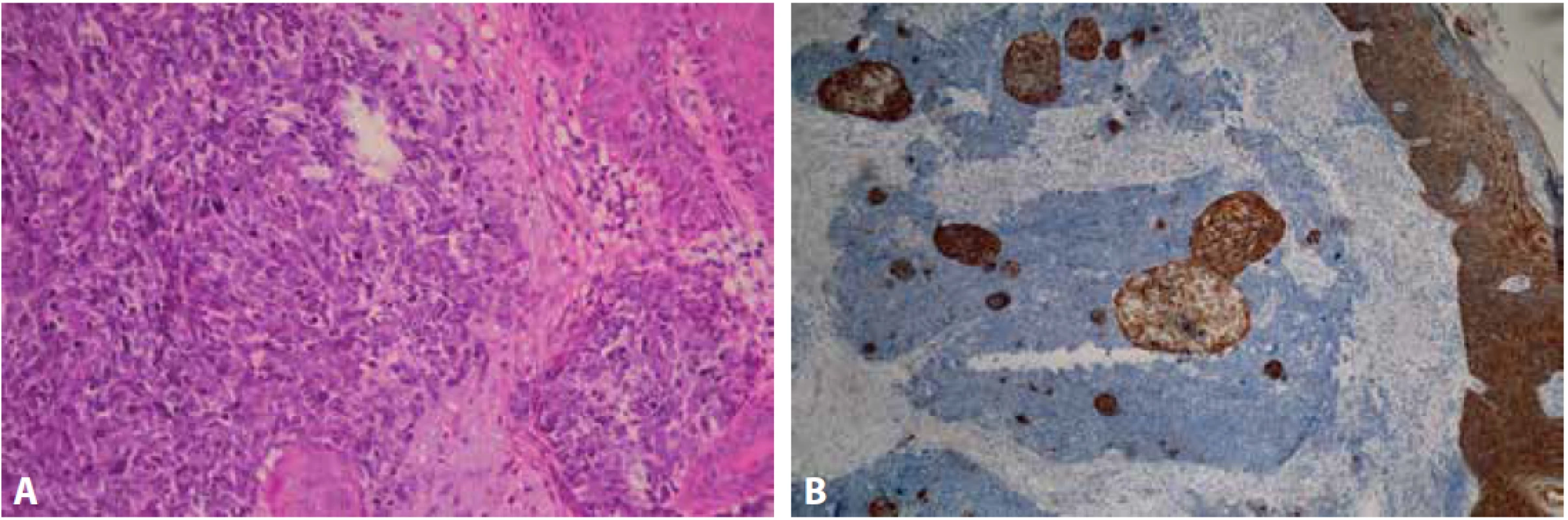
DISKUZE
Karcinom z Merkelových buněk poprvé popsal Cyril Toker jako trabekulární karcinom již v roce 1972. (9) Domníval se, že nádor vychází z buněk uložených v bazální vrstvě epidermis, tvořících kožní mechanoreceptory, které objevil a pojmenoval v roce 1876 německý anatom a patolog Friedrich Sigmund Merkel. (10,11) Novější práce však tvrdí, že pravděpodobným zdrojem nádoru je pluripotentní kmenová buňka, která se dále diferencuje v buňky Merkelova karcinomu. (12,13) Zásadní význam měl objev Merkelova polyomaviru a jeho integrace v DNA nádorových buněk, kdy Feng a spol. v roce 2008 popsal infekci u 8 z 10 případů (14).
Jedná se o vzácný a vysoce agresivní kožní tumor, se stoupající incidencí kolísající mezi 0,13/100 000 obyvatel v Evropě, 0,73/100 000 v USA až 1,6/100 000 obyvatel v Austrálii. (15) Novější data ukazují výrazně stoupající incidenci spojenou se stárnutím populace (16). Typickým pacientem je starší muž ve věku 70-80 let, běloch, s tumorem v oblasti vystavené slunečnímu záření, zejména v oblasti hlavy a krku či horních končetin (1). MCC se jen vzácně vyskytuje před 50. rokem života (17). V etiologii se mimo ultrafialového záření uplatňuje infekce Merkelovým polyomavirem (15). Incidence je vyšší u imunokompromitovaných jedinců, až 10-násobně častěji se vyskytuje u pacientů po transplantaci orgánů či infikovaných HIV (18,19). Karcinom z Merkelových buněk se nejčastěji projevuje jako červenorůžový či nafialovělý nebolestivý nodulární útvar, poměrně rychle rostoucí, někdy ulcerovaný (4,7). Klinickým vyšetřením nelze přesnou diagnózu stanovit, může se podobat bazocelulárnímu karcinomu, spinocelulárnímu karcinomu, melanomu či lymfomu (6), vždy je nutné doplnit imunohistochemické vyšetření. Často metastazuje do regionálních lymfatických uzlin či vzdálenějších lokalit (6), velmi vzácně může být přítomna uzlinová metastáza bez primárního kožního ložiska (20). Mortalita je vysoká, v porovnání s melanomem až dvounásobná (21), 5leté přežití pacientů s touto diagnózou se odhaduje na 51 % u lokálního postižení, 35 % u metastáz do regionálních lymfatických uzlin a 14 % u vzdálených metastáz (8).
Histologicky tumor roste v podobě solidních dermálních či subkutánních uzlů, poměrně dobře ohraničených vůči okolí, někdy tvoří trabekulární a stužkovité formace či pseudorozety. Velikost nádorových buněk kolísá: nejčastěji jsou středně velké, s oválnými až kulatými jádry s chromatinem charakteru „sůl a pepř“ a skromnou cytoplazmou (4-6). Mitotická aktivita bývá vysoká, lze zastihnout i atypické figury. V menších biopsiích ho lze zaměnit za bazocelulární karcinom či lymfom, důležité je odlišení od metastatického neuroendokrinního nádoru jiných primárních lokalit (např. malobuněčný karcinom plic – TTF-1+) (6). Vzácně může vykazovat známky skvamózní, glandulární, ekrinní, melanocytární či sarkomatoidní diferenciace. (5,22,23) Imunohistochemicky je pro většinu MCC charakteristická současná exprese epiteliálních markerů (24), zvlášť pak perinukleární tečkovitá pozitivní reakce pro CK20 a neuroendokrinní markery (chromogranin, synaptophysin a CD56). (4,6,7) Pozitivní je rovněž exprese EMA a neurofilament, téměř vždy je negativní CK7 a TTF-1. Vzácně byly popsány případy CK20 negativních karcinomů, zejména recidiv (7,25). Ztráta exprese je popisována rovněž u karcinomů bez přítomné infekce Merkelovým polyomavirem (7,22,26). Významnou roli má z prognostického hlediska staging tumoru v době diagnózy, zvláště přítomnost uzlinových metastáz. Rovněž exprese p63 je spojována s agresivnějším chováním nádoru. (27,28)
Léčba MCC se liší v závislosti na stadiu onemocnění a celkovém stavu pacienta. Poprvé v roce 2010 se pro staging MCC začal používat jednotný systém, který nahradil předchozích pět současně užívaných. V 8. edici TNM klasifikace platné od 2018 došlo ke změnám, nově se odlišuje klinický stage od patologického a přítomnost či nepřítomnost primárního ložiska. (29) Základem terapie je kompletní chirurgické odstranění léze s dostatečným bezpečnostním lemem (1-2 cm) do zdravé tkáně (30), doplněné biopsií sentinelové lymfatické uzliny. Při pozitivním nálezu lze doplnit léčbu o radikální lymfadenektomii s adjuvantní radioterapií cílenou na primární ložisko a oblast regionálních lymfatických uzlin. U pokročilého karcinomu s metastatickým postižením či rekurenci lze indikovat adjuvantní chemoterapii, avšak její zásadní vliv na délku přežití nebyl prokázán. (30)
V prezentovaném případu se jednalo o recidivu karcinomu z Merkelových buněk se skvamózní diferenciací, který byl v původní biopsii označen jako nízce diferencovaný spinocelulární karcinom. Až imunohistochemický průkaz charakteristické epiteliální a neuroendokrinní diferenciace umožnil stanovení přesné diagnózy. Pacientce byla provedena další vyšetření, včetně PET/CT a magnetické rezonance hlavy s nálezem lokálně pokročilé léze, avšak bez vzdálených metastáz. Tato kazuistika chce poukázat na existenci karcinomu z Merkelových buněk s divergentní diferenciací a netypickým imunofenotypem, který dále znesnadňuje už tak širokou diferenciální diagnostiku MCC.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
∗ Adresa pro korespondenci:
MUDr. Ondrej Savka
Oddělení patologie Nemocnice Kyjov, příspěvková organizace
Strážovská 1247/22, 697 01 Kyjov
tel: 518601541
email: savka.ondrej@nemkyj.cz
Zdroje
1. Pulitzer M. Merkel cell carcinoma. Surg Pathol Clin 2017; 10 : 399-408.
2. Campillo R, Gil-Carcedo E, Alonso D, Vallejo LA, Oñate JM, Gil-Carcedo LM. Primary cutaneous neuroendocrine carcinoma, Merkel cell carcinoma. Case series 1991-2012. Acta Otorrinolaringol Esp 2013; 64 : 396-402.
3. Kieny, A , Cribier, B , Meyer, N , Velten, M, Jégu, J and Lipsker, D. Epidemiology of Merkel cell carcinoma. A population‐based study from 1985 to 2013, in northeastern of France. Int J Cancer 2019; 144 : 741-745.
4. Adamicová K, Fetisovová Ž, Šingliar A, Maretta I. Histopatologické nálezy pri diagnostike karcinómu Merkelových buniek. Dermatologie pro praxi 2010; 10 : 3–6.
5. Pulitzer MP, Brannon AR, Berger MF, et al. Cutaneous squamous and neuroendocrine carcinoma: genetically and immunohistochemically different from Merkel cell carcinoma. Mod Pathol 2015; 28(8): 1023.
6. Krejčí K; Zadražil J; Tichý T et al. Kožní karcinom z Merkelových buněk. Klin Onkol 2010; 23(4): 210-217.
7. Jirásek T, Matěj R, Pock L, Knotková I, Mandys V. Karcinom z Merkelových buněk – imunohistologická studie v souboru 11 pacientů. Cesk Patol 2009; 45 : 9–13.
8. Harms KL, Healy MA, Nghiem P, et al. Analysis of prognostic factors from 9387 Merkel cell carcinoma cases forms the basis for the new 8th edition AJCC staging system. Ann Surg Oncol 2016; 23 : 3564–3571.
9. Toker C. Trabecular carcinoma of the skin. Arch Dermatol 1972; 105(1): 107-110.
10. Halata Z, Grim M, Bauman KI. Merkelova buňka: morfologie, vývojový původ, funkce, Cas Lek Cesk 2003; 4-9.
11. Merkel FS. Tastzellen und Tastkörperchen bei den Hausthieren und beim Menschen. Archiv für mikroskopische Anatomie 1875; 11 : 636-652.
12. Hausen A, Rennspiess D, Winnepenninck V, et al. Early B-cell differentiation in Merkel cell carcinomas: clues to cellular ancestry. Cancer Res 2013; 73 : 4982-4987.
13. Tilling T, Moll I. Which are the cells of origin in Merkel cell carcinoma? J Skin Cancer 2012 : 680410.
14. Feng H, Shuda M, Chang Y, Moore PS. Clonal integration of a polyomavirus in human Merkel cell carcinoma. Science 2008; 319(5866): 1096-1100.
15. Coggshall K, Tello TL, North JP, Yu SS. Merkel cell carcinoma: An update and review. J Am Acad Dermatol 2018; 78(3): 433-442.
16. Paulson KG, Park SY, Vandeven NA, et al. Merkel cell carcinoma: Current US incidence and projected increases based on changing demographics. J Am Acad Dermatol 2018; 78(3): 457–463.
17. Penn I, First MR. Merkel’s cell carcinoma in organ recipients: report of 41cases. Transplantation 1999; 68(11): 1717-1721.
18. Jalilian C, Chamberlain AJ, Haskett M, et al. Clinical and dermoscopic characteristics of Merkel cell carcinoma. Br J Dermatol 2013; 169 : 294–297.
19. Engels EA, Frisch M, Goedert JJ, Biggar RJ, Miller RW. Merkel cell carcinoma and HIV infection. Lancet 2002; 359 : 497-498.
20. Szabó A; Richter I, Frydrychová D, Saláková M, Jirásek T. Uzlinová metastáza karcinomu z Merkelových buněk bez kožního primárního ložiska – kazuistické sdělení. Cesk Patol 2017; 53 : 135-138.
21. Miller RW, Rabkin CS. Merkel cell carcinoma and melanoma: etiological similarities and differences. Cancer Epidemiol Biomarkers Prev 1999; 8(2): 153–158.
22. Martin B, Poblet E, Rios JJ, et al. Merkel cell carcinoma with divergent differentiation: histopathological and immunohistochemical study of 15 cases with PCR analysis for Merkel cell polyomavirus. Histopathology 2013; 62(5): 711-722.
23. Saeb-Lima M, Montante-Montes de Oca D, Albores-Saavedra J. Merkel cell carcinoma with eccrine differentiation: a clinicopathologic study of 7 cases. Ann Diagn Pathol 2008; 12(6): 410-414.
24. Jensen, K., Kohler, S., Rouse, R. V. Cytokeratin staining in Merkel cell carcinoma: an immunohistochemical study of cytokeratins 5/6, 7, 17, and 20. Appl Immunohistochem Mol Morphol 2000; 8 : 310–315.
25. Miner AG, Patel RM, Wilson DA, et al. Cytokeratin 20-negative Merkel cell carcinoma is infrequently associated with the Merkel cell polyomavirus. Mod Pathol 2015; 28 : 498-504.
26. Narisawa Y, Koba S, Inoue T, Nagase K Histogenesis of pure and combined Merkel cell carcinomas: An immunohistochemical study of 14 cases. J Dermatol 2015; 42(5): 445-452.
27. Asioli S, Righi A, Volante M, Eusebi V, Bussolati G. p63 expression as a new prognostic marker in Merkel cell carcinoma. Cancer 2007; 110(3): 640-647.
28. Stetsenko GY, Malekirad J, Paulson KG, et al. p63 expression in Merkel cell carcinoma predicts poorer survival yet may have limited clinical utility. Am J Clin Pathol 2013; 140(6): 838–844.
29. Amin MB, Edge S, Greene F, et al. AJCC Cancer Staging Manual (8th edition). Springer International Publishing: American Joint Commission on Cancer.
30. Schadendorf D, Lebbé C, Zur Hausen A, et al. Merkel cell carcinoma: Epidemiology, prognosis, therapy and unmet medical needs. Eur J Cancer 2017; 71 : 53-69.
Štítky
Patologie Soudní lékařství Toxikologie
Článek vyšel v časopiseČesko-slovenská patologie

2020 Číslo 3-
Všechny články tohoto čísla
- Praktická imunohistochémia v genitourinárnej patológii
- Profesor Ivo Šteiner osmdesátiletý
- Monitor aneb nemělo by vám uniknout, že...
- Využití imunohistochemie při diagnostice renálních neoplázií
- Využití imunohistochemie při diagnostice lézí vývodného močového traktu
- Monitor aneb nemělo by vám uniknout, že...
- Praktické využití imunohistochemie a genetiky v diagnostice nádorů varlat
- Využití imunohistochemie v patologii prostaty
- Gossypibóm – imitujúci recidívu nádoru mandibuly: kazuistika
- Uzlinová metastáza high-grade adenoidně cystického karcinomu příušní slinné žlázy
- Karcinom z Merkelových buněk se skvamózní diferenciací – kazuistika
- Diagnostic Histopathology of Tumors
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Uzlinová metastáza high-grade adenoidně cystického karcinomu příušní slinné žlázy
- Využití imunohistochemie při diagnostice lézí vývodného močového traktu
- Využití imunohistochemie při diagnostice renálních neoplázií
- Využití imunohistochemie v patologii prostaty
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



