-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Současné možnosti in vivo protonové (1H) MR spektroskopie v diagnostice mozkového abscesu
Current Possibilities of In Vivo Proton (1H) Magnetic Resonance Spectroscopy in the Diagnosis of Brain Abscess
Brain abscess remains a serious inflammatory brain disease with significant morbidity and mortality. Neuroimaging is an essential part of diagnostic process, postcontrast T1-weighted imaging and diffusion-weighted imaging in particular. The examination should also include in vivo proton (1H) spectroscopy. Its role in differentiating similarly appearing intracranial cystic lesions was confirmed. Spectroscopy is increasingly being used in experimental and clinical applications – noninvasive identification of bacterial type, evaluation of chronological change of the brain abscess, assessment of therapy and postoperative changes. This paper summarizes current findings of in vivo proton MR spectroscopy in the diagnosis of cerebral abscess.
Key words:
brain abscess – diffusion weighted imaging – MR spectroscopy – diffusion tensor imaging
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři: Z. Večeřa 1; P. Hanzlíková 2; T. Krejčí 1; R. Lipina 1,3; M. Kanta 4
Působiště autorů: Neurochirurgická klinika LF OU a FN Ostrava 1; MR pracoviště, Sagena s. r. o., Frýdek Místek 2; Lékařská fakulta OU v Ostravě 3; Neurochirurgická klinika LF UK a FN Hradec Králové 4
Vyšlo v časopise: Cesk Slov Neurol N 2016; 79/112(3): 294-298
Kategorie: Přehledný referát
Souhrn
Mozkový absces v současné době nadále představuje závažné zánětlivé onemocnění mozku s významnou morbiditou a mortalitou. Význam neurozobrazovacích metod v diagnostice hraje dominantní roli. Zejména magnetická rezonance a její modality – především T1 vážený obraz s aplikací kontrastní látky a difuzně vážený obraz. Součástí vyšetřovacího protokolu by měla být in vivo protonová (1H) MR spektroskopie. Její význam v diferenciální diagnostice cystických lézí mozku je potvrzen. S rozšiřujícím se využíváním v klinické praxi a experimentu dochází ke snaze o obohacení diagnostických možností – neinvazivní širší identifikaci agens abscesu, hodnocení stáří a vývoje zánětlivých změn, zhodnocení důsledků ATB léčby a pooperačních změn. Tato práce přináší shrnutí současných poznatků MR spektroskopie v diagnostice mozkového abscesu.
Klíčová slova:
mozkový absces – difuzně vážený obraz – MR spektroskopie – zobrazení tenzorů difuzeÚvod
Mozkový absces představuje závažné ohraničené zánětlivé onemocnění mozku. Incidence kolísá mezi 1 a 8 % všech intrakraniálních lézí, v současné době nadále s významnou morbiditou (až 50 % postižených) a mortalitou (mezi 5 a 10 %) [1]. Špatnou prognózu mají imunokompromitovaní pacienti, fungální abscesy a tuberkulomy. Klinické projevy zahrnují febrilie, symptomy nitrolební hypertenze (bolesti hlavy, nauzea, zvracení), meningeální dráždění, epilepsii či rozličné neurologické postižení v závislosti na lokalizaci léze. V terapii se užívá dlouhodobé podávání kombinace antibiotik, chirurgické ošetření (punkce nebo exstirpace) a léčba případného primárního zdroje. Absces vzniká přestupem z okolí (záněty středouší či paranazálních dutin), hematogenním rozsevem, následkem poranění či po neurochirurgických operacích. Původcem je nejčastěji anaerobní flóra – (Streptococcus sp., Bactroides sp.), fakultativní anaeroby (Staphylococcus aureus), příp. směsné infekce fakultativních a obligatorních anaerobů. Až ve 25 % případů se původce nepodaří zjistit. Vzácně vidíme atypické agens (např. Mycobacterium, Cryptococcus, Candida albicans).
V diagnostice hrají dominantní roli neurozobrazovací metody. Základním vyšetřením je CT mozku s prakticky 100% senzitivitou, ale nízkou specificitou. Při MR vyšetření mozku – typicky v T1 vážených sekvencích s aplikací kontrastní látky – se zobrazuje tenkostěnná hyperintenzní prstenčitá léze s hypointenzním centrem a perifokální edémem (obr. 1). Součástí vyšetřovacího protokolu by měl být difuzně vážený obraz (DWI), který absces zobrazuje s vysokou intenzitou signálu a nízkou hodnotou zdánlivého koeficientu difuze (Apparent Diffusion Coefficient; ADC) (obr. 2). Spektroskopické vyšetření poskytuje neurochemickou charakteristiku léze, přínosnou v následném diagnosticko-terapeutickém procesu (obr. 3). Text je určen neurologicko-neurochirurgické odbornosti, podrobné technické detaily a metodologii vyšetření záměrně vynecháváme.
Obr. 1. T1 vážený obraz s aplikací kontrastní látky. Mozkový absces se zobrazuje jako tenkostěnná dosycující prstenčitá léze s hypointenzním centrem a perifokální edémem. Fig. 1. T1-weighted image with contrast. Brain abscess appears as a thin contrast-enhanced ring lesion with hypointensive center and perifocal edema. 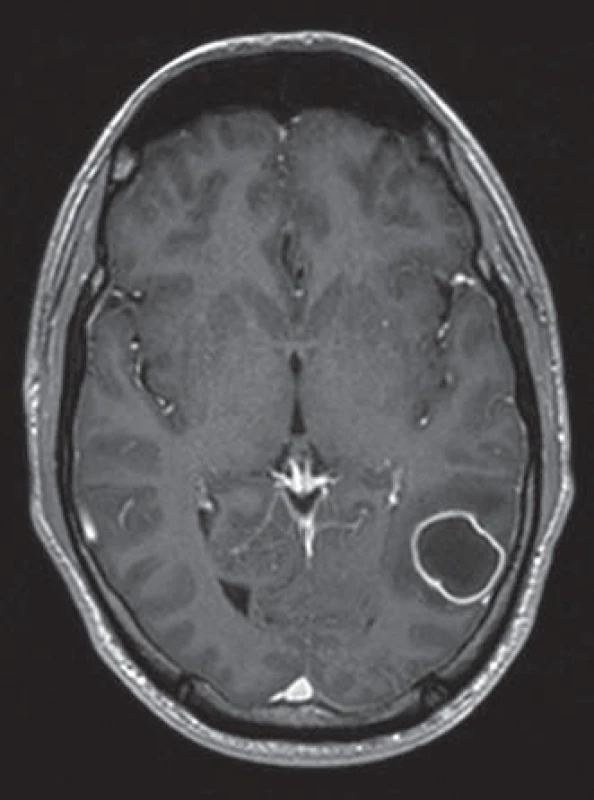
Obr. 2. Zobrazení mozkového abscesu v difuzně váženém obraze (DWI) a zdánlivém koeficientu difuze (ADC) – vyšetření v poli 1,5T. Fig. 2. Brain abscess in diffusion-weighted MRI (DVI) and apparent diffusion coefficient (ADC) – a 1.5 T examination. 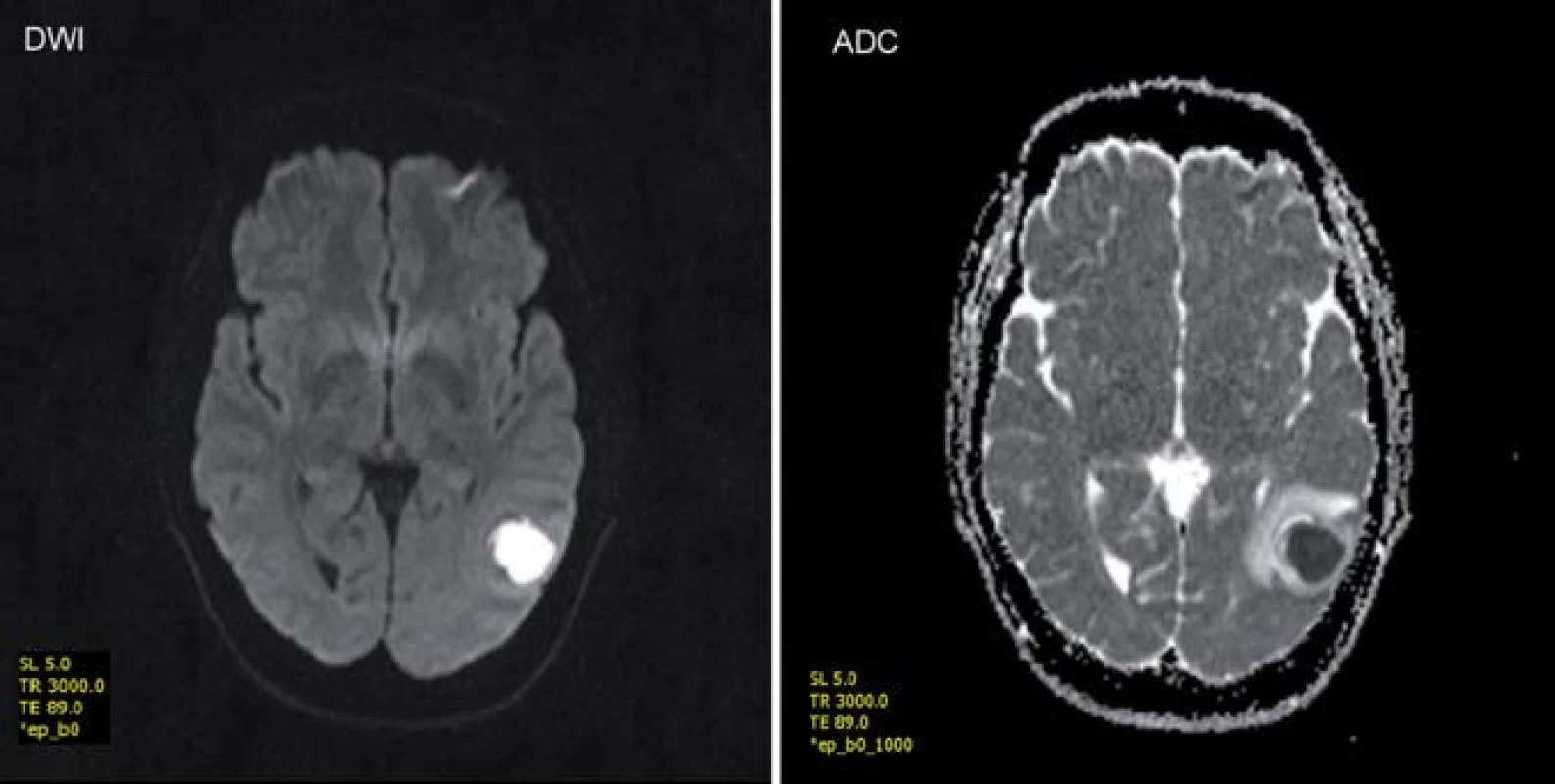
Obr. 3. MR spektroskopie mozkového abscesu – patrná výrazná elevace laktátu v oblasti zájmu, nízká hladina NAA a lehce vyšší pík cholinu při zachycení i okolní mozkové tkáně (1,5T, SVS, TE 135 ms). Fig. 3. MR spectroscopy of brain abscess – demonstrates signifi cant elevation of lactate in the area of interest, low levels of NAA and choline peak slightly higher when capturing surrounding brain tissue (1.5T, SVS, TE of 135 ms). 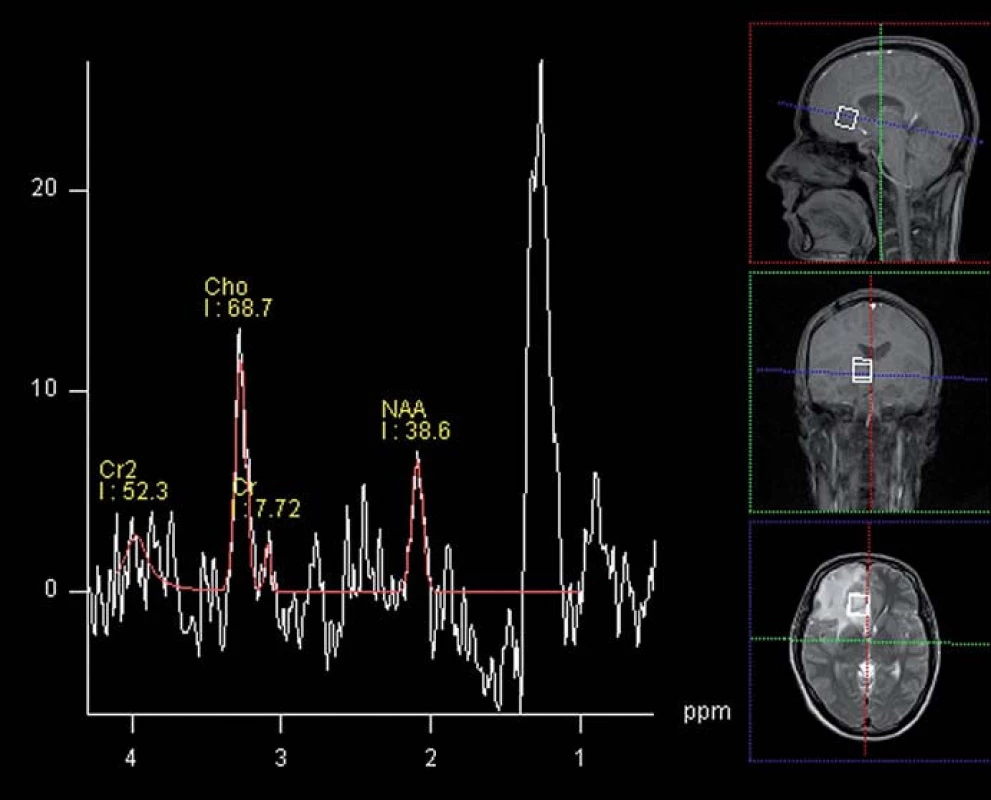
In vivo protonová (1H) MR spektroskopie
Jedná se o analytickou modalitu MR měřící neinvazivně koncentrace metabolitů v mozku na základě odlišných rezonančních vlastností protonů jednotlivých metabolitů (odlišují se v rezonanční frekvenci; Chemical Shift; CS). Identifikujeme je pomocí chemických posunů jejich rezonančních čar vztahovaných ke zvolenému standardu – tetrametylsilanu (TMS) – a udáváme v relativních jednotkách ppm (miliontinách rezonančního kmitočtu) [2]. Patologické stavy mozku se pak projevují kvantitativními změnami signálů, změnami jejich poměrů, event. přítomností signálů, které v normálním mozku nedetekujeme.
V současné době se neustále rozšiřují možnosti jejího využití od zkoumání biochemických změn normálně se vyvíjejícího mozku až po rozmanité klinické aplikace v neurologii (traumatologie, epilepsie, neurodegenerativní postižení, demyelinizační onemocnění, onkologická problematika, ischemie/ mozková hypoxie, vrozené metabolické choroby) [3].
Zmínky o užití v experimentu a diagnostice mozkového abscesu se poprvé objevují na počátku 90. let 20. století [4,6–8]. Od té doby její využití a počet klinických a experimentálních prací neustále vzrůstá v součinnosti s pokrokem a vývojem spektroskopické metodologie (pulzní sekvence), hardwaru (např. aktivně stíněné gradienty, digitální detekce) a narůstajícími zkušenostmi radiologů [1–46].
Předpokladem kvalitní spektroskopické analýzy je dostatečná velikost léze (min. velikost 1,5 – 2 cm3), přesná lokalizace studovaného voxelu (Volume Of Interest; VOI), čímž se vyhneme akvizici nechtěných signálů z objemu mimo oblast zájmu a kvalitnímu potlačení signálu vody. Nezbytnou podmínkou vyšetření je spolupracující pacient. Klinická měření jsou prováděna zejména v poli 1,5T. V posledních letech se již objevují práce na 3T MR přístrojích.
Ve většině publikovaných studií zkoumajících mozkový absces jsou vyšetřována spektra metodou jednovoxelové spektroskopie (Singel Voxel Spectroscopy; SVS). Již se ale objevily práce srovnávající takto získaná měření s metodou spektroskopického zobrazování (Magnetic Resonance Spectroscopic Imaging; MRSI). Vyšetřením získáme neurochemický profil z více voxelů lokalizovaných v různých částech mozku (centrum a stěna abscesu, perifokální edém, kontralaterální hemisféra). Metoda se jeví v diagnostice abscesu příhodnější [5]. Nevýhodou je horší kvalita spekter, větší časová a technická náročnost. S rostoucím pokrokem a vývojem softwaru a MR technik lze předpokládat větší využití v budoucích letech [2]. Lze shrnout, že SVS je metoda, která díky většímu voxelu a dobrému poměru signál/ šum poskytne detailní neurochemickou informaci, zatímco MRSI s větším prostorovým rozlišením charakterizuje heterogenní povahu léze [2,5].
Spektroskopický obraz abscesu
Mozkový absces je v čase se vyvíjející léze se specifickým obrazem – centrum obsahuje nekrotickou mozkovou tkáň, bakterie a zánětlivé buňky – polymorfonukleáry. Nekróza buněčných membrán způsobí uvolnění lipidů (0,8–1,3 ppm) a laktátu (1,3 ppm). Jedná se o nespecifické markery vyplývající z glykolýzy a nekrózy mozkové tkáně. Lze je pozorovat i u nekrotických mozkových tumorů [20,22,46]. Charakteristická pro absces je detekce aminokyselin (AA, 0,90 ppm), acetátu (1,9 ppm), sukcinátu (2,4 ppm) [9–13,15,16,20 – 22,46]. Při korektní lokalizaci objemu zájmu nelze v nekrotické tkáni detekovat základní metabolity mozkové tkáně – neuronální marker N-acetyl aspartát (NAA, 2,01 ppm), cholin jako marker integrity buněčných membrán (3,20 ppm) a marker energetického metabolizmu kreatin (3,03 ppm). Garg et al považují detekci NAA u abscesu za kontaminaci signálu [6,9]. Při detekci NAA nemusí jít vždy nutně o kontaminaci signálu způsobenou nesprávnou lokalizací objemu zájmu pulzní sekvencí, může se jednat o tzv. efekt částečného objemu (partial volume effect), který obecně limituje spektroskopii [10].
Pyogenní absces
Aminokyseliny (leucin, isoleucin, valin) detekované při vyšetření jsou výsledkem rozpadu proteinů vyvolaných proteolytickými enzymy uvolněných mikroorganizmy či polymorfonukleáry v hnisu [10,20 – 22,45,46]. Jsou považovány za citlivý marker zánětu, nicméně jejich absence absces nevylučuje [10].
Infekční mikroorganizmy akcelerovanou glykolýzou a fermentací produkují laktát, acetát a sukcinát [20–22]. V anaerobním prostředí přeměňují glukózu glykolýzou přes pyruvát, který podléhá mléčnému, alkoholovému, smíšenému, propionovému či máselnému kvašení [12,15]. Laktát v abscesové dutině vzniká homofermentativní či heterofermentativní fermentací (př. Streptococcus, Lactobacillus). Acetát je produkt heterofermentativní, propionové či smíšené fermentace (Lactobacillus sp., Propionibacterium sp., Enterobacteriacae) [12]. Acetát je považován za znak infekce. Sukcinát vzniká jako konečný produkt propionového a smíšeného kvašení u rozličných anaerobních bakterií, je pokládán za znak anaerobní infekce [4,16,31,46]. Sukcinát a acetát se jeví jako charakteristické pro pyogenní mozkový absces vyvolaný anaeroby nebo směsí obligátních a fakultativních anaerobů [9,10,13].
V experimentu indukovaný stafylokokový absces u laboratorního potkana je charakteristický detekcí lipidů a laktátu, absencí acetátu, sukcinátu a AA. Nicméně tento obraz je typický i pro multiformní glioblastom a je nutné ho dalšími modalitami odlišit [14]. Obdobný nález pro stafylokokový absces dokládají Garg et al [9]. U obligatorního aerobního abscesu (Nocardia sp., Pseudomonas aeruginosa) udávají autoři detekci lipidů, laktátu a aminokyselin. V aerobních podmínkách pyruvát vznikající glykolýzou vstupuje do citrátového cyklu, sukcinát a acetát proto nedetekujeme [9,43]. Stručný přehled jevů u zánětlivých změn mozku uvádíme v souhrnné tab. 1.
Tab. 1. Stručný přehled změn u MR spektroskopie zánětlivých onemocnění mozku. 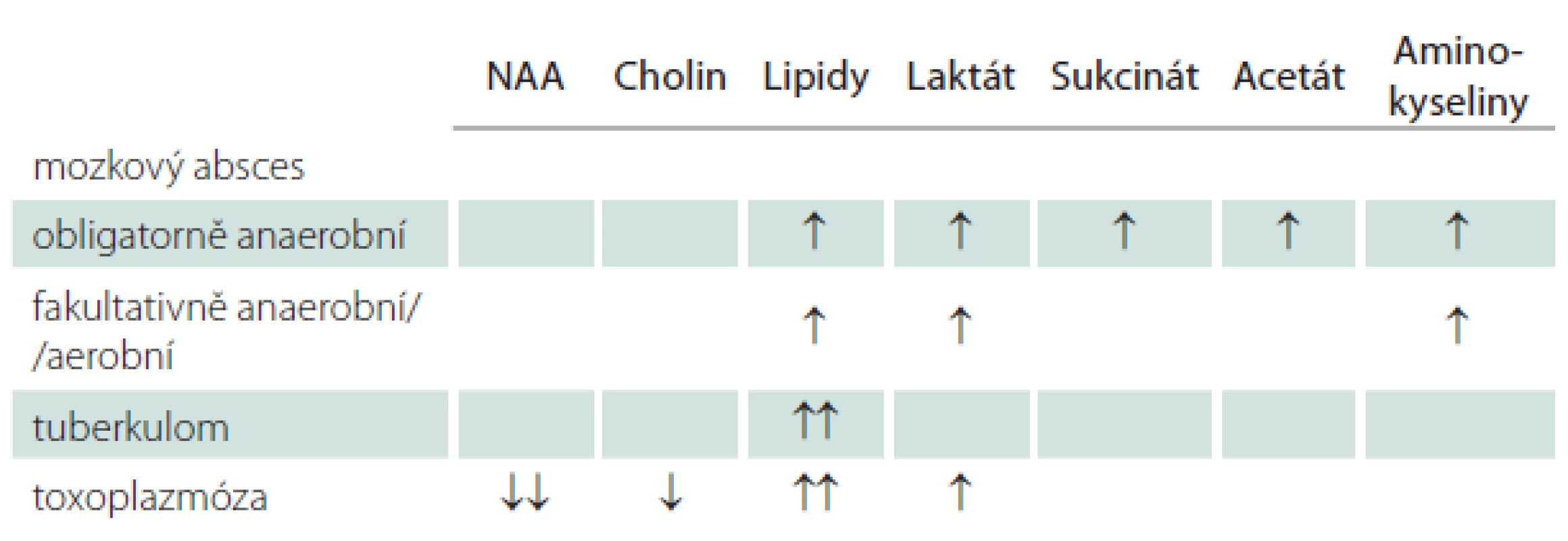
↑ – zvýšen, ↑↑ – velmi zvýšen, ↓ – snížen, ↓↓ – velmi snížen. Možností odlišení anearobní a aerobní etiologie pomocí spektroskopie se zabývalo více autorů. Bajpai et al v souboru 35 pacientů prováděli vyšetření na 3T MR přístroji, hnis vyšetřovali kultivačně a molekulárním vyšetřením (PCR, 16S rRNA sekvenace). Pozitivní kultivace mělo 22 případů (prokázáno 27 původců kultivačně i molekulárně), zbylých 13 mělo sterilní půdy. Zde molekulární vyšetření prokázalo 16 mikroorganizmů (třikrát smíšenou infekci). Spektroskopicky prokázali dvě charakteristické skupiny metabolitů – lipidy-laktát-AA u aerobů/ fakultativních anaerobů. U obligatorních aneaerobů detekovali lipidy-laktát-AA-sukcinát s/ bez přítomnosti acetátu. Statistické zhodnocení ukazovalo vysokou senzitivitu i specificitu pro uvedené rozdělení u kultivačně pozitivních i negativních nálezů (87,5–100 %). Výsledky považují autoři za slibné, za nezbytné pokládají potvrzení dalším výzkumem [11].
Atypické agens (tuberkulom, fungální absces)
V případě tuberkulomů, fungálních abscesů (nejčastěji kryptokokových) a parazitóz (toxoplazmóza) nebyly detekovány aminokyseliny [27,31]. Obecně jsou práce zabývající se spektroskopickou diagnostikou fungálních lézí charakteru kazuistických sdělení. Santy et al v souboru čtyř pacientů s TBC abscesem popisují výraznou elevaci lipidů ve spektrech [17]. Nález vysvětlují relativním nedostatkem proteolytických enzymů v tuberkulózním exsudátu v porovnání s pyogenním zánětem, a tím nízkou degradací proteinů. Dalším faktorem je dominující obsah lipidů v buněčné stěně mykobakterií [18–19,23,24]. Fuchs et al u mozečkového tuberkulomu pozorovali pouze absenci NAA, bez elevace lipidů [29].
U kryptokokového abscesu Chang et al detekovali pouze elevaci lipidů [30]. Dusak et al v kazuistice cystického septovaného torulomu uvádějí detekci sukcinátu, alaninu, laktátu a lipidů [27]. Za typický znak pro kryptokokózu považují Barker et al elevaci laktátu a lipidů (s vyšším píkem laktátu) [30,31]. U kryptokokové léze chybí dosycování po aplikaci kontrastní látky v T1 váženém obraze, tyto poznatky je možné využít k odlišení toxoplazmózy, lymfomu CNS a pyogenního abscesu, které se zpravidla dosycují [27,32].
Toxoplazmóza mozku bývá spolu s primárním mozkovým lymfomem považována za nejčastější sekundární mozkovou afekci HIV imunokompromitovaných pacientů. Neinvazivní diagnostika a rozlišení charakteru léze bývá obtížné. Dostupná spektroskopická vyšetření poskytují nespecifické výsledky. Obecně lze konstatovat u toxoplazmózy nespecifickou elevaci lipidů a možnou přítomnost laktátu. Mozkový lymfom má obdobný nález, ale navíc detekovatelnou velmi nízkou hladinu NAA s výraznou elevací cholinu [30,34,35].
Diferenciální diagnostika
Význam spektroskopie v diferenciální diagnostice cystických lézí je potvrzen celou řadou prací [6,13,20–22,25,28,36–38]. Mozkový absces charakterizuje při difuzně váženém obrazu vysoká intenzita signálu a nízká hodnota ADC mapy. Mozkový tumor a jeho cystická či nekrotická porce se zobrazuje v difuzně vážném obraze s nízkou intenzitou signálu a vyšší hodnotou ADC mapy. Uvedené parametry neplatí absolutně. Byla publikována řada prací, kde část vyšetřovaných pacientů s tumorem měla při DWI vyšetření charakter odpovídající abscesu [25,28,36,37]. Dále Reddy et al udávají v souboru čtyři mozkové abscesy u tří pacientů s hypointenzitou na DWI [26].
Přínos spektroskopie potvrdili Mishra et al. V souboru celkem osmi z 29 případů abscesu zobrazuje nízkou intenzitu DWI signálu a vysokou hodnotu ADC mapy. Kultivační vyšetření u pěti z osmi pacientů bylo negativní. Pacienti již delší dobu před vyšetřením užívali ATB. Autor předpokládá, že tyto změny pravděpodobně indikují vymizení purulentního obsahu po léčbě. DWI při rozlišení cystické a abscesové léze má senzitivitu 72 % a specificitu 100 %. S využitím spektroskopie stoupá senzitivita na 96 % a specificita je 100 % [25].
Lai et al stanovili u konvenční MR k rozlišení cystických lézí senzitivitu, resp. specificitu 60,9 a 61,9 %. S využitím DWI stoupá senzitivita na 95,2 % a specificita 95,7 %. Spektroskopie samotná má senzitivitu 85,7 % a specificitu 100 %. Kombinací obou technik dosahují senzitivitu 95,2 % a specificitu 100 % [38].
Zobrazení tenzorů difuze (Diffusion Tensor Imaging; DTI) umožňuje popsat difuzi v 3D prostoru a vypočítat průměrnou difuzivitu (MD) a frakční anizotropii (FA) [39]. FA je bezrozměrná hodnota anizotropní difuze a nabývá hodnot od 0 do 1. Nízká hodnota FA znamená izotropní difuzi, vysoká hodnota odpovídá směrovému uspořádání difuze, např. podél drah bílé hmoty. Na rozdíl od FA, MD neobsahuje směrovou informaci, protože je průměrem hodnot vektorů tenzorů difuze. Dle Gupty et al [40] a Nath et al [41] hnis v mozkovém abscesu vykazuje zvýšené hodnoty FA s restrikcí MD v porovnání z jinými cystickými lézemi, které charakterizuje vysoká difuzivita a nízká hodnota frakční anizotropie. Nath et al v souboru 35 pacientů vyšetřovali cystické léze spektroskopií a stanovovali hodnoty MD, FA. Stanovili senzitivitu a specificitu pro odlišení mozkového abscesu od cystického tumoru na 80 a 100 % pro spektroskopii, 75 a 100 % pro průměrnou difuzitivitu, a 100 a 76 % pro frakční anizotropii. Stanovení FA považují za dostatečně senzitivní k predikci abscesu, zatímco spektroskopie a difuzivita je více specifická v rozlišení abscesu a cystického tumoru. Doporučují spektroskopické vyšetření raději kombinovat s DTI než DWI [41].
Vliv terapie na MR obraz (ATB, operace)
Předpokládá se, že vymizení metabolitů bakteriálního původu naznačuje pozitivní odpověď na terapii. Burtscher et al prokázali u nechirurgicky léčeného pacienta vymizení vstupní detekce sukcinátu, acetátu, alaninu, aminokyselin a přetrvávající zvýšenou koncentrací laktátu [45]. Podobné výsledky u dvou pacientů léčených chirurgicky a antibiotiky prezentují Akutsu et al. Po chirurgickém ošetření a medikaci došlo k vymizení sukcinátu, acetátu, AA. Přetrvává nález nespecifického laktátu. [44]. Taktéž Dev et al prokázali vymizení acetátu a pyruvátu týden po chirurgickém ošetření a nasazení medikace [42]. Pouze detekci laktátu u pacienta s mnohočetným miliárním abscesem den po zahájení ATB terapie prezentují Lai et al [10].
Závěr
Využití a význam in vivo protonové MR spektroskopie v diagnosticko-terapeutickém protokolu cystických lézí, zejména mozkového abscesu, vzrůstá. Vyšetření by mělo být standardní součástí multimodálního MR vyšetření těchto lézí. Nespornou výhodou je neinvazivní charakter vyšetření. Využití v diferenciální diagnostice je již potvrzeno. Se zvyšujícím se počtem prací lze předpokládat snahu o širší kategorizaci původce abscesu na základě spektroskopické analýzy (rozlišení aerobní či anaerobní etiologie). Přínosem se jeví taktéž zhodnocení efektu ATB léčby abscesu u inoperabilních pacientů. Další výzkum bude profitovat z nástupu moderních spektroskopických lokalizačních technik a přístrojů s vyšším polem (3T). Dosavadní publikované práce poskytují slibné výsledky, které bude nutné potvrdit dalším výzkumem.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Zdeněk Večeřa
Neurochirurgická klinika
LF OU a FN Ostrava
17. listopadu 1790
708 52 Ostrava
e-mail: cenobite@seznam.cz
Přijato k recenzi: 2. 9. 2014
Přijato do tisku: 22. 1. 2016
Zdroje
1. Alvis-Miranda H, Castellar-Leones SM, Elzain MA, et al. Brain abscess: current management. J NeurosciRural Pract 2013;4(Suppl 1):67 – 81. doi: 10.4103/0976-3147.116472.
2. Starčuk Z, Krupa P, Starčuk Z jr, et al. 1H in vivoMR spektroskopie v klinické neurologii. Neurol Prax 2005;6(3):113 – 39.
3. Oz G, Alger JR, Barker PB, et al. Clinical Proton MR Spectroscopy in Central Nervous System Disorders. Radiology 2014;270(3):658 – 79. doi: 10.1148/radiol.13130531.
4. Demaerel P, Van Hecke P, Van Oostende S, et al. Bacterial metabolism shown by magnetic resonance spectroscopy. Lancet 1994;344(8931):1234 – 5.
5. Hsu SH, Chou MC, Ko CW, et al. Proton MR spectroscopy in patients with pyogenic brain abscess: MR spectroscopic imaging versus single-voxel spectroscopy Eur J Radiol 2013;82(8):1299 – 307. doi: 10.1016/j.ejrad.2013.01.032.
6. Otto D, Henning J, Ernst T. Human brain tumors: assess-ment with in vivo proton MR spectroscopy. Radiology 1993;186(3):745 – 52.
7. Schumacher DJ, Nelson TR, Van Sonnenberg E,et al. Quantification of amino acids in human body fluids by 1 H magnetic resonance spectroscopy: a specific test for the identification of abscess. Invest Radiol 1992;27(12):999 – 1004.
8. Harada M, Tanouchi M, Miyoshi H, et al. Brain abscess observed by localized proton magnetic resonance spectroscopy. Magn Reson Imaging 1994;12(8):1269 – 74.
9. Garg M, Gupta RK, Husain N, et al. Brain abscesses: etiologic categorization with in vivo proton MR spectroscopy. Radiology 2004;230(2):519 – 27.
10. Lai PH, Li KT, Hsu SS, et al. Pyogenic brain abscess: findings from in vivo 1.5-T and 11.7-T in vitro proton MR spectroscopy. AJNR Am J Neuroradiol 2005;26(2):279 – 88.
11. Bajpai A, Prasad KN, Mishra P, et al. Multimodal approach for diagnosis of bacterial etiology in brain abscess. Magn Reson Imaging 2014;32(5):491 – 6. doi: 10.1016/j.mri.2014.02.015.
12. Willett HP. Energy metabolism. In: Joklik WK, Willett HP, Amos DB, eds. Zinsser Microbiology, 19th ed. Stamford, CT: Appleton Lange 1988 : 25 – 43.
13. Tsui EY, Chan JH, Cheung YK, et al. Evaluation of cerebral abscesses by diffusion-weighted MR imaging and MR spectroscopy. Comput Med Imaging Graph 2002;26(5):347 – 51.
14. Himmelreich U, Accurso R, Malik R, et al. Identification of Staphylococcus aureus brain abscesses: rat and human studies with 1H MR spectroscopy. Radiology 2005;236(1):261 – 70.
15. Jurtshuk P. Bacterial metabolism. In: Baron S, ed. Medical Microbiology, 2nd ed. Galveston, TX: University of Texas 1996 : 65 – 84.
16. Britt RH, Engmann DR, Yeager AS. Neuropathological and computerized tomographic findings in experimental brain abscess. J Neurosurg 1981;55(4):590 – 603.
17. Santy K, Nan P, Chantana Y, et al. The diagnosis of brain tuberculoma by (1)H-magnetic resonance spectroscopy. Eur J Pediatr 2011;170(3):379 – 87. doi: 10.1007/s00431-011-1408-7.
18. Russell DG. Who puts the tubercle in tuberculosis? Nat Rev Microbiol 2007;5(1):39 – 47.
19. Karakousis PC, Bishai WR, Dorman SE. Mycobacterium tuberculosis cell envelope lipids and the host immune response. Cell Microbiol 2004;6(2):105 – 16.
20. Chang KH, Song IC, Kim SH, et al. In vivo single voxel proton MR spectroscopy in intracranial cystic masses. AJNR Am J Neuroradiol 1998;19(3):401 – 5.
21. Grand S, Passaro G, Ziegler A, et al. Necrotic tumor versus brain abscess: importance of amino acids detected at 1H MR spectroscopy: initial results. Radiology 1999;213(3):785 – 93.
22. Poptani H, Gupta RK, Jain VK, et al. Cystic intracranial mass lesions: possible role of in vivo MR spectroscopy in its differential diagnosis. Magn Reson Imaging 1995;13(7):1019 – 29.
23. Peng J, Ouyang Y, Fang WD, et al. Differentiation of intracranial tuberculomas and high grade gliomas using proton MR spectroscopy and diffusion MR imaging. Eur J Radiol 2012; 81(12):4057 – 63. doi: 10.1016/j.ejrad.2012.06.005.
24. Kaminogo M, Ishimaru H, Morikawa M, et al. Proton MR spectroscopy and diffusion-weighted MR imaging for the diagnosis of intracranial tuberculomas. Report of two cases. Neurol Res 2002;24(6):537 – 43.
25. Mishra AM Gupta RK, Jaggi RS, et al. Role of diffusion-weighted imaging and in vivo proton magnetic resonance spectroscopy in the differential diagnosis of ring-enhancing intracranial cystic mass lesions. J Comput Assist Tomog 2004;28(4):540 – 7.
26. Reddy JS, Mishra AM, Behari S, et al. The role of diffusion-weighted imaging in the differential diagnosis of intracranial cystic mass lesions: a report of 147 lesions. Surg Neurol 2006;66(3):246 – 50.
27. Dusak A, Hakyemez B, Kocaeli H, et al. Magnetic Resonance Spectroscopy Findings of Pyogenic, Tuberculous and Cryptococcus Intracranial Abscesses. Neurochem Res 2012;37(2):233 – 7. doi: 10.1007/s11064-011-0622-z.
28. Park SH, Chang KH, Song IC, et al. Diffusion weighted MRI in cystic or necrotic intracranial lesions. Neuroradiology 2000;42(10):716 – 21.
29. Fuchs J, Siekmeyer M, Kiess W, et al. Tuberculous cerebellar abscess in a child--role of 1H-magnetic resonance spectroscopy. Klin Padiatr 2012;224(5):318 – 9.
30. Chang L, Miller BL, McBride D, et al. Brain lesions in patients with AIDS: H1 MR spectroscopy. Radiology 1995;197(2):525 – 31.
31. Barket et al. Clinical MR spectroscopy – techniques and applications. MRS in infectious, inflammatory, and demyelinating lesions, Cambridge University Press 2010 : 110 – 24.
32. Mamidi A, DeSimone JA, Pomerantz RJ. Central nervous system infections in individuals with HIV-1 infection. J Neurovirol 2002;8(3):158 – 67.
33. Pomper MG, Constantinides CD, Barker PB, et al. Quantitative MR spectroscopic imaging of brain lesions in patients with AIDS: correlation with 11C-methyl-thymidine PET and thallium-201 SPECT. Acad Radiol 2002;9(4):398 – 409.
34. Kingsley PB, Shah TC, Woldenberg R. Identification of diffuse and focal brain lesions by clinical magnetic resonance spectroscopy. NMR Biomed 2006;19(4):435 – 62.
35. Simone IL, Federico F, Tortorella C, et al. Localized 1H-MR spectroscopy for metabolic characterisation of diffuse and focal brain lesions in patients infected with HIV. J Neurol Neurosurg Psychiatry 1998;64(4):516 – 23.
36. Holtas S, Geijer B, Stromblad L, et al. A ring-enhancing metastasis with central high signal on diffusion--weighted imaging and low apparent diffusion coefficient. Neuroradiology 2000;42(11):824 – 7.
37. Reiche W, Schuchardt V, Hagen T, et al. Differential diagnosis of intracranial ring enhancing cystic mass lesions – role of diffusion-weighted imaging (DWI) and diffusion-tensor imaging (DTI). Clin Neurol Neurosurg 2010;112(3):218 – 25. doi: 10.1016/j.clineuro.2009.11.016.
38. Lai PH, Ho JT, Chen WL, et al. Brain abscess and necrotic brain tumors: discrimination with proton MR spectroscopy and diffusion-weighted imaging. Am J Neuroradiol 2002;23(8):1369 – 77.
39. Herrnberger B. Diffusion tensor magnetic resonance imaging. Nervenheilkunde 2004;23 : 50 – 9.
40. Gupta RK, Hasan KM, Mishra AM, et al. High fractional anisotropy in brain abscesses versus other cystic intracranial lesions. Am J Neuroradiol 2005;26(5):1107 – 14.
41. Nath K, Agarwal M, Ramola M, et al. Role of diffusion tensor imaging matrics and in vivo proton magnetic resonance spectroscopy in the differential diagnsosis of cystic intracranial mass lesions. Magn Reson Imaging 2009;27(2):198 – 206. doi: 10.1016/j.mri.2008.06.006.
42. Dev R, Gupta RK, Poptani H, et al. Role of in vivo proton magnetic resonance spectroscopy in the diagnosis and management of brain abscesses. Neurosurgery 1998;42(4):37 – 43.
43. Pal D, Bhattacharyya A, Husain M, et al. In vivo proton MR spectroscopy evaluation of pyogenic brain abscesses: a report of 194 cases. AJNR Am J Neuroradiol 2010;31(2):360 – 6. doi: 10.3174/ajnr.A1835.
44. Akutsu H, Matsumura A, Isobe T, et al. Chronological change of brain abscess in 1H magnetic resonance spectroscopy. Neuroradiology 2002;44(7):574 – 8.
45. Burtscher IM, Holtas S. In vivo proton MR spectroscopy of untreated and treated brain abscesses. AJNR Am J Neuroradiol 1999;20(6):1049 – 53.
46. Rémy C, Grand S, Lai ES, et al. 1H MRS of human brain abscess in vivo and in vitro. Magn Reson Med 1995;34(4):508 – 14.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2016 Číslo 3- Magnosolv a jeho využití v neurologii
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Pre-motorické a non-motorické príznaky Parkinsonovej choroby – taxonómia, klinická manifestácia a neuropatologické koreláty
- Majú bunkové terapie budúcnosť v liečbe extrapyramidových ochorení? ÁNO
- Mají buněčné terapie budoucnost v léčbě extrapyramidových onemocnění? NE
- Mají buněčné terapie budoucnost v léčbě extrapyramidových onemocnění?
- Atypický parkinsonizmus a frontotemporální demence – klinické, patologické a genetické aspekty
- MikroRNA u cerebrovaskulárních onemocnění – od patofyziologie k potenciálním biomarkerům
- Současné možnosti in vivo protonové (1H) MR spektroskopie v diagnostice mozkového abscesu
- Korelace intenzity fluorescence s proporcionálním zastoupením maligních buněk ve tkáni při resekci glioblastomu s použitím 5-ALA
- Validační studie české verze Bostonského testu pojmenování
- Periprocedurální komplikace a dlouhodobý efekt karotických angioplastik – výsledky z praxe
- Periprocedurální komplikace a dlouhodobý efekt karotických angioplastik – výsledky z praxe
- Baha jako možné řešení jednostranné hluchoty
- Léčba gama nožem u algických syndromů v inervační oblasti nervus glossopharyngeus
- Pacient s homozygozitou mutácie E200K v rodine slovenského klastru genetickej formy Creutzfeldtovej-Jakobovej choroby
- Schwannom nejspíše z krčního sympatiku – kazuistika
- Projekt ncRNAPain
- Využití zolpidemu v neurorehabilitaci pacienta ve stavu minimálního vědomí – kazuistika
- Klinický standard pro diagnostiku a léčbu pacientů s ischemickou cévní mozkovou příhodou a s tranzitorní ischemickou atakou – verze 2016
- Webové okénko
-
Analýza dat v neurologii
LVII. Koncept atributivního rizika v analýze populačních studií – IV. Hodnocení populačního efektu preventivních programů
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Schwannom nejspíše z krčního sympatiku – kazuistika
- Validační studie české verze Bostonského testu pojmenování
- Klinický standard pro diagnostiku a léčbu pacientů s ischemickou cévní mozkovou příhodou a s tranzitorní ischemickou atakou – verze 2016
- Pre-motorické a non-motorické príznaky Parkinsonovej choroby – taxonómia, klinická manifestácia a neuropatologické koreláty
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



