-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaKorelace intenzity fluorescence s proporcionálním zastoupením maligních buněk ve tkáni při resekci glioblastomu s použitím 5-ALA
Correlation of Fluorescence Intensity with the Relative Proportion of Malignant Cells in the Tissue in 5-ALA-guided Resection of Glioblastoma
Aim:
To ascertain correlation between histological findings and the intensity of intraoperative fluorescence. During 5-aminolevulinic acid fluorescence-guided glioblastoma resection, three different levels of fluorescence intensity of the examined tissue can be distinguished in the operative field: 1. red, highly intensive fluorescence zone; 2. pink, moderately intensive fluorescence zone; 3. none, tissue without fluorescence.Groups and methods:
A prospective study of 13 patients who underwent fluorescence-guided glioblastoma surgery. Representative specimens of the corresponding levels of fluorescence intensity were collected for histological examination. The semi-quantitative method was used to evaluation relative proportion of malignant cells in the tissue.Results:
The histological examination from the highly intensive fluorescence zone biopsy samples revealed 75–100% proportion of malignant cells in the tissue. The infiltration reached 50–75% of the examined tissue in the moderately intensive fluorescence zone, and co-existence of glioblastoma and low grade glioma was noted in two cases. In six cases, there were no malignant cells in the negative fluorescence zone. However, seven specimens were positive for malignant cells, with the infiltration rate around 25% of the tissue. The correlation between the fluorescence intensity and the relative proportion of malignant cells in the tissue was statistically significant (p value < 0.001), and high positive predictive value of the fluorescence for the presence of malignant cells (PPV = 92%) was observed.Conclusion:
The intensity of intraoperative fluorescence correlates with the relative proportion of malignant cells in the tissue. The presence of malignant cells beyond observable fluorescence was confirmed in more than a half of the biopsy samples.Key words:
glioblastoma – 5-aminolevulinic acid – fluorescence-guided resection – fluorescence intensity – histopathology
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři: T. Krčík 1,2; P. Buzrla 2,3; K. Křivánková 4; R. Lipina 1,2; M. Smrčka 5
Působiště autorů: Neurochirurgická klinika LF OU a FN Ostrava 1; LF OU v Ostravě 2; Ústav patologie, FN Ostrava 3; Radiodiagnostický ústav, FN Ostrava 4; Neurochirurgická klinika LF MU a FN Brno 5
Vyšlo v časopise: Cesk Slov Neurol N 2016; 79/112(3): 300-306
Kategorie: Původní práce
Souhrn
Cíl:
Objasnění patologicko-anatomického korelátu k intenzitě peroperačně zaznamenané fluorescence. Během fluorescencí navigované resekce glioblastomu mohou být v chirurgickém poli identifikovány tři různé intenzity fluorescence posuzované tkáně za použití kyseliny 5-aminolevulinové: 1. červená, silně intenzivní zóna fluorescence; 2. růžová, slabě intenzivní zóna fluorescence; 3. tkáň bez fluorescence.Soubor a metodika:
Soubor 13 pacientů s multiformním glioblastomem, u kterých byly odebrány reprezentativní vzorky tkáně z příslušných zón intenzity fluorescence k histopatologickému hodnocení. Semikvantitativní metoda byla použita pro hodnocení podílu maligních buněk ve tkáni.Výsledky:
Silně intenzivní zóna fluorescence vykazovala při histologickém hodnocení 75–100% podíl infiltrace nádorových buněk. V zóně se slabou intenzitou fluorescence dosahovala infiltrace 50–75 %, přičemž ve dvou případech byla zaznamenána koexistence glioblastomu a low grade gliomu. V zóně bez fluorescence byly v šesti případech vzorky negativní, v sedmi případech však dosahovalo proporcionální zastoupení maligních buněk kolem 25 % tkáně vzorku. Korelace mezi intenzitou fluorescence a relativním zastoupením maligních buněk ve tkáni dosáhla statistické významnosti (p < 0,001) a potvrdila se vysoká prediktivní hodnota fluorescence pro přítomnost nádorových buněk (PPV = 92 %).Závěr:
Intenzita fluorescence během operace koreluje s proporcionálním zastoupením maligních buněk ve tkáni. Přítomnost maligních buněk byla prokázána i za hranicí pozitivity fluorescence ve více než polovině případů.Klíčová slova:
glioblastom – 5-aminolevulinová kyselina – fluorescencí navigovaná resekce – intenzita fluorescence – histopatologieÚvod
Jednou ze základních biologických a histologických vlastností vysokostupňových gliomů mozku je infiltrativní růst do svého okolí. Tento plynulý přechod do zdravé tkáně výrazně ztěžuje spolehlivou identifikaci rozhraní nádor–zdravá tkáň i při použití operačního mikroskopu. Potřeba lepší identifikace nádorové tkáně je dána množícími se poznatky, že radikálnější resekce vede k prodloužení jak intervalu do progrese nemoci, tak i doby celkového přežití [1–4]. Fluorescencí navigovaná resekce vysokostupňových gliomů mozku je relativně nová neurochirurgická metoda, jejímž primárním atributem je zlepšení peroperační identifikace nádoru v operačním poli [5]. Fluorescenční jev je způsoben nekontrolovanou a nadměrnou syntézou protoporfyrinu IX intracelulárně v gliomových buňkách po zajištění dodávky dostatečného množství jeho prekurzoru kyseliny 5-aminolevulinové (5-ALA) [6]. Protoporfyrin IX je odpovědný za emitované fluorescenční světlo. Podrobnější postup a principy fluorescencí navigované resekce u high grade gliomů byly popsány v našem předchozím sdělení [7]. Pilotní multicentrická randomizovaná studie v Německu potvrdila významný efekt na radikalitu resekce (65 % ve skupině ALA, pouze 36 % v kontrolní skupině) a statisticky významné prodloužení intervalu do progrese (PFS) u pacientů s fluorescencí navigovanou resekcí [8]. V průběhu fluorescencí navigované resekce vysokostupňových gliomů mozku se setkáváme s různou intenzitou emitované fluorescence. Zpravidla klesá směrem k „okrajům“ nádoru. Zajímalo nás, jak se tato intratumorální variabilita intenzity fluorescence projeví v histologickém obraze.
Soubor a metodika
Soubor tvoří prospektivně sledovaná skupina skupina 13 pacientů. Pacienti byli zařazeni na základě předoperačního MR vyšetření, které vykazovalo typické radiologické znaky svědčící pro glioblastom, tj. nález solitárního prstencovitě se sytícího intraaxiálního tumoru, v MR spektroskopii nález vysokého obsahu cholinu, kreatinu a sníženého obsahu N-acetyl aspartátu. Dalšími podmínkami byly fyziologický nález na předoperačním RTG vyšetření hrudníku a nepřítomnost maligního onemocnění v anamnéze. Všichni pacienti byli operováni na Neurochirurgické klinice LF OU a FN Ostrava s použitím peroperační fluorescence a současně byly u nich odebrány histologické vzorky z korespondujících částí nádoru podle intenzity fluorescence. Ve všech případech byl první autor přítomen během výkonu buď jako operatér, nebo asistent. Všem pacientům byl vysvětlen princip a cíle operace a pacienti podepsali informovaný souhlas s výkonem.
Dále v rámci standardní předoperační přípravy bylo u všech pacientů provedeno den před operací MR vyšetření mozku, kde T1 postkontrastní skeny byly použity k výpočtu objemu kontrast enhancující porce nádoru a zároveň využity pro peroperační bezrámovou navigaci (StealthStation®, Medtronic). K operacím s použitím peroperační fluorescence se indikovali pacienti, u kterých byl vysloven předpoklad, že je možné provést radikální exstirpaci kontrast enhancující porce nádoru.
Přibližně 3 hod před plánovaným začátkem operace byla pacientům perorálně podána 5-ALA (Gliolan, Medac) v dávce 20 mg/kg ve formě vodného roztoku. Po uvedení pacienta do celkové anestezie byla provedena resekce nádoru mikrochirurgickou technikou s využitím bezrámové navigace a fluorescence, za pomoci operačního mikroskopu Leica M720 OH5 vybaveného fluorescenčním modulem FL400. Během operace byly identifikovány tři zóny odlišné intenzity fluorescence jednoduchým vizuálním posouzením operačního pole:
zóna 1 – jasně červená intenzivní fluorescence (obr. 1),
zóna 2 – slabší růžovofialová fluorescence u „okraje“ nádoru (obr. 2),
zóna 3 – tkáň bez fluorescence v bezprostřední blízkosti a zevně od zóny 2 (obr. 2).
Obr. 1. Histologický preparát barvený HE ze zóny se silnou intenzitou fluorescence. Infiltrace nádorovými elementy zaujímá 100 % materiálu. Fig. 1. A histological slide stained with HE from the high fluorescence intensity zone. 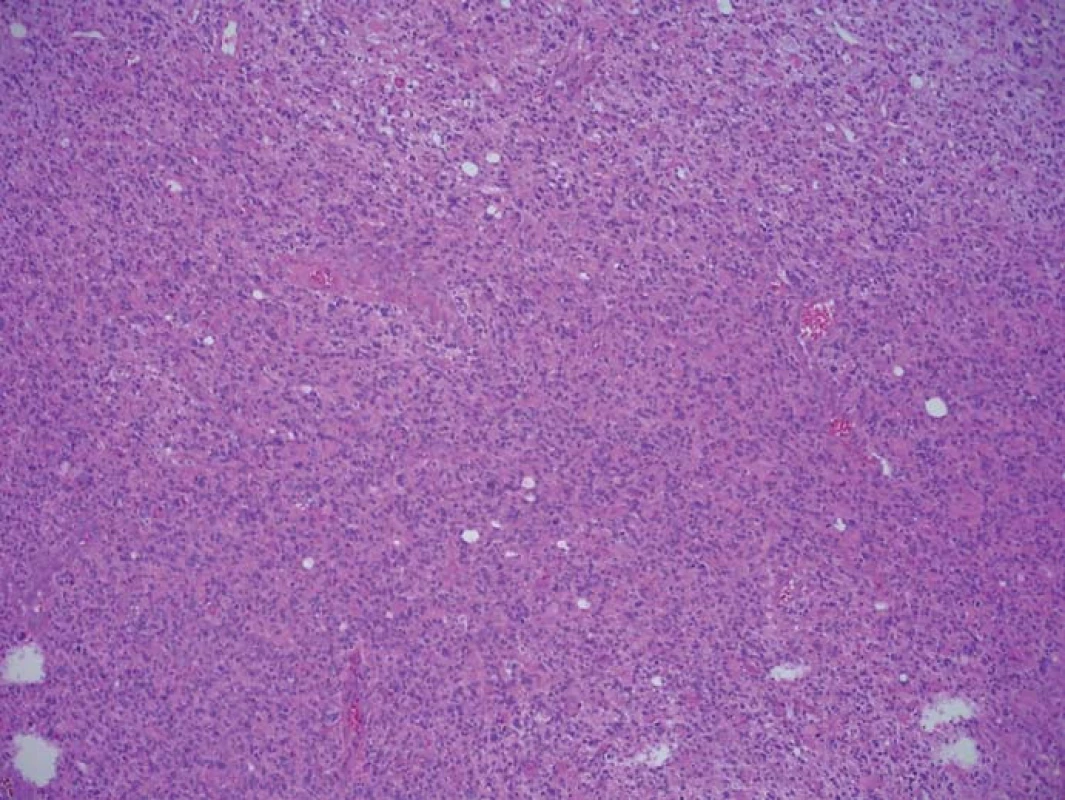
Obr. 2. Histologický preparát ze zóny se slabší intenzitou fluorescence. Nádorové elementy infiltrují parenchym mozku, stupeň infiltrace 50 %. Fig. 2. A histological slide from the low fluorescence intensity zone. 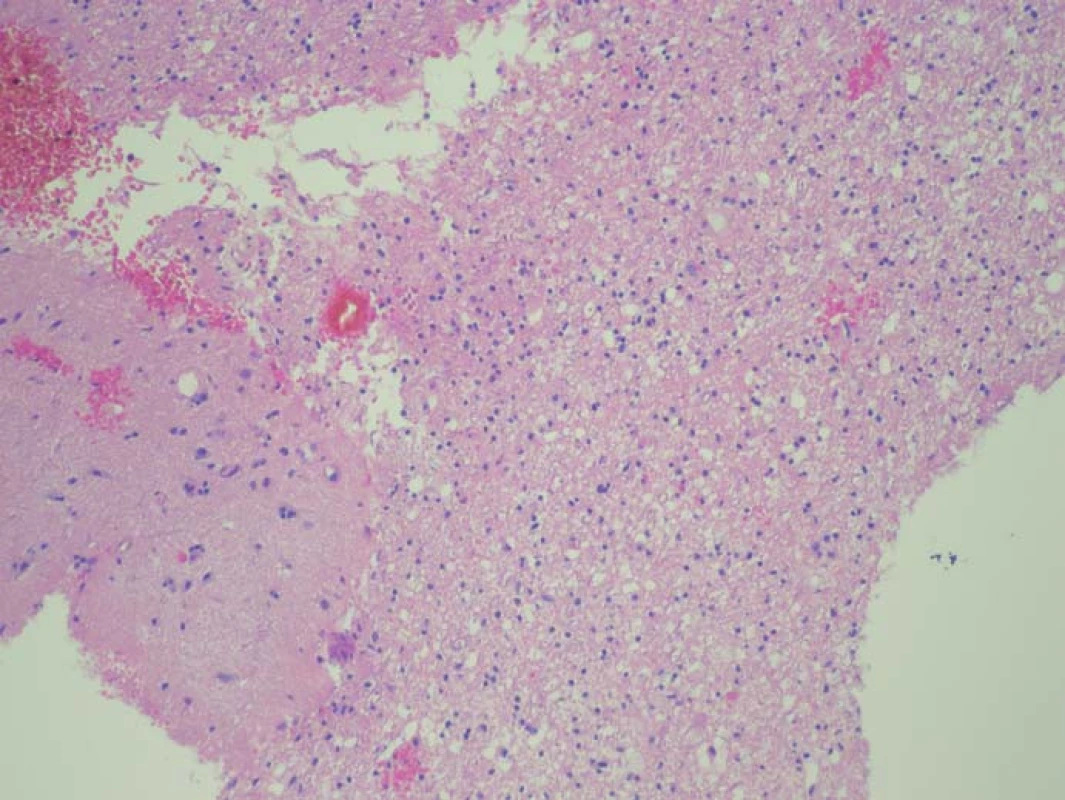
Z každé zóny byly odebrány reprezentativní vzorky, které byly fixovány formalínem a odeslány k definitivnímu histologickému vyšetření. Rozsah resekce byl proveden s ohledem na předoperační plán, aktuální hodnocení vzhledu tkáně v operačním mikroskopu a blízkost elokventních struktur. V indikovaných případech byly použity peroperační kortikální a subkortikální stimulace a elektrofyziologický monitoring. V žádném případě neproběhla resekce pouze na základě přítomnosti/nepřítomnosti fluorescence. Vzorky ze zóny 3 (tj. fluorescenčně negativní) byly odebrány z přístupové cesty anebo z toho okraje postresekční dutiny, který byl považován za bezpečný ve smyslu elokvence, bezprostředně navazujícího na fluorescenčně pozitivní tkáň.
Všechny histologické vzorky byly hodnoceny patologem, který použil barvení hematoxylinem a eosinem a k imunohistochemickému vyšetřování protilátky proti GFAP, Ki67, p53 a u některých pacientů protilátku proti IDH1 (např. při přítomnosti nízkostupňové složky). Kombinace typických cytologických znaků pro malignitu s pozitivním imunohistochemických vyšetřením byla podmínkou k hodnocení buněk jako maligních. Bylo provedeno semikvantitativní hodnocení nádorové infiltrace zaslaného vzorku každé zóny, a to od 0 do 25 %, od 26 do 50 %, od 51 do 75 % a od 76 do 100 %, které udává relativní podíl nádorových buněk k nenádorové tkáni.
Výsledky
Zjištěná data jsou přehledně zobrazena v tab. 1. V zóně 1 s jasně intenzivní fluorescencí byla potvrzena přítomnost nádorové tkáně ve všech vzorcích. V osmi případech vzorek obsahoval pouze nádorovou tkáň (infiltrace 100 %), v pěti případech nádorová infiltrace zaujímala 75 % materiálu. Vzorky z této zóny obsahovaly materiál s vysokou mitotickou aktivitou, četnými mikrovaskulárními proliferacemi s narušenou hematoencefalickou bariérou, svědčící pro vysokou metabolickou činnost a typické maligní znaky nádoru (obr. 3). Ve vzorcích z okraje resekce se slabší intenzitou fluorescence (zóna 2) byla rovněž potvrzena přítomnost nádorových buněk v 10 případech, přičemž procentuální infiltrace nádorovými buňkami se pohybovala od 50 do 75 % materiálu (obr. 4). Známky malignity byly méně vyjádřeny a ve dvou případech byla zaznamenána koexistence difúzního astrocytomu gr. II a glioblastomu (v tomto případě byly vzorky ze zóny 3 negativní), a koexistence anaplastického astrocytomu gr. III a glioblastomu (vzorky ze zóny 3 byly pozitivní pro glioblastom s podílem nádorových buněk do 25 % materiálu). Ve dvou případech nebyly ve vzorcích ze zóny 2 nádorové elementy potvrzeny a vzorky byly hodnoceny jako negativní. Ve vzorcích ze zóny bez pozitivity fluorescence (zóna 3) byla přítomnost nádorové infiltrace prokázána u sedmi případů, přičemž stupeň infiltrace většinou dosahoval do 25 % tkáně vzorku, pouze v jednom případě 75 % (obr. 5). V šesti případech však nádorové elementy nebyly zachyceny a vzorky byly hodnoceny jako negativní.
Tab. 1. V tabulce jsou uvedena zdrojová data jednotlivých pacientů souboru s provedenou volumometrií postkontrastně se sytící porce nádoru před- a pooperačně. A dále procentuální hodnoty relativního zastoupení maligních buněk ve tkáni v příslušných zónách intenzity fluorescence. 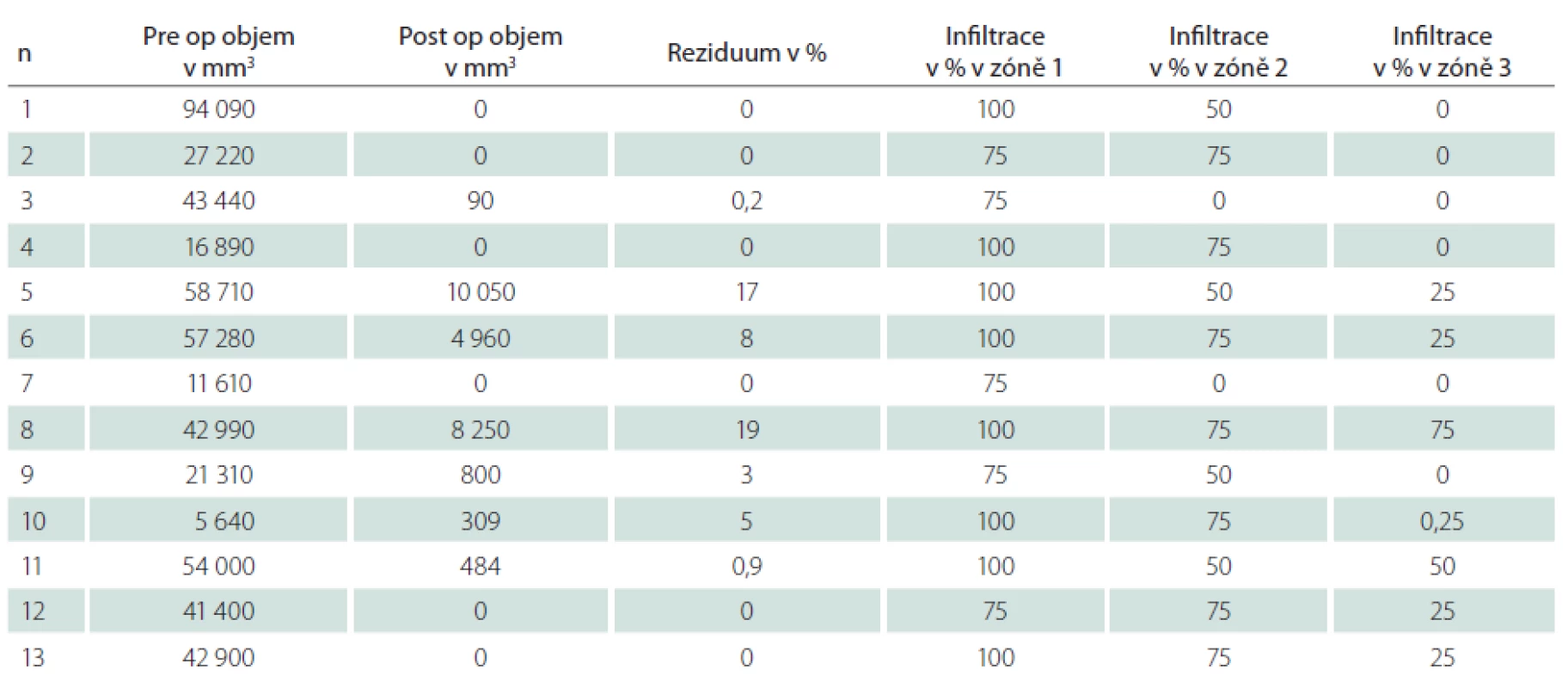
Obr. 3. Histologický preparát z tkáně bez pozitivní fluorescence, bez přítomnosti nádorových elementů. Fig. 3. A histological slide from the tissue with no fluorescence and with no tumor elements. 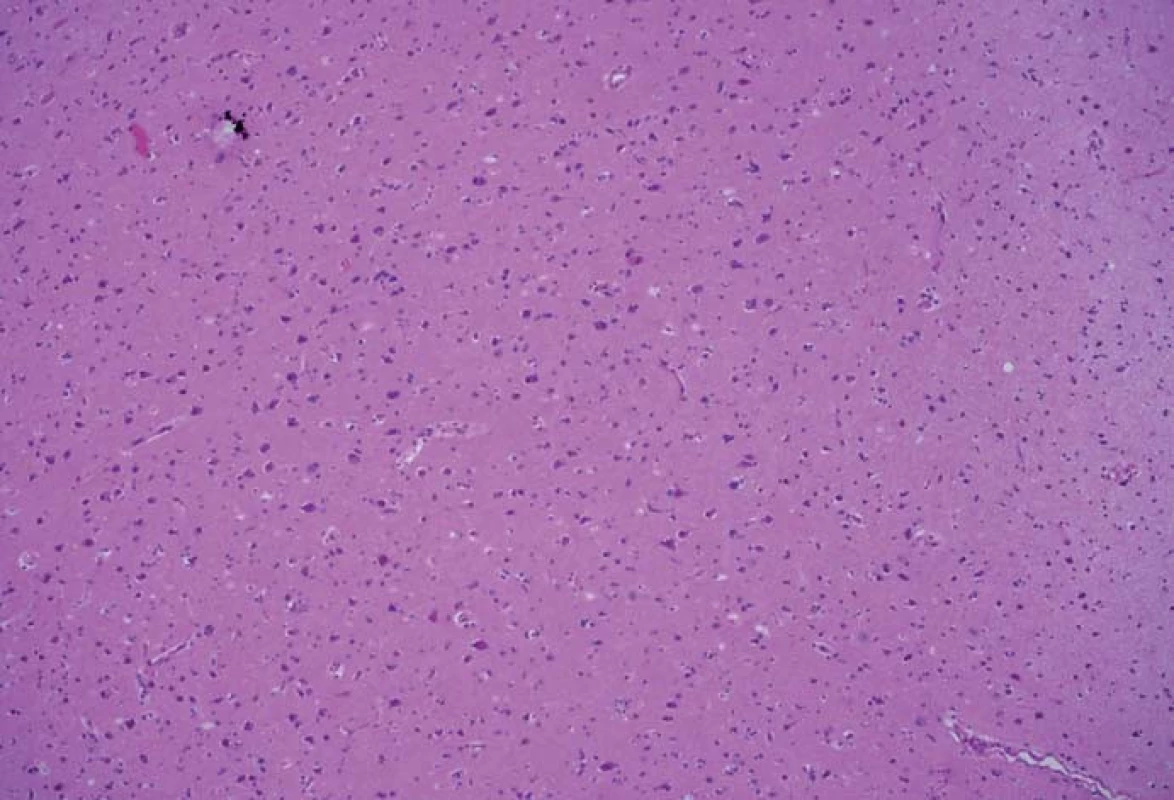
Obr. 4. Fotografie zachycující jasně intenzivní fluorescenci nádoru (zóna 1). Fig. 4. Snapshots depicting bright tumour fluorescence (zone 1). 
Obr. 5. Fotografie zachycující resekční dutinu se slabě růžovou fluorescencí na horním okraji snímku (zóna 2), pod ní je oblast parenchymu již bez viditelné fluorescence (zóna 3). Fig. 5. Snapshots depicting the resection cavity with light pink fluorescence at the upper edge of the image (zone 2), the parenchyma below has no visible fluorescence (zone 3). 
Pro výpočet a statistické hodnocení byla data převedena do tabulky četnosti podílu infiltrace nádorovými buňkami ve vztahu k intenzitě fluorescence (tab. 2). Grafické vyjádření tohoto vztahu je znázorněno v grafu 1. Pearsonův chí-kvadrát test byl použit pro výpočet závislosti mezi intenzitou fluorescence a zastoupením maligních buněk ve tkáni. Byla zjištěna statisticky významná závislost mezi intenzitou fluorescence a procentuálním zastoupením maligních buněk ve tkáni (chí-kvadrát = 42,5077; df = 8; p = 1,087– 6). Pozitivita fluorescence vykazovala vysokou pravděpodobnost přítomnosti nádorových buněk (pozitivní predikční hodnota 92 %), naopak nepřítomnost fluorescence neznamenala současně i absenci nádorových buněk (negativní predikční hodnota 46 %).
Graf 1. Boxplot neboli krabicový graf, který zobrazuje rozdělení podílů maligních buněk ve třech zónách a popisuje charakter rozložení hodnot jako jsou hodnoty mediánů (tečky) a průměrů (čtverečky). 
Přesto, že rozdělení pravděpodobnosti je velmi nesymetrické a nehomogenní, je vidět signifikantní rozdíly v jednotlivých zónách. Celkový podíl maligních buněk ve tkáni klesá v porovnání zóny 1 a 3. Hodnoty 95% konfidenčních intervalů tomu odpovídají: 95% CI zóna 1 (0,82–0,98) p value 7.196e-12; 95% CI zóna 2 (0,39–0,72) p value 8.664e-06; 95% CI zóna 3 (0,05–0,33) p value = 0,01122. Tab. 2. Tabulka četnosti výskytu jednotlivých relativních hodnot infiltrace nádorovými buňkami ve vztahu k intenzitě fluorescence. Podrobíme-li kontingenční tabulku chí-kvadrát testu závislosti hodnot podílů maligních buněk na výskytu v histologických zónách pak z výsledků testu vyplývá signifikantní závislost (p value = 1.087e-06 a to je << 0,05). 
U všech pacientů bylo provedeno měření objemu kontrast enhancující porce nádoru před operací a po ní (tab. 1). Kompletní odstranění kontrast enhancující porce nádoru jsme zaznamenali v šesti případech, ve zbylých případech dosahoval relativní reziduální objem 0,2–19 % předoperační hodnoty (průměr 5,6 %), z toho u dvou pacientů byla ponechána fluorescenčně pozitivní tkáň z důvodu infiltrace tumoru do elokventních struktur (pacienti s pořadovým číslem 5 a 8 v tab. 1).
Neurologický stav byl pooperačně beze změn u devíti pacientů; k přechodnému prohloubení neurologického deficitu došlo u tří pacientů (s návratem do původního stavu během 2–4 dnů); k trvalému zhoršení neurologického stavu došlo u jednoho pacienta.
Diskuze
V této práci jsme se zabývali otázkou, zda má intenzita fluorescence korelát v histopatologickém hodnocení vzorku. U všech 13 zkoumaných pacientů byl diagnostikován multiformní glioblastom gr. IV dle WHO. Pozorovali jsme, že během fluorescencí navigované resekce není intenzita fluorescence v rámci jednoho nádoru rovnoměrná. V nekrotických částech nádoru chybí, ve viabilní části nádoru bývá intenzivní, při „hranici“ nádoru se její intenzita snižuje až ztrácí. Během operace byly odebrány vzorky tkáně ze tří různých oblastí intenzity fluorescence, následně byly histologicky vyšetřeny. Podíl maligních buněk ve vzorcích byl stanoven semikvantitativní metodou. Nejintenzivnější jasně červená fluorescence byla zaznamenána v těch částech nádorové tkáně, která odpovídá maximální koncentraci maligních buněk, s vysokou mitotickou aktivitou, zvýšeným metabolizmem, kde jsou přítomny mikrovaskulární proliferace s poruchou hematoencefalické bariéry. V MR nálezu této oblasti odpovídá jasně kontrast enhancující porce nádoru. Oblasti s nižší intenzitou fluorescence se nacházejí již na rozhraní nádor–okolní tkáň. Stupeň infitrace materiálu maligními elementy dosahoval nejvýše 75 % a vyjádření dalších neoplastických změn bylo rovněž nižší. V MR obrazu této zóně odpovídá oblast perifokálního edému v blízkosti kontrast enhancující porce nádoru. Ve vzorcích z fluorescence negativní zóny byla přítomnost nádorových elementů prokázána v 54 %, a v těchto případech stupeň infiltrace dosahoval kolem 25 % materiálu vzorku. Při nepřítomnosti fluorescence tudíž nelze spolehlivě vyloučit přítomnost nádorových elementů.
Naše pozorování podporuje domněnku, že existuje souvislost mezi intenzitou peroperačně zaznamenané fluorescence a histopatologickým nálezem (graf 2). Podmínkou vzniku jevu fluorescence je intracelulární syntéza protoporfyrinu IX z prekurzoru 5-ALA. K tomu jsou nutné změny intracelulárního metabolizmu nádorových buněk, dále zvýšená neovaskularizace, s narušením hematoencefalické bariéry a umožněním přísunu 5-ALA [9]. Tyto změny jsou ve větší míře vyjádřeny v těch částech nádoru, které obsahují všechny známky malignity, jsou považovány za nejagresivnější části. Směrem k okrajům nádoru postupně ubývá poměrné zastoupení jak maligních buněk, tak i dalších neoplastických změn, jako např. výskyt mikrovaskulárních proliferací spojených s narušením hematoencefalické bariéry, nezbytné podmínce k zajištění transportu 5-ALA k nádorovým buňkám. Intenzita fluorescence postupně klesá, až ji lidské oko ztrácí schopnost zachytit. V tomto momentě se operatérovi jeví obraz v operačním mikroskopu jako negativní, bez přítomnosti fluorescence. V našem souboru pacientů jsme však i v této oblasti ve více než polovině případů prokázali přítomnost nádorových elementů, které infiltrovaly okolní tkáň do 25 % materiálu vzorku. Obdobně se v experimentu zjistilo, že je nutná určitá prahová hustota nádorových buněk, aby byla fluorescence pro pozorovatele viditelná. Nicméně i za touto „hranicí“ je možné prokázat nádorové elementy a fluorescenci pomocí přístroje [10].
Graf 2. Sloupcový graf ilustruje klesající stupeň infiltrace maligních buněk ve tkáni v příslušných zónách dle intenzity fluorescence. 
K podobným výsledkům dospěli Roberts et al, kteří na souboru 11 pacientů zkoumali vztahy mezi intenzitou peroperační fluorescence, znaky na MR zobrazení a histopatologickým nálezem. Bioptické vzorky byly odebrány podle intenzity fluorescence a současně byla zaznamenána i poloha odběrového místa v MR obrazu. Zjistili statisticky významný rozdíl v intenzitě signálu na postkontrastním MR mezi vzorky s pozitivní a negativní fluorescencí. Dále zjistili závislost mezi intenzitou fluorescence a hodnotou histopatologického skóre, které stoupá s výskytem neoplastických změn, pro jeho stupeň postupovali analogicky s klasifikací WHO pro gliomy [11].
Podobnou problematikou se zabývali Stummer et al v prospektivní studii 33 pacientů operovaných pro high grade gliom s použitím fluorescence, kde byly odebírány histologické vzorky s oblastí se „silnou“ a „slabou“ fluorescencí a z tkáně bez fluorescence [12]. Obdobně hodnotili podíl nádorových buněk semikvantitativní metodou s vyjádřením podílu maligních buněk ve vyšetřené tkáni v procentech, přičemž tento parametr nazvali „hustota buněk“ (cell density). Identifikace maligních buněk v odebrané tkáni byla provedena porovnatelně s naší metodikou s použitím imunohistochemických markerů GFAP, Ki-67a p53. Výsledky z jejich práce jsou velmi podobné, hustota maligních buněk ve tkáni se silnou fluorescencí se pohybovala nad 80 %, ve tkáni se slabou fluorescencí od 15 do 50 %, ve tkáni bez fluorescence do hodnoty 25 %. Tyto rozdíly byly rovněž statisticky významné. Velmi podobné hodnoty zjistili i co se týká senzitivity a specificity fluorescence. Pozitivní prediktivní hodnota fluorescence pro přítomnost nádorových buněk dosáhla 92,6 %, negativní prediktivní hodnota 39,5 %, tj. obdobně až v 60,5 % fluorescenčně negativních vzorků byla prokázána přítomnost nádorových buněk.
V našem materiálu, v přechodové zóně slabší fluorescence, jsme ve dvou případech zaznamenali histologický obraz koexistence nádorové tkáně vykazující charakteristické znaky difuzního astrocytomu gr. II dle WHO a anaplastického astrocytomu gr. III dle WHO, tj. oblastí s nižší hodnotou histopatologického skóre. Je známo, že multiformní glioblastom se vyznačuje značnou intratumorální variabilitou a obsahuje heterogenní klony nádorových buněk, které se liší svým genetickým profilem [13]. Piccirillo et al popsali v okrajové zóně multiformního glioblastomu odlišné populace tumorigenních buněk, které na rozdíl od kmenových tumorigenních buněk z centra stejného nádoru nevykazovaly samoobnovovací potenciál in vitro (charakteristika pro „pravé“ kmenové tumorigenní buňky), ale pouze in vivo [14]. Tradiční klonální model tumorigeneze předpokládal, že nádor vzniká proměnou a dediferenciací jedné buňky, ze které proliferací a selekcí vznikají další klony, přičemž postupně převládnou ty agresivní, odpovědné za progresi tumoru [15]. Tato hypotéza tak ale nedokáže vysvětlit, proč jsou v okrajové části glioblastomu nacházeny spíše známky nádoru s nižším stupněm malignity. Tento nález však více odpovídá náborové hypotéze (recruitment hypothesis), kde tzv. tumor progenitorová buňka má schopnost indukovat u normálních neurálních progenitorových buněk metabolické změny vedoucí k nekontrolované proliferaci [16].
Určitým limitem této práce je skutečnost, že odlišení reaktivní gliózy od okraje astrocytomu může být problematické. Některým neuropatologům stačí jen barvení HE, ostatní se spoléhají na imunohistochemické vyšetření s použitím protilátek GFAP, p53, Ki67, WT-1, nestin a IDH1 [17]. Je nutno konstatovat, že Perry a Brat upozorňují, že tyto protilátky nemusí být spolehlivé z důvodu jejich nízké specifity a senzitivity, např. IDH1 má přínos jen v případech, když je glioblastom sekundární (IDH1 je vždy u primárních glioblastomů negativní), p53 může být pozitivní i v reaktivní glióze [18]. V průkazu GFAP jsou pozitivní jak nádorové buňky, tak nenádorové gliální buňky, takže směrem od centra na okraj difuzního astrocytomu se vzdálenost nádorových buněk postupně zvětšuje a tím pádem je na okraji difuzního astrocytomu, resp. v zóně slabé intenzity fluorescence či zóně č. 3 rozlišení mezi nádorovými buňkami a nenádorovými buňkami, když jsou obě pozitivni v průkazu GFAP, problematické. Z těchto důvodů je k mikroskopické verifikaci neoplastického původu zapotřebí kombinovat klasické morfologické hodnocení a imunohistochemické vyšetření [18,19].
Tato práce je první v naší domácí literatuře zabývající se zkoumáním korelace intenzity fluorescence s proporcionálním zastoupením maligních buněk ve tkáni u high grade gliomů. Obdobnou problematikou (odběrem vzorků tkáně infiltrativních gliomů z oblastí s pozitivní a negativní fluorescencí) se zabývali pouze autoři Šteňo et al, kteří použili pozitivitu fluorescence k detekci anaplastických ložisek stupně III u infiltrativních gliomů s nevýrazným postkontrastním sycením na MR [20].
Závěr
Během fluorescencí navigované resekce glioblastomu se intenzita emitované fluorescence může měnit v různých částech nádoru. Intenzita fluorescence koreluje s relativním podílem nádorových buněk ve tkáni. Úbytek intenzity fluorescence na okraji cílového objemu tumoru je doprovázen nejenom relativním úbytkem maligních buněk ve tkáni, ale i úbytkem dalších neoplastických histologických změn. Rozhraní tumor–zdravá tkáň je charakterizováno infiltrativním šířením nádorových elementů do okolí, které bylo zaznamenáno i za hranicí viditelné fluorescence ve více než polovině případů. Nepřítomnost fluorescence není spolehlivý marker pro nepřítomnost nádorových buněk.
Tato práce poukazuje na význam dalšího výzkumu hraniční zóny glioblastomu, která částečně zůstává po neurochirurgické intervenci na místě, a její chování rozhoduje o dalším osudu pacienta.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Tomáš Krčík
Neurochirurgická klinika
LF OU a FN Ostrava
17. listopadu 1790
708 52 Ostrava
e-mail: tomkrcik@gmail.com
Přijato k recenzi: 21. 7. 2015
Přijato do tisku: 13. 1. 2016
Zdroje
1. McGirt MJ, Chaichana KL, Gathinji M, et al. Independent association of extent of resection with survival in patients with malignant brain astrocytoma. J Neurosurg 2009;110(1):156–62. doi: 10.3171/2008.4.17536.
2. Sanai N, Polley MY, McDermott MW, et al. An extent of resection threshold for newly diagnosed glioblastomas. J Neurosurg 2011;115(1):3–8. doi: 10.3171/2011.2.JNS10998.
3. Vecht CJ, Avezaat CJ, van Putten WL, et al. The influence of the extent of surgery on the neurological function and survival in malignant glioma. A retrospective analysis in 243 patients. J Neurol Neurosurg Psychiatry 1990;53(6):466–71.
4. Lacroix M, Abi-Said D, Fourney DR, et al. A multivariate analysis of 416 patients with glioblastoma multiforme: prognosis, extent of resection, and survival. J Neurosurg 2001;95(2):190–8.
5. Stummer W, Stocker S, Wagner S, et al. Intraoperative detection of malignant gliomas by 5-aminolevulinic acid-induced porphyrin fluorescence. Neurosurgery 1998;42(3):518–25.
6. Stummer W, Stocker S, Novotny A, et al. In vitro and in vivo porphyrin accumulation by C6 glioma cells after exposure to 5-aminolevulinic acid. J Photochem Photobiol B 1998;45(2–3):160–9.
7. Krčík T, Lipina R, Paleček T, et al. Fluorescencí navigovaná resekce vysokostupňových gliomů mozku. Cesk Slov Neurol N 2014;77/110(3):308–13.
8. Stummer W, Pichlmeier U, Meinel T, et al. Fluorescence-guided surgery with 5-aminolevulinic acid for resection of malignant glioma: a randomized controlled multicentre phase III trial. Lancet Oncol 2006;7(5):392–401.
9. Collaud S, Juzeniene A, Moan J, et al. On the selectivity of 5-aminolevulinic acid-induced protoporphyrin IX formation. Curr Med Chem Anticancer Agents 2004;4(3):301–16.
10. Kitai R, Takeuchi H, Miyoshi N, et al. Determining the tumor-cell density required for macroscopic observation of 5-ALA-induced fluorescence of protoporphyrin IX in cultured glioma cells and clinical cases. No Shinkei Geka 2014;42(6):531–6.
11. Roberts DW, Valdés PA, Harris BT, et al. Coregistered fluorescence-enhanced tumor resection of malignant glioma: relationships between δ-aminolevulinic acid-induced protoporphyrin IX fluorescence, magnetic resonance imaging enhancement, and neuropathological parameters. J Neurosurg 2011;114(3):595–603. doi: 10.3171/2010.2.JNS091322.
12. Stummer W, Tonn JC, Goetz C, et al. 5-Aminolevulinic acid-derived tumor fluorescence: the diagnostic accuracy of visible fluorescence qualities as corroborated by spectrometry and histology and postoperative imaging. Neurosurgery 2014;74(3):310–9. doi: 10.1227/NEU.0000000000000267.
13. Lee J, Kotliarova S, Kotliarov Y, et al. Tumor stem cellsderived from glioblastomas cultured in bFGF and EGF more closely mirror the phenotype and genotype of primary tumors than do serum-cultured cell lines. Cancer Cell 2006;9(5):391–403.
14. Piccirillo SG, Dietz S, Madhu B, et al. Fluorescence-guided surgical sampling of glioblastoma identifies phenotypically distinct tumour-initiating cell populations in the tumour mass and margin. Br J Cancer 2012;107(3):462–8. doi: 10.1038/bjc.2012.271.
15. Nowell PC. The clonal evolution of tumor cell populations. Science 1976;194(4260):23–8.
16. van der Valk P, Lindeman J, Kamphorst W. Growth factor profiles of human gliomas. Do non-tumour cellscontribute to tumour growth in glioma? Ann Oncol 1997;8(10):1023–9.
17. Schittenhelm J, Mittelbronn M, Nguyen TD, et al. WT1 expression distinguishes astrocytic tumor cellsfrom normal and reactive astrocytes. Brain Pathol 2008;18(3):344 – 53. doi: 10.1111/j.1750-3639.2008.00127.x.
18. Perry A, Brat DJ. Practical surgical neuropathology: a diagnostic approach. Churchill Livingstone, Edinburg, UK 2010 : 63–100.
19. Rivera-Zengotita M, Yachnis AT. Gliosis versus glioma?: don‘t grade until you know. Adv Anat Pathol 2012;19(4):239 – 49. doi: 10.1097/PAP.0b013e31825c6a04.
20. Šteňo A, Illéš R, Rychlý B, et al. Detection of anaplastic foci within infiltrative gliomas with nonsignificant contrast enhancement using 5-aminolevulic acid – a report of five cases. Cesk Slov Neurol N 2012;75/108(2):227 – 32.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2016 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Pre-motorické a non-motorické príznaky Parkinsonovej choroby – taxonómia, klinická manifestácia a neuropatologické koreláty
- Majú bunkové terapie budúcnosť v liečbe extrapyramidových ochorení? ÁNO
- Mají buněčné terapie budoucnost v léčbě extrapyramidových onemocnění? NE
- Mají buněčné terapie budoucnost v léčbě extrapyramidových onemocnění?
- Atypický parkinsonizmus a frontotemporální demence – klinické, patologické a genetické aspekty
- MikroRNA u cerebrovaskulárních onemocnění – od patofyziologie k potenciálním biomarkerům
- Současné možnosti in vivo protonové (1H) MR spektroskopie v diagnostice mozkového abscesu
- Korelace intenzity fluorescence s proporcionálním zastoupením maligních buněk ve tkáni při resekci glioblastomu s použitím 5-ALA
- Validační studie české verze Bostonského testu pojmenování
- Periprocedurální komplikace a dlouhodobý efekt karotických angioplastik – výsledky z praxe
- Periprocedurální komplikace a dlouhodobý efekt karotických angioplastik – výsledky z praxe
- Baha jako možné řešení jednostranné hluchoty
- Léčba gama nožem u algických syndromů v inervační oblasti nervus glossopharyngeus
- Pacient s homozygozitou mutácie E200K v rodine slovenského klastru genetickej formy Creutzfeldtovej-Jakobovej choroby
- Schwannom nejspíše z krčního sympatiku – kazuistika
- Projekt ncRNAPain
- Využití zolpidemu v neurorehabilitaci pacienta ve stavu minimálního vědomí – kazuistika
- Klinický standard pro diagnostiku a léčbu pacientů s ischemickou cévní mozkovou příhodou a s tranzitorní ischemickou atakou – verze 2016
- Webové okénko
-
Analýza dat v neurologii
LVII. Koncept atributivního rizika v analýze populačních studií – IV. Hodnocení populačního efektu preventivních programů
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Schwannom nejspíše z krčního sympatiku – kazuistika
- Validační studie české verze Bostonského testu pojmenování
- Klinický standard pro diagnostiku a léčbu pacientů s ischemickou cévní mozkovou příhodou a s tranzitorní ischemickou atakou – verze 2016
- Pre-motorické a non-motorické príznaky Parkinsonovej choroby – taxonómia, klinická manifestácia a neuropatologické koreláty
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



