-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Nové perorálne antikoagulanciá a krvácanie do horného gastrointestinálneho traktu
New oral anticoagulants and upper gastrointestinal bleeding
Background: Novel oral non-vitamin K antagonist anticoagulants (NOAC) are more effective and safer medications than warfarin to prevent and treat venous thromboembolism and to prevent stroke in patients with atrial fibrillation. Although NOACs are associated with an overall decrease in hemorrhagic complications, findings regarding the incidence of gastrointestinal tract (GIT) bleeding are contradictory. This prospective single-center study aimed to compare the occurrence of upper GIT bleeding during NOAC and warfarin treatment, and to identify risk factors for bleeding.
Methods: A cohort of 80 patients with a mean age of 74.8 years was divided into four equivalent groups. After exclusion of patients with preexisting pathological lesions in the upper GIT mucosa on esophageal-gastroduodenoscopic (EGD) examination at entry, anticoagulation therapy with dabigatran, rivaroxaban, apixaban, or warfarin was initiated. All patients were followed up for 3 months after treatment initiation, with a focus on anamnestic and endoscopic signs of bleeding. In addition, risk factors for bleeding were evaluated.
Results: When anticoagulant therapy was initiated with an intact upper gastrointestinal mucosa, serious or clinically significant GIT bleeding was not detected in any patients treated with warfarin or NOACs. No patients required hospitalization or an additional medical examination. The incidence of bleeding (anamnestic or endoscopically detected) did not differ among the groups (χ2 = 2.8458; p = 0.41608) within 3 months of treatment initiation. The incidence of endoscopically detected, clinically asymptomatic bleeding was moderate in patients treated with warfarin (4/20, 20%), dabigatran (4/20, 20%), rivaroxaban (2/20, 10%), and apixaban (1/20, 5%). The presence of Helicobacter pylori (HP) was a risk factor for upper GIT bleeding (p < 0.05), while the use of proton pump inhibitors (PPIs) was a protective factor (p = 0.206; Spearman’s correlation coefficient = 0.205). No patients experienced continuous bleeding associated with upper GIT biopsy.
Conclusion: In patients with an increased risk of upper GIT bleeding, we believe it is beneficial to perform EGD examination prior to initiating any anticoagulation treatment. Detection and eradication of HP and preventive administration of PPIs are advised in these patients. Biopsy is safe in patients taking NOACs or warfarin.
Doručené/Submitted: 5. 6. 2019
Prijaté/Accepted: 3. 7. 2019
MUDr. Ľubomír Mihalkanin
Gastroenterologická ambulancia
Gastro LM s. r. o.
Jurkovičová 18
080 01 Prešov
mihalkanin@gmail.com
Keywords:
warfarin – NOAC – gastrointestinal bleeding – esophagogastroduodenoscopy – Helicobacter pylori – PPI – endoscopic biopsy
Autoři: Mihalkanin Ľ. 1; Stančák B. 2
Působiště autorů: Gastroenterologická ambulancia, Gastro LM s. r. o., Prešov 1; Východoslovenský ústav srdcových a cievnych chorôb, a. s., Košice 2
Vyšlo v časopise: Gastroent Hepatol 2019; 73(4): 326-332
Kategorie: Klinická a experimentální gastroenterologie: původní práce
doi: https://doi.org/10.14735/amgh2019326Souhrn
Úvod: Nové perorálne antikoagulanciá (NOAK – new oral anticoagulants) sú účinnejšie a bezpečnejšie pri prevencii a liečbe venózneho trombembolizmu a prevencie náhlej cievnej mozgovej príhody u pacientov s fibriláciou predsiení v porovnaní s warfarínom. Hoci sa udáva celkový pokles počtu hemoragických komplikácií, údaje o výskyte krvácania do gastrointestinálneho traktu (GIT) sú rozporuplné. Cieľom tejto prospektívnej štúdie, realizovanej v jednom centre, bolo sledovať výskyt krvácania do horného GIT pri liečbe NOAK a porovnať ho s warfarínom, ako aj identifikovať rizikové faktory pre vznik tohto krvácania.
Metodika: V štúdii bolo zahrnutých 80 pacientov s priemerným vekom 74,8 roka, ktorí boli rozdelení do štyroch rovnakých skupín. Po vylúčení preexistujúcich patologických lézií na sliznici hornej časti GIT pri vstupom vyšetrení pomocou ezofagogastroduodenoskopického vyšetrenia (EGD) bola v jednotlivých skupinách zahájená antikoagulačná liečba dabigatranom, rivaroxabanom, apixabanom a warfarínom. Všetci pacienti boli sledovaní 3 mesiace od začiatku liečby so zameraním na anamnestické a endoskopické známky krvácania. Zároveň sme hodnotili vplyv rizikových faktorov na krvácanie.
Výsledky: Ak bola antikoagulačná liečba začatá pri intaktnej sliznici horného GIT, ani u jedného z našich pacientov liečeného warfarínom alebo NOAK sme nezaznamenali žiadne závažné alebo klinicky významné GIT krvácanie. Žiaden náš sledovaný pacient nevyžadoval hospitalizáciu, resp. mimoriadne lekárske vyšetrenie. Nezistili sme rozdiel vo výskyte krvácania (anamnesticky resp. endoskopicky zisteného) medzi jednotlivými skupinami počas 3 mesiacov liečby (χ2 = 2,8458; p = 0,41608). Pozorovali sme stredný výskyt endoskopicky zisteného, klinicky asymptomatického krvácania – 4/20 (20 %) pacientov liečených warfarínom, 4/20 (20 %) dabigatranom, 2/20 (10 %) rivaroxabanom a 1/20 (5 %) apixabanom. Rizikovým faktorom krvácania do horného GIT bola prítomnosť Helicobacter pylori (HP) u pacientov (p < 0,05), zatiaľ čo protektívnym faktorom užívanie inhibítorov protónovej pumpy (PPI – proton pump inhibitor) (p = 0,206; Spearmanov korelačný koeficient – 0,205). Nezaznamenali sme žiadne pokračujúce krvácanie pri realizácii biopsií v hornom GIT.
Záver: U pacientov so zvýšeným rizikom krvácania do horného GIT považujeme za prospešné realizovať EGD vyšetrenie pred začatím akejkoľvek antikoagulačnej liečby. Vhodné je zisťovanie a eradikácia HP, resp. preventívne podávanie PPI u týchto rizikových pacientov. Podobne ako pri liečbe warfarínom, aj pri liečbe NOAK, je bioptické vyšetrenie bezpečné.
Klíčová slova:
NOAK – warfarin – krvácanie do gastrointestinálneho traktu – ezofagogastroduodenoskópia – Helicobacter pylori – PPI – endoskopická biopsia
Úvod
Nové perorálne antikoagulanciá (NOAK – new oral anticoagulants) sú v súčasnosti už bežnou súčasťou našej klinickej praxe. Majú pevné miesto v antikoagulačnej liečbe venóznej trombózy a pľúcnej embólie, ako aj v prevencii cievnych mozgových príhod a systémovej embolizácie pri nevalvulárnej fibrilácii predsiení.
Aj keď celkový výskyt krvácania do gastrointestinálneho traktu (GIT) v posledných rokoch mierne klesá (horný GIT 100/100 000, dolný GIT 20/100 000), mortalita pri krvácaní ostáva konštantná. Veľmi časté sú recidívy krvácania, ktoré sa vyskytujú až u 20 % pacientov [1]. Na základe publikovaných dát sa zdá, že najmä krvácanie do GIT je „Achillovou pätou“ pri užívaní NOAK. Vyskytuje sa asi v 1,5–2 % pacientov užívajúcich NOAK za rok, z toho je asi 1/3 krvácani do GIT, pričom krvácanie do horného GIT je závažnejšie ako do dolného [2–5]. Ako rizikové faktory tohto krvácania sa udávajú: anémia, predchádzajúce GIT krvácanie, anamnéza vredovej choroby gastroduodéna, antitrombotická liečba, vek, a. hypertenzia, fajčenie, mužské pohlavie, chronická obštrukčná choroba pľúc a renálna insuficiencia. Riziko GIT krvácania je najvyššie v prvých 3 mesiacoch po začatí liečby NOAK [2].
Súčasné klinické štúdie majú viacero obmedzení:
- Na základe inklúznych kritérií sú do štúdií zahŕňovaní len pacienti s nízkym rizikom krvácania do GIT, hoci v bežnej klinickej praxi má 25–40 % pacientov vysoké riziko krvácania, ktoré u nich môže byť 3–15× vyššie [6]. Pacienti s nedávnou anamnézou peptickej vredovej choroby alebo pacienti so zvýšeným rizikom krvácania do GIT (napr. s trombocytopéniou alebo koagulopatiou) boli vylúčení z veľkého množstva štúdií.
- Vo väčšine štúdií sa publikujú len dáta o výskyte krvácania bez bližšej špecifikácie. Ak štúdie predsa len udávajú dáta o gastrointestinálnom krvácaní, jedná sa o závažné krvácania s poklesom hemoglobínu o > 20 g/l alebo vyžadujúcich substitúciu strát dvomi a viacerými jednotkami červených krviniek. Klinicky významné, ale menej závažné krvácania, ktoré nespĺňajú vyššie uvedené kritériá, avšak vyžadujú klinickú intervenciu (neplánovaná návšteva u lekára, nutná zmena liečby, dyskomfort pacienta, ako aj malé krvácania), sa v štúdiách neuvádzajú. To vedie k nedostatočnému vyhodnoteniu rizika klinicky významných gastrointestinálnych krvácaní [7].
- Nakoľko mnohé štúdie sú retrospektívne a zaznamenávajú prítomnosť už vzniknutého krvácania, nie je možné zistiť, či krvácaniu bolo možné predísť a aký je skutočný mechanizmus krvácania.
Vzhľadom na veľkú heterogenitu klinických štúdií je obťažne posúdiť, ktorý preparát NOAK je najbezpečnejší. Nepriama porovnávacia analýza štúdií však naznačuje, že dabigatran v dávke 2 × 150 mg a rivaroxaban podávaný raz denne zvyšujú riziko krvácania do GIT 1,5× oproti warfarínu, kým pri liečbe dabigatranom v dávke 2 × 110 mg a apixabanom je zaznamenaný podobný výskyt krvácania ako pri warfaríne [2,6,8,9].
Cieľom práce bolo prospektívne sledovanie výskytu krvácania do horného GIT definovaného endoskopicky, resp. na základe anamnestických údajov a identifikácia rizikových faktorov podieľajúcich sa na vzniku tohto krvácania z pohľadu gastroenterológa u pacientov liečených NOAK (rivaroxabanom, dabigatranom a apixabanom) a porovnať ich s warfarínom.
Súbor pacientov a metodika
Do nášho súboru sme zaradili pacientov, ktorí boli v období 7/2014–1/2018 indikovaní na perorálnu antikoagulačnú liečbu z dôvodu fibrilácie predsiení, resp. hlbokej žilovej trombózy. So zámerom vylúčenia preexistujúcich patologických lézií v hornom GIT (napr. erozívnych slizničných zmien, prípadne prejavov krvácania, zvyčaje v dôsledku predchádzajúcej liečby nízkomolekulovým heparínom alebo kyselinou acetylosalicylovou) sme pred začatím perorálnej antikoagulačnej liečby realizovali ezofagogastroduodenoskopické vyšetrenie (EGD). Pacienti s takýmito léziami boli z ďalšieho sledovania vylúčení. Do štúdie boli zaradení výlučne pacienti s normálnym endoskopickým nálezom v hornom GIT pri vstupnom vyšetrení. Pri vstupnom a ako aj kontrolnom endoskopickom vyšetrení realizovanom videogastroskopom (Olympus Exera II CV 180 HDTV) sme na porovnanie nálezov vyhotovili fotodokumentáciu piatich oblastí horného GIT: distálny pažerák, telo žalúdka, antrum žalúdka, bulbus duodéna, D2 duodénum (obr. 1).
Obr. 1. Endoskopický nález u pacienta pred antikoagulačnou liečbou. A – D2 duodénum, B – bulbus duodéna, C – antrum žalúdka, D – telo žalúdka, E – distálny pažerák.
Fig. 1. Endoscopic finding in patient before anticoagulant therapy. A – D2 duodenum, B – duodenal bulbus, C – stomach antrum, D – stomach body, E – distal oesophagus.
Pri vstupnom vyšetrení sme u pacientov zisťovali anamnestické údaje (tab. 1), z ktorých sme následne vypočítali CHA2DS2-VASc skóre (C – srdcové zlyhávanie (cardiac failure) – dokumentovaná stredne ťažká až ťažká systolická dysfunkcia, H – hypertenzia, A – vek (age) ≥ 75 rokov, D – diabetes mellitus, S – cievna mozgová príhoda (stroke), V – vaskulárne ochorenie, A – vek (age) 65–74 rokov, Sc – ženské pohlavie (sex category)) a HAS-BLED skóre (H – hypertenzia, A – abnormálna funkcia obličiek/pečene, S – cievna mozgová príhoda (stroke), B – anamnéza alebo predispozícia pre krvácanie (bleeding history or predisposition), L – labilita INR, E – vyšší vek (ederly), D – lieky/alkohol (drug)).
Tab. 1. Prehľad údajov pacientov podľa jednotlivých liekov.
Tab. 2. Overview of patient’s data according to the individual drugs.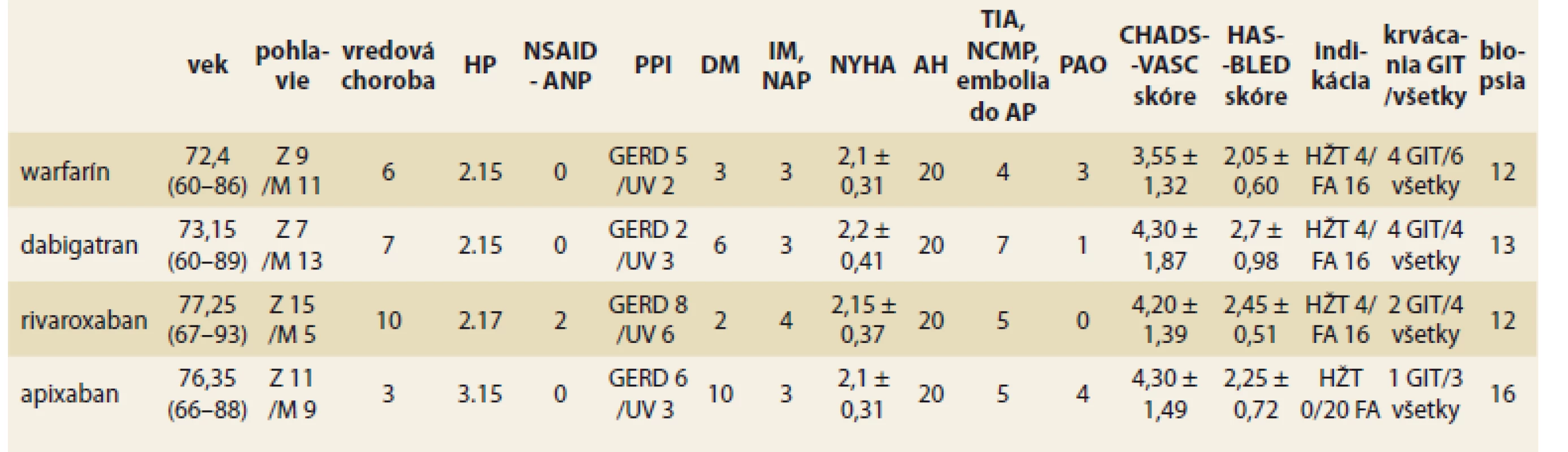
Z – žena, M – muž, HP – Helicobacter pylori, NSAID – nesteroidné antiflogistiká, ANP – anopyrín, PPI – inhibítory protónovej pumpy, GERD – refluxová choroba pažeráka, UV – ulcus ventriculi, DM – diabetes mellitus, IM – infarkt myokardu, NAP – nestabilná angina pectoris, NYHA – trieda srdcového zlyhávania, AH – a. hypertenzia, TIA – tranzitórna ischemická príhoda, NCMP – náhla cievna mozgová príhoda, AP – artéria pulmonalis, PAO – periférne arteriálne ochorenia, HŽT – hlboká žilová trombóza, FA – fi brilácia predsieni, GIT – gastrointestinálny trakt Kontrolné vyšetrenie sme realizovali po 3 mesiacoch od začatia antikoagulačnej liečby, kedže práve v danom období je najvyššie riziko a výskyt krvácania do GIT [2]. Pri endoskópii sme pátrali po slizničných prejavoch krvácania v hornom GIT. Pri ich popise sme použili terminológiu Svetovej organizácie digestívnej endoskópie (ESGE – European society of gastrointestinal endoscopy) [10]. Nálezy sme hodnotili semikvantitatívne. V anamnéze po údajoch možného prebehnutého krvácania (klinického alebo laboratórneho). Sledovali sme súbežné užívanie inhibítorov protónovej pumpy (PPI – proton pump inhibitor) počas antikoagulačnej liečby ako aj dôvod užívania PPI, prípadne iné zmeny liečby u daných pacientov. Prítomnosť, resp. neprítomnosť Helicobacter pylori (HP) (ak údaj nebol zaznamenaný v dokumentácii) sme zisťovali rýchlym ureázovým testom z biopsie z antra a tela žalúdka priamo pri endoskopickom vyšetrení.
Celkovo sme sledovali 80 pacientov – po 20 pacientov v každej skupine liečených NOAK (dabigatranom, rivaroxabanom, apixabanom) a 20 pacientov liečených warfarínom. V skupine pacientov liečených warfarínom sme pri kontrolnej endoskópii odobrali krv za účelom zistenia účinnosti antikoagulačnej liečby (Q test a INR). Do hodnotenia bolo vzatých prvých 20 pacientov s terapeutickou hodnotou Q testu (INR 2,0–3,0).
Štatistické spracovanie
Spracovanie výsledkov pozostávalo z jednorozmernej analýzy variancie, následne z post-hoc Schefého a Newmanovho-Keulsovho testu na porovnávanie skupinových priemerov. V prípade chýbania normality rozdelenia bol použitý neparametrický Mannov-Whitneyho U test. Miera tesnosti štatistickej závislosti sa určovala Spearmanovým korelačným koeficientom (r), štatistická významnosť korelačného koeficienta sa skúmala pomocou Fisherovej z-transformácie. Výsledné dáta sú uvedené ako aritmetický priemer ± smerodajná odchýlka. Alternatívne údaje boli vyhodnocované pomocou kontingenčných tabuliek (χ2), v prípade nízkeho počtu v bunke za použitia Yatesovej korekcie. Za signifikantnú hladinu významnosti pri vyššie uvedených štatistických metódach bola považovaná hodnota p < 0,05.
Výsledky
Pri porovnávaní vstupných údajov jednotlivých skupín pacientov (tab. 1) pomocou jednorozmernej analýzy variancie neboli zistené rozdiely medzi priemermi v triede srdcového zlyhávania NYHA (p = NS), ako ani v CHA2DS2 – VASc skóre (p = 0,345). V HAS – BLED skóre bol nájdený významný rozdiel medzi skupinami (p = 0,038). Najviac rizikoví z pohľadu krvácania v našom súbore boli pacienti liečení dabigatranom a najmenej warfarínom (p = 0,005). Nezistil sa rozdiel vo výskyte HP v jednotlivých skupinách (χ2 = 0,5011; p = 0,918).
Rozdiel vo výskyte krvácania do horného GIT, ako aj celkovo (do horného aj dolného GIT), bol medzi jednotlivými liekmi štatisticky nevýznamný (χ2 = 2,8458; p = 0,41608 resp. χ2 = 4,4192; p = 0,701) (tab. 2, obr. 2).
Obr. 2. Endoskopické nálezy u pacienta so známkami krvácania. A – ojedinelé petéchie v antre žalúdka pri liečbe dabigatranom, B – Cameronove lézie so známkami krvácania pri liečbe dabigatranom, C, D – hemoragická gastropathia pri liečbe warfarínom, E – erózia v antre žalúdka so známkami krvácania pri liečbe rivaroxabanom, F – erózie v antre žalúdka so známkami krvácania pri liečbe apixabanom.
Fig. 2. Endoscopic findings in the patient with bleeding’s signs. A – sporadic petechiae in stomach antrum during dabigatran treatment, B – Cameron’s lesions with bleeding signs during dabigatran treatment, C, D – haemorrhagic gastropathy during warfarin treatment, E – erosions in stomach antrum with bleeding signs during rivaroxaban treatment, F – erosions in stomach antrum with bleeding signs during apixaban treatment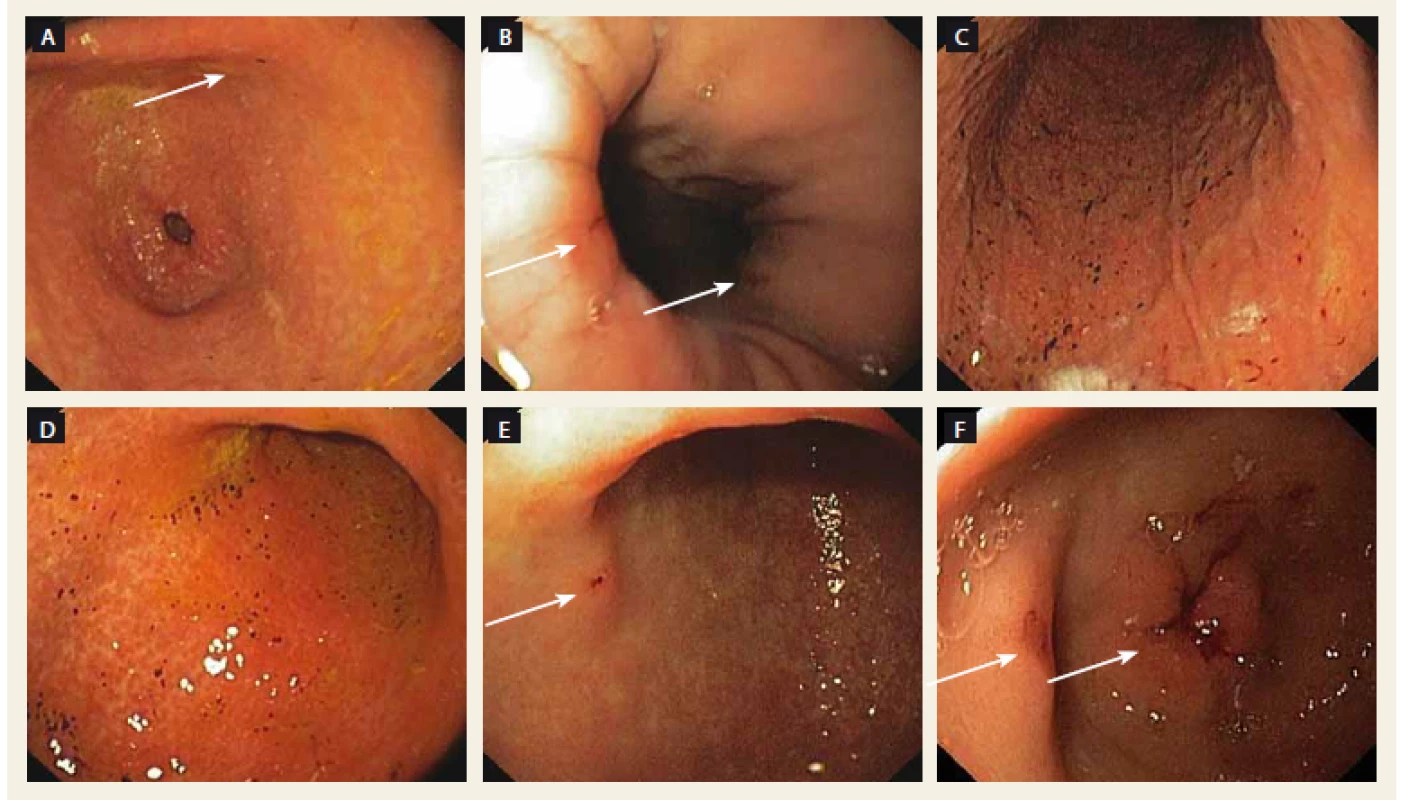
Tab. 2. Prehľad zdrojov krvácania počas antikoagulačnej liečbe.
Tab. 2. Overview of source of bleeding during the anticoagulant treatment.
HP – Helicobacter pylori, negat. – negativný, pozit. – pozitivný, FOBT – fecal occult blood test, EGD – ezofagogastroduodenoskopia Pri analýze liečby PPI pomocou kontingenčných tabuliek (χ2) boli zistené rozdiely pri predpisovaní PPI v jednotlivých skupinách (χ2 = 12,9167; p = 0,00482). Štatisticky významne častejšie (p < 0,005) užívali PPI pacienti liečení rivaroxabanom ako v iných skupinách (bolo tam viac pacientov liečených na refluxovú chorobu pažeráka (GERD – gastroesophageal reflux disease) a pacientov, ktorí preventívne užívali PPI pre anamnézu vredovej choroby) čo môže mať význam pre podhodnotenie množstva krvácavých príhod v skupine pacientov liečených rivaroxabanom.
Korelácia medzi užívaním PPI a výskytom krvácania nebola v našom súbore dokázaná (p = 0,206). Hranične významná hodnota Spearmanovho korelačného koeficienta (r = –0,205) však poukazuje na trend zníženia počtu krvácania u pacientov užívajúcich PPI.
Krvácanie bolo signifikantne častejšie u pacientov s HP celkovo, resp. u pacientov užívajúcich warfarín alebo dabigatran a výskytom HP (p < 0,05). U pacientov s prítomnosťou HP užívajúcich rivaroxaban mohol byť výskyt krvácania podhodnotený užívaním PPI, ako už bolo spomenuté.
Potvrdili sme skutočnosť, že pacienti s vyššou hodnotou CHA2DS2-VASc skóre majú zároveň vyššie HAS-BLED skóre a teda aj zvýšené riziko krvácania. Regresná analýza výskytu krvácania však neukázala vzťah k veku pacientov ani k dávke užívaného NOAK. Nepozorovali sme častejší výskyt krvácania u pacientov s diabetes mellitus.
Diskusia
NOAK preukázali svoju lepšiu účinnosť a bezpečnosť v porovnaní s warfarínom v zníženom výskyte systémovej embolizácie alebo náhlej cievne mozgovej príhody (NCMP) o 19 %, (relative risk (RR)) 0,81; 95% CI 0,73–0,91; p < 0,0001), hlavne hemoragických NCMP o 51 % (RR 0,49; 95% CI 0,38–0,64; p < 0,0001), ako aj mortality pacientov o 10 % (RR 0,90; 95% CI 0,85–0,95) [9].
Krvácanie však naďalej ostáva významným nežiaducim účinkom antikoagulačnej liečby. Prvotné práce poukazovali na častejší výskyt krvácania do GIT pri liečbe NOAK ako pri liečbe warfarínom – Ruff et al v metaanalýze randomizovaných klinických štúdií RE-LY, ROCKET AF, ARISTOTLE a ENGAGE AF-TIME 48 (42 411 pacientov), RR 1,25; 95% CI 1,01–1,55; p = 0,04) [11]. Novšie práce naopak ukazujú vyššiu incidenciu krvácania pri liečbe warfarínom ako NOAK – Cangemi et al v retrospektívnej analýze 6 263 pacientov liečených warfarínom vs. NOAK, RR 4,13; 95% CI 1,69–10,09 [12]. Iné zase nezistili rozdiel vo výskyte GIT krvácania pri liečbe NOAK v porovnaní s konvenčnou antikoagulačnou liečbou – Miller et al v metaanalýze 28 randomizovaných štúdií (129 357 pacientov); veľké krvácania (1,5 vs. 1,3 % resp. RR 0,98; 95% CI 0,80–1,21); krvácania do horného GIT (1,5 vs. 1,6 % resp. RR 0,96; 95% CI 0,77–1,20) [7].
Jednoznačnejšie výsledky sú udávané pri porovnávaní výskytu GIT krvácania medzi warfarínom a jednotlivými NOAK, resp. medzi jednotlivými NOAK. Napr. Miller et al vo svojej metaanalýze zistili zvýšený výskyt veľkého GIT krvácania pri liečbe dabigatranom a rivaroxabanom oproti warfarínu (2,0 vs. 1,4 %, RR 1,27; 95% CI 1,04–1,55 resp. 1,7 vs. 1,3 %, RR 1,4; 95% CI 1,15–1,70), pri liečbe apixabanom sa rozdiel nezistil (0,6 vs. 0,7 %, RR 0,81; CI 95% 0,64–1,02) [7].
Vo veľkej retrospektívnej populačnej štúdii realizovanej Mayo clinic v USA v roce 2017 [13] bol porovnávaný výskyt závažného GIT krvácania len medzi jednotlivými NOAK. Pri porovnaní výskytu krvácania u pacientov liečených apixabanom vs. dabigatranom (31 574 pacientov) a apixabanom vs. rivaroxabanom (13 130 pacientov) bol menší výskyt krvácania pri liečbe apixabanom (RR 0,39 resp. 0,33; CI 95%). Pri porovnaní rivaroxabanu a dabigatranu bolo zaznamenaných o 20 % prípadov GIT krvácaní viac pri liečbe rivaroxabanom (RR 1,2; CI 95%) [13].
Všetky uvedené metaanalýzy a štúdie sú však retrospektívne a hodnotia len závažné a klinicky významné krvácania do GIT. Naša práca bola prospektívna s vylúčením pacientov s preexistujúcimi patologickými léziami na sliznici horného GIT, ktoré by mohli zvýšiť možnosť následného krvácania po začatí liečby warfarínom alebo NOAK. Ak bola antikoagulačná liečba začatá pri intaktnej sliznici horného GIT, ani u jedného z našich pacientov (20 pacientov liečených warfarínom a 60 pacientov s NOAK) sme nezaznamenali žiadne závažné ani klinicky významné krvácanie. Žiaden náš sledovaný pacient nevyžadoval hospitalizáciu ani mimoriadne lekárske vyšetrenie do 3 mesiacov od začiatku liečby. Pri liečbe dabigatranom sme nezaznamenali zvýšený výskyt krvácania popisovaný v literatúre, hoci pacienti v tejto skupine mali vyššie HAS-BLED skóre ako ostatné skupiny pacientov. Pri liečbe rivaroxabanom však mohol byť výskyt krvácania podhodnotený konkomitantnou liečbou PPI. Rozdiel vo výskyte krvácania celkovo, ako aj vo výskyte všetkých endoskopicky zistených prejavov krvácania na sliznici horného GIT po 3 mesiacoch liečby, aj keď ich počet bol dosť vysoký: 4/20 (20 %) pacientov liečených warfarínom, 4/20 (20 %) dabigatran, 2/20 (10 %) rivaroxabanom a 1/20 (5 %) apixabanom, nebol medzi skupinami štatisticky významný. Už aj malé novovzniknuté patologické lézie v hornom GIT však boli s prejavmi krvácania.
Pri konkomitantnej liečbe PPI podávanej pre anamnézu vredovej choroby gastroduodéna resp. GERD bol rozdiel vo výskytu krvácania síce štatisticky nevýznamný, ale predsa len poukazujúci na trend zníženia počtu krvácaní u pacientov užívajúcich PPI. K podobnému záveru dospeli aj Maruyama et al roku 2018, ktorý pomocou regresnej analýzy zistil závislosť anamnézy prekonanej vredovej choroby gastroduodéna a absencie konkomitantnej liečby PPI s incidenciou krvácania do horného GIT [3]. Chan et al udávajú redukciu rizika krvácania o 50 % u pacientov užívajúcich PPI a dabigatran [14].
PPI sa zdajú byť kľúčovými liekmi v prevencii krvácania do horného GIT počas liečby NOAK. U našich pacientov bolo preventívne podávané PPI u 19 z 26 pacientov (73 %) s anamnézou vredovej choroby gastroduodéna a len u dvoch z nich (2/19 (10,5 %)) bolo pozorované slizničné, klinicky asymptomatické krvácanie.
Hoci sa vek nad 75 rokov všeobecne uvádza ako rizikový faktor pre vyšší výskyt krvácania do GIT [2,13,15], v našom súbore pacientov sme tento vplyv nepozorovali. Podobne sme nezaznamenali zvýšený výskyt krvácania v závislosti na dávke užívaného NOAK. Dá sa to vysvetliť aj tým, že u našich pacientov s vekom nad 75 rokov bola dávka NOAK redukovaná.
Ako rizikový faktor pre krvácanie do horného GIT sa však ukázala prítomnosť HP (Spearmanov korelačný koeficient r = 0,528; p < 0,05). U našich pacientov bol výskyt HP len v 14,5 % (6/62 pacientov), ale až u polovice z nich (6/11 pacientov s prejavmi krvácania) po vzniku erozívnych zmien v hornom GIT sme pozorovali endoskopické známky krvácania na daných léziách.
Podľa odporúčaní ESGE (2016) [16] je možné bezpečne vykonať biopsiu v GIT pri liečbe warfarínom za predpokladu, že hodnota INR je v terapeutickom rozmedzí 2,0–3,0. Pri liečbe NOAK sa odporúča vynechať NOAK 24 hod pred endoskopickým vyšetrením s biopsiou. U 12 pacientov liečených warfarínom a 41 pacientov liečených NOAK sme realizovali biopsie pri endoskopickom vyšetrení za účelom zistenia prítomnosti HP. Ani v jednej skupine pacientov nebolo zaznamenané žiadne postbioptické pokračujúce krvácanie, čím sa nám javí realizácia biopsií aj pri štandardnej liečbe NOAK ako bezpečná.
Záver
V našej práci sme prospektívne sledovali výskyt krvácania do horného GIT a zisťovali prítomnosť rizikových faktorov tohto krvácania u pacientov liečených NOAK (dabigatranom, rivaroxabanom a apixabanom) a porovnávali sme ho s warfarínom. Po vylúčení preexistujúcich organických lézií v hornom GIT pri vstupnom EGD vyšetrení sme u žiadneho sledovaného pacienta liečeného NOAK nezistili zvýšený výskyt krvácania v hornom GIT v porovnaní s warfarínom, resp. medzi jednotlivými pacientmi liečenými NOAK po 3 mesiacoch od začatia liečby.
Rizikovým faktorom krvácania do horného GIT sa ukázala prítomnosť HP, kým protektívny vplyv malo užívanie PPI. Na výskyt krvácania nemal vplyv vek, dávka NOAK ani prítomnosť diabetes mellitus u našich pacientov.
Z tohto dôvodu preto považujeme za vhodné u rizikových pacientov pred začatím antikoagulačnej liečby realizovať EGD vyšetrenie. Jedná sa najmä o pacientov užívajúcich nesteroidné antireumatiká alebo kyselinu acetylsalicylovú v období pred začatím antikoagulačnej liečby, ako aj pacientov s anamnézou vredovej choroby gastroduodéna alebo pacientov s dyspeptickými ťažkosťami horného GIT.
Taktiež je isto prospešné zisťovanie a eradikácia HP u pacientov liečených NOAK, resp. warfarínom s cieľom znížiť možnosť vzniku erózií a vredov v hornom GIT a tým následného krvácania.
Ani u jedného pacienta liečeného NOAK resp. warfarínom sme nezaznamenali pri biopsii v hornom GIT postbiop-tické pokračujúce krvácanie, čo hovorí o bezpečnosti tohto výkonu aj počas antikoagulačnej liečby.
Doručené: 5. 6. 2019
Prijaté: 3. 7. 2019
MUDr. Ľubomír Mihalkanin
Gastroenterologická ambulancia
Gastro LM s. r. o.
Jurkovičová 18
080 01 Prešov
Konflikt záujmov: Autori deklarujú, že text článku zodpovedá etickým štandardom, bola dodržaná anonymita pacientov, a vyhlasujú, že v súvislosti s predmetom článku nemajú finančné, poradenské ani iné komerčné záujmy.
Publikačná etika: Príspevok nebol doteraz publikovaný ani nie je v súčasnosti zaslaný do iného časopisu na posúdenie.
Autori súhlasí s uverejnením svojho mena a e-mailového kontaktu v publikovanom texte.
Dedikácia: Článok nie je podporený grantom ani nevznikol za podpory žiadnej spoločnosti.
Redakčná rada potvrdzuje, že rukopis práce splnil ICMJE kritériá pre publikácie zasielané do biomedicínskych časopisov.
Zdroje
1. Jairath V, Desborough MJ. Modern-day management of upper gastrointestinal haemorrhage. Transfus Med 2015; 25 (6): 351–357. doi: 10.1111/tme.12266.
2. Raval AN, Cigarroa JE, Chung MK et al. Man-agement of patients on non-vitamin K antagonist oral anticoagulants in the acute care and periprocedural setting: a scientific statement from the American Heart Association. Circulation 2017; 135 (10); e604–e633. doi: 10.1161/CIR.0000000000000477.
3. Maruyama K, Yamamoto T, Aoyagi H et al. Difference between the upper and the lower gastrointestinal bleeding in patients taking nonvitamin K oral anticoagulants. Biomed Res Int 2018; 7123607. doi: 10.1155/2018/7123607.
4. Majeed A, Hwang HG, Connolly SJ et al. Management and outcomes of major bleeding during treatment with dabigatran or warfarin. Circulation 2013; 128 (21): 2325–2332. doi: 10.1161/CIRCULATIONAHA.113.002332.
5. Caldeira D, Barra M, Ferreira A et al. Systematic review with meta-analysis: the risk of major gastrointestinal bleeding with non-vitamin K antagonist oral anticoagulants. Aliment Pharmacol Ther 2015; 42 (11–12): 1239–1249. doi: 10.1111/apt.13412.
6. Cheung KS, Leung WK. Gastrointestinal bleeding in patients on novel oral anticoagulants: risk, prevention and management. World J Gastroenterol 2017; 23 (11): 1954–1963. doi: 10.3748/wjg.v23.i11.1954.
7. Miller CS, Dorreen A, Martel M et al. Risk of gastrointestinal bleeding in patients taking non-vitamin K antagonist oral anticoagulants: a systematic review and meta-analysis. Clin Gastroenterol Hepatol 2017; 15 (11): 1674–1683. doi: 10.1016/j.cgh.2017.04.031.
8. Camm AJ, Lip GY, de Caterina R et al. 2012 focused update of the ESC guidelines for the management of atrial fibrillation: an update of the 2010 ESC guidelines for the management of atrial fibrillation. Developed with the special contribution of the European Heart Rhythm Association. Eur Heart J 2012; 33 (21): 2719–2747. doi: 10.1093/eurheartj/ehs253.
9. Kirchhof P, Benussi S, Kotecha D et al. 2016 ESC guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur Heart J 2016; 37 (38): 2893–2962. doi: 10.1093/eurheartj/ehw210.
10. Aabakken L, Rembacken B, LeMoine O et al. Minimal standard terminology for gastrointestinal endoscopy – MST 3.0. Endoscopy 2009; 41 (8): 737–728. doi: 10.1055/s-0029-1214 949.
11. Ruff CT, Giugliano RP, Braunwald E et al. Comparison of the efficacy and safety of new oral anticoagulants with warfarin in patients with atrial fibrillation: a meta-analysis of randomised trials. Lancet 2014; 383 (9921): 955–962. doi: 10.1016/S0140-6736 (13) 62343-0.
12. Cangemi DJ, Krill T, Weideman R et al. A comparison of the rate of gastrointestinal bleeding in patients taking non-vitamin K antagonist oral anticoagulants or warfarin. Am J Gastroenterol 2017; 112 (5): 734–739. doi: 10.1038/ajg.2017.39.
13. Abraham NS, Noseworthy PA, Yao X et al. Gastrointestinal safety of direct oral anticoagulants: a large population-based study. Gastroenterology 2017; 152 (5): 1014–1022. doi: 10.1053/j.gastro.2016.12.018.
14. Chan EW, Lau WC, Leung WK et al. Prevention of Dabigatran-related gastrointestinal bleeding with gastroprotective agents: a population-based study. Gastroenterology 2015; 149 (3): 586–595. doi: 10.1053/j.gastro.2015.05.002.
15. Desai J, Kolb JM, Weitz JI et al. Gastrointestinal bleeding with new oral anticoagulants – defining the issues and the management strategies. Thromb Haemost 2013; 110 (2): 205–212. doi: 10.1160/TH13-02-0150.
16. Veitch AM, Vanbiervliet G, Gershlick AH et al. Endoscopy in patients on antiplatelet or anticoagulant therapy, including direct oral anticoagulants: British Society of Gastroenterology (BSG) and European Society of Gastrointestinal Endoscopy (ESGE) guidelines. Endoscopy 2016; 48 (4): c1. doi: 10.1055/s-0042-122686.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2019 Číslo 4- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Klinická a experimentální gastroenterologie
- Kvíz z klinické praxe
- Vývoj inzulinové rezistence po transplantaci jater – prospektivní studie
- Paměťové B lymfocyty v periferní krvi u celiakie – pilotní studie
- Cystická fibróza a exokrinní pankreatická insuficience
- Význam pH-metrie s impedanciou u pacientov s nadmernou supragastrickou eruktáciou
- Vizualizácia aktivity nervov bolesti z orgánov tráviaceho traktu
- Ovplyvňuje liečba inhibítormi protónovej pumpy riziko gastrointestinálneho krvácania u pacientov na liečbe novými orálnymi antitrombotikami?
- Nové perorálne antikoagulanciá a krvácanie do horného gastrointestinálneho traktu
- Inzulinom – příčina těžké hypoglykemie u pacientky s neurologickou symptomatikou
- Dysfagie jako projev nežádoucího účinku antikoagulační terapie
- Neobvyklá manifestace tuberkulózy u pacienta s ulcerózní kolitidou léčeného infliximabem
- Díl IV. – Mortalita a očekávaná doba dožití pacientů s IBD
- OLOMOUC LIVE ENDOSCOPY 2019
- Dvě dekády endoskopické léčby časného karcinomu žaludku v České republice perspektivou kongresu IGCC 2019
- Výběr z mezinárodních časopisů
- Správná odpověď na kvíz
- Kreditovaný autodidaktický test: klinická a experimentální gastroenterologie
- Tofacitinib – první JAK inhibitor v léčbě ulcerózní kolitidy. Začátek terapeutické éry „malých molekul“ u idiopatických střevních zánětů?
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Inzulinom – příčina těžké hypoglykemie u pacientky s neurologickou symptomatikou
- Díl IV. – Mortalita a očekávaná doba dožití pacientů s IBD
- Nové perorálne antikoagulanciá a krvácanie do horného gastrointestinálneho traktu
- Dysfagie jako projev nežádoucího účinku antikoagulační terapie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



