-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Využití kontrastní endosonografie v diagnostice karcinomu pankreatu
Contrast enhanced endosonography in diagnosis of pancreatic cancer
The main objective of this work is to compare the sensitivity and specificity of conventional endosonography (EUS) and contrast enhanced harmonic endosonography (CEH EUS) for the diagnosis of pancreatic cancer. The secondary objective of the project is to determine to what extent the evaluation of CEH EUS is affected by the subjectivity of the endosonographer.
Methods:
A prospective single-center study in patients with pancreatic lesions. The patients were examined by conventional EUS followed by CEH EUS; and an endosonographic-guided fine needle biopsy was performed eventually. The obtained results were compared with the final diagnosis which was based on cytology and further clinical findings in non-operated patients or resection histology in operated subjects. The evaluation was performed for solid tumors, while cystic tumors were excluded. Retrospectively, a second reading of EUS findings was performed by another endosonographer.Results:
We examined 54 patients, the final evaluation included 46 patients with solid tumors, and eight patients were excluded. The sensitivity, specificity, negative predictive value and positive predictive value of conventional EUS for the diagnosis of pancreatic cancer were 82.9%, 45.5%, 45.5% and 82.9%, respectively. For the CEH EUS, the same characteristics achieved 97.1%, 63.6%, 87.5% and 89.5%, respectively. The difference in sensitivity was statistically significant (p = 0.06). The interobserver agreement in the evaluation of EUS was very good (κ = 0.64), in the evaluation for the CEH EUS was satisfactory (κ = 0.45).Conclusion:
CEH EUS is a noninvasive method that allows us to identify pancreatic cancer more accurately than conventional EUS. The subjectivity of CEH EUS evaluation is worse than that of EUS, but is still acceptable.Key words:
contrast enhanced endosonography – fine needle aspiration biopsy – pancreatic cancer
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Submitted:
7. 9. 2014Accepted:
14. 10. 2014
Autoři: B. Bunganič 1; T. Dvořáková 1; M. Laclav 1; K. Kmochová 1; E. Traboulsi 2; O. Májek 3; Š. Suchánek 1; M. Zavoral 1
Působiště autorů: Interní klinika 1. LF UK a ÚVN – VFN Praha 1; Oddělení patologie, ÚVN – VFN Praha 2; Institut biostatistiky a analýz, LF MU, Brno 3
Vyšlo v časopise: Gastroent Hepatol 2014; 68(5): 430-435
Kategorie: Gastrointestinální onkologie: původní práce
doi: https://doi.org/10.14735/amgh2014430Souhrn
Hlavním cílem práce je porovnat senzitivitu a specificitu konvenční endosonografie (EUS) a kontrastní endosonografie (CEH EUS) pro diagnózu karcinomu pankreatu. Mezi vedlejší cíle práce patří zjištění, do jaké míry je hodnocení CEH EUS ovlivněno subjektivitou vyšetřujících.
Metody:
Prospektivní unicentrická studie u pacientů s ložiskovým postižením pankreatu. Pacienti byli vyšetřeni konvenční EUS, poté CEH EUS a nakonec byla provedena endosonograficky navigovaná biopsie tenkou jehlou. Výsledky byly porovnány s konečnou diagnózou. Ta byla založena na výsledku cytologie a dalšího klinického průběhu u neoperovaných nebo výsledku histologie z resekátu u operovaných. Hodnoceny byly pouze solidní tumory, cystické byly z hodnocení vyřazeny. Retrospektivně bylo provedeno druhé čtení EUS nálezů druhým endosonografistou.Výsledky:
Celkem bylo vyšetřeno 54 pacientů, do konečného hodnocení bylo zařazeno 46 nemocných se solidními tumory, osm nemocných bylo vyřazeno. Senzitivita, specificita, negativní prediktivní hodnota a pozitivní prediktivní hodnota konvenčního EUS pro diagnózu karcinomu pankreatu byla 82,9 %, 45,5 %, 45,5 %, resp. 82,9 %. Pro CEH EUS byly tytéž charakteristiky 97,1 %, 63,6 %, 87,5 %, resp. 89,5 %. Rozdíl v senzitivitě byl statisticky hraničně významný (p = 0,06). Interobservační shoda byla při hodnocení EUS velmi dobrá (κ 0,64), při hodnocení CEH EUS byla uspokojivá (κ 0,45).Závěr:
CEH EUS je neinvazivní metoda, která umožňuje identifikovat karcinom pankreatu přesněji než konvenční EUS. Subjektivita hodnocení CEH EUS je horší než při EUS, ale je stále akceptovatelná.Klíčová slova:
kontrastní endosonografie – endosonograficky navigovaná biopsie tenkou jehlou – karcinom pankreatu
Endoskopická ultrasonografie (EUS) se již řadu let uplatňuje v diagnostice karcinomu pankreatu [1–4]. Endosonograficky navigovaná biopsie tenkou jehlou (fine needle aspiration biopsy – FNAB) je považována za zlatý standard v diferenciální diagnostice solidních nádorů pankreatu se senzitivitou i specificitou přibližně 90 % [5–8]. Nicméně vlastní odběr biologického materiálu je považován za invazivní proceduru s 1% rizikem komplikací [9]. FNAB je dále limitována v případě lokalizace tumoru v processus uncinatus pankreatu nebo přítomnosti interponovaných cév [10]. Přesnost FNAB je významně ovlivněna hodnocením vzorku cytopatologem [11]. Asi u 10 % pacientů je navíc nutné odběr opakovat pro nevýtěžnost vzorku [12].
V posledních deseti letech se do praxe rozšířily dvě nové metody rozšiřující možnosti endosonografického zobrazování směrem k neinvazivní diferenciální diagnostice ložisek – EUS elastografie a kontrastní endosonografie (contrast enhanced endosonography – CE EUS). První generace CE EUS byla založena na využití běžného dopplerovského zobrazení, které však neumožňuje vizualizaci drobných cév.
Od roku 2005 je využívána nová technologie (contrast enhanced harmonic endosonography – CEH EUS) [13–15], pomocí které lze sledovat mikrocirkulaci díky velmi citlivým endosonografickým sondám. Tato metoda je založena na odrazu ultrazvukových vln od mikrobublin kontrastní látky, které pod jejich vlivem mění svůj objem. Vibrace vzniklé při rozpínání bublin kontrastní látky se vracejí zpět k ultrazvukové sondě významně jinou frekvencí, než je frekvence vln odražených od okolních tkání. Frekvence odražených vln závisí na velikosti mikrobubliny, použitém plynu a akustické síle ultrazvukových vln endosonografické sondy (ta je vyjádřena mechanickým indexem – MI, který je nastavitelný a měnitelný).
Používané kontrastní látky jsou mikrobubliny speciálních plynů s průměrem menším než 10 µm. Jsou aplikovány do systémové cirkulace, pronikají přes plicní kapiláry do arteriálního systému a nakonec zůstávají na úrovni kapilár v parenchymu orgánů. Jedná se o látky neembolizující a netoxické, nežádoucí účinky jsou při respektování kontraindikací řídké. V současné době se používají nejčastěji látky druhé generace (např. SonoVue®, Sonazoid®).
Metoda kontrastního ultrazvuku v této podobě našla uplatnění zejména při vyšetřování ložiskových lézí parenchymových orgánů (jater, prsní žlázy a slinivky břišní), neboť díky výše popsané schopnosti zobrazit v reálném čase mikrocirkulaci v ložisku umožňuje neinvazivním způsobem zpřesnit diferenciální diagnostiku benigních a maligních lézí [16–19].
Materiál a metody
Do studie byli prospektivně zařazeni pacienti indikovaní k vyšetření pro suspektní či známou ložiskovou lézi pankreatu, kteří podepsali informovaný souhlas se studií. Mezi exkluzní kritéria patřil věk méně než 18 let a kontraindikace podání kontrastní látky SonoVue® (srdeční selhání NYHA IV, akutní koronární syndrom, recentní intervence na koronárních tepnách, recentní zhoršení anginy pectoris, těžká arytmie, těžká plicní hypertenze, známý pravo-levý srdeční zkrat, přecitlivělost na fluorid sodný). Studie byla schválena Etickou komisí ÚVN a použití kontrastní látky bylo schváleno SÚKL.
K provádění CEH EUS byl použit lineární elektronický echoendoskop GF-UCT 180 Olympus a ultrazvukový přístroj Aloka Prosound Alpha 10 vybavený rozšířeným softwarem pro CEH EUS (ExPED). Použitou kontrastní látku druhé generace SonoVue® (Bracco, Itálie) tvořily mikrobubliny sulfurhexafluoridu navázaného na fosfolipidy. K EUS FNA byly použity jehly Pro-Core 19G a 22G (Cook Medical), Expect 19G a 22G (Boston Scientific) a standardní jehly Olympus 22G.
Endosonografické vyšetření bylo prováděno jedním endosonografistou, který byl seznámen s anamnézou i výsledky dosud provedených vyšetření. Endosonografie probíhala za standardní monitorace před výkonem, během něj i po výkonu (krevní tlak, tepová frekvence, saturace O2, v indikovaných případech EKG monitor) a byla podávána běžná premedikace (lokálně Xylocain spray®, nitrožilně Midazolam®, Fentanyl® a Buscopan®).
Nejprve byla provedena konvenční EUS včetně dopplerovského zobrazení. Poté bylo v optimální pozici pro zobrazení vyšetřovaného ložiska aplikováno nitrožilně bolusově 2,4 ml SonoVue® a následně 10 ml fyziologického roztoku k proplachu žíly. Pozorování sycení ložiska probíhalo 2 min a byl vždy pořízen video - a fotozáznam. Mechanický index přístroje byl nastaven na 0,5. V případě potřeby byla dávka SonoVue® zopakována (nejdříve s odstupem 5 min od první aplikace). Po kontrastním vyšetření byla u všech pacientů standardním způsobem provedena FNAB, jež byla vyhodnocena cytopatologem.
Při konvenčním EUS byla u každé léze popsána lokalizace, velikost, homogenita, echogenita a okraje. Jako karcinom bylo označeno ložisko hypoechogenní a nehomogenní a/nebo s nepravidelnými okraji [20]. Pro diagnózu chronické pankreatitidy byla použita Rosemontská kritéria [21].
U CEH EUS byly na základě intenzity průniku kontrastní látky (sycení) tumoru rozlišovány tři typy zobrazení: hypovaskulární (obr. 1), izovaskulární a hypervaskulární vzor. Jako ložisko karcinomu bylo v CEH EUS označeno to, u kterého byl popsán hypoenhancement v arteriální a žilní fázi [22–26].
Obr. 1. Hypoenhancement typický pro karcinom pankreatu s arteriální invazí. Fig. 1. Pancreatic cancer with typical hypoenhancement and with arterial invasion. 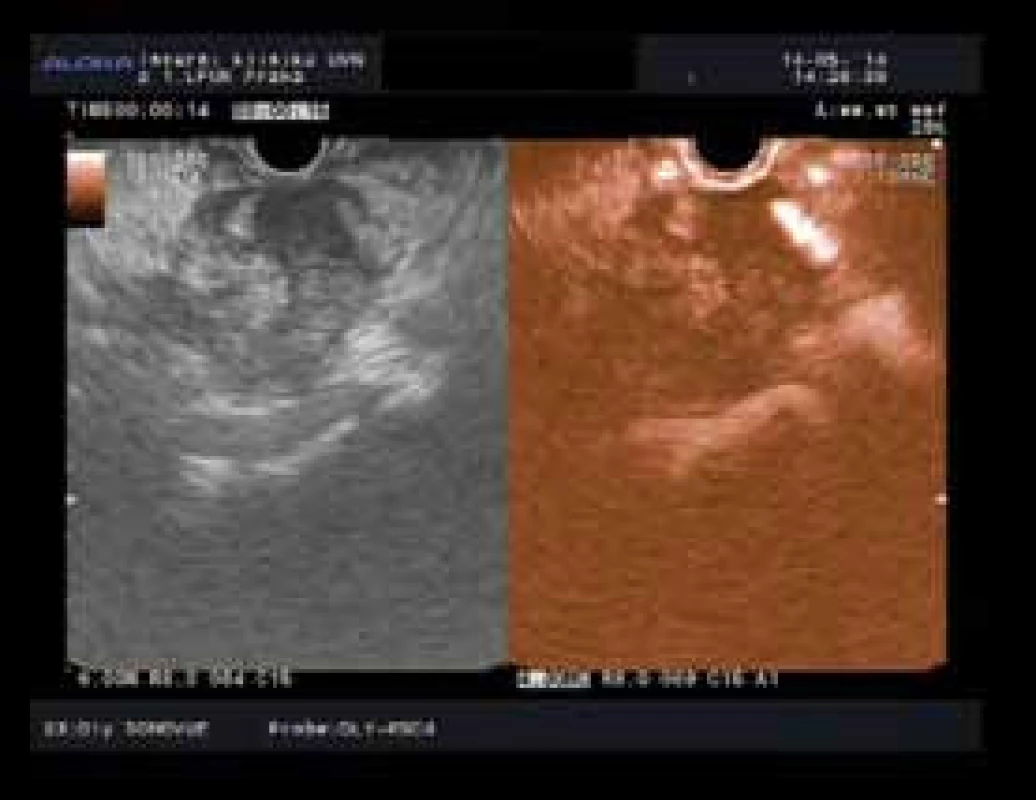
Konečná diagnóza byla stanovena na základě cytologie a dalšího klinického průběhu u neoperovaných nebo výsledku histologie z resekátu u operovaných. Hodnoceny byly pouze solidní tumory, cystické byly z hodnocení vyřazeny.
Retrospektivně pak bylo provedeno druhé čtení nálezů druhým endosonografistou, který provádí standardně konvenční EUS, nicméně bez zkušeností s vyšetřením CEH EUS.
Statistické zpracování
Pro celý soubor pacientů byla zpracována popisná statistika. Senzitivita, specificita, pozitivní prediktivní hodnota (PPV) a negativní prediktivní hodnota (NPV) EUS, CEH EUS pro karcinom pankreatu byly vypočítány spolu s exaktními binomickými intervaly spolehlivosti. Srovnání mezi EUS a CEH EUS bylo provedeno pomocí McNemarova statistického testu. Shoda mezi hodnotiteli byla odhadnuta prostřednictvím kappa (κ) statistiky. Statistické vyhodnocení bylo provedeno v softwarovém nástroji Stata/IC 13.1 (College Station, TX, US).
Výsledky
Od září 2013 do května 2014 bylo vyšetřeno celkem 54 pacientů (31 žen, 23 mužů; průměrný věk 66 let). Z celkového počtu bylo dále hodnoceno 46 pacientů se solidními tumory, pacienti s ostatními nálezy (cystické tumory, akcesorní slezina a normální nález) byli ze studie vyřazeni. Průměrná velikost ložiska byla 34 mm s nejčastější lokalizací v hlavě pankreatu. Základní charakteristika souboru je uvedena v tab. 1. Senzitivita, specificita, PPV a NPV EUS a CEH EUS pro karcinom pankreatu jsou uvedeny v tab. 2, resp. tab. 3. Rozdíl v senzitivitě byl statisticky hraničně významný (p = 0,06). Kritéria užitá pro zjištění karcinomu pankreatu na konvenčním EUS byla falešně pozitivní v šesti případech. Jednalo se o nemocné s konečnou diagnózou karcinomu žaludku, karcinomu duodena, solidního pseudopapilárního tumoru (SPN), dvou neuroendokrinních tumorů (NET) a v jednom případě o chronickou pankreatitidu. Čtyři z těchto šesti nemocných (karcinomy duodena a žaludku, NET a SPN) měli současně hypovaskulární obraz ložiska při CEH EUS. Při CEH EUS vykazovalo 34 karcinomů pankreatu z 35 (97 %) hypovaskulární vzorec sycení. Zbývající případ byl hodnocen jako izovaskulární. Vzhled jednotlivých patologických typů tumorů v CEH EUS je podrobněji popsán v tab. 4. U pěti pacientů bylo nutné aplikovat i druhou dávku SonoVue® (tedy celkem 4,8 ml). Komplikace po podání SonoVue® nebyly zaznamenány.
Tab. 1. Celková charakteristika souboru. Tab. 1. Characteristics of the investigated tumors. 
NET – neuroendokrinní tumor (neuroendocrine tumor), SPN – solidní pseudopapilární neoplazie (solid pseudopapillary neoplasms) Tab. 2. Přesnost konvenčního EUS pro identifikaci karcinomu pankreatu. Jako karcinom bylo hodnoceno ložisko hypoechogenní a zároveň s nepravidelným okrajem. Tab. 2. The accuracy CEH-EUS for pancreatic cancer. As carcinoma were evaluated the hypoechoic bearing and at the same time the bearing with an irregular edge. 
IS – interval spolehlivosti (cofidence interval), PPV – pozitivní prediktivní hodnota (positive predictive value), NPV – negativní prediktivní hodnota (negative predictive value) Tab. 3. Přesnost CEH EUS pro identifikaci karcinomu pankreatu. Jako karcinom bylo hodnoceno ložisko s obrazem hypoenhancementu v arteriální i venózní fázi. Tab. 3. The accuracy of conventional EUS examination for pancreatic cancer. As carcinoma was evaluated the bearing with the image of hypoenhancement in arterial and venous phase. 
IS – interval spolehlivosti (cofidence interval), PPV – pozitivní prediktivní hodnota (positive predictive value), NPV – negativní prediktivní hodnota (negative predictive value) Tab. 4. Vzhled jednotlivých typů tumorů v CEH EUS obraze. Tab. 4. Appearance of various types of tumors in CEH EUS image. 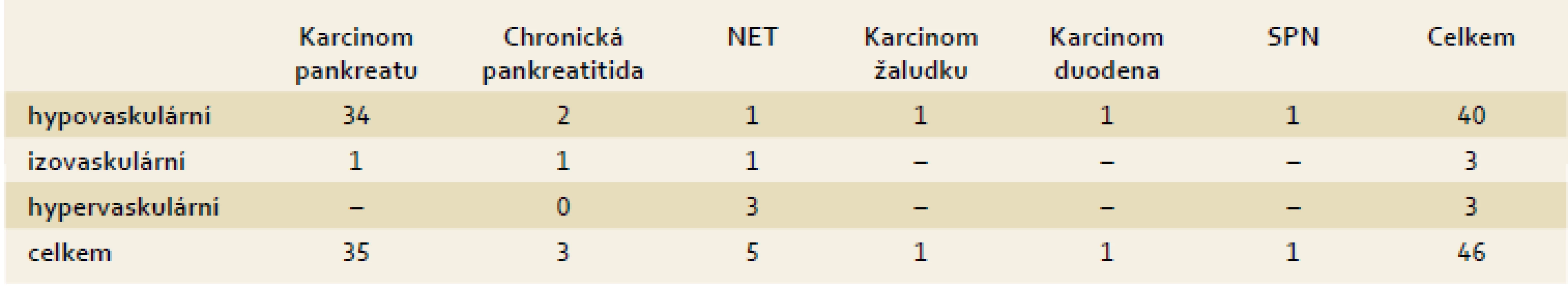
NET – neuroendokrinní tumor (neuroendocrine tumor), SPN – solidní pseudopapilární neoplazie (solid pseudopapillary neoplasms) Interobservační shoda v hodnocení echogenity, homogenity a okrajů tumoru při konvenčním EUS byla dobrá (κ 0,64, resp. 0,64, resp. 0,65). Interobservační shoda byla při hodnocení CEH EUS pro arteriální i žilní fázi uspokojivá (κ 0,43, resp. κ 0,45).
FNAB byla nevýtěžná ve třech případech (6,5 %). Jednalo se o nemocné s konečnou diagnózou karcinomu pankreatu (dva případy) a jeden NET. Oba dva tyto karcinomy byly v CEH EUS obraze hypovaskulární. V jednom případě došlo během FNAB k periprocedurálnímu krvácení, které se spontánně zastavilo, k jiným komplikacím nedošlo.
Diskuze
Zlatý standard v diferenciální diagnostice tumorů pankreatu představuje EUS FNA. Z recentních studií vyplývá, že i CEH EUS umožňuje rozlišit jednotlivé typy nádorů slinivky zobrazením mikrovaskularity ložiska a okolní tkáně [13,27]. Typickým obrazem karcinomu při CEH EUS je hypovaskulární léze, dále je někdy uváděn ještě nehomogenní vzorec sycení. Senzitivita a specificita tohoto kritéria pro karcinom je 89–96 %, resp. 64–88 %, naopak hypervaskularita s vysokou pozitivní prediktivní hodnotou (90–100 %) karcinom vylučuje [22–25]. V popisované studii bylo dosaženo podobných výsledků, 97% senzitivita CEH EUS pro identifikaci karcinomu pankreatu patří mezi nejvyšší dosud publikované hodnoty. Tento výsledek může mít několik důvodů. Publikované studie pracují s relativně malými soubory nemocných (většinou desítky vyšetřovaných). Vzhledem k typickému obrazu karcinomu pankreatu závisí celková přesnost i na jeho procentuálním zastoupení ve studované populaci – čím vyšší, tím je hodnocení jednodušší a výsledná přesnost vyšší. V naší práci představoval karcinom pankreatu 75 % tumorů, naopak ve studii Napoleona et al jen 51 %, Fusaroliho et al 57 %, Dietricha et al 67 % a Kitana et al 73 % [22–25]. Dalším faktem je, že citované práce byly publikovány před několika lety. Jednalo se o pilotní průkopnické projekty a v současné době je metoda již velmi dobře propracována, a bylo tak možné vyhnout se procedurálním chybám.
CEH EUS má při identifikaci karcinomu pankreatu v porovnání s konvenčním EUS statisticky lepší výsledky (tab. 5). Pro srovnání Fusaroli et al [25] uvádějí senzitivitu a specificitu konvenčního EUS pro karcinom pankreatu 86 %, resp. 18 %; pro CEH EUS mají stejné parametry hodnoty 96 %, resp. 64 %. Metodologickým problémem je nastavení kritéria pro karcinom pankreatu v EUS obraze. Zatímco kritérium v CEH EUS zobrazení (hypovaskularita) je typické právě jen pro karcinom, tak pro EUS běžně užívané hypoechogenita, nehomogenita a nepravidelné okraje korespondují s jakoukoli malignitou, tedy i maligním NET nebo např. SPN. Navíc část karcinomů pankreatu nemusí splňovat všechna tři kritéria současně – např. malý tumor nemusí být nehomogenní.
Tab. 5. Porovnání přesnosti jednotlivých vyšetřovacích metod pro diagnózu karcinomu pankreatu. Fig. 5. Comparison of the accuracy of various methods of examination for the diagnosis of pancreatic cancer. 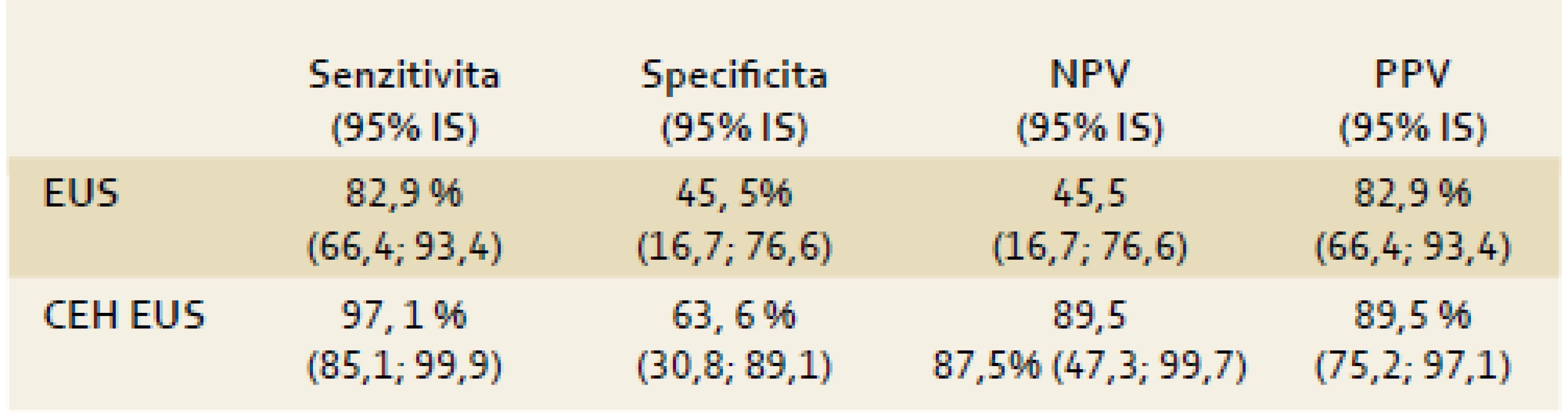
IS – interval spolehlivosti (cofidence interval), PPV – pozitivní prediktivní hodnota (positive predictive value), NPV – negativní prediktivní hodnota (negative predictive value) V případě definice karcinomu jako „hypoechogenita a nehomogenita“ nebo „hypoechogenita a nerovné okraje“ bylo dosaženo senzitivity 82–85 %. Tuto problematiku nejednoznačně stanovené definice lze vypozorovat i v zahraničních studiích, např. ve výše zmiňované Fusaroliho práci, kde je karcinom definován samotnou hypoechogenitou.
Interobservační shoda s prováděním konvenčního EUS nebyla tak vysoká jako v případě japonských autorů (κ 0,95; Kitano et al) [19], nicméně stále uspokojivá (κ 0,95).
Zajímavou otázkou je srovnání přesnosti CEH EUS také s EUS FNA, což nebylo v rámci této studie ze statistických důvodů provedeno. Nicméně při využití dat z předchozí práce skupiny autorů [28], kdy bylo EUS FNA provedeno u 106 pacientů, byla zjištěna senzitivita, specificita, NPV a PPV EUS FNA 75 %, 85 %, 100 % a 100 %. Lze tedy konstatovat, že CEH EUS je minimálně srovnatelné s EUS FNA. Publikované studie uvádějí NPV CEH EUS pro karcinom kolem 85–90 % [22–25]. Tedy pokud je FNAB z ložiska negativní nebo nevýtěžná, ale v CEH EUS se jevil hypovaskulární obraz, dá se s velkou pravděpodobností předpokládat, že se jedná o karcinom (v našem souboru dva nemocní). Tento fakt je z praktického hlediska velmi podstatný. Přestože v současné době jistě nenahradí CEH EUS pozitivní výsledek cytologie před podáním chemoterapie, usnadní rozhodování ve sporných případech. Pokud je EUS FNA negativní a současně pozorujeme hypovaskulární obraz ložiska na CEH EUS, je nutné zvážit indikaci k chirurgické revizi nebo minimálně k opakování EUS FNA. Naopak negativní EUS FNA a současně hypervaskulární obraz ložiska favorizují spíše konzervativní postup [23].
Velké naděje byly do CEH EUS vkládány v otázce diferenciální diagnostiky karcinomu pankreatu a chronické pankreatitidy. Navzdory slibným výsledkům několika studii se ukázalo, že ani tato metoda jednoznačnou odpověď neposkytne [22,29,30]. I v publikovaném souboru byl obraz chronické pankreatitidy v EUS obraze proměnlivý – u dvou nemocných hypovaskulární, v jednom případě izovaskulární.
Byl zachycen jeden neuroendokrinní tumor hlavy pankreatu (inzulinom) velikosti 15 mm, který nebyl zobrazen na CT. Senzitivita EUS a CEH EUS pro nález ložiska je ve srovnání s moderními CT přístroji významně vyšší u lézí menších než 20 mm [4,24,31,32].
Zajímavým vzácným nálezem byl solidní pseudopapilární tumor těla pankreatu (42 mm) u 41leté ženy, jehož obraz v EUS i CEH EUS obraze byl falešně pozitivní pro karcinom (obr. 2). D’Onofrio et al uvádějí ještě hyperenhancement zevního okraje tumoru, který byl pozorován i v tomto případě [33].
Obr. 2. Solidní pseudopapilární nádor s hypoenhancementem a hypervaskularizovaným okrajem. Fig. 2. Solid pseudopapilary tumor with hypoenhancement and hypervascular rim. 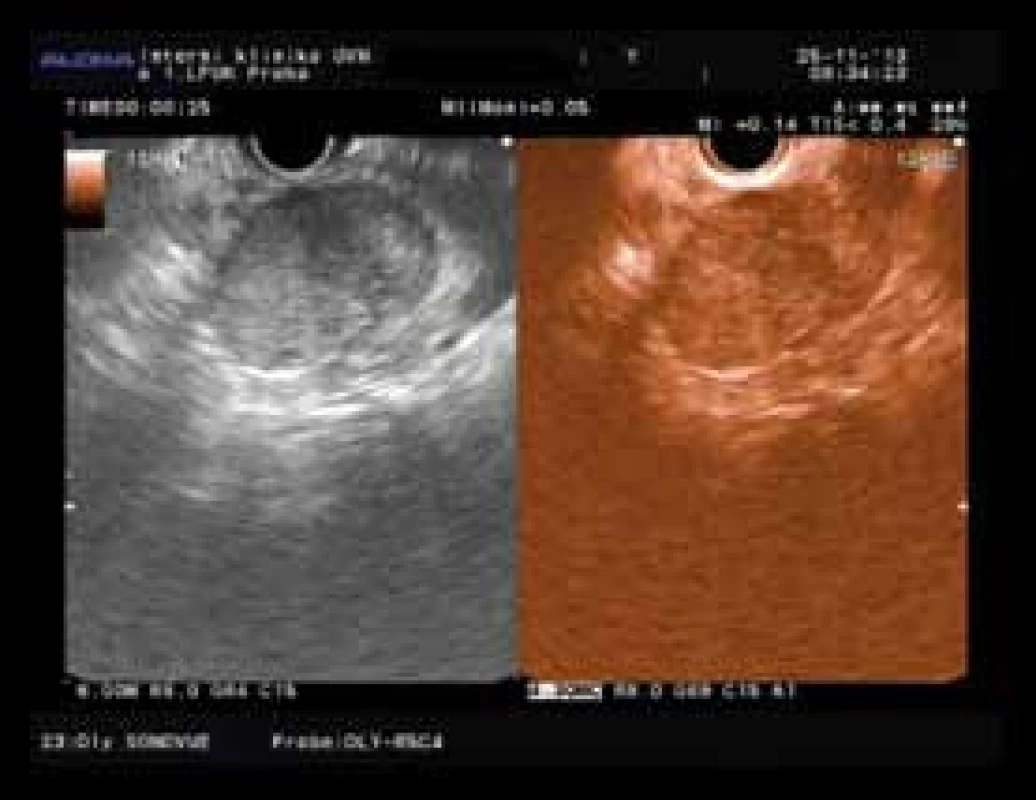
Závěr
Kontrastní endosonografie je moderní neinvazivní metoda, která umožňuje identifikovat ložiskové léze slinivky přesněji než konvenční EUS a zároveň s přesností srovnatelnou s EUS FNA přispívá k jejich diferenciální diagnostice. Její význam vzrůstá zejména ve sporných nejasných případech (např. opakovaně negativní nebo nediagnostické FNAB) nebo u malých ložisek. Míra subjektivity hodnocení CEH EUS je pro běžnou praxi akceptovatelná.
Poděkování
Autoři děkují Ing. Lucii Šťovíčkové za stylistickou úpravu článku a překlad části textu do anglického jazyka.
Práce byla podpořena grantem IGA MZ ČR číslo NT 13638.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 7. 9. 2014
Přijato: 14. 10. 2014
MUDr. Bohuš Bunganič
Interní klinika 1. LF UK a ÚVN – VFN Praha
U Vojenské nemocnice 1200, 160 00 Praha 6
bohus.bunganic@uvn.cz
Zdroje
1. Classen M, Strohm WD, Kurtz W. Pancreatic pseudocysts and tumors in endosonography. Scand J Gastroenterol 1984; 94 (Suppl): 77–84.
2. Yasuda K, Mukai H, Fujimoto S et al. The diagnosis of pancreatic cancer by endoscopic ultrasonography. Gastrointest Endosc 1988; 34(1): 1–8.
3. Palazzo L, Roseau G, Gayet B et al. Endoscopic ultrasonography in the diagnosis and staging of pancreatic adenocarcinoma. Results of a prospective study with comparison to ultrasonography and CT scan. Endoscopy 1993; 25(2): 143–150.
4. Khashab MA, Yong E, Lennon AM et al. EUS is still superior to multidetector computerized tomography for detection of pancreatic neuroendocrine tumors. Gastrointest Endosc 2011; 73(4): 691–696. doi: 10.1016/j.gie.2010.08.030.
5. Eloubeidi MA, Jhala D, Chhieng DC et al. Yield of endoscopic ultrasound-guided fine-needle aspiration biopsy in patients with suspected pancreatic carcinoma. Cancer 2003; 99(5): 285–292.
6. Harewood GC, Wiersema MJ. Endosonography-guided fine needle aspiration biopsy in the evaluation of pancreatic masses. Am J Gastroenterol 2002; 97(6): 1386–1391.
7. Varadarajulu S, Tamhane A, Eloubeidi MA. Yield of EUS-guided FNA of pancreatic masses in the presence or the absence of chronic pancreatitis. Gastrointest Endosc 2005; 62(5): 728–736.
8. Kliment M, Urban O, Cegan M et al. Endoscopic ultrasound-guided fine needle aspiration of pancreatic masses: the utility and impact on management of patients. Scand J Gastroenterol 2010; 45(11): 1372–1379. doi: 10.3109/00365521.2010.503966.
9. Al-Haddad M, Wallace MB, Woodward TA et al. The safety of fine-needle aspiration guided by endoscopic ultrasound: a prospective study. Endoscopy 2008; 40(3): 204–208.
10. Kongkam P, Ang TL, Vu CK et al. Current status on the diagnosis and evaluation of pancreatic tumor in Asia with particular emphasis on the role of endoscopic ultrasound. J Gastroenterol Hepatol 2013; 28(6): 924–930. doi: 10.1111/jgh.12198.
11. Eisendrath P, Ibrahim M. How good is fine needle aspiration? What results should you expect? Endosc Ultrasound 2014; 3(1): 3–11. doi: 10.4103/2303-9027.127122.
12. Iglesias-Garcia J, Dominguez-Munoz JE, Abdulkader I et al. Influence of on-site cytopathology evaluation on the diagnostic accuracy of endoscopic ultrasound-guided fine needle aspiration (EUS-FNA) of solid pancreatic masses. Am J Gastroenterol 2011; 106(9): 1705–1710. doi: 10.1038/ajg.2011.119.
13. Kitano M, Kudo M, Maekawa K et al. Dynamic imaging of pancreatic diseases by contrast enhanced coded phase inversion harmonic ultrasonography. Gut 2004; 53(6): 854–859.
14. Dietrich CF, Ignee A, Frey H et al. Contrast-enhanced endoscopic ultrasound with low mechanical index: a new technique. Z Gastroenterol 2005; 43(11): 1219–1223.
15. Kitano M, Sakamoto H, Matsui U et al. A novel perfusion imaging technique of the pancreas: contrast-enhanced harmonic EUS (with video). Gastrointest Endosc 2008; 67(1): 141–150.
16. Napoleon B. L´echoendoscopie de contraste. Acta Endosc 2010; 40 : 31–34. doi: 10.1007/s10190-010-0017-z.
17. Sanchez MV, Varadarajulu S, Napoleon B. EUS contrast agents: what is available, how do they work, and are they effective? Gastrointest Endosc 2009; 69 (2 Suppl): S71–S77. doi: 10.1016/j.gie.2008.12.004.
18. Fusaroli P, Saftoiu A, Mancino MG et al. Techniques of image enhancement in EUS (with videos). Gastrointest Endosc 2011; 74(3): 645–655. doi: 10.1016/j.gie.2011.03.1246.
19. Kitano M, Kudo M, Sakamoto H et al. Endoscopic ultrasonography and contrast-enhanced endoscopic ultrasonography. Pancreatology 2011; 11 (Suppl 2): 28–33. doi: 10.1159/000323493.
20. Kitano M, Sakamoto H, Komaki T et al. New techniques and future perspective of EUS for the differential diagnosis of pancreatic malignancies: contrast harmonic imaging. Dig Endosc 2011; 23 (Suppl 1): 46–50. doi: 10.1111/j.1443-1661.2011.01146.x.
21. Catalano MF, Sahai A, Levy M et al. EUS-based criteria for the diagnosis of chronic pancreatitis: the Rosemont classification. Gastrointest Endosc 2009; 69(7): 1251–1261. doi: 10.1016/j.gie.2008.07.043.
22. Dietrich CF, Ignee A, Braden B et al. Improved differentiation of pancreatic tumors using contrast-enhanced endoscopic ultrasound. Clin Gastroenterol Hepatol 2008; 6(5): 590–597. doi: 10.1016/j.cgh.2008.02.030.
23. Napoleon B, Alvarez-Sanchez MV, Gincoul R et al. Contrast-enhanced harmonic endoscopic ultrasound in solid lesions of the pancreas: results of a pilot study. Endoscopy 2010; 42(7): 564–570. doi: 10.1055/s-0030-1255537.
24. Kitano M, Kudo M, Yamao K et al. Characterization of small solid tumors in the pancreas: the value of contrast-enhanced harmonic endoscopic ultrasonography. Am J Gastroenterol 2012; 107(2): 303–310. doi: 10.1038/ajg.2011.354.
25. Fusaroli P, Spada A, Mancino MG et al. Contrast harmonic echo-endoscopic ultrasound improves accuracy in diagnosis of solid pancreatic masses. Clin Gastroenterol Hepatol 2010; 8(7): 629–634. doi: 10.1016/j.cgh.2010.04.012.
26. Romagnuolo J, Hoffman B, Vela S et al. Accuracy of contrast-enhanced harmonic EUS with a second-generation perflutren lipid microsphere contrast agent (with video). Gastrointest Endosc 2011; 73(1): 52–63. doi: 10.1016/j.gie.2010.09.014.
27. D´Onofrio M, Martone E, Malago R et al. Contrast-enhanced ultrasonography of the pancreas. JOP 2007; 8 (1 Suppl): 71–76.
28. Salek C, Benesova L, Zavoral M et al. Evaluation of clinical relevance of examining K-ras, p16 and p53 mutations along with allelic losses at 9p and 18q in EUS-guided fine needle aspiration samples of patients with chronic pancreatitis and pancreatic cancer. World J Gastroenterol 2007; 13(27): 3714–3720.
29. Becker D, Strobel D, Bernatik T et al. Echo-enhanced color - and power-Doppler EUS for the discrimination between focal pancreatitis and pancreatic carcinoma. Gastrointest Endosc 2001; 53(7): 784–789.
30. Hocke M, Schulze E, Gottschalk P et al. Contrast-enhanced endoscopic ultrasound in discrimination between focal pancreatitis and pancreatic cancer. World J Gastroenterol 2006; 12(2): 246–250.
31. Sakamoto H, Kitano M, Suetomi Y et al. Utility of contrast-enhanced endoscopic ultrasonography for diagnosis of small pancreatic carcinomas. Ultrasound Med Biol 2008; 34(4): 525–532.
32. Ishikawa T, Itoh A, Kawashima H et al. Usefulness of EUS combined with contrast-enhancement in the differential diagnosis of malignant versus benign and preoperative localization of pancreatic endocrine tumors. Gastrointest Endosc 2010; 71(6): 951–959. doi: 10.1016/j.gie.2009.12.023.
33. D'Onofrio M, Malagò R, Vecchiato F et al. Contrast-enhanced ultrasonography of small solid pseudopapillary tumors of the pancreas: enhancement pattern and pathologic correlation of 2 cases. J Ultrasound Med 2005; 24(6): 849–854.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2014 Číslo 5- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Gastrointestinální onkologie – prevence, diagnostika i léčba
- Zpráva o činnosti výboru České gastroenterologické společnosti za uplynulé volební období
- Vedomostná úroveň na Slovensku o obezite ako rizikovom faktore zhubných nádorov tráviaceho traktu i ďalších orgánov
- Screening kolorektálního karcinomu v ČR po zavedení adresného zvaní – dosavadní výsledky dle dostupných dat
- Kvíz: Je léčená celiakie zdrojem problémů na celý život?
- Cílený screening kolorektálního karcinomu u diabetiků 2. typu a osob s vysokým kardiovaskulárním rizikem – první průběžné výsledky multicentrické prospektivní studie
- Transanal endoscopic microsurgery for rectal cancer at the 3rd Surgical Clinic of the 1st Faculty of Medicine, Charles University and the University Hospital in Motol in 2008–2013
- Nové pohledy na zařazení farmakoterapie do algoritmu léčby jaterních metastáz kolorektálního karcinomu
- Využití kontrastní endosonografie v diagnostice karcinomu pankreatu
- Zařazení režimu FOLFIRINOX do algoritmu léčby metastazujícího karcinomu slinivky břišní – první zkušenosti
- Expandibilné stenty v liečbe benígnych a malígnych ochorení pažeráka
- Rehabilitace a moderní přístup v léčbě syndromu solitárního rektálního vředu
- Péče o IBD pacienty – klinická praxe v gastroenterologických ambulancích sekundárního typu v ČR
- Komentář k článku „Účinnosť a bezpečnosť silymarínu u pacientov s chronickými chorobami pečene – multicentrická, prospektívna, otvorená klinická štúdia IMHOTEP“
- Správná odpověď na kvíz
- Autodidaktický test: gastrointestinální onkologie
- Hyaluronát sodný: nová cesta v léčbě ulcerózní kolitidy?
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Zařazení režimu FOLFIRINOX do algoritmu léčby metastazujícího karcinomu slinivky břišní – první zkušenosti
- Rehabilitace a moderní přístup v léčbě syndromu solitárního rektálního vředu
- Expandibilné stenty v liečbe benígnych a malígnych ochorení pažeráka
- Využití kontrastní endosonografie v diagnostice karcinomu pankreatu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



