-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Standardy České gastroenterologické společnosti – endoskopická léčba pacientů s Barrettovým jícnem a časnými neoplaziemi jícnu
Guidelines of the Czech gastroenterological society – endoscopic treatment of Barrett´s esophagus and early esophageal neoplasia
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
25. 11. 2013Accepted:
2. 12. 2013
Autoři: J. Martínek 1; Přemysl Falt 2
; J. Gregar 3; V. Procházka 3
; J. Špičák 1; O. Urban 2; S. Rejchrt 4; A. Pazdro 5; M. Zemanová 6; A. Hep 7; J. Malušková 8; M. Stefanová 9; M. Vieth 10; T. Jirásek 11; T. Hucl 1
Působiště autorů: Klinika hepatogastroenterologie, IKEM, Praha 1; Centrum péče o zažívací trakt, Vítkovická nemocnice a. s. 2; II. interní klinika UP a FN Olomouc 3; II. interní klinika LF UK a FN Hradec Králové 4; III. chirurgická klinika 1. LF UK a FN v Motole, Praha 5; Onkologická klinika 1. LF UK a VFN, Praha 6; Interní gastroenterologická klinika, FN Brno-Bohunice 7; Pracoviště klinické a transplantační patologie, IKEM, Praha 8; Interní oddělení, Nemocnice Na Františku, Praha 9; Klinikum Bayreuth, Department of Pathology, Preuschwitzer Str. 101, 95445 Bayreuth, Německo 10; Ústav patologie 3. LF UK a FN Královské Vinohrady, Praha 11
Vyšlo v časopise: Gastroent Hepatol 2013; 67(6): 479-487
Kategorie: Klinická a experimentální gastroenterologie: doporučené postupy
Souhrn
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
25. 11. 2013Accepted:
2. 12. 2013Obsah
- Úvod
- Definice pojmů
- Barrettův jícen bez dysplazie
- Barrettův jícen s nízkým stupněm dysplazie
- Barrettův jícen s vysokým stupněm dysplazie
- Časný adenokarcinom jícnu(v terénu BJ i bez BJ)
- Dlaždicobuněčné neoplazie
- Cíle léčby
- Radiofrekvenční ablace
- Endoskopická resekce a endoskopická submukózní disekce
- Role EUS, CT a dalších metod při stagingu a sledování pacientů s časnými neoplaziemi
- Sledování pacientů po léčbě neoplazií jícnu
- Role gastroenterologa v primární péči
- Zpracování a zhodnocení vzorků; Staging
- Zápis – minimální požadavky
- Shrnutí a závěry
- Přílohy
Seznam hlavních zkratek
AFI – autofluorescence, ALP – speciální typ barvení (alciánová modř s PAS, barvení dle Mowryho), APC – argon-plazma koagulace, BJ – Barrettův jícen, EAC – časný adenokarcinom, EMRC – endoskopická resekce s plastovým cylindrem (capem), EMRL – endoskopická resekce s ligátorem, ER – endoskopická resekce, ESD – endoskopická submukózní disekce, HE – hematoxylin-eozin, HGD – high-grade dysplazie, LGD – low-grade dysplazie, NBI – narrow band imaging, PAS – periodic acid-Schiff, RFA – radiofrekvenční ablace, SCC – dlaždicobuněčný karcinom
Pozn.: namísto pojmu „intraepiteliální neoplazie“ používáme v tomto textu užívanější termín „dysplazie“.
1. Úvod
Barrettův jícen (BJ) je prekancerózou s rizikem vzniku zhoubného nádoru 0,12–0,5 % / rok u pacientů bez dysplazie [1,2]. K rozvoji BJ dochází v důsledku dlouhotrvajícího neléčeného nebo neadekvátně léčeného gastroezofageálního refluxu. U pacientů s BJ je normální dlaždicový epitel jícnu nahrazen epitelem cylindrickým s intestinální metaplazií. Tento úsek musí být jednoznačně endoskopicky zřetelný [3].
V minulosti byli pacienti s BJ a vysokým stupněm dysplazie (HGD) nebo časným adenokarcinomem (EAC) indikováni k chirurgické resekci jícnu s rizikem odpovídajícím rozsahu operačního výkonu (mortalita ve specializovaných centrech je pod 5 % a morbidita se pohybuje v rozmezí 20–50 %). Pacienti bez dysplazie a s nízkým stupněm dysplazie (LGD) byli sledováni v pravidelných intervalech.
Podobný přístup existoval i u pacientů s nálezem dlaždicobuněčných neoplazií. Na rozdíl od BJ není u dlaždicobuněčných neoplazií definována prekanceróza s jasným programem sledování. Detekce časných dlaždicobuněčných neoplazií je méně častá.
Endoskopická léčba změnila přístup k pacientům s časnými neoplaziemi jícnu. Její metody slouží jednak k přesnější diagnostice a stagingu, jednak mohou vést k úspěšnému kurativnímu zásahu, který nemusí být následován další chirurgickou nebo onkologickou léčbou. Výhodou je miniinvazivní přístup, menší frekvence komplikací (život ohrožující komplikace jsou extrémně vzácné) i možný ekonomický přínos.
Metody endoskopické léčby jsou: endoskopická resekce (ER), endoskopická submukózní disekce (ESD) a radiofrekvenční ablace (RFA) [3]. Standardní argon plazma koagulace (APC) nemá v primární léčbě časných neoplazií místo. APC lze použít jako „escape“ metodu v individuálních případech [3–5]. Klíčová a nezbytná je v péči o pacienty s časnými neoplaziemi jícnu multidisciplinární spolupráce (onkolog, chirurg, gastroenterolog) a zásadní je přítomnost zkušeného gastrointestinálního (a event. na časné neoplazie jícnu specializovaného) patologa [4,5].
2. Definice pojmů
Barrettův jícen
Náhrada dlaždicobuněčného epitelu epitelem cylindrickým s intestinální metaplazií v endoskopicky viditelném segmentu začínajícím v oblasti G-E junkce. Pouhá přítomnost kardiální sliznice je pro diagnózu BJ nedostačující.
Časná neoplazie jícnu
BJ s LGD
BJ s HGD
BJ a EAC (stadium T1, N0)
EAC jícnu bez přítomnosti BJ (stadium T1, N0)
Dlaždicobuněčná LGD
Dlaždicobuněčná HGD
Dlaždicobuněčný karcinom „in situ“
Časný dlaždicobuněčný karcinom (stadium T1, N0)
Endoskopická resekce
Odstranění části sliznice s podílem submukózy následujícími metodami:
- podpich a odstranění kličkou (lift and cut)
- podpich, aspirace a řez s použitím plastového capu (nástavce) – EMRC
- endoskopická resekce s použitím ligačních kroužků (s podpichem nebo bez něj) – EMRL
- podpich, trakce tkáně kleštěmi a odstranění kličkou
Endoskopická submukózní disekce
Odstraněním sliznice (s částí submukózy) za použití podpichu a nože k endoskopické disekci, pokud možno v jedné části (en bloc).
RFA
Radiofrekvenční ablace v jícnu pomocí balonových elektrod HALO 360 nebo jiných elektrod (např. HALO 90, HALO 60 a další).
T staging
- nádor T1a: invazivní karcinom s invazí do sliznice (m),
- nádor T1b: invazivní karcinom s invazí do submukózy (sm),
- sm1: invaze nádoru do horní třetiny submukózy;
- dlaždicobuněčných neoplazií je hloubka invaze menší nebo rovna 200 µm, u adenokarcinomu v terénu Barrettova jícnu je hloubka invaze menší nebo rovna 500 µm.
- sm2: invaze nádoru do střední třetiny submukózy,
- sm3: invaze nádoru do spodní třetiny submukózy.
Měření hloubky invaze
Hloubka invaze se měří pouze u nádorů infiltrující submukózu. Hloubka se měří od nejhlubšího vlákna spodní vrstvy muscularis mucosae k nejhlubšímu místu invaze. Dále se měří minimální vzdálenost nejhlubší infiltrace nádoru k linii řezu. Dále se měří, je-li to možné, šířka invaze do submukózy a celková šíře nádoru.
Centrum
Komplexně technicky a personálně vybavené centrum k léčbě časných neoplazií jícnu (specializovaný patolog, vyškolený endoskopista, možnost provádění ER, ESD a RFA) se snadno dostupným multidisciplinárním týmem.
Multidisciplinární tým
Tým složený z chirurga zabývajícího se jícnovou chirurgií, onkologa (nejlépe zabývajícího se léčbou maligních nádorů jícnu) a gastroenterologa zabývajícího se problematikou jícnových neoplazií. Součástí týmu je i specializovaný gastrointestinální, resp. jícnový patolog.
„Kvalitní“ endoskopie
Současný moderní model endoskopu s vysokým rozlišením (tzv. high resolution endoscopy) s možností elektronického zvýraznění slizničního reliéfu (NBI, i-Scan, FICE) nebo trimodální endoskopie (ZOOM, AFI, NBI).
3. Barrettův jícen bez dysplazie
Riziko vzniku adenokarcinomu je nízké, 0,12–0,5 % / rok [1–3]. Endoskopická léčba není indikována s výjimkou pacientů s viditelnou lézí (indikace ER) nebo individuálních případů (např. kancerofobie, rodinná anamnéza adenokarcinomu jícnu). Radiofrekvenční ablace není v této indikaci hrazena z veřejného pojištění.
Pacienti s BJ bez dysplazie se endoskopicky sledují v pravidelných intervalech. Pacienti s BJ do délky 3 cm jsou po dvou úvodních endoskopiích, které neprokáží dysplazii, indikováni k endoskopické kontrole každých 3–5 let. Interval úvodních dvou endoskopíí je 6–12 měsíců. Pacienti s BJ delším než 3 cm jsou po dvou negativních endoskopiích indikováni k endoskopickým kontrolám každé 2–3 roky.
Při standardních endoskopických kontrolách se doporučuje dodržovat klasický tzv. Seattle protokol, tj. nejprve biopsie ze všech viditelných lézí (jsou-li tyto přítomny) a pak náhodné čtyřkvadrantové biopsie na každé 2 cm délky.
4. Barrettův jícen s nízkým stupněm dysplazie
LGD je patology diagnostikována častěji, než je ve skutečnosti přítomna, tzv. overestimation, často v důsledku „nadhodnocení“ regenerativních změn [6]. Potvrzená LGD s sebou nese vyšší riziko vzniku pokročilé neoplazie (HGD nebo karcinom) oproti BJ bez dysplazie (13,4 % / rok) a v dlouhodobém horizontu je kumulativní riziko až 80 % [6–8].
K definitivnímu potvrzení (stanovení) LGD je nutné naplnit tyto tři podmínky:
- histologické potvrzení LGD u alespoň dvou endoskopických vyšetřeních,
- odběr biopsií „large capacity“ nebo jumbo bioptickými kleštěmi [9–11],
- potvrzení diagnózy (druhé čtení) nejlépe patologem centra (viz definice pojmů).
K potvrzení je nutné mít k dispozici jak původní preparáty, tak i parafinový blok (bloky) k event. doplnění vyšetření. Druhým čtením se míní vyšetření na jiném patologickém pracovišti. V případě primární diagnózy LGD specializovaným patologem centra není druhé čtení nutné, platí však podmínka potvrzení LGD u alespoň dvou endoskopických vyšetřeních.
Před endoskopickou léčbou RFA je nezbytné provedené „kvalitní“ endoskopie (viz definice pojmů). Cílem je jednoznačné vyloučení makroskopicky viditelných lézí vhodných k endoskopické resekci (předcházející RFA). V současnosti totiž přibývá údajů o vzniku nových neoplazií vzniklých během surveillance po RFA [12].
Pacienti s definitivní diagnózou LGD jsou indikováni k endoskopické léčbě, většinou radiofrekvenční ablací [8]. Endoskopická resekce je indikována v případě viditelných lézí nebo individuálně u pacientů s krátkým segmentem BJ. Výhodou ER je definitivní histopatologická diagnóza [13].
Alternativou je intenzivní endoskopická surveillance každých šest měsíců v individuálních případech (např. preference pacienta, riziko komplikací – např. pacienti s varixy jícnu, vysoký věk nebo významná komorbidita apod.) [3].
5. Barrettův jícen s vysokým stupněm dysplazie
- Pacienti jsou jednoznačně indikováni k léčbě [3,14]. Pacienti s HGD mají vysoké riziko (10–18 % / rok) vzniku adenokarcinomu. Před terapií je nezbytná „kvalitní“ endoskopie k vyloučení či jasné specifikaci eventuelních ložiskových lézí, které jsou indikovány k ošetření ER nebo ESD a nikoli k ošetření RFA. Tato „kvalitní“ endoskopie může být součástí již plánovaného terapeutického výkonu.
- K léčbě lze použít endoskopickou resekci, radiofrekvenční ablaci nebo kombinaci obou metod v libovolném pořadí. Jakákoli viditelná léze musí být odstraněna endoskopickou resekcí [15,16].
- ER by se neměla provádět v případě nedostupnosti kvalitních zobrazovacích metod (tj. „kvalitní“ endoskopie). Klíčová je identifikace všech lézí vhodných k endoskopické resekci. Tyto léze mohou být v případě nedostupnosti „kvalitní endoskopie“ přehlédnuty.
- Chirurgická léčba (ezofagektomie) byla dříve standardním postupem. Z definice odstraní v jedné době celou patologickou tkáň. Je však zatížena signifikantními riziky komplikací. U pacientů s HGD je chirurgická léčba indikována individuálně, např.:
- a) nespolupracující pacient (nelze očekávat adherenci k surveillance či adherenci k několikaetapové léčbě spočívající v opakování endoskopických výkonů – RFA),
- b) selhání endoskopické léčby.
- Druhé čtení vzorků specializovaným patologem (patologem se specializovanou způsobilostí) je nutné v případě, že pacient s diagnózou HGD přichází do centra k další léčbě odjinud. Druhé čtení není nezbytné, pokud je diagnóza HGD stanovena patologem centra. Druhým čtením se míní vyšetření na jiném patologickém pracovišti (nejlépe patologem centra). Diagnóza HGD by měla být učiněna na základě hodnocení bioptických vzorků z „large capacity“ nebo „jumbo“ kleští [9–11].
- Definitivní diagnóza HGD (ale i LGD) by měla být stanovena na základě biopsií barrettovské sliznice bez makroskopických (endoskopických) známek zánětu.
6. Časný adenokarcinom jícnu (v terénu BJ i bez BJ)
- Jednoznačně je indikována endoskopická léčba. Při histologickém průkazu adenokarcinomu je nezbytné ošetření endoskopickou resekcí nebo disekcí, RFA je kontraindikována. V případě náhodného bioptického nálezu karcinomu bez jednoznačně endoskopicky patrné léze je nezbytné cíleně pátrat po takové lézi, ve většině případů je identifikovatelná.
- Před samotným provedením resekce je nezbytné provedení „kvalitní“ endoskopie.
- Viditelné léze se klasifikují podle Pařížské klasifikace.
- ER/ESD odstraňují lézi s karcinomem. Tato léze musí být po patřičném zpracování vyšetřena histopatologicky specializovaným gastrointestinálním patologem centra. Teprve histopatologické vyšetření určí definitivní diagnózu a hlavně staging na základě jasně definovaných parametrů [17,18]. Každý pacient po ER/ESD časného adenokarcinomu musí být individuálně diskutován v rámci multidisciplinárního týmu se stanovením dalšího postupu (pokračování v endoskopické léčbě – chirurgická nebo onkologická léčba – pouze surveillance). Hodnotí se riziko možné generalizace proti riziku operačního výkonu. Nezbytné je přihlížet i k preferencím informovaného pacienta.
- U všech pacientů po ER/ESD EAC (v případě, že není posléze indikováno chirurgické řešení) je indikováno další pokračování léčby (RFA, ER/ESD, kombinace obou) k docílení kompletní eradikace sliznice Barrettova jícnu. Při kombinaci RFA + ER je velmi nízké procento lokálních recidiv neoplazie [15,16,19]. Další pokračování endoskopické léčby není nutné u malých lézí GE junkce, kde nejsou makroskopické známky reziduální metaplastické sliznice [3,4,15–17,19].
Obecně lze považovat za kurativní [3,4,15–17,19]:
- EAC se slizniční invazí,
- EAC s R1 resekcí (pozitivita laterálních okrajů) s maximálně slizniční invazí, pokud endoskopista garantuje makroskopické odstranění léze piece-meal (po částech) technikou (tj. R0 resekce není nezbytnou podmínkou prohlášení resekce za kurativní).
Obecně jsou k následné chirurgické léčbě (resekci) indikovány:
- karcinomy se submukózní invazí sm2, sm3,
- méně diferencované karcinomy (G2–3) se submukózní invazí sm1,
- špatně diferencované nebo nediferencované karcinomy (G3, G4) s hlubokou slizniční (m4, 18) invazí nebo karcinomy s nepříznivými histologickými vlastnostmi (disociace, budding, L1, V1 atd.).
„Hraniční indikace“:
- Karcinomy dobře diferencované, zvláště po R0 resekci s invazí sm1. U těchto nemocných lze zvážit dokončení endoskopické léčby s následnou dispenzarizací nebo indikovat chirurgický výkon (na základě doporučení multidisciplinárního týmu specializovaného centra).
- Chirurgická léčba zůstává alternativou i u časných nádorů v případě preference pacienta či jiných okolností.
Endoskopická léčba pro EAC je uznávanou metodou první volby, tj. metodou standardní. Chirurgické řešení je zde alternativou.
- Většina endoskopicky léčených pacientů s sm1 invazí neumírá na generalizovaný karcinom, v budoucnosti není vyloučené rozšíření indikace endoskopické léčby na sm1 invazi [18]. Zdá se, že riziko lymfatických metastáz u sm1 invaze je menší než riziko chirurgické léčby (pouze 1 ze 66 pacientů s sm1 invazí léčených endoskopicky vyvinul během několikaletého sledování metastázy v lymfatických uzlinách) a žádný z pacientů nezemřel na generalizaci karcinomu [20].
- V rámci multidisciplinárního týmu se musí zvažovat věk, komorbidity, spolupráce pacienta, riziko výkonu a mnoho dalších faktorů.
- Ne všechny EAC G-E junkce (anatomicky v jícnu) vycházejí z Barrettova jícnu.
7. Dlaždicobuněčné neoplazie
- Záchyt časných dlaždicobuněčných neoplazií je méně častý oproti neoplaziím v terénu BJ. K časné detekci těchto lézí přispívá pečlivě prováděná endoskopie horní části GIT (pomalé vytahování endoskopu včetně důkladné inspekce proximálního jícnu, oplach sliznice jícnu, používání NBI, i-Scan, FICE) a diagnostika s pomocí Lugolova roztoku při podezření na ložiskové postižení zvláště u rizikových jedinců (muži nad 60 let, dlouhodobí kuřáci a konzumenti alkoholu, nádor v ORL oblasti, tylóza, poleptání jícnu, achalázie).
- V případě nálezu dlaždicobuněčné léze je nezbytné vyšetřit podrobně celý jícen s pomocí chromoendoskopie (Lugolův roztok) k vyloučení rizika přítomnosti dalších lézí.
- Oproti adenokarcinomu je dlaždicobuněčný karcinom agresivnější, této skutečnosti odpovídají i následující doporučení [21].
Léze s LGD
Indikována endoskopická léčba (ER//ESD, RFA). Endoskopické resekční metody je vhodné užít, kdykoli je to možné k definitivnímu histopatologickému stagingu. Léčebné metody lze kombinovat [22,23].
Léze s HGD
Indikována endoskopické léčba (ER/ESD, RFA). Resekční metody je vhodné užít, kdykoli je to možné (histopatologický staging). Léčebné metody lze kombinovat [22,23]. V případě viditelné léze je jednoznačně indikována ER/ESD.
Časný dlaždicobuněčný karcinom
Indikována je ER nebo ESD. RFA je kontraindikována [22–24].
Chirurgická léčba je alternativním způsobem léčby pacientů s časnými dlaždicobuněčnými neoplaziemi. V případě endoskopicky řešitelné léze je metodou první volby endoskopická léčba a chirurgická léčba následuje v případě potřeby a podle výsledků histopatologického stagingu.
8. Cíle léčby
8a. Cílem léčby je u neoplazie v terénu BJ
- kompletní endoskopické snesení karcinomu a makroskopicky viditelných lézí,
- makroskopická a mikroskopická eradikace dysplastického i zbytkového nedysplastického BJ.
Cíle léčby lze specifikovat i pro potřebu analýzy dat následovně:
- makroskopická eradikace Barrettova jícnu,
- eradikace neoplazie (karcinomu) a dysplazie (CE-N, D),
- eradikace intestinální metaplazie (CE-IM).
8b. Cílem léčby je u dlaždicobuněčné neoplazie
- Kompletní endoskopické snesení neoplazie a eradikace dysplazie (patolog věnuje zvláštní pozornost laterálnímu šíření dlaždicobuněčné neoplazie podél vrstvy bazálních buněk).
- Dosažení cíle lze konstatovat po dvou negativních endoskopických kontrolách s intervalem 3–6 měsíců od skončení léčby. Biopsie se odebírají z oblasti nové Z-line v G-E junkci (alespoň 3×) a jícnu (oblast původně metaplastického epitelu) v případě BJ a z jizvy či místa léčby u dlaždicobuněčných neoplazií.
- Pokud dojde k makroskopické eradikaci BJ (tj. Z-line bez ostrůvků a jazýčků), přičemž biopticky je přítomna intestinální metaplazie bez dysplazie v oblasti Z-line, není nutné pokračovat v léčbě a pacient je indikován k endoskopické surveillance [25–27].
- Pokud dojde k histologickému relapsu (tj. znovuobjevení se intestinální metaplazie) v oblasti nové Z-line, bez makroskopických známek BJ, není další endoskopická léčba indikována [25–27].
- V případě makroskopického relapsu v oblasti Z-line (tj. jazýčky, ostrůvky) je indikována RFA, ER nebo surveillance (záleží na původní indikaci, výsledku histologie a dalších faktorech).
- V případě objevu tzv. burried glands (žlázky pod nově vytvořeným dlaždicovým epitelem) je další postup stanoven individuálně v závislosti na původní indikaci a aktuální histologii. Možné je ošetření RFA, ER, možná je i endoskopická surveillance.
9. Radiofrekvenční ablace
- Radiofrekvenčí ablace je účinnou metodou léčby BJ s dysplazií nebo dlaždicobuněčných neoplazií [3,14,28]. Jde o v současnosti nejúčinnější a standardní ablační metodu k léčbě HGD/LGD bez viditelné léze a k ablaci reziduální barrettovské sliznice po resekci časného karcinomu nebo HGD [4].
- Ošetření RFA (pokud se provádí v distálním jícnu) by mělo vždy zahrnout i několik milimetrů kardie.
- V ČR se jedná o jedinou dostupnou a vhodnou ablační metodu [28].
- Používají se elektrody balonové (HALO 360) a elektrody ploché (HALO 90, HALO 60, HALO TTS).
- V léčbě lze použít protokolu klasického (2× pálení, odstranění nekróz, 2× pálení), tak i protokolu zkráceného (bez odstranění nekróz), oba způsoby jsou stejně účinné [29,30].
- Kalibrace (sizing) je nezbytná ke správnému určení velikosti balonové elektrody. U pacientů po ER/ESD je vhodné použít balon o jednu velikost menší, než je velikost doporučená kalibrační procedurou.
- Před samotnou léčbou je vhodné použití mukolytika (např. N-acetylcystein 1 %, 20–50 ml).
- Centrum povinně poskytuje údaje do centrálního registru RFA (registr je ve správě IKEM).
- Posouzení efektu RFA s event. opakováním se obvykle provádí za 2–3 měsíce po předchozím výkonu.
- RFA lze provádět i ambulantně v závislosti na preferenci pracoviště, endoskopisty a pacienta. RFA lze provádět v analgosedaci včetně použití propofolu, v celkové anestezii i bez jakékoli premedikace. Záleží na zkušenostech pracoviště, volbě anesteziologa, endoskopisty a pacienta.
- Postup bezprostředně po RFA závisí na zvyklostech a zkušenostech daného pracoviště (tj. hospitalizace vs ambulantní výkon, strategie antisekreční léčby – i.v. nebo per os apod.). Obecně lze doporučit vždy inhibitory protonové pumpy 2× denně, analgetika p.p. a antipyretika p.p., tekutiny a event. kašovitou stravu v den výkonu a dále dle tolerance.
- Pokud po pěti etapách léčby (míní se tím RFA etapy) není dosaženo cíle, není vhodné pokračovat v dalších etapách a je nutné zvolit jiný způsob léčby (např. „escape“ APC nebo „escape ER“ nebo chirurgickou léčbu).
- Centrum sleduje kvalitu provádění RFA (zvláště procenta dosažení eradikace intestinální metaplazie, eradikace dysplazie, dlouhodobý follow up, recidivy, komplikace apod.).
- Lékař provádějící RFA je adekvátně vyškolen.
10. Endoskopická resekcea endoskopická submukózní disekce
- ESD v jícnu je riziková a náročná, provádí ji jen endoskopisté s patřičným tréninkem. Jednoznačná výhoda oproti ER (např. piece-meal vs. en-block) není evidence-based potvrzena, zvláště u adenokarcinomu [23,31]. Je proto na endoskopistovi, jakou resekční metodu zvolí.
- ER je technicky jednodušší než ESD. Metodu by však měli provádět zkušení endoskopisté v centrech zabývající se léčbou časných neoplazií. ER je zatížena signifikantními komplikacemi, pokud je prováděna bez adekvátní zkušenosti a tréninku [4,32].
- Nevybavení všech vzorků k histologickému vyšetření se považuje za chybu.
- Rozsah endoskopické resekce/disekce není arbitrárně omezen. Odstranit lze i velké plochy včetně cirkulární resekce/disekce jícnu. Je na posouzení multidisciplinárního týmu, zda podobný výkon je, nebo není indikován. Např. při piece-meal wide-spread endoskopické resekci (nebo cirkulární disekci) jícnu s dysplazií hrozí vetší riziko stenóz, naproti tomu přináší výhodu přesné histopatologické diagnózy a stagingu.
- ER/ESD se provádějí v celkové anestezii a analgosedaci i bez jakékoli premedikace. Záleží na povaze léze a předpokládané náročnosti výkonu, toleranci pacienta, preferenci endoskopisty apod.
- V jícnu lze použít všechny typy ER.
- K ESD lze použít všechny typy nožů.
- ER/ESD lze kombinovat s RFA v libovolném pořadí (odstranění viditelných lézí vždy předchází provedení RFA).
- ER/ESD na jednom pracovišti s následnou RFA na jiném pracovišti není vhodný postup. Je preferována komplexní léčba na jednom pracovišti [28].
- ER a RFA lze provádět i v jedné době. Je nutné zohlednit benefit pro pacienta a ekonomické hledisko (např. teprve po histopatologickém stagingu lze jednoznačně rozhodnout o pokračování endoskopické léčby). Jedná se o přístup indikovaný pouze výjimečně [33].
- Pracoviště provádějící ER/ESD jícnu je komplexně vybaveno k hemostáze a endoskopickému stentování a léčbě perforací jícnu.
- Po ER/ESD je vhodná krátkodobá hospitalizace, nicméně některé výkony (resekce menšího rozsahu u nerizikových pacientů) lze provádět i ambulantně.
Další poznámky
RFA lze výjimečně indikovat jako paliativní léčbu u pacientů s histologicky prokázaným karcinomem bez viditelné léze, u kterého není indikováno chirurgické řešení (např. velmi starý nemocný, extrémní riziko chirurgické léčby apod.). Podobně lze v takových případech uvažovat o paliativní ablaci argon-plazma koagulací.
Použití argon-plazma koagulace a další ablační metody
U pacientů s časnými neoplaziemi jícnu není APC primárně indikována jako ablační terapie a její použití je v této indikaci „non-lege artis“. Důvodem je nedostatečná radikalita této léčby. Výjimku představuje „escape“ léčba po pěti etapách RFA nebo paliativní léčba malignit jícnu.
Mezi další ablační metody léčby patří kryoterapie a fotodynamická léčba. Ani jedna z těchto metod není v ČR dostupná. RFA je považována za účinnější a bezpečnější oproti fotodynamické léčbě [4]. Kryoterapie nebyla doposud zhodnocena v randomizované kontrolované studii a není tč. považována za zavedenou metodu [4].
Novinku představuje tzv. hybridní APC (podpich sliznice BJ tekutinou a ablace APC). V současné době se jedná o metodu, která je v praxi používána jen v rámci klinických studií.
11. Role EUS, CT a dalších metod při stagingu a sledování pacientů s časnými neoplaziemi
- EUS má pouze pomocnou úlohu při stagingu časných neoplazií jícnu. Výsledek EUS není rozhodující k úvaze o chirurgickém nebo endoskopickém řešení. EUS není dostatečně přesné ke stagingu časných neoplazií jícnu (včetně vysokofrekvenčních sond) [34–36]. Výsledky stagingu na základě hodnocení vzorků tkáně (z resekce, disekce) se neshodují s výsledkem EUS ve velkém procentu případů [37].
- Provedení EUS není nezbytné před provedením ER/ESD u časných neoplazií jícnu, zvláště u lézí do 20 mm [3,4,34–36].
- CT nebo PET CT nemají diagnostickou ani stagingovou úlohu u pacientů s časnými neoplaziemi jícnu a rutinně se neindikují [5,35].
- EUS a CT hrají roli k vyloučení mediastinální/břišní lymfadenopatie u pacientů s podezřením na lymfadenopatii, tato vyšetření se indikují individuálně (např. makroskopicky pokročilá léze).
- EUS a CT mají omezenou roli při sledování pacientů po endoskopické léčbě časných neoplazií jícnu (viz níže).
12. Sledování pacientů po léčbě neoplazií jícnu
Pacienti jsou po léčbě časné neoplazie jícnu sledováni buď v centru, které danou léčbu provádělo, nebo specializovaným gastroenterologem. Cílem sledování je časný záchyt recidivy neoplazie jícnu nebo event. generalizace nádoru v případě karcinomu. Všichni pacienti po endoskopické léčbě časné neoplazie jícnu musí být endoskopicky sledováni [25–27].
1. BJ s LGD
- Po dosažení histologicky verifikované eradikace dysplazie / BJ (tj. dvě negativní endoskopie, viz výše) je indikována kontrola za tři roky. Další frekvence kontrol není určena. Doporučujeme kontroly každých 3–5 let.
2. BJ s HGD
- Po dosažení histologicky verifikované eradikace dysplazie / BJ (tj. dvě negativní endoskopie) je indikována kontrola za 6–12 měsíců a další interval kontrol není určen. Doporučujeme kontroly každých 12–24 měsíců.
3. BJ s EAC
- Po dosažení cíle léčby jsou indikovány endoskopické kontroly po 3–6 měsících první dva roky, pak každoročně další dva roky a dále jednou za 3–5 let. Ostatní vyšetření (UZ, RTG, CT, EUS atd.) závisí na individuálním posouzení (staging, věk, přítomnost R0 resekce atd.).
4. Dlaždicobuněčné neoplazie
U každé dispenzární endoskopie je nezbytné použití Lugolova roztoku.
- LGD a HGD: kontrolní endoskopie za rok a poté za dva roky po dosažení eradikace dysplazie a poté jednou za tři roky.
- Časný karcinom: endoskopické kontroly jsou indikovány každých 3–6 měsíců první dva roky, poté každoročně další dva roky a následně jdnou za 3–5 let. Ostatní vyšetření (UZ, RTG, EUS atd.) závisí na individuálním posouzení (staging, věk, přítomnost R0 resekce atd.).
13. Role gastroenterologa v primární péči
- Hlavní úlohou gastroenterologa v primární péči je časná detekce suspektních lézí a časná detekce dysplazie na základě kvalitního provádění standardních endoskopických vyšetření s doporučeným odběrem biopsií. Zásadní je též časné odeslání indikovaných pacientů k další diagnostice a léčbě. V případě nejasného nálezu spolupracuje gastroenterolog s centrem.
- Vhodné je pořízení a uchování videodokumentace nebo fotodokumentace u všech pacientů s BJ.
- BJ se popisuje za použití Pražské C&M klasifikace.
- Všichni pacienti s BJ by měli být adekvátně léčeni (antirefluxní léčba – buď inhibitory protonové pumpy, nebo fundoplikace).
- Sledování a antirefluxní léčba pacienta po dohodě s centrem po skončení léčby časné neoplazie (např. dispenzarizace pacienta v centru není možná nebo je problematická, proto pacienty po dohodě může sledovat i praktický gastroenterolog v místě bydliště).
14. Zpracování a zhodnocení vzorků z ER/ESD (tab. 1)
Tab. 1. Zaškrtávací tabulka. Tab. 1. Check table. 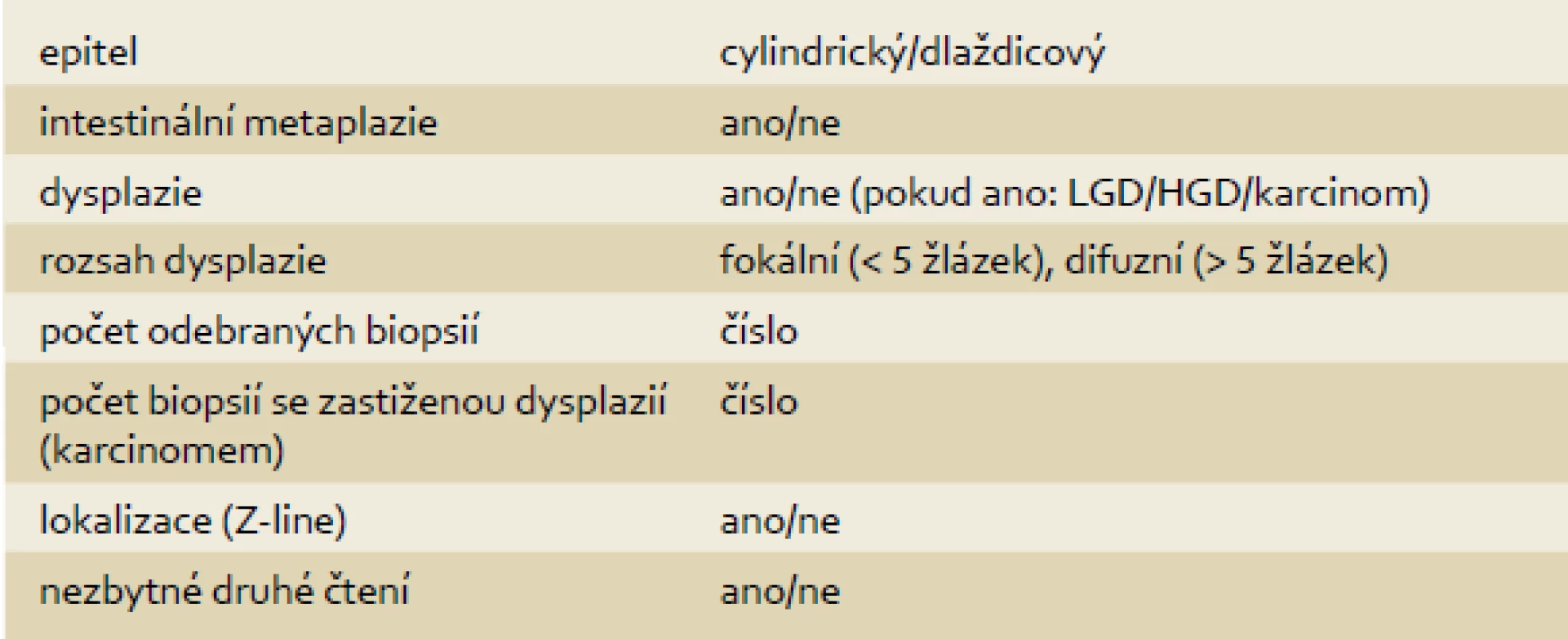
- Napnutý vzorek (vzorky) tkáně se přišpendlí na korkovou destičku (endoskopista). Špendlíky by neměly penetrovat samotnou lézi.
- Fotodokumentace vzorků na korku (endoskopista).
- Vzorky jsou fixovány 10% roztokem formaldehydu, fixovaná tkáň je standardně zpracována (tj. popsána a rozdělena na 1–2mm řezy) a zalita do parafínu po identifikaci nejbližšího okraje léze na základě makroskopického aspektu. Vzorky jsou krájeny sériově na řezy o síle cca 2–4 µm a histologicky barveny hematoxylin-eosinem (HE) a alciánovou modří s PASem (ALP-Mowry), pokud to patolog považuje za nezbytné. V případě potřeby je možné doplnit i jiné speciální metody barvení. Minimem jsou tři skla se čtyřmi řezy na každém, barvené v pořadí: HE, ALP (pokud provedeno), HE.
- Na specializovaném pracovišti hodnotí vzorky z časných neoplazií jícnu specializovaný gastrointestinální (jícnový) patolog.
- U karcinomu hodnotí patolog následující parametry: histologický typ nádoru, diferenciaci – G (grading), hloubku invaze (m1–4 u adenokarcinomu, m1–3 u dlaždicobuněčného karcinomu, sm1–3), laterální okraje (HM = horizontal margin, R0 nebo R1), spodní okraj (VM = vertical margin), disociaci (D), lymfangoinvazi (L), angioinvazi (A nebo V), hloubku šíření (v µm) v případě sm invaze.
15. Zápis – minimální požadavky
Endoskopie – standardizovaná forma zápisu
- a) popis typu endoskopu, event. použití NBI či jiné chromodiagnostiky,
- b) C&M klasifikace,
- c) popis počtu a velikosti metaplastických ostrůvků (pokud nejsou, nutno poznamenat),
- d) popis přítomnosti/nepřítomnosti viditelných lézí,
- e) u každé léze popsat:
- typ dle Pařížské klasifikace,
- velikost,
- lokalizace (v cm od řezáků, kvadrant nebo pozice dle hodinových ručiček),
- f) biopsie: popsat počet odebraných biopsií a etáže, z kterých byly odebrány, a počet kontejnerů, do kterých byly vzorky dány.
Patologie – standardizovaná forma zápisu
Závěr bioptického vyšetření by měl vždy obsahovat tyto údaje:
- a) typ/typy zastiženého epitelu (cylindrický nebo dlaždicový),
- b) intestinální metaplazie (ano – ne),
- c) stupeň dysplazie (bez zastižené dysplazie/LGD/HGD/karcinom (typ)),
- d) rozsah dysplazie (< 5 žlázek (= fokální), > 5 žlázek (difuzní)),
- e) celkový počet hodnocených vzorků a počet vzorků se zastiženou dysplazií,
- f) mikroskopická lokalizace léze (zvláště důležité v oblasti junkce dlaždicového a žlázového epitelu, kde po odebrání biopsie může léze přerůst dlaždicovým epitelem a nemusí být dále patrná),
- g) užívání termínu „indefinite for dysplasia“ by mělo být v co největší míře omezeno,
- h) LGD léze by měly být ověřovány zkušeným GIT patologem (druhé čtení před uvažovanou léčbou je nezbytné),
- i) všechny typy dysplazie, které nebyly viditelné endoskopicky (jako léze), mají být ověřeny zkušeným GI patologem.
16. Shrnutí a závěry
- Radiofrekvenční ablace (RFA) s endoskopickou resekcí/disekcí představují standardní léčebnou metodu u pacientů s časnými neoplaziemi jícnu.
Indikací k RFA jsou:
- pacienti s BJ a potvrzenou LGD,
- pacienti s BJ a potvrzenou HGD bez viditelné léze,
- pacienti po endoskopické resekci nebo disekci karcinomu (nebo viditelné léze s HGD) k eradikaci zbytkové metaplastické sliznice BJ, není-li indikováno chirurgické řešení,
- pacienti s dlaždicobuněčnou LGD a HGD, není-li indikována ER/ESD.
K RFA indikováni nejsou:
- pacienti s BJ bez dysplazie,
- pacienti s viditelnou lézí,
- pacienti bez viditelné léze s histologicky prokázaným karcinomem.
- Endoskopická resekce/disekce představuje základní stagingovou a v určitých případech i kurativní metodou časných neoplazií jícnu. Karcinomy slizniční jsou tč. standardně léčeny endoskopicky, neboť je zde v podstatě nulové riziko lymfatických metastáz [17,18,21,38].
- Rozhodnutí o definitivním léčebném postupu u pacientů s diagnostikovanými časnými karcinomy přísluší multidisciplinárnímu týmu.
- RFA a ER/ESD se dají kombinovat v libovolném pořadí. Léčba pacienta s časnou neoplazií by měla probíhat ve specializovaném centru, zvláště předpokládá-li se kombinace RFA s ER/ESD.
- Cílem léčby je eradikace neoplazie (dlaždicobuněčný karcinom, dlaždicobuněčná LGD a HGD) a eradikace neoplazie i intestinální metaplazie (BJ).
- Histopatologické hodnocení resekátů včetně stagingu provádí patolog zabývající se jícnovou problematikou.
- Centra provádějící RFA povinně poskytují anonymní data výsledků léčby do centrálního registru v ČR a monitorují kvalitu. Údaje jsou průběžně k dispozici všem centrům.
- Gastroenterologové v primární péči mají důležitou roli v časné detekci neoplazií jícnu a event. při sledování pacientů po skončení léčby.
17. Přílohy (příloha 1 a 2)
Příloha 1. Diagnostická kritéria dysplazie/neoplazie. Annex 1. Diagnostic criteria of dysplasia/neoplasia. 
Podle Borchard unpublished data, Borchard et al 1991 et 2000 (modifikováno podle Vieth et al; in: Diversity of gastric cancer. Tokyo: Springer 2005). Pozn. Tato kritéria nejsou akceptována univerzálně. Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 25. 11. 2013
Přijato: 2. 12. 2013
doc. MUDr. Jan Martínek, Ph.D., AGAF
Klinika hepatogastroenterologie, IKEM
Vídeňská 1958/9, 140 21 Praha 4
jan.martinek@volny.cz
Zdroje
1. Hvid-Jensen F, Pedersen L, Drewes AM et al. Incidence of adenocarcinoma among patients with Barrett's esophagus. N Engl J Med 2011; 365(15): 1375–1383.
2. Martinek J, Benes M, Brandtl P et al. Low incidence of adenocarcinoma and high-grade intraepithelial neoplasia in patients with Barrett's esophagus: a prospective cohort study. Endoscopy 2008; 40(9): 711–716.
3. Spechler SJ, Sharma P, Souza RF et al. American Gastroenterological Association medical position statement on the management of Barrett´s esophagus. Gastroenterology 2011; 140(3): 1084–1091.
4. Bennett C, Vakil N, Bergman J et al. Consensus statements for management of Barrett´s dysplasia and early-stage esophageal adenocarcinoma, based on a Delphi process. Gastroenterology 2012; 143(2): 336–346.
5. Stahl M, Budach W, Meyer HJ et al. Esophageal cancer: Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2010; 21 (Suppl 5): 46–49.
6. Curvers WL, ten Kate FJ, Krishnadath KK et al. Low-grade dysplasia in Barrett's esophagus: overdiagnosed and underestimated. Am J Gastroenterol 2010; 105(7): 1523–1530.
7. Lim CH, Treanor D, Dixon MF et al. Low--grade dysplasia in Barrett's esophagus has a high risk of progression. Endoscopy 2007; 39(7): 581–587.
8. Phoa KN, van Vilsteren RE, Pouw BL et al. Surveillance vs. RFA for Barrett´s esophagus with confirmed low-grade dysplasia: a European multicenter randomized controlled trial. DDW 2013; abstract 1004.
9. Komanduri S, Swanson G, Keefer L et al. Use of a new jumbo forceps improves tissue acquisition of Barrett´s esophagus surveillance biopsies. Gastrointest Endosc 2009; 70(6): 1072–1078.
10. Martinek J, Maluskova J, Stefanova M et al. Jumbo biopsy forceps improves adequate tissue sampling in patients with Barrett´s esophagus: final results of a randomized study. UEGW 2013; abstract 4821.
11. Evans JA, Early DS, Fukami N et al. The role of endoscopy in Barrett´s esophagus and other premalignant conditions of the esophagus. Gastrointest Endosc 2012 : 76(6): 1087–1094.
12. Lee JK, Cameron RG, Binmoeller KF et al. Recurrence of subsquamous dysplasia and carcinoma after successful endoscopic and radiofrequency ablation therapy for dysplastic Barrett´s esophagus. Endoscopy 2013; 45(7): 571–574.
13. Stefanová M, Tučková I, Malušková J et al. Biopsie nejsou dostatečné pro přesnou diagnostiku neoplazie u pacientů s Barrettovým jícnem. Gastroent Hepatol 2013; 67(4): 264–270.
14. Shaheen NJ, Sharma P, Overholt BF et al. Radiofrequency ablation in Barrett´s esophagus with dysplasia. N Engl J Med 2009; 360(22): 2277–2288.
15. Phoa KN, Pouw RE, van Vilsteren FG et al. Remission of Barrett's esophagus with early neoplasia 5 years after radiofrequency ablation with endoscopic resection: A Netherlands cohort study. Gastroenterology 2013; 145(1): 96–104.
16. Phoa KN, Pouw RE, Bisschops R et al. Radiofrequency ablation combined with endoscopic resection for Barrett´s esophagus with early neoplasia in 132 patients: results of a prospective European multicenter study (EURO-II). DDW 2013.
17. Vieth M, Ell C, Gossner L et al. Histological analysis of endoscopic resection specimens from 326 patients with Barrett´s esophagus and early neoplasia. Endoscopy 2004; 36(9): 776–781.
18. Vieth M, Stolte M. Pathology of early upper GI cancers. Best Pract Res Clin Gastroenterol 2005; 19(6): 857–869.
19. Martinek J, Stefanova M, Maluskova J et al. Radiofrequency ablation in patients with early esophageal neoplasia: a prospective evaluation of 52 consecutive cases. UEGW 2013.
20. Manner H, Pech O, Heldmann Y et al. Efficacy, safety, and long-term results of endoscopic treatment for early stage adenocarcinoma of the esophagus with low-risk sm1 invasion. Clin Gastroenterol Hepatol 2013; 11(6): 630–635.
21. Gockel I, Sgourakis G, Lyros O et al. Risk of lymph node metastasis in submucosal esophageal cancer: a review of surgically resected patiens. Expert Rev Gastroenterol Hepatol 2011; 5(3): 371–384.
22. Bergman JJ, Zhang YM, He S et al. Outcomes from a prospective trial of endoscopic radiofrequency ablation of early squamous cell neoplasia of the esophagus. Gastrointest Endosc 2011; 74(6): 1181–1190.
23. Higuchi K, Tanabe S, Azuma M et al. A phase II study of endoscopic submucosal dissection for superficial esophageal neoplasms (KDOG 0901). Gastrointest Endosc 2013; 78(5): 704–710.
24. Zhang YM, Boerwinkel DF, He S et al. Prospective feasibility study on the use of multiband mucosectomy for endoscopic resection of early squamous neoplasia in the esophagus. Endoscopy 2013; 45(3): 167–173.
25. Pouw RE, Bergman JJ. Radiofrequency ablation for Barrett´s esophagus, for whom and by whom? Clin Gastroenterol Hepatol 2013; 11(10): 1256–1258.
26. Orman ES, Li N, Shaheen NJ. Efficacy and durability of radiofrequency ablation for Barrett´s esophagus: systematic review and meta-analysis. Clin Gastroenterol Hepatol 2013; 11(10): 1245–1255.
27. Gupta M, Iyer PG, Lutzke L et al. Recurrence of esophageal intestinal metaplasia after endoscopic mucosal resection and radiofrequency ablation of Barrett´s esophagus: results from a US Multicenter Consortium. Gastroenterology 2013; 145(1): 79–86.
28. Martínek J, Falt P, Gregar J et al. Radiofrekvenční ablace v gastrointestinálním traktu – aktuální stav ve světě a v ČR. Gastroent Hepatol 2011; 65(5): 279–285.
29. van Vilsteren FG, Phoa KN, Alvarez Herrero L et al. Circumferential balloon-based radiofrequency ablation of Barrett´s esophagus with dysplasia can be simplified, yet efficacy maintained, by omitting the cleaning phase. Clin Gastroenterol Hepatol 2013; 11(5): 491–498.
30. van Vilsteren FG, Phoa KN, Alvarez Herrero L et al. A simplified regimen for focal radiofrequency ablation of Barrett´s mucosa: a randomized multicenter trial comparing two ablation regimens. Gastrointest Endosc 2013; 78(1): 30–38.
31. Neuhaus H, Terheggen G, Rutz EM et al. Endoscopic submucosal dissection plus radiofrequency ablation of neoplastic Barrett´s esophagus. Endoscopy 2012; 44(12): 1105–1113.
32. van Vilsteren FG, Pouw RE, Herrero LA et al. Learning to perform endoscopic resection of esophageal neoplasia is associated with significant complications even within a structured training program. Endoscopy 2012; 44(1): 4–12.
33. van Vilsteren FG, Alvarez Herrero L, Pouw RE et al. Radiofrequency ablation and endoscopic resection in a single session for Barrett's esophagus containing early neoplasia: a feasibility study. Endoscopy 2012; 44(12): 1096–1104.
34. Pouw RE, Heldoorn N, Herrero LA et al. Do we still need EUS in the workup of patients with early esophageal neoplasia? A retrospective analysis of 131 cases. Gastrointest Endosc 2011; 73(4): 662–668.
35. Pech O, May A, Günter E et al. The impact of endoscopic ultrasound and computed tomography on the TNM staging of early cancer in Barrett´s esophagus. Am J Gastroenterol 2006; 101(10): 2223–2229.
36. Fernández-Sordo JO, Konda VJ, Chennat J et al. Is Endoscopic Ultrasound (EUS) necessary in the pre-therapeutic assessment of Barrett´s esophagus with early neoplasia? J Gastrointest Oncol 2012; 3(4): 314–321.
37. May A. Stop confusing us with EUS prior to endoscopic resection. Endoscopy 2008; 40(1): 71–72.
38. Griffin SM, Burt AD, Jennings NA. Lymph node metastasis in early esophageal adenocarcinoma. Ann Surg 2011; 254(5): 731–736.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2013 Číslo 6- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Naše sny menia svet, avšak len veľmi pomaly...
- Z Číny do Evropy: inspirace gastroenterologické i jiné
-
Kvíz – případ z klinické praxe
Subepiteliální nádor žaludku - Kolonoskopie ve vodní imerzi s použitím chladné vody – dvojitě zaslepená, randomizovaná studie
- Endoskopické riešenie refraktérneho pooperačného úniku žlče z hepatocholedochu pomocou plne povlečeného samorozťažného metalického stentu
- Význam endoskopické retrográdní cholangiopankreatikografie u traumatického poranění pankreatického vývodu u adolescenta
- Standardy České gastroenterologické společnosti – endoskopická léčba pacientů s Barrettovým jícnem a časnými neoplaziemi jícnu
- Diagnostika poruch evakuace žaludku u diabetiků s diabetickou autonomní neuropatií
- Struktura a funkce intestinální epiteliální bariéry
- Hepatocelulární karcinom – naše zkušenosti se surveillance, efekt a komplikace transarteriální chemoembolizace
- Jsme připraveni přijmout změnu paradigmatu léčby časných karcinomů trávicí trubice?
- Report of 12th Slovak-Czech IBD day in Nitra
- 22nd Congress of Gastroenterology Society of Central Germany – Frankfurt am Main
- Oznámení pro lékaře se zájmem o léčbu IBD
- XVIIIth Gastroenterological day in Roznov
- UEGW 2013: důstojná česká účast, hezké ženy a německá preciznost
- Ohlédnutí hepatologů za letošním kongresem České gastroenterologické společnosti
- Announcement of the winner of the 2nd year Kasafirek’s price
- Vizionář a průkopník ERCP MUDr. Ivo Skála, CSc., se dožívá významného jubilea
- Správná odpověď na kvíz
- Prof. Jan Lata šedesátníkem
- ESGE / ESPEN Quality in Endoscopy symposium
- Autodidaktický test: kongresové číslo
- Golimumab
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Diagnostika poruch evakuace žaludku u diabetiků s diabetickou autonomní neuropatií
- Endoskopické riešenie refraktérneho pooperačného úniku žlče z hepatocholedochu pomocou plne povlečeného samorozťažného metalického stentu
- Standardy České gastroenterologické společnosti – endoskopická léčba pacientů s Barrettovým jícnem a časnými neoplaziemi jícnu
- Hepatocelulární karcinom – naše zkušenosti se surveillance, efekt a komplikace transarteriální chemoembolizace
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




