-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Hepatocelulární karcinom – naše zkušenosti se surveillance, efekt a komplikace transarteriální chemoembolizace
Hepatocellular carcinoma – our experience with surveillance, effect and complications of transarterial chemoembolization
Hepatocellular carcinoma (HCC) is the most common primary liver carcinoma. This type of tumour typically occurs along with chronic liver diseases and thus the population in risk is clearly defined. Due to the more common incidence of HCC the patients with liver conditions should be monitored by specialised outpatient clinics. The recommended HCC surveillance system concerns regular check-ups every six months with an abdomen ultrasound examination. Our experience shows that more than half of patients with liver conditions are not monitored by specialised outpatient clinics and only a third of patients undergo the recommended HCC surveillance system. The vast majority of HCC is diagnosed in the advanced stages allowing only palliative or symptomatic therapy. Transarterial chemoembolization is a very efficient and relatively safe method of palliative therapy in hepatocellular carcinoma, which significantly prolongs the survival rate. The risk of complications depends on the functional condition of liver parenchyma and the size of liver focus. Our set of patients has achieved the mean survival period of 22 months from diagnosis.
Key words:
hepatocellular carcinoma – virus hepatitis B – virus hepatitis C – transarterial chemoembolization
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
30. 9. 2013Accepted:
11. 11. 2013
Autoři: K. Kubíčková 1
; P. Urbánek 1; I. Buřič 2; H. Parobkova 2; M. Ryska 3; F. Bělina 3; J. Pudil 3; P. Tesařová 4; M. Kupec 5; L. Vítek 6; M. Zavoral 1
Působiště autorů: Interní klinika 1. LF UK a ÚVN, Praha 1
Vyšlo v časopise: Gastroent Hepatol 2013; 67(6): 498-503
Kategorie: Hepatologie: původní práce
Souhrn
Hepatocelulární karcinom (HCC) je nejčastější primární nádor jater. Tento typ nádoru typicky vzniká v terénu chronických jaterních chorob, proto máme jasně definovanou ohroženou populaci. Vzhledem k častějšímu výskytu HCC by pacienti s jaterním onemocněním měli být dispenzarizování v odborných ambulancích. Doporučený systém surveillance HCC je pravidelná kontrola každých šest měsíců s provedením UZ břicha. Z našich zkušeností vyplývá, že více než polovina pacientů s jaterním onemocněním není sledována v odborných ambulancích, doporučený systém surveillance HCC absolvuje pouze třetina pacientů. Naprostá většina HCC je diagnostikována v pokročilých stadiích, kdy je možná pouze paliativní či symptomatická terapie. Transarteriální chemoembolizace je velmi účinná a relativně bezpečná metoda paliativní léčby hepatocelulárního karcinomu, která významně prodlužuje přežívání pacientů. Riziko komplikací je závislé na funkčním stavu jaterního parenchymu a velikosti jaterního ložiska. V našem souboru pacientů dosahujeme průměrné doby přežívání 22 měsíců od stanovení diagnózy.
Klíčová slova:
hepatocelulární karcinom – virová hepatitida B – virová hepatitida C – transarteriální chemoembolizaceHepatocelulární karcinom (HCC) je nejčastější primární nádor jater. Tento typ nádoru typicky vzniká v terénu chronických jaterních chorob, proto máme jasně definovanou ohroženou populaci. Dispenzarizaci rizikovým pacientů zajišťuje hepatolog, gastroenterolog či infektolog. Cílem screeningu HCC je odhalení nádoru v časných stadiích, kdy je možná kurativní léčba. Optimální metodou screeningu HCC je ultrasonografie jater, surveillance HCC rozumíme opakovaní zobrazovacího vyšetření u rizikových pacientů v šestiměsíčních intervalech. Převážná většina pacientů má HCC diagnostikován v pokročilém stadiu, kdy je možná pouze paliativní či symptomatická terapie. V současné době však i paliativní léčba zajišťuje prodloužené přežívání pacientů s rizikem minima komplikací a dobrou kvalitou života nemocných.
V následujícím článku prezentujeme kohortu pacientů diagnostikvoaných, léčených a systematicky sledovaných na Interní klinice 1. LF UK a ÚVN Praha v letech 2006–2013.
Cíle studie
- zhodnotit provádění surveillance u pacientů v riziku vzniku HCC,
- zhodnotit staging nádoru v okamžiku jeho diagnózy v závislosti na kvalitě prováděné surveillance,
- zhodnotit přežívání u pacientů s HCC v intermediárním stadiu léčených paliativně.
Charakteristika souboru
Hodnocenou skupinu nemocných tvoří 96 pacientů. Zastoupení pohlaví ukázalo významnou predominanci mužů – 75 mužů (78 %) a 21 žen (22 %). Medián věku pacientů v době diagnózy HCC byl 65 let, nejmladší pacientce v našem souboru bylo 27 let, nejstaršímu pacientovi 86 let. Z celkového počtu 96 pacientů nebylo u 11 zjištěno žádné chronické jaterní onemocnění.
U 85 pacientů s HCC bylo přítomno preexistující jaterní onemocnění, nejčastěji se jednalo o chronickou HCV infekci (24 %), NASH/NAFLD (23 %) a alkoholovou chorobu jater (21 %). Z dalších příčin byla zastoupena chronická HBV infekce, kryptogenní cirhóza a u části pacientů se na etiologii jaterního onemocnění podílel úzus alkoholu a metabolický syndrom (tab. 1).
Tab. 1. Rozložení dle etiologie (n = 96). Tab. 1. The distribution according to etiology (n = 96). 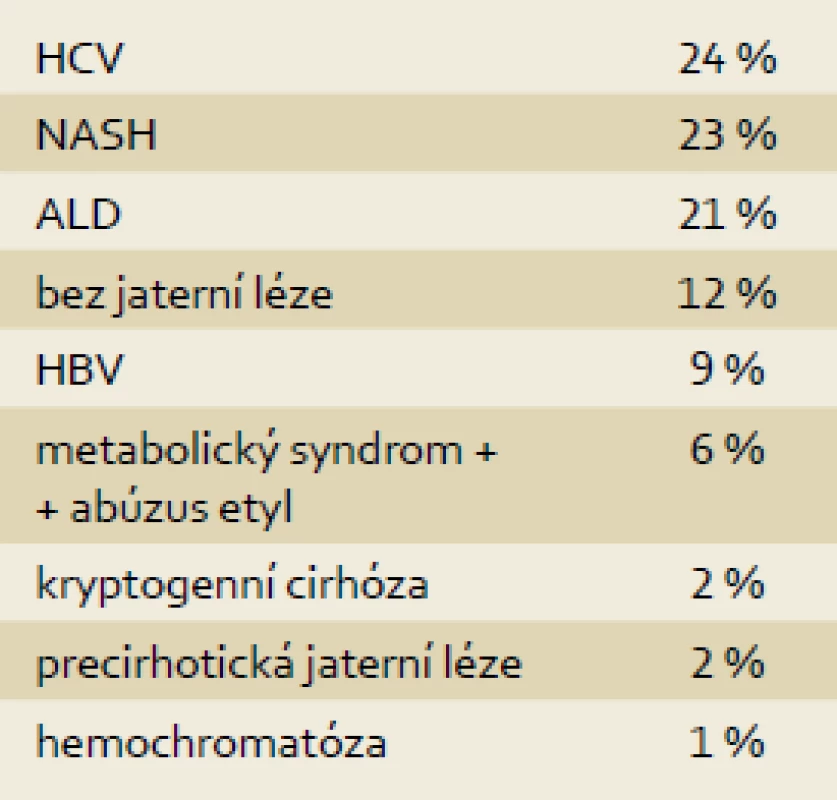
Cíl 1 – surveillance HCC
Východiska: Podmínkou kvalitně prováděné surveillance je identifikace rizikové populace, zavedení optimální vyšetřovací metody a stanovení adekvátního intervalu vyšetření. Tento typ nádoru vzniká v téměř 90 % v terénu chronického jaterního onemocnění, nejčastěji ve stadiu jaterní cirhózy. V běžné populaci bez jaterního onemocnění je tento nádor raritní. Máme tedy jasně definovanou ohroženou populaci.
Zásadní pro zavedení surveillance HCC byly výsledky randomizované kontrolované studie z Šanghaje. V této studii se u více než 18 000 pacientů s chronickou HBV infekcí prováděla ultrasonografie jater a odběr alfafetoproteinu (AFP) v šestiměsíčních intervalech. U pacientů podstupujících tato vyšetření bylo dosaženo významně nižší mortality (o 37 %) a delšího přežívání než u kontrolní skupiny osob, u nichž nebyla surveillance HCC prováděna [1]. Jednoznačným faktorem rozhodujícím o lepší prognóze přitom byla skutečnost, že u skupiny podstupujících surveillance byl nádor odhalen významně častěji v časných stadiích onemocnění. Stejný systém surveillance je aplikován i u pacientů s jinými jaterními chorobami, ačkoli dle zásad evidence based medicine (EBM) jsou u těchto indikací důkazy slabší než pro surveillance u HBV infekce. Kromě chronické hepatitidy B a C patří mezi choroby s vysokou incidencí HCC hereditární hemochromatóza, primární biliární cirhóza ve 4. stadiu, alfa1-antitrypsin deficience ve stadiu jaterní cirhózy [2]. Naopak u dalších onemocnění, jako je například autoimunitní hepatitida či Wilsonova choroba, je HCC vzácný. Na incidenci HCC se také začínají významně podílet nealkoholická steatohepatitida ve spojení s obezitou a diabetem [3]. Vzhledem k výše uvedenému by nemělo být obtížné identifikovat populaci ohroženou vznikem HCC. Definice rizikové skupiny dále podmiňuje efektivní zavedení optimální screeningové metody. Dle doporučení České hepatologické společnosti zařazujeme do screeningového programu v ČR tyto skupiny pacientů [4]:
- pacienti s cirhózou jakékoli etiologie,
- pacienti bez cirhózy s chronickou HBV infekcí,
- pacienti bez cirhózy s chronickou HCV infekcí a pokročilou fibrózou jater, pacienti s fibrózou při NAFLD.
Doporučenou metodou screeningu HCC je ultrasonografie jater prováděná v šestiměsíčních intervalech [5]. V diagnostice maligních ložisek je senzitivita této metody 53–77 % nehledě na techniku jejího provedení [6] a dále klesá pod 20 % u ložisek menších než 1 cm [7], specificita dosahuje až 90 % [8]. Dříve doporučovaná kombinace s odběrem sérové hladiny AFP se již v nových doporučeních neobjevuje, např. v guidelines americké odborné společnosti je AFP od roku 2010 vyřazen z diagnostických kritérií [9]. Důvodem je nízká specificita tohoto onkomarkeru, jeho hodnoty bývají zvýšené u jiných nádorových onemocnění.
Ultrasonografie jater je metoda v našich podmínkách velmi dobře dostupná, relativně levná, nezatěžuje vyšetřované ionizujícím zářením a je také pacienty dobře tolerovaná, tudíž k ní očekáváme dobrou compliance pacientů. Oproti všem výhodám nutno zdůraznit, že je to expertdependentní vyšetření zatížené subjektivním hodnocením vyšetřujícího. Optimální časový interval šest měsíců byl určen na základě odhadu růstu asymptomatického HCC do doby jeho diagnózy [10]. Vzhledem k velké rozdílnosti jednotlivých klinických případů je např. v Japonsku interval surveillance zkrácen na tři měsíce [11]. Ovšem rozdíl v záchytu časných malých HCC při surveillance prováděné v intervalu tři a šest měsíců nebyl prokázán [12]. Naopak studie porovnávající šesti - a dvanáctiměsíční interval surveillance vyzněla ve prospěch kratšího intervalu [8]. Toto je v souladu i se studiemi sledujícími nákladovou efektivitu.
Výsledky 1
Pouze 39 pacientů (46 %, skupina A) s jaterním onemocněním mělo dispenzarizujícího lékaře (hepatolog, gastroenterolog, infekcionista), u ostatních 46 pacientů (54 %, skupina B) bylo diagnostikováno jaterní onemocnění současně s HCC. Ze skupiny A podstupovalo jen 33 % (13/39) pacientů pravidelnou surveillance HCC v intervalu šesti měsíců, kontroly à 1 rok absolvovalo 44 % (17/39) pacientů (graf 1).
Graf 1. Surveillance (n = 39). Graph 1. Surveillance (n = 39). 
Přestože je odběr AFP dle současných doporučení ze screeningu vyřazen, zpětně jsme hodnotili, zda byly zachyceny zvýšené hodnoty tohoto onkomarkeru v době diagnózy HCC. Diagnostické zvýšení AFP (nad 400 µg/l) bylo zjištěno u 22 % (22/96) pacientů se známým HCC. U pacientů s HCC a současným jaterním onemocněním mělo 70 % (59/85) pacientů hodnoty AFP do 100 ug/l (graf 2).
Graf 2. AFP u pacientů s jaterním onemocněním (n = 85). Graph 2. AFP in patients with liver disease (n = 85). 
Cíl 2 – staging nádoru v závislosti na kvalitě surveillance
Východiska: Na základě doporučení EASL a AASL [9,13] používáme v klinické praxi na našem pracovišti ke klasifikaci HCC tzv. Barcelonskou klasifikaci (BCLC – Barcelona clinic liver cancer clasification) [14] (obr. 1), díky které můžeme komplexně zhodnotit stav pacienta a volit nejlepší možnou léčebnou strategii. Dle stadia HCC by měla být použita optimální léčebná modalita. Žádný jiný klasifikační systém nemá přímou vazbu na ověřený optimální léčebný postup. V souladu s výše zmíněnými literárními daty jsme vyslovili hypotézu, že ve skupině pacientů podstupujících správnou surveillanci bude častější výskyt časných stadií nádoru.
Obr. 1. BCLC klasifikace [14]. Fig. 1. BCLC ckasification [14]. ![BCLC klasifikace [14].
Fig. 1. BCLC ckasification [14].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/10b29cceb278249ce1050dbfa6f3f351.jpg)
Výsledky 2
Pouze u 10 % (9/85) pacientů s jaterním onemocněním byl diagnostikován HCC ve stadiu A, kdy je možná kurativní léčba (transplantace jater či resekce), u 90 % (76/85) pacientů bylo nádorové onemocnění diagnostikováno v pokročilém stadiu – nejčastěji stadium B dle BCLC klasifikace (38 %, 32/85). Terminální stadium D bylo v našem souboru zastoupeno ve 20 % (17/85), což je srovnatelné s publikovanými výsledky velkých souborů (graf 3). U pacientů bez jaterního onemocnění byla metodou volby resekce, kterou podstoupilo devět z jedenácti pacientů, u dalších dvou pacientů byla vzhledem k rozsahu nádoru indikována pouze symptomatická terapie.
Graf 3. Pokročilost v době diagnózy (n = 85) Graph 3. Advancement at the time of diagnosis (n = 85). 
Na základě těchto výsledků jsme u všech pacientů s jaterním onemocněním hodnotili, má-li kvalita prováděné surveillance vliv na staging nádoru v době diagnózy. Celou kohortu našich pacientů jsme pro tento účel rozdělili na dvě skupiny: skupina I: ultrasonografické vyšetření prováděné alespoň jednou ročně; skupina II: ultrasonografické vyšetření prováděné v delších intervalech.
U osob ze skupiny I byl v 19 % (6/31) zjištěn nádor ve stadiu A. Naopak u osob ze skupiny II se podařilo toto časné stadium zachytit pouze u 6 % (3/44) pacientů. V této skupině bylo také téměř dvojnásobné množství pacientů v terminálním stadiu onemocnění (stadium D). V obou skupinách bylo obdobné zastoupení pacientů, kteří jsou indikováni k paliativní léčbě, tj. stadium intermediární (B) + pokročilé (C) dle BCLC klasifikace. Ve skupině I. bylo také více zastoupeno stadium B bez extrahepatálního postižení. Ve skupině II byla tato stadia zastoupena srovnatelně (graf 4).
Graf 4. Vlevo surveillance alespoň jednou ročně (n = 31), vpravo surveillance méně než jednou ročně (n = 44). Graph 4. Left surveillance at least once a year (n = 31), right surveillanceless than one year (n = 44). 
Cíl 3 – paliativní léčba u stadia B
Východiska: Do stadia B dle BCLC klasifikace řadíme pacienty v dobrém biologickém stavu s funkční klasifikací jaterní cirhózy Child Pugh A či maximálně Child Pugh B (7b). Rozsah tumoru v tomto stadiu obvykle neumožňuje resekci či transplantaci jater (limitující je velikost ložiska či multilokulární postižení). Optimální paliativní léčbou pro toto stadium je transarteriální chemoembolizace jater (TACE). Principem TACE je kombinace ischemizace ložiska s lokálním podáním chemoterapeutika. V současnosti je dostupná konvenční TACE (c-TACE), což je chemoembolizace emulzí lipiodolu s chemoterapeutikem, v případě DEB-TACE je chemoterapeutikum (doxorubicin) navázáno na speciální částice, tzv. drug eluting bead (DC bead). Výkon je prováděn z femorálního přístupu, při jedné etapě výkonu je podáno 50–100 mg doxorubicinu. Metoda vede k významnému prodloužení doby přežití pacientů, v metaanalýze velkých studií po zavedení metody byl medián přežití 20 měsíců [15]. Recentně byla publikována práce hodnotící přežití skupiny 104 pacientů v šestiletém sledovacím období, kdy při použití DEB-TACE bylo dosahováno přežití s mediánem 48 měsíců [16]. Komplikace TACE jsou vaskulární (poranění tepny v místě vstupu, spazmus, trombóza či disekce hepatické tepny, nezacílená embolizace) [17,18] a nevaskulární (vznik bilomu, jaterního abscesu a tzv. postchemoembolizační syndrom) [19]. Četnost jaterních abscesů po TACE je ve velkých souborech pacientů 0,2 % [20].
Výsledky 3
U 27 pacientů s HCC se provedlo celkem 59 cyklů DEB-TACE hepatocelulárního karcinomu v počtu 1–4 cykly na pacienta. Hodnocení efektu léčby probíhalo na základě kontrolního CT vyšetření, laboratorních odběrů a klinického stavu pacienta. Z celkového počtu 27 pacientů za dané období zemřelo 15 pacientů, z toho u tří pacientů byla příčina smrti jiná než progrese nádorového onemocnění či jaterní cirhózy (srdeční selhání, cévní mozková příhoda a krvácení do GIT). Průměrné přežívání po TACE s vyřazením třech výše uvedených pacientů činí 21 měsíců (hranice 4–49 měsíců). Ve skupině pacientů, kteří jsou již po smrti a kde příčinou úmrtí byla progrese nádorového onemocnění, byla průměrná doba přežití 19 měsíců. Konečně ve skupině žijících pacientů s probíhající léčbou je aktuální průměrné přežívání 22 měsíců.
Komplikace po TACE
Postchemoembolizační syndrom vyjádřený přechodnými bolestmi v pravém podžebří s elevací zánětlivých parametrů a febriliemi se vyskytoval u naprosté většiny pacientů. V souboru 27 pacientů při celkovém počtu 59 etap TACE se u jedné pacientky vytvořil jaterní absces s nutností drenáže komplikovaný rozvojem jaterního selhání s následkem smrti. Letální komplikace TACE tedy v tomto souboru činí 1,7 %. Celkový počet TACE (a DEB-TACE) na našem pracovišti zahrnující neselektivní TACE a TACE pro jinou malignitu než HCC (nejčastěji metastázy kolorektálního karcinomu) činí 134 výkonů, v tomto souboru je procento fatálních komplikací 0,75 %.
Závěr
Vzhledem k častějšímu výskytu HCC by měli být pacienti s jaterním onemocněním dispenzarizováni v odborných ambulancích. Doporučený systém surveillance HCC je pravidelná kontrola po šesti měsících s provedením UZ břicha. Z našich zkušeností vyplývá, že více než polovina pacientů s jaterním onemocněním není sledována v odborných ambulancích, doporučený systém surveillance HCC absolvuje pouze třetina pacientů. Naprostá většina HCC je diagnostikována v pokročilých stadiích, kdy je možná pouze paliativní či symptomatická terapie. DEB-TACE je velmi účinná a relativně bezpečná metoda paliativní léčby hepatocelulárního karcinomu, která významně prodlužuje přežívání pacientů. Riziko komplikací je závislé na funkčním stavu jaterního parenchymu a velikosti jaterního ložiska. V našem souboru pacientů dosahujeme průměrné doby přežívání 22 měsíců od stanovení diagnózy.
Tato práce byla podpořena grantem MO 1012.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 30. 9. 2013
Přijato: 11. 11. 2013
MUDr. Kristýna Kubíčková
Interní klinika 1. LF UK a ÚVN
U vojenské nemocnice 1200
169 02 Praha 6
kristyna.kubickova@uvn.cz
Zdroje
1. Zhang BH, Yang BH, Tang ZY. Randomized controlled trial of screening for hepatocellular carcinoma. J Cancer Res Clin Oncol 2004; 130(7): 417–422.
2. Bruix J, Sherman M. Management of hepatocellular carcinoma. Hepatology 2005; 42(5): 1208–1236.
3. Caldwell SH, Crespo DM, Kang HS et al. Obesity and hepatocellular carcinoma. Gastroenterology 2004; 127 (5 Suppl 1): S97–S103.
4. Brůha R, Šperl J, Urbánek P et al. Doporučený postup pro léčbu a diagnostiku hepatocelulárního karcinomu. Gastroent Hepatol 2012; 66(2): 83–92.
5. Bruix J, Sherman M, American Association for the Study of Liver Diseases. Management of hepatocellular carcinoma: an update. Hepatology 2011; 53(3): 1020–1022.
6. Albrecht T, Blomley MJ, Burns PN et al. Improved detection of hepatic metastases with pulse-inversion Us during the liver-specific phase of SHU 508A: multicenter study. Radiology 2003; 227(2): 361–370.
7. Del Frate C, Zuiani C, Londero V et al. Comparing Levovist-enhanced pulse inversion harmonic imaging and ferumoxides-enhanced MR imaging of hepatic metastases. Am J Roentgenol 2003; 180(5): 1339–1346.
8. Singal A, Volk ML, Waljee A et al. Meta-analysis: surveillance with ultrasound for early-stage hepatocellular carcinoma in patients with cirrhosis. Aliment Pharmacol Ther 2009; 30(1): 37–47.
9. AASLD practice guideline. Available from: http://www.aasld.org/practiceguidelines/Documents/Bookmarked%20Practice%20Guidelines/HCCUpdate2010.pdf.
10. Sheu JC, Sung JL, Chen DS et al. Growth rate of asymptomatic hepatocellular carcinoma and its clinical implications. Gastroenterology 1985; 89(2): 259–266.
11. Makuuchi M, Kokudo N, Arii S et al. Development of evidence-based clinical guidelines for the diagnosis and treatment of hepatocellular carcinoma in Japan. Hepatol Res 2008; 38(1): 37–51.
12. Trinchet JC, Chaffaut C, Bourcier V et al. Ultrasonographic surveillance of hepatocellular carcinoma in cirrhosis: a randomized trial comparing 3 - and 6-month periodicities. Hepatology 2011; 54(6): 1987–1997.
13. European Association for the Study of the Liver, European Organisation for Research and Treatment of Cancer. EASL–EORTC clinical practice guidelines: management of hepatocellular carcinoma. J Hepatol 2012; 56(4): 908–943.
14. Llovet JM, Di Bisceglie AM, Bruix J et al. Design and endpoints of clinical trials in hepatocellular carcinoma. J Natl Cancer Instit 2008; 100(10): 698–711.
15. Llovet JM, Llovet JM, Bruix J. Systematic review of randomized trials for unresectable hepatocellular carcinoma: chemoembolization improves survival. Hepatology 2003; 37(2): 429–442.
16. Burrel M, Reig M, Forner A et al. Survival of patients with hepatocellular carcinoma treated by transarterial chemoembolisation (TACE) using Drug Eluting Beads. Implications for clinical practice and trial design. J Hepatol 2012; 56(6): 1330–1335.
17. Yoon DY, Park JH, Chung JW et al. Iatrogenic dissection of the celiac artery and its branches during transcatheter arterial embolization for hepatocellular carcinoma: outcome in 40 patients. Cardiovasc Intervent Radiol 1995; 18(1): 16–19.
18. Chung JW, Park JH, Im JG et al. Pulmonary oil embolism after transcatheter oily chemoembolization of hepatocellular carcinoma. Radiology 1993; 187(3): 689–693.
19. Clark TW. Complications of hepatic chemoembolization. Semin Intervent Radiol 2006; 23(2): 119–125.
20. Song SY, Chung JW, Han JK et al. Liver abscess after transcatheter oily chemoembolization for hepatic tumors: incidence, predisposing factors, and clinical outcome. J Vasc Interv Radiol 2001; 12(3): 313–320.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2013 Číslo 6- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Naše sny menia svet, avšak len veľmi pomaly...
- Z Číny do Evropy: inspirace gastroenterologické i jiné
-
Kvíz – případ z klinické praxe
Subepiteliální nádor žaludku - Kolonoskopie ve vodní imerzi s použitím chladné vody – dvojitě zaslepená, randomizovaná studie
- Endoskopické riešenie refraktérneho pooperačného úniku žlče z hepatocholedochu pomocou plne povlečeného samorozťažného metalického stentu
- Význam endoskopické retrográdní cholangiopankreatikografie u traumatického poranění pankreatického vývodu u adolescenta
- Standardy České gastroenterologické společnosti – endoskopická léčba pacientů s Barrettovým jícnem a časnými neoplaziemi jícnu
- Diagnostika poruch evakuace žaludku u diabetiků s diabetickou autonomní neuropatií
- Struktura a funkce intestinální epiteliální bariéry
- Hepatocelulární karcinom – naše zkušenosti se surveillance, efekt a komplikace transarteriální chemoembolizace
- Jsme připraveni přijmout změnu paradigmatu léčby časných karcinomů trávicí trubice?
- Report of 12th Slovak-Czech IBD day in Nitra
- 22nd Congress of Gastroenterology Society of Central Germany – Frankfurt am Main
- Oznámení pro lékaře se zájmem o léčbu IBD
- XVIIIth Gastroenterological day in Roznov
- UEGW 2013: důstojná česká účast, hezké ženy a německá preciznost
- Ohlédnutí hepatologů za letošním kongresem České gastroenterologické společnosti
- Announcement of the winner of the 2nd year Kasafirek’s price
- Vizionář a průkopník ERCP MUDr. Ivo Skála, CSc., se dožívá významného jubilea
- Správná odpověď na kvíz
- Prof. Jan Lata šedesátníkem
- ESGE / ESPEN Quality in Endoscopy symposium
- Autodidaktický test: kongresové číslo
- Golimumab
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Diagnostika poruch evakuace žaludku u diabetiků s diabetickou autonomní neuropatií
- Endoskopické riešenie refraktérneho pooperačného úniku žlče z hepatocholedochu pomocou plne povlečeného samorozťažného metalického stentu
- Standardy České gastroenterologické společnosti – endoskopická léčba pacientů s Barrettovým jícnem a časnými neoplaziemi jícnu
- Hepatocelulární karcinom – naše zkušenosti se surveillance, efekt a komplikace transarteriální chemoembolizace
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



