-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Význam stanovování cirkulujících nádorových buněk v diagnostickém a léčebném procesu u karcinomu ovaria
The importance of circulating tumor cells in the diagnostic and therapeutic process in ovarian cancer
Objective:
Our goal was to summarize clinical studies which used CTC/CSCs for prognosis in patients with ovarian cancer.Type of study:
Review article.Setting:
Department of Gynecology and Obstetrics, 3rd Faculty of Medicine, Charles University, Faculty Hospital Královské Vinohrady, PragueMaterial and methods:
This paper reviews various methods of CTCs detection as well as the biology and molecular characterisation of CTCs/CSCs.Conclusion:
Determination of CTC (circulating tumor cells) / CSCS (cancer stem cells) has great potential in the diagnosis, prognosis, monitoring of disease, therapeutic effect and the risk of relapse in ovarian cancer for other malignancies. The presence of CTCs / CSCS in the blood seems to be a decisive factor in the initiation of metastatic process. The results of these studies show a clear link CTC negativity with an extension length of progression-free interval (PFI) and overall survival in patients with ovarian cancer.Keywords:
circulating tumor cells – cancer stem cells – metastasis – ovarian cancer
Autoři: J. Pavlásek; E. Kučera
Působiště autorů: Gynekologicko-porodnická klinika 3. LF UK a FNKV, Praha, přednosta doc. MUDr. E. Kučera, CSc.
Vyšlo v časopise: Ceska Gynekol 2013; 78(4): 342-346
Souhrn
Cíl studie:
Naším cílem bylo shrnout klinické studie, které detekovaly CTC/CSCs pro určení prognózy u pacientek s karcinomem vaječníků.Typ studie:
Přehledová práce.Název a sídlo pracoviště:
Gynekologicko-porodnická klinika 3. LF UK a FNKV, Praha.Předmět a metoda studie:
Prezentovaný článek popisuje různé metody detekce CTCs jako jednoho z možných nových biomarkerů, použitelných v rámci diagnostického a terapeutického procesu u karcinomu ovaria.Závěr:
Stanovování CTC (cirkulujících nádorových buněk) / CSCS (rakovinných kmenových buněk) má obrovský potenciál v diagnostice, stanovení prognózy, monitoringu onemocnění, terapeutického účinku a rizika relapsu u karcinomu ovaria i u dalších malignit. Přítomnost CTCs/CSCs v krvi se zdá být rozhodujícím faktorem iniciace metastatického procesu. Z výsledků uvedených studií vyplývá zřejmá souvislost CTC negativity s prodluženou délkou intervalu bez progrese (PFI) a celkového přežití (OS) u pacientek s karcinomem ovaria.Klíčová slova:
cirkulující nádorové buňky – nádorové kmenové buňky – metastazování – karcinom ovariaÚVOD
Rakovina vaječníků je druhou nejčastěji diagnostikovanou gynekologickou malignitou. Hlavní příčinou úmrtí v důsledku rakoviny vaječníků je její metastatické šíření do mnoha tkání a orgánů. Metastatický proces vyžaduje migraci nádorových buněk z primárního ložiska do vzdálených míst. Dokonce i u nádorů šířících se zejména lymfatickým systémem je hematogenní rozsev nejčastější cestou metastazování. Migrace rakovinných buněk z primárního nádoru do krevního oběhu je podmíněná epitelo-mezenchymální tranzicí (EMT). Protože se tyto buňky pak dále šíří v krvi, jsou označovány jako cirkulující nádorové buňky (CTCs). Populace CTCs se dynamicky vyvíjí a mění, pokud jde o počet CTC v krvi. Dalšími účastníky nádorového rozsevu jsou rakovinné kmenové buňky (CSCs),vznikající z diferencovaných nádorových buněk přes EMT a zárodečným transdiferenciačním procesem. Přítomnost CTCs/CSCs v krvi se zdá být rozhodujícím faktorem iniciace metastatického procesu. V klinických studiích byl prokázán prediktivní a prognostický význam CTC u pacientů s metastazujícím karcinomem prsu, prostaty a tlustého střeva.
Velká část ovariálních nádorů je diagnostikována ve stadiu III/IV (75–80 %). Časná diagnóza a detekce metastáz spolu s optimálním posouzením účinnosti léčby by byly jednoznačně cestou ke zlepšení přežívání. Na systémovou léčbu u ovariálního karcinomu odpovídá přibližně 80 % pacientek. Za nejlepší sérový biomarker monitorující onemocnění je v současné době považován CA 125 (MUC-16), jeho specificita je však relativně nízká. Proto je nadále třeba identifikovat nové prediktivní biomarkery pro rozhodování v procesu léčby, které by vedly k individualizaci nádorové terapie u ovariálního karcinomu.
DETEKCE CIRKULUJÍCÍCH NÁDOROVÝCH BUNĚK
Detekce, kvantifikace a molekulární charakterizace CTCs mají obrovský potenciál v mnoha oblastech onkologie. V počátečních stadiích onemocnění CTCs mohou být použity k určení rizika metastazování a posouzení prognózy. V průběhu léčby mohou být CTCs použity ke zhodnocení účinnosti terapie, nebo jako pomocná metoda při volbě nejvhodnějšího léčebného režimu. To by mohlo napomoci k individualizaci terapie a snížení jejích potenciálně nepříznivých účinků. Navíc by molekulární analýza CTCs mohla napomoci ke zdokonalení cílené biologické léčby. Nicméně detekce a izolace CTCs je technicky dosti náročná. V prvé řadě je množství CTCs v periferní krvi poměrně malé, asi 1 CTC na 106–109 normálních krevních buněk [19, 29, 30], a dále jsou tyto buňky relativně heterogenní skupinou.
Mezi nejčastěji používané metody pro izolaci CTC patří imunomagnetická separace, separace podle velikosti na bázi filtrace a metody gradientu hustoty ve spojení s imunohistochemií.
IMUNOMAGNETICKÁ SEPARACE
Imunocytochemická detekce CTC v periferní krvi se obvykle provádí v kombinaci s odstředěním gradientu hustoty. Jedinou metodou, která byla zatím americkou agenturou Food and Drug Agency (FDA) schválena pro klinické vyžití, je CellSearch (Veridex, Raritan, NJ). CellSearch je založen na imunomagnetickém obohacování a je semi-automatickou metodou, která obohacuje CTC v krvi pomocí ferrofluid – nanočástic potažených anti-EpCAM protilátkami (pozitivní selekce). Obohacená populace je následně obarvena fluorescenčním jaderným barvivem DAPI, fluorescenčními protilátkami specifickými pro CD45 (negativní selekce leukocytárních buněk) a fluorescenčními protilátkami vůči intracelulárním cytokeratinům 8, 18 a 19, které jsou specifické pro epitelové buňky. Analýza vzorků se pak provádí v Cell-Spotter analyzátoru, složeném ze čtyř barevných semi-automatizovaných mikroskopů, které identifikují epitelové buňky (např. CTCs) jako DAPI pozitivní, cytokeratin pozitivní a CD45 negativní [3].
Podobně AdnaTest (AdnaGen AG, Lan-genhagen, Německo) je založený na zachycení buněk epiteliálních nádorů, tedy buněk exprimujích na povrchu buněk vazebnou molekulu – EpCAM, která obvykle není přítomna u krevních buněk.
AdnaTest využívá kombinaci protilátek EpCAM/mucinu 1 (MUC1) u karcinomu prsu a tlustého střeva, u karcinomu ovaria a prostaty kombinaci EpCAM/HER2 [6, 14, 29]. Obohacená CTC frakce je dále analyzována pomocí semikvantitativní RT-PCR pro transkripty spojené s nádorovým procesem, např. EpCAM, HER2, MUC1, CAE, PSA, PSMA, EGFR. Omezením výše uvedených metod separace je to, že detekce EpCAM a/nebo cytokeratinů může být ovlivněna procesem EMT (epiteliálně mezenchymální tranzice) [24, 27, 28]. Frekvence CTC s mezenchymálními a/nebo EMT vlastnostmi se zvyšuje u pacientů, kteří jsou rezistentní na léčbu [1] a také u pacientů s metastatickým onemocněním v porovnání s časným stadiem onemocnění [12].
SEPARACE ZALOŽENÉ NA VELIKOSTI
CTC-obohacení na základě velikosti buňky řeší problém snížení EpCAM exprese na CTCs buněčné membráně. Nicméně, filtrace ukazuje relativně nízkou senzitivitu a specifitu, protože malé CTCs mohou uniknout detekci, zatímco velké leukocyty mohou kontaminovat CTC populaci. Separace CTC na základě velikosti odděluje nádorové buňky větší než 8 μm. ScreenCell/ISET filtrace izoluje nádorové buňky podle velikosti a může být použita pro izolaci širokého spektra nádorových buněk nezávisle na protilátkách, včetně buněk non-epiteliálního původu [7].
MICROCHIP MIKROFLUIDNÍ TECHNOLOGIE
Nově byla představena CEE-CTC-chip – Cell Enrichment a extrační technologie (Biocept, San Diego, CA), která je schopna zachytit buňky nezávisle na jejich EpCAM a CK19 expresi, na rozdíl od CellSearch a AdnaTestu [8, 17]. Získané buňky mohou být hodnoceny morfologicky a immunohistochemicky pomocí FISH nebo různými molekulárními analýzami po extrakci DNA nebo RNA. CEE platforma využívá kokteil protilátek namířených proti různým epiteliálním antigenům na povrchu buněk epiteliálních a buněk mezenchymálních [21]. Pomocí této platformy Pecot et al. zjišťovali CK+ a/nebo CK - CTC u pacientů s karcinomem prsu, vaječníků nebo tlustého střeva [21].
IMUNOHISTOCHEMICKÁ ANALÝZA OBRAZU
Nová metoda „high definition“ CTC (HD-CTC) test identifikuje CTC bez použití povrchovýchproteinů, a to tak, že v rámci obohacené leukocytární frakce vizualizuje CTC v dostatečně vysokém rozlišení (HD), tak aby splňovaly diagnosticképožadavky kvality obrazu [13, 15]. Ve studii Phillips et al. byly CTC detekovány pomocí HD-CTC testu také u pacientek s ovariálním karcinomem [22]. Byla využita světelná mikroskopie ke kvantifikaci fyzikálních parametrů, jako je objem, hmotnost, plocha, a hustota CTC. Jde o novou techniku k posouzení heterogenity CTC [22, 23]. Navíc HD-CTC testem jsou detekovány vyšší počty CTC než pomocí CellSearch systému. HD-CTC test poukazuje na přítomnost CTC –shluků (CTC-clusters) u 88 % u pacientů s metastazujícím nádorovým onemocněním [15], takže je možné, že pro klinickou praxi bude mít v budoucnu detekce shluků větší prognostickou validitu.
CTC A JEJICH VÝZNAM V KLINICKÉ PRAXI
Detekce CTC může být potenciálně použita ke stanovení diagnózy, jako alternativa k invazivní biopsii pro včasnou detekci metastatického šíření nádoru a pro monitorování efektivity terapie u jednotlivých pacientů. Počty a vlastnosti CTC mohou být prognostickým faktorem pro přežití, nebo prediktivním faktorem odpovědi na terapii. Dlouhodobé monitorování CTC může poskytnout příležitost lépe posoudit dynamiku odpovědi na léčbu. Přítomnost CTC v krvi předchází změnu nálezu při zobrazovacích metodách a naznačuje, že CTC analýza může být senzitivnějším biomarkerem pro zhodnocení progrese onemocnění než zobrazovací metody [20].
Nepříznivá prognostická hodnota přítomnosti CTC je popsána u metastazujícího karcinomu prsu, metastazujícího karcinomu tlustého střeva a metastazujícího karcinomu prostaty.
Vysoká míra nesouladu v expresi receptorů u primárních nádorů a CTC naznačuje, že molekulární charakterizace CTC by mohla určit nový terapeutický cíl u pacientů s metastatickým onemocněním, v tomto konkrétním případě u karcinomu prsu, kde jde o expresi HER2 [10]. Existují také studie, týkající se propojení výskytu CTC a vzniku žilního tromboembolismu. Mego et al. zjistili, že u pacientů s ≥ 1 CTC byl výskyt trombózy čtyřikrát vyšší ve srovnání s pacienty bez CTC [16]. CTC jsou pravděpodobně zapojeny do aktivace koagulace prostřednictvím exprese a uvolněním tkáňových faktorů (TFS) [4, 5].
VÝZNAM CTC U KARCINOMU OVARIA
V tabulce 1 jsou uvedeny recentní studie týkající se různých metod používaných ke stanovení CTCs u karcinomu ovaria a hodnotící délku celkového přežití v měsících u pacientek, které byly na začátku terapeutického procesu CTC pozitivní a CTC negativní a rovněž progresion free interval u CTC pozitivních a negativních pacientek. Z výsledků uvedených studií vyplývá výraznější souvislost CTC negativity s prodlouženou délkou intervalu bez progrese. Rozdíly v měsících celkového přežití nejsou tak výrazné, ovšem i zde je patrný signifikantní rozdíl ve smyslu prodloužení celkového přežití u CTC negativních pacientek.
Tab. 1. Přehled klinických studií, zabývajících se CTC a publikovaných v posledním desetiletí 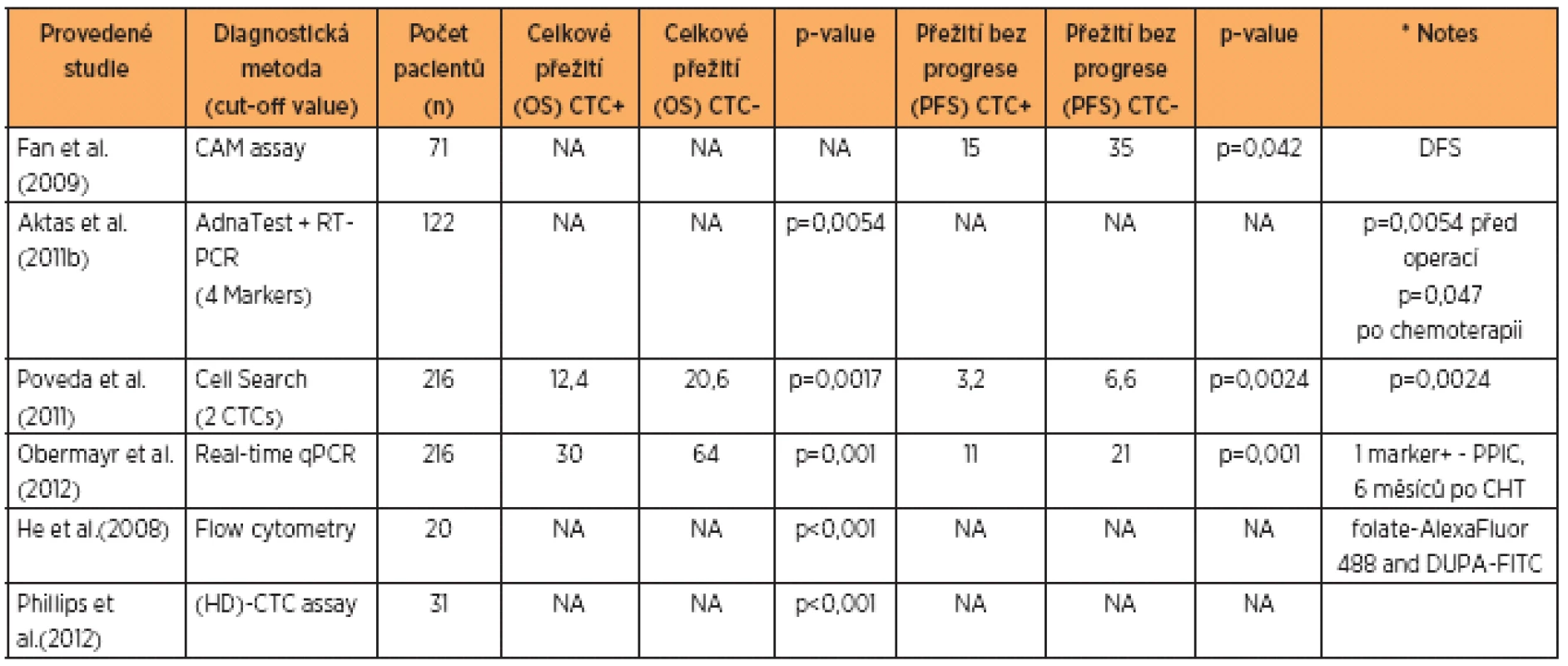
Celkové přežití (OS) a přežití bez progrese (PFS), data pro CTC pozitivní (CTC +) a negativní (CTC-), skupiny pacientů jsou uvedeny v měsících Jednou z řešených otázek bylo, zda je možno pomocí kvantifikace CTCs předpovědět délku, respektive zkracování intervalu přežití bez progrese (PFS) a celkové přežití (OS) u pacientek s recidivou pokročilého ovariálního karcinomu. Vícečetné analýzy ukazují, že vstupní hodnoty CA 125, rezistence či citlivost vůči cisplatině, největší průměr léze, počet nádorových lézí a grade tumoru korespondují s množstvím detekovaných CTCs. V případě zvýšeného počtu CTC je tedy prokázána závislost ve smyslu zkrácení PFS a OS intervalu [2, 25].
U ovariálního karcinomu se jako přesnější, spíše než jen počet CTC či pouhá detekce přítomnosti CTC, jeví sledování overexprese některých genů z krve. Obermayr et al. testovali expresi u 216 pacientek pomocí RT-qPCR. U dvou třetin byla identifikována zvýšená exprese genu cyklofilinu C (PPIC) a jen nízká exprese EpCAM. Přítomnost CTC na začátku léčby souvisí s přítomností ascitu, suboptimálním debulkingem a hladinou CA 125a HE-4, vyšší množství CTC v průběhu léčby bylo zjištěno častěji u pacientek vyššího věku a platina rezistentních pacientek. PPIC pozitivní CTC v průběhu terapie byly významně častěji zjištěny u platina rezistentních pacientek a jsou indikátorem horší odpovědi na první linii chemoterapie platinovými deriváty, nezávisle na klasických prognostických parametrech [18].
V další práci [26] se ověřovala souvislost cirkulujících endotelových progenitorových buněk (EPC) s nádorovou angiogenezí a růstem nádoru. Počet cirkulujících EPC byl stanovován pomocí průtokové cytometrie a soubor tvořilo 25 zdravých žen a 42 pacientek. EPC byly definovány současně expresí CD34 a receptorem cévního endoteliálního růstového faktoru (VEGFR2). Hladiny cirkulujících EPC byly významně zvýšeny u pacientů s karcinomem vaječníků a vykazují korelaci se stadiem nádoru a velikostí nádorového rezidua. Hladiny EPC u pacientek s karcinomem ovaria ve stadiu III a IV byly vyšší než u pacientek ve stadiu I a II nemoci. Po excizi nádoru hladina EPC rychle klesala. Při velikosti nádorového rezidua větší než 2 cm bylo sledováno výrazně vyšší množství EPC. Kromě toho vysoké množství cirkulujících EPC koreluje s délkou OS. Dále byla u pacientek s ovariálním karcinomem rovněž zjištěna over-exprese VEGFR2 a plazmatické hladiny VEGF a MMP-9.
Ukazuje se, že grade a histologický typ nádoru neovlivňuje detekci CTC. Byl zjištěn výrazně kratší disease free interval (DFS) při vyšším množství dia-gnostikovaných CTC a pozitiva CTC byla až v 75 % diagnostikována u stadií III–IV. Avšak větší množství CTC může odrážet pozdější stadium onemocnění a je spojeno s vyššími hodnotami CA 125 [9].
Ve snaze co nejpřesněji kvantifikovat CTCs byly syntetizovány fluorescenční konjugáty dvou vysoce pro tumor afinních specifických ligandů (folátu AlexaFluor 488 a FITC), které vážou nádorové buňky více než 20krát účinněji než fluorescenční protilátky. Využití tumor-specifických fluorescenčních ligandů CTC v periferní krvi může poskytnout jednoduchou, přesnou a citlivou metodu pro stanovení počtu nádorových buněk cirkulujících v krevním řečišti [11].
ZÁVĚR
V posledních letech mnoho výzkumných pracovišť vynakládá nemalé úsilí k pochopení role CTC u pacientů s nádorovým mestastazujícím onemocněním karcinomu ovaria. Přes četné dílčí úspěchy zůstává řada otázek, týkajících se zlepšení terapie onkologických pacientů včetně přípravy na CTC selektivně orientovaných chemoterapeutik, nezodpovězena. K tomu bude nutné pochopení celého procesu metastatické kaskády. CTC jsou generovány v EMT, procesem charakterizovaným down-regulací epiteliálních markerů a up-regulací mezenchymálních markerů. Tyto změny podporují nádorové buňky ke zvýšené motilitě, invazivitě a odolnosti vůči terapii. CTC představují populaci nádorových buněk šířených do vzdálených orgánů s možností následného vzniku mikro - i makrometastatických ložisek. Část nádorových buněk z primárního tumoru a/nebo CTC má vlastnosti kmenových buněk (CSCs). Populace nádorových kmenových buněk má schopnost vlastní obnovy a svědčí o populaci na léčbu rezistentní s horší prognózou. CTC/CSCS mají obrovský potenciál v diagnostice, stanovení prognózy, monitoringu onemocnění, terapeutického účinku a riziku relapsu, a proto je nutné pokračovat v rozvoji a snaze o rozšíření testace CTC na co největší počet pracovišť zabývajících se diagnostikou a terapií gynekologických malignit a zařazení mezi standardní vyšetření u pacientek s karcinomem ovaria, ať už ve stadiu diagnostiky, tak ve stadiu neo-/aud-juvantní terapie.
Podpořeno z výzkumného projektu P 27/2012 Univerzity Karlovy, 3. lékařské fakulty v Praze.
MUDr. Jiří Pavlásek
Gynekologicko-porodnická klinika
3. LF UK a FNKV
Šrobárova 50
100 34 Praha 10
e-mail: jiri-pavlasek@seznam.cz
Zdroje
1. Aktas, B., et al. Stem cell and epithelial-mesenchymal transition markers are frequently overexpressed in circulating tumor cells of metastatic breast cancer patients. Breast Cancer Res, 2009, 11:R46.
2. Aktas, B., et al. Molecular profiling and prognostic relevance of circulating tumor cells in the blood of ovarian cancer patients at primary diagnosis and after platinum-based CHT. Int J Gynecol Cancer, 2011b, 21(5), p. 822–830.
3. Allard, WJ., et al. Tumor cells circulate in the peripheral blood of all major carcinomas but not in healthy subjects or patients with nonmalignant diseases. Clin Cancer Res, 2004, 10, p. 6897–6904.
4. Berni, R., Lang, T., et al. Promotion of experimental thrombus formation by the procoagulant activity of breast cancer cells. Phys Biol, 2011, 8(1):01501.
5. Davila, M., et al. Tissue factor-bearing microparticles derived from tumor cells: impact on coagulation activation. J Thromb Haemost, 2008, 6(9), p. 1517–1524.
6. Demel, U., et al. Detection of tumour cells in the peripheral blood of patients with breast cancer. Development of a new sensitive and specific immunomolecular assay. J Exp Clin Cancer Res, 2004, 23(3), p. 465–468.
7. Dessiter, I., et al. A new device for rapid isolation and characterisation of rare circulating tumor cells. Anticancer Res, 2011, 31(2), p. 427–442.
8. Dickinson, RB., et al. Efficient capture of circulating tumor cells with a novel immunocytochemical microfluidic device. Biomicrofluidics, 2011, 5(3, p. 34119–341195.
9. Fan, J., et al. Clinical significance of circulating tumor cells detected by an invasion assay in peripheral blood of patients with ovarian cancer. Gynecol Oncol, 2009, 112(1), p. 185–191.
10. Giordano, A., Cristofanilli, M. CTCs in metastatic breast cancer. Recent Results Cancer Res. 2012a, 195, p. 193–201.
11. He, W., et al. Quantitation of circulating tumor cells in blood samples from ovarian and prostate cancer patients using tumor-specific fluorescent ligands. Int J Cancer, 2008, 123(8), p. 1968–1973.
12. Kallergi, G., et al. Epithelial to mesenchymal transition markers expressed in circulating tumour cells of early and metastatic breast cancer patients. Breast Cancer Res, 2011, 13(3):R59.
13. Kuhn, P., Bethel, K. A fluid biopsy as investigating technology for the solid phase of solid tumors. Phys Biol, 2012, 9(1):010301. Epub 2012 Feb 3.
14. Lankiewicz, S., et al. Quantitative real-time RT-PCR of disseminated tumor cells in combination with immunomagnetic cell enrichment. Mol Biotechnol, 2006, 34, p. 15–27.
15. Marrinucci, D., et al. Fluid biopsy in patients with metastatic prostate, pancreatic and breast cancers. Phys Biol, 2012, 9(1):016003. Epub 2012 Feb 3.
16. Mego, M., et al. Circulating tumour cells are associated with increased risk of venous thromboembolism in metastatic breast cancer patients. Br J Cancer, 2009b, 101(11), p. 1813–1816.
17. Mikolajczyk, SD., et al. Detection of EpCAM-negative and cytokeratin-negative circulating tumor cells in peripheral blood.J Oncol, 2011, 2011 : 252361.
18. Obermayr, E., et al. Molecular characterization of circulating tumor cells in patients with ovarian cancer improves their prognostic significance – A study of the OVCAD consortium. Gynecol Oncol, 2012 Sep 24. pii: S0090-8258(12)00777-9. doi: 10.1016/j.ygyno.2012.09.021. [Epub ahead of print].
19. Pantel, K., Otte, M. Occult micrometastasis: enrichment, identification and characterization of single disseminated tumor cells. Semin Cancer Biol, 2001, 11, p. 327–337.
20. Parkinson, DR., et al. Considerations in the development of circulating tumor cell technology for clinical use. J Transl Med, 2012, 10, p. 138.
21. Pecot, CV., et al. A novel platform for detection of CK+ and CK - CTCs. Cancer Discov, 2011, 1(7), p. 580–586.
22. Phillips, KG., et al. Optical quantification of cellular mass, volume, and density of circulating tumor cells identified in an ovarian cancer patient. Front Oncol, 2012a, 2 : 72. Epub 2012 Jul 18.
23. Phillips, KG., et al. Quantification of cellular volume and sub-cellular density fluctuations: comparison of normal peripheral blood cells and circulating tumor cells identified in a breast cancer patient. Front Oncol, 2012b, 2, p. 96.
24. Polyak, K., Weinberg, RA. Transitions between epithelial and mesenchymal states: acquisition of malignant and stem cell traits. Nat Rev Cancer, 2009, 9, p. 265–273.
25. Poveda, A., et al. Circulating tumor cells predict progression free survival and overall survival in patients with relapsed/recurrent advanced ovarian cancer. Gynecol Oncol, 2011, 122(3), p. 567–572.
26. Su, YJ., et al. Quantity and clinical relevance of circulating endothelial progenitor cells in human ovarian cancer. J Experiment Clin Cancer Res, 2010, 29, p. 27.
27. Thiery, JP., Sleeman, JP. Complex networks orchestrate epithelial-mesenchymal transitions. Nat Rev Mol Cell Biol, 2006, 7, p. 131–142.
28. Yang, J., Weinberg, RA. Epithelial-mesenchymal transitions: at the crossroads of developement and tumor metastasis. Dev Cell, 2008b, 14, p. 818–829.
29. Ziegelschmidt, et al. Combination of immunomagnetic enrichment with multiplex RT-PCR analysis for the detection of disseminated tumor cells. Anticancer Res, 2005a, 25, p. 1803–1810.
30. Ziegelschmidt, et al. Detection of disseminated tumor cells in peripheral blood. Crit Rev Clin Lab Sci, 2005b, 42, p. 155–196.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicína
Článek EditorialČlánek Melanom vulvy
Článek vyšel v časopiseČeská gynekologie
Nejčtenější tento týden
2013 Číslo 4- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Magnosolv a jeho využití v neurologii
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- Editorial
- Gynekologicko-porodnická klinika FNKV před padesáti lety a dnes
- Diagnostika minimálních karcinomů prsní žlázy
- Laparoskopické řešení borderline tumorů ovaria u žen ve fertilním věku
- Spolupráce mamologa a radiodiagnostika při managementu mamárních lézí ve FNKV
- Retrospektivní analýza efektivity diagnostiky ektopické gravidity transvaginálním ultrazvukovým vyšetřením
- Význam stanovování cirkulujících nádorových buněk v diagnostickém a léčebném procesu u karcinomu ovaria
- Postavení cílené léčby v managementu ovariálního karcinomu
- Melanom vulvy
- Nepenetrující poranění močového měchýře při antiinkontinenční operaci (TVT)
- Profylaktické užití antiinfekčních léčiv v gynekologii
- Solubilní Toll-like receptor 2 v pupečníkové krvi u těhotenství komplikovaných předčasným odtokem plodové vody
- Rýchla detekcia najbežnejších chromozómových aneuploídií z plodovej vody v druhom trimestri tehotnosti využitím QF-PCR
- Peripartální život ohrožující krvácení – intenzivní péče a hematologická léčba
- Léčba noční polyurie desmopresinem
-
Olomouc course, autumn 2013
Publishing a scientific medical article - Podrobné hodnocení morfologie plodu při ultrazvukovém vyšetření ve 20.-22. týdnu těhotenství– doporučený postup
- Aktuální otázky asistované reprodukce v České republice
- 5. celostátní konference Sekce infekčních nemocí v gynekologii a porodnictví ČGPS
- Teoretická a praktická náplň oboru klinická embryologie
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Melanom vulvy
- Laparoskopické řešení borderline tumorů ovaria u žen ve fertilním věku
- Léčba noční polyurie desmopresinem
- Peripartální život ohrožující krvácení – intenzivní péče a hematologická léčba
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



