-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Nádory štítné žlázy – molekulárně genetické příčiny a možnosti cílené léčby
Thyroid tumors – moleculargenetic causes and choices for target therapy
Thyroid tumors are the most common endocrine malignancy. The main genetic changes are point mutations in the RET proto-oncogene (somatic or germ-line) in medullary thyroid carcinoma and point mutations in BRAF and RAS genes or RET/PTC rearrangements in carcinomas developing from follicular cells. Moleculargenetic diagnosis of RET mutations in patients with medullary thyroid carcinoma and their relatives is now the part of clinical approach. Currently, knowledge about genetic causes of thyroid tumors has begun applying into target gene therapy providing new therapeutic drugs and more individualized treatment. This review summarizes main genetic causes of thyroid tumors and their application in target gene therapy.
Key words:
RET, thyroid carcinoma, mutations, gene therapy.
Autoři: Běla Bendlová; Šárka Dvořáková; Vlasta Sýkorová; Eliška Václavíková; Tereza Hálková
Působiště autorů: Endokrinologický ústav Praha, Oddělení molekulární endokrinologie
Vyšlo v časopise: Čas. Lék. čes. 2012; 151: 123-127
Kategorie: Přehledové články
Souhrn
Karcinomy štítné žlázy jsou nejběžnější malignitou endokrinního systému. Hlavními genetickými změnami jsou bodové mutace v RET proto-onkogenu (somatické či zárodečné) v případě medulárního karcinomu, u karcinomů pocházejících z folikulárních buněk se jedná především o bodové mutace v genech BRAF a RAS či vznik tzv. RET/PTC přeskupení. Molekulárně-genetická diagnostika RET mutací u pacientů s medulárním karcinomem a jejich příbuzných je v současné době již součástí klinické praxe. Nyní se poznatky o genetické příčině nádorů začínají aplikovat také do cílené genové terapie, která umožňuje přesnější zacílení nových léčiv a větší individualizaci léčby. Článek shrnuje hlavní genetické příčiny nádorů štítné žlázy a jejich využití v cílené terapii.
Klíčová slova:
RET, karcinomy štítné žlázy, mutace, genová terapie.ÚVOD
Nádory štítné žlázy jsou nejčastější malignitou endokrinního systému. Karcinomy štítné žlázy tvoří nehomogenní skupinu nádorů, lišících se morfologicky i biologickým chováním. Mezi nádory vznikající z folikulárního epitelu patří dobře diferencované karcinomy (DTC) (papilární – PTC a folikulární – FTC), které si jsou podobné některými klinickými vlastnostmi, málo diferencované karcinomy (poorly differentiated thyroid carcinoma – PDTC), označované také jako insulární karcinomy, a velmi agresivní nediferencované karcinomy (anaplastické – ATC). Od parafolikulárních buněk (C-buněk produkujících kalcitonin) je odvozen medulární karcinom štítné žlázy (MTC) (1).
Všechny tyto karcinomy vznikají v důsledku určitých genetických změn vedoucích k aktivaci proteinkináz zapojených do dvou signálních drah – MAPK (mitogen-activated protein kinase), která je důležitá v buněčné proliferaci, diferenciaci a programované buněčné smrti, a PI3K-AKT, která hraje roli v regulaci glukózového metabolismu, v přežívání, adhezi a motilitě buněk (2). Uplatňují se zde především dva molekulární mechanismy – bodové mutace, tzn. jednonukleotidové změny v DNA, a chromozomální přeskupení, při kterém dochází ke zlomu a spojení dvou genů na stejném či odlišném chromozomu. Etiologie obou mechanismů je odlišná. Chromozomální přeskupení mohou vznikat působením radiačního záření (terapeutické či náhodné ozáření, např. po černobylské havárii) či v důsledku blízkosti fragilních chromozomálních míst. Bodové mutace vznikají pravděpodobně chemickou mutagenezí, uvažuje se také o roli vysokého příjmu jódu (1). Většina těchto mutací je somatických, tzn. nacházejících se pouze v nádoru, zárodečné mutace jsou příčinou familiárního medulárního karcinomu (3). Identifikace genetických změn a objasnění jejich role v karcinogenezi je důležitá nejenom z diagnostického a prognostického hlediska, ale poznatky mohou být aplikovány i v léčbě, především v podobě rozvíjející se cílené genové terapie.
Hlavní geny zapojené do karcinogeneze štítné žlázy (tab. 1)
RET proto-onkogen
RET (REarranged during Transfection) proto-onkogen je lokalizován na 10. chromozomu (10q11.2) a má 21 exonů. Kóduje transmembránový tyrozinkinázový receptor s klíčovou úlohou v buněčném růstu, diferenciaci a přežití buněk (4). Skládá se ze tří funkčních domén – extracelulární se čtyřmi kadherinu podobnými oblastmi, doménou vázající vápník a cysteinově bohatou doménou, dále z transmembránové a tyrozinkinázové domény. Mezi cysteiny se tvoří disulfidické vazby, které jsou rozhodující při formování terciární struktury RET proteinu. Po vazbě ligandu na extracelulární oblast receptoru dochází díky cysteinově bohaté oblasti k dimerizaci a autofosforylaci intracelulárních tyrozinových zbytků. Aktivovaný protein stimuluje několik signálních drah, kromě MAPK a PI3K-AKT signální dráhy, také p38MAPK, Src/JAK/STAT3, JNK a proteinkinázu C (5). Za normálních okolností je RET protein exprimován v raných vývojových fázích pouze v buňkách odvozených z neurální lišty. Je tedy nepostradatelný pro vývoj štítné žlázy, ledvin a sympatického, parasympatického a enterického nervového systému. V případě štítné žlázy se vyskytuje pouze v parafolikulárních buňkách. Aktivace RET proteinu je velmi přísně regulovaný, tkáňově specifický proces. Pokud dojde k jeho poruše, stává se účinným onkogenem. U karcinomů štítné žlázy se uplatňují oba výše popsané molekulární mechanismy, které způsobí na ligandu nezávislou aktivaci.
Tab. 1. Hlavní geny zapojené v karcinogenezi štítné žlázy 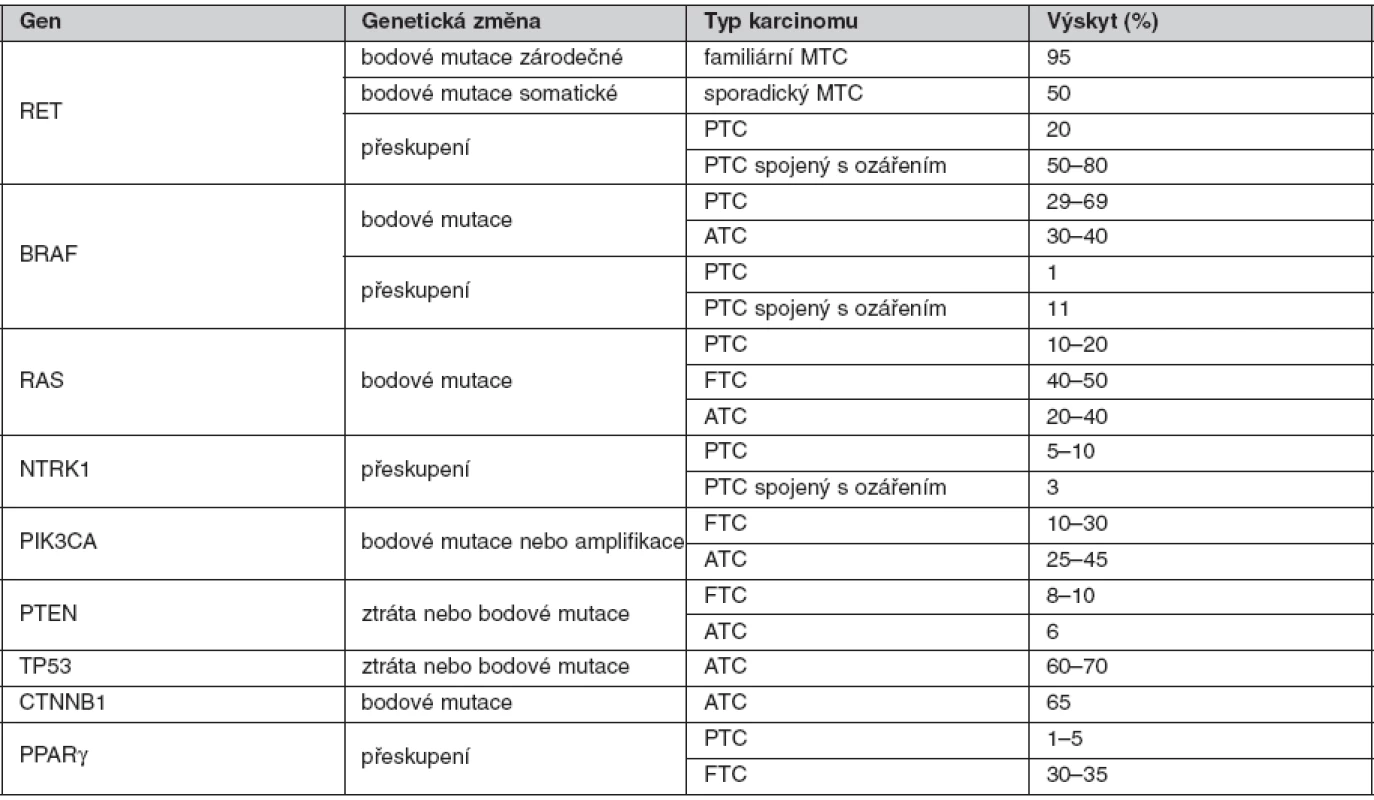
U papilárního karcinomu je RET proto-onkogen aktivován pomocí tzv. RET/PTC přeskupení, kdy dochází ke spojení tyrozinkinázové domény RET genu s jiným běžně exprimovaným genem. Druhý gen poskytuje promotor a dimerizační funkci, a tím dochází k expresi aktivační domény RET genu, který za normálních okolností ve folikulárních buňkách štítné žlázy přepisován není. Neporušená tyrozinkinázová doména RET genu umožňuje RET/PTC proteinu aktivovat MAPK signální dráhu (6). V současné době je známo 12 různých genů tvořících s aktivační doménou RET genu 18 typů RET/PTC přeskupení, nejčastější je RET/PTC1 (s genem CCDC6, dříve H4) a RET/PTC3 (s genem NCOA4, neboli ELE1) (2). Zajímavé je, že všechny zlomy v RET genu jsou v 11. intronu. RET/PTC se vyskytuje asi u 10 až 20 % PTC a je pro tento typ karcinomu specifický. Výskyt RET/PTC je častější u dětí a u pacientů s radiační historií. Prevalence RET/PTC přeskupení v nádorových tkáních je spojena s geografickou variabilitou, ale liší se i v závislosti na použité molekulárně genetické metodě (1). V našem souboru jsme za použití standardních metod nalezli RET/PTC přeskupení u 25,5 % pacientů s PTC. Naše pilotní studie ukazuje, že vznik RET/PTC přeskupení mohou ovlivňovat i některé polymorfismy v RET genu.
U medulárního karcinomu je RET proto-onkogen aktivován bodovými mutacemi a hraje klíčovou roli především u familiárních forem (MEN2A a MEN2B syndromy a FMTC), kde se jedná o zárodečné mutace, na rozdíl od sporadického MTC, kde se somatické mutace vyskytují pouze v nádorové tkáni (7, 8). U MEN2A téměř 90 % mutací postihuje kodón 634 (11. exon), zatímco u FMTC jsou mutace více rozptýleny v extracelulární doméně bohaté na cystein (10., 11., 13., 14. exon). Tyto mutace způsobují dimerizaci mutovaných proteinů a na ligandu nezávislou konstitutivní aktivaci RET kinázy. U syndromu MEN2B se většina zárodečných mutací nalézá v kodónu 918 (16. exon) v intracelulární tyrozinkinázové doméně RET proteinu (9, 10). Předpokládá se, že tato mutace mění substrátovou specificitu RET kinázy, způsobující fosforylaci neobvyklých intracelulárních proteinů. Naše výsledky detekce mutací v RET proto-onkogenu, rozdělení mutací vzhledem k fenotypu a záchyt mutací udávají tabulky 2 a 3. U sporadických MTC postihuje většina somatických mutací kodón 918 (16. exon), což odpovídá i u našeho souboru nádorových tkání (11). Detekce zárodečných mutací umožňuje identifikovat příbuzné pacienta, kteří mají vysoké riziko vzniku MTC a u kterých se proto doporučuje profylaktická operace. Podle klinické závažnosti se dle nových amerických kritérií jednotlivé mutace rozdělují do čtyř rizikových skupin A až D s doporučeným věkem a rozsahem profylaktické operace (12). Do skupiny D se řadí nejagresivnější mutace v kodónech 918 a 883. U těchto pacientů se doporučuje profylaktická operace již do jednoho roku života. Skupina C zahrnuje mutace v kodónu 634 s doporučením operace do 5 let života. U skupiny B (mutace v kodónech 609, 611, 618, 620 a 630) se doporučuje operace také do 5 let života, ale je možné ji provést i později. Nejméně agresivní jsou mutace v kodónech 768, 790, 791, 804 a 891 (skupina A). U těchto pacientů je možné provést profylaktickou operaci až po 5. roce života, případně až při zvýšené hladině kalcitoninu.
Tab. 2. Zárodečné mutace <em>RET</em> proto-onkogenu detekované v českých rodinách s MTC 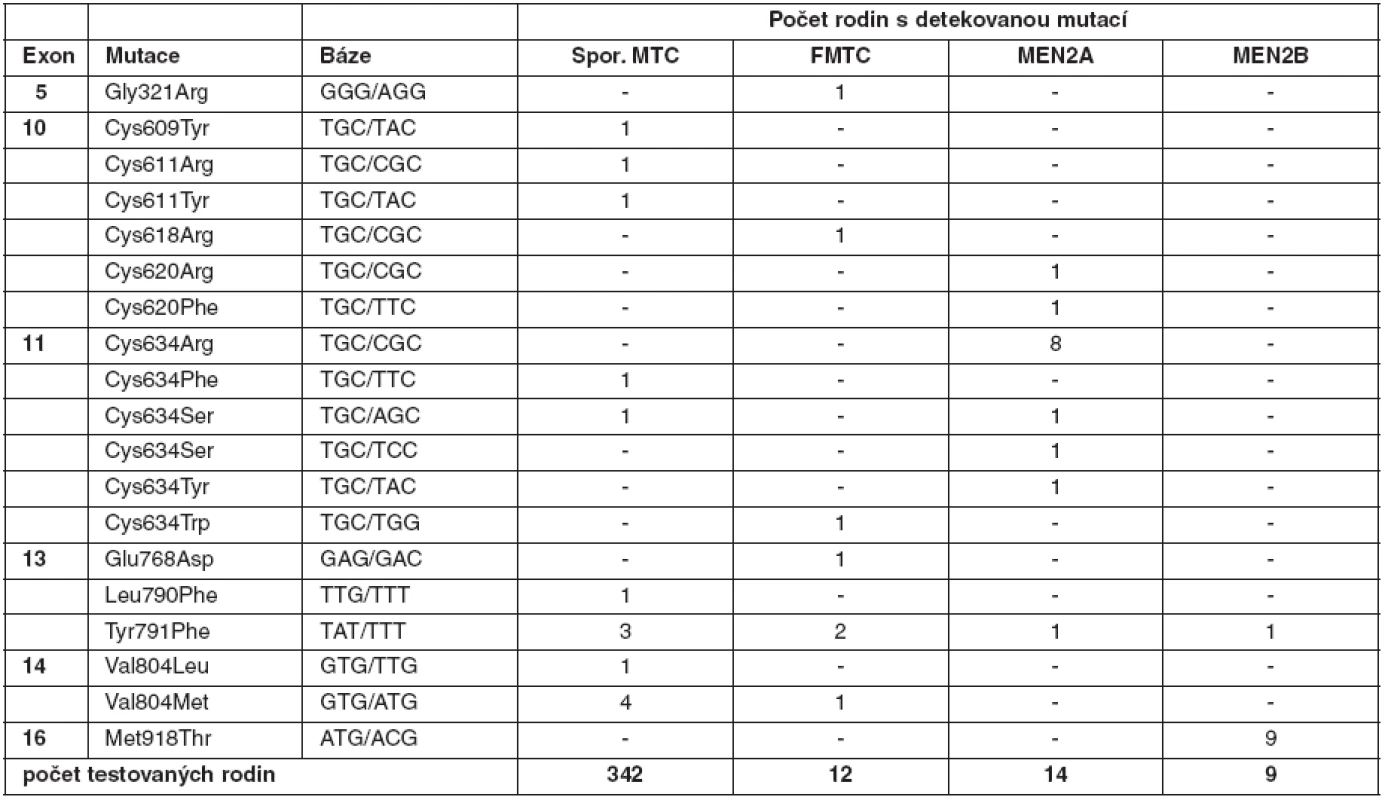
Tab. 3. Procentuální záchyt zárodečných mutací <em>RET</em> proto-onkogenu a výsledky genetické analýzy u probandů a jejich příbuzných v českých rodinách s MTC (celkem testováno 725 osob) 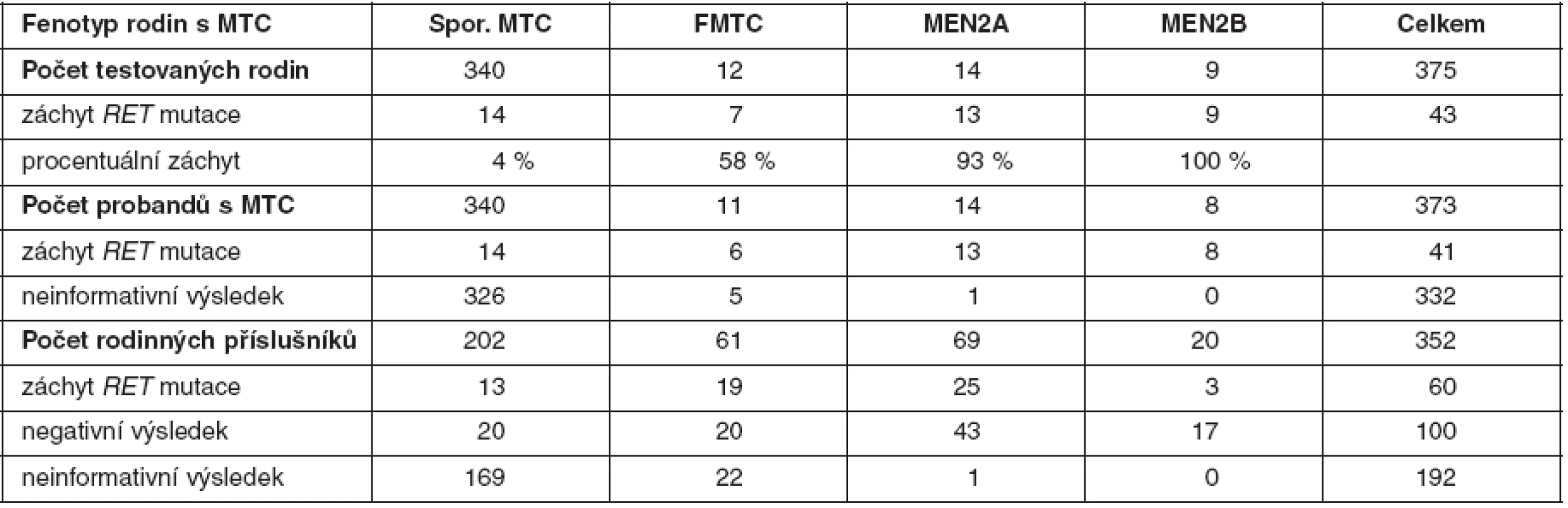
BRAF proto-onkogen
Gen BRAF kóduje serin-threoninovou proteinkinázu, která je součástí MAPK signální dráhy. Gen může být aktivován bodovými mutacemi, malými delecemi či inzercemi v rámci čtecího rámce nebo chromozomálním přeskupením (AKAP9/BRAF). V současné době je známo již přes 40 mutací, ale 98–99 % BRAF mutací nalezených u karcinomů štítné žlázy tvoří substituce V600E v 15. exonu (13). Tato mutace způsobuje konformační změnu, která imituje fosforylovanou formu proteinu, a dochází tak k neustálé aktivaci signální dráhy bez jinak nezbytné stimulace aktivovaným RAS proteinem (14). Mutace V600E je nejčastější mutace nalézaná u PTC a je pro tento typ nádoru specifická. Je nalézána i u 20–40 % PDTC a 30–40 % ATC, ale tyto karcinomy se mohou vyvinout z PTC, jak dokládá nalézaná koexistence obou typů karcinomů (1). V našem souboru 242 českých pacientů s PTC byla mutace detekována u 33,5 % papilárních, 16,7 % málo diferencovaných a jednoho anaplastického karcinomu. U medulárních karcinomů mutace detekována nebyla. Mutace byla daleko méně častá u folikulární varianty PTC (13,2 %) než u klasické papilární varianty (46,4 %). Její přítomnost byla spojena s vyšším věkem v čase diagnózy, větší velikostí nádoru a vyšší agresivitou, především s přítomností metastáz v lymfatických uzlinách, pokročilejším TNM stadiem a recidivou onemocnění (15). RET/PTC a BRAF se jen vzácně vyskytují zároveň, v našem souboru jsme nalezli obě alterace současně u pěti pacientů s PTC.
RAS proto-onkogen
RAS proteiny aktivují MAPK, PI3K-AKT a další signální dráhy a tím regulují proliferaci a přežití buněk. Jsou součástí rodiny GTP vazebných proteinů. V patogenezi nádorů jsou důležité tři geny – H-RAS, K-RAS a N-RAS, které se nacházejí na různých místech v genomu, ale vykazují velkou homologii. Mutace se vyskytují především v GTP vazebné doméně (12. a 13. kodón), kde způsobují zvýšenou afinitu ke GTP, a v GTPázové doméně (61. kodón), kde brání hydrolýze GTP (16). Oba typy mutací způsobují stabilizaci aktivní formy proteinu, a tím také neustálou stimulaci signální dráhy. Mutace RAS genů se nacházejí až u 30 % všech lidských nádorů, ale zatímco u většiny nádorů jsou nejčastější mutace ve 12. a 13. kodónu K-RAS genu, u tyroidálních tumorů jsou nejčastější mutace v 61. kodónu N-RAS genu a 61. kodónu H-RAS genu (17). Mutace RAS se nacházejí u všech nádorů štítné žlázy, u 10–20 % PTC (v podstatě všechny u folikulární varianty PTC), 20–40 % folikulárních adenomů, 40–50 % FTC a 20–40 % PDTC a ATC (1). Byly nalezeny také u MTC (18). V našem souboru 98 pacientů jsme u folikulární varianty PTC nalezli i několik nových genetických změn RAS genů, z nichž některé by dle in silico analýzy mohly výrazně ovlivňovat strukturu proteinu, a hrát tak významnou roli v patogenezi PTC.
Další geny
PAX8/PPARγ přeskupení vzniká chromozomální translokací a fúzí genu PAX8, který kóduje transkripční faktor, a genu PPARγ kódující jaderný receptor (peroxisome proliferator-activated receptor). PAX8/PPARγ je detekován u 30–35 % FTC, ale také u 2–13 % FTA a 1–5 % folikulární varianty PTC (1).
NTRK1 gen (NTRK1 – neurotrophin tyrosine kinase receptor 1, neboli TrkA) je lokalizován na 1q21–22. Kóduje transmembránový receptor nervového růstového faktoru a za normálních okolností je exprimován v periferních nervových gangliích. Ve folikulárních buňkách je aktivován pomocí fúze tyrozinkinázové domény NTRK1 genu s jedním ze tří genů. Jsou známy čtyři formy vyskytující se u méně než 10 % PTC (19). U málo diferencovaných a anaplastických karcinomů se kromě výše popsaných mutací nacházejí ještě další genetické změny, především v tumor-supresorových genech TP53, CTNNB1 (beta-katenin) a genech účastnících se PI3K-AKT signální dráhy (geny PIK3CA, PTEN a AKT1). U onkocytárních (Hürthleho) karcinomů se nacházejí mutace v tumor-supresorovém genu GRIM-19 (NDUFA13), který kóduje protein regulující apoptózu a účastní se mitochondriálního metabolismu (2).
Molekulárně cílená terapie
Klasickou léčbou karcinomů štítné žlázy je většinou radikální chirurgický výkon – totální tyreoidektomie. Jak bylo zmíněno, u familiárních forem MTC je tento výkon indikován i u dosud asymptomatických příbuzných pacienta – nositelů patogenní zárodečné mutace RET genu. U diferencovaných karcinomů následuje po operaci léčba radiojódem. Některé karcinomy ovšem radiojód nepřijímají, především PTC s pozitivní BRAF mutací (13). Navíc karcinomy štítné žlázy recidivují i po mnoha letech, proto je nezbytné doživotní sledování pacienta. Léčba málo diferencovaných karcinomů a anaplastických karcinomů, které jsou často neoperovatelné, je obtížná a prognóza těchto pacientů velmi nepříznivá. Pro pokročilejší metastatické karcinomy a méně diferencované či anaplastické karcinomy se proto hledají nové možnosti léčby. V posledních letech se intenzivně studuje především molekulárně cílená léčba, tedy možnost inhibice abnormálně aktivovaných proteinů zahrnutých do signálních drah, které přímo vedou ke vzniku karcinomů štítné žlázy, nebo dalších signálních drah, které růst nádoru a angiogenezi obecně podporují. V prvním případě se jedná o výše popsané proteiny RET a BRAF, ve druhém především o receptorové kinázy růstových faktorů EGFR (epidermal growth factor receptor), PDGFR (platelet-derived growth factor receptor) a VEGFR (vascular endothelial growth factor receptor), které se podílejí na angiogenezi endoteliálních buněk a jejichž exprese je u karcinomů štítné žlázy často zvýšená (20, 21).
Pro inhibici těchto proteinů je k dispozici několik strategií, zahrnujících RNA interferenci k zastavení exprese genu, genovou terapii s dominantně negativní mutantní alelou nebo využití malých molekul, které slouží jako inhibitory tyrozinkináz. Genová terapie je pro léčbu nádorů štítné žlázy zvláště atraktivní, protože je zde možnost selektivního zacílení terapeutických genů do nádorových buněk aplikací tkáňově specifických promotorů, jako je např. kalcitoninový promotor u MTC, čímž dochází ke snížení mimonádorové toxicity. Možnosti jsou zatím testovány zejména in vitro na tkáňových kulturách nebo na zvířecích modelech (22, 23).
Již v klinické fázi je testování inhibitorů tyrozinkináz (TKI) (24, 25). Mechanismus jejich působení spočívá v blokaci ATP vazebného místa kinázy. Tím se zabrání navázání buněčného ATP, fosforylaci a stimulaci signálních drah. Výhodou TKI je perorální podávání, relativně malá toxicita, nevýhodou je malá specificita inhibitorů pro určitou kinázu a postupná rezistence nádoru k použitému inhibitoru. Tato rezistence je primárně způsobena klonální expanzí nádorových buněk nesoucích sekundární mutace, které mohou chránit kinázu změnou konformace nebo přímo mění vazebné místo pro TKI.
Proti aktivaci RET proteinu bylo vyvinuto několik malých molekul TKI, jejichž testování nejen in vitro a in vivo, ale i v preklinických a klinických studiích přineslo slibné výsledky pro terapii MTC a PTC. Jsou to inhibitory s firemními názvy Vandetanib, Sunitinib, Sorafenib, Motesanib, Imatinib, CEP-751, CEP-701, XL-880, XL-184 a RPI-1, jejichž působení na signální dráhu je zobrazeno na obrázku 1. Klinické studie ukázaly úspěšnost léčby pomocí TKI u 30–50 % pacientů s metastatickým MTC. Nejslibnějším kandidátem z testovaných potenciálních léčiv se zatím jeví Vandetanib (ZD6474). Vandetanib je v první řadě inhibitorem VEGFR-2, ale efektivně blokuje i RET a EGFR (26, 27). Inhibuje tak nádorový růst a působí zároveň jako antiangiogenní agens, přitom má relativně nízkou toxicitu pro okolní tkáně. Vandetanib blokuje růst nádorových lidských linií nesoucích nejčastější mutace RET genu spojené s MEN2B, MEN2A a FMTC i RET/PTC přeskupením, ale není schopný inhibovat aktivaci způsobenou mutací v kodónu 804. Proto je důležité před nasazením léčby provést u pacienta genotypizaci RET genu. U pacientů s metastatickým MTC po podání Vandetanibu klesla hladina kalcitoninu v plazmě a zastavil se nádorový růst. Sunitinib je dalším multikinázovým inhibitorem působícím proti aktivaci RET (včetně RET/PTC), ale také proti PDGFR a VEGFR2 (28).
Obr. 1. Působení inhibitorů na signální dráhu 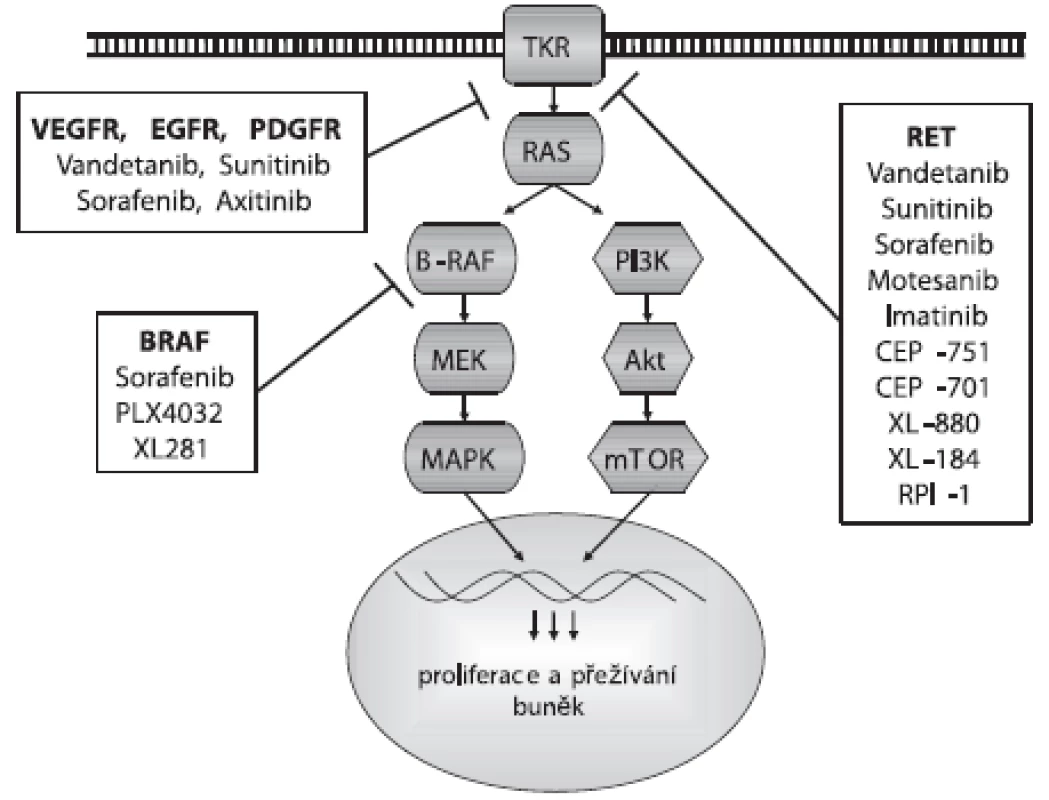
Bylo identifikováno a testováno i několik inhibitorů BRAF proteinu. Jejich použití je výhodné především díky vysokému záchytu mutace BRAF u PTC a její asociací s dediferenciací nádoru a resistencí na radioterapii. Navíc, v MAPK signální kaskádě je BRAF protein až za RET a RAS proteiny, a tak inhibitory BRAF mohou působit efektivně i v nádorech s jinými mutacemi této signalizační dráhy (obr. 1). Sorafenib (BAY43-9006) byl původně vyvinut jako inhibitor BRAF proteinu, ale zjistilo se, že ještě účinnější je u ostatních kináz VEGFR-2, VEGFR-3, PDGFR-beta a RET (včetně RET/PTC a mutace v kodónu 804) (29, 30). Inhibuje proliferaci PTC, MTC a ATC buněk a angiogenezi indukcí endoteliální apoptózy. Efektivně blokuje normální i mutovanou V600E BRAF kinázovou aktivitu. Tento inhibitor byl úspěšně testován u pacientů s metastatickým PTC, FTC a MTC. Dalšími inhibitory proti BRAF jsou PLX4032 a XL281. Oba se váží i na aktivní formu BRAF proteinu, na rozdíl od Sorafenibu, který se váže pouze na inaktivní formu a udržuje ji v inaktivní konformaci (31). Inhibitorem VEGFR je také Axitinib (AG-013736), který je více specifickým proti VEGFR než výše zmíněné TKI. Blokuje také aktivitu PDGFR kinázy (32).
ZÁVĚR
Nádory štítné žlázy, stejně jako všechna nádorová onemocnění, jsou způsobeny genetickými poruchami, nejčastěji aktivací proto-onkogenů či inhibicí tumor-supresorových genů. Znalost těchto genetických poruch je důležitá nejen z pohledu základního výzkumu, ale zejména z diagnostického a prognostického hlediska. Nedávné pokroky v molekulární onkologii umožnily vývoj nových léčebných strategií, které jsou velkým příslibem pro léčbu pacientů, zejména s agresivními formami nádorů štítné žlázy, u kterých jsou možnosti léčby velmi omezené. Průběžné výsledky probíhajících klinických studií, které ověřují účinnost některých inhibitorů tyrozinkináz vypadají velmi nadějně. Možná se v dohledné době dočkáme i cílené genové terapie těchto nádorů, která by umožnila specifičtější zásah a větší individualizaci léčby.
Zkratky
- ATC – anaplastický karcinom štítné žlázy
- DNA – deoxyribonukleová kyselina
- DTC – diferencované karcinomy štítné žlázy
- EGFR – receptor pro epidermální růstový faktor
- FMTC – familiární medulární karcinom štítné žlázy
- FTC – folikulární karcinom štítné žlázy
- GTP – guanozin trifosfát
- MAPK – proteinkináza aktivovaná mitogeny
- MEN2A – mnohočetná endokrinní neoplazie typu 2A
- MEN2B – mnohočetná endokrinní neoplazie typu 2B
- MTC – medulární karcinom štítné žlázy
- PDGFR – receptor pro růstový faktor pocházející z destiček
- PDTC – málo diferencovaný karcinom štítné žlázy
- PPAR – kódující jaderný receptor
- PTC – papilární karcinom štítné žlázy
- TKI – inhibitory tyrozinkinázy
- TNM – tumor-node-metastasis
- VEGFR – receptor pro vaskulární endoteliální růstový faktor
Výzkum genetických poruch u nádorů štítné žlázy byl podpořen grantem IGA MZ ČR NS/9165–3.
Adresa pro korespondenci
RNDr. Běla Bendlová, CSc.
Endokrinologický ústav
Národní 8, 116 94 Praha 1
e-mail: bbendlova@endo.cz
Zdroje
1. Nikiforov YE, et al. Molecular genetics and diagnosis of thyroid cancer. Nat Rev Endocrinol 2011; 7 : 569–580.
2. Mitsuades N, Fagin JA. Molecular Genetics of Thyroid Cancer: pathogenetic significance and clinical applications. Genetic diagnosis of endocrine disorders 2010; 11 : 117–138.
3. Nikiforov YE. Molecular diagnostics of thyroid tumors. Arch Pathol Lab Med 2011; 135 : 569–577.
4. Hansford JR, et al. Multiple endocrine neoplasia type 2 and RET: from neoplasia to neurogenesis. J Med Genet 2000; 37 : 817–827.
5. Lodish MB, et al. RET oncogene in MEN2, MEN2B, MTC and other forms of thyroid cancer. Expert Rev Anticancer Ther 2008; 8 : 625–632.
6. Zitzelsberger H, et al. Molecular rearrangements in papillary thyroid carcinomas. Clin Chim Acta 2010; 411 : 301–308.
7. van Veelen W, et al. Medullary thyroid carcinoma and biomarkers: past, present and future. J Intern Med 2009; 266 : 126–140.
8. Cakir M, et al. Medullary thyroid cancer: molecular biology and novel molecular therapies. Neuroendocrinology 2009; 90 : 323–348.
9. Mulligan LM, et al. Genotype-phenotype correlation in multiple endocrine neoplasia type 2: report of the International RET Mutation Consortium. J Intern Med 1995; 238 : 343–346.
10. Raue F, et al. Genotype-phenotype relationship in multiple endocrine neoplasia type 2. Implications for clinical management. Hormones (Athens) 2009; 8 : 23–28.
11. Dvorakova S, et al. Somatic mutations in the RET proto-oncogene in sporadic medullary thyroid carcinomas. Mol Cell Endocrinol 2008; 284 : 21–27.
12. Kloos RT, et al. Medullary thyroid cancer: management guidelines of the American Thyroid Association. Thyroid 2009; 19 : 565–612.
13. Xing M. BRAF mutation in papillary thyroid cancer: pathogenic role, molecular bases, and clinical implications. Endocr Rev 2007; 28 : 742–762.
14. Wan PT, et al. Mechanism of activation of the RAF-ERK signaling pathway by oncogenic mutations of B-RAF. Cell 2004; 116 : 855–867.
15. Sykorova V, et al. BRAFV600E Mutation in the Pathogenesis of a Large Series of Papillary Thyroid Carcinoma in Czech Republic. J Endocrinol Invest 2010; 33 : 318–324.
16. Namba H, et al. H-Ras Protooncogene Mutations in Human Thyroid Neoplasms. J Clin Endocrinol Metab 1990 : 71 : 223–229.
17. Vasko V, et al. Specific Pattern of RAS Oncogene Mutations in Follicular Thyroid Tumors. J Clin Endocrinol Metab 2003; 88 : 2745–2752.
18. Moura MM, et al. High prevalence of RAS mutations in RET-negative sporadic medullary thyroid carcinomas. J Clin Endocrinol Metab 2011; 96: E863–868.
19. Handkiewicz-Junak D, et al. Molecular prognostic markers in papillary and follicular thyroid cancer: Current status and future directions. Mol Cell Endocrinol 2010; 322 : 8–28.
20. Torino F, et al. Medullary thyroid cancer: a promising model for targeted therapy. Curr Mol Med 2010; 10 : 608–625.
21. Wells SA Jr, et al. Targeting the RET pathway in thyroid cancer. Clin Cancer Res 2009; 15 : 7119–7123.
22. Castellone MD, et al. Receptor tyrosine kinase inhibitors in thyroid cancer. Best Pract Res Clin Endocrinol Metab 2008; 22 : 1023–1038.
23. Cerrato A, et al. Molecular genetics of medullary thyroid carcinoma: the quest for novel therapeutic targets. J Mol Endocrinol 2009; 43 : 143–155.
24. Pinchot SN, et al. Medullary thyroid carcinoma: targeted therapies and future directions. J Oncol 2009; 2009 : 183031.
25. Santarpia L, et al. Beyond RET: potential therapeutic approaches for advanced and metastatic medullary thyroid carcinoma. J Intern Med 2009; 266 : 99–113.
26. Wells SA Jr, et al. Vandetanib for the treatment of patients with locally advanced or metastatic hereditary medullary thyroid cancer. J Clin Oncol 2010; 28 : 767–772.
27. Morabito A, et al. Vandetanib (ZD6474), a dual inhibitor of vascular endothelial growth factor receptor (VEGFR) and epidermal growth factor receptor (EGFR) tyrosine kinases: current status and future directions. Oncologist 2009; 14 : 378–390.
28. Pasqualetti G, et al. The emerging role of sunitinib in the treatment of advanced epithelial thyroid cancer: our experience and review of literature. Mini Rev Med Chem 2011; 11 : 746–752.
29. Hong D, et al. Medullary thyroid cancer: targeting the RET kinase pathway with sorafenib/tipifarnib. Mol Cancer Ther 2008; 7 : 1001–1006.
30. Duntas LH, et al. Sorafenib: rays of hope in thyroid cancer. Thyroid 2010; 20 : 1351–1358.
31. Dienstmann R, et al. BRAF as a target for cancer therapy. Anticancer Agents Med Chem 2011; 11 : 285–295.
32. Deshpande HA, et al. Axitinib: The evidence of its potential in the treatment of advanced thyroid cancer. Core Evid 2010; 4 : 43–48.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek Respirační kaleidoskopČlánek Kniha
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Nádory štítné žlázy – molekulárně genetické příčiny a možnosti cílené léčby
- Autofagie a její úloha v obranné a poškozující zánětové reakci*
- Plánované akce odborných složek ČLS JEP
- Běžná dětská obezita a její metabolické následky
- Plánované akce odborných složek ČLS JEP
- Faktory ovlivňující experimentování s kouřením: výsledky studie ELSPAC
- Kurz koordinátorů HPH (Health Promoting Hospitals, Nemocnic podporujících zdraví) a podzimní škola WHO v Praze
- Zemřel prof. MUDr. Petr Zatloukal, CSc.
- XV. celostátní konference DNA diagnostiky
- Plánované akce odborných složek ČLS JEP
- Jedenáctá konference o menopauze na Seči
- World Medical Association (WMA) o sociálních determinantách zdraví
- 17. ročník onkologického sympózia na téma „Onkologie v gynekologii a mammologii“
- 10. sympozium Aktuality v dětské intenzivní péči v Ostravě
- Respirační kaleidoskop
- Kniha
- Spolek českých lékařů v Praze
- Ocenění České lékařské společnosti JEP prof. MUDr. Pavlu Bartákovi, CSc.
- Velikost endozomů je regulována p97
- EARL WILBUR SUTHERLAND (1915–1974)
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Autofagie a její úloha v obranné a poškozující zánětové reakci*
- XV. celostátní konference DNA diagnostiky
- Běžná dětská obezita a její metabolické následky
- Zemřel prof. MUDr. Petr Zatloukal, CSc.
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



