-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Význam radiochirurgie v léčbě meningiomů
Significance of radiosurgery for the treatment of meningiomas
Treatment of intracranial meningiomas in the light of their benignity (90%) should ensure minimal risk of recurrence, avoid new neurological deficit and preserve quality of life. Stereotactic radiosurgery has proved its long-term effectiveness and safety with a low complication rate. It can be applied as a method of choice for meningiomas in locations that are too risky for microsurgical removal, meningiomas that usually do not exceed 3 cm in diameter and in patients, who are not candidates for microsurgery because of associated disease. It is a part of multimodal treatment for recurrence after operative resection or after partial removal of large meningiomas, where radical surgery represents a high risk of postoperative morbidity and mortality. Indication of radiosurgical treatment of intracranial meningiomas should be considered for each patient individually in order to choose methods or their combination with the lowest risk of complications.
Key words:
meningioma, gamma knife, stereotactic radiosurgery, long term results.
Autoři: Aurélia Kollová 2; Roman Liščák 1; Gabriela Šimonová 1; Vilibald Vladyka 1; Dušan Urgošík 1; Tomáš Chytka 1
Působiště autorů: Oddělení stereotaktické a radiační neurochirurgie, Nemocnice Na Homolce, Praha 1; UPJŠ Košice, Univerzita L. Pasteura, Neurochirurgická klinika 2
Vyšlo v časopise: Čas. Lék. čes. 2011; 150: 250-253
Kategorie: Přehledový článek
Souhrn
Léčba intrakraniálních meningiomů by vzhledem k jejich benignímu (v 90 %) charakteru měla zajistit minimální riziko recidivy, nenavodit nový neurologický deficit a nezhoršit kvalitu života. Stereotaktická radiochirurgie prokázala svoji dlouhodobou efektivitu a bezpečnost s nízkým výskytem komplikací. Může se uplatnit jako metoda první volby u meningiomů v lokalizacích, které jsou pro mikrochirurgický výkon příliš rizikové, obvykle pokud nepřesahují průměr 3 cm a v ostatních případech u pacientů, kteří nejsou kvůli přidruženým onemocněním kandidáty pro otevřenou operaci. Dále je součástí multimodální léčby pro recidivu po resekci anebo po parciálním odstranění rozsáhlých meningiomů, kde by radikální operace představovala velké riziko postoperační morbidity a mortality. Indikaci radiochirurgické léčby intrakraniálních meningiomů je třeba zvažovat pro každého pacienta individuálně s cílem volit metody, případně jejich kombinaci s nejnižším rizikem komplikací.
Klíčové slova:
meningiom, gama nůž, stereotaktická radiochirurgie, dlouhodobé výsledky.Intrakraniální meningiomy
Meningiomy mají svůj původ v arachnoidální výstelce a představují kolem 25 % intrakraniálních tumorů. Jejich incidence v populaci je 2,6–6/100 000 obyvatel. Až v 90 % jsou to tumory benigní, WHO Grade I. Biologicky agresivnější chováni vykazují atypické meningiomy WHO Grade II (4,7–7,2 %) a anaplastické meningiomy WHO Grade III (1–2,8 %) (1–3). Dle posledních zjištění je možné identifikovat meningiomy náchylnější k časným recidivám nejenom histologickým stupněm definovaným počtem mitóz, invazí mozkové tkáně, přítomností nekróz, polymorfních jader a vaskulární proliferací, ale také podle specifických chromozomových aberací detekovatelných pomocí fluorescentní hybridizace in situ (4). Meningiomy se vyskytují více u žen, u mužů jsou pak častější meningiomy s biologicky agresívnějším chováním, u dětí jsou vzácné. Vyskytují se také jako součást neurofibromatózy 2. typu, kdy je jejich výskyt obvykle mnohočetný. Mnohočetné meningiomy se mohou objevit také sporadicky (1–3).
Meningiomy se vyskytují v různých lokalizacích, nejčastěji na konvexitě, na bázi lební a na durálních duplikaturách (falx, tentorium), ale také intraventrikulárně, intraorbitálně anebo ektopicky. Klinická symptomatologie meningiomů je dána jejich velikostí, lokalizací a přítomností kolaterálního edému. I když se jedná o bohatě vaskularizované nádory, krvácení způsobují jen velmi vzácně. V diagnostice meningiomů se uplatňuje v rámci první diagnostické etapy výpočetní tomografie (CT), magnetická rezonance (MRI) má pak nezastupitelné místo v detailním zobrazení meningiomu a jeho vztahu k sousedním strukturám a ke změnám v přilehlé mozkové tkáni, např. otoku. V málo častých případech diagnostických rozpaků je potřebné doplnit stereotaktickou biopsii. Pokud je ale nález na CT a MRI zcela typický a diagnóze meningiomu odpovídá také klinický průběh onemocnění, není histologická verifikace nádoru vyžadována. Na MRI je meningiom typicky s hladkými okraji, dobře ohraničen proti okolní mozkové tkáni. Na T1 vážené sekvenci je meningiom izodenzní a po podání kontrastní látky se výrazně sytí. Typický je „durální ocásek“ přiléhající k hlavní mase nádoru. Častá je přítomnost kolaterálního edému (asi v 60 %), dobře patrného zejména na T2 vážené sekvenci, na které je intenzita signálu meningiomu vzhledem k mozkové tkáni nejčastěji izointenzní až lehce hyperintenzní. Na CT jsou patrné kalcifikace asi u jedné čtvrtiny případů (5).
Léčebné možnosti
Operační resekce nádoru je tradiční léčebnou metodou a jistě stojí na prvním místě u pacientů s velkým anebo klinicky symptomatickým meningiomem, kde je potřebná dekomprese a u meningiomů s výrazným kolaterálním edémem (1–3, 6–12). Otevřená operace je metodou volby u snadno dostupných nádorů na konvexitě a u mladších a interně nezatížených nemocných, kteří mohou podstoupit operační zákrok v celkové anestezii. Výskyt meningiomu je ale nejčastější v 6. až 7. deceniu, kdy může být takovýto zatěžující léčebný postup již problematický.
Radikální resekce je však možné dosáhnout jen u části intrakraniálních meningiomů, lokalizovaných na konvexitě mozku a mozečku (11). Meningiomy báze lební jsou často v kontaktu s vitálními nervovými a cévními strukturami, nebo je dokonce obrůstají, co dělá jejich radikální resekci technicky velmi obtížnou až nemožnou. Dostatečná resekce přilehlé tvrdé pleny v oblasti báze lební je obzvlášť technicky náročná (11, 13–15). I radikálně resekované meningiomy mohou recidivovat po pěti letech až v 4–20 %, subtotálně resekované v 18,4–37 %; po 15 letech je to nejméně dvakrát tolik. Součástí pooperačního sledování jsou proto pravidelné MR kontroly (16–19). Meningiomy jsou z hlediska své lokalizace heterogenní skupinou a dosahované operační výsledky jsou na lokalizaci nádoru výrazně závislé, proto je nelze jednoduše srovnávat.
Prvotním cílem léčby by mělo být uchování kvality života, a pokud ji nelze zajistit mikrochirurgickou operací, je vhodné poohlédnout se po méně rizikových alternativách (20). U parciálně resekovaných nádorů se zvažuje frakcionovaná radioterapie, radiochirurgie anebo sledování pacienta s reoperací při další prokázané progresi nádoru.
Pohled na význam frakcionované radioterapie v léčbě benigních meningiomů není zcela jednotný. Převládá stanovisko, že frakcionovanou radioterapií lze zabránit nebo oddálit recidivu subtotálně odoperovaných meningiomů (21, 22). Na druhé straně některé práce význam frakcionované radioterapie v léčbě reziduálních meningiomů zpochybňují (23) a závažné komplikace byly pozorovány u 56–75 % parciálně resekovaných a následně frakcionovaně ozářených meningiomů (24–26). Provedení frakcionované radioterapie v léčbě maligních meningiomů má nezastupitelné místo, je však nutné ji považovat za paliativní, nikoliv kurativní léčbu (17).
U meningiomů v blízkosti zrakové dráhy se v poslední době stále častěji indikuje frakcionovaná stereotaktická radioterapie – kvůli minimalizaci rizika poškození zraku (27–31).
Jiný způsob fokusovaného ozáření představuje intersticiální brachyterapie. V současnosti u benigních nádorů není ale brachyterapie rozšířeným způsobem léčby. Chemoterapie v léčbě benigních meningiomu nemá zatím uplatnění v praxi (1, 3).
Poslední možnost je pouhá dispenzarizace pacienta bez jakékoliv léčby. Poznatky o přirozeném průběhu onemocnění v případě meningiomu jsou omezené. Jde o pomalu rostoucí nádor a k průkazu progrese nádoru je nezřídka potřebný interval sledování delší než 10 let (17). Růst nádoru při průměrné délce sledování 42–85 měsíců byl pozorován ve 22–76 % (32–35). Roční zvětšování nádoru může být v průměru 2,4 mm, ale až o 10 mm ročně (32). Observace je metodou volby u starších pacientů s kalcifikovanými meningiomy, bez kolaterálního edému, zejména na konvexitě, protože jejich velikost bývá často stacionární, resp. jejich růstová aktivita je velice nízká (33, 36).
Radiochirurgická léčba gama nožem
Radiochirurgický výkon na gama noži pozůstává z připevnění stereotaktického rámu k lebce pacienta v lokální anestezii. Následně je realizováno MR vyšetření s vhodným indikátorovým boxem, které umožňuje kromě vizualizace meningiomu zobrazit kontrastní značky tohoto indikátoru a snímky tak stereotakticky nadefinovat. Snímky z MR jsou importovány do plánovacího softwaru. Příprava plánu ozáření spočívá ve vytvoření prostorové distribuce dostatečně účinné dávky, která velmi přesně konturuje nádor třeba i velmi nepravidelného tvaru a přitom se vyhýbá kritickým strukturám v okolí nádoru. Prudký spád dávky za hranicí nádoru umožňuje aplikovat dávku záření jednorázově, čím se znásobí efekt ozáření na samotný nádor (stejná dávka aplikovaná jednorázově má mnohonásobně vyšší biologický efekt než stejná dávka aplikovaná frakcionovaně), současně ale integrální dávka do okolní zdravé tkáně je natolik nízká, že nevyvolá nežádoucí komplikující odezvu. Podle připraveného léčebného plánu se následně uskuteční samotné ozáření v ozařovací jednotce gama nože. Po jejím ukončení je sňat stereotaktický rám z hlavy nemocného a pacient může ještě tentýž den opustit nemocnici.
Meningiom byl léčen gama nožem poprvé v roce 1971 (37). Cílem radiochirurgické léčby není odstranění tumoru a jeho úplní regrese, ale ovlivnění proliferační schopnosti buněk meningiomu, které tak ztrácejí možnost dalšího dělení. Pro výsledný efekt léčby je důležité, aby byla aplikována dostatečně vysoká dávka do cílového objemu (27, 38). Dosavadní klinické zkušenosti s radiochirurgickou léčbou meninigiomů ukazují, že k zastavení růstu meninigiomu lze považovat za dostatečnou a současně bezpečnou dávku na okraj nádoru v rozmezí 12–15 Gy (39–42). Kontrola růstu meningiomu po radiochirurgické léčbě byla zaznamenaná u 84,3–100 % léčených pacientů. Publikované studie uvádějí 3–13% riziko dočasných komplikací a 1–7% riziko trvalých komplikací (43–55). Nejčastějším nežádoucím účinkem léčby gama nožem je rozvoj, nebo akcentace již existujícího kolaterálního edému. Pokud dojde ke zhoršení klinické symptomatologie v důsledku rozvoje kolaterálního edému, je podávaná antiedémová léčba kortikoidy do vymizení příznaků, nejčastěji po dobu 6–8 týdnů. Zvýšené riziko komplikací mají pacienti s větším objemem nádoru (27, 41, 56, 57). Co se týče lokalizace, vyšší riziko nežádoucích účinku po léčbě gama nožem mají pacienti s meningiomy lokalizovanými parasagitálně a frontobazálně (27, 58, 59, 60). Slabým místem dosavadních studií je doba sledování, která v průměru nepřekračuje dobu 5 let a publikované výsledky jsou proto střednědobé. Na našem pracovišti jsme analyzovali výsledky léčby 400 meningiomů u 368 nemocných léčených do konce roku 1999 (40). Medián sledování byl u těchto nemocných 5 let. V 70 % byla léčba gama nožem primární, předchozí mikrochirurgickou léčbu podstoupilo 30 % pacientů a k radiochirurgické léčbě byl indikován reziduální anebo recidivující nádor. Ve 3 % případů byla léčba vzhledem k velikosti nádoru rozdělena do dvou etap, kdy v odstupu obvykle 6 měsíců se léčila nejdříve jedna a poté druhá polovina objemu nádoru. Dávka na okraj nádoru se pohybovala nejčastěji v intervalu 12–13 Gy. Kontroly nádoru (žádný růst anebo zmenšení meningiomu) bylo při pětiletém sledování dosaženo v 98 %. Zmenšení nádoru jsme pozorovali u 70 % nemocných (obr. 1). Pokračující růst nádoru byl zaznamenán u 2,5 % léčených pacientů a tito nemocní podstoupili další léčbu (polovina z nich otevřenou operaci, zbytek opakovanou léčbu gama nožem, frakcionovaná radioterapie byla doporučena u jednoho pacienta).
Obr. 1. Třicetičtyřletá pacientka s meninigiomem kavernózního splavu vpravo, který se manifestoval diplopií, okraj nádoru je bezpečně vzdálen od zrakové dráhy (T1 vážená sekvence po podání kontrastní látky) (a); 10 let po radiochirurgické léčbě je patrné zmenšení nádoru, trvá diplopie při pohledu do stran (b) 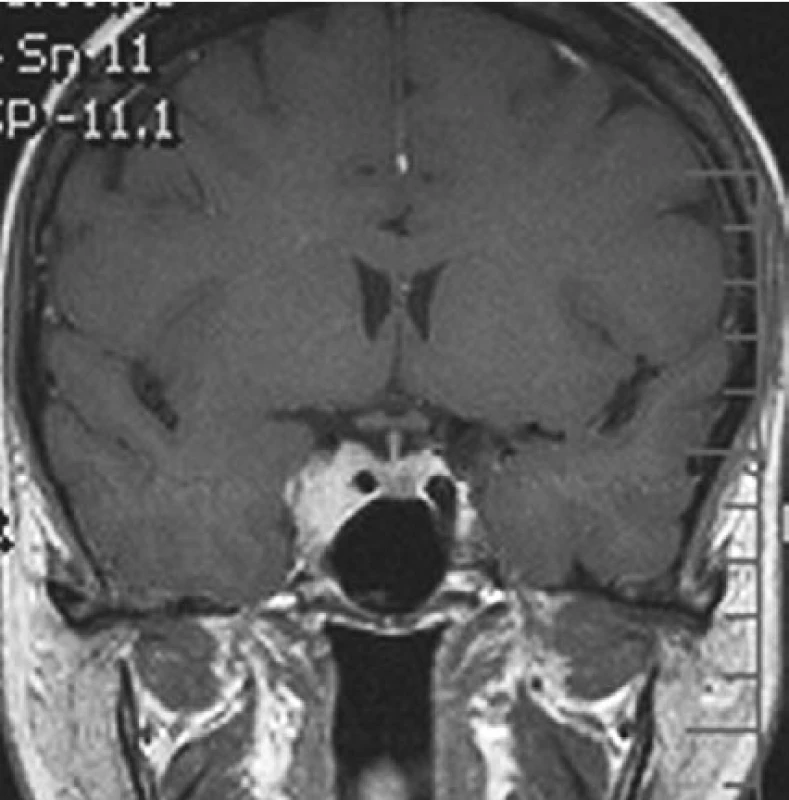
K dispozici máme také analýzu dlouhodobých výsledků u pacientů, kde od léčby uplynulo nejméně 10 let (60). Ve skupině 226 pacientů s 249 meningiomy byla kontrola růstu nádoru 10 let od léčby v 94,7 %. K parciální regresi nádoru došlo v 68 %, stabilizace byla zaznamenaná ve 29 % a progrese ve 3 %.
Indikace k radiochirurgické léčbě
K léčbě meningiomů je nutné přistupovat u každého pacienta individuálně. Rozhodnutí o léčebném postupu, resp. o sledu použitých léčebních modalit musí brát v úvahu velikost a lokalizaci meningiomu, přítomnost kolaterálního edému, věk a klinické symptomy pacienta. Nezřídka je nejvýhodnější multimodální přístup.
Stereotaktický radiochirurgický výkon na gama noži by měl být metodou volby u pacientů s meningiomem báze lební s velikostí do 3 cm, eventuálně do 10 cm3 objemu. V ostatních, neurochirurgicky snadněji dostupných lokalizacích, se k radiochirurgické léčbě přikloní také starší anebo interně nemocní pacienti, pro které by byla celková anestezie a dlouhý otevřený operační výkon příliš riskantní. Další skupinou pacientů indikovaných k radiochirurgickému výkonu jsou pacienti po resekčním výkonu, při kterém byla ponechaná část meningiomu v blízkosti vitálně důležitých struktur, vzhledem na riziko progrese tumoru, eventuálně při dokázané progresi růstu na kontrolním MRI vyšetření. Radiochirurgický výkon je indikovaný také u parafalcinních a parasagittálních meningiomů, je však třeba pamatovat na zvýšené riziko v případě výskytu perifokálního edému, resp. při objemu větším než 10 cm3. Tehdy je vhodné zvážit provedení frakcionované radioterapie, nejlépe stereotakticky anebo moderní konformní ozařovací technikou. Další, narůstající skupinou jsou pacienti, u kterých je víc možností léčby a kteří se rozhodnou pro danou alternativu po prokonzultování všech možností a jejich rizik.
Závěr
Dlouhodobé výsledky léčby benigních meningiomů gama nožem potvrzují, že je to efektivní a bezpečná metoda léčby. Kontroly růstu tumoru je dosaženo po 10 letech podle naší zkušenosti ve 94,7 % s dočasnou morbiditou 13,8 % a trvalou morbiditou 6,4 % (60). Rozhodnutí o nejoptimálnější léčbě meningiomu, resp. o následnosti užití jednotlivých léčebních modalit by mělo být posuzováno pro každého pacienta individuálně.
Adresa pro korespondenci:
doc. MUDr. Roman Liščák, CSc.
Oddělení stereotaktické a radiační neurochirurgie Nemocnice Na Homolce
Roentgenova 2, 150 30 Praha 5
e-mail: roman.liscak@homolka.cz
Zdroje
1. DeMonte F, Marmor E, Al-Mefty O. Meningiomas. In: Kaye AH, Laws ER Jr (eds.). Brain tumors. London: Churchill Livingstone 2000; 719–750.
2. Sanson M, Cornu P. Biology of menigiomas. Review article. Acta Neurochir 2000; 142(5): 493–505.
3. Whittle IR, et al. Meningiomas. The Lancet 2004; 363(9420): 1535–1543.
4. Pfisterer WK, et al. Fluorescent in situ hybridization and ex vivo 1H magnetic resonance spectroscopic examinations of meningioma tumor tissue: is it possible to identify a clinically-aggressive subset of benign meningiomas? Neurosurgery 2000; 61(5): 1048–1059.
5. Drevelegas A, et al. Meningeal tumors. In: Drevelegas A (ed) Imaging of brain tumors with histological correlations. Berlin: Springer 2002; 177–214.
6. Couldwell WT, et al. Petroclival meningiomas: surgical experience in 109 cases. J Neurosurg 1996; 84(1): 20–28.
7. Cudlip SA, et al. Posterior fossa meningiomas: Surgical experience in 52 cases. Acta Neurochir (Wien) 1998; 140(10): 1007–1012.
8. Fahlbush R, Schott W. Pterional surgery of meningiomas of the tuberculum sellae and planum sphenoidale: surgical results with special consideration of ophtalmological and endocrinological outcomes. J Neurosurg 2002; 96 : 235–243.
9. Hirsch WL, et al. Meningiomas involving the cavernous sinus: Value of imaging for predicting surgical complications. AJR 1993; 160 : 1083–1088.
10. De Jesus O, et al. Long-term follow up of patients with meningiomas involving the cavernous sinus: recurrence, progression and quality of life. Neurosurgery 1996; 39 : 915–920.
11. Schaller B, et al. Premeatal and retromeatal cerebellopontine angle meningioma. Two distinct clinical entities. Acta Neurochir (Wien) 1999; 141 : 465–471.
12. Jung HW, et al. Long term outcome and growth rate of subtotally resected petroclival meningiomas. Neurosurgery 2000; 46 : 567–574.
13. Kotapka M, et al. Infiltration of the carotid artery by cavernous sinus meningioma. J Neurosurg 1994; 81(2): 252–255.
14. Larson JJ, et al. Evidence of meningiomainfiltration into cranial nerves: clinical implications for cavernous sinus meningiomas. J Neurosurg 1995; 83(4): 596–599.
15. Sindou MM, Alaywan M. Most intracranial meningiomas are not cleavable tumors: Anatomic-surgical evidence and angiographic predictibility. Neurosurgery 1998; 42(3): 476 – 480.
16. Jung HW, et al. Long term outcome and growth rate of subtotally resected petroclival meningiomas. Neurosurgery 2000; 46 : 567–574.
17. Mathiesen T, et al. Recurrence of cranial base meningiomas. Neurosurgery 1996; 39 : 2–9.
18. Yamashita J, et al. Reccurence of intracranial meningiomas, with special reference to radiotherapy. Surg Neurol 1980; 14 : 33–40.
19. Simpson D. The recurrence of intracranial meningiomas after surgical treatment. J Neurol Neurosurg Psychiatry 1957; 20 : 22–39.
20. Steiner L, et al. Clinical aspects of gamma knife stereotactic radiosurgery. In: Gildenberg P, Tasker R. (eds.) Textbook of Stereotactic and Functional Neurosurgery. New York: McGraw-Hill 1997; 772–774.
21. Goldsmith BJ, et al. Postoperative irradiation for subtotally resected meningiomas. J Neurosurg 1994; 80 : 192–201.
22. Lunsford LD. Contemporary management of meningiomas: radiation therapy as an adjuvant and radiosurgery as an alternative to surgical removal? J Neurosurg 1994; 80 : 187–190.
23. Yamashita J, et al. Reccurence of intracranial meningiomas, with special reference to radiotherapy. Surg Neurol 1980; 14 : 33–40.
24. Mathiesen T, et al. Potential complications following radiotherapy for meningiomas. Surg Neurol 2003; 60 : 193–200.
25. Lunsford LD. Contemporary management of meningiomas: radiation therapy as an adjuvant and radiosurgery as an alternative to surgical removal? J Neurosurg 1994; 80 : 187–190.
26. Girvigian MR, et al. Comparison of early complicationsfor patients with convexity and parasagittal meningiomas treated with either stereotactic radiosurgery or fractionated radiotherapy. Neurosurgery 2008; 62(5 Suppl): A19–A27.
27. Liščák R, a kol. Radiochirurgie gama nožem. Praha: Grada Publishing 2009.
28. Andrews DW, et al. Fractionated stereotactic radiotherapy for the treatment of optic nerve sheath meningiomas: preliminary observations of 33 optic nerves in 30 patients with historical comparison to observation with or without prior surgery. Neurosurgery 2002; 51(4): 890–902.
29. Selch MT, et al. Stereotactic radiotherapy for treatment of cavernous sinus meningiomas. Int J Radiation Oncology Biol Phys 2004; 59 : 101–111.
30. Shrieve DC, et al. Dose fractionation in stereotactic radiotherapy for parasellar meningiomas: radiobiological considerations of efficiacy and optic nerve tolerance. J Neurosurg (Suppl) 2004; 101 : 390–395.
31. Morita A, et al. Risk of injury to cranial nerves after Gamma Knife radiosurgery for skull base meningiomas: experience in 88 patients. J Neurosurg 1999; 90 : 42–49.
32. Olivero WC, et al. The natural history and growth rate of asymptomatic meningiomas: a review of 60 patients. J Neurosurg 1995; 83 : 222–224.
33. Niiro M, et al. Natural history of elderly patients with asymptomatic meningiomas. J Neurol Neurosurg Psychiatry 2000; 68 : 25–28.
34. Van Havenbergh T, et al. Natural history of petroclival meningiomas. Neurosurgery 2003; 52 : 55–62.
35. Yoneoka Y, et al. Growth of incidental meningiomas. Acta Neurochir (Wien) 2000; 142 : 507–511.
36. Nakamura M, et al. The natural history of incidental meningiomas. Neurosurgery 2003; 53 : 62–72.
37. Leksell L. Stereotactic Radiosurgery. J Neurol Neurosurg Psychiatry 1983 : 46 : 797–803.
38. Gildenberg PL, Tasker RR. Textbook of stereotactic and functional neurosurgery. New York: McGraw-Hill 1998.
39. Ganz JC, et al. Radiation - nduced edema after gamma knife treatment for meningioma. Stereotact Funct Neurosurg 1996; 66(Suppl 1): 129–133.
40. Kollová A, et al. Gamma knife surgery for benign meningioma. J Neurosurg 2007; 107 : 325–336.
41. Liščák R, et al. Gamma knife radiosurgery of skull base meningiomas. Acta Neurochir 2004; 91(Suppl): 65–74.
42. Liščák R, et al. Gamma knife radiosurgery of meningiomas in the cavernous sinus region. Acta Neurochir (Wien) 1999; 141 : 473–480.
43. DiBiase SJ, et al. Factors predicting local tumor control after gamma knife stereotactic radiosurgery for benign intracranial meningiomas. Int. J. Radiation Oncology Biol Phys 2004; 60(5): 1515–1519.
44. Iwai Y, et al. Gamma knife surgery for skull base meningiomas. The effectiveness of low-dose treatment. Surg Neurol 1999; 52 (1): 40–45.
45. Lee JY, et al. Stereotactic radiosurgery providing long term tumor control of cavernous sinus meningiomas. J Neurosurg 2002; 97(1): 65–72.
46. Roche PH, et al. Gamma knife radiosurgical management of petroclival meningiomas result and indications. Acta Neurochir 2003; 145(10): 883–888.
47. Shafron DH, et al. Linac radiosurgery for benign meningiomas. Int J Radiation Oncology Biol Phys 1999; 43 (2): 321–327.
48. Spiegelmann R, et al. Linear accelerator radiosurgery for meningiomas in and around the cavernous sinus. Neurosurgery 2002; 51(6): 1373–1380.
49. Stafford SL, et al. Meningioma radiosurgery: tumor control, outcomes and complications among 190 consecutive patients. Neurosurgery 2001; 49(5): 1029–1037.
50. Subach BR, et al. Management of petroclival meningiomas by stereotactic radiosurgery. Neurosurgery 1998; 42(3): 437–443.
51. Pollock BE. Stereotactic radiosurgery for intracranial meningiomas: indications and results. Neurosurg Focus 2003; 14(5): Article 4.
52. Aichholzer M, et al. Gamma knife radiosurgery of skull base meningiomas. Acta Neurochir (Wien) 2000; 42(6): 647–653.
53. Hakim R, et al. Results of linear accelerator-based radiosurgery for intracranial meningiomas. Neurosurgery 1998; 42(3): 446–454.
54. Selch MT, et al. Stereotactic radiotherapy for treatment of cavernous sinus meningiomas. Int J Radiation Oncology Biol Phys 2004; 59 : 101–111.
55. Shrieve DC, et al. Dose fractionation in stereotactic radiotherapy for parasellar meningiomas: radiobiological considerations of efficiacy and optic nerve tolerance. J Neurosurg (Suppl) 2004; 101 : 390–395.
56. Patil CG, et al. Predictors of peritumoral edema after stereotactic radiosurgery of supratentorial meningiomas. Neurosurgery 2008; 63 (3): 435–440.
57. Novotný J Jr, et al. Prediction of intracranial edema after radiosurgery of meningiomas. J Neurosurg 2006; 105(Suppl): 120–126.
58. Kondziolka D, et al. Judicious Resection and/or radiosurgery for parasagittal meningiomas: outcomes from a multicenter review. Neurosurgery 1998; 43(3): 405–414.
59. Kim DG, et al. Gamma knife surgery of superficially located meningioma. J Neurosurg 2005; 102(Suppl): 255–258.
60. Kollová A, et al. Dlhodobé výsledky liečby meningeómov Leksellovým gama nožom. Cesk Slov Neurol Neurochir 2010; 73/106(4): 415–421.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek ÚvodníkČlánek ZprávyČlánek ZprávyČlánek KnihyČlánek Diagnostika sepseČlánek ZprávyČlánek ZprávyČlánek Pokroky v lékových formáchČlánek Zprávy JCLČlánek Laureáti Nobelovy ceny
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Úvodník
- Nemocnice Na Homolce – dvacet let špičkové medicíny
- Aplikace moderní mikroneurochirurgie a současných technologií při řešení nádorových a cévních onemocnění mozku
- Zprávy
- Karcinom ledviny v éře nastupujících robotických technologií
- Zprávy
- Hluboká mozková stimulace u extrapyramidových poruch pohybu – pražská zkušenost
- Antitrombotická terapie po operacích chlopní – současná doporučení a budoucí trendy
- Syndrom časné repolarizace a idiopatická fibrilace komor
- Psychologická péče jako součást interdisciplinární přípravy pacienta k bariatrické operaci
- Minimálně invazivní výkony v cévní chirurgii
- Význam radiochirurgie v léčbě meningiomů
- Temporální epilepsie dospělých a možnosti neurochirurgické léčby: úloha magnetické rezonance
- Zprávy
- Nekonvulzivní status epilepticus
- Význam radiochirurgie v léčbě mozkových metastáz
- Současná farmakoterapie epilepsie
- Knihy
- Diagnostika sepse
- Pedální bypass a jeho role v záchraně kriticky ischemické končetiny
- Zprávy
- Šestileté zkušenosti s operacemi vrozených srdečních vad u dospělých
- Využití vydechovaného oxidu dusnatého v diagnostice astmatu
- 24. český a slovenský neurologický sjezd
- X. a XI. česko-slovenská konference laboratorní hematologie
- Onkologie v gynekologii a mammologii
- 19. lipovské dermatovenerologické fórum
- Mezioborový seminář Třeboň ‘11
- Pokroky v lékových formách
- Doc. MUDr. Milan Jaroš, CSc. – osmdesátiletý
- Docent Radim Kočvara šedesátníkem
- Zprávy JCL
- Laureáti Nobelovy ceny
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Syndrom časné repolarizace a idiopatická fibrilace komor
- Temporální epilepsie dospělých a možnosti neurochirurgické léčby: úloha magnetické rezonance
- Nekonvulzivní status epilepticus
- Využití vydechovaného oxidu dusnatého v diagnostice astmatu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




