-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Mužská plodnost a onkologická léčba
Male fertility and cancer treatment
Approximately 15% of men with newly diagnosed cancer are younger than 55 years, and about 26% of them are younger than 20 years. However the most common cause of fertility disorders is oncological treatment itself, the oncological diseases, changes in anatomy, and primary or secondary hormonal insufficiency are also significant factors. The chemotherapy, radiation, or their combination reduce sperm count, impair sperm motility and cause disorders in morphology and DNA integrity. Prognosis of sperm production recovery depends on the type of cancer, stage of the disease, patient age, drug treatment, treatment route and dosage, and pre-treatment male fertility.
Key words:
male infertility, cancer, chemotherapy, radiotherapy, gonadotoxicity, spermatogenesis.
Autoři: Jiří Heráček 1,2; Vladimír Sobotka 1,2,3; Eva Kindlová 2,4; Václav Eis 2,5; Michael Urban 1,2
Působiště autorů: Univerzita Karlova v Praze, 3. lékařská fakulta, Urologická klinika 1; Fakultní nemocnice Královské Vinohrady, Praha 2; Pronatal, Praha 3; Univerzita Karlova v Praze, 3. lékařská fakulta, Radioterapeutická a onkologická klinika 4; Univerzita Karlova v Praze, 3. lékařská fakulta, Ústav patologie 5
Vyšlo v časopise: Čas. Lék. čes. 2010; 149: 16-20
Kategorie: Přehledový článek
Souhrn
Přibližně 15 % mužů s nově diagnostikovaným nádorovým onemocněním tvoří pacienti mladší 55 let, 26 % z nich je mladších 20 let. Poruchy plodnosti vznikají v důsledku onkologické nemoci, anatomických změn, primární nebo sekundární hormonální nedostatečnosti, nejčastější příčinou je však samotná onkologická léčba. Chemoterapie, radioterapie nebo jejich kombinace snižují počet spermií, poškozují jejich motilitu a způsobují poruchy morfologie a integrity DNA. Pro prognózu obnovy tvorby spermií je důležitý typ nádoru, stadium nemoci, věk pacienta, typ léčiva, způsob podání a dávkování léčby a plodnost muže před léčbou.
Klíčová slova:
mužská neplodnost, nádor, chemoterapie, radioterapie, gonadotoxicita, spermatogeneze.Úvod
Přibližně 15 % mužů s nově diagnostikovaným nádorovým onemocněním tvoří pacienti mladší 55 let, 26 % z nich nedosahuje v době diagnózy věku 20 let (1). Poruchy plodnosti vznikají u těchto pacientů v důsledku onkologického onemocnění (nádor varlete, lymfom), anatomických změn (retrográdní ejakulace nebo anejakulace po retroperitoneální lymfadenektomii) či primární nebo sekundární hormonální nedostatečnosti (hypopituitarismus, hyperprolaktinémie při prolaktinomu). Nejčastější příčinou je však samotná onkologická léčba, při které jsou poškozeny germinální buňky varlete. Vliv protinádorových léčiv na spermatogenezi uvádí tabulka 1 (2). U řady nových látek není vliv na tvorbu spermií znám, např. u taxanů či monoklonálních protilátek. Riziko poruchy plodnosti po léčbě nádoru v dětském věku uvádí tabulka 2 (3).
Tab. 1. Vliv protinádorových léčiv na spermatogenezi 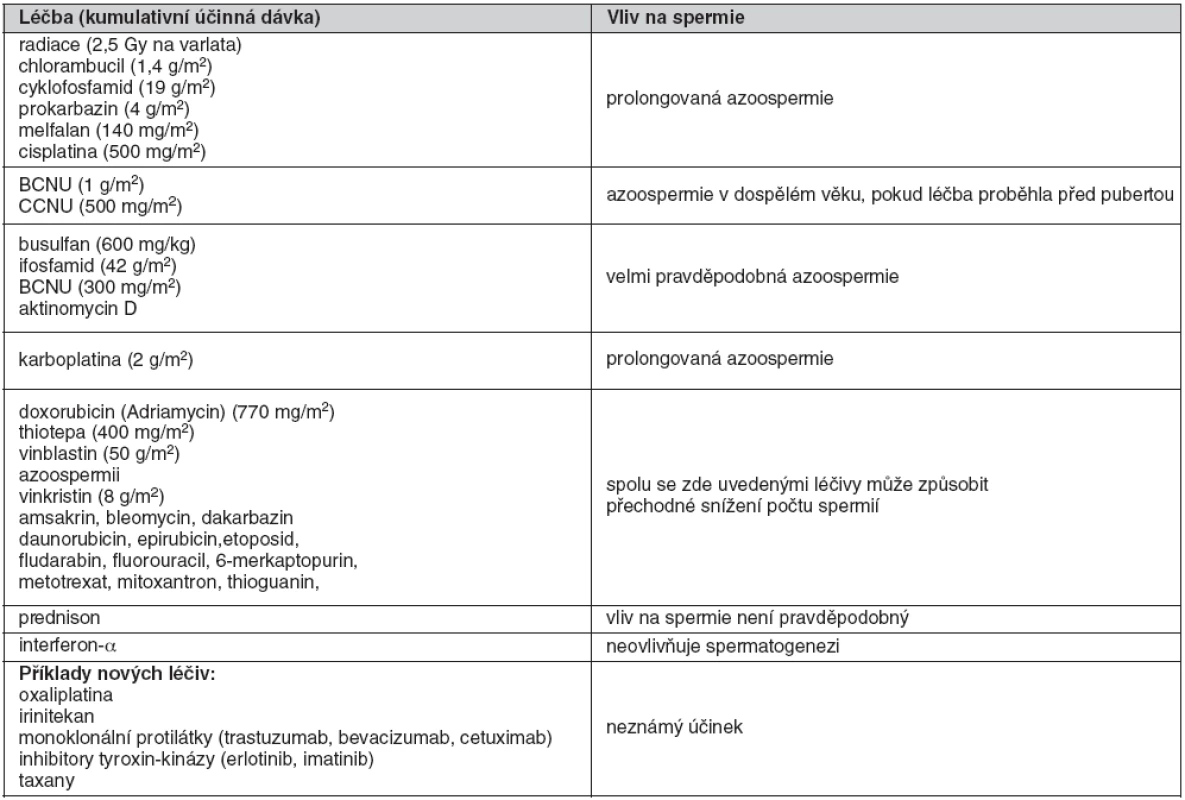
BCNU – karmustin, CCNU – lomustin Tab. 2. Rizika poruchy plodnosti po léčbě nádoru v dětském věku 
Parametry spermií před onkologickou léčbou
Tvorbu spermií ovlivňuje samotný proces zhoubné nemoci. U onkologických pacientů zjišťujeme před začátkem jakékoli léčby výskyt oligozoospermie ve srovnání se zdravými muži častěji. Chung et al. prokázali oligozoospermii u 28 % pacientů s nádory varlat, 25 % s Hodgkinovým lymfomem, 57 % s leukémií a 33 % s nádory žaludku a střev (4). Další studie uvádějí zhoršenou kvalitu ejakulátu u 47–67 % pacientů s Hodgkinovou nemocí. Mezi stupněm poškození spermií a stadiem či systémovými příznaky nemoci však nebyla nalezena žádná souvislost (5). Mechanismus odpovědný za sníženou kvalitu ejakulátu u pacientů s onkologickým onemocněním není jasně popsán. Zřejmě se na něm podílí více faktorů včetně již existujících poruch zárodečných buněk a systémových účinků nádorů (5).
Tvorbu spermií mohou také ovlivňovat látky tvořené nádorem, jako jsou hormony a cytokiny. Nejtěžší poruchy tvorby spermií byly pozorovány ve tkáni varlat v těsné blízkosti nádoru (6). Poruchy tvorby spermií před léčbou jsou dobře prostudovány u pacientů s Hodgkinovou nemocí. Přepokládá se, že porucha rovnováhy mezi subpopulacemi T-lymfocytů, ke kterým dochází u těchto pacientů, mohou vyvolávat dysspermii (7). Hallak et al. pozorovali nízký počet a pohyblivost spermií u pacientů s různými nádorovými onemocněními včetně nádorů centrálního nervového systému. Sníženou kvalitu ejakulátu mohou u těchto pacientů způsobovat endokrinní poruchy na centrální úrovni, systémové důsledky nádoru nebo oba tyto faktory (8).
Toxické účinky onkologické léčby na pohlavní orgány
Některá léčiva snadno pronikají nejen do Leydigových a Sertoliho buněk, ale i do spermatogonií, které se nacházejí na vnějším okraji kanálků varlete. Mnoho cytostatik překoná i bariéru Sertoliho buněk a naruší zárodečné buňky v pozdním stadiu vývoje.
Na účinek cytotoxických látek jsou velmi citlivé především spermatogonie (9). Základem obnovy zárodečných buněk jsou spermatogonie typu A, které přežijí i opakovanou chemoterapii, pokud celková dávka cytostatik nepřekročí kritickou hranici (10). Po cytotoxické léčbě máme často dojem, jako by zárodečné buňky buď v důsledku významného snížení spermatogenních buněk, nebo ztráty podpory somatických buněk, či kombinace obou těchto faktorů, zcela vymizely. Zárodečné buňky v pozdějších stadiích (spermatocyty a další stadia) jsou vůči poškození poměrně necitlivé. To je jedním z důvodů, proč nemá chemoterapie okamžitý vliv na počet spermií a proč k jeho snížení často dochází postupně. V prvních dvou měsících léčby zůstává počet spermií normální nebo se snižuje jen mírně. Tři měsíce po expozici (doba nezbytná pro proměnu diferencujících se spermatogonií ve spermie) se často objeví azoospermie u mužů, kterým podáváme vysoce gonadotoxické látky. Tato indukovaná azoospermie může být dočasná nebo dlouhodobá, závisí na přežití kmenových spermatogonií a jejich schopnosti množit se, diferencovat a produkovat spermie. Při terapii méně toxickými léčivy můžeme pozorovat oligozoospermii či dokonce normozoospermii (11). Studie na zvířatech ukázaly, že buňky v pozdějších stadiích spermatogeneze jsou citlivé na vyvolání mutagenního poškození a mohou dokonce mutace vnesené do jejich DNA přenášet na další generace. Leydigovy a Sertoliho buňky u dospělých jedinců neproliferují a přežijí většinu typů cytotoxické léčby. Může u nich však dojít k funkčním poruchám (9, 10).
Pokud dojde ke ztrátě zárodečných buněk, sekrece inhibinu Sertoliho buňkami se snižuje, a protože inhibin omezuje vylučování folikulostimulačního hormonu (FSH) hypofýzou, zvyšuje se koncentrace FSH v séru. Korelace mezi FSH a počtem spermií v ejakulátu však nebyla jednoznačně prokázána, především v důsledku velkého rozptylu hodnot koncentrací hormonu před léčbou nádoru. Na rozdíl od těchto údajů uvádí studie Petersena et al. spolehlivější korelaci s koncentrací inhibinu B (12).
Mužskou plodnost po léčbě nádoru ovlivňuje řada faktorů. Kromě samotného léku hraje důležitou úlohu způsob jeho podání, typ nádoru, věk, anatomické změny, primární či sekundární hormonální nedostatečnost a plodnost muže před léčbou (13).
Poruchy chromozomů po chemoterapii
U pacientů s nádory varlat nebyl prokázán významný rozdíl ve výskytu početních či strukturálních poruch chromozomů v analýze karyotypu spermií před léčbou a do 13 let po chemoterapii BEP (bleomycin, etoposid a cisplatina). FISH analýzy chromozomů 1, 12, XX a YY v ejakulátu neprokázaly významné rozdíly v četnosti disomií, ale ukázaly významný nárůst frekvence výskytu spermií s chromozomální výbavou 24,XY a diploidních spermií během a po chemoterapii. Potvrzují se tak výsledky studií na zvířatech, které prokazují výrazné riziko vzniku poruch chromozomů mužských spermií během chemoterapie. Tyto poruchy zřejmě s časem ustupují (14–16).
Údaje získané od potomků mužů, kteří nádorové onemocnění přežili, jsou omezené. Jedná se o různé druhy nádorů, léčby, dobu do početí a reprodukční výsledky. V populační studii byl počet živě narozených dětí v rodinách osob, jež nádor přežily a měly abnormální karyotyp, stejný jako u rodin jejich sourozenců (17).
Toxické účinky chemoterapie na pohlavní orgány
Cytostatika s alkylačním účinkem vyvolávají vysoké riziko výskytu azoospermie (18). Hlavním cytostatikem uváděným v současné době v onkologických protokolech pro léčbu nádorů varlat je cisplatina. Poruchy spermatogeneze a endokrinní funkce varlat jsou dočasné, pokud celková dávka cisplatiny nepřesáhne 400 mg/m2 (nebo podle jiných autorů 600 mg/m2). Kombinace s ifosfamidem (42 g/m2) zřejmě toxicitu zvyšuje (9,18).
U pacientů s Hodgkinovou nemocí často používáme léčebný režim MOPP (mustargen, vinkristin, prokarbazin a prednison) a ABVD (doxorubicin, bleomycin, vinblastin a dakarbazin). Zejména prokarbazin (4 g/m2) vyvolává dlouhodobou azoospermii. Doxorubicin (770 mg/m2), vinkristin (8 g/m2) a vinblastin (50 g/m2) jsou toxické pro spermatogenezi, zvláště, pokud je používáme v kombinaci s dalšími onkologickými léčivy. Pokud však podáváme tyto látky samostatně, způsobují pouze dočasné snížení počtu spermií (9).
Toxické účinky radiační léčby na pohlavní orgány
Toxické účinky radiační léčby ovlivňuje mnoho faktorů. Kromě typu radioaktivního zdroje je také důležité, zda je ozařování přímé či rozptýlené. Důležitým faktorem jsou celková aplikovaná dávka a použitý frakcionační režim, tj. dávka použitá na frakci, počet frakcí a délka celé série ozařování. Významnou úlohu mají individuální faktory, např. citlivost nebo věk jedince.
Při radioterapii břicha a pánve je odhadovaná rozptýlená dávka na varlata 1–2 % celkové dávky aplikované na malou pánev. Ozáření šourku bez stínění varlat je s azoospermií spojeno vždy (18).
Snížení počtu spermií způsobují dávky větší než 0,15 Gy. Přímé ozáření (0,15–0,35 Gy) vede k oligozoospermii; dávky mezi 0,35 Gy a 0,50 Gy k reverzibilní azoospermii. Nejvyšší pokles počtu spermií v ejakulátu pozorujeme 4–6 měsíců po ukončení léčby a k úplné obnově spermií dochází 10–18 měsíců po léčbě. Ozařovací dávky nad 6 Gy nejsou spermie schopny přežít. Leydigovy buňky jsou poškozovány přímým ozařováním varlat nad 15 Gy. Toto poškození je nevratné, pokud jsou dávky vyšší než 20 Gy (9, 18, 19).
Na rozdíl od jiných orgánů, u nichž frakcionace dávky snižuje celkové poškození, ozařovací dávky zárodečného epitelu varlat v průběhu 3–7týdenní frakcionace způsobují silnější poškození zárodečných buněk než jedna celková dávka. Pokud je kumulativní dávka vyšší než 2,5 Gy, dochází při frakcionaci k dlouhodobé a často trvalé azoospermii na podkladě nevratného poškození tvorby spermií (9).
Prozatím nejsou dostupné údaje, které hodnotí vliv nových forem radioterapie (např. tomoterapie) na zachování zárodečných buněk či obnovu spermií.
Obnova plodnosti po léčbě
Typ nádoru a koncentrace spermií před léčbou jsou nejdůležitějšími faktory, které ovlivňují parametry ejakulátu po léčbě a obnovu tvorby spermií. Mnoho studií, které vyhodnocují plodnost po léčbě nádoru, však bohužel nehodnotí parametry ejakulátu a hormonální profil mužů před léčbou.
Nádory varlat
Rok po orchiektomii a chemoterapii cisplatinou byla pozorována normozoospermie u 64 % pacientů, po 3–5 letech došlo k obnově tvorby spermií u 80 % pacientů. Dokonce i po 5 letech můžeme u pacientů pozorovat návrat k normální kvalitě ejakulátu. Tyto výsledky však závisí na stavu plodnosti před léčbou a na věku pacienta. U některých mužů dochází k nevratné ztrátě plodnosti. Pravděpodobnost obnovy tvorby spermií je významně vyšší u pacientů léčených karboplatinou než u pacientů léčených cisplatinou (20). U seminomů stadia IA a IIA nebyla po orchiektomii a ozáření paraaortálních lymfatických uzlin (Th 11/12-L5/S1) azoospermie pozorována a obnova tvorby spermií byla bezproblémová (21). Při porovnání pacientů se seminomem stadia I ozářených i na oblast ipsilaterálních pánevních lymfatických uzlin (rozptylová dávka 0,55 Gy) a pacientů, kterým byly ozářeny pouze paraaortální uzliny (rozptylová dávka 0,25 Gy), byly v první skupině 4 roky po léčbě pozorovány významně zvýšené hodnoty FSH a luteinizačního hormonu (LH), avšak žádné změny v parametrech ejakulátu (22). U 40 pacientů, kterým byla ozářena varlata (16–18 Gy) pro intratubulární germinální neoplazii, byly spermatogonie nalezeny pouze u dvou z nich. U ostatních byl v biopsii varlete histologicky diagnostikován Sertoli cells-only syndrom (23).
Hodgkinův lymfom
Při testování plodnosti u 47 mužů s Hodgkinovým lymfomem po chemoterapii MOPP Marmor et al. uvedli výskyt azoospermie u všech pacientů 14 měsíců po ukončení léčby. U některých pacientů začala regenerace po 5 letech, u některých dokonce až za 10 let po léčbě. Pouze jeden z 11 pacientů v dlouhodobém sledování vykazoval téměř normální hodnoty spermiogramu (24). Výsledky dalších studií naznačují, že tři cykly chemoterapie MOPP představují maximální expozici slučitelnou s obnovou tvorby spermií (25).
Režim ABVD zřejmě působí méně škodlivě na tvorbu spermií než léčba MOPP. Studie provedená rok po ukončení chemoterapie ukázala, že u 90 % pacientů léčených režimem ABVD se počet spermií nesnížil, zatímco z devíti pacientů, kteří byli léčeni MOPP, bylo osm azoospermických (26).
Poškození pohlavních orgánů bylo prokázáno u velké většiny mužů, kteří byli léčeni režimem VEBEP (etoposid, epirubicin, bleomycin, cyklofosfamid a prednisolon) s předchozí nebo následnou radioterapií (30–36 Gy) uzlin. U 50 % pacientů bylo toto poškození vratné (27).
Non-hodgkinské lymfomy
Režimy chemoterapie využívané pro léčbu non-hodgkinských lymfomů (NHL) jsou pro pohlavní orgány obvykle méně toxické než režimy pro léčbu Hodgkinova lymfomu, což je zřejmě způsobeno absencí prokarbazinu ve standardní léčbě. Všichni pacienti léčení chemoterapií CHOP (cyklofosfamid, doxorubicin, vinkristin a prednisolon) vykazovali během léčby azoospermii, u 67 % však po 5 letech k obnově tvorby spermií došlo (19).
Transplantace kostní dřeně
Po léčbě pouze cyklofosfamidem pozorujeme obnovu tvorby spermií u 90 % pacientů. Toto procento se snižuje na 50 %, pokud léčbu rozšíříme o busulfan či thiotepu a na 17 % v případě radiace celého těla nebo břicha a pánve. Anserini et al. nezaznamenali obnovu tvorby spermií u žádného pacienta před čtvrtým rokem po transplantaci, pokud byli léčeni cyklofosfamidem v kombinaci s radiací, celkový výskyt azoospermie v souboru byl 70 % (28). Všichni pacienti léčení kombinací karmustinu, etoposidu, cytosin arabinosidu a melfalanu (BEAM) vykazovali azoospermii při dlouhodobém sledování po transplantaci (29).
Karcinom prostaty
V nedávné dotazníkové studii uvedlo neplodnost jako významný problém vzhledem ke svému věku pouze 3,7 % pacientů s karcinomem prostaty (30). V posledních letech pozorujeme zvýšený záchyt karcinomu prostaty i u mladých pacientů. Abychom se po radikální prostatektomii vyhnuli odběru spermií z varlat (TESE), je vhodné nabídnout mladším pacientům kryoprezervaci ejakulátu před výkonem. U pacientů, kteří podstoupili brachyterapii (expozice stydké spony 10 mR/h), nebyly zjištěny významné změny v parametrech ejakulátu (31). Naopak zevní radioterapie je spojena s následnou sníženou tvorbou spermií (32).
Karcinom močového měchýře
Léčba dvanácti mladých pacientů s povrchovým uroteliálním karcinomem (pTa, pT1, pTis) pomocí adjuvantní intravezikální aplikace BCG (bacillus Calmette-Guérin) vakcíny nebo roztoku mitomycinu C (MMC) do močového měchýře prokázala normální objem ejakulátu u všech pacientů kromě jednoho. Šest pacientů, kteří postoupili léčbu MMC, mělo pouze mírně sníženou kvalitu spermií, zatímco tři ze šesti pacientů, kteří byli léčeni BCG, vykazovali výrazné změny ve všech parametrech kvality ejakulátu (33).
U pacientů s vysoce rizikovým povrchovým karcinomem močového měchýře po nervy a semenné váčky šetřící radikální cystektomii byla u sedmi z osmi pacientů zjištěna potenciální plodnost pomocí odběru spermií z moči (34).
Sarkomy dětského věku
Neplodnost u mladých mužů v dětství léčených pro sarkom vícerežimovou terapií se udává až 76 % (35). Longhi et al. prokázali souvislost mezi dávkami ifosfamidu a obnovou plodnosti u mužů s osteosarkomem. U dětí několika málo pacientů, kteří se stali otci po léčbě sarkomu, nebyly pozorovány žádné vrozené poruchy (36).
Radioterapie jódem
Mladí muži s dobře diferencovaným karcinomem štítné žlázy mají velmi dobrou dlouhodobou prognózu, pokud jsou léčeni vysokými dávkami radioaktivního jódu 131I. Léčba karcinomu štítné žlázy radioaktivním jódem může principiálně přechodně poškodit funkci pohlavních orgánů. V prospektivní studii 14 pacientů, kteří byli ozařováni pro karcinom štítné žlázy, hodnotili Hyer et al. funkci gonád na základě měření hladin FSH, LH a testosteronu v séru. Dávku ozáření varlat měřili termoluminiscenční dozimetrií. Studie neprokázala poruchu funkce gonád, i když bylo pacientům třeba provést několik ozáření pro přetrvávající nebo metastazující karcinom štítné žlázy (37).
Radioterapie nádoru konečníku
Herrmann et al. měřili u 11 pacientů (průměrný věk 55 let) dávku na varlata při ozáření pánve a ingvinálních uzlin (50 Gy) při léčbě nádoru konečníku. Průměrná celková dávka ozáření varlat byla 3,56 Gy (0,7–8,4 Gy), takže se předpokládá vysoké riziko trvalé ztráty plodnosti a hypogonadismu (38).
Závěr
Chemoterapie, radioterapie nebo jejich kombinace snižují počet spermií, poškozují jejich motilitu a způsobují poruchy morfologie a integrity DNA. Pro prognózu obnovy tvorby spermií je důležitý typ nádoru, stadium nemoci, věk pacienta, typ léčiva, způsob podání a dávkování léčby a plodnost muže před léčbou.
Nejvíce ovlivňují fertilitu alkylační léčiva (především cyklofosfamid, izofosfamid, nitrosurea, chlorambucil, melfalan, busulfan a prokarbazin) a celotělová radiační léčba. Některá léčiva jsou naopak spojena s nízkým rizikem poruchy plodnosti: metotrexát, flourouracil, vinkristin, bleomycin nebo daktinomycin, sporé informace máme o účincích taxanů. Vliv nových forem radioterapie (např. tomoterapie) na zárodečné buňky není prozatím vyhodnocen.
Zkratky
ABVD – doxorubicin, bleomycin, vinblastin a dakarbazin
BCG – bacillus Calmette-Guérin
BEAM – karmustin, etoposid, cytosin arabinosid a melfalan
CHOP – cyklofosfamid, doxorubicin, vinkristin a prednisolon
FSH – folikulostimulační hormon
LH – luteinizační hormon
MOPP – mechloretamin, vinkristin, prokarbazin a prednison
TESE – testicular sperm extraction
VEBEP – etoposid, epirubicin, bleomycin, cyklofosfamid a prednisolon
Práce vznikla za podpory grantu IGA MZ ČR č. NS9967-4.
Adresa pro korespondenci:
MUDr. Jiří Heráček, Ph.D.
Urologická klinika 3. LF UK a FNKV
Šrobárova 50, 100 34 Praha 10
fax: +420 267 162 999,
e-mail: heracek@fnkv.cz
Zdroje
1. Steliarova-Foucher E, Stiller C, Kaatsch P, et al. ACCIS Scientific Committee. Geographical patterns and time trends of cancer incidence and survival among children and adolescents in Europe since the 1970s (the ACCIS project): an epidemiological study. Lancet 2004; 364 : 2097–2105.
2. DeVita VT, Hellman S, Rosenberg SA. Cancer: Principles & Practice of Oncology (ed 7). Philadelphia: Lippincott Williams & Wilkins 2004; 936.
3. Stephanie JL, Leslie RS, Ann HP, et al. American Society of Clinical Oncology recommendations on fertility preservation in cancer patients. J Clin Oncol 2006; 24 : 2917–2930.
4. Chung K, Irani J, Efymow B, et al. Sperm cryopreservation for male patients with cancer: an epidemiological analysis at the University of Pennsylvania. Eur J Obstet Gynecol Reprod Biol 2004; 113 : 7–11.
5. Agarwal A, Allamaneni SS. Disruption of spermatogenesis by the cancer disease process. J Natl Cancer Inst Monogr 2005; 34 : 9–12.
6. Ho GT, Gardner H, DeWolf WC, et al. Influence of testicular carcinoma on ipsilateral spermatogenesis. J Urol 1992; 148 : 821–825.
7. Barr RD, Clark DA, Booth JD. Dyspermia in men with localized Hodgkin’s disease. A potentially reversible, immune-mediated disorder. Med Hypotheses 1993; 40 : 165–168.
8. Hallak J, Kolettis PN, Sekhon VS, et al. Cryopreservation of sperm from patients with leukemia: is it worth the effort? Cancer 1999; 85 : 1973–1978.
9. Meistrich ML, Vassilopoulou-Sellin R, Lipshultz LI. Adverse effects of treatment: gonadal dysfunction. In: DeVita VT, Hellman S, Rosenberg SA, editors. Cancer: principles and practice of oncology. ed. 7. Philadelphia: Lippincott Williams & Wilkins 2005; 2560–2574.
10. Schrader M, Muller M, Straub B, et al. The impact of chemotherapy on male fertility: a survey of the biologic basis and clinical aspects. Reprod Toxicol 2001; 15 : 611–617.
11. Trottmann M, Becker AJ, Stadler T, et al. Semen quality in men with malignant disease before and after therapy and role of cryopreservation. Eur Urol 2007; 52 : 355–367.
12. Petersen PM, Andersson AM, Rorth M, et al. Undetectable inhibin B serum levels in men after testicular irradiation. J Clin Endocrinol Metab 1999; 84 : 213–215.
13. Magelssen H, Brydoy M, Fossa SD. The effects of cancer and cancer treatments on male reproductive function. Nat Clin Pract Urol 2006; 3 : 312–322.
14. Martin R. Human sperm chromosome complements in chemotherapy patients and infertile men. Chromosoma 1998; 107 : 523–527.
15. Robbins WA, Meistrich ML, Moore D, et al. Chemotherapy induces transient sex chromosomal and autosomal aneuploidy in human sperm. Nat Genet 1997; 16 : 74–78.
16. Wyrobek AJ, Schmid TE, Marchetti F, et al. Relative susceptibilities of male germ cells to genetic defects induced by cancer chemotherapies. J Natl Cancer Inst Monogr 2005; 34 : 31–35.
17. Winther JF, Boice Jr JD, Mulvihill JJ, et al. Chromosomal abnormalities among offspring of childhood-cancer survivors in Denmark: a population-based study. Am J Hum Genet 2004; 74 : 1282–1285.
18. Colpi GM, Contalbi GF, Nerva F, et al. Testicular function following chemo-radiotherapy. Eur J Obstet Gynecol Reprod Biol 2004; 113 (Suppl 1): 2–6.
19. Howell SJ, Shalet SM. Spermatogenesis after cancer treatment: damage and recovery. J Natl Cancer Inst Monogr 2005; 34 : 12–17.
20. Lampe H, Horwich A, Norman A, et al. Fertility after chemotherapy for testicular germ cell cancers. J Clin Oncol 1997; 15 : 239–245.
21. Nalesnik JG, Sabanegh Jr ES, Eng TY, et al. Fertility in men after treatment for stage 1 and 2A seminoma. Am J Clin Oncol 2004; 27 : 584–588.
22. Joos H, Sedlmayer F, Gomahr A, et al. Endocrine profiles after radiotherapy in stage I seminoma: impact of two different radiation treatment modalities. Radiother Oncol 1997; 43 : 159–162.
23. Classen J, Dieckmann K, Bamberg M, et al. German Testicular Cancer Study Group. Radiotherapy with 16 Gy may fail to eradicate testicular intraepithelial neoplasia: preliminary communication of a dose-reduction trial of the German Testicular Cancer Study Group. Br J Cancer 2003; 88 : 828–831.
24. Marmor D, Duyck F. Male reproductive potential after MOPP therapy for Hodgkin’s disease: a long-term survey. Andrologia 1995; 27 : 99–106.
25. da Cunha MF, Meistrich ML, Fuller LM, et al. Recovery of spermatogenesis after treatment for Hodgkin’s disease: limiting dose of MOPP chemotherapy. J Clin Oncol 1984; 2 : 571–577.
26. Tal R, Botchan A, Hauser R, Yogev L, et al. Follow-up of sperm concentration and motility in patients with lymphoma. Hum Reprod 2000; 15 : 1985–1988.
27. Viviani S, Bonfante V, Santoro A, et al. Long-term results of an intensive regimen: VEBEP plus involved-field radiotherapy in advanced Hodgkin’s disease. Cancer J Sci Am 1999; 5 : 275–282.
28. Anserini P, Chiodi S, Spinelli S, et al. Semen analysis following allogeneic bone marrow transplantation. Additional data for evidence-based counselling. Bone Marrow Transplant 2002; 30 : 447–451.
29. Jacob A, Barker H, Goodman A, et al. Recovery of spermatogenesis following bone marrow transplantation. Bone Marrow Transplant 1998; 22 : 277–229.
30. Boyd BG, McCallum SW, Lewis RW, et al. Assessment of patient concern and adequacy of informed consent regarding infertility resulting from prostate cancer treatment. Urology 2006; 68 : 840–844.
31. Mydlo JH, Lebed B. Does brachytherapy of the prostate affect sperm quality and/or fertility in younger men? Scand J Urol Nephrol 2004; 38 : 221–224.
32. Daniell HW, Tam EW. Testicular atrophy in therapeutic orchiectomy specimens from men with prostate carcinoma: association with prior prostate bed radiation and older age. Cancer 1998; 83 : 1174–1179.
33. Raviv G, Pinthus JH, Shefi S, et al. Effects of intravesical chemotherapy and immunotherapy on semen analysis. Urology 2005; 65 : 765–767.
34. Colombo R, Bertini R, Salonia A, et al. Nerve and seminal sparing radical cystectomy with orthotopic urinary diversion for select patients with superficial bladder cancer: an innovative surgical approach. J Urol 2001; 165 : 51–55.
35. Mansky P, Arai A, Stratton P, et al. Treatment late effects in long-term survivors of pediatric sarcoma. Pediatr Blood Cancer 2007; 48 : 192–199.
36. Longhi A, Macchiagodena M, Vitali G, et al. Fertility in male patients treated with neoadjuvant chemotherapy for osteosarcoma. J Pediatr Hematol Oncol 2003; 25 : 292–296.
37. Hyer S, Vini L, O’Connell M, et al. Testicular dose and fertility in men following I (131) therapy for thyroid cancer. Clin Endocrinol (Oxf) 2002; 56 : 755–758.
38. Hermann RM, Henkel K, Christiansen H, et al. Testicular dose and hormonal changes after radiotherapy of rectal cancer. Radiother Oncol 2005; 75 : 83–88.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek ÚvodníkČlánek Kubátův denČlánek Spolek lékařů českýchČlánek KnihaČlánek FRANCIS HARRY COMPTON CRICKČlánek Může nám jít o život!
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
-
Všechny články tohoto čísla
- Role mikroRNA v imunitním systému
- Mužská plodnost a onkologická léčba
- Edukace u schizofrenie: Jak pacienti a příbuzní hodnotí program prevence relapsu PREDUKA
- Posuzování zdravotního stavu a pracovní schopnosti u duševních poruch a poruch chování
- Úvodník
- Autofagie a její membrány jsou hitem!
- Loci na chromozomech ovlivňují menopauzu
- Podobnost HIV A chřipkového viru A
- Globální evropská síť pro léčbu alergií a astmatu (GA2LEN) se zabývá epidemií alergií a astmatu
- Zadluženost lidí s návykovými nemocemi je zdravotní i společenský problém
- HOX geny a vývoj končetin v klinické medicíně i v experimentu
- Kubátův den
- XVI. kongres České společnosti anesteziologie, resuscitace a intenzivní medicíny
- Evropská síť prevence kouření
- Olomoucký pracovní den ČSKB „Laboratorní vyšetření v péči o matku a dítě“
- 10. dermatologické sympozium „Jak léčím já“
- Zemřel profesor MUDr. Vilém Ganz
- Spolek lékařů českých
- Praktická pomůcka pro ty, kdo překonávají návykový problém
- Kniha
- FRANCIS HARRY COMPTON CRICK
- Stratum corneum a význam jeho pH
- Může nám jít o život!
- Středem zájmu jsou membrány autofagozomů
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Mužská plodnost a onkologická léčba
- Edukace u schizofrenie: Jak pacienti a příbuzní hodnotí program prevence relapsu PREDUKA
- Posuzování zdravotního stavu a pracovní schopnosti u duševních poruch a poruch chování
- HOX geny a vývoj končetin v klinické medicíně i v experimentu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



