-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaJe rozdiel v prežívaní pacientov s kraniocerebrálnym poranením s meraným a nemeraným intrakraniálnym tlakom?
Does measuring the intracranial pressure influence survival rates in patients with brain injury?
Objective:
To compare the outcomes and mortality at 7 and 270 days in brain-injured patients with an inserted ICP sensor to those without an ICP sensor.Type of study:
Prospective and comparative clinical study.Materials and methods:
The study population, which consisted of 64 patients with brain injury, was divided into a group with continuous ICP monitoring for 7days and a group without ICP monitoring. The follow-up period was between 7 and 270 days. The recorded values and other relevant data were analysed by methods of descriptive and inductive statistics.Results:
The differences between the groups in survival up to 7 and 30 days were not statistically significant (median survival = 30 days in both groups, P = 0.32). In the group with ICP monitoring, the values below 20 mm Hg were associated with a significantly reduced risk of death. The overall mortality rates within 30 days were not characterized by unusual survival distribution curves. In the period from the 30th up to the 270th day after injury there was a single death recorded.Conclusion:
Trauma patients’ survival depends on the speed and quality of the pre-hospital care followed by adequate treatment in specialized centres. Mortality and survival up to 7 and 30 days were not significantly different between the groups, possibly due to a small sample size.Keywords:
craniocerebral trauma – intracranial pressure monitoring – survival analysis – prediction of neurologic outcome
Autoři: Krbila Štefan 1; Soboňa Viliam 1; Waczulíková Iveta 2; Záhorec Roman 3
Působiště autorů: KAIM FNsP Nové Zámky 1; Matematicko-fyzikálna fakulta Univerzity Komenského, Bratislava 2; II. KAIM LF UK a Onkologického ústavu sv. Alžbety v Bratislave 3
Vyšlo v časopise: Anest. intenziv. Med., 22, 2011, č. 5, s. 272-278
Kategorie: Intenzivní medicína - Původní práce
Souhrn
Cieľ štúdie:
Zhodnotiť súbor pacientov so zavedeným snímačom ICP a bez zavedenia snímača ICP pri kraniocerebrálnych poraneniach. Porovnať letalitu a prežívanie pacientov do 7, 30, 180 a 270 dní v oboch skupinách.Typ štúdie:
Prospektívna komparatívna klinická štúdia.Materiál a metóda:
Súbor tvorilo 64 pacientov s kraniocerebrálnym poranením rozdelených do dvoch skupín, s kontinuálne monitorovaným ICP po dobu 7 dní a nemonitorovaným ICP. Obdobie ďalšieho sledovania bolo v rozmedzí 7–270 dní. Namerané hodnoty a ďalšie zaznamenané údaje boli analyzované metódami deskriptívnej a induktívnej štatistiky.Výsledky:
Rozdiely medzi skupinami v prežívaní do 7 dní a do 30 dní neboli štatisticky významné (medián prežitia = 30 dní v oboch skupinách, p = 0,32). V skupine s monitorovaným ICP hodnoty pod 20 mm Hg boli spojené s významne nižším rizikom úmrtia pacienta v danom období. Celková mortalita do 30 dní sa nevyznačovala extrémom v časovom priebehu krivky prežívania. V časovom úseku 30–270 dní sme zaznamenali jedno úmrtie (1,6 %).Záver:
Prežívanie pacientov závisí od rýchlosti a kvality poskytnutia prednemocničnej lekárskej starostlivosti a od následnej adekvátnej liečby na špecializovaných pracoviskách. Krivky prežívania a mortalita pacientov do 7 a do 30 dní sa medzi skupinami štatisticky nelíšili. Vyššiu proporciu mortality vo včasnej hospitalizačnej fáze u nemonitorovaných pacientov nie je možné potvrdiť, ani vylúčiť. Doporučujeme pokračovať v štúdii s cieľom zvýšiť silu štatistických testov rozšírením súboru pacientov.Kľúčové slová:
kraniocerebrálne poranenie – meranie intrakraniálneho tlaku (ICP) – analýza prežívania – prognóza miery a stupňa neurologického zotaveniaÚvod
Moderné postupy v liečbe poranenia mozgu sa začali uplatňovať v 60. rokoch 20. storočia, keď Lundberg publikoval práce o meraní intrakraniálneho tlaku. Táto metodika so zavedením štandardizovaných terapeutických postupov znížila rozsah sekundárneho posttraumatického poškodenia mozgu [1].
V roku 1996 boli prvý raz publikované jednotné postupy diagnostiky a liečby ťažkého kraniocerebrálneho poranenia (KCP) odporúčané Americkou neurochirurgickou asociáciou (AANS – American Association of Neurological Surgeons) a Spoločnosťou pre kraniocerebrálne poranenie (TBIF – Trauma Brain Injury Foundation). Ich pravidelná aktualizácia výrazne prispieva k zníženiu mortality a morbidity pacientov s kraniocerebrálnym poranením [2].
Vo väčšine prípadov je kraniocerebrálne poranenie súčasťou polytraumatizmu, rozsah ktorého výrazne ovplyvňuje morbiditu a mortalitu pacientov v negatívnom zmysle.
Najčastejšou príčinou kraniocerebrálnych poranení sú dopravné nehody, druhú skupinu tvoria pády z výšky a strelné poranenia, treťou v poradí sú pracovné úrazy. V súčasnej dobe medzinárodných vojenských konfliktov stúpa incidencia kraniocerebrálnych poranení vzniknutých počas vojnových konfliktov a blast syndrómu v dôsledku poškodenia mozgu tlakovou rázovou vlnou.
Zmyslom tejto štúdie bolo zistiť, do akej miery meranie, alebo nemeranie ICP pri KCP môže ovplyvniť prežívanie pacientov v krátkom časovom úseku od vzniku traumatickej udalosti. Položili sme si klinickú otázku: či úmrtnosť v skupine s nemeraným ICP je vyššia ako v skupine s meraným ICP. Medzi odborníkmi stále prebiehajú diskusie o prínose ICP monitorovania. Keďže ICP monitoring nie je bez chýb a rizík, ako sú napr. nesprávne umiestnenie snímača, kolabované komorové priestory, možnosť intrakraniálnej hemoragie a mechanické zlyhania ICP snímača [3]. Infekcia v súvislosti s inzerciou ICP snímača dosahuje 6–11 % v prípade ponechania v časovom intervale dlhšom ako 6 dní [3, 4]. Incidencia bakteriálnej kolonizácie intraparenchýmového snímača bez klinických známok infekcie dosahuje 10 % [4]. Treba ale uviesť, že mortalita závažnej kraniocerebrálnej traumy a jej klinického výsledku sa v skupine bez inzerovaného snímača výraznejšie nezmenila [5].
Súbor pacientov a metódy
Od 1. 1. 2009 do 31. 12. 2010 boli na našej klinike hospitalizovaní pacienti s kraniocerebrálnym poranením, privezení primárne z terénu, alebo sekundárne z iného zdravotníckeho zariadenia, kde bolo zistené kraniocerebrálne poranenie s nutnosťou neurochirurgickej intervencie. Jednalo sa prevažne o pacientov v bezvedomí s GCS (Glasgow Coma Scale /Score) pod 9 bodov, s nutnosťou umelej pľúcnej ventilácie. Pacienti privezení z miesta nehody mali ihneď vykonané CT vyšetrenie mozgu. Podľa CT nálezu stav vyžadoval buď neurochirurgickú intervenciu, alebo konzervatívnu liečbu s následným zavedením snímača ICP. Monitorovanie intrakraniálneho tlaku prebiehalo v prípade prežitia počas 7 dní. Kontrolné CT vyšetrenie mozgu bolo vykonané do12–24 hodín po operačnom výkone. Pri vyšších hodnotách ICP, nereagujúcich na liečbu, bolo CT vyšetrenie vykonané ihneď. U pacientov bez snímača ICP bolo kontrolné CT vyšetrenie vykonané do 12 hodín od operačného výkonu a opakované podľa výsledku predchádzajúceho CT vyšetrenia, alebo podľa klinického stavu. U pacientov bez zavedeného snímača ICP a bez operačného výkonu bolo CT vyšetrenie vykonané bezprostredne po prijatí na lôžko a následne po 12 hod., alebo podľa klinického stavu. Štúdiu sme vykonali zo súhlasom Etickej komisie FNsP v Nových Zámkoch. Jedná sa o prospektívnu, komparatívnu a kontrolovanú klinickú štúdiu.
Súbor pacientov bol rozdelený do dvoch skupín, s meraným intrakraniálnym tlakom (ICP skupina) a s nemeraným ICP (NM skupina) kvázi-náhodným výberom pri rovnakom klinickom stave a identických liečebných postupoch. Randomizácia nemohla byť zabezpečená matematickými postupmi, protože zaradenie pacienta ovplyvňovali dostupnosť monitorovacieho zariadenia a etické princípy. Pre overenie homogénnosti oboch skupín a na adjustáciu možných nerovnomerne rozložených faktorov boli naplánované zodpovedajúce metódy analýz dát.
Na súbore pacientov sme využívali nasledovné metódy monitorovania a spôsoby klinického sledovania:
- inzercia snímača ICP, kontinuálne meranie ICP, CPP, telesnej teploty;
- kontinuálne invazívne meranie arteriálneho TK;
- pravidelné meranie CVT;
- pravidelné vyhodnocovanie GCS, neurologického stavu;
- vyhodnotenie doby hospitalizácie, letality na KAIM;
- vyhodnotenie neurologického stavu pomocou GOS (Glasgow Outcome Scale/Score) po 7., 30., 180. a 270. dňoch (tab.1, tab. 2).
Tab. 1. Protokol neurointenzívnej starostlivosti u pacientov s meraným ICP 
Tab. 2. Protokol neurointenzívnej starostlivosti u pacientov s nemeraným ICP 
Z uvedených parametrov sme v práci vyhodnocovali nasledovné parametre neurologického stavu: GCS, GOS, intrakraniálny tlak (ICP), a hemodynamiky: cerebrálny perfúzny tlak (CPP) a stredný arteriálny tlak (MAP).
Na meranie a kontinuálne monitorovanie intrakraniálneho tlaku sme používali snímač CODMAN od výrobcu Johnson & Johnson, ktorý bol po kalibrácii napojený na monitor vitálnych funkcií.
Štatistická analýza
Charakteristiky pacientov a klinické dáta, ktoré sú v aspoň intervalovej mierke, popisujeme ako priemer a smerodajnú odchýlku (SD) v prípade, že dáta boli normálne rozdelené. Ak Shapirov-Wilkov test normalitu nepotvrdil, uvádzame medián s príslušným dolným a horným kvartilom. Kategorické premenné popisujeme ako absolútne alebo relatívne (v %) početnosti.
Pre testovanie rozdielov v jednotlivých premenných medzi skupinami monitorovaných pacientov (ICP, n = 28) a nemonitorovaných pacientov (NM, n = 36) v danom čase sme použili nepárový t-test, ak boli dáta normálne rozdelené – v opačnom prípade sme použili neparametrický Mannův-Whitneyův U test. Kategorické premenné sme testovali binomickým testom pre dve nezávislé proporcie.
Prežívanie sme vyhodnotili metódou Kaplanových - -Meierových kriviek a charakterizovali mediánom prežitia spolu s 95% intervalom spoľahlivosti (95% CI). Rozdiely medzi krivkami prežitia pre obe skupiny sme testovali log-rankovým testom v Peto-Prentice modifikácii.
V skupine monitorovaných pacientov sme sledovali priebehy zaznamenaných priemerných ICP hodnôt po stratifikácii skupiny na pacientov, ktorí prežili dobu sledovania 180 dní od vzniku traumy (S-survived, n = 5) a na tých, ktorí traumu neprežili (D-dead, n = 23). Časové priebehy ICP sme testovali analýzou variancie pre jeden faktor s opakovaním.
Testovanie vzťahov medzi faktormi (možnými prediktormi) a prežitím sme analyzovali viacnásobnou logistickou regresiou. Pre prediktory uvádzame hodnotu pomeru šancí OR (odds ratio), ktorá vyjadruje šancu realizácie výstupu (prežitie, zaklasifikovanie do skupiny) pri jednotkovej zmene sledovanej charakteristiky. Kvalitu fitovania modelom sme stanovili chi-kvadrát testom dobrej zhody a významnosť modelu chi-kvadrát testom pomeru pravdepodobností.
Vo všetkých prípadoch sme použili dvojstrannú alternatívu testu a významné rozdiely postulujeme pri hodnote p ≤ 0,05.
Výsledky
Porovnávali sme dve skupiny pacientov s meraným intrakraniálnym tlakom (ICP skupina) a nemeraným intrakraniálnym tlakom (NM skupina), ktoré boli charakterizované vekom, zastúpením pohlaví, hodnotou GCS a zastúpením polytraumatických pacientov (tab. 3). Skupiny mali rovnaké vekové zloženie, zastúpenie pohlaví a nevýznamne rozdielne zastúpenie výskytu polytraumatických pacientov. Z klinických dôvodov je medzi skupinami významný rozdiel v zastúpení pacientov s GCS=3 – pacienti s vyšším GCS boli pridelení do skupiny NM. Pacienti s GCS = 3 boli do skupín zaraďovaní jednoduchou randomizáciou. Logistická regresia tiež ukázala, že na zaklasifikovanie pacienta do skupiny ICP alebo NM vstupná hodnota GCS pri súčasnej adjustácii na vek významne nevplýva (PGCS = 0,99; pvek = 0,98; významnosť celého modelu p = 0,0007). Rovnaký výsledok sme získali pre výstup na prežitie pacienta (PGCS = 0,98; pvek = 0,37; významnosť celého modelu p = 0,047). V oboch prípadoch model dobre „fitoval“ dáta. V priemere teda GCS/ 0. deň neovplyvňuje prežitie, a to napriek nerovnomernému rozloženiu GCS u pacientov v skupinách ICP a NM. Pre model prežitia pomerne nízka hodnota pravdepodobnosti pre vek poukazuje na očakávaný trend väčšieho rizika pre vyšší vek (OR = 0,98; 95% CI: 0,95–1,01).
Tab. 3. Počiatočné charakteristiky skupín 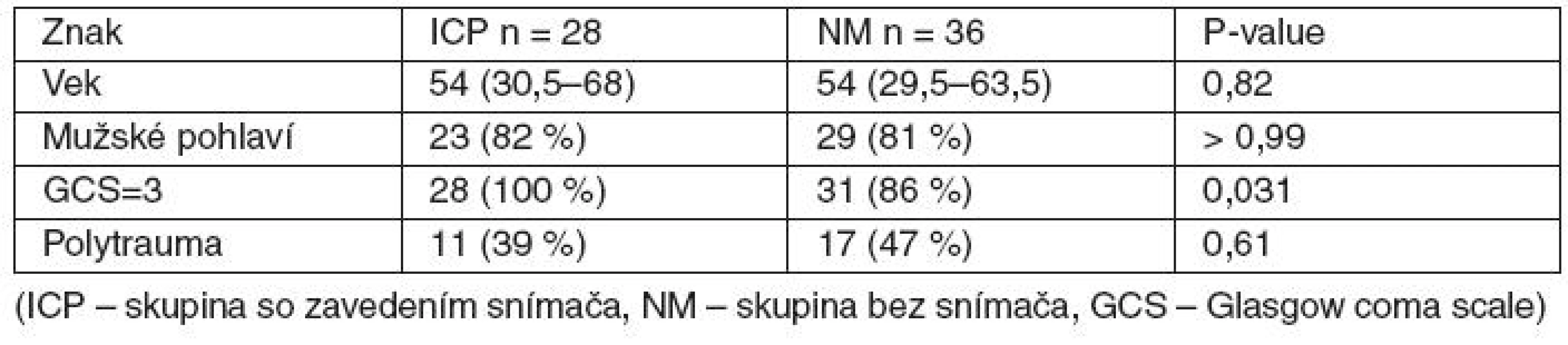
Ďalšie zaznamenané údaje v študovaných skupinách
Dĺžka hospitalizácie sa medzi skupinami významne nelíšila (p = 0,17). V skupine ICP bol medián 8 dní (6–12) a v skupine NM 6,5 dní (4–10,5). V dĺžke potreby umelej pľúcnej ventilácie sa skupiny významne líšili (p = 0,0048). V skupine ICP bol medián 8 dní (4–11) a v skupine NM 4 dni (1–8,5). Ďalej v skupine monitorovaných pacientov bolo potrebné CVVHD (Continuous Veno-venous Hemodialysis) u dvoch pacientov, kým v skupine NM CVVHD nebolo vykonané (p = 0,10).
Celkovo bolo v oboch skupinách operovaných 30 pacientov, z toho 21 so zavedeným snímačom ICP (70 %) a 9 bez zavedenia snímača ICP (30 %). Neoperovaných pacientov bolo 34, z toho 7 so zavedeným snímačom ICP (21 %) a 27 bez zavedenia snímača ICP (79%).
Analýza prežívania v skupinách
Kaplanove-Meierove krivky prežívania (obr. 1) sa medzi skupinami ICP a NM významne nelíšili (p = 0,32). Čas 50% prežitia v dňoch bol v skupine ICP rovnaký (30, 95% CI: 21,8 až 38,2) ako v skupine NM (30, 95% CI: 20,0–39,9). Skupina nemonitorovaných pacientov sa líšila vyššou úmrtnosťou vo včasných štádiách (tab. 4). Vzhľadom na nízky počet subjektov však nebolo možné rozdiel v proporciách spoľahlivo testovať. Dominujúcou príčinou všetkých úmrtí do 7 dní a do 30 dní od kritickej udalosti v oboch skupinách bola hlboká kóma (GCS = 3 body) po kraniotraume.
Obr. 1. Kaplanove-Meierove krivky prežívania pacientov s KCP s meraným (štvorec) a nemeraným (krúžok) intrakraniálnym tlakom (ICP) Cenzurovaná udalosť je označená čiarkou. 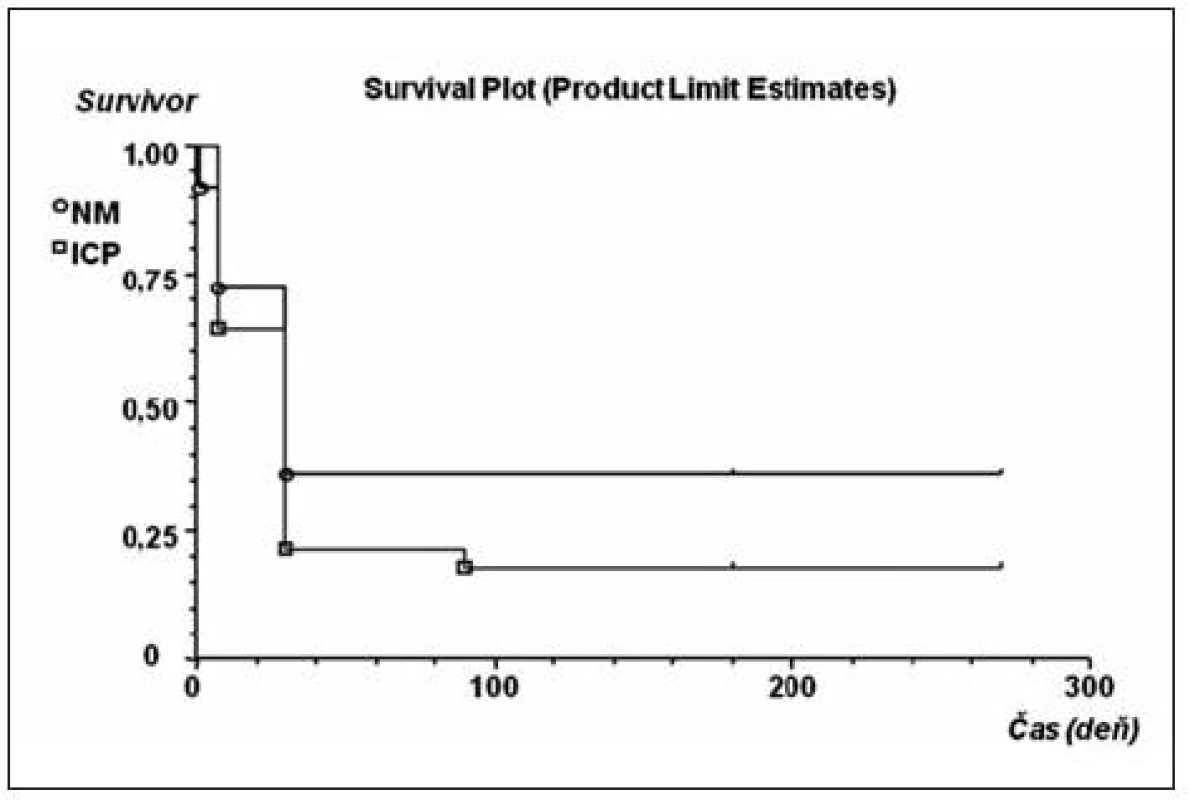
Tab. 4. Dlhodobé prežívanie pacientov s KCP po 7, 30,180 a 270 dňoch od kritickej udalosti 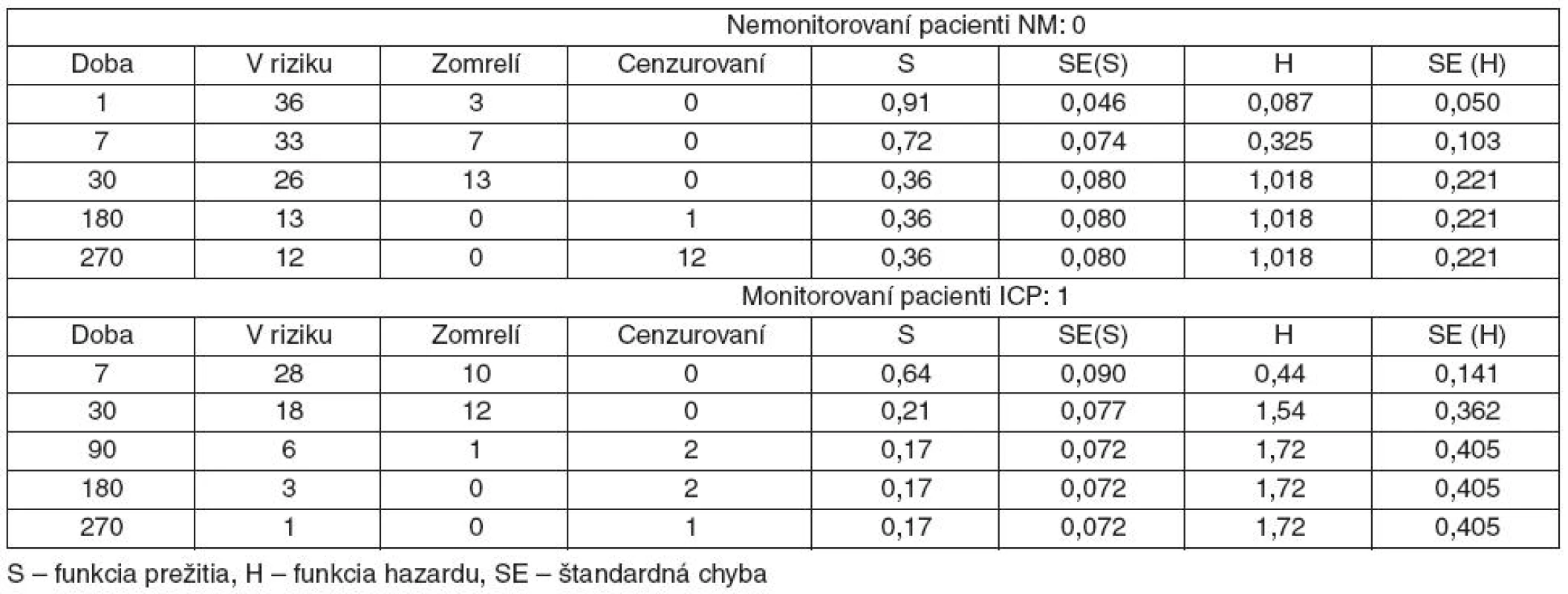
Analýza priebehu monitorovaného ICP
Monitorovaných pacientov sme stratifikovali podľa prežitia obdobia sledovania na skupinu S (survived = prežitie) a skupinu D (death = úmrtie). Vyhodnotili sme deskriptívne (obr. 2) aj analyticky priemerný priebeh zaznamenaných tlakov. Z grafu môžeme vidieť posun časového záznamu v skupine D smerom k vyšším hodnotám ICP. V skupine S bol posun voči hraničnej hodnote normálneho tlaku pomerne malý. Tlaky sa celkovo v čase hospitalizácie významne nemenili, čo taktiež potvrdila jednofaktorová analýza variancie s opakovaním v čase (p = 0,57). Testovanie priebehu ICP počas hospitalizácie medzi skupinami preukázalo vysoko významne vyššie hodnoty krivky ICP pre skupinu pacientov, ktorí traumu neprežili (p = 0,0023). Rozdiel potvrdilo aj testovanie priebehu ICP vo včasnej fáze (0.–2. deň), kde sme však našli nižšiu hodnotu p (0,0234), čo poukazuje na očakávane vyššiu variabilitu tlakov v oboch skupinách pri zachovanom odstupe kriviek.
Obr. 2. Intrakraniálny tlak v akútnej fáze (prvých 7 dní po udalosti) u pacientov s KCP prežívajúcich a neprežívajúcich 30 dní 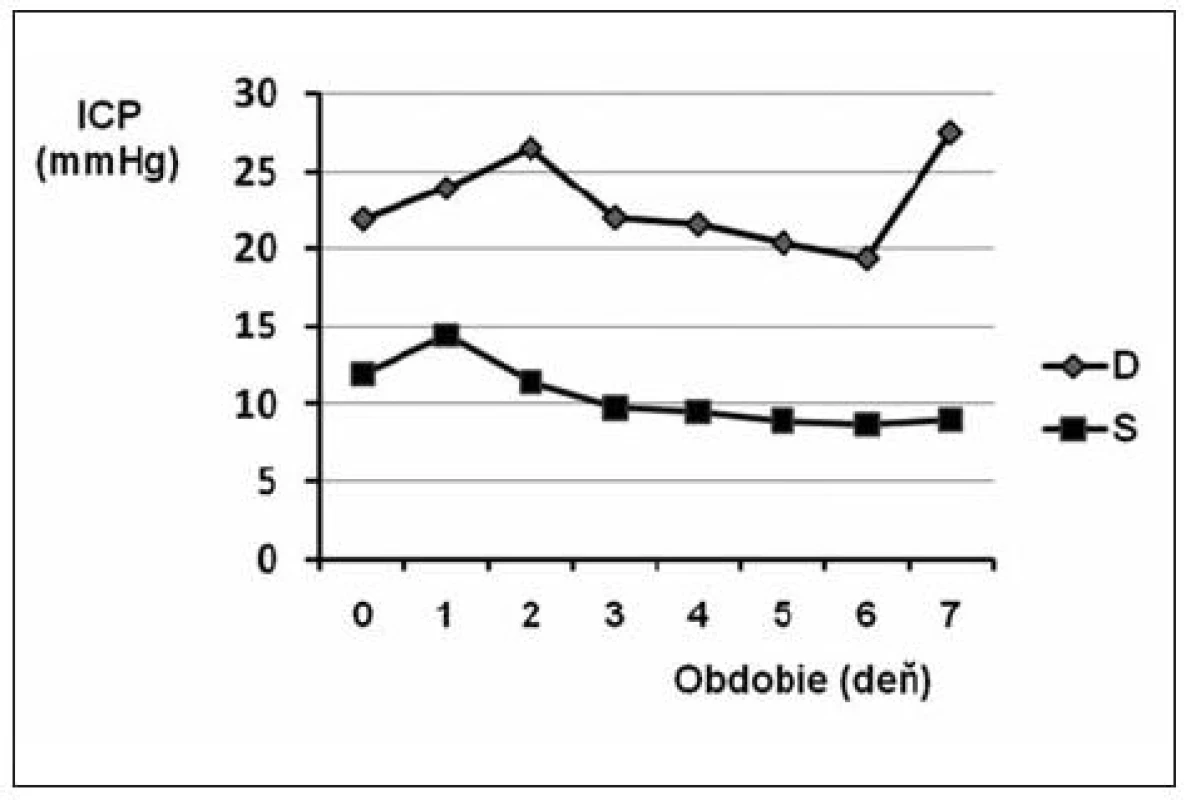
Diskusia
Prvá zmienka o klinickom použití kontinuálneho monitoringu intrakraniálneho tlaku sa objavila pred viac ako 50 rokmi [6]. V súčasnosti sa monitoring ICP stal trvalou súčasťou manažmentu závažných kraniocerebrálnych poranení. Paralelne s jeho zavedením sa výrazne znížila úmrtnosť na kraniocerebrálne poranenia. Avšak štatistika hovorí, že v USA a rovnako i v Európe 30 % pacientov s kraniocerebrálnym poranením ostáva hospitalizovaných mimo moderných traumacentier bez možnosti monitorovania ICP a napriek tomu je ich mortalita porovnateľná s pacientami so zavedeným snímačom ICP [7]. Podľa publikovaného prieskumu pätina kanadských neurochirurgov neprikladá rutinnému monitoringu ICP rozhodujúci prínos v znížení mortality pacientov s kraniocerebrálnym poranením [8]. Monitoring ICP sa preto stále považuje za invazívny prístup s rizikom rôznych komplikácií a otázka jeho účinnosti a užitočnosti ostáva otvorená [8].
Uvádzame tie stavy, ktoré podľa odporúčaní manažmentu KCP [2] vyžadujú monitorovanie ICP:
- pacient so závažným kraniocerebrálnym poranením s abnormálnym CT obrazom predstavuje 53–63% riziko nárastu ICP;
- komatózny pacient bez jednoznačne patologického CT obrazu – 13% riziko nárastu ICP;
- pacient nad 40 rokov veku s ložiskovou symptomatológiou, hypotenzný so systolickým tlakom krvi (STK) pod 12 kPa (< 90 mm Hg) – 60% riziko;
- pacienti v hlbokej kóme s nízkými hodnotami GCS (menej ako 8 bodov);
- pacienti po dekompresívnych kraniotómiách s nepriaznivou prognózou a progresiou edému mozgu [2].
V prospech zavedenia monitorovania intrakraniálneho tlaku argumentujeme nasledovnými faktami:
- zvýšenie ICP u intrakraniálnych hemorágií je časté a nie je možné bez priameho merania udržiavať jeho prijateľné hodnoty, a zabezpečiť tak adekvátnu tkanivovú perfúziu;
- zvýšenie ICP a jeho pretrvávanie má rozhodujúci vplyv na nepriaznivý neurologický klinický priebeh pacienta;
- zvýšenie ICP poukazuje na zmenu cerebrálnej poddajnosti v súvislosti s posttraumatickým a posthemoragickým perifokálnym edémom, poukazuje na riziko tvorby hemoragicko-kontúznych ložísk alebo hydrocefalu;
- meranie ICP umožní rýchlu diagnostiku zhoršenia sekundárneho inzultu, recidívy hemorágie a urýchli indikáciu k rekraniotómii zo strany neurochirurga;
- meranie ICP umožní cielenú a adekvátnu antiedematóznu a cerebroprotektívnu liečbu [1, 3].
Rozsah veku pacientov v našom sledovanom súbore bol 4–90 rokov. Zaujímavým epidemiologickým pozorovaním bolo vekové rozloženie pacientov s kraniotraumou. Vekové rozdelenie malo zreteľne bimodálny tvar s minimom okolo 36 rokov. Usudzujeme, že populačne najmenej ohrozenú skupinu predstavujú osoby medzi 30-tym až 45-tym rokom života. Hodnota vstupného vyšetrenia GCS u ICP monitorovaných pacientov bola rovná 3, a tvorili tak homogénnu skupinu pacientov v hlbokom bezvedomí s nutnou UPV. Hoci sa v nemonitorovanej skupine nachádzala väčšina pacientov s GCS = 3, do NM skupiny bolo zaradených aj 5 pacientov, u ktorých boli hodnoty GCS v rozmedzí 9 až 15 bodov. Títo 5 pacienti nevyžadovali UPV.
Po komplexnej liečbe (neurochirurgickej, konzervatívnej) sa priebeh ICP u monitorovaných pacientov vyvíja dvoma možnými smermi. Buď dochádza k upraveniu ICP pod 20 mm Hg a následne k vzostupu GCS nad 10 bodov, alebo stav poškodenia mozgu progreduje aj napriek uvedenej liečbe, hodnoty ICP stúpajú nad 20 mm Hg a pacienti umierajú v rôznych časových úsekoch, a to v závislosti od rozsahu (poly)traumy, veku, kondície a ďalších faktorov (viď obr. 2). U pacientov s nemonitorovaným ICP s GCS = 3 je prežívanie pacientov charakterizované rovnakou hodnotou mediánu ako v skupine ICP, aj keď liečba bola riadená len podľa protokolu (tab. 2) a CT nálezu. V monitorovanej skupine dĺžka hospitalizácie vo väčšine prípadov trvala do 22 dní, len dvaja pacienti boli hospitalizovaní 48 dní. U nemonitorovanej skupiny dĺžka hospitalizácie nepresiahla 24 dní. Dĺžka UPV sa u monitorovaných a nemonitorovaných pacientov signifikantne nelíšila, len pri monitorovanej skupine dvaja pacienti boli ventilovaní 48 dní.
Výsledky našej práce nepreukázali významný rozdiel medzi pohlaviami v mortalite, v dĺžke prežívania. Aj rozdiely medzi mortalitou a prežívaním neboli výrazné u pacientov s meraným a nemeraným ICP, ako aj v dĺžke prežívania sa výrazne nelíšili aj preto, lebo súbor tvorilo len 64 pacientov. Do 7 dní umrelo 20 pacientov a prežilo 44 (letalita 31,3 %). Do 30 dní umrelo 45 pacientov a prežili 19 (letalita 70,3 %). Z celkového počtu 28 monitorovaných pacientov do 7 dní umrelo 10 a do 30 dní umrelo 22. Tento počet je relatívne nízky na vyjadrenie väčšieho štatistického rozdielu, ale ani svetová literatúra neuvádza významné štatistické rozdiely v prežívaní medzi pacientami so zavedením a bez zavedenia ICP snímača.
Napriek tomu podporujeme názor, že kontinuálne meranie ICP umožňuje rýchle a adekvátne reagovať na zvýšenie hodnôt ICP na rôzne podnety, a tak ich eliminovať. Kontinuálne meranie ICP umožňuje v predstihu vykonať kontrolné CT vyšetrenie mozgu, s možnou následnou operáciou, vedúcou k zníženiu ICP, alebo agresívnejšou konzervatívnou liečbou smerujúcou k zníženiu hodnôt ICP. Vzťah medzi ICP, CPP a MAP je matematicky závislý, preto je dôležité udržiavať hodnoty MAP na takých hodnotách, aby sa ICP pohyboval v rozmedziach maximálne do 20 mm Hg. Ako je to možné vidieť na grafoch, kde hodnoty ICP nad 20 mm Hg vedú k úmrtiu pacientov (viď obr. 2).
Letalita pacientov s ťažkým kraniocerebrálnym poranením s GCS menej ako 8 bodov zostáva vysoká. Pohybuje sa v rozmedzí od 50 % do 100 %. Potvrdzujú to aj prospektivne a retrospektivne štúdie. Chamoun et al. uvádzajú 49,2% mortalitu pri GCS-3. Z ich súboru prežilo 50,8 % pacientov, ale s GOS-1: len 9,5 %, s GOS-2 : 3,7 %, s GOS-3 : 18,5% a s GOS-4 : 19,0 % zo súboru 189 pacientov [9]. Fearnside et al. zistili letalitu 65 % pacientov s KCP s GCS = 3 [10]. Ďalej Tien et al., v retrospektívnej štúdii uverejnenej v roku 2006 u pacientov s ťažkým KCP s krvácením s GCS = 3, udávajú 100% letalitu a celkovú letalitu na KCP 76,8 % [11]. V roku 1995 Kotwica et al. publikovali prácu so súborom 111 pacientov s krvácaním do CNS s EDH pri GCS = 3, kde uvádza letalitu 89 % [12]. Waxman et al. v roku 1991 udávajú 64% mortalitu zo súboru 117 pacientov. S GOS-1 prežilo 10 pacientov a s GOS-2 to boli 3 pacienti [13].
Kombinácie významných prediktorov primárneho výstupu (prežitie), ktoré sú merané, resp. zaznamenané, vo včasných fázach, vytvárajú jednoduché predikčné modely, ktoré umožňujú identifikovať pacientov predisponovaných na neúspech liečby. Spoľahlivosť týchto modelov môže byť zvýšená po prípadnom rozšírení súboru. Limitom tejto prospektívnej štúdie z jedného pracoviska bol nižší počet pacientov s kraniotraumou, ktorý nedovoľuje robiť hlbšie závery. Tiež sme nesledovali súvis medzi vplyvom polytraumy (vyjadrenej TRISS score alebo APACHE II skóre) na letalitu kraniotraumatických pacientov.
Záver
Cieľom našej prospektívnej klinickej práce bolo zistiť, či zdokonaľováním manažmentu komplexnej neurointenzívnej liečby kraniocerebrálneho poranenia na podklade monitorovania intrakraniálneho tlaku pozitívne ovplyvňuje u pacientov klinický priebeh, a umožňuje ich návrat do života a do spoločnosti, s čo najmenšími trvalými následkami.
Letalita na ťažké KCP zostáva veľmi vysoká. Väčšina pacientov umiera do 7 a do 30 dní od kritickej úrazovej udalosti. Vysoký intrakraniálny tlak, tj. hodnota (ICP > 20 mm Hg), ktorý sa nedá liečebne ovplyvniť, je hlavným markerom zlej prognózy a neprežívania pacientov s traumou mozgu.
Došlo dne 25. 5. 2011.
Přijato dne 26. 9. 2011.
Adresa pro korespondenci:
MUDr. Štefan Krbila
KAIM FNsP Nové Zámky
Slovenská ulica 11/A
940 34 Nové Zámky
Slovenská republika
e-mail: krbila@nspnz.sk
Zdroje
1. Lundberg, N. Continuous recording and control of ventricular fluid pressure in neurosurgical practice. Acta Psychol. Neur. Scand., 1960, 36, suppl., p. 1–193.
2. Bullock, M. R. for the Task Force Indications for intracranial pressure monitoring. In: Management and prognosis of severe traumatic brain injury – Part I.: Guidelines for the management of severe traumatic brain injury, J. Neurotrauma, 2007, 24, suppl. 1, p. 37–44.
3. Ghajar, J. Intracranial pressure monitoring techniques. New Horiz., 1995, 3, p. 395–399.
4. Mayhall, C. G., Archer, N. H. et al. Ventriculostomy – related infections: A propspective epidemiologic study. N. Engl. J. Med., 1984, 310, p. 553–559.
5. Martinez-Maňas, R. M, Santamaria, D. Intracranial pressure monitor: Prospective study of accuracy and complications. J. Neurol. Neurosurg. Psychiatry, 2000, 69, p. 82–86.
6. Guillame, J., Janny, P. Continuous intracranial manometry; physiopathologic and clinical significance of the method. Presse Med., 1951, 59, p. 953–955.
7. Patel, H. C., Boumra, O., Woodford, M., King, A. T., Yates, D. W., Lecky, F. E. Trends in head injury outcome from 1989 to 2003 and the effect of neurosurgical care: An observational study. Lancet, 2005, 366, p. 1538–1544.
8. Sahipaul, R., Girotti, M. Intracranial pressure monitoring in severe traumatic brain injury – results of Canadian survey. Can. J. Neurol. Sci., 2000, 27, p. 143–147.
9. Roukoz, B., Chamoun, M. D., Claudia, S., Robertson, M. D., Shankar, P., Gopinath, M. D. Outcome in patients with blunt head trauma and a Glasgow Coma Scale score of 3 at presentation. Clinical article J. Neurosurg., 2009, 111, p. 683–687.
10. Fearnside, M. R., Cook, R. J., McDougall, P., McNeil, R. J. The Westmead Head Injury Project outcome in severe head injury. A comparative analysis of pre-hospital, clinical and CT variables. Br. J. Neurosurg., 1993, 7, p. 267–279.
11. Tien, H. C., Cunha, J. R., Wu, S. N., Chughtai, T., Tremblay, L. N., Brenneman, F. D. et al. Do trauma patients with a Glasgow Coma Scale score of 3 and bilateral fixed and dilated pupils have any chance of survival? J. Trauma, 2006, 60, p. 274–278.
12. Kotwica, Z., Jakubowski, J. K. Head-injured adult patients with GCS of 3 on admission – who have a chance to survive? Acta Neurochir., 1995, 133, p. 56–59.
13. Waxman, K., Sundine, M. J., Young, R. F. Is early prediction of outcome in severe head injury possible? Arch. Surg., 1991, 126, p. 1237–1242.
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2011 Číslo 5- Jak souvisí postcovidový syndrom s poškozením mozku?
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
- Léčba akutní pooperační bolesti z pohledu ortopeda
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
-
Všechny články tohoto čísla
- Bezpečná anestezie
- Ultrazvukem naváděný mediální cervikální blok
- Kardiopulmonálna resuscitácia
- Vliv teploty na výsledky tromboelastografie – prospektivní studie
- Erratum
- Fibrinolýza v kardiochirurgii v postaprotinínovej ére
- Mechanismus vzniku hypotenze po i. v. paracetamolu u kriticky nemocných
- Je rozdiel v prežívaní pacientov s kraniocerebrálnym poranením s meraným a nemeraným intrakraniálnym tlakom?
- Doporučení pro poskytování poanestetické péče
- Doporučení pro omezování příjmu tekutin a stravy před anesteziologickou péčí
-
Doporučený postup pro život ohrožující krvácení
(mezioborové konsenzuální stanovisko) - 18. kongres ČSARIM, Praha 6.–8. 10. Souhrn přednášek a abstrakt – I. část
-
EBA recommendations for Safe Medication Practice
(June 2011) - WFSA RESEARCH GRANTS 2011
- Medaile Františka Celestýna Opitze
-
V. česko-slovenský kongres intenzivní medicíny a I. sympozium České resuscitační rady
11.–13. května 2011, Clarion Congress Hotel Prague - Kalendář akcí
- Competency based training in intensive care medicine in Europe (první část)
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Ultrazvukem naváděný mediální cervikální blok
- Je rozdiel v prežívaní pacientov s kraniocerebrálnym poranením s meraným a nemeraným intrakraniálnym tlakom?
- Doporučení pro poskytování poanestetické péče
- Mechanismus vzniku hypotenze po i. v. paracetamolu u kriticky nemocných
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



