-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaHodnocení spolehlivosti Neutrophil Gelatinase-Associated Lipocalin jako markeru renální dysfunkce v kardiochirurgii dospělých – prospektivní studie
Assessment of the reliability of the urinary neutrophil gelatinase-associated lipocalin (NGAL) as an early marker of renal dysfunction after cardiac surgery: A prospective observational study
Objective:
To assess the reliability of the urinary neutrophil gelatinase-associated lipocalin (NGAL) as an early marker of renal dysfunction after cardiac surgery.Design:
A prospective observational study.Setting:
Cardiac surgery ICU, University Hospital.Materials and Methods:
We evaluated 65 patients who had had cardiac surgery with cardiopulmonary bypass. The exclusion criteria for enrolment in the study were pre-existing renal failure (serum creatinine above 350 μmol/l) requiring haemodialysis, and previous renal transplantation. Urine samples for NGAL analysis by ELISA were collected before incision and for 24 hours post-operatively. Postoperative acute kidney injury (AKI) was defined as 50% or greater increase in serum creatinine from the baseline or 25% or greater decrease in the glomerular filtration rate from the baseline. The statistical analysis was performed using Sigma Stat 3.1. software. The tests used to compare the variables included: The two-sample t-test, the Mann - -Whitney rank sum test, the chi-square test and Fisher’s exact test. A conventional ROC curve was generated to calculate the sensitivity and specificity for the urine NGAL measurement.Results:
21 of 65 patients (32%) developed postoperative AKI. The urinary NGAL levels and kinetics were equivalent in patients with and without ARF.Conclusion:
Urinary NGAL is not a reliable marker of renal dysfunction after adult cardiac surgery.Keywords:
acute kidney injury – cardiopulmonary bypass – markers of renal injury – neutrophil gelatinase-associated lipocalin – glomerular filtration – RIFLE criteria
Autoři: Gerlichová Monika 1; Černý Vladimír 1; Dostál Pavel 1; Živný Pavel 2
Působiště autorů: Klinika anesteziologie, resuscitace a intenzivní medicíny, Univerzita Karlova v Praze, LF v Hradci Králové a Fakultní nemocnice Hradec Králové 1; Ústav klinické biochemie a diagnostiky, Univerzita Karlova v Praze, LF v Hradci Králové a Fakultní nemocnice Hradec Králové 2
Vyšlo v časopise: Anest. intenziv. Med., 19, 2008, č. 6, s. 297-303
Kategorie: Anesteziologie - Původní práce
Souhrn
Cíl studie:
Zhodnotit spolehlivost močového Neutrophil Gelatinase-Associated Lipocalin (NGAL) jako časného markeru renální dysfunkce po kardiochirurgických výkonech.Typ studie:
Prospektivní, observační studie.Název a sídlo pracoviště:
Kardiochirurgická JIP fakultní nemocnice.Materiál a metoda:
Do studie bylo zařazeno 65 nemocných, kteří podstoupili kardiochirurgický výkon s mimotělním oběhem. Vyloučeni byli nemocní s preexistující renální insuficiencí (kreatinin v séru nad 350 μmol/l), v dialyzačním programu a po transplantaci ledvin. Všem nemocným byly před incizí a dále v určených intervalech v průběhu 24 hodin odebírány vzorky moči k analýze NGAL metodou ELISA. Pooperační akutní renální dysfunkce/poškození (acute kidney injury, AKI) bylo klasifikováno jako vzestup sérového kreatininu na 1,5násobek výchozí hodnoty nebo pokles glomerulární filtrace o více než 25 % předoperační hodnoty. Získaná data byla zpracována s použitím Sigma Stat 3.1. software. K porovnání údajů byly využity následující testy: nepárový t-test, Mannův-Whitneyův test, chí-kvadrát test a přesný test podle Fischera, k hodnocení senzitivity a specificity močového NGAL byla konstruována ROC-křivka.Výsledky:
U 21 nemocných (32 %) došlo pooperačně k rozvoji AKI, hladiny a kinetika močového NGAL nebyla v této skupině signifikantně odlišná od skupiny bez renálního poškození.Závěr:
Močový NGAL není spolehlivý marker renální dysfunkce u dospělých podstupujících kardiochirurgický výkon.Klíčová slova:
akutní renální dysfunkce – mimotělní oběh – markery renálního poškození – neutrophil gelatinase-associated lipocalin – glomerulární filtrace – RIFLE kritériaÚvod
Akutní renální dysfunkce/poškození (acute kidney injury, AKI) je druhou nejčastěji se vyskytující orgánovou dysfunkcí u nemocných v intenzivní péči a zásadně ovlivňuje průběh základního onemocnění, rozvoj komplikací a tím i prognózu nemocného. Riziko úmrtí je u pacientů s AKI 4krát vyšší než u pacientů se stejnou závažností onemocnění, ale bez AKI, což dokazuje, že AKI není jen marker závažnosti onemocnění, ale sám o sobě zvyšuje mortalitu díky rozvoji akutní uremické intoxikace a imunosuprese [1]. AKI je současně jednou z nejzávažnějších komplikací u nemocných po kardiochirurgických výkonech až s 30% incidencí. Náhradu renálních funkcí eliminačními technikami (continuous renal replacement technique, CRRT) vyžaduje 1–5 % z těchto pacientů, mortlita v této skupině dosahuje 60 % [2]. Hlavními příčinami vzniku AKI v kardiochirurgii jsou ischemicko-reperfuzní trauma během mimotělního oběhu (cardiopulmonary bypass, CPB), nízký srdeční výdej, působení exotoxinů (antibiotika, diuretika) a endotoxinů (myoglobin) i preexistující renální dysfunkce. Ve fázi použití CPB negativně spolupůsobí hypoperfuze, nepulzatilní průtok, hypotermie, hemodiluce a indukce zánětlivé odpovědi.
Zlatý standard v diagnostice renální insuficience – kreatinin – vykazuje pozdní elevaci a v predikci závažnosti a délky trvání renální insuficience se jeví jako nedostatečný.
Existence markerů, časně detekujících závažnost a rozsah poškození, by umožnila dřívější zahájení preventivních a terapeutických opatření, ale také experimentální a klinické testování nových renoprotektivních postupů. Charakteristika ideálních biomarkerů renálního poškození různé etiologie zahrnuje jejich časnou a snadnou detekci v plasmě nebo moči, identifikaci postižené části nefronu, rozsahu poškození, včetně subklinického a eventuální monitorování úspěšnosti léčby sledováním jejich dynamiky. Slibnými markery se jeví enzymy uvolněné z poškozených tubulárních buněk, převážně z jejich proximálních částí. Detekce v moči je možná během několika hodin po inzultu, původ proteinu (cytoplasmatický, lysozomální nebo membranózní) může navíc přinést informaci o příčině a rozsahu postižení [3].
Předmětem intenzivního výzkumu jsou zejména NGAL (Neutrophil Gelatinase-Associateed Lipocalin), kidney injury molekule-1 (KIM-1) a interleukin-18 (IL-18) [4, 5, 6].
Řada studií byla provedena u nemocných podstupujících kardiochirurgický výkon s cílem zlepšit outcome těchto pacientů a využít CPB jako model ischemicko-reperfuzního poškození, které je hlavní příčinou AKI v klinické praxi. Studie byly prováděny především s močovým a plasmatickým NGAL, 25 kDa proteinem kovalentně vázaným na gelatinázu lidských neutrofilů. V nízké koncentraci se nachází v řadě lidských tkání jako ledviny, dýchací cesty, žaludek a střevo, jeho uvolnění je indukováno poškozením epitelu. V postischemické ledvině se přednostně kumuluje v proximálních tubulech spolu s proliferujícími epiteliálními buňkami, což podpořilo hypotézu, že indukuje reepitelizaci. NGAL je považován za regulátor epiteliální morfogeneze a železo-transportní protein během nefrogeneze, což naznačuje jeho možnou roli v renální postischemické regeneraci [7].
Mezi potenciální výhody NGAL patří snadná detekce v krátkém časovém odstupu od inzultu, k nevýhodám skutečnost, že je uvolňován z řady dalších orgánů a tím je snížena jeho specificita pro renální funkce. Bylo pozorováno zvýšení jeho hladin u nemocných s bakteriální infekcí, se symptomatickým kardiovaskulárním onemocněním a s mozkovou ischémií [8].
Klinické studie s NGAL byly primárně provedeny u dětských kardiochirurgických pacientů bez předoperační renální dysfunkce [9], následovala studie u dospělých, jejichž renální funkce jsou zatíženy řadou komorbidit [10]. Studie společně prokázaly časnou elevaci plasmatické i močové hladiny NGAL po kardiochirurgickém výkonu (během 2–3 hodin) a hodnotily ho jako vysoce senzitivní a specifický marker umožňující časnou predikci renálního poškození. Nicméně elevace NGAL, i když v menší míře a s odlišnou kinetikou, byla pozorována také u nemocných bez následného rozvoje ARF, což může být výrazem indukce systémové zánětlivé odpovědi s následným uvolněním NGAL do cirkulace [7].
Cílem naší studie bylo ověřit, zda lze močový NGAL použít jako spolehlivý prediktor renálního poškození u dospělých pacientů podstupujících kardiochirurgický výkon.
Soubor pacientů a metoda
Do prospektivní observační studie bylo zařazeno 65 pacientů, kteří podstoupili plánovaný kardiochirurgický výkon s CPB na Kardiochirurgické klinice Fakultní nemocnice (FN) v Hradci Králové v období od ledna do prosince 2007. Studie byla provedena se souhlasem Etické komise FN Hradec Králové a všichni nemocní podepsali informovaný souhlas s účastí ve studii. Vylučovací kritéria zahrnovala preexistující renální selhání s elevací sérového kreatininu nad 350 μmol/l, zařazení do dialyzačního programu nebo stav po transplantaci ledviny. U všech nemocných jsme sledovali věk, pohlaví, BMI (body mass index), vstupní hodnotu SOFA skóre (Sequential Organ Failure Assesment score), NYHA (New York Heart Association) a EF LK (ejekční frakce levé komory), typ a délku operačního výkonu, délku CPB a klampu aorty. V pooperačním období byly sledovány délka pobytu na JIP (jednotce intenzivní péče), délka UPV (umělé plicní ventilace), bilance tekutin a diuréza, výskyt AKI, potřeba eliminačních technik a mortalita. Stav renálních funkcí byl hodnocen podle hladiny sérového kreatininu a glomerulární filtrace (GFR), stupeň pooperační renální dysfunkce byl klasifikován podle kritérií RIFLE (Risk, Injury, Failure, Loss, End-stage). Tento skórovací systém byl definován The Acute Dialysis Quality Initiative Group a umožňuje stratifikaci nemocných bez ohledu na stupeň preexistující renální dysfunkce [11]. Podle těchto kritérií jsme definovali skupinu AKI jako skupinu nemocných, u nichž došlo pooperačně k 1,5násobnému nárůstu hodnot sérového kreatininu ve srovnání s výchozí hodnotou nebo poklesu GFR o více než 25 % výchozí hodnoty. Ostatní nemocní byli zařazeni do skupiny no-AKI. U všech nemocných byl v průběhu operace použit manitol v dávce 1 g . kg-1, který je na našem pracovišti standardní součástí primární náplně CPB z důvodu předpokládaného renoprotektivního účinku. Standardně jsou rovněž u výkonů s použitím CPB podávaná antifibrinolytika pro předpokládanou existenci koagulační poruchy s cílem redukce krevních ztrát.
Pacientům bylo odebráno 5 ml moči před zahájením operačního výkonu a dále za 4, 12 a 24 hodin po zahájení výkonu. Vzorky moči byly odeslány do laboratoře a ihned po přijetí uloženy do mrazicího boxu s teplotou -20 °C. Pro dlouhodobější archivaci byly uchovávány v hlubokomrazicím boxu (NBSC Premium U570, USA) s teplotou -75 °C. Teplota obou mrazicích zařízení je pod nepřetržitou kontrolou (systém Regultech, Hradec Králové). Analýza vzorků moče byla provedena diagnostickým setem NGAL ELISA Kit (KIT 036) AntibodyShopR (Denmark) pro in vitro určení NGAL v lidské plasmě, séru a moči.
Vzorky moči byly před vlastní analýzou ředěny 500krát, faktor ředění byl při výpočtu zohledněn. Metoda je založena na principu sendvičové ELISA techniky: jamky mikrotitrační destičky jsou potažené monoklonální protilátkou značenou biotinem, na biotin se váže streptavidin konjugovaný křenovou peroxidázou, která po přídavku substrátu (TMB) způsobí vývoj barevného komplexu, jehož intenzita (absorbance) je přímo úměrná množství NGAL ve vzorku. Kalibrační křivka byla sestrojená pomocí sady kalibračních materiálů v intervalu koncentrací 0, 10, 25, 100, 250, 500 a 1000 pg . ml-1 NGAL, které byly součástí diagnostického kitu. V pracovní dokumentaci výrobce je uvedena přesnost stanovení CV 2,1% (1,3 – 4,0).
Výpočet GFR byl prováděn podle rovnice the Modification of Diet in Renal Disease (MDRD):
MDRD – GF = [170 . (kreat)-0,999 . (age)-0,176 . (urea)-0,170 . (albumin)0,318]
U žen byl použit korekční faktor 0,762 [12]. Hodnoty sérového kreatininu, urey a albuminu k výpočtu byly vyšetřovány z krve nemocného před výkonem, za 24 a 48 hodin. Po dodání vzorku krve do laboratoře byla provedena separace séra a krevního koláče, sérum bylo následně zpracováno v automatickém analyzátoru MODULAR (Roche Diagnostic GmbH, Germany) diagnostickými kity téhož výrobce. Pro měření albuminu byl použit kit ALB plus na principu kolorimetrického stanovení s bromkrezolovou zelení (BCG) a endpoint měřením, dále kit UREA/BUN pro měření hladiny urey kinetickou UV metodou a kit CREA pro měření hladiny kreatininu na principu kinetické kolorimetrického stanovení (Jaffé) s využitím rate-blank (minimalizace interference bilirubinu) a korekcí výsledku, vzhledem k přítomnosti nespecificky reagujících proteinů.
Statistická analýza byla provedena s použitím Sigma Stat 3.1. software (Systat Software Inc., San Rafael, CA, USA). K porovnání údajů byly využity následující testy: nepárový t-test, Mannův-Whitneyův test, chí-kvadrát test a přesný test podle Fischera; k hodnocení senzitivity a specificity močového NGAL byla konstruována ROC-křivka. Pro všechny testy byla zvolena hladina významnosti p < 0,05.
Výsledky
Do studie bylo zařazeno 65 pacientů, u 21 pacientů (32 %) se rozvinulo pooperační AKI v průběhu 48 hodin od zahájení operačního výkonu, podle klasifikace RIFLE mělo 20 nemocných (30 %) stupeň R a 1 nemocný (2 %) stupeň I. U všech nemocných s rozvojem AKI došlo k poklesu GFR, u 6 z nich (29 %) nastal současně vzestup hodnot sérového kreatininu.
U žádného pacienta nedošlo k rozvoji AKI ve stadiu F, L nebo E nebo nutnosti použít CRRT. Charakteristiky pacientů skupiny no-AKI a AKI jsou uvedeny v tabulce 1. Obě skupiny no-AKI a AKI se nelišily v základních charakteristikách, jako je věk, pohlaví, BMI, vstupní SOFA skóre, kardiální funkce. Skupiny se shodovaly i v zastoupení jednotlivých typů operačních výkonů, délce operace, CPB, klampu aorty a pobytu na JIP. Statisticky významný byl pouze rozdíl v délce umělé plícní ventilace v období prvních 48 hodin. Bilance tekutin a diuréza v tabulce 1 je vyhodnocena v intervalu 48 hodin od zahájení operačního výkonu, ve kterém byly sledovány renální funkce nemocného pomocí GFR. Ve skupině AKI zemřel 1 nemocný (2 %), příčinou byla infekce operační rány s přestupem na pravou komoru srdeční a následnou chirurgicky neřešitelnou rupturou, rozdíl v mortalitě nebyl statisticky významný.
Tab. 1. Demografická charakteristika souboru nemocných a klinické výsledky 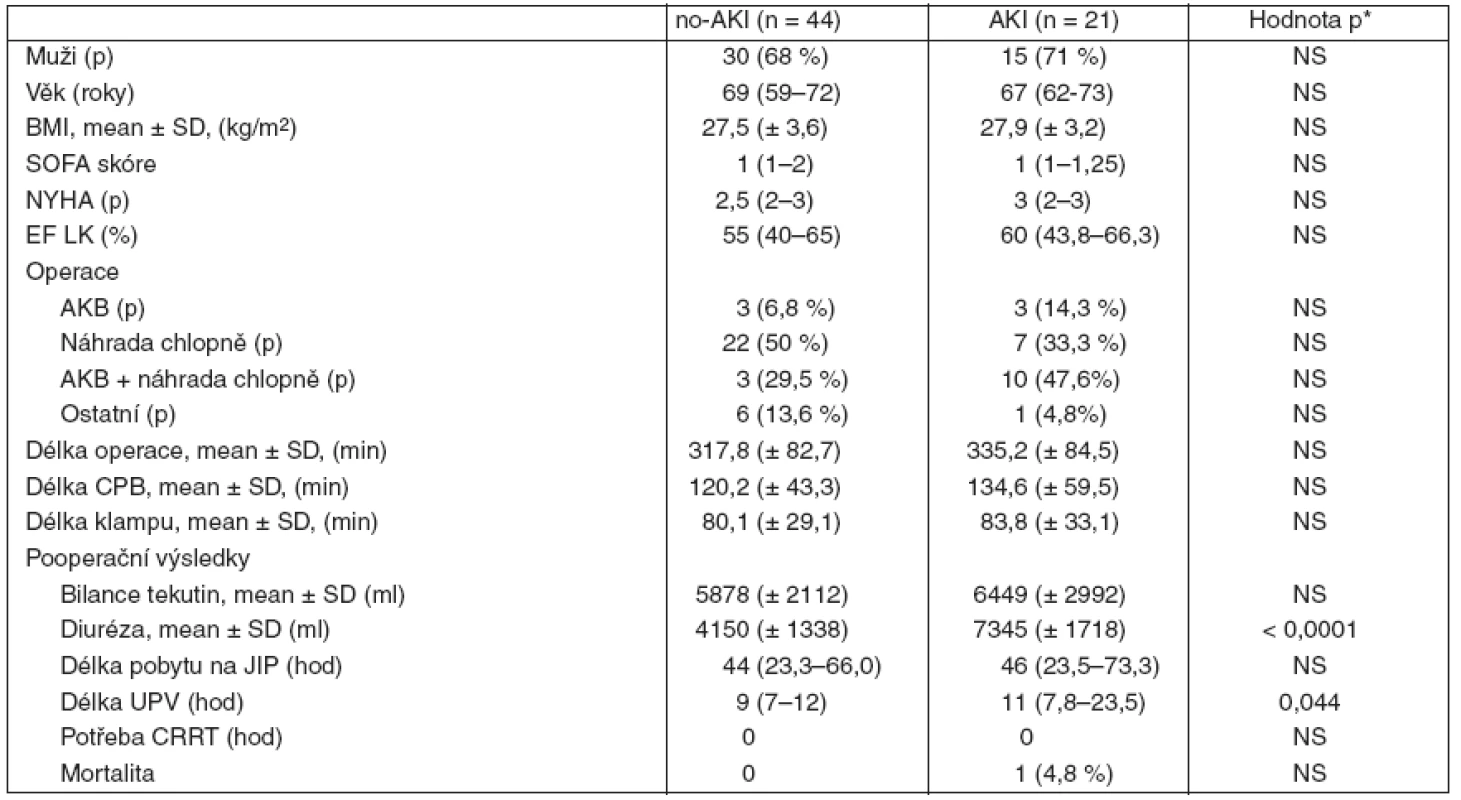
Data jsou uváděna jako průměr ± směrodatná odchylka, procenta nebo medián s rozptylem od 25. do 75. percentilu; *hladina významnosti p < 0,05; AKB = aortokoronární bypass; AKI = akutní renalní poškození; no-AKI= nepřítomnost akutního renálního poškození; BMI = body mass index; CPB = mimotělní oběh; CRRT = continual renal replacement therapy; EF LK = ejekční frakce levé komory; NS = nesignifikantní rozdíl; NYHA = New York Heart Association; UPV = umělá plícní ventilace; p = počet, SOFA skóre = Sequential Organ Failure Assesment score. Hladina NGAL v moči (tab. 2) před zahájením operačního výkonu byla obdobná v obou skupinách nemocných. U všech nemocných došlo ke vzestupům NGAL ve 4. a 12. hodině od zahájení operace bez signifikantního rozdílu mezi skupinou AKI a no-AKI (po 4 hodinách byl nárůst hodnot cca 2–3násobný, po 12 hodinách 6násobný). Za 24 hodin od zahájení operace nastal u nemocných ve skupině no-AKI pokles NGAL, zatímco ve skupině s následným rozvojem AKI hodnoty dále stoupaly, rozdíl v hodnotách NGAL za 24 hodin v obou skupinách však nebyl statisticky významný (obr. 1).
Tab. 2. Hladiny močového NGAL ve skupině AKI a no-AKI 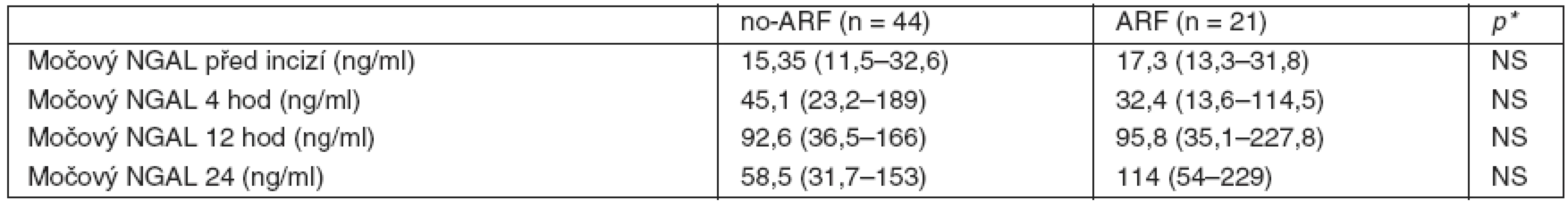
Data jsou vyjádřena jako medián s rozptylem od 25 do 75 percentilu, *p < 0,05. AKI = akutní renální poškození, no-AKI = nepřítomnost akutního renálního poškození, NGAL = netrophil gelatinase-associated lipocalin, NS = nesignifikantní Obr. 1. Vývoj hodnot močového NGAL v průběhu 24 hodin od zahájení operace ve skupině s rozvojem pooperační renální dysfunkce (AKI) a bez něj (no-AKI) Data jsou vyjádřena jako medián s rozptylem od 25. do 75. percentilu před zahájením operace, za 4, 12 a 24 hodin po zahájení výkonu, *p < 0,05 vs baseline value. 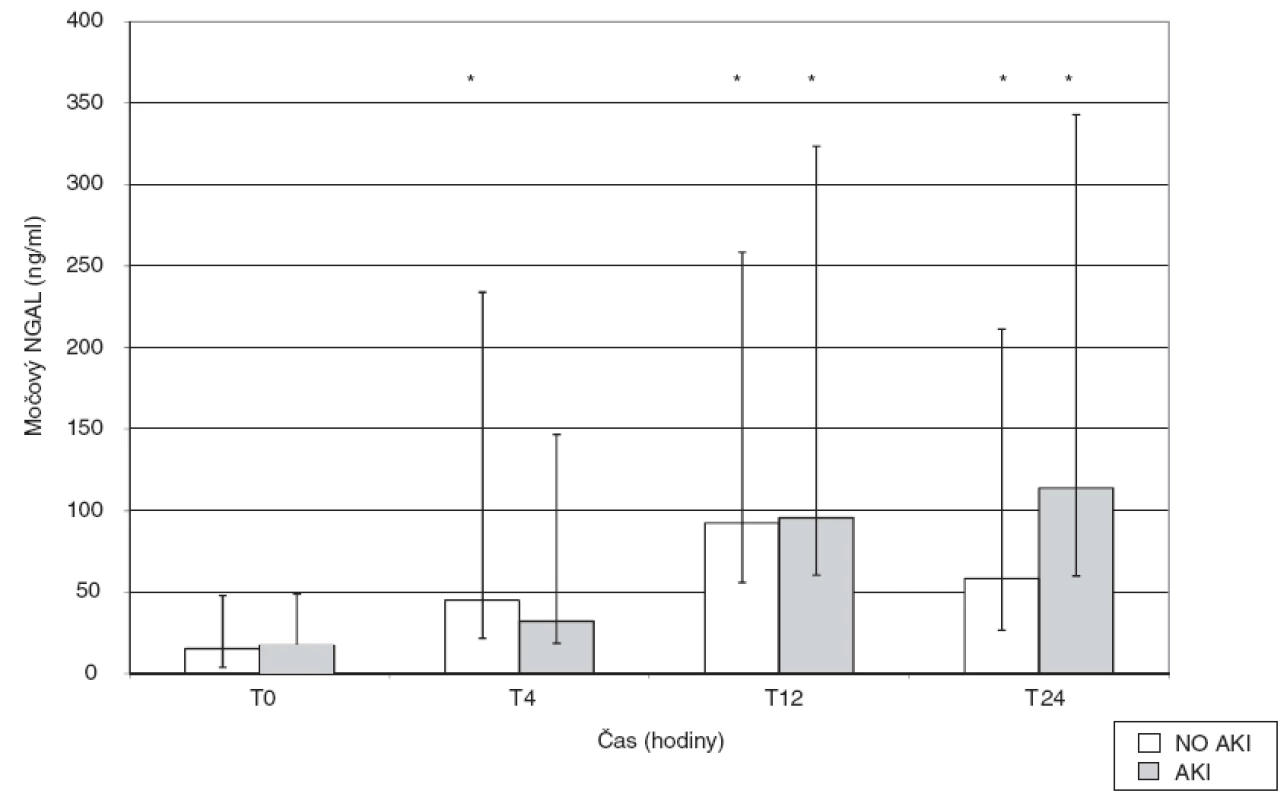
Vstupní hodnota GFR podle rovnice MDRD byla rovněž srovnatelná v obou skupinách AKI 146,0 (121,9–189,2) vs no-AKI 129,3 (107,7–159,5) ml . min-1 . 1,73 m-2, vývoj GFR jsme sledovali v následujících 48 hodinách. V obou skupinách došlo po 24 hodinách k poklesu GFR, ve skupině s následným rozvojem AKI o 32 % ((AKI 99,9 (84,7–116,3) ml . min-1 . 1,73m-2), ve skupině bez následného AKI o 3 % (no-AKI 124,9 (98,5–159,2) ml. . min-1 . 1,73 m-2)), rozdíl v poklesu GFR po 24 hodinách mezi oběma skupinami byl statisticky významný (p = 0,010). Po 48 hodinách nastal opět vzestup GFR v obou skupinách, zatímco ve skupině AKI tento vzestup nedosáhl výchozích hodnot (pouze 73 % výchozí hodnoty), ve skupině bez AKI se obnovily původní hodnoty GFR (AKI 106,4 (91,9–161,3) vs no-AKI 142,9 (99,4 až 183,4) ml . min-1 . 1,73m-2)) – obrázek 2.
Obr. 2. Vývoj hodnot GFR v průběhu 48 hodin od zahájení operace ve skupině s rozvojem pooperační renální dysfunkce (AKI) a bez něj (no-AKI) Data jsou vyjádřena jako medián s rozptylem od 25. do 75. percentilu, předoperačně, za 24 a 48 hodin, *p < 0,05 vs baseline value, #p < 0,05 vs no-AKI. 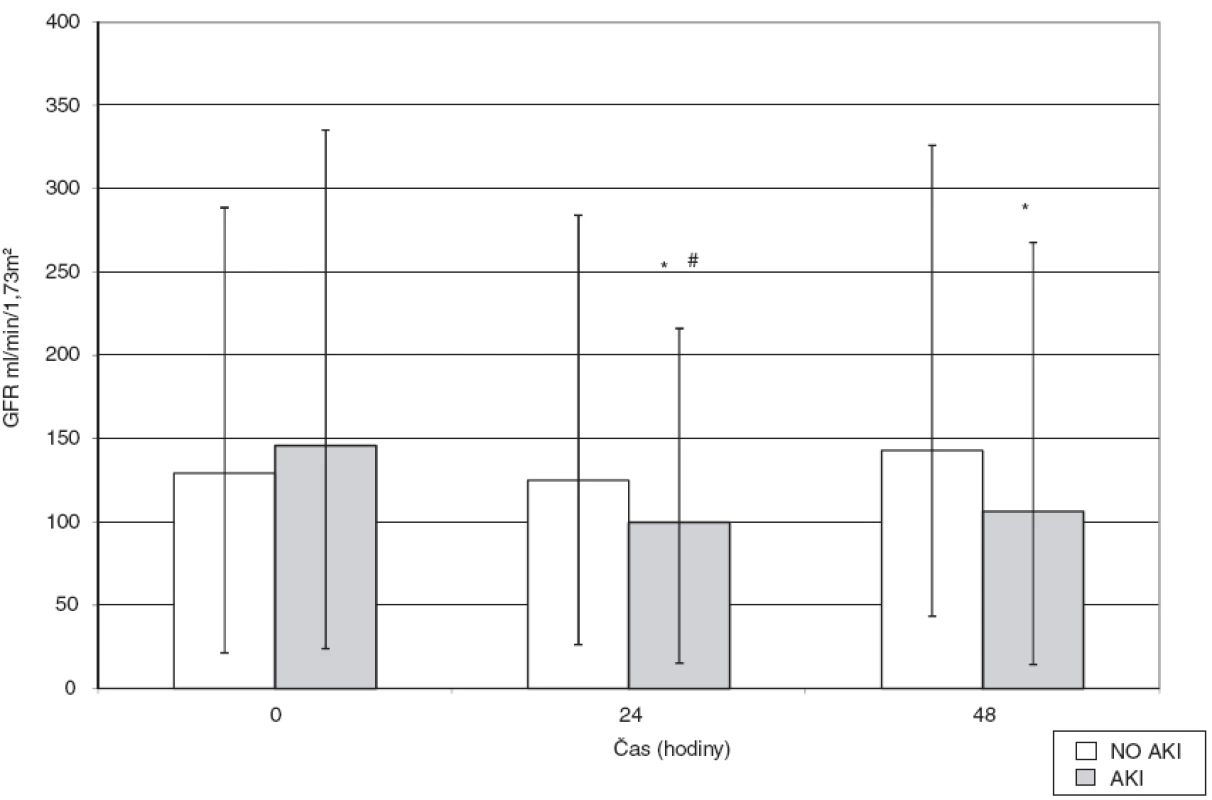
Receiver operating characteristic (ROC) křivka byla konstruována pro hladiny močového NGAL před zahájením operace, za 4, 12 hodin (nezobrazeno) a za 24 hodin (obr. 3). Hodnoty ploch pod křivkami (AUC) jsou uvedeny v tabulce 3. Nejvyšší hodnota plochy pod křivkou byla zjištěna pro hodnotu NGAL stanovenou za 24 hodin od začátku operace. Pokles GFR o 25 % ve srovnání s předoperační hodnotou nejlépe predikovala hodnota NGAL 97,4 ng . ml-1 odebraná za 24 hodin od zahájení operace, která vykazovala senzitivitu 57,1% a specificitu 68,2%. Mezi jednotlivými časy stanovení nebyly zjištěny signifikantní rozdíly.
Obr. 3. ROC-křivka pro močový NGAL 24 hodin po zahájení operace Plocha pod křivkou (AUC) je 0,627 (95% confidence interval, 0,498–0,744). 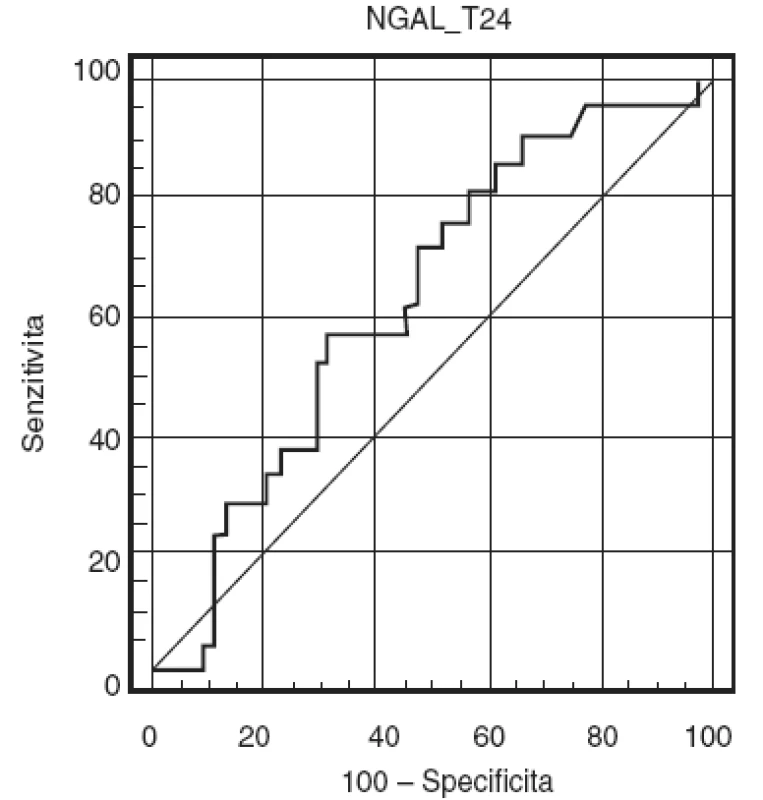
Tab. 3. Hodnoty plochy pod křivkou (AUC) pro močový NGAL při ROC analýze 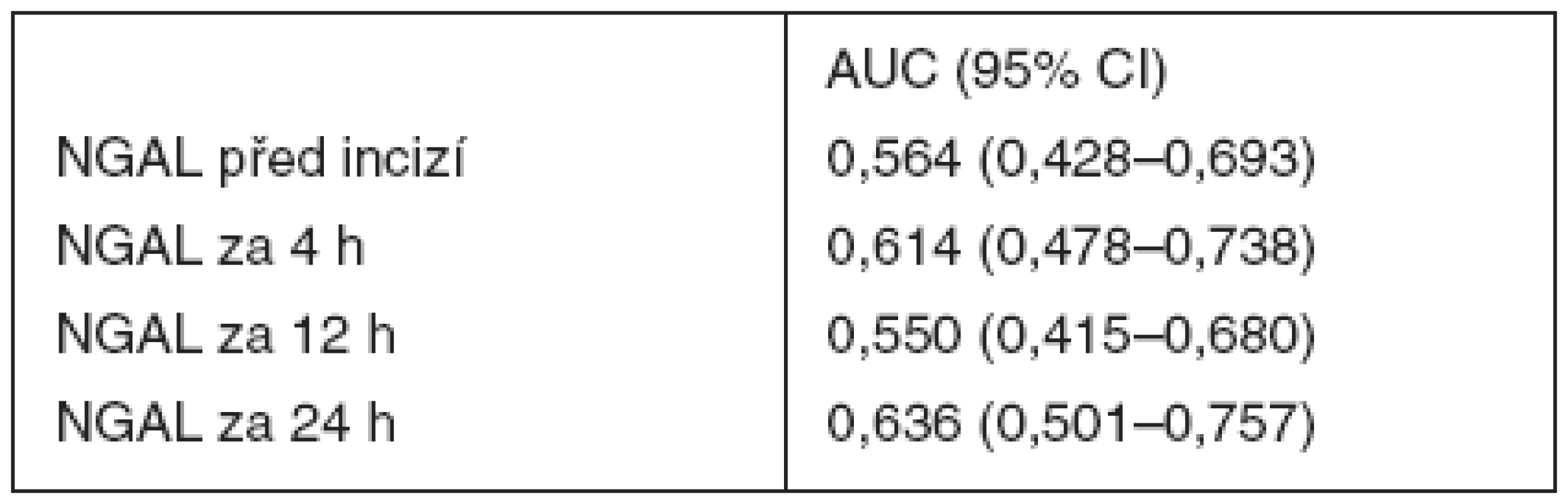
AUC = plocha pod křivkou; CI = confidence interval; NGAL = urinary neutrophil gelatinase-associated lipocalin. Diskuse
Hlavním zjištěním naší studie je, že močový NGAL není spolehlivý marker renálního poškození dospělých po kardiochirurgických operacích s použitím CPB. Ke srovnatelnému vzestupu hodnot NGAL došlo v prvních 12 hodinách po výkonu u všech nemocných bez ohledu na následný vývoj renálních funkcí. Rozdíl v kinetice močového NGAL byl detekovatelný až po 24 hodinách, kdy ve skupině bez rozvoje AKI hladina klesla, zatímco u nemocných s AKI dále stoupala, tento rozdíl ale nebyl statisticky významný.
K hodnocení renálních funkcí jsme použili tzv. zlatý standard – hodnoty sérového kreatininu a urey a s jejich použitím pak výpočtu GFR podle rovnice MDRD, která zohledňuje hladinu sérového albuminu, věk a pohlaví. Hodnota GFR po 24 hodinách vykázala signifikantní pokles ve skupině nemocných s následným rozvojem AKI ve srovnání se skupinou nemocných bez AKI. V průběhu následujících 24 hodin došlo v obou skupinách nemocných opět k vzestupu GFR, ale ve skupině s AKI hodnoty nedosáhly výchozí úrovně GFR jako ve skupině bez AKI. V časné pooperační fázi dochází při tendenci organismu zadržovat tekutiny k nárůstu celkové tělesné vody a diluci, která ovlivňuje hladinu urey a kreatininu, proto jsme u nemocných hodnotili vývoj GFR v intervalu 48 hodin od zahájení operace ve vztahu k tekutinové bilanci. Příjem tekutin i bilance byla v obou skupinách nemocných bez signifikantního rozdílu. Statisticky významný rozdíl byl pouze v diuréze, vyšší objem diurézy ve skupině AKI může být současně příčinou diluce močového NGAL a tím zkreslení hodnot NGAL u nemocných s vyšším stupněm renální dysfunkce. Nejcitlivější částí nefronu na ischemické poškození jsou proximální tubuly, kde za fyziologických okolností dochází k resorpci 70–80 % glomerulárního filtrátu [13], jejich poškození by vysvětlovalo nadměrnou diurézu ve skupině s následným rozvojem renální dysfunkce.
NGAL je v organismu secernován imunitními buňkami, hlavně neutrofily, v rámci aktivace systémové zánětlivé odpovědi organismu [14]. K této nespecifické obranné reakci organismu dochází i během operačního výkonu, hladina plasmatického NGAL tedy může odrážet závažnost inzultu představovaného operační zátěží a použitím CPB. Plasmatický, extrarenální NGAL se pak sekundárně kumuluje v proximální tubulech ledvin, renální NGAL vzniká v distální části nefronu v reakci na renální poškození. Hladina močového NGAL, zahrnující obě tyto složky, pak může být ukazatelem intenzity renálního, ale i systémového poškození endotelu [15, 16]. Tuto hypotézu podporuje i naše zjištění, že hladina NGAL T12 korelovala s délkou pooperační UPV.
V roce 2005 publikoval Mishra et al. závěry jedné z prvních studií s NGAL u dětských kardiochirurgických nemocných [9]. Elevaci NGAL v moči s odstupem 2 hodin po ukončení CPB hodnotil jako spolehlivý marker renálního poškození (senzitivita/specificita 1,0/0,98). Rozvoj pooperačního renálního selhání současně koreloval s délkou CPB a rozsahem operačního výkonu. Výsledky další studie u dětí rovněž dokumentují souvislost mezi elevací plasmatického NGAL 2 hodiny po CPB a rozvojem AKI [17]. V roce 2006 byla publikována studie hodnotící význam NGAL v kardiochirurgii dospělých se shodným závěrem, ale významně nižší senzitivitou a specificitou močového NGAL v predikci AKI (senzitivita/specificita 0,73/0,78), a to s časovým odstupem 18 hodin od skončení výkonu [10]. Výsledky naznačují, že použití NGAL jako markeru renální dysfunkce v kardiochirurgii dospělých nedosahuje spolehlivosti u dětských pacientů. Naše studie přinesla obdobné závěry ve smyslu nižší spolehlivosti NGAL a delšího časového odstupu od CPB ve srovnání se studiemi u dětí – nejlépe predikovala zhoršení renálních funkcí hodnota močového NGAL za 24 hodin od zahájení operace (senzitivita/specificita 0,57/0,68).
Dále byly v roce 2006 zveřejněny výsledky 2 studií, které se zabývaly objasněním role NGAL u aterosklerotického postižení cév, kardiovaskulárních a cerebrovaskulárních onemocnění [8, 18]. Bylo prokázáno, že indukce tvorby NGAL je součástí odpovědi buněk cévní stěny na hypoxický stres a ischémii, ale také mechanické poškození. NGAL takto uvolněný do cirkulace by mohl vést k významnému ovlivnění hodnot zvláště u kardiochirurgických nemocných.
Naše studie je jednou z prvních, která hodnotí spolehlivost NGAL jako časného markeru renální dysfunkce u dospělých pacientů bez ohledu na komorbidity a preexistující renální dysfunkci, s výjimkou nemocných po transplantaci ledvin a s těžkým stupněm renálního poškození (kreatinin nad 350 μmol . l-1). V hodnocení NGAL jsme upřednostnili hladinu v moči, s cílem eliminovat vliv NGAL uvolněného z jiných orgánů. Limitace studie spatřujeme v tom, že jsme díky existenci standardního protokolu pro primární náplň CPB neměli možnost eliminovat vliv podávaného manitolu. K ověření tvrzení, že jím navozená vysoká diuréza a tím i obrat tekutin mohou být příčinou zkreslení, by bylo vhodné studii doplnit o srovnávací skupinu nemocných, kterým by manitol v průběhu CPB nebyl podán.
I podání antifibrinolytik je ve vztahu k hladině močového NGAL diskutabilní. Možná indukce tubulárního poškození až renálního selhání spojená s elevací NGAL byla prokázaná po podání aprotininu [19]. Pacienti naší studie obdrželi aprotinin nebo kyselinu tranexamovou podle typu výkonu a volby operatéra. Srovnání vlivu těchto dvou látek na hladinu NGAL nebylo předmětem naší studie, ale vliv aprotininu nelze v tomto směru vyloučit.
V naší studii došlo u 20 nemocných (30 %) k rozvoji AKI nejnižšího stupně R a jen u 1 nemocného (2 %) to byl stupeň I. U žádného pacienta nenastalo renální selhání vyššího stupně (F, L a E), ani nebylo třeba zahájit CRRT. Absence vyššího stupně renálního poškození mohla být rovněž příčinou nevýrazného zvýšení hodnot NGAL a nesignifikantních rozdílů mezi oběma skupinami.
Závěr
V naší studii jsme neprokázali souvislost mezi rozvojem pooperačního renálního poškození a elevací močového NGAL. Hodnoty NGAL vykazovaly obdobnou kinetiku u všech nemocných bez ohledu na pooperační vývoj renálních funkcí, a neposkytovaly tak přesnější informaci ve srovnání s hodnotami glomerulární filtrace.
Práce vznikla za podpory Výzkumného záměru MZO 00179906.
Došlo 9. 7. 2008.
Přijato 21. 9. 2008.
Adresa pro korespondenci:
MUDr. Monika Gerlichová
KARIM FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
e-mail: monika.gerlichova@centrum.cz
Zdroje
1. Druml, W. Acute renal failure is not a „cute“ renal failure! Intensive Care Med., 2004, 30, p. 1886–1890.
2. Bove, T., Calabró, M. G., Landoni, G., Aletti, G., Marino, G., Crescenzi, G., Rosica, C., Zangrillo, A. The Incidence and Risk of Acute Renal Failure After Cardiac Surgery. J. Cardiothorac. Vasc. Anesth., 2004, 18, p. 442–445.
3. Westhuyzen, J., Endre, Z. H., Reece, G., Reith, D. M., Saltissi, D., Morgan, T. J. Measurement of tubular enzymuria facilitates early detection of acute renal impairment in the intensive care unit. Nephrol. Dial. Transplant., 2003, 18, p. 543–551.
4. Han, W. K., Bonventre, J. V. Biologic markers for the early detection of acute kidney injury. Curr. Opin. Crit. Care, 2004, 10, p. 476–482.
5. Waikar, S. S., Bonventre, J. V. Biomarkers for the diagnosis of acute kidney injury. Curr. Opin. Nephrol. Hypertens., 2007, 16, p. 557–564.
6. Bagshaw, S. M., Bellomo, R. Early diagnosis of acute kidney injury. Curr. Opin. Crit. Care, 2007, 13, p. 638–644.
7. Mishra, J., Ma, Q., Prada, A., Mitsnefes, M., Zahedi, K., Yang, J., Barasch, J., Devarajan, P. Identification of Neutrophil Gelatinase-Associated Lipocalin as a Novel Early Urinar Biomarker for Ischemic Renal Injury. J. Am. Soc. Nephrol., 2003, 14, p. 2534–2543.
8. Hemdahl, A. L., Gabrielsen, A., Zhu, CH., Eriksson, P., Hedin, U., Kastrup, J., Thorén, P., Hansson, G. K. Expression of Neutrophil Gelatinase –Associated Lipocalin in Atherosclerosis and Myocardial Infarction. Arterioscler. Tromb. Vasc. Biol., 2006, 26, p. 136–142.
9. Mishra, J., Dent, C., Tarabishi, R., Mitsnefes, M. M., Ma, Q., Kelly, C., Ruff, S. M., Zahedi, K., Shao, M., Bean, J., Mori, K., Barasch, J., Devarajan, P. Neutrophil Gelatinase-Associated lipocalin as a biomarker for acute renal injury after cardiac surgery. The Lancet, 2005, 365, p. 1231–1238.
10. Wagener, G., Jan, M., Kim, M., Mori, K., Barasch, J. M., Sladen, R. N., Lee, H. T. Association between Increases in Urinary Neutrophil Gelatinase-Associated Lipocalin and Acute Renal Dysfunction after Adult Cardiac Surgery. Anesthesiology, 2006, 105, p. 485–491.
11. Uchino, S., Bellomo, R., Goldsmith, D., Bates, S., Ronco, C. An Assessment of the RIFLE Criteria for Acute Renal Failure in Hospitalized Patients. Crit. Care Med., 2006, 34, p. 1913–1917.
12. Pedone, C., Corsonello, A., Incalzi, R. A. Estimating renal function in older people: a comparison of three formulas. Age and Ageing, 2006, 35, p. 121–126.
13. Trojan, S. et al. Fyziologie 1.část. 1. vyd. Praha: Avicenum 1987, 564 s. ISBN 08-027-87.
14. Liu, Q., Hamilton, M. N. Identification of a New Acute Phase Protein. J. Biol. Chem., 1995, 270, p. 22565–22570.
15. Schmidt, O., Mori, K., Kalandadze, A., Li, J. Y., Paragas, N., Nicholas, T., Devarajan, P., Barasch, J. NGAL – mediated iron traffic in kidney epithelia. Curr. Opin. Nephrol. Hypertens., 2006, 15, p. 442–449.
16. Schmidt, O., Mori, K., Li, J. Y., Kalandadze, A., Cohen, D. J., Devarajan, P., Barasch, J. Dual action of neutrophil gelatinase – Associated lipocalin. J. Am. Soc. Nephrol., 2007, 18, p. 407–413.
17. Dent, C. L., Ma, Q., Dastrala, S., Bennett, M., Mitsnefes, M. M., Barasch, J., Devarajan, P. Plasma neutrophil gelatinase – Associated lipocalin predicts acute kidney injury, morbidity and mortality after pediatric cardiac surgery: a prospective uncontrolled cohort study. Crit. Care, 2007, 11. Dostupný na: www:
18. Bu, D., Hemdahl, A. L., Gabrielsen, A., Fuxe, J., Zhu, Ch., Ericsson, P., Yan, Z. Induction of Neutrophil Gelatinase - Associated Lipocalin in Vascular Injury via Activation of Nuclear Factor - κB. Am. J. Pathol., 2006, 169, p. 2245–2252.
19. Wagner, G., Gubitosa, G., Naobout, M., Robert, S., Lee, H. T. Aprotinin Increases Urinary NGAL, a Marker for Renal Tubular Injury after Cardiac Surgery. Anesthesiology, 2006, 105, p. A1732. Dostupný na:
www:
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek Permisivní hyperkapnieČlánek Výborová schůze ČSARIMČlánek Výborová schůze ČSARIMČlánek JMENNÝ REJSTŘÍKČlánek VĚCNÝ REJSTŘÍK
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2008 Číslo 6- Jak souvisí postcovidový syndrom s poškozením mozku?
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Metamizol a jeho pozice v léčbě bolesti
-
Všechny články tohoto čísla
- Peroperační betablokáda – Devereaux kontra Poldermans: 2. kolo
- Hodnocení spolehlivosti Neutrophil Gelatinase-Associated Lipocalin jako markeru renální dysfunkce v kardiochirurgii dospělých – prospektivní studie
- První kombinovaná transplantace srdce a plic v České republice z pohledu anesteziologa a intenzivisty
- Power M-modus při transkraniálním dopplerovském vyšetření pro snazší diagnostiku v neurointenzivní péči – kazuistiky
- Kortikosteroidy v léčbě ALI/ARDS*
- Permisivní hyperkapnie
- Výborová schůze ČSARIM
- Výborová schůze ČSARIM
- Indikátory kvality anesteziologické péče – doporučení ČSARIM
- Diagnostika a léčba akutního peripartálního život ohrožujícího krvácení – doporučení odborných společností
- Zápis z jednání výboru 4/2008
- Profesorka MUDr. Danuše Táborská, DrSc. – významné jubileum
- JMENNÝ REJSTŘÍK
- VĚCNÝ REJSTŘÍK
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Permisivní hyperkapnie
- Kortikosteroidy v léčbě ALI/ARDS*
- První kombinovaná transplantace srdce a plic v České republice z pohledu anesteziologa a intenzivisty
- Profesorka MUDr. Danuše Táborská, DrSc. – významné jubileum
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



