-
Medical journals
- Career
Využití plazmy bohaté na trombocyty v hojení ran – některé poznatky a první zkušenosti
Authors: Igor Slaninka 1,2; Leo Klein 1,2,3; František Hošek 1,2; Lucie Hasenöhrlová 1,2; Stanislav Jíška 1,2; Milan Kaška 1,2
Authors‘ workplace: Katedra chirurgie, LF UK, Hradec Králové 1; Chirurgická klinika, LF UK a FN Hradec Králové 2; Katedra válečné chirurgie, Fakulta vojenského zdravotnictví UO, Hradec Králové 3
Published in: Hojení ran 7, č. 2: 25-27, 2013
Category:
Overview
I přes významný pokrok v terapii ran v posledních desetiletích neustále existují rány, které se nám i přes veškerou snahu nedaří zhojit. Autoři prezentují aktuální poznatky o léčbě ran s využitím plazmy bohaté na trombocyty (PRP), jako zdroje růstových faktorů. Dodání růstových faktorů může v případě akutní rány urychlit hojení nebo předejít přechodu do chronicity u rizikových skupin pacientů. V případě ran chronických by mohli z PRP profitovat pacienti, u kterých selhaly běžné dostupné metody celkové a lokální terapie. Tento fakt potvrzují i první zkušenosti na pracovišti autorů.
Klíčová slova:
plazma bohatá na trombocyty, trombocyty, hojení ran, růstové faktoryÚvod
Hojení ran je složitý proces, který v sobě zahrnuje interakce velkého množství aktivovaných buněčných a enzymových systémů, při kterých se uplatňuje schopnost regenerace a obnova všech tkání kůže. V současnosti existuje široké spektrum možností jak o ránu pečovat. Pod pojmem lokální terapie ran rozumíme především účelné provádění jejich převazů. Základem je aseptický přístup, kdy po toaletě (ošetření okolí rány a jejím opláchnutí k tomu určeným roztokem) provedeme débridement. Přítomnost nekrotických tkání, buněčného detritu, cizích těles a tekutinových kolekcí je zásadní překážkou pro hojení. Nekrotická tkáň jednak brání granulaci a epitelizaci, jednak je živným mediem pro růst bakterií a rozvoj bakteriální kolonizace rány. Z toho vyplývá, že débridement a nekrektomie jsou pro lokální terapii zásadní. Débridement nejčastěji provádíme v ambulantních podmínkách mechanicky exkochleací. V případě rozsáhlejší rány s nutností débridementu se nevyhneme celkové či místní anestezii. Každá rána má schopnost samočištění a pomocí proteolytických enzymů může být nekrotická tkáň rozpuštěna. V případě, že pro hojení rány vytvoříme vhodné podmínky podle zásad vlhkého hojení, je možné tímto pro pacienta nejpřijatelnějším způsobem provádět débridement i extenzivněji. Nevýhodou tohoto konzervativního přístupu je delší doba potřebná k vyčištění rány. K podpoře autolytického čištění rány je vhodná mj. podtlaková terapie. Ta kromě akcelerace débridementu výrazně urychluje i tvorbu granulační tkáně.
K dispozici jsou na trhu desítky variant krycích materiálů. Z toho může ale vzniknout problém, jaký materiál použít v dané situaci k léčení konkrétní rány. Při volbě krycího materiálu bychom se měli opírat hlavně o své zkušenosti a možnosti. Stejně důležité je správné vyhodnocení stadia hojení, v němž se rána momentálně nachází a zhodnocení případné ranné infekce. Přítomnost bakterií v chronické ráně kvantitativně hodnotíme od kontaminace, přes kolonizaci až k infekci (Wysocki 2002). U chronické rány dojde v čase téměř vždy ke kontaminaci.
Další možností léčby rány je terapie celková. Ta je nutná hlavně u ran chronických. I chronické rány mohou mít tendenci ke spontánnímu zhojení, ale většina z nich by se bez adekvátní lokální a celkové terapie hojila velmi dlouho nebo by se vůbec nezhojila. U malého procenta pacientů se i přes veškerou a jinak správnou léčbu ránu nedaří zhojit. V tom případě si každý, kdo se problematikou léčby ran zabývá, už určitě položil otázku, zda pro léčbu udělal maximum a hledá nové cesty využitelné v léčbě ran. Jednou z nových možností je využití plazmy bohaté na trombocyty.
Plazma bohatá na trombocyty (platelet-rich plasma – PRP) je definována jako frakce autologní krve s koncentrací trombocytů, která je vyšší než jejich koncentrace v periferní krvi. V experimentech in vitro se neprokázalo, že vyšší lokální koncentrace trombocytů vede k lepšímu efektu. Za jejich optimální koncentraci v klinické praxi se považují hodnoty asi 2,5–5x vyšší, než je standardně tato hodnota v periferní krvi (Graziani et al. 2006; Sánchez-González et al. 2012). Terapeuticky se využívá od 80. let 20. století (Driver et al.; Autologel Diabetic Foot Ulcer Study Group 2006). Za tuto dobu se začala používat v mnoha medicínských oborech jako je maxilo-faciální chirurgie, stomatochirurgie (Pietrzak et Eppley 2005; Lindeboom et al. 2007), ortopedie (Wrotniak et al. 2007), estetická a rekonstrukční chirurgie (Frechette et al. 2005), popáleninová medicína a další (Bhanot et al. 2002). Stejně tak se opakovaně potvrdil i její příznivý efekt na hojení měkkých i tvrdých tkání.
Podstatou účinku PRP je přítomnost vitálních trombocytů v ní. Kromě jejich dobře známé funkce v procesu hemostázy mají ještě významné funkce v angiogenezi, reparaci a hojení tkání. Jsou to první elementy, které se účastní časné zánětové reakce v procesu hojení (Nachman et al. 2008). V alfa granulích, denzních granulích a lysozomech obsahují celou řadu nezbytných růstových faktorů, cytokinů, signálních a jiných molekul (Rentu et Brohard-Bohm 2001). Pro hojivý proces se jeví být nejdůležitější přítomnost alfa granulí, v kterých jsou obsažené růstové faktory jako například platelet-derived growth factor (PDGF), insulin-like growth factor 1 (IGF-1), transforming growth factor-beta 1 (TGF-β1), vascular endothelial growth factor (VEGF), basic fibroblastic growth factor (bFGF) a epidermal growth factor (EGF) (Anitua et al. 2004). Nemalou úlohu v procesu hojení hrají též katecholaminy, histamin, serotonin, dopamin a ionty kalcia rovněž obsažené v trombocytech. Jejich role spočívá hlavně ve zvýšení permeability kapilár a aktivaci zánětové reakce (Qureshi et al. 2009). Aby mohlo dojít k procesu vyplavení všech výše uvedených faktorů, musí být trombocyty aktivovány (Sánchez-González et al. 2012). K aktivaci dochází buď adhezí a kontaktem s molekulami endotelu (jako například von Willebrandův faktor, kolagen, fibronektin a laminin), nebo kontaktem s trombinem a tromboxanem A2 (Borregard et Cowland 1997). Po aktivaci trombocytů dojde k vyplavení přibližně 95 % předsyntetizovaných růstových faktorů do 10 minut, zbylých 5 % se následně syntetizuje a vyplavuje během jejich dalšího života (5–10 dnů) (Sánchez-González et al. 2012; Cole et al. 2010).
von Willebrand Erik Adolf (1870–1949) – finský internista. Medicínu studoval na University of Helsingfors. V letech 1894 a 1895 pracoval jako lékařna Ålandských ostrovech, kde se setkal s „Ålandskouhemoragickou chorobou“. K publikaci poznatkůo nemoci, již identifikoval jako novou formu hemofilie sevrátil v roce 1926 (ve švédštině) a v roce 1931 (v němčině).V roce 1903 se stal docentem fyzikální terapie,v roce 1908 pak i interní medicíny. Věnoval se změnámkrve během svalové práce, obezitě a další problematice.Většinu své kariéry (1908–1935) pracoval v DeaconessInstitute. (Zdroj informací: archiv redakce)
Klinické možnosti využití destičkami obohacených substancí
Právě díky přítomnosti růstových faktorů v procesu hojení ran se ukazuje užití PRP jako jedna z možností, jak urychlit hojení rány, nebo jak umožnit zhojení tam, kde je proces hojení zpomalen nebo zastaven. Její použití vidíme jako optimální v případech, kdy lze očekávat zpomalené hojení operačních, traumatických ran a popálenin. Během několika desítek let používaní PRP se v mnoha studiích prokázal její příznivý efekt na hojení nejen tvrdých ale i měkkých tkání (Stryja 2012; Dionyssiou et al. 2012; Sakata et al. 2012). Stejně tak i řada studií in vitro prokázala jednoznačný příznivý efekt PRP v procesu hojení (Shengyun et Zuolin 2012). Na druhou stranu existují i studie in vivo, které tuto skutečnost nakonec částečně zpochybnily (Abate et al. 2012; Casati et al. 2007). Jako jeden z hlavních faktorů těchto nejednoznačných závěrů vidíme fakt, že proces hojení ran je natolik složitý děj, že pouhé zvýšení koncentrace přítomných růstových faktorů nemusí znamenat i rychlejší hojení, ale může ke zhojení dopomoci jako jeden z mnoha faktorů.
Trombocyty lze získat z venózní krve buď užitím separátoru, nebo centrifugací. Ta představuje dostupnější a finančně méně náročný způsob selekce trombocytů. Na našem pracovišti jsme dosud u dvou pacientů poprvé použili k přípravě PRP plazmy zkumavkový set a centrifugu (TropoCells, Estar Technologies Ltd.). Příprava PRP začíná odběrem venózní krve. Z 10 ml venózní krve lze získat cca 3 ml PRP. Venózní krev odebereme do vakuové trubice s antikoagulantem (ACD – Adenine Citrate Dextrose) a separačním gelem (velikost pórů 10 µm). Po 10 minutách odstřeďování při 3 600 ot/min dojde k separaci erytrocytů, plazmy chudé na trombocyty (PPP – platelet poor plasma) a trombocytů (obr. č. 1). Odebereme přebytečnou plazmu (asi 3 ml) a zbylou plazmu následně rozmícháme s trombocyty. Tím vytvoříme PRP plazmu, kterou oddělíme speciální filtrační trubicí a můžeme ji aplikovat pomocí injekční stříkačky na povrch rány (obr. č. 2). I naše první zkušenosti potvrzují příznivý efekt PRP jednak v rychlejší hemostáze a jednak v akceleraci základních mechanismů hojení rány. Nezanedbatelný je i její příznivý efekt na redukci intenzity bolesti v ráně, kam byla aplikována.
Image 1. Venózní krev ve zkumavce po centrifugaci 
Image 2. Aplikace PRP na ranou plochu tupou jehlou 2 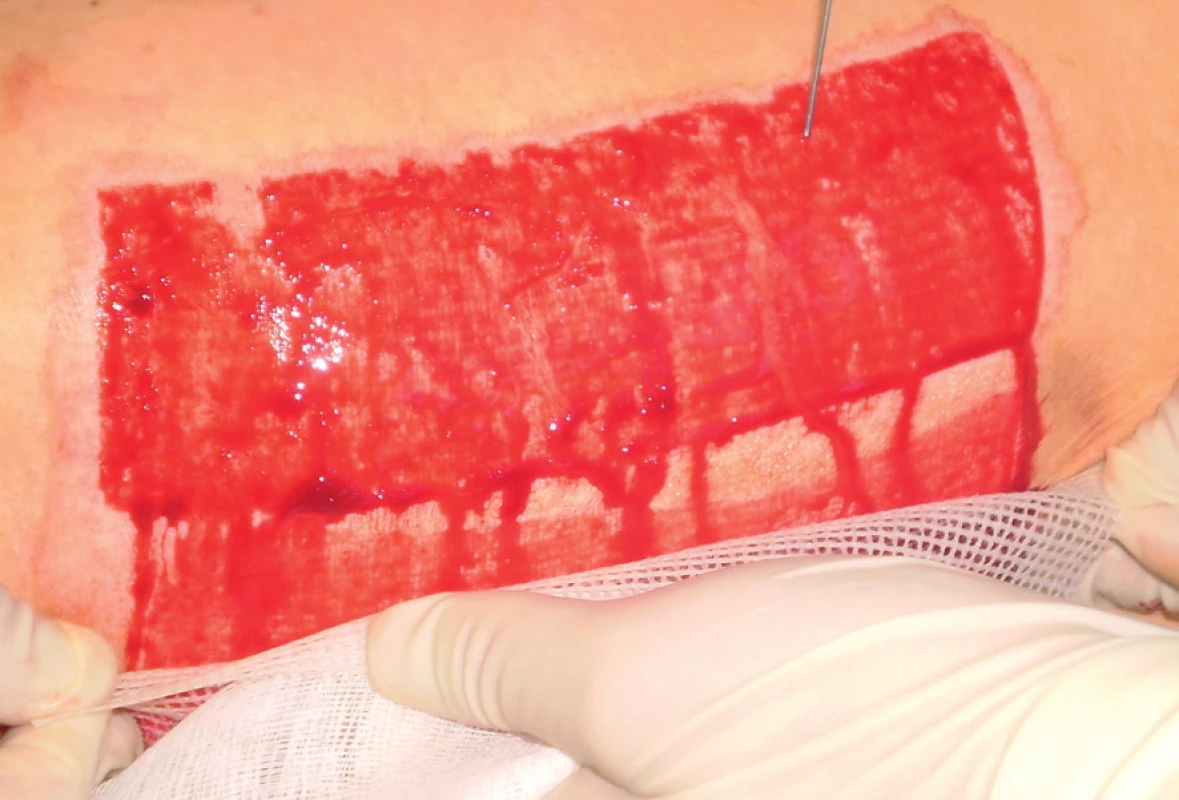
Podle našich informací se v současnosti plazma bohatá na trombocyty k terapii ran využívá v České republice na více pracovištích s různým zaměřením terapie. V popáleninovém centru Fakultní nemocnice v Ostravě ke stimulaci rychlosti hojení, zvýšení kvality hojení a snížení rizika vzniku hypertrofických jizev. Dále se využívá například na oddělení plastické a estetické chirurgie ve FN Olomouc, nebo v nemocnici Podlesí a.s. v Třinci se využívá autologní fibrin bohatý na krevní destičky v léčbě chronických kožních defektů. Naším záměrem je využití PRP v léčbě chronických ran při užití kožních štěpů. Cílem pak je určení významu využití PRP v urychlení a zkvalitnění hojení dermo-epidermálních štěpů u rizikové skupiny gerontologických pacientů, po předchozí přípravě kožního defektu pomocí podtlakové terapie.
Závěr
PRP plazma je experimentálně a klinicky zkoušená metoda využívající aplikaci autologních trombocytů a v nich obsažených růstových faktorů a dalších působků s příznivým efektem na hojivý proces a hemostázu. Časový faktor při přípravě není zanedbatelný, ale příprava PRP je nyní už finančně i provozně dostupná metoda s ohledem na benefit, který pro pacienta v určitých indikacích může nabídnout. Tento fakt potvrzují i naše první dílčí zkušenosti. Pro jednoznačný průkaz výše uvedených výhod metodiky s použitím PRP a pro její zavedení do běžné klinické praxe bude zapotřebí dalších prospektivních randomizovaných studií s vyšším počtem pacientů.
Práce je dedikována výzkumnému programu UK PRVOUK P37/04.
MUDr. Igor Slaninka
Chirurgická klinika, Fakultní nemocnice
Sokolská 581
500 05 Hradec Králové
e-mail: islaninka@post.cz
Sources
Abate, M., Di Gregorio, P., Schiavone, C. et al. Platelet rich plasma in tendinopathies: how to explain the failure. Int J Immunopathol Pharmacol 25, 2 : 325–234, 2012.
Anitua, E., Andia, I., Ardanza, B. et al. Autologous platelets as a source of proteins for healing and tissue regeneration. Thromb Haemost 91, 1 : 4–15, 2004.
Bhanot, S., Alex, J. C. Current applications of platelet gels in facial plastic surgery. Facial Plast Surg 18, 1 : 27–33, 2002.
Borregaard, N., Cowland, J. B. Granules of the human neutrophilic polymorphonuclear leukocyte. Blood 89, 10 : 3503–3521, 1997.
Casati, M. Z., de Vasconcelos Gurgel, B. C., Gonçalves, P. F. et al. Platelet-rich plasma does not improve bone regeneration around peri-implant bone defects-a pilot study in dogs. Int J Oral Maxillofac Surg 36, 2 : 132–136, 2007.
Cole, B. J., Seroyer, S. T., Filardo, G. et al. Platelet-rich plasma: where are we now and where are we going? Sports Health 2, 3 : 203–210, 2010.
Dionyssiou, D., Demiri, E., Foroglou, P. et al. The effectiveness of intralesional injection of platelet-rich plasma in accelerating the healing of chronic ulcers. An experimental and clinical study. Int Wound J doi:10.1111 : 1742–1748, 2012.
Driver, V. R., Hanft, J., Fylling, C. P., Beriou, J. M.; Autologel Diabetic Foot Ulcer Study Group. A prospective, randomized, controlled trial of autologous platelet-rich plasma gel for the treatment of diabetic foot ulcers. Ostomy Wound Manage 52, 6 : 68–70, 2006.
Frechette, J. P., Martineau, I., Gagnon, G. Plateletrich plasmas: growth factor content and roles inwound healing. J Dent Res 84, 5 : 434–439, 2005.
Graziani, F., Ivanovski, S., Cei, S. et al. The in vitro effect of different PRP concentrations on osteoblasts and fibroblasts. Clin Oral Implants Res 17, 2 : 212–219, 2006.
Lindeboom, J. A., Mathura, K. R., Aartman, I. H. et al. Influence of the application of platelet-enriched plasma in oral mucosal wound healing. Clin Oral Implants Res 18, 1 : 133–139, 2007.
Nachman, R. L., Rafii, S. Platelets, petechiae, and preservation of the vascular wall. The N Engl J Med 359, 12 : 1261–1270, 2008.
Pietrzak,W. S., Eppley, B. L. Platelet rich plasma: biology and new technology. J Craniofac Surg 16, 6 : 1043–1054, 2005.
Qureshi, A. H., Chaoji, V., Maiguel, D. Proteomic and phospho-proteomic profile of human platelets in basal, resting state: insights into integrin signaling. PLoS One 4, 10: e7627, 2009.
Rendu, F., Brohard-Bohn, B. The platelet release reaction: granules’ constituents, secretion and functions. Platelets 12, 5 : 261–273, 2001.
Sakata, J., Sasaki, S., Handa, K. A retrospective, longitudinal study to evaluate healing lower extremity wounds in patients with diabetes mellitus and ischemia using standard protocols of care and platelet-rich plasma gel in a Japanese wound care program. Ostomy Wound Manage 58, 4 : 36–49, 2012.
Sánchez-González, D. J., Méndez-Bolaina, E., Trejo-Bahena, N. I. Platelet-rich plasma peptides: key for regeneration. Int J Pept 2012 : 532519, 2012.
Shengyun, H., Zuolin, W. Platelet-rich plasma-derived growth factors promotes osteogenic differentiation of rat muscle satellite cells: in vitro and in vivo studies. Cell Biol Int 36, 12 : 1195–1205, 2012.
Stryja, J. Použití fibrinu bohatého na krevní destičky v rámci komplexní terapie bércového vředu – kazuistika. Hojení ran 6, 3 : 17–21, 2012.
Wrotniak, M., Bielecki, T., Gazdzik, T. S. Current opinion about using the platelet-rich gel in orthopaedics and trauma surgery. Ortop Traumatol Rehabil 9, 3 : 227–238, 2007.
Wysocki, A. B. Evaluating and managing open skin wounds: colonization versus infection. AACN Clin Issues 13, 3 : 382–397, 2002.
Labels
Surgery Nurse Home nurse
Article was published inWound Healing

2013 Issue 2-
All articles in this issue
- Antibiotická profylaxe v chirurgii – výsledky po roce užívání standardu
- Celulózové materiály v ošetřování ran
- Komplexní regionální bolestivý syndrom při léčbě ran
- Využití plazmy bohaté na trombocyty v hojení ran – některé poznatky a první zkušenosti
- Porodní traumatismus
- Zajímavosti z historie dopravních zdravotních služeb I.
- Hojení ran v intenzivní péči z pohledu fyzioterapeuta
- Význam antimikrobiální profylaxe u neodkladné appendektomie
- Wound Healing
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Komplexní regionální bolestivý syndrom při léčbě ran
- Porodní traumatismus
- Antibiotická profylaxe v chirurgii – výsledky po roce užívání standardu
- Celulózové materiály v ošetřování ran
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


