-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaVyužití plazmy bohaté na trombocyty v hojení ran – některé poznatky a první zkušenosti
The use of plasma rich in thrombocytes in the wound healing – some new information and the first experience
Despite significant advances in the treatment of wounds during the decades there are still wounds that we are fail to heal despite all efforts. The authors present the current knowledge of wound healing with the use of platelet rich plasma (PRP) as a source of growth factors. Delivery of growth factors can accelerate the healing process or prevent the transition of acute wounds to chronicity. Mostly risk groups of patients can profit from that as well as the patients with chronic wound who have failed conventional methods available to general and local therapy. This fact is confirmed by the authors group first experiences.
Key words:
platelet-rich plasma, platelets, wound healing, growing factors
Autoři: Igor Slaninka 1,2; Leo Klein 1,2,3; František Hošek 1,2; Lucie Hasenöhrlová 1,2; Stanislav Jíška 1,2; Milan Kaška 1,2
Působiště autorů: Katedra chirurgie, LF UK, Hradec Králové 1; Chirurgická klinika, LF UK a FN Hradec Králové 2; Katedra válečné chirurgie, Fakulta vojenského zdravotnictví UO, Hradec Králové 3
Vyšlo v časopise: Hojení ran 7, č. 2: 25-27, 2013
Kategorie: Hojení ran
Souhrn
I přes významný pokrok v terapii ran v posledních desetiletích neustále existují rány, které se nám i přes veškerou snahu nedaří zhojit. Autoři prezentují aktuální poznatky o léčbě ran s využitím plazmy bohaté na trombocyty (PRP), jako zdroje růstových faktorů. Dodání růstových faktorů může v případě akutní rány urychlit hojení nebo předejít přechodu do chronicity u rizikových skupin pacientů. V případě ran chronických by mohli z PRP profitovat pacienti, u kterých selhaly běžné dostupné metody celkové a lokální terapie. Tento fakt potvrzují i první zkušenosti na pracovišti autorů.
Klíčová slova:
plazma bohatá na trombocyty, trombocyty, hojení ran, růstové faktoryÚvod
Hojení ran je složitý proces, který v sobě zahrnuje interakce velkého množství aktivovaných buněčných a enzymových systémů, při kterých se uplatňuje schopnost regenerace a obnova všech tkání kůže. V současnosti existuje široké spektrum možností jak o ránu pečovat. Pod pojmem lokální terapie ran rozumíme především účelné provádění jejich převazů. Základem je aseptický přístup, kdy po toaletě (ošetření okolí rány a jejím opláchnutí k tomu určeným roztokem) provedeme débridement. Přítomnost nekrotických tkání, buněčného detritu, cizích těles a tekutinových kolekcí je zásadní překážkou pro hojení. Nekrotická tkáň jednak brání granulaci a epitelizaci, jednak je živným mediem pro růst bakterií a rozvoj bakteriální kolonizace rány. Z toho vyplývá, že débridement a nekrektomie jsou pro lokální terapii zásadní. Débridement nejčastěji provádíme v ambulantních podmínkách mechanicky exkochleací. V případě rozsáhlejší rány s nutností débridementu se nevyhneme celkové či místní anestezii. Každá rána má schopnost samočištění a pomocí proteolytických enzymů může být nekrotická tkáň rozpuštěna. V případě, že pro hojení rány vytvoříme vhodné podmínky podle zásad vlhkého hojení, je možné tímto pro pacienta nejpřijatelnějším způsobem provádět débridement i extenzivněji. Nevýhodou tohoto konzervativního přístupu je delší doba potřebná k vyčištění rány. K podpoře autolytického čištění rány je vhodná mj. podtlaková terapie. Ta kromě akcelerace débridementu výrazně urychluje i tvorbu granulační tkáně.
K dispozici jsou na trhu desítky variant krycích materiálů. Z toho může ale vzniknout problém, jaký materiál použít v dané situaci k léčení konkrétní rány. Při volbě krycího materiálu bychom se měli opírat hlavně o své zkušenosti a možnosti. Stejně důležité je správné vyhodnocení stadia hojení, v němž se rána momentálně nachází a zhodnocení případné ranné infekce. Přítomnost bakterií v chronické ráně kvantitativně hodnotíme od kontaminace, přes kolonizaci až k infekci (Wysocki 2002). U chronické rány dojde v čase téměř vždy ke kontaminaci.
Další možností léčby rány je terapie celková. Ta je nutná hlavně u ran chronických. I chronické rány mohou mít tendenci ke spontánnímu zhojení, ale většina z nich by se bez adekvátní lokální a celkové terapie hojila velmi dlouho nebo by se vůbec nezhojila. U malého procenta pacientů se i přes veškerou a jinak správnou léčbu ránu nedaří zhojit. V tom případě si každý, kdo se problematikou léčby ran zabývá, už určitě položil otázku, zda pro léčbu udělal maximum a hledá nové cesty využitelné v léčbě ran. Jednou z nových možností je využití plazmy bohaté na trombocyty.
Plazma bohatá na trombocyty (platelet-rich plasma – PRP) je definována jako frakce autologní krve s koncentrací trombocytů, která je vyšší než jejich koncentrace v periferní krvi. V experimentech in vitro se neprokázalo, že vyšší lokální koncentrace trombocytů vede k lepšímu efektu. Za jejich optimální koncentraci v klinické praxi se považují hodnoty asi 2,5–5x vyšší, než je standardně tato hodnota v periferní krvi (Graziani et al. 2006; Sánchez-González et al. 2012). Terapeuticky se využívá od 80. let 20. století (Driver et al.; Autologel Diabetic Foot Ulcer Study Group 2006). Za tuto dobu se začala používat v mnoha medicínských oborech jako je maxilo-faciální chirurgie, stomatochirurgie (Pietrzak et Eppley 2005; Lindeboom et al. 2007), ortopedie (Wrotniak et al. 2007), estetická a rekonstrukční chirurgie (Frechette et al. 2005), popáleninová medicína a další (Bhanot et al. 2002). Stejně tak se opakovaně potvrdil i její příznivý efekt na hojení měkkých i tvrdých tkání.
Podstatou účinku PRP je přítomnost vitálních trombocytů v ní. Kromě jejich dobře známé funkce v procesu hemostázy mají ještě významné funkce v angiogenezi, reparaci a hojení tkání. Jsou to první elementy, které se účastní časné zánětové reakce v procesu hojení (Nachman et al. 2008). V alfa granulích, denzních granulích a lysozomech obsahují celou řadu nezbytných růstových faktorů, cytokinů, signálních a jiných molekul (Rentu et Brohard-Bohm 2001). Pro hojivý proces se jeví být nejdůležitější přítomnost alfa granulí, v kterých jsou obsažené růstové faktory jako například platelet-derived growth factor (PDGF), insulin-like growth factor 1 (IGF-1), transforming growth factor-beta 1 (TGF-β1), vascular endothelial growth factor (VEGF), basic fibroblastic growth factor (bFGF) a epidermal growth factor (EGF) (Anitua et al. 2004). Nemalou úlohu v procesu hojení hrají též katecholaminy, histamin, serotonin, dopamin a ionty kalcia rovněž obsažené v trombocytech. Jejich role spočívá hlavně ve zvýšení permeability kapilár a aktivaci zánětové reakce (Qureshi et al. 2009). Aby mohlo dojít k procesu vyplavení všech výše uvedených faktorů, musí být trombocyty aktivovány (Sánchez-González et al. 2012). K aktivaci dochází buď adhezí a kontaktem s molekulami endotelu (jako například von Willebrandův faktor, kolagen, fibronektin a laminin), nebo kontaktem s trombinem a tromboxanem A2 (Borregard et Cowland 1997). Po aktivaci trombocytů dojde k vyplavení přibližně 95 % předsyntetizovaných růstových faktorů do 10 minut, zbylých 5 % se následně syntetizuje a vyplavuje během jejich dalšího života (5–10 dnů) (Sánchez-González et al. 2012; Cole et al. 2010).
von Willebrand Erik Adolf (1870–1949) – finský internista. Medicínu studoval na University of Helsingfors. V letech 1894 a 1895 pracoval jako lékařna Ålandských ostrovech, kde se setkal s „Ålandskouhemoragickou chorobou“. K publikaci poznatkůo nemoci, již identifikoval jako novou formu hemofilie sevrátil v roce 1926 (ve švédštině) a v roce 1931 (v němčině).V roce 1903 se stal docentem fyzikální terapie,v roce 1908 pak i interní medicíny. Věnoval se změnámkrve během svalové práce, obezitě a další problematice.Většinu své kariéry (1908–1935) pracoval v DeaconessInstitute. (Zdroj informací: archiv redakce)
Klinické možnosti využití destičkami obohacených substancí
Právě díky přítomnosti růstových faktorů v procesu hojení ran se ukazuje užití PRP jako jedna z možností, jak urychlit hojení rány, nebo jak umožnit zhojení tam, kde je proces hojení zpomalen nebo zastaven. Její použití vidíme jako optimální v případech, kdy lze očekávat zpomalené hojení operačních, traumatických ran a popálenin. Během několika desítek let používaní PRP se v mnoha studiích prokázal její příznivý efekt na hojení nejen tvrdých ale i měkkých tkání (Stryja 2012; Dionyssiou et al. 2012; Sakata et al. 2012). Stejně tak i řada studií in vitro prokázala jednoznačný příznivý efekt PRP v procesu hojení (Shengyun et Zuolin 2012). Na druhou stranu existují i studie in vivo, které tuto skutečnost nakonec částečně zpochybnily (Abate et al. 2012; Casati et al. 2007). Jako jeden z hlavních faktorů těchto nejednoznačných závěrů vidíme fakt, že proces hojení ran je natolik složitý děj, že pouhé zvýšení koncentrace přítomných růstových faktorů nemusí znamenat i rychlejší hojení, ale může ke zhojení dopomoci jako jeden z mnoha faktorů.
Trombocyty lze získat z venózní krve buď užitím separátoru, nebo centrifugací. Ta představuje dostupnější a finančně méně náročný způsob selekce trombocytů. Na našem pracovišti jsme dosud u dvou pacientů poprvé použili k přípravě PRP plazmy zkumavkový set a centrifugu (TropoCells, Estar Technologies Ltd.). Příprava PRP začíná odběrem venózní krve. Z 10 ml venózní krve lze získat cca 3 ml PRP. Venózní krev odebereme do vakuové trubice s antikoagulantem (ACD – Adenine Citrate Dextrose) a separačním gelem (velikost pórů 10 µm). Po 10 minutách odstřeďování při 3 600 ot/min dojde k separaci erytrocytů, plazmy chudé na trombocyty (PPP – platelet poor plasma) a trombocytů (obr. č. 1). Odebereme přebytečnou plazmu (asi 3 ml) a zbylou plazmu následně rozmícháme s trombocyty. Tím vytvoříme PRP plazmu, kterou oddělíme speciální filtrační trubicí a můžeme ji aplikovat pomocí injekční stříkačky na povrch rány (obr. č. 2). I naše první zkušenosti potvrzují příznivý efekt PRP jednak v rychlejší hemostáze a jednak v akceleraci základních mechanismů hojení rány. Nezanedbatelný je i její příznivý efekt na redukci intenzity bolesti v ráně, kam byla aplikována.
Obr. 1. Venózní krev ve zkumavce po centrifugaci 
Obr. 2. Aplikace PRP na ranou plochu tupou jehlou 2 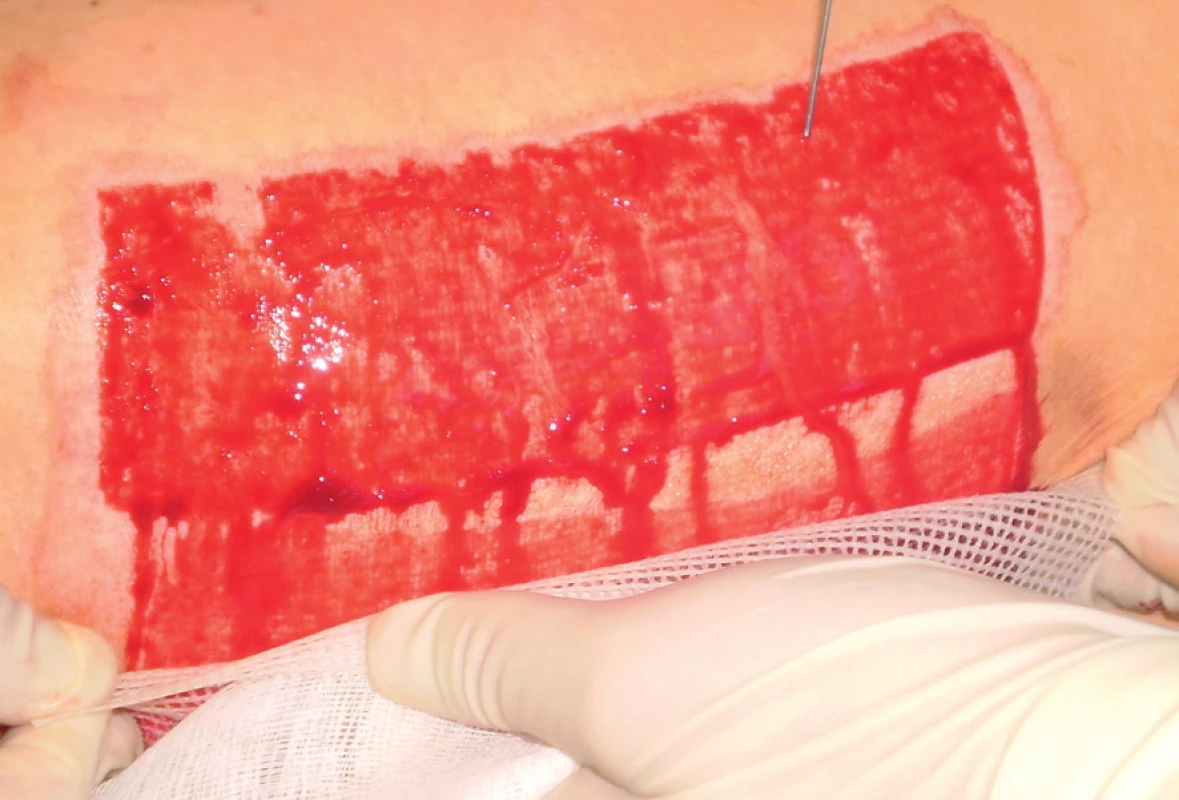
Podle našich informací se v současnosti plazma bohatá na trombocyty k terapii ran využívá v České republice na více pracovištích s různým zaměřením terapie. V popáleninovém centru Fakultní nemocnice v Ostravě ke stimulaci rychlosti hojení, zvýšení kvality hojení a snížení rizika vzniku hypertrofických jizev. Dále se využívá například na oddělení plastické a estetické chirurgie ve FN Olomouc, nebo v nemocnici Podlesí a.s. v Třinci se využívá autologní fibrin bohatý na krevní destičky v léčbě chronických kožních defektů. Naším záměrem je využití PRP v léčbě chronických ran při užití kožních štěpů. Cílem pak je určení významu využití PRP v urychlení a zkvalitnění hojení dermo-epidermálních štěpů u rizikové skupiny gerontologických pacientů, po předchozí přípravě kožního defektu pomocí podtlakové terapie.
Závěr
PRP plazma je experimentálně a klinicky zkoušená metoda využívající aplikaci autologních trombocytů a v nich obsažených růstových faktorů a dalších působků s příznivým efektem na hojivý proces a hemostázu. Časový faktor při přípravě není zanedbatelný, ale příprava PRP je nyní už finančně i provozně dostupná metoda s ohledem na benefit, který pro pacienta v určitých indikacích může nabídnout. Tento fakt potvrzují i naše první dílčí zkušenosti. Pro jednoznačný průkaz výše uvedených výhod metodiky s použitím PRP a pro její zavedení do běžné klinické praxe bude zapotřebí dalších prospektivních randomizovaných studií s vyšším počtem pacientů.
Práce je dedikována výzkumnému programu UK PRVOUK P37/04.
MUDr. Igor Slaninka
Chirurgická klinika, Fakultní nemocnice
Sokolská 581
500 05 Hradec Králové
e-mail: islaninka@post.cz
Zdroje
Abate, M., Di Gregorio, P., Schiavone, C. et al. Platelet rich plasma in tendinopathies: how to explain the failure. Int J Immunopathol Pharmacol 25, 2 : 325–234, 2012.
Anitua, E., Andia, I., Ardanza, B. et al. Autologous platelets as a source of proteins for healing and tissue regeneration. Thromb Haemost 91, 1 : 4–15, 2004.
Bhanot, S., Alex, J. C. Current applications of platelet gels in facial plastic surgery. Facial Plast Surg 18, 1 : 27–33, 2002.
Borregaard, N., Cowland, J. B. Granules of the human neutrophilic polymorphonuclear leukocyte. Blood 89, 10 : 3503–3521, 1997.
Casati, M. Z., de Vasconcelos Gurgel, B. C., Gonçalves, P. F. et al. Platelet-rich plasma does not improve bone regeneration around peri-implant bone defects-a pilot study in dogs. Int J Oral Maxillofac Surg 36, 2 : 132–136, 2007.
Cole, B. J., Seroyer, S. T., Filardo, G. et al. Platelet-rich plasma: where are we now and where are we going? Sports Health 2, 3 : 203–210, 2010.
Dionyssiou, D., Demiri, E., Foroglou, P. et al. The effectiveness of intralesional injection of platelet-rich plasma in accelerating the healing of chronic ulcers. An experimental and clinical study. Int Wound J doi:10.1111 : 1742–1748, 2012.
Driver, V. R., Hanft, J., Fylling, C. P., Beriou, J. M.; Autologel Diabetic Foot Ulcer Study Group. A prospective, randomized, controlled trial of autologous platelet-rich plasma gel for the treatment of diabetic foot ulcers. Ostomy Wound Manage 52, 6 : 68–70, 2006.
Frechette, J. P., Martineau, I., Gagnon, G. Plateletrich plasmas: growth factor content and roles inwound healing. J Dent Res 84, 5 : 434–439, 2005.
Graziani, F., Ivanovski, S., Cei, S. et al. The in vitro effect of different PRP concentrations on osteoblasts and fibroblasts. Clin Oral Implants Res 17, 2 : 212–219, 2006.
Lindeboom, J. A., Mathura, K. R., Aartman, I. H. et al. Influence of the application of platelet-enriched plasma in oral mucosal wound healing. Clin Oral Implants Res 18, 1 : 133–139, 2007.
Nachman, R. L., Rafii, S. Platelets, petechiae, and preservation of the vascular wall. The N Engl J Med 359, 12 : 1261–1270, 2008.
Pietrzak,W. S., Eppley, B. L. Platelet rich plasma: biology and new technology. J Craniofac Surg 16, 6 : 1043–1054, 2005.
Qureshi, A. H., Chaoji, V., Maiguel, D. Proteomic and phospho-proteomic profile of human platelets in basal, resting state: insights into integrin signaling. PLoS One 4, 10: e7627, 2009.
Rendu, F., Brohard-Bohn, B. The platelet release reaction: granules’ constituents, secretion and functions. Platelets 12, 5 : 261–273, 2001.
Sakata, J., Sasaki, S., Handa, K. A retrospective, longitudinal study to evaluate healing lower extremity wounds in patients with diabetes mellitus and ischemia using standard protocols of care and platelet-rich plasma gel in a Japanese wound care program. Ostomy Wound Manage 58, 4 : 36–49, 2012.
Sánchez-González, D. J., Méndez-Bolaina, E., Trejo-Bahena, N. I. Platelet-rich plasma peptides: key for regeneration. Int J Pept 2012 : 532519, 2012.
Shengyun, H., Zuolin, W. Platelet-rich plasma-derived growth factors promotes osteogenic differentiation of rat muscle satellite cells: in vitro and in vivo studies. Cell Biol Int 36, 12 : 1195–1205, 2012.
Stryja, J. Použití fibrinu bohatého na krevní destičky v rámci komplexní terapie bércového vředu – kazuistika. Hojení ran 6, 3 : 17–21, 2012.
Wrotniak, M., Bielecki, T., Gazdzik, T. S. Current opinion about using the platelet-rich gel in orthopaedics and trauma surgery. Ortop Traumatol Rehabil 9, 3 : 227–238, 2007.
Wysocki, A. B. Evaluating and managing open skin wounds: colonization versus infection. AACN Clin Issues 13, 3 : 382–397, 2002.
Štítky
Chirurgie všeobecná Sestra Domácí péče
Článek vyšel v časopiseHojení ran
Nejčtenější tento týden
2013 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Hojení análních fisur urychlí čípky a gel
- Jak souvisí postcovidový syndrom s poškozením mozku?
- Cinitaprid – v Česku nová účinná látka nejen pro léčbu dysmotilitní dyspepsie
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- O partnerství
- Celulózové materiály v ošetřování ran
- Komplexní regionální bolestivý syndrom při léčbě ran
- Využití plazmy bohaté na trombocyty v hojení ran – některé poznatky a první zkušenosti
- Hojení ran v intenzivní péči z pohledu fyzioterapeuta
- Význam antimikrobiální profylaxe u neodkladné appendektomie
- Porodní traumatismus
- Scabies – svrab
- Systagenix – pojďte s námi léčit rány
- Zajímavosti z historie dopravních zdravotních služeb I.
- Ohlédnutí za XI. ročníkem celostátního kongresu ČSLR s mezinárodní účastí
- Antibiotická profylaxe v chirurgii – výsledky po roce užívání standardu
- Hojení ran
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Scabies – svrab
- Komplexní regionální bolestivý syndrom při léčbě ran
- Porodní traumatismus
- Antibiotická profylaxe v chirurgii – výsledky po roce užívání standardu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




