-
Medical journals
- Career
Adenocarcinoma in situ děložního hrdla – 10letý soubor
Authors: doc. MUDr. Pavel Freitag, CSc.
Authors‘ workplace: Gynekologicko-porodnická klinika 1. LF UK a VFN, Praha, přednosta prof. MUDr. Alois Martan, DrSc.
Published in: Prakt Gyn 2015; 19(1): 42-45
Category: Oncogynecology: Original Article
Overview
V souboru 39 případů adenokarcinomu in situ děložního hrdla byly sledovány: věk pacientek, cytologické, kolposkopické a histologické nálezy, operační výkony a definitivní řešení. Medián věku byl 38 let (24–75). Prebioptická suspekce žlázové léze byla vyslovena v 7 cytologických (18 %) a v 7 kolposkopických (18 %) nálezech. U 28 nemocných (72 %) byla současně přítomna koexistující skvamózní léze. V 16 případech (46 %) z 35 konizací byly popsány histologicky pozitivní okraje léze a u 15 z nich byl proveden opakovaný nebo definitivní operační výkon. V něm byl ve 2 případech již invazivní adenokarcinom.
Klíčová slova:
adenokarcinom in situ – cytologie – děložní hrdlo – kolposkopie – pozitivní okrajeÚvod
Adenocarcinoma in situ (AIS) je diagnostikován v přibližně 2 % všech high grade intraepiteliálních lézích děložního hrdla – jeden případ AIS připadá na 30–80 high-grade skvamózních lézí. Přitom podíl invazivních adenokarcinomů na celkovém počtu karcinomů děložního hrdla se pohybuje mezi 6–18 % a jeví v posledních letech postupný nárůst, zejména u mladších pacientek. Vysvětlení této diskrepance není jednoznačné. Lze předpokládat, že vznik adenokarcinomu v této lokalizaci nemusí být předcházen postupným vývojem preinvazivních lézí, jak toto kontinuum postulujeme v případě karcinomu dlaždicobuněčného. Určitě však je vysvětlením také obtížnější diagnostika žlázových oproti dlaždicovým lézím děložního hrdla. To z prebioptických metod platí především pro kolposkopii, u níž ve většině případů přispívá k diagnóze často koexistující skvamózní léze.
Soubor a metodika
V Centru onkologické prevence gynekologicko-porodnické kliniky 1. LF UK a VFN v Praze jsme v letech 2005–2014 diagnostikovali celkem 477 případů carcinoma in situ děložního hrdla (zahrnuty jen případy s výsledky histopatologického laboratorního vyšetření popsané jako carcinoma in situ – nebyly zahrnuty nemocné s diagnózou CIN3 bez této bližší specifikace; CIN – cervical intra-epithelial neoplasia). Z tohoto počtu bylo diagnostikováno 39 případů adenocarcinoma in situ, tj. 8,2 %. Tento podíl oproti předchozím letům, v nichž byl záchyt případů AIS zcela sporadický, postupně narůstal. Za období posledních 5 let (2010–2014) vzrostl počet AIS v našem souboru na 33 ze 196 případů, tj. na 16,8 %. V předkládaném 10letém souboru byly sledovány: věk pacientek, cytologické, kolposkopické a histologické nálezy, operační výkony a definitivní řešení.
Výsledky
Medián věku nemocných byl 38 let (24–75). Diagnóza AIS byla ve 35 případech stanovena konizací nebo cylindrickou disekcí děložního hrdla, ve 4 případech byla zjištěna při laparoskopicky asistované vaginální hysterektomii (LAVH) indikované pro uterus myomatosus. Současná přítomnost dlaždicové léze byla ve 28 případech, tj. 72 %: 5krát CIN1, 6krát CIN2 a 17krát CIN3/CIS. Cytologické nálezy signalizovaly přítomnost žlázové léze v 7 případech (18 %): 4krát cytologický nález AIS, 3krát AGC-FN (Atypical glandular cells favouring neoplasia). U ostatních figurovaly nálezy LSIL (low grade squamous intraepithelial lesion), HSIL (high grade intraepithelial lesions), AGC-NOS (atypical glandular cells not otherwise specified) ale i NILM (negative for intraepithelial lesion and malignancy). V kolposkopických nálezech byla vyslovena suspekce na žlázovou lézi 7krát (18 %): 2krát pro budding (pučení papil cylindrického epitelu), 3krát pro clumps (shluky papil) a 2krát pro bělavé apexy papil cylindrického epitelu.
Z 35 provedených excizních výkonů byly zaznamenány pozitivní okraje v 16 případech, tj. ve 46 %. Ve 4 vzorcích šlo o dosah AIS do exocervikálního okraje, ve 13 případech do endocervikálního okraje (10krát dosah AIS, 3krát dosah CIN3) a ve 2 případech dosah obou okrajů. V 15 ze 16 případů pozitivních okrajů byla provedena reoperace. Její výsledky uvádí tab. 1. Ve 2 případech byl v reoperaci již nález invazivního adenokarcinomu, stadium T1a1.
Table 1. Histologické nálezy reoperací pro pozitivní okraj 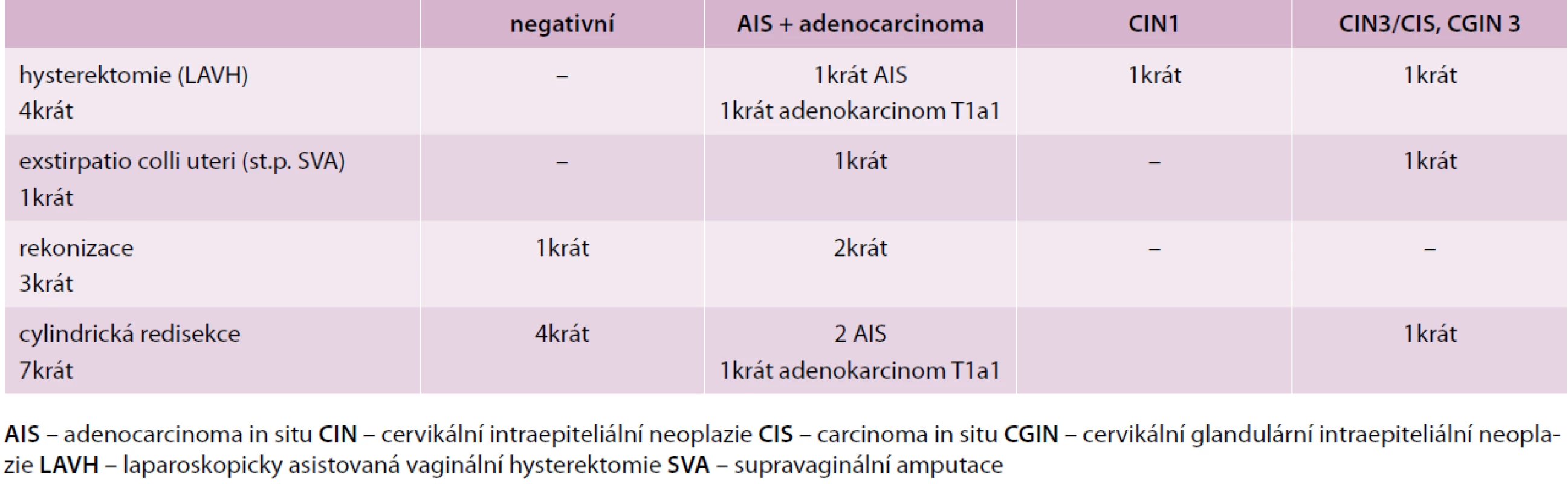
V kyretáži proximálního kanálu děložního hrdla byl ve 24 případech (69 %) normální cylindrický epitel, ve 4 případech (11 %) byl materiál nediagnostický. V 7 případech (20 %) byl přítomen patologický nález (3krát CGIN 2/3, 1krát AIS, 1krát CIN 3, 2krát popsán dysplastický epitel). Histologické nálezy v reoperacích provedených pro tyto nálezy uvádí tab. 2.
Table 2. Reoperace pro nálezy v kyretáži proximálního děložního hrdla 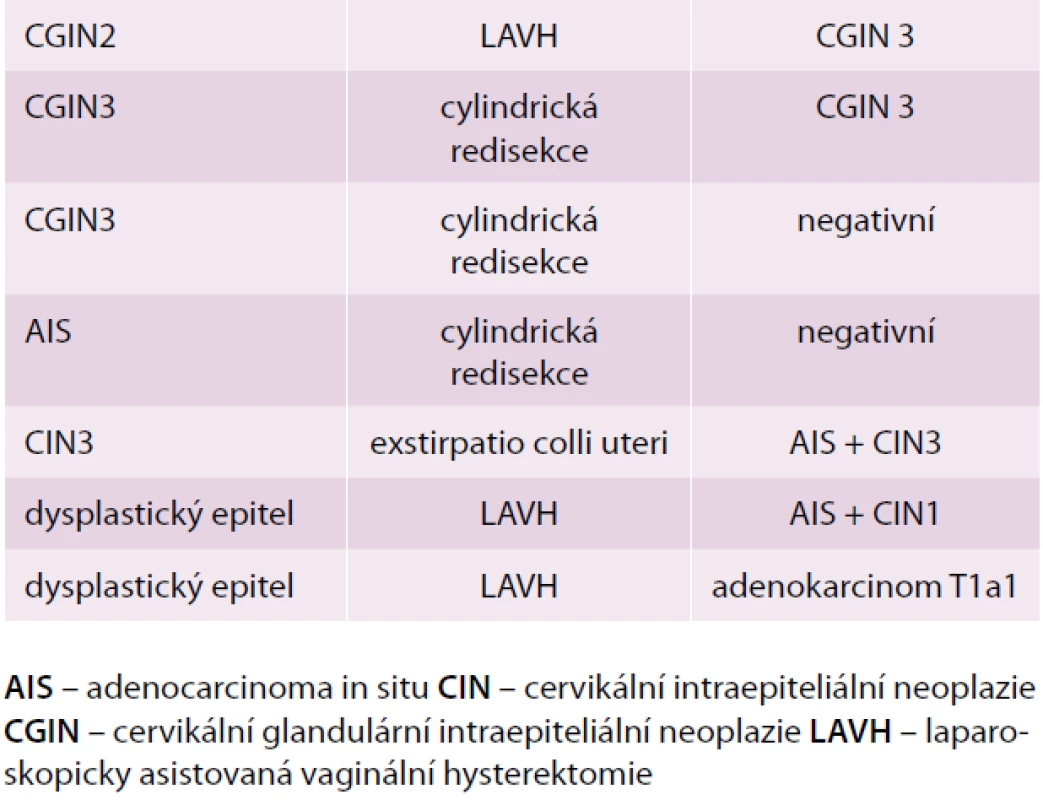
Image 1. Kolposkopický obraz adenocarcinoma in situ – vzájemně splývající papily cylindrického epitelu, bílé po kyselině octové 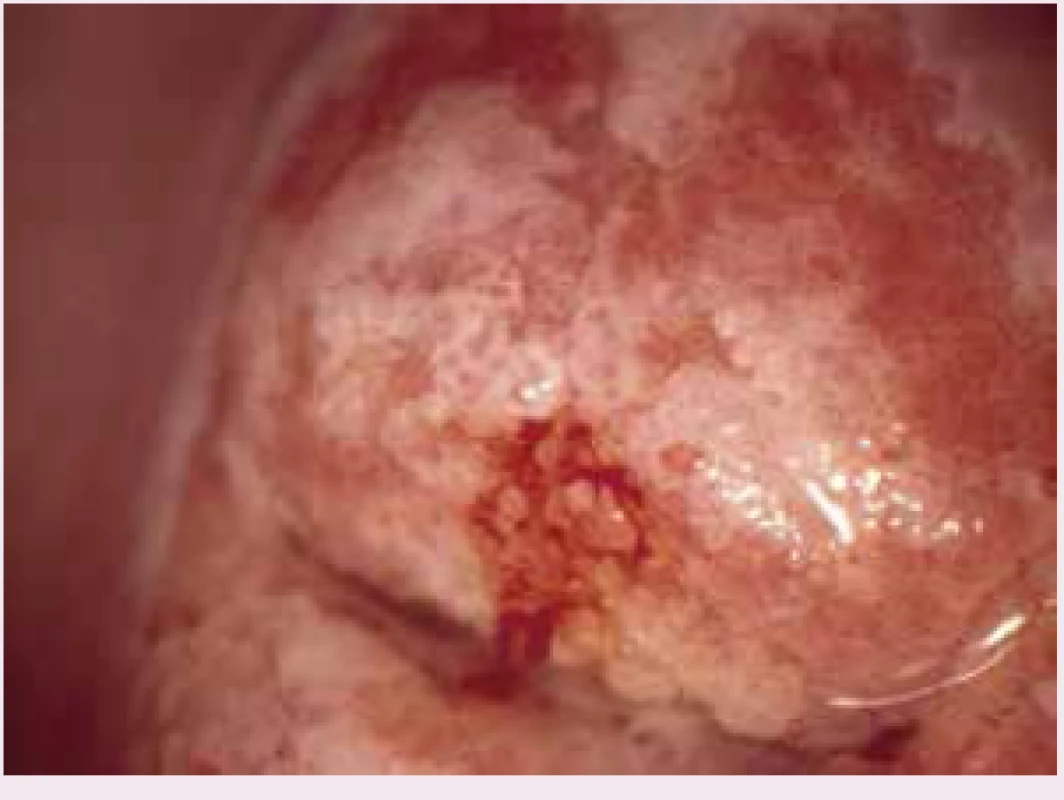
Recidivu nálezu AIS ve follow-up pacientek jsme zaznamenali v 1 případě, 2 roky od primární diagnózy.
Diskuse
V cytologické klasifikaci (Bethesda 2001) atypií žlázových buněk (AGC) je možná přítomnost přednádorových lézí žlázového epitelu vyjádřena kategoriemi AGC-NOS (blíže nespecifikované), AGC-NEO či AGC-FN (spíše neoplastické) a AGC-AIS (adenocarcinoma in situ). Nález AGC-AIS je popisován vzácně a histologická diagnóza AIS se může skrývat i pod „lehčími“ nálezy atypie žlázových buněk. Situaci komplikuje (ale současně i usnadňuje) současný výskyt dlaždicobuněčných lézí (tzv. mixed prekancerózy). Pohybuje se mezi 50–80 % a cytologický nález pak reflektuje spíše tuto skvamózní složku (zejména kategorií HSIL). V našem souboru přispěl cytologický nález k podezření na žlázovou lézi v 7 případech (18 %). 14krát byl přítomen nález HSIL. V definitivním histologickém nálezu byla koincidentní skvamózní léze přítomna ve 28 z 39 případů (72 %).
Kolposkopický obraz žlázových lézí může vykazovat některé charakteristické rysy, ale jejich specifita není pro diagnózu AIS dostatečná, a navíc je často subtilní nález překryt či ovlivněn vysokým procentem koexistující skvamózní léze. K možným typickým obrazům patří papilarita léze – variabilně velké klky cylindrického epitelu a jejich vzájemná fúze (shluky – clumps), bílé vrcholy papil a dále střídání okrsků červené a bílé barvy (red and white) – obojí může připomínat nezralou transformační zónu. Nástup zbělení po kyselině octové bývá rychlý. Dále lze nalézt elevaci denzní acetowhite léze nad niveau okolního epitelu (isolated elevated laesion), široká ústí žlázových krypt (large gland openings) a pučení papil epitelu (tzv. epithelial budding). Změny bývají převážně uvnitř transformační zóny, mohou zasahovat do endocervikálního kanálu nebo být přítomny pouze uvnitř něho. Často jde o multifokální (skip) léze. Žlázová složka mixed prekanceróz je lokalizována zpravidla proximálně od skvamózní léze. Menší plošný rozměr (do 15 mm) nacházíme zpravidla u mladších žen, u starších může být nález plošně větší a propagace do hloubky žlázových krypt větší (do 6 mm). Cévní atypie specifické pro AIS nejsou charakteristické – někdy lze nalézt cévy tvaru kořenů, výhonků, čárek i písmen, zpravidla však nejsou přítomny vývrtkovité cévy [1].
V našem souboru signalizovala kolposkopie přítomnost žlázové léze v 7 případech, převažovaly nálezy svědčící pro HG-skvamózní lézi a 9krát bylo nutno pro neviditelnost skvamokolumnární junkce kolposkopii považovat za „unsatisfactory“.
Význam punch-biopsie (nebo endocervikální kyretáže) je limitován menší velikostí, častou endocervikální lokalizací a možnou multifokalitou léze. V našem souboru byla punch-biopsie provedena 4krát, vždy s nálezem high grade skvamózní léze (CIN2/3). Jednou vedl k diagnóze AIS výsledek endocervikální kyretáže (ověřený pak dalšími výkony). Adekvátní histologický nález může poskytnout jen konizace nebo cylindrická disekce děložního hrdla, doplněné kyretáží proximálního kanálu děložního hrdla. V histologických nálezech je diagnóza cervikální glandulární intraepiteliální neoplazie (CGIN stupňů 1–3) uváděna méně často a převažuje nález vyjádřený přímo jako AIS. Zcela zvláštní případy tzv. gastrické diferenciace žlázových lézí představuje nález atypické LEGH (lobular endocervical glandular hyperplasia), který je uváděn jako možný prekurzor non-HPV adenokarcinomu a dále nález SMILE (stratified mucin producing intraepithelial laesion), pokládaný za formu dysplazie rezervních buněk či stratifikovaný AIS [2]. V našem souboru jsme se s těmito formami nesetkali.
Vzhledem k uvedeným charakteristikám glandulárních lézí je riziko pozitivních okrajů provedeného excizního výkonu vysoké. V našem souboru to bylo v 16 případech (46 %) z 35 excizních výkonů. U všech nemocných byl indikován 2. operační výkon (v 1 případě i 3. výkon). 6krát byla v těchto případech definitivním řešením laparoskopicky asistovaná vaginální hysterektomie (LAVH), 1krát abdominální hysterektomie a 2krát vaginální hysterektomie.
Salani et al publikovali metaanalýzu 33 studií s 1 278 případy konizací a zjistili 4krát vyšší riziko reziduální nemoci v případě pozitivních okrajů konizace. Opakovaná excize byla provedena ve 47 % případů. Z 671 dále sledovaných recidivovalo 2,6 % nemocných s negativními okraji (v 0,1 % jako invazivní adenokarcinom), zatímco při pozitivních okrajích to bylo 19,4 % (5,2 % invazivních adenokarcinomů). Konzervativní přístup v managementu považují autoři za bezpečnější pro nemocné s negativními okraji excidovaného vzorku [3].
Baalbergen et al v metaanalýze 35 studií zjistili v 16,5 % reziduální nález AIS v rekonizacích, v případě pozitivních okrajů prvého výkonu bylo procento reziduálních nálezů 49,3 %. Výskyt recidiv byl u pozitivních okrajů v 5 %, u negativních okrajů ve 3 %. Malignizace byla < 1% [4]. Podobně Taylor et al zaznamenali v souboru 52 pacientek s AIS 50 % pozitivních okrajů a reziduum AIS ve druhém výkonu ve 47 % [5]. Tierney et al u 78 pacientek s AIS v případě pozitivních okrajů zjistili 68 % reziduálního nálezu (oproti 14 % v případě negativních okrajů), v případě pozitivní endocervikální kyretáže 95 % reziduí a v případě pozitivity obou již 15 % adenokarcinomů [6].
Latif et al ve srovnání 115 konizací provedených LEEP technikou nebo skalpelem nenalezli žádný statisticky významný rozdíl ve výskytu pozitivních okrajů, rekurencí či následného vzniku adenokarcinomu [7]. Costales et al naopak uvádějí u 180 pacientek s AIS 55,6 % pozitivních okrajů při LEEP technice oproti 35 % při použití skalpelu. V následných hysterektomiích byl reziduální AIS přítomen v 11,3 % a invazivní adenokarcinom ve 2,8 % [8]. Progresi do invazivního adenokarcinomu zjistili ve svém souboru 119 pacientek Costa et al v 6,7 % [9].
Rolí punch-biopsie se zabývali Jordan et al – při nálezu AIS v punch-biopsii byl ve 29 % finální diagnózou již invazivní adenokarcinom [10].
Zastoupení HR-HPV-genotypů studovali Andersson et al – genotypy 18/45 zjistili v 77 % případů AIS, HPV 16 byl přítomen ve 27 % [11].
Možný konzervativní přístup hodnotili v přehledovém článku Graesslin et al, kteří uvádějí riziko rekurence léze v 5–10 % (invazivního adenokarcinomu ve 2 %). Podobně jako další autoři uvádějí jako podmínky konzervativního postupu provedení konizace skalpelem, resekci hrdla v minimální délce 25 mm, provedení endocervikální kyretáže, přání zachovat fertilitu a plnou komplianci nemocné. V ostatních případech preferují navrhnout nemocné řešení hysterektomií [12]. Dlouhodobé sledování nemocných je považováno za nezbytné, někteří doporučují až 10leté follow-up.
Závěr
V popsaném souboru 39 případů adenokarcinomu in situ děložního hrdla byla prebioptická suspekce ze žlázové léze vyslovena v 7 případech cytologicky (18 %) a v 7 případech kolposkopicky (18 %). Ve 28 případech (72 %) byla současně přítomna koexistující skvamózní léze. V 16 případech (46 %) z 35 excizních výkonů (27krát konizace, 8krát cylindrická disekce) byly přítomny pozitivní okraje léze a u všech těchto nemocných proveden opakovaný nebo definitivní operační výkon. Ve 2 případech byl v opakovaném výkonu přítomen již invazivní adenokarcinom děložního hrdla.
V souhlasu s literárními údaji byla i v našem souboru prebioptická diagnostika adenokarcinomu in situ vzácným jevem. Odhalené případy byly diagnostikovány především díky koincidentní skvamózní epitelové lézi. Vysoké procento pozitivních okrajů, vyplývající z charakteru žlázových lézí, si vyžádalo opakování excizního výkonu nebo radikální řešení.
Konzervativní postup, zejména v případě snahy o zachování fertility, je možný, pečlivá a dlouhodobá dispenzarizace je však nezbytná. Po splnění reprodukčních plánů je většinou autorů doporučováno provedení hysterektomie.
Doručeno do redakce 11. 3. 2015
Přijato po recenzi 26. 3. 2015
doc. MUDr. Pavel Freitag, CSc.
pfreitag@vfn.cz
Gynekologicko-porodnická klinika 1. LF UK a VFN, Praha
www.vfn.cz
Sources
1. Sláma J. Prekancerózy v gynekologii. In: Cibula D, Petruželka L (eds). Onkogynekologie. Grada: Praha 2009; 315–339. ISBN 978–80–247–2665–6.
2. McCluggage WG. Premalignant lesions of the lower female genital tract: cervix, vagina and vulva. Pathology. 2013; 45(3): 214–228.
3. Salani R, Puri I, Bristow RE. Adenocarcinoma in situ of the uterine cervix: a metaanalysis of 1278 patients evaluating the predictive value of conization margin status. Am J Obstet Gynecol 2009; 200(2):182.e1–5. Dostupné z DOI: <http://doi: 10.1016/j.ajog.2008.09.012>.
4. Baalbergen A, Helmerhorst TJ. Adenocarcinoma in situ of the uterine cervix--a systematic review. Int J Gynecol Cancer 2014; 24(9): 1543–1548.
5. Taylor JS, Panico V, Caputo T et al. Clinical outcomes of patients with adenocarcinoma in situ of the cervix treated by conization. Eur J Gynaecol Oncol 2014; 35(6): 641–645.
6. Tierney KE, Lin PS, Amezcua C et al. Cervical conization of adenocarcinoma in situ: a predicting model of residual disease. Am J Obstet Gynecol 2014; 210(4): 366.e1–5. Dostupné z DOI: <http://doi: 10.1016/j.ajog.2013.12.030>.
7. Latif NA, Neubauer NL, Helenowski IB et al. Management of Adenocarcinoma In Situ of the Uterine Cervix: A Comparison of Loop Electrosurgical Excision Procedure and Cold Knife Conization. J Low Genit Tract Dis 2014. Dostupné z WWW: <http://journals.lww.com/jlgtd/pages/articleviewer.aspx?year=9000&issue=00000&article=99713&type=abstract>.
8. Costales AB, Milbourne AM, Rhodes HE et al. Risk of residual disease and invasive carcinoma in women treated for adenocarcinoma in situ of the cervix. Gynecol Oncol 2013; 129(3): 513–516.
9. Costa S, Venturoli S, Negri G et al. Factors predicting the outcome of conservatively treated adenocarcinoma in situ of the uterine cervix: an analysis of 166 cases. Gynecol Oncol 2012; 124(3): 490–495.
10. Jordan SM, Chase DM, Watanabe T et al. High pathologic misdiagnosis of cervical adenocarcinoma in situ. Eur J Gynaecol Oncol 2013; 34(5): 446–449.
11. Andersson S, Mints M, Wilander E. Results of cytology and high-risk human papillomavirus testing in females with cervical adenocarcinoma in situ. Oncol Lett 2013; 6(1): 215–219.
12. Graesslin O, Dedecker F, Collinet P et al. Management of in situ cervical adenocarcinoma. Gynecol Obstet Fertil 2006; 34(12): 1178–1184.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inPractical Gynecology

2015 Issue 1-
All articles in this issue
- Nová klasifikace nádorů a lézí prsu, jejich hormonální senzitivita a naše možnosti prevence
- Současné možnosti rekonstrukce prsu po mastektomii
- Dispenzarizace pacientek po léčbě karcinomu prsu
- Vztah kvality života a typu léčby u žen s karcinomem prsu: pilotní studie
- Recidivující melanom vulvy s heterogenními histologickými rysy: kazuistika
- Adenocarcinoma in situ děložního hrdla – 10letý soubor
- Zanedbání prevence onkogynekologických onemocnění u žen bez domova
- Postavení D-manózy v léčbě a prevenci urologických infekcí Adam Neumann
- Management porodů po císařském řezu v Nemocnici Český Krumlov
- Jak správně klasifikovat ženské sexuální dysfunkce?
- Specifika prenatální péče u žen z vybraných minorit
- Specifika ošetřovatelské péče o ženu s HELLP-syndromem: kazuistika
- Metformin a těhotenství
- Tomáš Fait, Michal Zikán, Jaromír Mašata et al. Moderní farmakoterapie v gynekologii a porodnictví
- Zdeněk Hájek, Evžen Čech, Karel Maršál et al. Porodnictví
- Eva Kašáková, Martin Vokurka, Jan Hugo. Výkladový slovník pro zdravotní sestry
- Editorial
- Hovory s Laurou Tentokrát s docentem Michalem Zikánem
- Practical Gynecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Nová klasifikace nádorů a lézí prsu, jejich hormonální senzitivita a naše možnosti prevence
- Metformin a těhotenství
- Postavení D-manózy v léčbě a prevenci urologických infekcí Adam Neumann
- Adenocarcinoma in situ děložního hrdla – 10letý soubor
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

