-
Medical journals
- Career
Metformin a těhotenství
: MUC. Jan Přáda; MUDr. Kateřina Anderlová, Ph.D.
: Gynekologicko-porodnická klinika 1. LF UK a VFN Praha
: Prakt Gyn 2015; 19(1): 74-76
: Students Articles: Review Article
Inzulin byl při léčbě diabetu v těhotenství vždy považován za lék první volby. Metformin a další perorální antidiabetika naopak patřily mezi léčiva, která podávána nebyla, a to z obavy možného poškození plodu. Poslední studie však ukazují, že bezpečnost metforminu je ve srovnání s inzulinem naprosto srovnatelná a že užívání metforminu dokonce může přinášet jistá pozitiva.
Klíčová slova:
diabetes mellitus – těhotenství – perorální antidiabetika – metforminÚvod
Za několik posledních desetiletí v populaci došlo k výraznému posunu v mnoha demografických ukazatelích. Pozorujeme nejen zvyšování věku prvorodiček a rodiček obecně, ale také vzestup jejich morbidity. Tyto tendence do značné míry odrážejí současné trendy ve společnosti a životní styl. Čím dál více těhotných žen má nadváhu až obezitu, stoupá incidence gestačního diabetu (GDM). GDM patří mezi nejčastější interní komplikace vyskytující se v těhotenství. Jedná se o poruchu metabolizmu glukózy, která se objeví v těhotenství a spontánně odezní během šestinedělí. Incidence GDM celosvětově narůstá. Výsledky nedávných českých i mezinárodních studií naznačují, že je v současné době postiženo GDM až 20 % těhotných žen. Neléčený GDM ohrožuje vývoj plodu a může vést k řadě komplikací jak pro matku, tak pro její plod, u kterého kromě bezprostředních perinatálních komplikací zvyšuje také riziko vzniku obezity, diabetes mellitus 2. typu, metabolického syndromu a kardiovaskulárních komplikací v pozdějším věku. Ženy s anamnézou GDM jsou ohroženy vznikem diabetu 2. typu v pozdějším věku [7].
Základem léčby GDM je dieta s omezením sacharidů a přiměřená fyzická aktivita. Pokud tato opatření nestačí, zahajujeme farmakoterapii. Do nedávné doby bylo možné v těhotenství použít pouze inzulin. Použití perorální antidiabetik (dále PAD) nebylo v těhotenství povoleno, především z obavy poškození plodu. Na základě výsledků randomizovaných studií byla prokázána bezpečnost a účinnost léčby metforminem, srovnatelná s léčbou inzulinem. Dle posledních výzkumů je však bezpečnost metforminu naprosto srovnatelná s inzulinem. Dále se jeho užívání vyznačuje vyšší kompliancí, protože je pro pacientky perorální forma podání příjemnější. Léčba je také ekonomicky méně náročná [1].
Metformin, jeho farmakokinetika a farmakodynamika
Metformin je zástupce druhé generace biguanidů. Tato skupina perorálních antidiabetik patří mezi léky zvyšující inzulinovou senzitivitu zejména v jaterní a v menší míře i svalové tkáni. Hlavní m účinkem metforminu je inhibice jaterní glukoneogeneze a glykogenolýzy, zpomaluje absorpci glukózy ve střevě a zvyšuje využití glukózy ve svalech a tukové tkáni. Sekrece inzulinu není metforminem ve větší míře ovlivněna, jeho podání tudíž není spojeno s rizikem hypoglykemie.
Metformin se prakticky neváže na plazmatické proteiny a je vylučován ledvinami v nezměněné podobě. V těhotenství, běheme kterého dochází ke zvýšení glomerulární filtrace, je jeho vylučování rychlejší [4].
Metformin přechází přes placentu transportem. V původních experimentech ex vivo sice odpovídala plazmatická koncentrace metforminu ve fetální krvi pouze 10–16% koncentraci v krvi mateřské, avšak pokusy in vivo prokázaly, že koncentrace v mateřské a fetální krvi mohou dosahovat až totožných hodnot [8].
Do mateřského mléka se metformin dostává pouze v nepatrném množství. Studie na zvířatech nenaznačují teratogenní účinky tohoho léku. Pokud byl metformin užíván v 1. trimestru těhotenství, nedošlo ke zvýšení kongenitálních malformací, naopak došlo ke snížení výskytu abortů a dalších těhotenských komplikací. Nebyl prokázán nežádoucí vliv na vývoj dětí do věku 2 let (další klinická sledování v současné době probíhají) [4].
Nejčastějším nežádoucím účinkem metforminu jsou gastrointestinální potíže – nauzea, zvracení, flatulence. Při dlouhodobém užívání byla také pozorována porucha absorpce vitaminu B12 [12].
Incidence laktátové acidózy je u metforminu oproti minulé generaci biguanidů výrazně nižší (9/100 000).
Mezi kontraindikace podání metforminu patří jaterní a renální insuficience, ketoacidóza, akutní stavy, které mohou ovlivnit funkci ledvin a způsobit tkáňovou hypoxii (srdeční a respirační selhání).
Metformin je kontraindikován při kojení.
Podle SPC se nedoporučuje užívání metforminu ani během těhotenství. V řadě zemí (včetně USA a Velké Británie) je podání metforminu v těhotenství povoleno stejně jako České republice. Proto je nutné před zahájením léčby metforminem informovat pacientku o rozporu současných znalostí medicíny s údaji o léku, které jsou uvedené v SPC. Je vhodné založit do dokumentace podepsaný informovaný souhlas pacientky. [13].
Praktické aspekty použití metforminu
Pro riziko dyspeptických potíží je nutná pomalá titrace dávky metforminu. Léčba se zahajuje dávkou 500 mg (večer). Léčbu metforminem ukončujeme 48 hodin před plánovaným císařským řezem nebo předpokládaným termínem porodu. V případě spontánního porodu nebo akutního císařského řezu před očekávaným termínem porodu se léčba metforminem ukončuje bezprostředně před porodem. Výhodou metforminu je menší váhový přírůstek v těhotenství a nepřítomnost rizika hypoglykemie matky. Nevýhodou je menší účinnost, neboť u více než 40 % léčených žen bývá nutné přidání inzulinu.
Studie metformin vs inzulin
MiG studie (Metformin in gestational diabetes) je rozsáhlá randomizovaná kontrolovaná studie, které se zúčastnilo 751 těhotných ve 20. až 33. gestačním týdnu a mezi 18 a 45 lety věku s diagnózou gestačního diabetu. Ženy byly náhodně rozděleny do 2 skupin, z nichž studii dokončilo 363 léčených metforminem a 370 inzulinem. V metforminové skupině bylo dávkování zpočátku nastaveno na 500 mg 1–2krát denně a případně bylo pro dosažení dostatečné kompenzace navyšováno v 1týdenních až 2týdenních intervalech až do maximální denní dávky 2 500 mg. Pokud ani to nestačilo, byla přidána ještě inzulinová terapie. Inzulinová skupina měla nastavené režimy na základě obvyklé praxe.
Léčbu metforminem nedokončilo 27 žen a u 168 bylo nutné k léčbě přidat inzulin.
Výsledky studie ukázaly, že výskyt neonatálních komplikací je v obou skupinách srovnatelný (32,0 % u metforminu oproti 32,2 % u inzulinu). Porodní hmotnosti novorozenců byly nepatrně nižší v metforminové skupině (průměrně 3 372 g oproti 3 413 g), naopak průměrný týden porodu byl lehce vyšší u inzulinu (38,5 oproti 38,3 u metforminu).
U léčby metforminem byl zaznamenán nižší výskyt těhotenské hypertenze či preeklampsie. Vyskytlo se zde 14 případů těhotenské hypertenze a 20 případů preeklampsie. Ve skupině léčené inzulinem bylo zaznamenáno 23 žen s těhotenskou hypertenzí a 26 trpících preeklampsií. Těhotné užívající metformin měly také v průměru menší nárůst tělesné hmotnosti. Kompenzace diabetu byla u obou skupin srovnatelná. Důležitým údajem je také spokojenost pacientek, 76,6 % žen léčených metforminem udalo, že by si při dalším těhotenství vybraly stejnou léčbu. V inzulinové skupině takto odpovědělo pouze 27,2 % žen.
Nejčastějšími nežádoucími účinky léčby metforminem na matky byly v této studii gastrointestinální obtíže (u 32 žen), u inzulinu se tyto účinky nevyskytují. U novorozenců byly sledovány vrozené vady u 11 z metforminové skupiny a 18 z inzulinové, v inzulinové skupině došlo také v jednom případě k úmrtí plodu. U novorozenců matek na metforminu byl dále menší výskyt závažné (< 1,6 mmol/l) hypoglykemie [11].
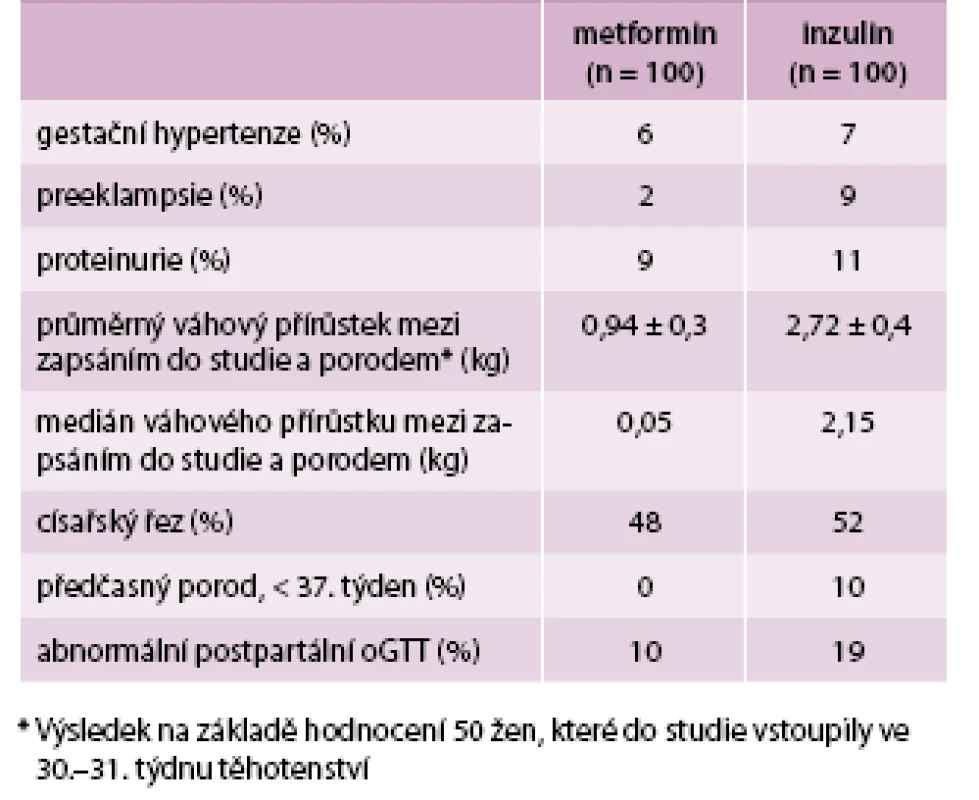
Další studie z roku 2009 [6] potvrzuje výsledky MiG a dále je rozvádí. I tentokrát byly porovnávány 2 skupiny, metformin oproti inzulinu, několik účastnic studii nedokončilo, a ve výsledku tak měly obě kontrolní skupiny počet 100 žen. Do studie byly zařazeny ženy, kterým byla v oGGT (75 g glukózy) provedeném ve 28. týdnu těhotenství naměřena hodnota glykemie ≥ 7,8 mmol/l. Dávkování metforminu bylo stejné jako ve studii MiG, začínalo se tedy na 500 mg denně a titrovalo se až do 2 500 mg denně. Medián dávky byl 1 500 mg za den. Ženy z obou skupin měly srovnatelný věk, BMI i etnicitu. U inzulinové skupiny byl nasazen intenzifikovaný režim (bazál-bolus).
Porovnávány byly jednak hodnoty mateřské jako váhový přírůstek a hypertenzní komplikace, dále pak fetální – perinatální úmrtnost, vrozené vývojové vady, dystokie ramének, prematurita, porodní hmotnost, novorozenecká žloutenka, hypoglykemie či RDS.
Ve skupině užívající metformin byl menší počet hypertenzních komplikací, menší váhový přírůstek a menší počet předčasně narozených dětí (tab. 1). Nejčastějším problémem v metforminové skupině byla i v této studii gastrointestinální intolerance, a to u 7 žen [6].
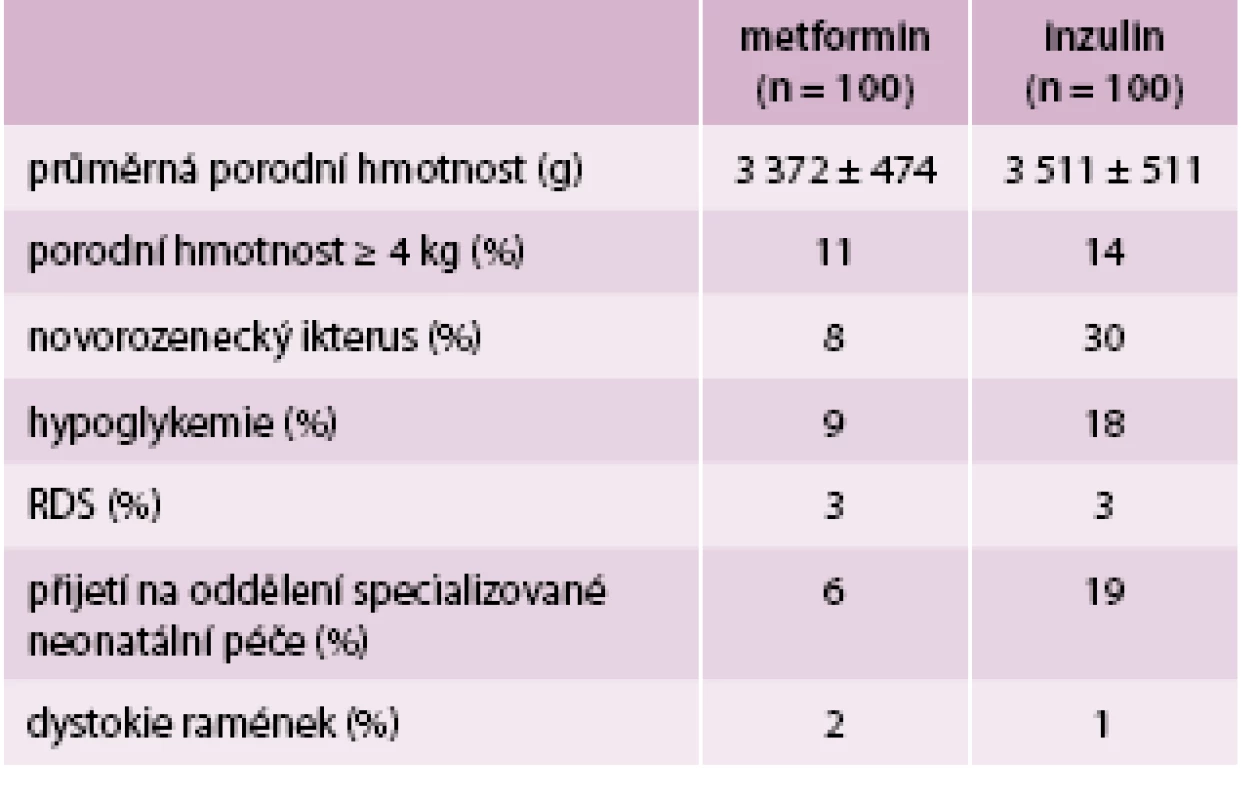
Ani v jedné skupině nedošlo k perinatálnímu úmrtí. Ve skupině metforminu byl pozorován menší výskyt novorozenecké žloutenky a hypoglykemie, menší počet přijetí na oddělení specializované neonatální péče a lehce nižší průměrná porodní hmotnost (tab. 2) [6].
Jak již bylo řečeno, pro diabetičky je typická makrosomie plodu. Příčina pravděpodobně tkví v nadbytečném přísunu nutrientů, nasycení jímací schopnosti podkožních tukových buněk, rozvoji leptinové a inzulinové rezistence, a tedy ektopickému ukládání tuků [10]. V randomizované studii MiG TOFU (Metformin in gestational diabetes: the offspring follow-up) [5] byly porovnávány 2leté děti matek, které v těhotenství užívaly metformin či inzulin. Do studie bylo zařazeno 154 dětí, jejichž matky užívaly v těhotenství metformin, a 164 dětí, jejichž matky byly léčeny inzulinem. Děti byly podrobeny několika vyšetřovacím metodám – antropometrickému měření, bioimpedanci a duální rentgenové absorpciometrii (DEXA – dual-energy X-ray absorptiometry).
Celkové procento tělesného tuku a hmotnost dětí byly v obou kontrolních skupinách srovnatelné. Skupiny se však lišily distribucí tuku. Ve skupině s metforminem byly oproti inzulinu naměřeny větší obvody paže (17,2 ± 1,5 vs 16,7 ± 1,5 cm), subskapulární (6,3 ± 1,9 vs 6,0 ± 1,7 mm) a bicepsová kožní řasa (6,03 ± 1,9 vs 5,6 ± 1,7 mm) [5]. Tyto výsledky naznačují, že při srovnatelném procentu tělesného tuku a hmotnosti měly děti matek užívajících metformin větší podíl subkutánní tukové tkáně než viscreální ve srovnání s dětmi matek léčených inzulinem. Viscerální tuková tkáň je spojena s rizikem rozvoje inzulinové rezistence [5].
Závěr
Užívání metforminu během těhotenství vzbuzovalo dlouhá léta obavy. Nejnovější studie, které byly provedeny na větších skupinách těhotných diabetiček, však ukazují, že jeho bezpečnost je naprosto srovnatelná s inzulinovou terapií. Léčba metforminem má řadu výhod. Je méně finančně nákladná a nevyžaduje injekční podávání, je tedy pro pacientky tak jako každá perorální forma pohodlnější a přináší větší komplianci pacientek [6]. Z těchto a dalších výše uvedených důvodů přestavuje metformin vhodnou alternativu k inzulinu, nicméně dlouhodobý efekt jeho podávání v těhotenství na zdraví matek a dětí je předmětem dalšího zkoumání [1].
Doručeno do redakce 8. 3. 2015
Přijato po recenzi 26. 3. 2015
MUC. Jan Přáda
MUDr. Kateřina Anderlová, Ph.D.
katerina.anderlova@vfn.cz
Gynekologicko-porodnická klinika 1. LF UK a VFN Praha
www. gynpo.lf1.cuni.cz
Sources
1. Kavitha N, De S, Kanagasabai S. Oral Hypoglycemic Agents in pregnancy: An Update. J Obstet Gynecol India 2013; 63(2): 82–87.
2. Centers for Disease Control and Prevention. National diabetes fact sheet: national estimates and general information on diabetes and prediabetes in the United States, 2011. Atlanta, GA: U.S. Department of Health and Human Services, Centers for Disease Control and Prevention, 2011. Dostupné z WWW: <http://www.cdc.gov/diabetes/pubs/pdf/ndfs_2011.pdf>.
3. Gui J, Liu Q, Feng L. Metformin vs Insulin in the Management of Gestational Diabetes: A Meta-Analysis. PLoS One 2013; 8(5): e64585. Dostupné z DOI: <http://doi: 10.1371/journal.pone.0064585>.
4. Eyal S et al. Pharmacokinetics of metformin during pregnancy. Drug Metab Dispos 2010; 38(5): 833–840.
5. Rowan JA, Rush EC, Obolonkin V et al. Metformin in gestational diabetes: the offspring follow-up (MiG TOFU). Body composition at 2 years of age. Diabetes Care 2011; 34(10): 2279–2284.
6. Balani J, Hyer SL, Rodin DA et al. Pregnancy outcomes in women with gestational diabetes treated with metformin or insulin: a case–control study. Diabet Med 2009; 26(8): 798–802
7. Metzger BE, Gabbe SG, Persson B et al. International association of diabetes and pregnancy study groups recommendations on the diagnosis and classification of hyperglycemia in pregnancy. Diabetes Care 2010; 33(3): 676–682.
8. Ryu RJ, Hays KE, Hebert MF. Gestational diabetes mellitus management with oral hypoglycemic agents. Semin Perinatol 2014; 38(8): 508–515.
9. Lautatzis ME, Goulis DG, Vrontakis M. Efficacy and safety of metformin during pregnancy in women with gestational diabetes mellitus or polycystic ovary syndrome: a systematic review. Metabolism 2013; 62(11): 1522–1534.
10. Ali AT, Ferris WF, Naran NH et al. Insulin resistance in the control of body fat distribution: a new hypothesis. Horm Metab Res 2011; 43(2): 77–80.
11. Rowan JA, Hague WM, Gao W et al. MiG Trial Investigators. Metformin versus insulin for the treatment of gestational diabetes. N Engl J Med 2008, 358(19): 2003–2015
12. Gilligan M. Metformin and vitamin B12 deficiency. Arch Intern Med 2002; 162(4): 484–485
13. Stang M, Wysowski DK, Butler-Jones D. Incidence of lactic acidosis in metformin users. Diabetes Care 1999, 22(6): 925–927.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inPractical Gynecology

2015 Issue 1-
All articles in this issue
- New classification of breast tumors and lesions, their hormonal sensitivity a and our possibilities of prevention
- Breast reconstruction after mastectomy
- Long-term follow-up of breast cancer patients after treatment
- Relation of quality of life and a type of treatment in women with breast carcinoma: A pilot study
- Reccurent melanoma of the vulva: case report
- Adenocarcinoma in situ of the uterine cervix –10-year series
- Neglect of prevention of oncogynecological diseases in homeless women
- Role of D-mannose in the treatment and prevention of urinary infections
- Management of deliveries after caesarean section in Český Krumlov Hospital
- How to properly classify female sexual dysfunctions?
- Specific characteristics of antenatal care in women from selected minorities
- Specifics of the intensive nursing care in women with HELLP-syndrome: case report
- Metformin and pregnancy
- Tomáš Fait, Michal Zikán, Jaromír Mašata et al. Moderní farmakoterapie v gynekologii a porodnictví
- Zdeněk Hájek, Evžen Čech, Karel Maršál et al. Porodnictví
- Eva Kašáková, Martin Vokurka, Jan Hugo. Výkladový slovník pro zdravotní sestry
- Editorial
- Talks with Laura this time with associated professor M. Zikán
- Practical Gynecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- New classification of breast tumors and lesions, their hormonal sensitivity a and our possibilities of prevention
- Metformin and pregnancy
- Role of D-mannose in the treatment and prevention of urinary infections
- Adenocarcinoma in situ of the uterine cervix –10-year series
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career