-
Medical journals
- Career
Hyponatremie u dětí: od patofyziologie k léčbě
Authors: MUDr. Ph.D. Jakub Zieg
Authors‘ workplace: Pediatrická klinika 2. LF UK a FN Motol
Published in: Čas. Lék. čes. 2016; 155: 145-150
Category: Review Article
Overview
Tento přehledový článek se zabývá příčinami, diagnostikou a léčbou stavů spojených s hyponatremií v dětském věku. K nadbytku volné vody a/nebo ztrátám natria může dojít z různých příčin, tudíž je pro správnou diagnostiku nezbytné pečlivě odebrat anamnézu, provést fyzikální a základní laboratorní vyšetření. Symptomatická hyponatremie může dítě přímo ohrožovat na životě, a proto vyžaduje rychlou a intenzivní léčbu. Nevhodně zvolená terapie může mít pro pacienta fatální následky.
Klíčová slova:
hyponatremie, děti, hyponatremická encefalopatie, syndrom inadekvátní sekrece antidiuretického hormonu, syndrom solných ztrátÚvod
Hyponatremie je definována jako koncentrace sérového natria < 135 mmol/l. U dětí je nejčastěji způsobena nadbytkem antidiuretického hormonu (ADH) při současně zvýšeném příjmu bezsolutové vody. Zásadní úkol lékaře spočívá v odlišení stavů vyvolaných nadbytečným příjmem vody od onemocnění spojených se ztrátami sodíku.
Ledviny jsou nejdůležitějším regulačním orgánem homeostázy natria, jehož přesuny mezi tělními kompartmenty velmi významně ovlivňují hospodaření s vodou. Sodík je hlavním extracelulárním kationtem, jeho koncentrace se v krvi udržuje v úzkém fyziologickém rozmezí řadou regulačních mechanismů. Od správného rozpoznání etiologie hyponatremie se poté odvíjí další přístup k nemocnému. Závažnou komplikací hyponatremie je rozvoj hyponatremické encefalopatie (HE) s velmi nespecifickými příznaky, jejíž nerozpoznání může vést k trvalým následkům a v nejhorším případě i k úmrtí dítěte.
Fyziologie vodního hospodářství
Voda tvoří asi 60 % hmotnosti lidského těla, u novorozenců a kojenců je její zastoupení vyšší − až 75 %. Dvě třetiny objemu celkové tělesné vody jsou zastoupeny v intracelulárním prostoru, zbylá třetina se nachází v extracelulárním kompartmentu. Ledviny dospělého jedince s glomerulární filtrací (GFR) 100 ml/min/1,73m2 vyprodukují denně 144 litrů primární moči. Průměrná koncentrace natria v séru je 140 mmol/l, primární filtrát tedy obsahuje více než 20 000 mmol sodíku. V proximálním tubulu, nejdelším segmentu nefronu, se reabsorbuje 65−70 % sodíkových iontů spolu s molekulami vody. Dále je asi 25 % sodíkových iontů aktivně vstřebáváno cestou Na-K-2Cl kotransportéru na apikální membráně tlusté části ascendentního raménka Henleovy kličky a 5 % sodíkových iontů se reabsorbuje přes NaCl kotransportér v distálním tubulu. Nakonec ve sběrném kanálku dochází k přesunu sodíkových iontů z lumen tubulu intracelulárně cestou epitelového sodíkového kanálu (ENaC).
Osmolalita moči se u zdravého jedince pohybuje mezi 50 a 1200 mmol/kg, diuréza může být poté v závislosti na příjmu tekutin u dospělých v rozmezí 500 ml až 20 l za den. U dětí se normální diuréza pohybuje od 0,5 do 3 ml/kg/hod. V případě novorozenců a kojenců považujeme za oligurii objem vylučované moči < 1 ml/kg/hod. Schopnost koncentrovat moč je daná adekvátní produkcí a uvolňováním ADH do krevního oběhu a účinky tohoto hormonu ve sběrném kanálku ledviny. ADH je produkován v paranukleárním a supraoptickém jádru hypotalamu ve formě preprohormonu, cestou nervových výběžků se dostává do neurohypofýzy, kde je ukládán, a v případě potřeby se uvolňuje do cirkulace. Hlavní účinek ADH je zprostředkován receptory lokalizovanými na bazolaterální straně epitelových buněk sběrného kanálku. Následkem navázání ADH na receptory V2 dochází k začlenění akvaporinových kanálů do apikální membrány těchto buněk. Již malé změny sérové osmolality (1−2 %) mají vliv na uvolnění ADH. Pocit žízně se objevuje až ve druhé fázi, pokud osmolalita séra nadále stoupá.
V oblasti hypotalamu jsou specializované neurony (centrální osmoreceptory) reagující na vzestup osmolality snížením buněčného objemu. Tento proces vede k depolarizaci, která je stimulem pro excitaci buněčné membrány osmoreceptorů a následně způsobí aferentní přenos signálu do hypotalamu. Na základě současných poznatků se tedy lze domnívat, že tyto neurony mají povahu mechanoreceptorů. Humánními i animálními studiemi byla potvrzena rovněž existence periferních osmoreceptorů v horní části zažívacího traktu a ve stěně cév odvádějících krev ze střev. Tyto receptory jsou schopné analyzovat osmolalitu tekutin, což vysvětluje rychlé uspokojení pocitu žízně záhy po příjmu tekutin, tedy ještě dříve, než dojde ke změně osmolality séra. K uvolnění ADH do krevního oběhu vede i řada neosmogenních stimulů, jako jsou hypotenze, hypovolemie, nauzea a nedostatek glukokortikoidů.
Baroreceptory jsou dalšími senzory, jež se účastní metabolismu natria a vody. Vysokotlaké receptory se nacházejí ve stěně velkých cév (oblouk aorty, sinus caroticus). Nízkotlaké receptory se vyskytují ve stěně žil velkého oběhu i plicních žil a v srdečních síních. Jedná se o mechanoreceptory, které detekují tlakové změny v cévním systému a nepřímo tak podávají informaci o intravaskulárním objemu tekutin. Pokles cirkulujícího objemu způsobí cestou baroreceptorů a jejich aferentních nervových podnětů zvýšení sekrece ADH. Naopak zvýšený cirkulující objem vede ke snížení sekrece ADH. Při poklesu krevního tlaku navíc na základě signálů z baroreceptorů dochází také k aktivaci sympatického systému a tím ke zvýšení srdečního výdeje a periferní cévní rezistence, což vede k udržení dobré perfuze vnitřních orgánů. Další baroreceptory, které však pracují nezávisle na centrální nervové soustavě, jsou lokalizovány v aferentní arteriole nefronu. Tyto receptory detekují tlak ve stěně cévy a při jeho poklesu přímo stimulují sekreci reninu. Následně se aktivuje osa renin − angiotenzin − aldosteron s cílem zabránit poklesu krevního tlaku a udržet v těle sodíkové ionty.
Regulace sekrece ADH je tedy ovlivňována osmoreceptory i baroreceptory. Při významném poklesu cirkulujícího objemu se baroreceptory stávají hlavním regulátorem sekrece ADH, jejich stimulace tak vede ke zvýšené sekreci ADH bez ohledu na informace z osmoreceptorů (1).
Diagnostika hyponatremie
Základním úkolem pediatra je odlišit stavy se zvýšenou produkcí ADH, které bývají obvykle potencovány zvýšeným příjmem vody, od vzácněji se vyskytujících onemocnění spojených se ztrátami sodíkových iontů (2). Při hodnocení sérové koncentrace natria je vhodné stanovit současně také osmolalitu séra, abychom vyloučili translokační hyponatremii, kterou charakterizuje hyperosmolární hyponatremie, při níž dochází ke zmnožení extracelulární tekutiny v důsledku přítomnosti osmolárně aktivní látky nepřecházející volně přes buněčnou membránu. Typickým příkladem osmolárně aktivní látky je glukóza, a proto hyperglykemie v případě diabetické ketoacidózy vede ke vzniku hyponatremie (3). Dalšími osmoticky aktivními látkami schopnými navodit translokační hyponatremii jsou např. manitol, glycerol, glycin a kontrastní látky.
Při hodnocení laboratorních parametrů se můžeme setkat také s tzv. pseudohyponatremií, charakterizovanou izoosmolární hyponatremií. Tento nález je typický při stanovení sérové hladiny natria metodou plamenově emisní spektrofotometrie či pomocí iontově neselektivních elektrod, kdy dochází při vysoké koncentraci bílkovin či lipidů ke snížení vodní frakce plazmy a následně pak zjišťujeme falešně nízké hladiny sérového natria. Při užití přímých iontově selektivních elektrod se pseudohyponatremie nevyskytuje (4).
Prvním krokem v diagnostice hyponatremie je pečlivě odebraná anamnéza. Soustředíme se na základní onemocnění dítěte, zhodnocení váhy a bilance tekutin. Zajímá nás objem a složení tekutin přijímaných per os, eventuálně složení infuzí či parenterální výživy a dále ztráty natria (stolicí, nazogastrickou sondou, stomií či nadměrným pocením). Velký důraz klademe na farmakologickou anamnézu, hlavně užívání diuretik bývá spojeno s výskytem hyponatremie. Jiná léčiva zase mohou vést ke vzniku syndromu neadekvátní sekrece antidiuretického hormonu (SIADH).
Druhým krokem je fyzikální vyšetření se zaměřením na posouzení hydratace nemocného. Typickými klinickými známkami hypovolemie jsou oschlé sliznice, tachykardie, hypotenze a vpadlá velká fontanela u kojenců. Naopak pacienti hypervolemičtí obvykle mívají otoky, hypertenzi a zvýšenou náplň jugulárních žil. Určení míry hydratace může být obtížné, u některých nemocných nám pomůže změření centrálního žilního tlaku, nicméně jednoduchá přesná vyšetření nemáme k dispozici.
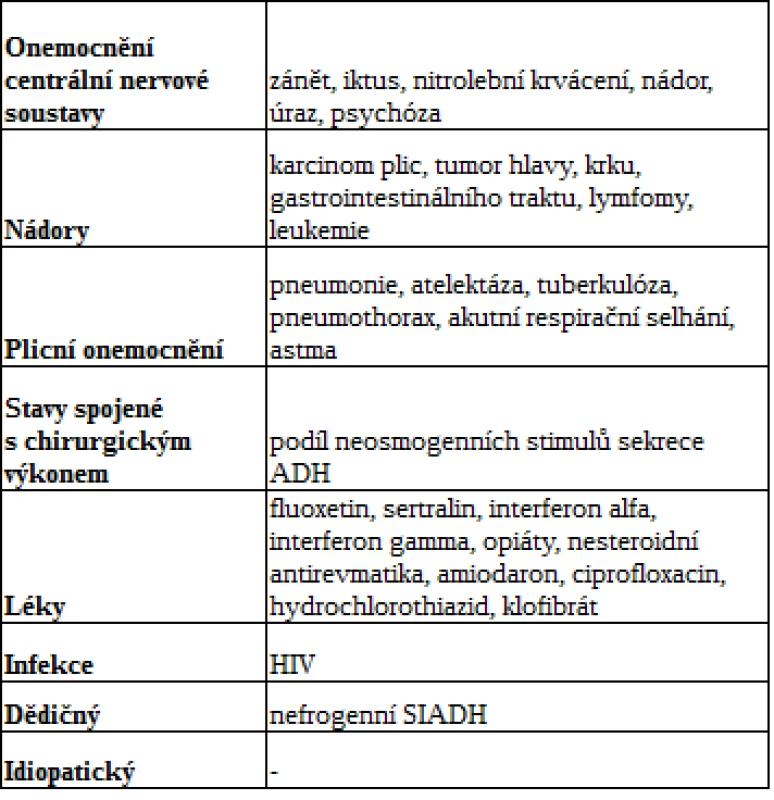
Dalším krokem v diagnostice hyponatremie je provedení základního laboratorního vyšetření, kdy stanovujeme sérové i močové koncentrace Na, K, kreatininu, kyseliny močové a osmolalitu ze vzorku krve i moči. Vyšetření glykemie slouží k vyloučení translokační hyponatremie. Na základě laboratorních výsledků vypočítáme hodnotu exkreční frakce natria (EFNa) podle vzorce (viz obr. 1).
Image 1. Výpočet exkreční frakce natria 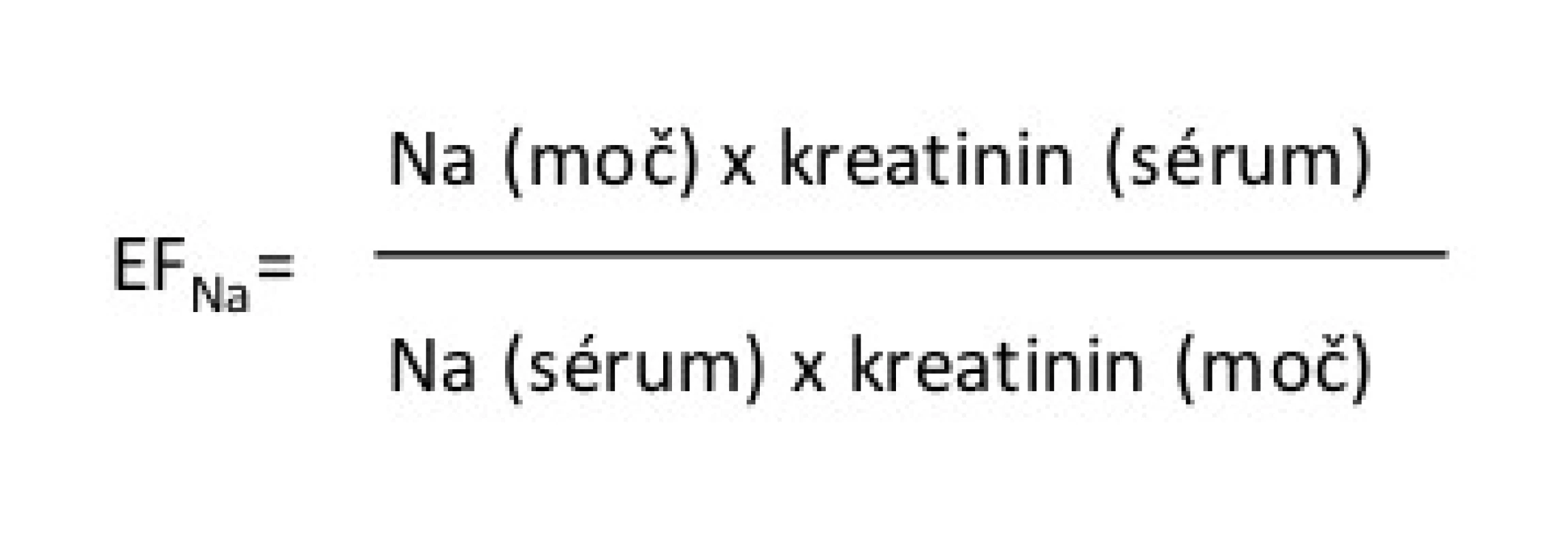
Pozn.: Na (sérum), Na (moč), kreatinin (moč) udáváme v mmol/l, kreatinin (sérum) v µmol/l. Hodnota EFNa vypovídá o tom, jaká část z profiltrovaného natria se dostává do definitivní moči. Výpočet EFNa nám spolu s informací o stavu hydratace pacienta umožňuje udělat základní diferenciálně diagnostickou rozvahu (5). Diagnostický postup u hyponatremie ukazuje obr. 2
Image 2. Diferenciální diagnostika hyponatremie u dětí 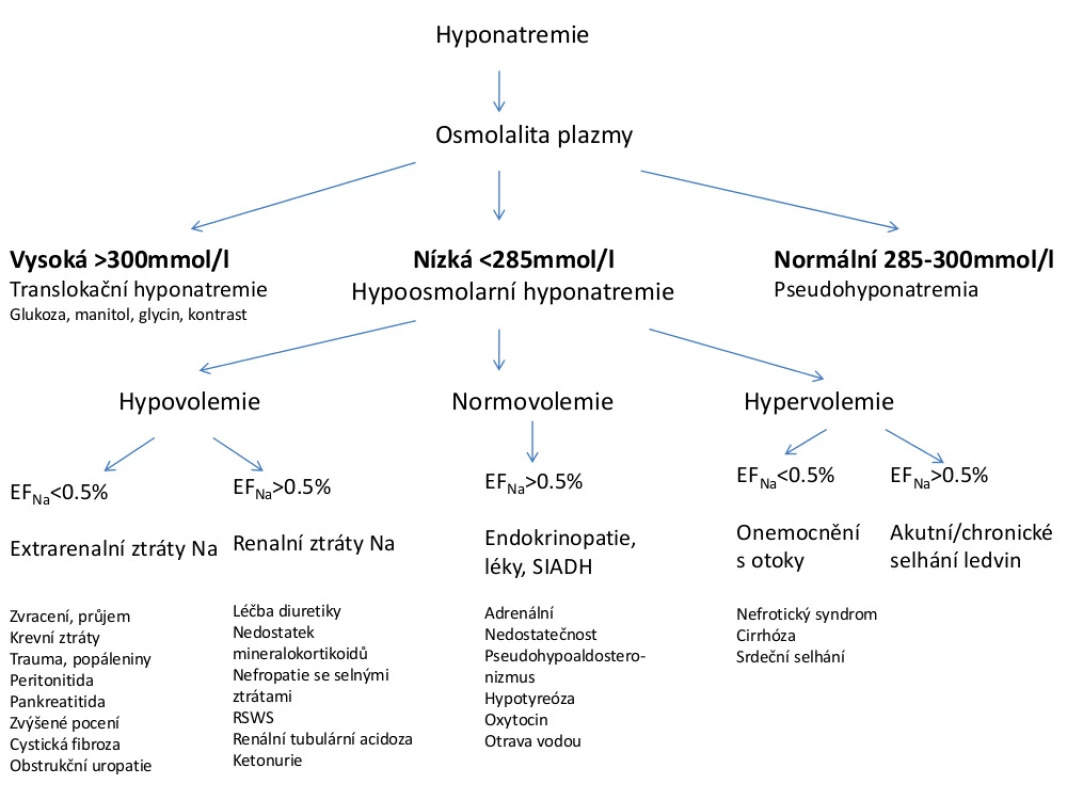
Pozn.: EFNa − exkreční frakce natria Hypovolemická hyponatremie s nízkou EFNa (< 0,5 %) je charakteristická pro stavy spojené s extrarenálními ztrátami natria. Nejčastější příčinou jsou akutní gastroenteritidy, dále traumata, popáleniny a krvácení. Pro udržení objemu extracelulární tekutiny tělo kompenzuje ztráty tekutin a sodíku zvýšenou tubulární reabsorpcí natria v ledvinách a sekrecí ADH. Hyponatremii spolu s hypovolemií a vyšší EFNa (> 0,5 %) zjišťujeme u děti léčených diuretiky, u jedinců s nedostatkem mineralokortikoidů a u pacientů s onemocněním ledvin se solnými ztrátami − nefropatiemi (např. intersticiální nefritidy) a syndromem solných ztrát (RSWS − renal salt wasting syndrome).
Euvolemická hyponatremie s vyšší EFNa je typická pro děti intoxikované vodou, u nemocných se syndromem neadekvátní sekrece antidiuretického hormonu (SIADH), dále u dětí s adrenální insuficiencí, hypotyreózou a u jedinců léčených oxytocinem (2).
Další skupinu tvoří hypervolemičtí pacienti s hyponatremií − děti s nefrotickým syndromem, jaterní cirhózou a srdečním selháním, u nichž dochází k retenci tekutin na podkladě rezistence ledvin k účinkům atriálního natriuretického peptidu a dále ke zvýšené sekreci ADH vlivem neosmotických podnětů při sníženém intravaskulárním objemu. Pro tyto jedince je charakteristická nízká EFNa spolu s nálezem otoků při fyzikálním vyšetření (6). Setkáváme se rovněž s hypervolemickými pacienty s vyšší EFNa, kteří jsou obvykle postiženi akutním či chronickým onemocněním ledvin.
Hyponatremická encefalopatie
Mezi nejzávažnější komplikace hyponatremie patří vznik hyponatremické encefalopatie (HE). Snížení sérové koncentrace natria vede k přesunu extracelulární tekutiny do buněk a tím dochází k rozvoji edému mozku. HE častěji postihuje mladé fertilní dívky, u nichž estrogeny ovlivňují volumovou regulaci mozkových buněk a navíc potencují vazokonstrikční účinek ADH. Obecně je riziko vzniku HE vyšší u dětí, jelikož mají vyšší poměr velikosti objemu mozku k intrakraniálnímu prostoru a při stavech s edémem mozku tím pádem méně prostoru pro expanzi tkáně. Proto jsou právě děti náchylnější ke vzniku mozkového konu. Dalším rizikovým faktorem vzniku HE je také hypoxie zhoršující adaptační schopnosti mozkové tkáně na hyponatremii.
Klinické příznaky HE jsou nespecifické: nauzea, zvracení, bolest hlavy, křeče, v závažných případech zástava dechu. U pacientů se symptomatickou hyponatremií může být hypoxie způsobena vznikem nekardiogenního plicního edému, jenž dále zhoršuje adaptaci mozku na hyponatremii. Předpokládá se, že edém mozku při HE vede ke zvýšené permeabilitě cév pro bílkoviny v plicním řečišti. Zvýšený sympatický tonus a uvolnění katecholaminů způsobí vazokonstrikci těchto cév a tím zvýšení hydrostatického tlaku. Tento mechanismus byl popsán poměrně nedávno a onemocnění se označuje jako Ayusův-Arieffův syndrom (7).
Mezi další příčiny nekardiogenního plicního edému u dětí patří stavy se snížením onkotického tlaku plazmy nebo intersticiálního tlaku, onemocnění spojená s poruchou lymfatické drenáže, akutní syndrom dechové tísně, hyperhydratace vedoucí ke zvýšení hydrostatického tlaku plicních kapilár a polékový plicní edém.
Intoxikace vodou
Nepřiměřený příjem bezsolutové vody vede k intoxikaci vodou, jež podmiňuje vznik diluční hyponatremie. U malých dětí dochází nejčastěji k otravě vodou, podává-li se zředěné umělé mléko. K příjmu nadbytečného množství vody může docházet i u nemocných trpících psychogenní polydipsií − návykovým pitím (8−10). Příčinou vzniku HE může být rovněž intoxikace vodou u dětí s primární enurézou v souvislosti s užíváním desmopresinu, analogu antidiuretického hormonu, který podmiňuje zadržování vody v organismu, a tím diluci extracelulární tekutiny (11). Jsou také známy případy vzniku HE v důsledku volního přijímání velkého objemu vody v rámci dětských her. V nemocničním prostředí může k intoxikaci vodou docházet při rehydrataci pacientů nízkoosmolárními roztoky.
Problém nastává zejména tehdy, je-li stav potencován aktivací sekrece ADH neosmogenními stimuly, jako jsou nauzea a bolest u dětí po operačním výkonech. V laboratoři nacházíme zvýšenou FENa spolu s nízkou osmolalitou moči. Je tomu to tak proto, že při nadbytku volné vody se ledviny snaží vylučovat natrium s cílem docílit znovu euvolemie. Tudíž vyšší koncentrace sodíku v moči nemusí být nezbytně známkou primární solné ztráty.
Extáze
Extáze (3,4-methylendioxy-N-methylamfetamin) patří mezi uměle připravované drogy. Jedná se o amfetamin, jenž má celkové stimulační účinky, navozuje pocity euforie, štěstí, uživatel obvykle nepociťuje únavu. Nejčastěji tuto drogu zneužívají adolescenti během tanečních zábav.
Jedním z hlavních nežádoucích účinků užívání extáze je právě HE, k jejímuž vyvolání v těchto případech přispívají hyperpyrexie, vysoký příjem tekutin a neadekvátní sekrece ADH vyvolaná metabolity extáze − dopaminem a serotoninem (12). V současnosti je v literatuře uvedeno více než 10 případů HE s fatálním koncem u uživatelů extáze, většinou se jedná o mladé dívky.
Maratonští běžci
Vytrvalostní sport může také vést ke vzniku hyponatremie a HE. Tato komplikace je v literatuře uvedena hlavně u maratonských běžců, kteří přijímají značné množství tekutin a zvýšeným pocením u nich dochází k významným ztrátám tekutin a natria, což může vést k rozvoji hyponatremie se všemi důsledky. V literatuře je rovněž popsáno několik fatálních případů vytrvalostních sportovců s HE a manifestací nekardiogenního plicního edému v rámci Ayusova-Arieffova syndromu (13).
SIADH a RSWS
Častou příčinou hyponatremie v dětském věku je SIADH, charakterizovaný hyponatremií a poruchou exkrece volné vody u euvolemického, případně hypervolemického pacienta s hyponatremií bez primárního onemocnění ledvin. SIADH vzniká u dětí s onemocněním centrální nervové soustavy, respiračního systému, dále u pacientů s malignitami, případně může být podmíněn užíváním některých léků. V posledních letech byla popsána i genetická forma podmíněná aktivační mutací receptoru V2. Nejčastější příčiny SIADH shrnuje tab. 1. Euvolemická hyponatremie u dětí se SIADH je podmíněná sníženou sekrecí aldosteronu spolu s vyšší produkcí atriálního natriuretického peptidu. V rámci diagnostiky SIADH je třeba vyloučit postižení štítné žlázy a nadledvin (14).
RSWS je na rozdíl od SIADH onemocnění spojené s hypovolemií. Za příčinu RSWS se považuje defekt v reabsorpci natria v proximálním tubulu, což vede ke snížení efektivního cirkulujícího objemu (15). Aktivace baroreceptorů indukuje sekreci ADH a tím retenci vody.
Vzhledem k tomu, že je často obtížné s jistotou odlišit SIADH od RSWS pouze na základě anamnézy a fyzikálního vyšetření, se řada studií zabývá i biochemickými parametry. Několik prací již prokázalo přítomnost vyšší exkreční frakce kyseliny močové (EFKM) u dospělých pacientů se SIADH i RSWS. Klinické pozorování uskutečněné na malém počtu dospělých pacientů ukázalo, že na rozdíl od nemocných s RSWS (16, 17) dochází u jedinců se SIADH po korekci hyponatremie k normalizaci EFKM. K potvrzení těchto závěrů je však zapotřebí provést studie u dětí. Základní charakteristiky SIADH a RSWS jsou uvedeny v tab. 2.
Table 2. Klinické a laboratorní parametry SIADH a RSWS 
Pozn.: EFNa − exkreční frakce natria, PRA − plazmatická reninová aktivita Léčba hyponatremie
Léčba hyponatremie se odvíjí od závažnosti stavu a dále se řídí etiologií základního onemocnění. Pokud se jedná o pacienta se symptomatickou HE, musíme volit rychlou a účinnou terapii. V tomto případě má léčba HE přednost před kompletní diagnostikou (např. doplněním zobrazení mozku).
Při léčbě dětí se symptomatickou hyponatremií má zásadní význam podání hypertonického roztoku. Ideální je použití 3% NaCl obsahujícího 513 mmol/l natria v dávce 2 mmol/kg ve formě 10 minutové infuze. Maximální jednorázová dávka činí 100 ml. Tento bolus NaCl lze opakovat, pokud příznaky HE přetrvávají. Přibližně 3% roztok NaCl v našich podmínkách nejlépe připravíme zředěním 5,85% roztoku NaCl 5% glukózou v poměru 1 : 1. Hladina sérového natria může v prvních 1−2 hodinách stoupnout až o 4−6 mmol (18), celkový vzestup natremie ale nesmí překročit 10−15 mmol/24 hod a 20 mmol/48 hod. Při překročení těchto limitů můžeme ke snížení natremie podat roztok čisté glukózy případně desmopresin.
Rychlejší korekce hyponatremie může vést k rozvoji pontinní i extrapontinní demyelinizace, jež zprvu nemusí být symptomatická, ale v některých případech bývá spojována se závažným dlouhodobým neurologickým postižením (19). Vyskytuje se častěji u pacientů s chronickou hyponatremií a u jedinců s přidruženým interním onemocněním.
Terapii symptomatické hyponatremie lze s výhodou rozšířit o podání kličkového diuretika ke zvýšení exkrece volné vody. Naprosto odlišná je však léčba asymptomatické hyponatremie, kdy je třeba primárně odlišit stavy s nadbytkem volné vody od onemocnění spojených se ztrátami natria. Při nadbytku bezsolutové vody je na místě restrikce tekutin, solné ztráty je nutno hradit. Podání hypertonického roztoku NaCl není v těchto případech indikováno. U dětí s hyponatremií se dále doporučuje korigovat případnou hypokalemii, jelikož nižší intracelulární koncentrace kalia může přispívat k přesunu sodíkových iontů do buňky.
U pacientů s pravděpodobným deficitem natria lze použít jednoduchou rovnici k odhadu substituce natria (viz obr. 3).
Image 3. Odhad deficitu natria 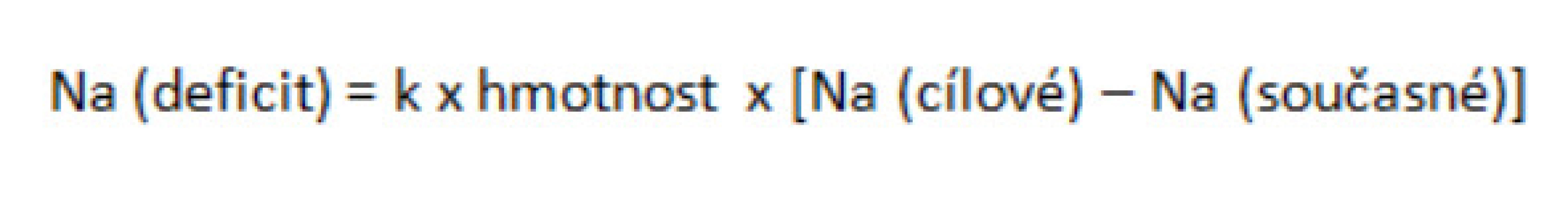
Pozn.: Na udáváme v mmol/l, hmotnost v kg. Konstanta k × hmotnost určuje zastoupení vody v těle. U dětí je k = 0,6, u novorozenců 0,75. Tato rovnice slouží pouze k odhadu potřeby natria při zahájení léčby, nezahrnuje izotonické ztráty tekutin ani možné změny sekrece ADH během substituce ztrát, proto se hodnoty natremie musejí během korekce opakovaně vyšetřovat a léčba případně upravovat. U hyponatremických pacientů s přebytkem volné vody můžeme následujícím výpočtem určit objem vody, který je nutno redukovat (viz obr. 4).
Image 4. Výpočet objemu přebytečné vody 
Pozn.: Objem udáváme v litrech, Na v mmol/l, k je u dětí rovna 0,6, u novorozenců 0,75. Tato rovnice platí v případě, že se v průběhu léčby nemění insenzibilní ztráta vody ani diuréza pacienta. U dětí se SIADH máme k dispozici několik léčebných možností. V určitých případech lze terapeuticky ovlivnit primární příčinu rozvoje SIADH. Restrikce tekutin je vhodná u asymptomatických pacientů s nižší osmolalitou moči (20). Symptomatičtí pacienti mají být léčeni hyperosmolárním roztokem NaCl, eventuálně spolu s furosemidem. V některých zemích se k terapii SIADH používá také perorální urea navozující osmotickou diurézu a tím exkreci volné vody.
Lékem volby euvolemické a hypervolemické hyponatremie u dospělých pacientů jsou vaptany − antagonisté V2 receptorů (21). Jejich podávání vede k exkreci volné vody. Doposud však nebyly provedeny potřebné studie u dětí, a proto je jejich využití v pediatrii zatím velmi limitované.
Terapie RSWS spočívá v substituci natria, při významných ztrátách se spíše vzácně nasazuje fludrokortison. Odlišení od RSWS od SIADH má zásadní význam pro volbu správné terapie, neboť restrikce tekutin by u dětí s RSWS vedla k dalšímu prohloubení hypovolemie (22).
Závěr
Pro efektivní léčbu dětí s hyponatremií je nutné určit její příčinu. V diagnostice se zaměřujeme na pečlivou anamnézu, fyzikální vyšetření a provádíme základní laboratorní testy. Rozvoj HE, projevující se velmi nespecifickými symptomy, představuje nejzávažnější komplikaci hyponatremie.
Léčba symptomatické hyponatremie musí být včasná, podáváme hypertonický roztok, případně spolu s kličkovými diuretiky. Vaptany, tj. léky zvyšující exkreci volné vody, jsou indikované u pacientů s euvolemickou a hypervolemickou hyponatremií, nicméně studie prokazující jejich efekt u dětí teprve očekáváme.
Rozlišení SIADH od RSWS má zásadní význam pro další léčbu, špatně zvolený terapeutický postup může pacienta ohrozit. Díky pokrokům v molekulární genetice je již možno diagnostikovat i dědičně podmíněné příčiny SIADH.
Seznam zkratek
ADH antidiuretický hormon
EF exkreční frakce
GFR glomerulární filtrace
HE hyponatremická encefalopatie
RSWS syndrom solných ztrát
SIADH syndrom neadekvátní sekrece antidiuretického hormonu
Korespondenční adresa
MUDr. Jakub Zieg, Ph.D.
Pediatrická klinika 2. lékařské fakulty UK a Fakultní nemocnice Motol
V Úvalu 84
150 06 Praha 5
Tel.: 224 432 001
e-mail: jakubzieg@hotmail.com
Sources
1. Danziger J, Zeidel M, Parker MJ. Renal Physiology: A Clinical Approach. Wolters Kluwer/Lippincott Williams & Wilkins, Philadelphia, 2012 : 139–155.
2. Moritz ML, Ayus JC. Disorders of water metabolism in children: hyponatremia and hypernatremia. Pediatr Rev 2002; 23 : 371–380.
3. Spasovski G, Vanholder R, Allolio B et al. Clinical practice guideline on diagnosis and treatment of hyponatraemia. Eur J Endocrinol 2014; 170: G1–G47.
4. Aw TC, Kiechle FL. Pseudohyponatremia. Am J Emerg Med 1985; 3 : 236–239.
5. Zieg J. Evaluation and management of hyponatraemia in children. Acta Paediatr 2014; 103(10): 1027–1034.
6. Schrier RW, Arroyo V, Bernardi M et al. Peripheral arterial vasodilation hypothesis: a proposal for the initiation of renal sodium and water retention in cirrhosis. Hepatology 1988; 8 : 1151–1157.
7. McClellan MD, Dauber IM, Weil JV. Elevated intracranial pressure increases pulmonary vascular permeability to protein. J Appl Physiol 1989; 67 : 1185–1191.
8. Štarha J, Dostálková D, Štěpánková D, Doležel Z. Intoxikace vodou u malých dětí způsobená nadměrným příjmem hypotonických tekutin. Česko-slovenská pediatrie 2003; 58(2): 73–75.
9. Skalická V, Bláhová K, Janda J. Psychogenní polydipsie u batolete na podkladě návykového pití přeslazeného čaje. Praktický lékař 1999; 79(5): 268–269.
10. Zieg J, Glombová M. Psychiatric disorders are associated with increased risk for developing hyponatraemia in children. J Pediatr Endocrinol Metab 2015; 28 : 1195–1196.
11. Lebl J, Kolská M, Zavacká A et al. Cerebral oedema in enuretic children during low-dose desmopressin treatment: a preventable complication. Eur J Pediatr 2001; 160 : 159–162.
12. Parrott AC. MDMA and temperature: a review of the thermal effects of 'Ecstasy' in humans. Drug Alcohol Depend 2012; 121 : 1–9.
13. Ayus JC, Varon J, Arieff AI. Hyponatremia, cerebral edema, and noncardiogenic pulmonary edema in marathon runners. Ann Intern Med 2000; 132 : 711–714.
14. Bartter FC, Schwartz WB. The syndrome of inappropriate secretion of antidiuretic hormone. Am J Med 1967; 42 : 790–806.
15. von Bismarck P, Ankermann T, Eggert P et al. Diagnosis and management of cerebral salt wasting (CSW) in children: the role of atrial natriuretic peptide (ANP) and brain natriuretic peptide (BNP). Childs Nerv Syst 2006; 22(10): 1275–1281.
16. Fenske W, Stork S, Koschker AC et al. Value of fractional uric acid excretion in differential diagnosis of hyponatremic patients on diuretics. J Clin Endocrinol Metab 2008; 93 : 2991–2997.
17. Maesaka JK, Batuman V, Yudd M et al. Hyponatremia and hypouricemia: differentiation from SIADH. Clin Nephrol 1990; 33 : 174–178.
18. Moritz ML, Ayus JC. New aspects in the pathogenesis, prevention, and treatment of hyponatremic encephalopathy in children. Pediatr Nephrol 2010; 25 : 1225–1238.
19. Wright DG, Laureno R, Victor M. Pontine and extrapontine myelinolysis. Brain 1979; 102 : 361–385.
20. Decaux G, Unger J, Brimioulle S, Mockel J. Hyponatremia in the syndrome of inappropriate secretion of antidiuretic hormone. Rapid correction with urea, sodium chloride, and water restriction therapy. JAMA 1982; 247 : 471–474.
21. Robertson GL. Vaptans for the treatment of hyponatremia. Nat Rev Endocrinol 2011; 7 : 151–161.
22. Bettinelli A, Longoni L, Tammaro F et al. Renal salt-wasting syndrome in children with intracranial disorders. Pediatr Nephrol 2012; 27 : 733–739.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Trendy v indikaci vybraných laboratorních metod všeobecnými praktickými lékaři
- Potenciální zdroje ftalátů a bisfenolu A a jejich význam u metabolických onemocnění
- K životnímu jubileu prof. MUDr. Jany Pařízkové, DrSc.
- Chirurgická léčba poranění nervů dolních končetin
- Ambulantní parenterální antibiotická terapie (OPAT)
- Fekální inkontinence – závažný medicínský a společenský problém
- Vezikoureterální reflux u dětí: stále mnoho nezodpovězených otázek
- Hyponatremie u dětí: od patofyziologie k léčbě
- Role inkretinů v energetickém metabolismu a změnách hmotnosti po zanechání kouření
- Biobanky − evropská infrastruktura
- Chirurgové a neurochirurgové jako laureáti Nobelovy ceny
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vezikoureterální reflux u dětí: stále mnoho nezodpovězených otázek
- Chirurgická léčba poranění nervů dolních končetin
- Hyponatremie u dětí: od patofyziologie k léčbě
- Fekální inkontinence – závažný medicínský a společenský problém
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career