-
Medical journals
- Career
Trombocytopenie u malignit. Úvod do problematiky: příčiny, prognostický význam, význam pro terapii
Authors: E. Faber
Authors‘ workplace: Hemato-onkologická klinika Lékařské fakulty UP a FN Olomouc, přednosta prof. MUDr. Karel Indrák, DrSc.
Published in: Vnitř Lék 2010; 56(Supplementum 1): 27-30
Category: 16th Parizek's Days, Ostrava-Poruba, March 25th –26th 2010
Overview
Výskyt trombocytopenie u zhoubných nádorů se velmi různí podle příčin jejího vzniku. Klinický význam včetně vzniku významného krvácení není v přímé úměře s počtem trombocytů, ale často s dalšími okolnostmi a komplikacemi. Prognóza nemocných při trombocytopenii způsobené metastatickým postižením kostní dřeně, diseminovanou koagulopatií nebo mikroangiopatií je však všeobecně velmi vážná. Léčba trombocytopenie u malignit by měla být podle možnosti kauzální.
Klíčová slova:
trombocytopenie – rakovina – prognózaÚvod
Výskyt trombocytopenie u některých typů zhoubných nádorů byl sice popsán, ale na rozdíl např. od trombóz, kterým je věnována mnohem větší pozornost, nebývá až tak často zkoumán. U solidního nádoru je trombocytopenie zřídka prvním nebo jediným signálem malignity. Přítomnost trombocytopenie může v čase stanovení diagnózy znamenat metastatické postižení kostní dřeně, ale může jít také o další komplikace nádoru a později i jeho léčby. Ať už je u solidních nádorů příčina trombocytopenie jakákoli, vždy má závažný prognostický význam. Následující text je věnován pouze obecným poznámkám a zejména problematice trombocytopenie u solidních nádorů a okrajově také u vybraných hematologických malignit. Problematika trombocytopenie u myelodysplastického syndromu, akutní promyelocytární leukemie a u dětí s malignitou jsou probrány jinde.
Patogeneze
Mechanizmy vzniku trombocytopenie u nádorů jsou různorodé. V podstatě mohou hrát roli všechny základní patogenetické mechanizmy mající význam při rozvoji trombocytopenie obecně – nedostatečná produkce trombocytů, jejich zvýšená destrukce nebo sekvestrace a hemodiluce [1]. Je nezbytné zdůraznit, že v řadě případů nelze vyloučit ani kombinaci několika mechanizmů, zejména v situaci léčeného pacienta s nádorem, jehož klinický průběh byl komplikován např. infekcí. Nedostatečná produkce je téměř výhradně asociována s postižením kostní dřeně, ať už jde o infiltraci nádorovým klonem u hematologických malignit, nebo metastatickým, popřípadě mikrometastatickým postižením. Významné postižení kostní dřeně vede obvykle kromě nedostatku trombocytů také k anémii a leukopenii. Někdy je naopak spojeno většinou s lehkou leukocytózou, která se v diferenciálním rozpočtu vyznačuje posunem doleva s vyplavením erytroblastů. Kromě hematologických malignit je možnost postižení kostní dřeně udávána zejména u karcinomu plic, ledvin, prsu, prostaty, štítné žlázy, o něco méně často pak u karcinomu dělohy nebo zažívacího traktu. Pitevní nálezy potvrzují postižení kostí a kostní dřeně u většiny pacientů se zhoubnými nádory. Dalším častým faktorem negativně ovlivňujícím produkci trombocytů je pochopitelně aplikace myelosupresivní chemoterapie nebo ozařování. Účast dalších léků je spíše zapříčiněna imunitními mechanizmy spojenými se zvýšenou destrukcí destiček. Mechanizmy stojící za zvýšenou spotřebou trombocytů jsou různorodé a sahají od imunologicky podmíněných (jako u sekundární imunogenní trombocytopenie) až ke spotřebě trombocytů při intravaskulárním srážení (akutní a chronická diseminovaná intravaskulární koagulopatie nebo mikroangiopatická hemolytická anémie). U diseminované intravaskulární koagulopatie bývá příčinou přímá sekrece tkáňového faktoru či jiné bílkoviny aktivující faktor X nádorovými buňkami. Konečně je zde možnost trombocytopenie jako výsledek sekvestrace trombocytů při hypersplenizmu většinou v důsledku postižení myelo - nebo lymfoproliferativním onemocněním. Za normálních okolností je ve slezině přítomno asi 30 % z celkového počtu trombocytů, při hypersplenizmu to může být až 90 % [2].
Výskyt
Výskyt hemoragických komplikací a trombocytopenie byl sledován v několika observačních studiích, v nichž byli zařazeni pacienti s různými druhy zhoubných nádorů léčenými chemoterapií [3–5]. I když byl výskyt trombocytopenie pod 100 × 109/l pozorován u více než 1/3 nemocných, výskyt krvácivých projevů byl popsán kolem 10 %, přičemž incidence závažného krvácení byla ještě nižší (pod 5 %) [3,5]. Výsledky podobných studií mají ovšem limitovanou cenu, protože výskyt trombocytopenie, její tíže i závažnost krvácivých projevů jsou závislé nejen od základního onemocnění, ale i od intenzity podané myelosupresivní terapie.
S ohledem na příčiny krvácení bylo opakovaně konstatováno, že v řadě případů bylo krvácení způsobeno samotnou nemocí, jejími komplikacemi, koagulopatií nebo léky ovlivňujícími funkci trombocytů a nebylo v přímé korelaci s počtem trombocytů. Je evidentní, že důležitější je počet funkčních destiček a řada dalších okolností [6].
Diagnostika
Pečlivá anamnéza a fyzikální vyšetření mají pro objasnění příčiny trombocytopenie často klíčový význam, ale jejich rozbor přesahuje zaměření tohoto článku. U trombocytopenií lehkého stupně, jejíž praktické klinické důsledky jsou pochopitelně menší, se můžeme setkat s tím, že lékař nález přehlédne nebo jej bagatelizuje. Až postupné prohloubení trombocytopenie, která někdy může být přítomná řadu týdnů až měsíců, vede k příslušnému vyšetřování její příčiny. Středně těžká trombocytopenie pak vede k indikaci vyšetřování etiologie významně častěji, zejména v situaci náhodného nálezu před plánovaným diagnostickým nebo léčebným chirurgickým výkonem. Těžká trombocytopenie, zejména v doprovodu krvácivých projevů, je zpravidla řešena okamžitě.
Velmi často se při vyšetřování příčin trombocytopenie zapomíná na vyloučení falešné neboli pseudotrombocytopenie způsobené špatně provedeným odběrem, chybnou zkumavkou nebo výskytem destičkových agregátů a destičkovým satelitizmem. Příčinou mohou být autoprotilátky zaměřené na destičkový glykoprotein GPIIb/ IIIa, které v přítomnosti EDTA vedou ke vzniku destičkových agregátů, v jejichž důsledku je počet trombocytů stanovených automatickými počítači krvinek falešně nízký. Při nově zjištěné trombocytopenii je proto vždy nezbytné zopakovat odběr krve, ale současně odebrat vzorky také do oxalátu nebo heparinu a do zkumavky uchované při teplotě 37 °C. Navíc je nezbytné mikroskopicky vyloučit přítomnost zmíněných destičkových agregátů a destičkového satelitizmu (obr. 1).
Image 1. Mikrofotografie satelitizmu trombocytů při pseudotrombocytopenii. 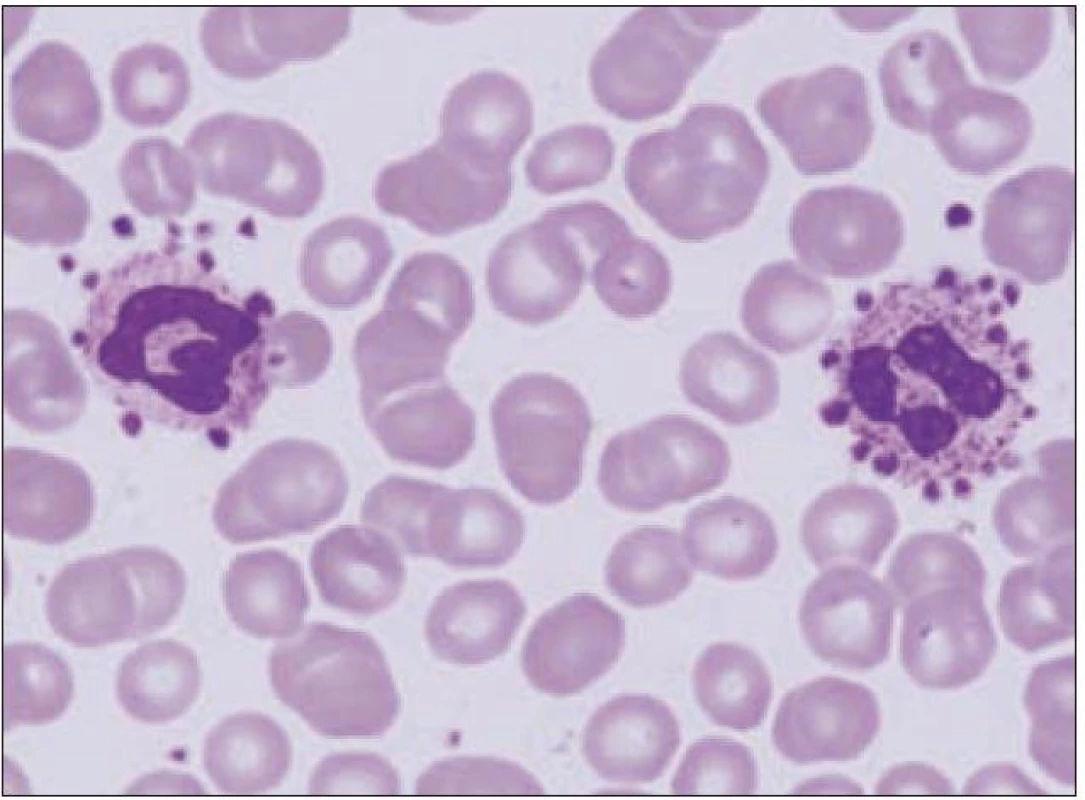
Postižení kostní dřeně při nádoru je nezbytné vyloučit provedením aspirační punkce nebo trepanobiopsie. Obě metody mají své limitace – u aspirační cytologie nebo imunofenotypizace je to možnost ztížené aspirace („suché“ punkce) nevalidního vzorku. Provedení trepanobiopsie v situaci trombocytopenie, koagulopatie nebo antikoagulační léčby může být komplikováno krvácením. Ztížený odběr bioptického vzorku může být při osteosklerotických metastázách nebo naopak při osteoporóze. Ve většině případů však oba zmíněné postupy postačují ke stanovení diagnózy včetně vyloučení vzácné hemofagocytózy. Scintigrafie kostní dřeně, počítačová tomografie (v poslední době často ve spojení s pozitronovou emisní tomografií) nebo magnetická rezonance poskytnou spíše informace o rozsahu a lokalitě postižení, ale i z těchto důvodů mohou být velmi užitečné. Výsledek imunocytologie nebo histologie kostní dřeně nemusí v každém případě vést ke stanovení primárního zdroje nádoru a v takových případech je nezbytné indikovat další vyšetření. Možná účast radioterapie a cytostatické léčby na vzniku trombocytopenie je zřejmá z časového sledu léčby a jejich možných důsledků. Seznam nejdůležitějších léků, jež mohou způsobit trombopenii vyvoláním imunitní reakce, je uveden v tab. 1. Je nezbytné zdůraznit, že výskyt léky vyvolané imunitní trombocytopenie je poměrně nízký [1]. V některých případech je velmi důležité myslet na možnost vyvolání trombocytopenie lékem (např. při heparinem indukované trombocytopenii), protože včasné neukončení léčby může mít závažné následky. Některé léky mohou na druhé straně ve vzácnějších případech indukovat trombotickou mikroangiopatii (např. cytostatika jako mitomycin, bleomycin, cisplatina nebo gemcitabin, ale méně často i další léky: cyklosporin, clopidrogel, simvastatin nebo ticlopidin), nebo vedou k rozvoji trombocytopenie dalšími mechanizmy (např. interferon) [7]. Destičky mohou poklesnout i v rámci hypersenzitivní reakce na lék.
Table 1. Příklady léků vyvolávajících sekundární imunní trombocytopenii. Upraveno podle [1]. ![Příklady léků vyvolávajících sekundární imunní trombocytopenii. Upraveno podle [1].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/63d060021df814d647e59be90c079f9b.jpg)
Zvýšenou konzumpci trombocytů při chronické nebo akutní diseminované koagulopatii je nezbytné potvrdit kompletním koagulačním vyšetřením včetně stanovení hladin fibrinogenu, antitrombinu III, fibrin degradačních produktů a D-dimerů. Diseminovaná koagulopatie se vyskytuje zejména u adenokarcinomů gastrointestinálního traktu, prostaty, plic nebo prsu. Trombocytopenie se u těchto nádorů může nezřídka vyskytnout i v kombinaci s venózní trombózou. V retrospektivní studii, která si položila za cíl popsat výskyt diseminované intravaskulární koagulopatie u solidních nádorů, byla tato diagnóza potvrzena u 76 z 1 117 pacientů (6,8 %). Většinou byla zjištěna u starších mužů s pokročilými nádory a u žen s karcinomem prsu [8]. Důležitým zjištěním studie bylo pozorování, že pouze asi 1/3 nemocných reagovala na léčbu a že výskyt diseminované koagulopatie měl pro přežití nemocných nezávislý prognostický význam. Nemocní s koagulopatií měli signifikantně horší přežití než nemocní s rakovinou, ale bez poruchy krevního srážení [8]. Trombocytopenii asociovanou s mikroangiopatií (jež se může také vyskytovat u adenokarcinomů, zejména pokud secernují mucin) lze vyloučit pomocí odečtení schistocytů, současným vyšetřením hladiny laktátdehydrogenázy a volného hemoglobinu. Udává se, že vyšetření hladiny ADAMTS13 nedává jednoznačné výsledky [9]. Imunogenní mechanizmus trombocytopenie potvrzuje výsledek vyšetření MAIPA, tento však nemusí být pozitivní v každém případě a často je sekundární imunní trombocytopenie diagnózou per exclusionem. Na imunogenní příčinu je nezbytné myslet zejména v případě lymfoproliferativních onemocnění (CLL, NHL, mnohotného myelomu nebo Hodgkinovy choroby). Účast hypersplenizmu na vzniku trombocytopenie je samozřejmě možné potvrdit radioizotopovým vyšetřením přežívání trombocytů, jež odhalí zvýšenou akumulaci destiček ve slezině, v běžné praxi ovšem nebývá důvod jej při potvrzené základní diagnóze indikovat.
Prognostický význam
U některých hematologických malignit signalizuje přítomnost trombocytopenie pokročilejší onemocnění. Např. u chronické myeloidní leukemie může znamenat akceleraci onemocnění a u chronické lymfatické leukemie znamená automatické zařazení nemocného do IV. klinického stadia podle Raie nebo C podle Bineta, což je spojeno ve všech případech s nezbytností rozhodování o léčbě. U nemocných s osteomyelofibrózou je počet trombocytů (většinou trombocytopenie < 100 × 109/ l) integrální součástí několika skórovacích systémů, které mají za cíl určit prognózu nemocného, a tak pomoci při rozhodování o léčbě [10,11]. Obdobně je tomu u chronické myeloidní leukemie, u níž je počet trombocytů součástí výpočtu aktuálně používaných skórovacích vzorců podle Sokala a Hasforda, i když v obou případech má prediktivní význam přítomnost trombocytemie [12,13]. Počet trombocytů byl používán u některých starších prognostických systémů pro CML, které již nejsou v současnosti používány (Turův a Kantarjianův). U solidních nádorů v případě potvrzení metastáz v kostní dřeni logicky vyplývá prognostický význam trombocytopenie z rozsahu základního onemocnění. Mikroangiopatie u solidních nádorů je spojena obvykle s velkou nádorovou masou a má v naprosté většině případů velmi nepříznivou prognózu. V těchto situacích může být trombocytopenie první známkou (v některých případech okultní) malignity [14,15]. Prognóza je vesměs závažná. Ani v případě mikroangiopatie vázané na chemoterapii nelze očekávat významnou účinnost léčebných opatření obvykle indikovaných u hemolyticko-uremického syndromu nebo trombotické trombocytopenické purpury. Literární údaje mluví o méně než 20% šanci dosažení léčebné odpovědi a 50% mortalitě do dvou měsíců [16,17].
Léčba
Léčba trombocytopenie by měla být kauzální a odvíjí se od příčinného mechanizmu. V případě potvrzení postižení kostní dřeně je to zejména léčba základního onemocnění. Léčba primárního nádoru může být jedinou účinnou možností i v případech účasti jiných mechanizmů trombocytopenie. U sekundární mikroangiopatické hemolytické anémie lze zkusit výměnné plazmaferézy nebo aplikaci imunoglobulinů, ale jejich účinnost je při perzistenci příčinného patogenetického mechanizmu limitovaná [17]. Na druhé straně možnost úspěšné aplikace chemoterapie je často limitovaná právě velkou nádorovou masou nebo celkovým klinickým stavem nemocného. Podání kortikoidů nebo imunoglobulinů je indikováno u imunitní trombocytopenie. V případě podezření na polékovou etiologii trombocytopenie je nezbytné pokud možno co nejdříve vynechat příslušný medikament. Podání transfuzí trombocytů je indikována při těžké trombocytopenii nezpůsobené mikroangiopatií ani imunitním mechanizmem. Plně na místě je při diseminované koagulopatii (za souběžné substituce koagulačních faktorů) nebo klinicky významném krvácení. Profylaktické podání koncentrátů destiček je při nepřítomnosti infekce a koagulopatie indikováno až při poklesu trombocytů na hodnotu 10 × 109/l a méně, kdy signifikantně stoupá riziko intracerebrálního krvácení [6]. Z růstových faktorů je při trombopenii u solidních nádorů (většinou po myelosupresivní chemoterapii) registrován k použití interleukin 11 (oprelvekin), jehož použití v praxi bylo po prvních úspěšných klinických zkouškách limitováno výskytem nežádoucích účinků [18,19]. Při nižším dávkování se zdá být tolerance léku lepší [20].
doc. MUDr. Edgar Faber, CSc.
www.fnol.cz
e-mail: edgar.faber@fnol.cz
Doručeno do redakce: 30. 3. 2010
Sources
1. Warketin TE, Kelton JG. Thrombocytopenia due to platelet destruction and hypersplenism. In: Hoffman R, Benz Jr EJ, Shattil SJ et al. Hematology basic principles and practice 4th Edition. Philadelphia: Elsevier Churchill Livingstone 2005 : 2305 – 2325.
2. Aster RH. Pooling of platelets in the spleen: Role in the pathogenesis of „hypersplenic“ thrombocytopenia. J Clin Invest 1966; 45 : 645 – 657.
3. Belt RJ, Leite C, Haas CD et al. Incidence of hemorrhagic complications in patients with cancer. J Am Med Assoc 1978; 239 : 2571 – 2574.
4. Dutcher JP, Schiffer CA, Aisner J et al. Incidence of thrombocytopenia and serious hemorrhage among patients with solid tumors. Cancer 1984; 53 : 557 – 562.
5. Goldberg GL, Gibbon DG, Smith HO et al. Clinical impact of chemotherapy-induced thrombocytopenia in patients with gynecolocig cancer. J Clin Oncol 1994; 12 : 2317 – 2320.
6. Avvisati G, Tirindelli MC, Annibali O. Thrombocytopenia and hemorrhagic risk in cancer patients. Crit Rew Oncol Hematol 2003; 48S: S13 – S16.
7. Medina PJ, Sipols JM, George JN. Drug-associated thrombotic thrombocytopenic purpura – hemolytic uremic syndrome. Curr Opin Hematol 2001; 8 : 286 – 293.
8. Sallah S, Wan J, Nguyen N et al. Disseminated intravascular coagulation in solid tumors: clinical and pathologic study. Thromb Haemost 2001; 86 : 828 – 833.
9. Forman RB, Benkel SA, Novik Y et al. Presence of ADAMTS13 activity in a patient with metastatic cancer and thrombotic microangiopathy. Acta Hematol 2003; 109 : 150 – 152.
10. Cervantes F, Pereira A, Esteve J et al. Identification of “short-lived” and “long-lived” patients at presentation of idiopathic myelofibrosis. Br J Haematol 1997; 97 : 635 – 640.
11. Hasselbalch H, Jensen BA. Prognostic factors in idiopathic myelofibrosis: a simple scoring system with prognostic significance. Eur J Haematol 1990; 44 : 172 – 178.
12. Sokal JE, Cox EB, Baccarani M et al. Prognostic discrimination in “good - risk” chronic granulocytic leukemia. Blood 1984; 63 : 789 – 799.
13. Hasford J, Pfirrmann M, Hehlmann R et al. A new prognostic score for survival of patients with chronic myeloid leukemia treated with interferon alfa. J Natl Canc Inst 1998; 90 : 850 – 858.
14. Hubáček J, Faber E, Slezák P et al. Mikroangiopatická hemolytická anemie jako první projev metastazujícího karcinomu. Prakt Lék 1996; 76 : 555 – 558.
15. Tomšová M, Žák P. Mikroangiopatická hemolytická anémie s trombocytopenií (cr - TTP) u pacienta s generalizovaným adenokarcinomem žaludku. Čs Patol 2003; 39 : 26 – 30.
16. Lesesne JB, Rothschild N, Erickson B et al. Cancer-associated hemolytic uremic syndrome. Analysis of 85 cases from a national registry. J Clin Oncol 1989; 7 : 781 – 789.
17. von Baeyer H. Plasmapheresis in thrombotic microangiopathy-associated syndromes: Review of of outcome data derived from clinical trials and open studies. Ther Apheresis 2002; 6 : 320 – 328.
18. Isaacs C, Robert NJ, Bailey FA et al. Randomized placebo - controlled study of recombinant human interleukin-11 to prevent chemotherapy-induced thrombocytopenia in patients with breast cancer receiving dose-intensive cyclophosphamide and doxorubicin. J Clin Oncol 1997; 15 : 3368 – 3377.
19. Tepler I, Elias L, Smith II et al. A randomized placebo - controlled trial of recombinant human interleukin-11 in cancer patients with severe thrombocytopenia due to chemotherapy. Blood 1996; 87 : 3607 – 3614.
20. Aribi A, Kantarjian H, Koller C et al. Effect of interleukin 11 on thrombocytopenia associated with tyrosine kinase inhibitor therapy in patients with chronic myeloid leukemia. Cancer 2008; 113 : 1338 – 1343.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2010 Issue Supplementum 1-
All articles in this issue
- Heparinem indukovaná trombocytopenie při léčbě nízkomolekulárními hepariny u dětí. Je čeho se obávat?
- Lokální intravenózní fibrinolýza u dětí a mladistvých
- Chronická imunitní trombocytopenická purpura – úspěšná léčba protilátkami anti‑CD 20
- Trombocytopenie a koagulopatie u hepatopatie: úvod do problematiky
- Monitorace parametrů koagulace a možnosti jejich ovlivnění u pacientů s jaterní cirhózou před invazivními výkony
- Imunitní trombocytopenie, diagnostika, klasifikace, diferenciální diagnostika
- Terapie imunitní trombocytopenie v graviditě
- Trombocytopenie u pacientů s průkazem antifosfolipidových protilátek nebo s antifosfolipidovým syndromem
- Diferenciální diagnostika trombocytopenie v těhotenství
- Syndrom HELLP – průběh onemocnění a aktivita markerů aktivace endotelu
- Porovnání hladin markerů aktivace endotelu v jednotlivých trimestrech.
- Využití parametru IPF (Immature platelet fraction) v laboratorní diagnostice
- Mikropartikule
- Uplatnění průtokové cytometrie v analýze trombocytů
- Změny laboratorních ukazatelů hemostázy u hepatopatií
- Úvodní slovo
- Ambulantní pacient s nově zjištěnou trombocytopenií
- Diferenciální diagnostika trombocytopenie u kriticky nemocných pacientů
- Trombocytopenie u malignit. Úvod do problematiky: příčiny, prognostický význam, význam pro terapii
- Dysplastické změny megakaryopoézy podle WHO klasifikace 2008
- Trombocytopenie u myelodysplastického syndromu
- Trombocytopenie u pacientů s akutní promyelocytární leukemií
- Využití destičkového lyzátu při kultivacích mezenchymálních kmenových buněk
- Trombocytopenie u novorozence
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Trombocytopenie a koagulopatie u hepatopatie: úvod do problematiky
- Monitorace parametrů koagulace a možnosti jejich ovlivnění u pacientů s jaterní cirhózou před invazivními výkony
- Diferenciální diagnostika trombocytopenie v těhotenství
- Využití parametru IPF (Immature platelet fraction) v laboratorní diagnostice
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

