-
Medical journals
- Career
Využití parametru IPF (Immature platelet fraction) v laboratorní diagnostice
Authors: M. Ryzí; J. Gumulec
Authors‘ workplace: Ústav klinické hematologie FN Ostrava, přednosta prim. MU Dr. Jaromír Gumulec
Published in: Vnitř Lék 2010; 56(Supplementum 1): 109-111
Category: 16th Parizek's Days, Ostrava-Poruba, March 25th –26th 2010
Overview
Mladé destičky – retikulotrombocyty – jsou markerem trombopoézy. Jejich stanovení je možno využít především v laboratorní diagnostice trombocytopenií a při monitorování kinetiky trombocytů po chemoterapiích a transplantacích kostní dřeně. Dříve byly retikulotrombocyty vyšetřovány pomocí průtokového cytometru. Toto stanovení bylo drahé, časově náročné a nestandardizovatelné. Nyní umožňuje jeho zavedení do rutinní praxe analyzátor Sysmex XE 5 000, který měří mladé destičky jako součást krevního obrazu a vyjadřuje je jako parametr IPF (Immature platelet fraction).
Klíčová slova:
retikulotrombocyty – IPF – trombocytopenieÚvod
Trombocyty jsou bezjaderné buněčné fragmenty s funkcí v řadě fyziologických procesů (stavění krvácení, vznik trombózy, metastazování tumorů aj.) [1].
Mají omezenou proteosyntetickou aktivitu a relativně krátkou životnost. V krevním oběhu kolují asi 10 dní. Z toho vyplývá, že při normálním počtu trombocytů v periferní krvi (150–400 × 109/l) [2] se každý den musí obnovit přibližně 10 % z jejich celkového počtu [3].
Nově vznikající trombocyty mají některé vlastnosti odlišné od starších krevních destiček (větší objem a obsah RNA), což umožňuje jejich odlišení v rámci laboratorního vyšetření krevního obrazu (parametry střední objem destiček – MPV a frakce nezralých destiček – IPF) [4]. Stanovení celkového množství nezralých, tj. mladých trombocytů může mít významnou roli v laboratorní diagnostice některých hematologických onemocnění, především trombocytopenií.
Co to jsou retikulotrombocyty?
Jako retikulotrombocyty se označují nezralé trombocyty bohaté na RNA. Jsou větší, fyziologicky aktivnější a analogické k retikulocytům. Jejich poměr k celkovému počtu trombocytů odráží intenzitu trombopoézy [4].
Funguje-li kostní dřeň normálně, má počet retikulotrombocytů v periferní krvi inverzní vztah k počtu trombocytů – čím nižší množství krevních destiček, tím vyšší podíl z nich tvoří retikulotrombocyty a naopak.
Jak se retikulotrombocyty stanovují?
Množství retikulotrombocytů v krvi lze stanovit průtokovou cytometrií s využitím fluorescenčních barviv, které vážou nukleové kyseliny (např. thiazolová oranž) [5].
Jsou-li retikulované destičky stanovovány na průtokovém cytometru, je měřený parametr označován jako high fluorescent platelet fraction (HFPF – frakce vysoce fluorescenčních trombocytů). Jelikož i použití shodného barviva přinášelo na různých pracovištích rozdílné výsledky a referenční rozmezí, nepodařilo se tento test nikdy standardizovat a zavést do rutinní praxe [6].
Retikulotrombocyty lze také stanovovat pomocí hematologického analyzátoru (přístroj Sysmex XE-5 000), který v rámci vyšetření krevního obrazu umožňuje měřit mladé destičky jako parametr IPF (Immature platelet fraction) [7].
Retikulotrombocyty jsou stanoveny jako IPF% (procentuální zastoupení retikulotrombocytů v celkovém počtu krevních destiček) nebo jako jejich absolutní počet.
IPF je měřeno v retikulocytárním (fluorescenčním) kanálu analyzátoru metodou průtokové cytometrie, používají se barviva polymetin a oxazin [8] (obr. 1).
Image 1. IPF je měřeno v retikulocytárním (fluorescenčním) kanálu analyzátoru metodou průtokové cytometrie, používají se barviva polymetin a oxazin. 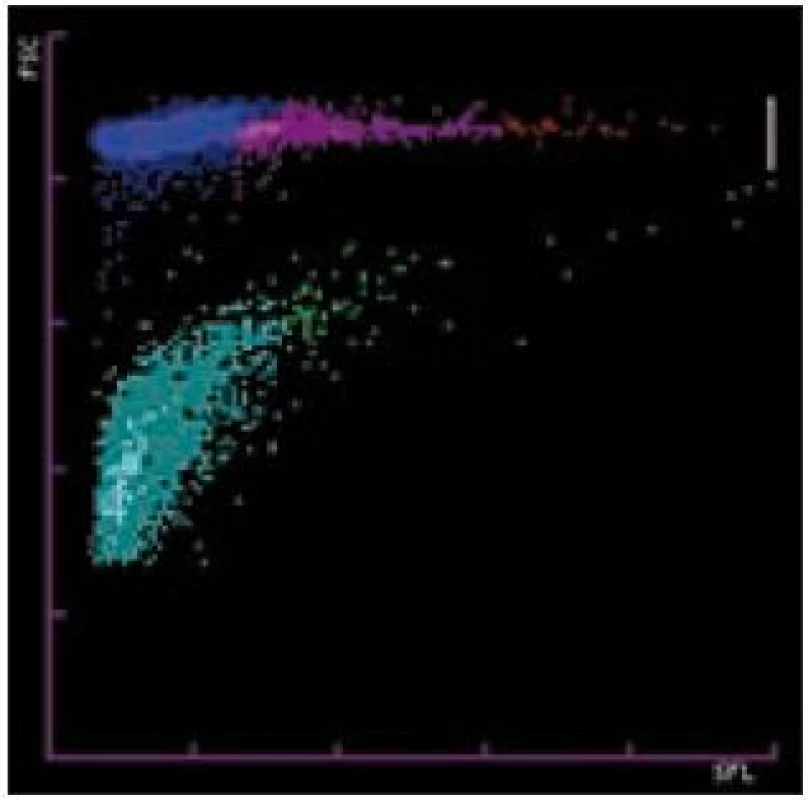
Referenční rozmezí IPF% bylo stanoveno týmem A. Takamiho na 0,5–5,7 % [9], Briggs et al [8] stanovili referenční rozmezí na 1,1–6,1 % z celkového počtu trombocytů.
Bylo zjištěno, že je-li vzorek pro stanovení IPF skladován při pokojové teplotě, jeho hodnota se po dobu 48 hod nemění [7]. Není vhodné skladovat materiál při 4 °C, neboť dochází k umělému zvyšování hodnoty IPF o téměř 200 % za 24 hod [10].
Využití IPF v laboratorní diagnostice
Parametr IPF lze využít při diagnostice a sledování řady převážně hematologických onemocnění.
Nejčastěji byla studována jeho využitelnost při diferenciální diagnostice trombocytopenií [7,11]. Dále bylo IPF zkoumáno jako marker nastupující trombopoézy po cytotoxických chemoterapiích a po transplantacích hematopoetických kmenových buněk [8,9]. Byl studován i význam retikulotrombocytů u pacientů s diagnózou myelodysplastický syndrom (MDS) [6].
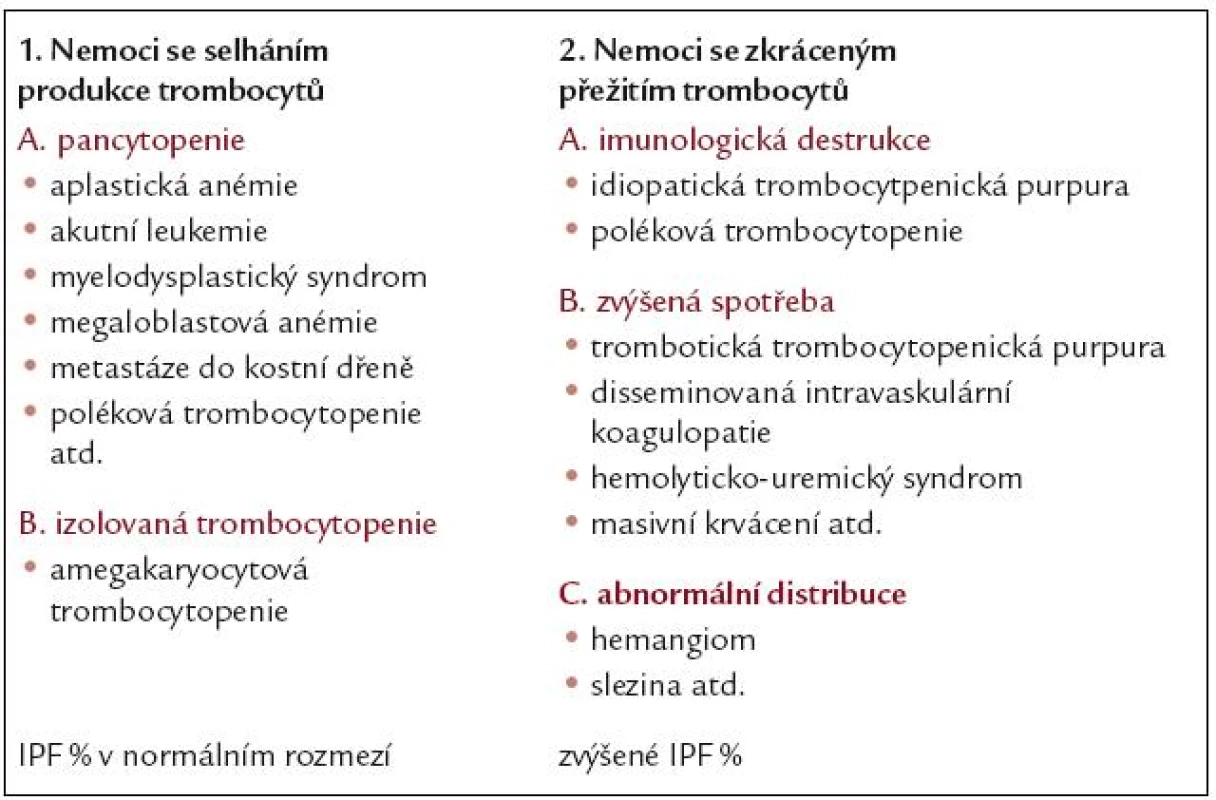
IPF a diferenciální diagnostika trombocytopenií
Stanovení retikulovaných destiček pomáhá odlišit trombocytopenie způsobené sníženou produkcí krevních destiček od trombocytopenií způsobených jejich zvýšenou konzumpcí nebo destrukcí (tab.1).
Snížená produkce trombocytů je nejčastěji důsledkem nedostatečnosti kostní dřeně způsobené např. nežádoucími účinky léků, radioterapií či chemoterapií. V tomto případě nedochází ani při výrazné trombocytopenii ke zvýšení IPF% mimo normální rozmezí.
Zvýšená spotřeba trombocytů je pozorována např. při krvácení, trombotické trombocytopenické purpuře (TTP) nebo při hemolyticko-uremickém syndromu (HUS). Aby byla kompenzována tato nadměrná ztráta destiček, narůstá aktivita kostní dřeně a megakaryocyty tvoří vyšší množství trombocytů. Tento jev lze zaznamenat jako zvýšenou hodnotu IPF% zjištěnou při vyšetření krevního obrazu. Je-li však onemocnění způsobující tuto konzumpci účinně léčeno, dochází k poklesu IPF% současně s nárůstem počtu trombocytů v periferní krvi [7].
Lze tedy shrnout, že dřeňový útlum nevede ke zvýšení hodnoty IPF%, kdežto nadměrná konzumpce nebo destrukce destiček může být provázena zvýšením IPF%.
IPF a transfuze krevních destiček
Po chemoterapii či transplantaci kostní dřeně trvá nějakou dobu, než dojde k obnově trombopoézy. Než dojde k navrácení produkce krevních destiček na potřebnou úroveň, může se pacient ocitnout v těžké trombocytopenii pod 10 × 109/l. Aby nedošlo k spontánnímu krvácení, připadá v úvahu profylaktická transfuze trombocytů.
Několik výzkumných týmů nezávisle na sobě pozorovalo, že dochází-li k obnovení trombopoézy, je nárůst počtu destiček ohlašován 1–4 dny dopředu zvýšením IPF% mimo normální rozmezí [7–9].
Tato skutečnost by mohla pomoci lékaři při rozhodnutí, zda u pacienta, který je afebrilní a nekrvácí, podat transfuzi trombocytů, nebo zda počkat, až počet destiček stoupne samovolně.
IPF a MDS
Někteří pacienti s MDS vykazují zvýšení IPF%, aniž by trpěli silnou trombocytopenií. Tato skutečnost je pravděpodobně způsobena dystrombopézou.
U všech pacientů z této skupiny byly zjištěny chromozomální abnormality, včetně monozomie či abnormalit chromozomu 7 nebo delece 5q [6].
Stavy ovlivňující stanovení a hodnoty IPF
Bylo zjištěno, že sepse či infekce zvyšuje u pacienta IPF% bez následného nastoupání počtu trombocytů [8,12].
Falešně pozitivní nárůst IPF byl pozorován i u kuřáků a pacientů s diabetem [13].
Závěr
Frakce mladých destiček – IPF je nový hematologický parametr, který lze jednoduše a levně měřit jako součást krevního obrazu. Má mnoho potenciálních využití, převážně v diagnostice trombocytopenií a sledování kinetiky trombocytů. V budoucnu budou jistě odhaleny nové souvislosti mezi IPF a diagnostikou či léčbou dalších i nehematologických onemocnění.
Mgr. Markéta Ryzí
www.fnspo.cz
e-mail: marketa.ryzi@fnspo.cz
Doručeno do redakce: 30. 4. 2010
Sources
1. Harrison P. Platelet development. Sysmex Journal Intern 2007; 2 : 73–80.
2. Doporučení České hematologické společnosti (www.hematology.cz)
3. Kaushansky K. The molecular mechanisms that control thrombopoiesis. J Clin Invest 2005; 115 : 3339–3347.
4. Ingram M., Coopersmith A. Reticulated platelets following acute blood loss. Br J Haematol 1969; 17 : 225–229.
5. Kienast J, Schmitz G. Flow cytometric analysis of thiazole orange uptake by platelets: a diagnostic iad in the evaluation of thrombocytopenic disorders. Blood 1990; 75 : 116–121.
6. Sugimori N, Kondo Y, Shibayama M et al. Aberrant increase in the immature platelet fraction in patients with myelodysplastic syndrome: a marker of karyotypic abnormalities associated with poor prognosis. Eur J Haematol 2008; 82 : 54–60.
7. Briggs C, Kunka S, Hart D et al. Assessment of an immature platelet fraction (IPF) in peripheral thrombocytopenia. Br J Haematol 2004; 126 : 93–99.
8. Briggs C, Hart D, Kunka S et al. Immature platelet fraction measurement: a future guide to platelet transfusion requirement after heamatopoietic stem cell transplantation. Trans Med 2006; 16 : 101–109.
9. Takami A, Shibayama M, Orito M et al. Immature platelet fraction for prediction of platelet engrafment after allogenic stem cell transplantation. Bone Marrow Transplant 2007; 39 : 501–507.
10. Osei-Bimpong A. The effect of storage on the clinical utility of the immature platelet fraction. Hematology 2009; 14 : 118–121.
11. Abe Y, Wada H, Tomatsu H et al. A simple technique to determine thrombopoiesis level using immature platelet fraction (IPF). Tromb Res 2006; 118 : 463–469.
12. Zucker ML, Murphy CA, Rachel JM et al. Immature platelet fraction as a predictor of platelet recovery following hematopoietic progenitor cell transplantation. Lab Haematol 2006; 12 : 125–130.
13. Grove EL, Hvas AM, Kristensen SD. Immature platelets in patients with acute coronary syndromes. Tromb Haemost 2009; 101 : 151–156.
14. Saigo K, Sakota Y, Masuda Y et al. Clinical utility of new parameters provided by Sysmex XE-2100 RET Channel. Sysmex Journal Intern 2007; 17 : 81–94.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2010 Issue Supplementum 1-
All articles in this issue
- Heparinem indukovaná trombocytopenie při léčbě nízkomolekulárními hepariny u dětí. Je čeho se obávat?
- Lokální intravenózní fibrinolýza u dětí a mladistvých
- Chronická imunitní trombocytopenická purpura – úspěšná léčba protilátkami anti‑CD 20
- Trombocytopenie a koagulopatie u hepatopatie: úvod do problematiky
- Monitorace parametrů koagulace a možnosti jejich ovlivnění u pacientů s jaterní cirhózou před invazivními výkony
- Imunitní trombocytopenie, diagnostika, klasifikace, diferenciální diagnostika
- Terapie imunitní trombocytopenie v graviditě
- Trombocytopenie u pacientů s průkazem antifosfolipidových protilátek nebo s antifosfolipidovým syndromem
- Diferenciální diagnostika trombocytopenie v těhotenství
- Syndrom HELLP – průběh onemocnění a aktivita markerů aktivace endotelu
- Porovnání hladin markerů aktivace endotelu v jednotlivých trimestrech.
- Využití parametru IPF (Immature platelet fraction) v laboratorní diagnostice
- Mikropartikule
- Uplatnění průtokové cytometrie v analýze trombocytů
- Změny laboratorních ukazatelů hemostázy u hepatopatií
- Úvodní slovo
- Ambulantní pacient s nově zjištěnou trombocytopenií
- Diferenciální diagnostika trombocytopenie u kriticky nemocných pacientů
- Trombocytopenie u malignit. Úvod do problematiky: příčiny, prognostický význam, význam pro terapii
- Dysplastické změny megakaryopoézy podle WHO klasifikace 2008
- Trombocytopenie u myelodysplastického syndromu
- Trombocytopenie u pacientů s akutní promyelocytární leukemií
- Využití destičkového lyzátu při kultivacích mezenchymálních kmenových buněk
- Trombocytopenie u novorozence
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Trombocytopenie a koagulopatie u hepatopatie: úvod do problematiky
- Monitorace parametrů koagulace a možnosti jejich ovlivnění u pacientů s jaterní cirhózou před invazivními výkony
- Diferenciální diagnostika trombocytopenie v těhotenství
- Využití parametru IPF (Immature platelet fraction) v laboratorní diagnostice
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career