-
Medical journals
- Career
Monitorace parametrů koagulace a možnosti jejich ovlivnění u pacientů s jaterní cirhózou před invazivními výkony
Authors: P. Vychodil; E. Kieslichová
Authors‘ workplace: Klinika anesteziologie, resuscitace a intenzivní péče IKEM Praha, přednostka prim. MUDr. Eva Kieslichová
Published in: Vnitř Lék 2010; 56(Supplementum 1): 70-73
Category: 16th Parizek's Days, Ostrava-Poruba, March 25th –26th 2010
Overview
Pro monitoraci koagulací u cirhotiků je dostačující vyšetření PT, aPTT, fibrinogenu, počtu trombocytů a anamnéza antiagregační léčby. Při nejasnostech nebo rozsáhlém neošetřitelném krvácení je indikováno nativní trombelastografické vyšetření a vyšetření s heparinázou I pro detekci vlivu heparinu a endogenních heparinoidů. Pro úpravu koagulačního stavu k invazivnímu výkonu je nejdůležitější příprava trombokoncentrátů při trombocytopenii a korekce PT těsně před výkonem, nebo pokud to situace dovolí, i v jeho průběhu.
Klíčová slova:
jaterní cirhóza – poruchy koagulace – monitorace koagulace – trombocytopenie – operační výkonÚvod
Jaterní cirhóza je chronické jaterní onemocnění charakterizované postupnou přestavbou jaterní tkáně a cévního řečiště jater a má charakteristický histologický obraz fibrózy jater s nodulární regenerací. Klinické projevy jaterní cirhózy jsou různorodé, někteří pacienti s jaterní cirhózou mohou být zcela asymptomatičtí, jiní pacienti vykazují množství závažných symptomů konečného stadia jaterního onemocnění se sníženou šancí na přežití. V České republice se jedná o stále rozšířenější onemocnění s prevalencí 15 – 20 případů/ 100 000/ rok. Postihuje odhadem 40 000 – 70 000 obyvatel a mortalita se pohybuje mezi 1 500 a 2 000/ rok. Reálný stav není znám a odhady vycházejí ze sekčních nálezů a povrchních průzkumů. Česká republika má mimořádně vysokou spotřebu alkoholu a prevalence cirhózy je u závislých na alkoholu v rozmezí 40 – 80 % [1]. Odhadovaný počet závislých na alkoholu v ČR je asi 140 000, z nichž 27 000 se ročně léčí. Udávané počty cirhotiků v ČR tak naplní jen cirhotici etylické etiologie a skutečný počet všech cirhotiků bude ještě vyšší. Výrazně menší podíl jaterní cirhózy ve srovnání se zeměmi EU tvoří nemocní s chronickými virovými hepatitidami. Hepatitida B má v ČR prevalenci 0,3 % a prevalence hepatitidy C se pohybuje pod 0,2 %. Ostatní příčiny cirhózy, ani jejich podíl v populaci, se od okolních zemí výrazně neliší.
Jaterní selhání i dysfunkce jater jsou provázeny poruchami srážlivosti projevujícími se nejčastěji krvácením. Koagulace cirhotiků je v rovnovážném stavu, ale rovnováha prokoagulačních a antikoagulačně působících faktorů je málo stabilní. Proto i malý inzult, někdy související s léčbou, vede k závažné poruše projevující se trombózou, nebo častěji krvácením. Trombotická onemocnění u cirhotiků jsou asi pětkrát četnější než v ostatní populaci a je třeba s nimi počítat i při těžké trombocytopenii. Mezi krvácivé komplikace se často řadí i krvácení z jícnových varixů, které není způsobené poruchou srážlivosti, ale často k ní přímo vede. INR (International Normalized Ratio) je součástí skórovacích systémů chronického postižení jater, jako je MELD skóre (Model for End-Stage Liver Disease) a Child - Pugh skóre. Používání INR má význam především pro monitoraci léčby warfarinem, pro monitoraci koagulací je doporučená hodnota protrombinového času (PT).
Příčiny poruchy srážlivosti
U cirhotiků dochází k poklesu syntetické schopnosti jater a následně i k výraznému poklesu hladin plazmatických faktorů II, V, VII, IX, X a XI. Tento pokles dosahuje u těžkých (dekompenzované cirhózy) cirhotiků 15 – 40 % normální aktivity. Pokles hladin plazmatických faktorů je kompenzován poklesem hladin proteinů C, S, Z, AT III a ADAMTS 13, které působí protikoagulačně. Kompenzací na prokoagulační straně je vzestup hladiny faktoru VIII (možná i proto se stále mylně píše, že f. VIII nevzniká v játrech, ale jen v endotelu) spojený se vzestupem vWF (von Willebrandova faktoru) [2].
U některých nemocných lze v krvi detekovat heparinoidy, které jsou endogenního původu. Endogenní heparinoidy vznikají při zánětu (nejčastěji se jedná o spontánní bakteriální peritonitidu) jen u cirhotiků. Někdy jsou detekovatelné i u nemocných v těžké sepsi s poruchou funkce jater. Endogenní heparinoidy patří mezi glysoaminoglykany (dermatan, heparan a chondroitin sulfát) a uvolňují se z mastocytů a hepatocytů. Jsou částečně antagonizovatelné protamin sulfátem a pro laboratorní vyšetření antagonizovatelné heparinázou I [3].
U fulminantního selhání jater (FHF) je podíl poklesu koagulačních faktorů jiný, nedochází ke kompenzaci, protože k selhání jater dochází akutně, a s ním i k výraznému poklesu faktorů II, V, VII a X [4], zatímco zůstávají vyšší hladiny f. IX a XI. Riziko trombózy u pacientů s FHF je minimální. Monitorace PT a faktoru V jsou důležité pro zařazení na čekací listinu k urgentní transplantaci jater (Clichy kritéria sledují hladinu faktoru V a King’s college kritéria hodnotu PT).
Trombocytopenie u cirhotiků má multifaktoriální příčiny. Hlavními faktory jsou nedostatečná tvorba trombopoetinu, který je u více než 90 % těžkých cirhotiků v krvi nedetekovatelný. Podílí se i sekundárně vzniklá splenomegalie při portální hypertenzi. Pokles počtu destiček u cirhotiků s hepatitidou C velmi dobře koreluje se stupněm cirhózy a inverzně s portální hypertenzí [5]. Vedlejšími faktory mohou být deficity vitaminů, destičkové protilátky u chronické hepatitidy C, které jsou obtížně detekovatelné, a v neposlední řadě i léčba hepatitidy C interferony s následnou myelosupresí a poklesem hladiny destiček. Trombocytopenie je u cirhotiků kompenzována především vzestupem hladiny vWf a poklesem TAFI (thrombin-activatable fibrinolysis inhibitor) se snížením hladiny ADAMTS13 [6]. U pacientů bez cirhózy dochází při krvácení ke konzumpci destiček dříve než ke konzumpci koagulačních faktorů. U cirhotiků nejsou k dispozici data, ale dá se předpokládat, že význam destiček pro koagulaci je výrazně větší a klinické zkušenosti z řady pracovišť to potvrzují.
Kontrola a monitorace na oddělení
Zatím neexistuje standard koagulačního vyšetření pacientů ani jeho hodnocení a vždy je třeba i klinická zkušenost pro interpretaci. Základní koagulační vyšetření na odděleních intenzivní péče zahrnují PT a aPTT a rozšířená pak i čas fibrinolýzy, D-dimery a hladinu fibrinogenu a ATIII. PT a aPTT jsou velmi vhodné pro monitoraci účinnosti antikoagulační léčby, ale predikce krvácení na jejich základě je nedostatečná a spíše matoucí. Přesto je vyšetřování PT a aPTT stále jedním z rutinních předoperačních vyšetření (tab. 1).
Table 1. Predikce krvácení podle provedených koagulačních vyšetření. 
Interpretace izolovaných rutinních vyšetření je pro nehematologa obtížná a u pacientů bez cirhózy jater je pozitivní hodnota PT a aPTT pro predikci rozvoje krvácení malá. Protože jsou tato základní koagulační vyšetření prováděna v laboratoři za supraoptimálních podmínek, nelze je hodnotit bez přihlédnutí ke klinickému stavu pacienta. Pro přesnější zhodnocení je třeba znát i teplotu pacienta, počet krevních destiček, pH a ionizované kalcium, jejichž poruchy mohou být příčinou krvácení. Dalším rutinním vyšetřením je vyšetření počtu, velikosti a hematokritu krevních destiček. Součástí je i pečlivá anamnéza užívání antiagregancií, která jsou často přehlížena. Bez toho je ale počet trombocytů jen „laboratorním číslem“ a pacient může při invazivním výkonu neošetřitelně krvácet s „plným počtem destiček“, které jsou částečně nebo úplně dysfunkční, a příčina se hledá pozdě a nákladně. Cirhotici užívající antiagregancia by proto měli být monitorováni obzvlášť pečlivě.
Ke změnám v koagulačních testech dochází až při poklesu hladin koagulačních faktorů na 20 – 30 %. Trvá dlouho, než se projeví pokles syntetické funkce jater v PT a aPTT, protože je zde velká funkční rezerva. Stanovení hladin koagulačních faktorů je na řadě pracovišť nedostupné, vyšetření je nákladné a dostupnost není v řádu desítek minut nebo hodin a pro běžnou klinickou praxi není třeba. Nejvhodnější kombinací se nám jeví trombelastografické vyšetření se základními koagulačními vyšetřeními aPTT, PT, fibrinogenem a počtem destiček. Na základě těchto vyšetření lze vyloučit vážnější riziko perioperačního krvácení, nebo upravit koagulaci, aby ke krvácení nedošlo. Trombelastografické vyšetření (TEG) je viskoelastografické vyšetření napodobující pomalý venózní tok. Jeho limitem je chybějící detekce deficitu vWf a acetylsalicylové kyseliny. U cirhotiků je TEG vyšetření velmi výhodné, protože zohledňuje i funkci a počet trombocytů (obr. 1).
Image 1. Pacientka po transplantaci jater s difuzním krvácením, INR 1,2, 34 × 10<sup>9</sup>/ l destiček; zelená křivka je po příjezdu z OS, bílá křivka po podání 2 trombokoncentrátů z aferézy. 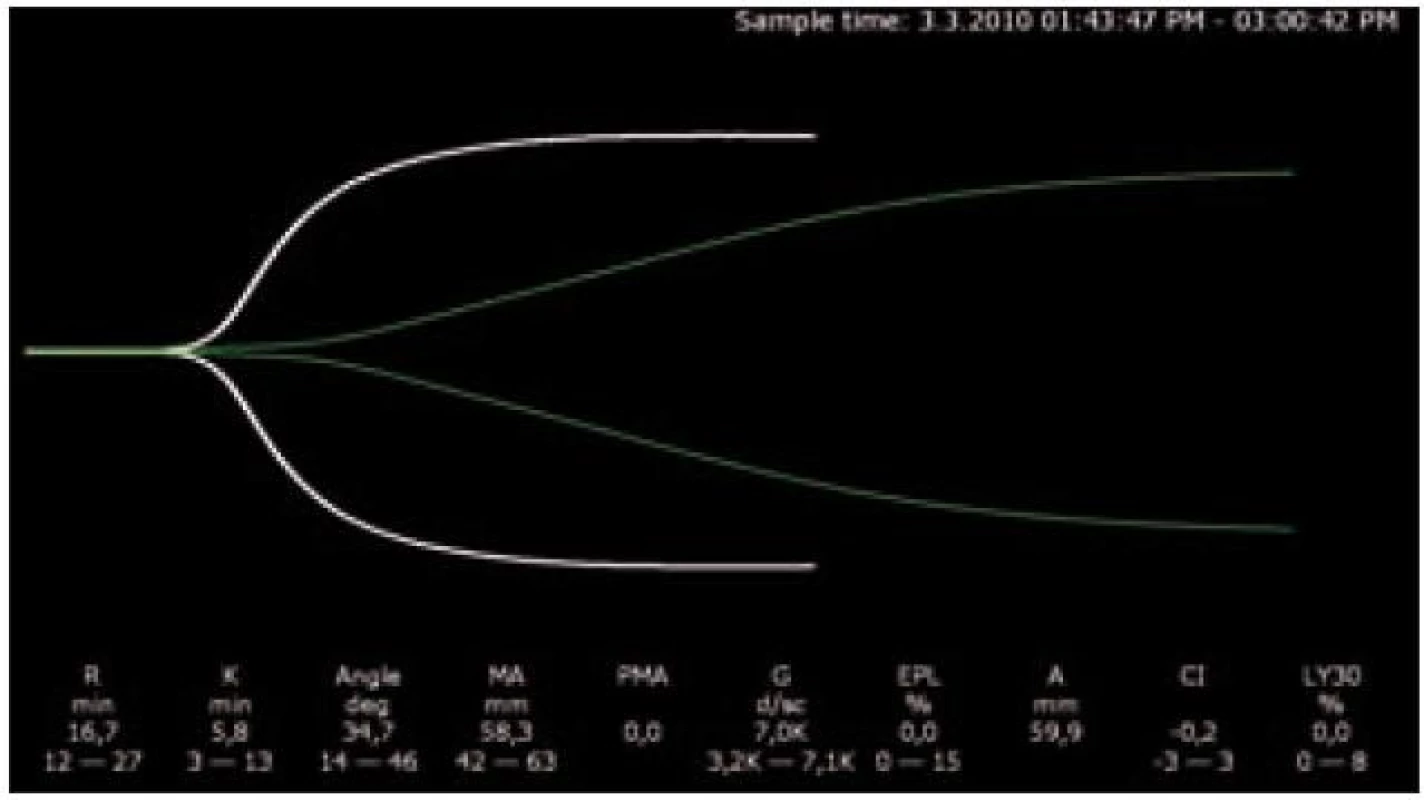
TEG také lépe zohlední deficity protikoagulačních faktorů. Výhodné je modifikované vyšetření s heparinázou Ipro detekci vlivu heparinoidů a monitorace hyperfibrinolytických stavů. Perioperační monitorace koagulace TEG je na specializovaných pracovištích rutinní záležitostí, ale izolované vyšetření je obtížně hodnotitelné a vždy bychom měli mít k dispozici i PT, aPTT, hladinu fibrinogenu a počet destiček.
Úprava koagulací u cirhotiků
Úprava koagulačního stavu má za cíl zabránit „nechirurgickému“ krvácení. To je krvácení, které není z větších zdrojů a není chirurgicky ošetřitelné. Vědecké práce a studie zabývající se predikcí krvácení u pacientů s cirhózou se výhradně týkají krvácení z jícnových varixů a rizik opakovaného krvácení a doporučení, nebo studie chybí. Pro postupy úpravy koagulací předoperačně, při traumatu, při krvácení do CNS, u ortopedických nebo srdečních operací existují ve většině evropských zemí doporučení. Pro cirhotické pacienty jsou doporučení jen při krvácení z jícnových varixů a obecná doporučení chybí.
Evidence pro perioperační krvácení se týká „necirhotických pacientů“, kteří podstupují kardiochirurgické a ortopedické výkony. Pro cirhotické nemocné je velmi dobrá evidence krvácení z jícnových varixů, které ale není primárně krvácením vyvolaným koagulační poruchou. K té dochází až během krvácení, pokud je masivní. Proto u cirhotiků postupujeme obvykle na základě empirie. Jedna z prvních a dodnes citovaných prací zabývající se úpravou koagulací před jaterní biopsií je stále aktuální a po přečtení podobných prací je možno zjistit, že za více než 30 let nedošlo na tomto poli k významným změnám [7]. Dodnes je cílem úpravy koagulace dosažení hodnot PT a aPTT v pásmu normy. Prostředkem k dosažení normokoagulace jsou čerstvě zmražená plazma (ČZP) a prothrombin complex concentrate (PCC) – faktory protrombinového komplexu. Nejběžnější chybou je podávání ČZP a PCC den před výkonem s kontrolou v den výkonu. Aktivita faktoru VII se podílí na PT asi ze 70 % a poločas f. VII je 3 – 6 hod. Ostatní faktory mají delší poločasy (tab. 2). U warfarinizovaných nemocných dochází okamžitě po antagonizaci vitaminem K k rozvoji syntézy plazmatických faktorů a při předčasném podání ČZP jsou plazmatické faktory s krátkým poločasem nahrazeny vlastní syntézou. U nemocných s cirhózou je nedostatečná syntéza v játrech primární příčinou poruchy, a nedojde tak k překrytí nástupu vlastní syntézy s podáním koagulačních faktorů exogenně.
Table 2. Poločasy koagulačních faktorů. 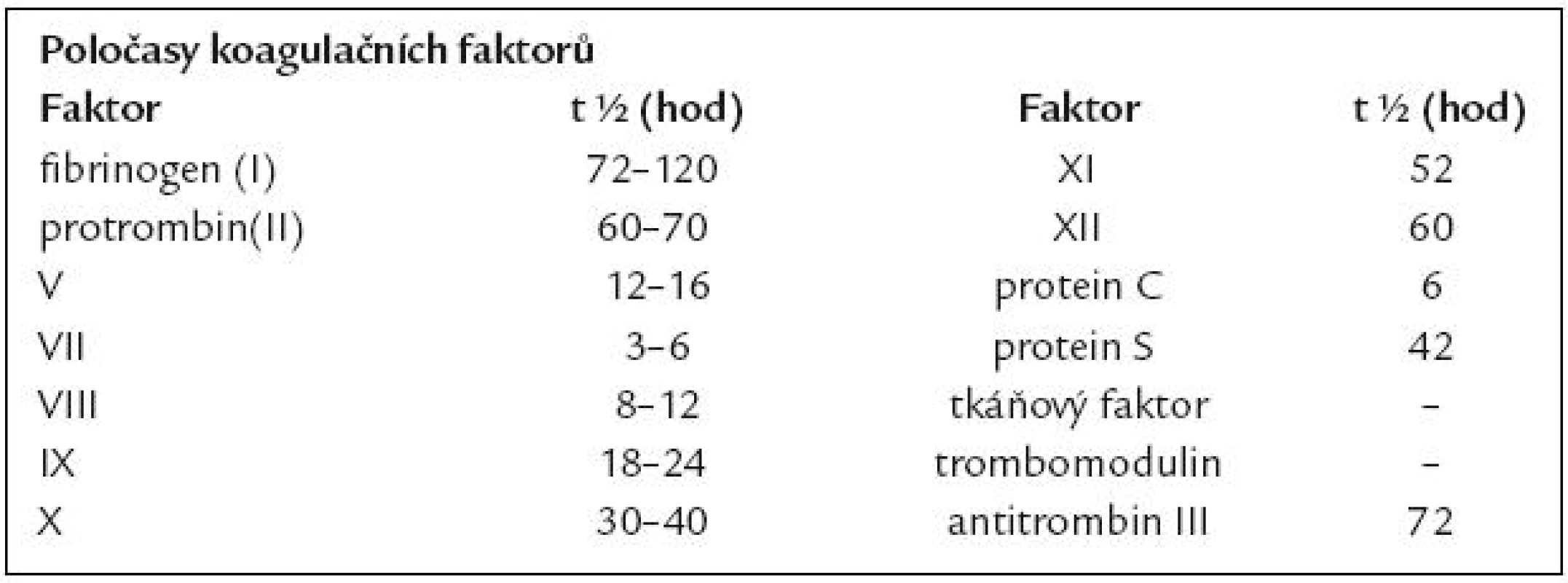
Po podání 2 TU ČZP pak nemohou být překvapením ranní náběry koagulací se stejně špatným výsledem jako při náběru, na který jsme reagovali. Pacient pak čeká s invazivním výkonem na podání dalších krevních přípravků/ derivátů a navíc je zbytečně zatížen objemem. V horším případě dojde k podání krevních přípravků/ derivátů odpoledne před výkonem a výkon je pacientovi proveden nezávisle na špatném aktuálním stavu koagulace.
Postup úpravy
U plánovaných výkonů je nezbytná eliminace infekce (často infekce ascitu – spontánní bakteriální peritonitida s cirkulujícími heparinoidy v oběhu), je nutné vysadit antikoagulancia a antiagregancia a u warfarinizovaných podat vitamin K a převést je na LMWH. Pacienti s antiagregační léčbou by ji měli vysadit 4 – 7dní před výkonem.
Požadovaný počet trombocytů k výkonům s minimálním rizikem krvácení je 50 × 109/ l a PT s aPTT postačují na horní hranici, nebo 10 – 20 % nad horní hranicí normy. Málo invazivní výkony s větším rizikem krvácení jako ERCP, snesení polypu nebo TIPS by měly mít stejnou přípravu jako výkony s nízkým rizikem a počet trombocytů okolo 100 × 109/ l (hranice 100 × 109/ l by neměla být jasně arbitrární, 93 × 109/ l je funkčně stejné jako 103 × 109/ l).
Urgentní výkony s vysokým rizikem krvácení
V urgentních případech není možnost dlouhého vyšetřování, ale vždy je třeba anamnesticky zjistit významnější antiagregační a antikoagulační léčbu, při počtu trombocytů pod 100 × 109/ l zajistit trombokoncentráty (podání před výkonem nebo dle dohody s anesteziologem) a podle zvyklostí pracoviště upravit koagulace. Při INR > 1,6 je indikováno podání ČZP nebo PCC. Podávání ČZP není bez rizika, protože asi 15 % ČZP od dárkyň obsahuje HLA DR protilátky a při podání většího množství ČZP je vysoké riziko především plicních komplikací (TRALI – transfusion related acute lung injury) [8]. Další riziko, které hrozí při podávání ČZP i PCC u cirhotiků, je vyšší procento trombotických komplikací. Proto by se při podávání většího množství ČZP/ PCC měl podávat LMWH a monitorovat hladina AT III, s její úpravou při poklesu pod 50 % pro snížení rizika trombotických komplikací. Poslední doporučení se týká fibrinogenu, jehož hladina k operačním výkonům není arbitrárně stanovena, ale dle obecného doporučení (ESICM 2010 – European Society of Intensive Care Medicine) by hladina fibrinogenu měla být > 2 g/ l. Protože při jaterní cirhóze není trombocytopenie spojená s trombocytopatií, je hladina 2 – 2,5 g/ l dostatečná i u cirhotiků [9].
MUDr. Pavel Vychodil
www.ikem.cz
e-mail: vychodil@seznam.cz
Doručeno do redakce: 31. 3. 2010
Sources
1. Špičák J. Novinky v gastroenterologii a hepatologii. Praha: Grada Publishing 2008.
2. Colman RW. Hemostasis and Thrombosis. 5th ed. Philadelphia: Lippincott Williams & Wilkins 2006.
3. Montalto P, Vlachogiannakos J, Cox DJ et al. Bacterial infection in cirrhosis impairs coagulation by a heparin effect: a prospective study. J Hepatol 2002; 37 : 463 – 470.
4. Kerr R, Newsome P, Germain L et al. Effects of acute liver injury on blood coagulation. J Throm Hemost 2003; 4 : 754 – 759.
5. Adinolfi LE, Giordano MG, Andreana Aet al. Hepatic fibrosis plays central role in the pathogenesis od thrombocytopenia in patient with chronic viral hepatitis. Br J Haematol 2001; 113 : 590 – 595.
6. Lisman T, Leebeek F, Mosnier L et al. Thrombin-Activatable Fibrinolysis Inhibitor Deficiency in Cirrhosis Is Not Associated With Increased Plasma Fibrinolysis. Gastroenterology 2001; 121 : 131 – 139.
7. Mannucci PM, Franca F, Dioguardi N. Correction of abnormal coagulation in chronic liver disease by combined use of FFP and PCC. Lancet 1976; 308 : 542 – 545.
8. Rana R, Fernández - Pérez ER, Anjum Khan S et al. Transfusion-related acute lung injury and pulmonary edema in critically ill patients: a retrospective study. Transfusion 2006; 46 : 1478 – 1483.
9. Tripodi A, Primignani M, Chantarangkul V. Thrombin generation in patients with cirrhosis: the role of platelets. Hepatology 2006; 44 : 440 – 445.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2010 Issue Supplementum 1-
All articles in this issue
- Heparinem indukovaná trombocytopenie při léčbě nízkomolekulárními hepariny u dětí. Je čeho se obávat?
- Lokální intravenózní fibrinolýza u dětí a mladistvých
- Chronická imunitní trombocytopenická purpura – úspěšná léčba protilátkami anti‑CD 20
- Trombocytopenie a koagulopatie u hepatopatie: úvod do problematiky
- Monitorace parametrů koagulace a možnosti jejich ovlivnění u pacientů s jaterní cirhózou před invazivními výkony
- Imunitní trombocytopenie, diagnostika, klasifikace, diferenciální diagnostika
- Terapie imunitní trombocytopenie v graviditě
- Trombocytopenie u pacientů s průkazem antifosfolipidových protilátek nebo s antifosfolipidovým syndromem
- Diferenciální diagnostika trombocytopenie v těhotenství
- Syndrom HELLP – průběh onemocnění a aktivita markerů aktivace endotelu
- Porovnání hladin markerů aktivace endotelu v jednotlivých trimestrech.
- Využití parametru IPF (Immature platelet fraction) v laboratorní diagnostice
- Mikropartikule
- Uplatnění průtokové cytometrie v analýze trombocytů
- Změny laboratorních ukazatelů hemostázy u hepatopatií
- Úvodní slovo
- Ambulantní pacient s nově zjištěnou trombocytopenií
- Diferenciální diagnostika trombocytopenie u kriticky nemocných pacientů
- Trombocytopenie u malignit. Úvod do problematiky: příčiny, prognostický význam, význam pro terapii
- Dysplastické změny megakaryopoézy podle WHO klasifikace 2008
- Trombocytopenie u myelodysplastického syndromu
- Trombocytopenie u pacientů s akutní promyelocytární leukemií
- Využití destičkového lyzátu při kultivacích mezenchymálních kmenových buněk
- Trombocytopenie u novorozence
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Trombocytopenie a koagulopatie u hepatopatie: úvod do problematiky
- Monitorace parametrů koagulace a možnosti jejich ovlivnění u pacientů s jaterní cirhózou před invazivními výkony
- Diferenciální diagnostika trombocytopenie v těhotenství
- Využití parametru IPF (Immature platelet fraction) v laboratorní diagnostice
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

