-
Medical journals
- Career
Mikropartikule
Authors: L. Slavík; J. Úlehlová; A. Hluší; J. Procházková; M. Procházka; V. Krčová; K. Indrák
Authors‘ workplace: Hemato- onkologická klinika Lékařské fakulty UP a FN Olomouc, přednosta prof. MUDr. Karel Indrák, DrSc.
Published in: Vnitř Lék 2010; 56(Supplementum 1): 112-116
Category: 16th Parizek's Days, Ostrava-Poruba, March 25th –26th 2010
Overview
Za mikropartikule (MP) můžeme považovat částice s velikostí 0,05–1 mm. Jejich složení je značně variabilní dle jejich původu. Vždy však nesou na svém povrchu glykoproteiny exprimované taktéž na povrchu buněk. Této vlastnosti se také využívá k jejich detekci pomocí monoklonálních protilátek. MP se uvolňují jako fragmenty z plazmatické membrány prakticky všech typů eukaryotických buněk po jejich stimulaci nebo v rámci jejich apoptózy. MP se mohou tvořit také při procesu narušení buněčné tkáně. Vznik MP takto může reprezentovat širokou odpověď podněty typu buněčného stimulu nebo stresu. V patogenezi zánětu patří mezi klíčové kroky poškození endotelu a uvolnění membrány mikročástic. Metody detekce MP vychází jednak ze snahy stanovit jejich absolutní počet a jednak stanovit jejich trombogenní potenciál. Pro stanovení počtu MP lze s úspěchem využít průtokovou cytometrii, kdy bylo v poslední době popsáno mnoho metod využívajících široké spektrum monoklonálních protilátek. V současné době se využívají zejména stanovení trombocytárních MP pomocí detekce exprese CD41 znaku a endoteliální MP pomocí CD144 znaku. ELISA metodiky naopak slouží pro stanovení trombogenního potenciálu MP pomocí detekce exprese P-selektinu. Specifickou metodou se jeví použití trombin generačního testu v kombinaci s ultrafiltrací pro stanovení trombogenního potenciálu MP. Patologie spojené s MP vychází zejména z poznání jejich patofyziologických vlastností. Trombogenní potenciál je benefitem u trombocytopenií, kde vysoké hladiny MP jsou detekovány u pacientů bez krvácivých komplikací. Tato vlastnost však může být příčinou trombotických komplikací. Naopak negativní vliv mohou mít MP u infarktu myokardu, zánětlivých procesů nebo roztroušené sklerózy.
Klíčová slova:
mikropartikule – trombofilní riziko – P-selektin – průtoková cytometrie – generace trombinuÚvod
Poškození endotelu a uvolnění membrány mikročástic jsou klíčovými kroky v patogenezi zánětu, v širším pojetí smyslu slova [1,2]. V místě poranění endotelu, sekrece pro-zánětlivých cytokinů a exprese cytoadhesivních endotelových buněk umožní rozšíření a diapedezi zánětu. Současné rozdělení endoteliální bariéry umožňuje infiltraci cévní stěny či perivaskulárního prostoru buňky a v jejich důsledku mediátory zprostředkovaný projev zánětlivé reakce. Dlouhou dobu byly MP považovány za inertní zbytky buněk nebo průvodce buněčné smrti. MP vzniklé apoptózou nebo poškozením buňky jsou nyní popisovány jako silné (dys) regulátory endoteliální funkce. Interakce s proximálními nebo distálními buňkami přispívá k přenosu biologických informací na relativně velké vzdálenosti, což může v konečném důsledku změnit endoteliální funkce samostatně [2].
Ve skutečnosti jsou oba děje – zánět a trombóza – propojeny interakcí cirkulujících buněk, krevních destiček, endotelu (včetně mastocytů) a z něj odvozených mikročástic. Dva odlišné skladovací pooly mikročástic se mohou podílet na patofyziologii trombózy jako: mikročástice uvolněné z periferních cév a krevních buněk, mikročástice uvolněné z apoptotických buněk sekvestrované v cévní stěně a uvolněné v případě ruptury ateromatózního plaku. Zde je důkaz, že trombóza je vyvolána tkáňovým faktorem (TF). TF je hlavním iniciátorem v koagulační kaskádě rozšířeným do krevního oběhu pomocí mikropartikulí. Je známo, že škodlivé cirkulující mikropartikule různého původu mohou vyvolat nežádoucí reakce endoteliálních buněk, včetně amplifikace pro-inflamatorní a pro-koagulační reakce. Experimentální a klinické údaje potvrzují škodlivé vlastnosti MP jako příčinu řady patofyziologických mechanizmů při zánětlivých reakcích, modulaci cévního průtoku, vaskulární remodelaci, angiogenezi a apoptóze, což se promítá řadou chorobných stavů, jako jsou aterotrombóza, vaskularitida, sepse a anafylaxe. Např. při aterotrombóze byl zjištěn podíl mikročástic na: uvolňování cytokinů a cytoadhesivní expresi endotelu a leukocytů, monocytární infiltraci aterosklerotického plaku, proliferaci buněk hladké svaloviny, proteolýze (v neovaskularizaci plaku, jako zdroji krvácení u pokročilé léze), zvýšení oxidativního stresu a také zvýšení trombogenicity [2]. Na druhé straně, protože mikročástice mohou odrážet jemnou rovnováhu mezi stimulací buněk, proliferací a smrtí, je možné, že působí jako signály pro udržení homeostázy u mnohobuněčných organizmů.
Pro-protizánětlivé účinky mikročástic na endoteliálních buňkách a cévní stěně
Účinky mikročástic na změny pro-zánětlivého fenotypu endotelu byly zdokumentovány řadou prací z poslední doby. První monitorování mikročástic a jejich vlivu na endoteliální fenotyp byl ve studiích zkoumajících účinky destičkových mikročástic na kultury endoteliálních buňek. V průkopnické studii zprostředkovaly transcelularní mikropartikule transport kyseliny arachidonové do endoteliální buňky a současně expresi cyklooxygenázy 2 [4]. Kromě toho byly prokázány schopnosti mikročástic: stimulovat uvolnění pro-zánětlivých cytokinů endotelu, včetně interleukinu (IL)-6, monocytárního chemosenzibilního proteinu-1, indukovat expresi endoteliálních cytoadhezinů (intercelulární adhezní molekuly-1, vaskulární adhezní molekuly-1 a E-selektin) a indukovat expresi příslušných counter-receptorů na povrchu leukocytární membrány [4,5].
Protizánětlivé účinky mikročástic
První poznatky naznačující protizánětlivý vliv membránových vesikul poskytla práce Gassera a Schifferliho [10]. Autoři zde ukázali, že neutrofilní mikrovesikula nedisponují prozánětlivou aktivitou v oblasti lidských makrofágů, což bylo hodnoceno monitorováním uvolňování IL-8 a TNF-α. Nicméně bylo zjištěno zvýšené vylučování transformačního růstového faktoru β1, který je účinným inhibitorem aktivace makrofágů. Dále se podařilo prokázat zablokování zánětlivé reakce makrofágů na lipopolysacharidy pomocí mikročástic. Uvolňování mikročástic z neutrofilů se jeví jako silný protizánětlivý efektor v brzké fázi zánětu [10]. V poslední době ukázal protizánětlivý účinek mikročástic odvozených z neutrofilů na endoteliálních buňkách novou cestu aktivace koagulace zprostředkovanou mikročásticemi nesoucí Anexin A1, endogenní protein schopný inhibovat adhezi neutrofilů k endotelu [11].
Protrombogenní potenciál mikročástic na endoteliálních buňkách
Různí endoteliální antagonisté, jako jsou cytokiny, mikroorganizmy (včetně Chlamydia pneumoniae), mohou indukovat membránovou remodelaci a expozici prokoagulačních fosfolipidů, expresi tkáňového faktoru a jeho uvolnění ve formě vázané na mikropartikule. Na jedné straně může být uvolňování endoteliálních mikročástic (EMP) považováno za přínosné k rozpoznání škodlivých pro-apoptotických faktorů, jako jsou kaspázy-3, a tím zabránění apoptóze endoteliálních buněk a jejich oddělení z endotelu [12]. Na druhé straně, v blízkosti cévních poškození může prokoagulační charakter mikročástic měnit rovnováhu hemostázy. Dokladem této hypotézy byla práce Mesriho a Altieriho, kteří prokázali up-regulaci cirkulujících leukocytárních mikročástic. Zánětlivá stimulace MP in vivo byla provedena pomocí stresu stejně jako aktivace signální cesty koagulační kaskády u endotelových buněk, která vede ke zvýšení aktivity tkáňového faktoru [5]. Souběžně mikročásticemi indukované rychlé uvolnění von Willebrandova faktoru na povrchu umožňuje přechodné přilnutí neaktivovaných destiček k endotelu. Tyto dvě hlavní buněčné odpovědi se zdají být pod kontrolou reaktivních kyslíkových radikálů (ROS) uvolněných mikročásticemi [13].
Antikoagulační potenciál mikročástic
Aniontové fosfolipidy odhalené na aktivovaných cévních buňkách nebo uvolněné z mikročástic mohou podpořit tvorbu jak prokoagulačních komplexů, tak protein C antikoagulačních enzymových komplexů (vyžadují přibližně desetkrát vyšší koncentrace fosfatidylserinu). V závislosti na původu MP dochází k expresi trombomodulinu, inhibitoru zevní cesty tkáňového faktoru, endoteliálního protein C receptoru (ePCR) nebo proteinu S, a tím k eventuálnímu zapojení do antikoagulační cesty [14]. Pozoruhodné je, že i když jsou mikročástice uznávány jako silné prokoagulační mediátory v cévách, zvláště pokud slouží jako nosič tkáňového faktoru, mikročástice uvolněné indukcí APC po interakci s funkčním ePCR disponují antikoagulační aktivitou, jako je inaktivace faktoru Va na povrchu mikropartikulí. Obě aktivní místa, jak pro aktivovaný protein C, tak pro proteázou aktivovaný receptor-1 (PAR-1), jsou nezbytná pro formování mikropartikulí [16].
Cirkulující mikročástice a cévní dysfunkce
Několik studií z poslední doby předpokládá, že mikročástice v oběhu lze považovat za doprovodný marker vulnerabilního plaku nebo globální poškození cév [17,18]. Zvýšení plazmatické hladiny endoteliálních MP (EMP) odráží zejména buněčné poškození a jeví se jako marker cévní dysfunkce. EMP koreluje s cirkulující endoteliální dysfunkcí u pacientů s ischemickou dysfunkcí levékomory.
Image 1. Příklad flowcytometrického stanovení endoteliálních mikropartikulí. 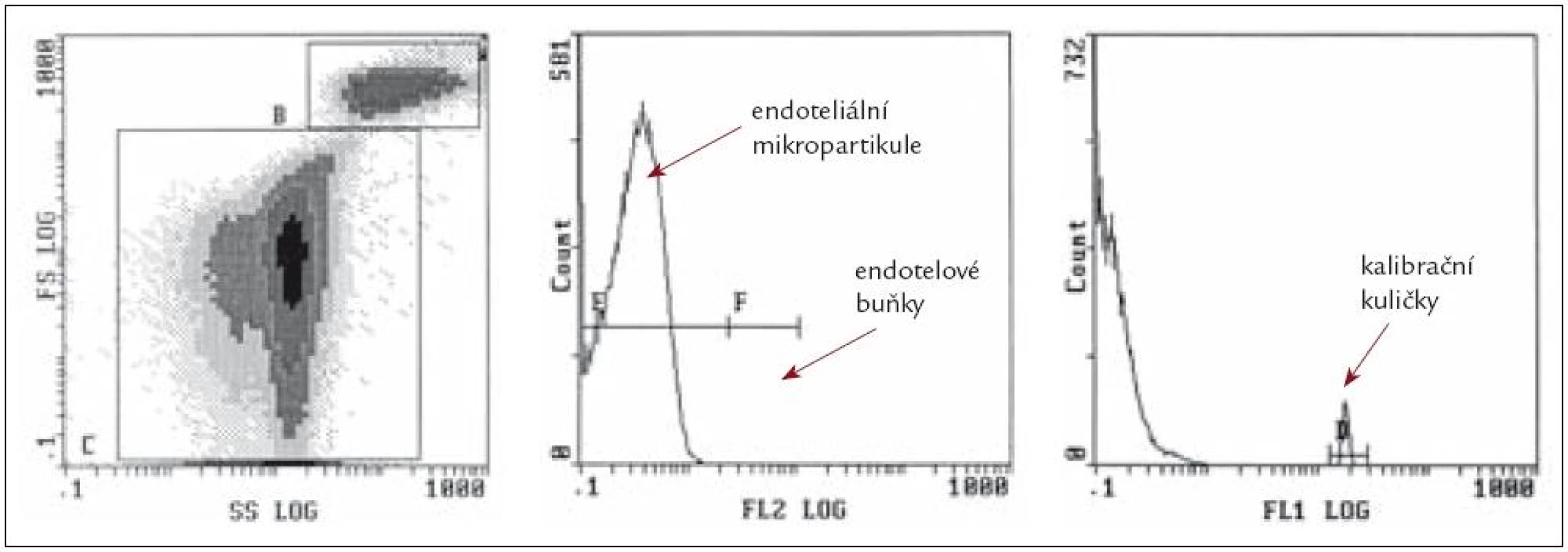
Metody detekce mikropartikulí
Laboratorní metody detekce mikropartikulí až do nedávné doby narážely na zásadní komplikace, které vycházely z charakteru mikročástic, tj. nelze je považovat ani za buňky, ani za plazmatický analyt. V poslední době, díky rostoucímu významu MP u řady chorobných stavů, se rozvinula řada metod pro stanovení počtu, ale zejména trombogenního potenciálu MP.
Metody na stanovení počtu mikročástic vychází z obecné vlastnosti MP, tj., že exprimují CD znak mateřské buňky. To umožňuje stanovit jednotlivé frakce MPs s ohledem na původ jejich vzniku. Naopak metody založené na stanovení trombogenního potenciálu využívají vlastnosti MP aktivovat koagulační systém. Tyto metody mají využití zejména pro monitorování protrombogenního potenciálu mikročástic.
Průtoková cytometrie
Pro stanovení průtokovou cytometrií lze použít řadu protokolů, které byly publikovány v posledních letech. Velmi elegantní je aplikace metodiky využívající průtokovou cytometrii z plné krve [19].
Vzorky plné krve jsou naznačeny příslušnou monoklonální protilátkou, která je specifická pro buňky, z kterých MP pocházejí. Následně jsou vzorky naředěny a podrobeny analýze v průtokovém cytometru. MP jsme schopni odečíst z forwardscatteru, čímž se vyhneme specifické separaci nebo dvojímu značení monoklonální protilátkou. Absolutní počet mikropartikulí je pak vypočten pomocí přídavku kalibračních kuliček o známé koncentraci.
Pro značení lze použít některou z následujících protilátek:
- CD 31 (PECAM 1) – CD31 antigen jeexprimován na destičkách, monocy-tech, granulocytech, ale ne na cirkulu-jících B-lymfocytech. Vysoká hladina je pozorována na povrchu endotelu.
- CD 41 – CD 41 znak je exprimován nadestičkách a megakaryocytech, ale také B-lymfocytech a endoteliálních buňkách.
- CD 144 – CD 144, také nazývaný Cad-herin 5 nebo VE-Cadherin je 140 kDa protein náležící do rodiny cadherinů, které představují molekuly buněčné adheze. CD 144 antigen je specifický pro endoteliální buňky a je lokalizován na intercelulárních trhlinách s poškozením endotelové tkáně.
ELISA metodiky
ELISA metodiky jsou koncipovány na základě vazby p-selektinu exprimovaného na povrchu MP [20,21]. Exprese p-selektinu je dle dostupných prací přímo úměrná trombogennímu potenciálu MP.
MP přítomné ve vzorku se vážou na Anexin V, který je imobilizován na povrchu mikrotitrační desky, a takto navázané fosfolipidové povrchy umožňují přeměnu protrombinu na trombin za přítomnosti F Xa – F Va a Ca2+. Koncentrace generovaného trombinu je pak přímo úměrná koncentraci vázaných fosfolipidů a lze ji monitorovat pomocí rozkladu specifického substrátu při 405 nm.
Generace trombinu v kombinaci s ultrafiltrací
Trombin generační test lze využít pro stanovení trombogenního potenciálu MP bez rozdílu jejich původu. Princip testu spočívá v měření TGA u vzorků před a po odstranění MP [22]. MP jsou pak odstraněny většinou ultrafiltrací.
Rozdíl naměřené generace trombinu je pak přímo úměrný trombogennímu potenciálu MP. Jedná se o elegantní metodiku, kterou lze používat v reálném čase bez nutnosti zamrazení vzorků, což vede k vyšší reprodukovatelnosti metodiky.
Patologie spojené s MP
V poslední době byla publikována řada sdělení o významu MP u srpkovité anémie [23], heparinem indukované trombocytopenie [24], septických stavů [25], trombotické trombocytopenické purpury (TTP) [26], paroxyzmální noční hemoglubinurie [27], systémových onemocnění [28–32], kardiovaskulárních onemocnění [33], stroku [34], aneuryzmatu aorty [35], hluboké žilní trombózy a plicní embolie [36], periferního vaskulárního onemocnění [37].
Ačkoli u řady onemocnění není role MP dosud plně objasněna, u některých stavů se MP stávají prostředkem pro terapeutické ovlivnění léčebných postupů. Objasnění patofyziologické role mikropartikulí u srpkovité anémie a TTP může být využito pro charakterizaci jednotlivých fází průběhu těchto onemocnění. Detekce chronicky zvýšené hladiny MP u pacientů se srpkovitou anémií může být využito pro rozpoznání endoteliálního ataku onemocnění, což může vést k časnějšímu terapeutickému zásahu.
Image 2. Schéma ELISA metodiky stanovení MP. 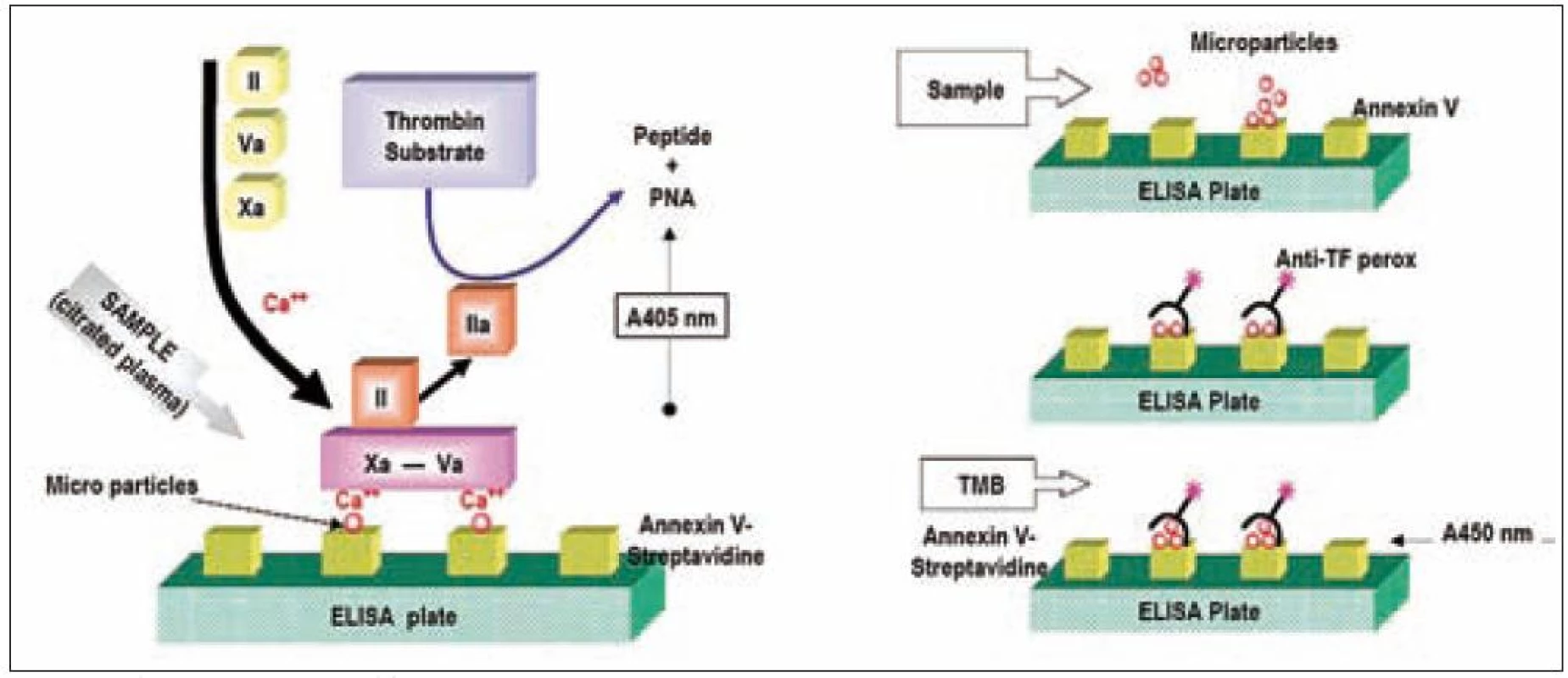
Aktivní MP mohou představovat u několika chorobných stavů přímou příčinu onemocnění a představují takto důležitý terapeutický cíl. Odstranění mikročástic v průběhu plazmaferézy může tuto metodu značně zvýhodnit proti podání mražené plazmy u TTP. Stejný postup může být efektivní i u některých septických stavů.
Terapeutické využití MP u krvácejících pacientů představuje jednu z dalších možností terapeutického ovlivnění chorobných stavů [38]. Účinek mikročástic v kryoprecipátutu u pacientů refrakterních na substituci krevních destiček je vysvětlován právě působením MP jako náhradních aktivačních povrchů.
Podpořeno grantem ministerstva zdravotnictví IGA NH 6986-3/2002 a NR 9282-3(2007) a projektem LF-2010-004.
Mgr. Luděk Slavík
www.fnol.cz
e-mail: Ludek.Slavik@fnol.cz
Doručeno do redakce: 31. 3. 2010
Sources
1. Schouten M, Wiersinga WJ, Levi M et al. Inflammation, endothelium, and coagulation in sepsis. J Leukoc Biol 2008; 83 : 536–545.
2. Morel O, Toti F, Hugel B et al. Procoagulant microparticles: disrupting the vascular homeostasis equation? Arterioscler Thromb Vasc Biol 2006; 26 : 2594–2604.
3. Pérez-Casal M, Downey C, Cutillas-Moreno B et al. Microparticle-associated endothelial protein C receptor and the induction of cytoprotective and anti-inflammatory effects. Haematologica 2009; 94 : 387–394.
4. Barry OP, Pratico D, Lawson JA et al. Transcellular activation of platelets and endothelial cells by bioactive lipids in platelet microparticles. J Clin Invest 1997; 99 : 2118–2127.
5. Mesri M, Altieri DC. Leukocyte microparticles stimulate endothelial cell cytokine release and tissue factor induction in a JNK1 signaling pathway. J Biol Chem 1999; 274 : 23111–23118.
6. Mause SF, von Hundelshausen P, Zernecke A et al. Platelet microparticles: a transcellular delivery system for RANTES promoting monocyte recruitment on endothelium. Arterioscler Thromb Vasc Biol 2005; 25 : 1512–1518.
7. Jy W, Mao WW, Horstman L et al. Platelet microparticles bind, activate and aggregate neutrophils in vitro. Blood Cells Mol Dis 1995; 21 : 217–231.
8. MacKenzie A, Wilson HL, Kiss-Toth E et al. Rapid secretion of interleukin-1beta by microvesicle shedding. Immunity 2001; 15 : 825–835.
9. Canault M, Leroyer AS, Peiretti F et al. Microparticles of human atherosclerotic plaques enhance the shedding of the tumor necrosis factor-alpha converting enzyme/ADAM17 substrates, tumor necrosis factor and tumor necrosis factor receptor-1. Am J Pathol 2007; 171 : 1713–1723.
10. Gasser O, Schifferli JA. Activated polymorphonuclear neutrophils disseminate antiinflammatory microparticles by ectocytosis. Blood 2004; 104 : 2543–2548.
11. Dalli J, Norling LV, Renshaw D et al. Annexin 1 mediates the rapid anti-inflammatory effects of neutrophil-derived microparticles. Blood 2008; 112 : 2512–2519.
12. Abid Hussein MN, Boing AN, Sturk A et al. Inhibition of microparticle release triggers endothelial cell apoptosis and detachment. Thromb Haemost 2007; 98 : 1096–1097.
13. Essayagh S, Xuereb JM, Terrisse AD et al. Microparticles from apoptotic monocytes induce transient platelet recruitment and tissue factor expression by cultured human vascular endothelial cells via a redoxsensitive mechanism. Thromb Haemost 2007; 98 : 831–837.
14. Satta N, Freyssinet JM, Toti F. The significance of human monocyte thrombomodulin during membrane vesiculation and after stimulation by lipopolysaccharide. Br J Haematol 1997; 96 : 534–542.
15. Sabatier F, Roux V, Anfosso F et al. Interaction of endothelial microparticles with monocytic cells in vitro induces tissue factor-dependent procoagulant activity. Blood 2002; 99 : 3962–3970.
16. Perez-Casal M, Downey C, Fukudome K et al. Activated protein C induces the release of microparticle-associated endothelial protein C receptor. Blood 2005; 105 : 1515–1522.
17. Chironi G, Simon A, Hugel B et al. Circulating leukocyte-derived microparticles predict subclinical atherosclerosis burden in asymptomatic subjects. Arterioscler Thromb Vasc Biol 2006; 26 : 2775–2780.
18. Pirro M, Schillaci G, Bagaglia F et al. Microparticles derived from endotheial progenitor cells in patients at different cardiovascular risk. Atherosclerosis 2008; 197 : 757–767.
19. Vidal1 C, Spaulding1 Ch, Picard F et al. Flow Cytometry Detection of Platelet Procoagulant Activity and Microparticles in Patients with Unstable Angina Treated by Percutaneous Coronary Angioplasty and Stent ImplantationThromb Haemost 2001; 86 : 784–790.
20. Nomura S. Measuring circulating cell-derived microparticles, J Thromb Haemost 2004; 10 : 1847–1848.
21. Miyamoto S, Marcinkiewicz C, Edmunds Jr. LH et al. Measurement of platelet microparticles during cardiopulmonary bypass by means of captured ELISA for GpIIb/IIIa. Thromb Haemost 1998; 80 : 225–230.
22. Bidot L, Jy W, Bidot C Jr et al. Microparticle-mediated thrombin generation assay: increased activity in patients with recurrent thrombosis. J Thromb Haemost 2008; 6 : 913–919.
23. Shet AS, Aras O, Gupta K et al. Sickle blood contains tissue factor-positive microparticles derived from endothelial cells and monocytes. Blood 2003; 102 : 2678–2683.
24. Visentin GP, Ford SE, Scott JP et al. Antibodies from patients with heparin-induced thrombocytopenia/thrombosis are specific for platelet factor 4 complexed with heparin or bound to endothelial cells. J Clin Invest 1994; 93 : 81–88.
25. Barry OP, Pratico D, Savani RC et al. Modulation of monocyte-endothelial cell interactions by platelet microparticles. J Clin Invest 1998; 102 : 136–144.
26. Furlan M, Robles R, Galbusera M et al. von Willebrand factor-cleaving protease in thrombotic thrombocytopenic purpura and the hemolytic-uremic syndrome. N Engl J Med 1998; 339 : 1578–1584.
27. Hugel B, Socie G, Vu T et al. Elevated levels of circulating procoagulant microparticles in patients with paroxysmal nocturnal hemoglobinuria and aplastic anemia. Blood 1999; 93 : 3451–3456.
28. Ogata N, Imaizumi M, Nomura S et al. Increased levels of platelet-derived microparticles in patients with diabetic retinopathy. Diabetes Res Clin Pract 2005; 68 : 193–201.
29. Omoto S, Nomura S, Shouzu A et al. Significance of platelet-derived microparticles and activated platelets in diabetic nephropathy. Nephron 1999; 81 : 271.
30. Omoto S, Nomura S, Shouzu A et al. Detection of monocyte-derived microparticles in patients with Type II diabetes mellitus. Diabetologia 2002; 45 : 550–555.
31. Diamant M, Nieuwland R, Pablo RF et al. Elevated numbers of tissue-factor exposing microparticles correlate with components of the metabolic syndrome in uncomplicated type 2 diabetes mellitus. Circulation 2002; 106 : 2442–2447.
32. Faure V, Dou L, Sabatier F et al. Elevation of circulating endothelial microparticles in patients with chronic renal failure. J Thromb Haemost 2006; 4 : 566–573.
33. Bernal-Mizrachi L, Jy W, Jimenez JJ et al. High levels of circulating endothelial microparticles in patients with acute coronary syndromes. Am Heart J 2003; 145 : 962–970.
34. Lee YJ, Jy W, Horstman LL et al. Elevated platelet microparticles in transient ischemic attacks, lacunar infarcts, and multi-infarct dementias. Thromb Res 1993; 72 : 295–304.
35. Touat Z, Ollivier V, Dai J et al.Renewal of mural thrombus releases plasma markers and is involved in aortic abdominal aneurysm evolution. Am J Pathol 2006; 168 : 1022–1030.
36. Heresi GA, Chirinos JA, Velasquez H et al. Elevated endothelial Microparticles (EMP) and activation markers of platelet and leukocytes in venous thromboembolism (VTE). Blood 2003; 102 : 804a.
37. Tan KT, Tayebjee MH, Lynd C et al. Platelet microparticles and soluble P selectin in peripheral artery disease: relationship to extent of disease and platelet activation markers. Ann Med 2005; 37 : 61–66.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2010 Issue Supplementum 1-
All articles in this issue
- Heparinem indukovaná trombocytopenie při léčbě nízkomolekulárními hepariny u dětí. Je čeho se obávat?
- Lokální intravenózní fibrinolýza u dětí a mladistvých
- Chronická imunitní trombocytopenická purpura – úspěšná léčba protilátkami anti‑CD 20
- Trombocytopenie a koagulopatie u hepatopatie: úvod do problematiky
- Monitorace parametrů koagulace a možnosti jejich ovlivnění u pacientů s jaterní cirhózou před invazivními výkony
- Imunitní trombocytopenie, diagnostika, klasifikace, diferenciální diagnostika
- Terapie imunitní trombocytopenie v graviditě
- Trombocytopenie u pacientů s průkazem antifosfolipidových protilátek nebo s antifosfolipidovým syndromem
- Diferenciální diagnostika trombocytopenie v těhotenství
- Syndrom HELLP – průběh onemocnění a aktivita markerů aktivace endotelu
- Porovnání hladin markerů aktivace endotelu v jednotlivých trimestrech.
- Využití parametru IPF (Immature platelet fraction) v laboratorní diagnostice
- Mikropartikule
- Uplatnění průtokové cytometrie v analýze trombocytů
- Změny laboratorních ukazatelů hemostázy u hepatopatií
- Úvodní slovo
- Ambulantní pacient s nově zjištěnou trombocytopenií
- Diferenciální diagnostika trombocytopenie u kriticky nemocných pacientů
- Trombocytopenie u malignit. Úvod do problematiky: příčiny, prognostický význam, význam pro terapii
- Dysplastické změny megakaryopoézy podle WHO klasifikace 2008
- Trombocytopenie u myelodysplastického syndromu
- Trombocytopenie u pacientů s akutní promyelocytární leukemií
- Využití destičkového lyzátu při kultivacích mezenchymálních kmenových buněk
- Trombocytopenie u novorozence
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Trombocytopenie a koagulopatie u hepatopatie: úvod do problematiky
- Monitorace parametrů koagulace a možnosti jejich ovlivnění u pacientů s jaterní cirhózou před invazivními výkony
- Diferenciální diagnostika trombocytopenie v těhotenství
- Využití parametru IPF (Immature platelet fraction) v laboratorní diagnostice
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

