-
Medical journals
- Career
Uplatnění průtokové cytometrie v analýze trombocytů
Authors: L. Kovářová
Authors‘ workplace: Oddělení klinické hematologie FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Miroslav Penka, CSc.
Published in: Vnitř Lék 2010; 56(Supplementum 1): 117-119
Category: 15th Parizek's Days
Overview
Průtoková cytometrie představuje moderní vyšetřovací metodu využívanou v klinických a výzkumných laboratořích k analýze buněčných populací. V rámci studia biologie a funkčního stavu trombocytů patří mezi její základní aplikace: 1. detekce vrozených a získaných defektů trombocytů; 2. analýza aktivace trombocytů in vivo; 3. transfuziologické aplikace; 4. studium doby obratu trombocytů. Každá ze jmenovaných aplikací má své výhody či úskalí. Cílem této práce je shrnout a osvětlit základní aplikace průtokové cytometrie a její uplatnění v analýze trombocytů.
Klíčová slova:
průtoková cytometrie – trombocyty – imunofenotypizaceÚvod
Průtoková cytometrie (flow cytometrie – FC) umožňuje rychlou analýzu současně několika parametrů na vysokém počtu částic v buněčné suspenzi. Jedním z FC přístupů je tzv. imunofenotypizace, kdy je detekována povrchová či cytoplazmatická (případně jaderná) exprese buněčných antigenů (Ag) pomocí monoklonálních (případně polyklonálních) protilátek (Ab). Získané výsledky jsou buď kvalitativního (přítomnost či nepřítomnost daného antigenu), anebo kvantitativního (intenzita/denzita exprese daného antigenu) charakteru.
Trombocyty (platelets – PLT) tvoří nejmenší buněčnou komponentu v periferní cirkulaci a jejich primární úlohou je udržování hemostázy. Uplatnění imunofenotypizace v analýze PLT a jejich případných dalších subpopulací (velké trombocyty, z trombocytů odvozené mikropartikule, agregáty s leukocyty apod.) je široké, přičemž zastoupení může být vyjádřeno jak v relativních (%), tak v absolutních počtech (počet bb/µl) [1–3]. Pro flowcytometrickou detekci PLT jsou podstatné membránové glykoproteiny (GP), což jsou adhezivní molekuly přítomné jednak na povrchu PLT či v membráně jejich granulí, které se podílejí na adhezi a agregaci PLT (tab. 1). Základní aplikace FC v analýze PLT jsou uvedeny v tab. 2 a rozvedeny dále v textu.
Table 1. Nejčastěji využívané znaky PLT. 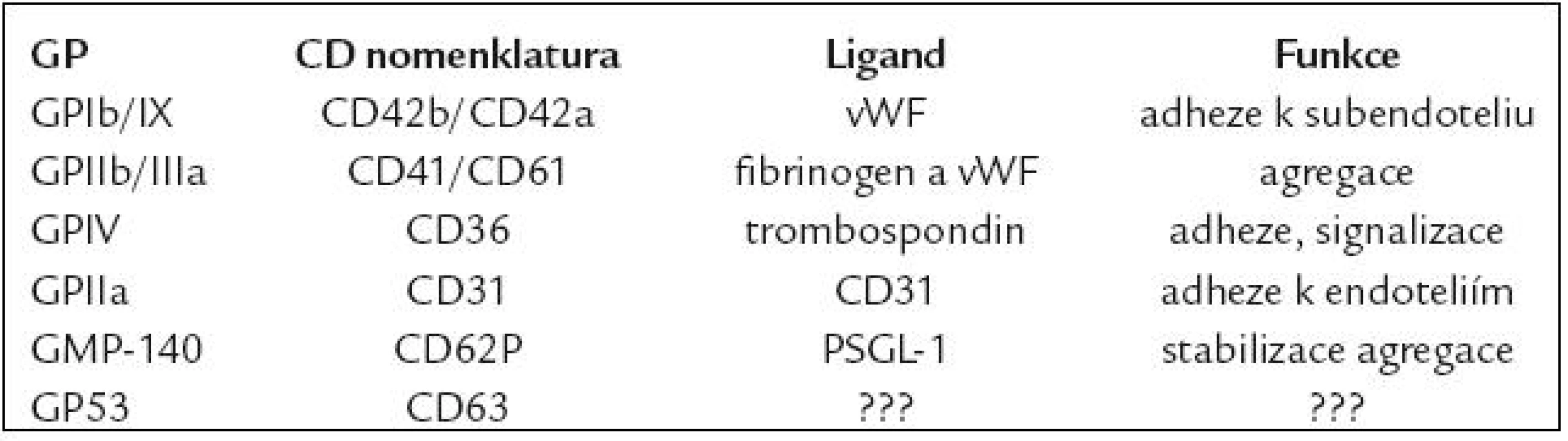
Table 2. Základní možnosti analýz PLT s využitím průtokové cytometrie. 
Nejčastějším materiálem pro analýzy je nesrážlivá periferní krev, přičemž se využívá spíše odběru do citrátu než do EDTA, jelikož u něj téměř nedochází k aktivaci PLT. Je však nutno mít na paměti, že citrát snižuje hladinu iontů vápníku a také ovlivňuje hladinu hořčíkových iontů, proto mohou speciální analýzy vyžadovat použití jiných antikoagulancií. Dle typu analýzy lze pak pracovat s plnou krví, se separovanou plazmou bohatou/chudou na trombocyty, s bezdestičkovou plazmou, ale také lze trombocyty převést do arteficiálního média.
Diagnostika dědičných či získaných defektů PLT
Vrozené deficity či funkční abnormality v expresi GP vedou ke krvácivým stavům – např. Glanzmannova trombastenie (defekt GPIIb/IIIa) či Bernard-Soulierův syndrom (defekt GPIb/IX), ale též další hematologická onemocnění mohou být provázena abnormalitami v expresi GP na PLT [4–6]. FC se uplatňuje nejen v diagnostice vrozených, ale také získaných defektů, kdy bylo publikováno, že v případě získané Glanzmannovy trombastenie je FC dokonce jediným testem schopným charakterizovat jak funkční efekt, tak cílení autoprotilátek namířených proti komplexu CD41/CD61 [7]. Tzv. syndrom šedých trombocytů je charakterizován jako trombocytopenie s chyběním a-granul, a následně tedy s deficiencí P-selektinu (CD62P), přičemž v literatuře byl popsán případ se současnou deficiencí také kolagenového receptoru GPVI [8]. Syndrom Heřmanský-Pudlák se naopak pojí s nepřítomností CD63 na denzních granulích PLT [9]. Flowcytometrická analýza uvedených deficiencí může být prováděna jak v plné krvi, tak v plazmě bohaté na PLT, kdy analýzou potřebných markerů a porovnáním se zdravou kontrolou je jednoznačně určen posun v expresi (obr. 1).
Image 1. Změny v expresi povrchových GP na PLT. 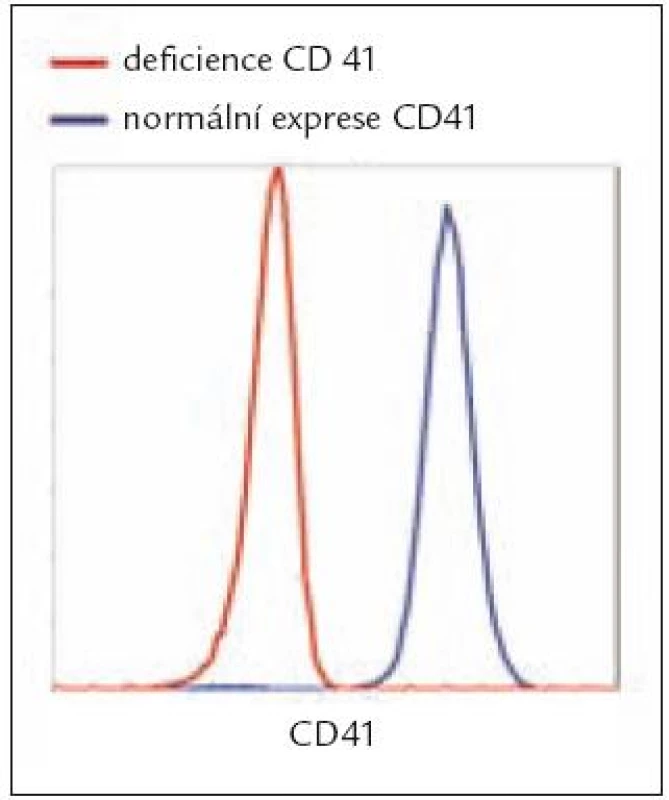
Studium aktivace PLT in vivo
Aktivace PLT je spojena s řadou změnsnadno detekovatelných v plné krvi. Kon-formační změna komplexu GPIIb/IIIa, která může být studována pomocí PAC-1 protilátky, otevírá vazebné místo pro fibrinogen. S aktivací a následnou degranulací se pojí nárůst CD62P uvolněného z a-granul a také nárůst CD63 antigenu lysozomálních/denzních granul, které mohou být detekovány na povrchu PLT [10].
Exprese CD62P vede k interakci s re-ceptorem PSGL-1 leukocytů za vzniku agregátů destiček s leukocyty, které mohou být odhaleny při použití CD45 (či jiného markeru specifického pro určitou leukocytární subpopulaci), a nejlépe markerů CD42a/CD42b [11].
Aktivací PLT také dochází k uvolňování prokoagulačních mikropartikulí (MP), které vznikají derivací plazmatické membrány PLT. Destičkové MP (PMP) nesou na svém povrchu jednak PLT antigeny, ale také negativně nabitý fosfatidylserin či tkáňový faktor apod. Přestože neustále vychází nové práce analyzující absolutní počet PMP, flowcytometrická detekce PMP prozatím nebyla standardizována a každé pracoviště zpracovává a analyzuje vstupní materiál jinými postupy, což pochopitelně vede k jiným výsledkům [12].
Transfuziologické aplikace
Existence autoprotilátek u imunitní trombocytopenické purpury (ITP) a aloprotilátek u potransfuzní reakce vede cestou aktivace komplementu k trombocytopenii způsobené destrukcí PLT. Sérologické postupy jsou schopny detekovat specifické protilátky proti PLT, nicméně v některých případech s nedostatečnou specificitou a senzitivitou. Flowcytometrická analýza imunoglobulinů typu IgM či IgG (u ITP i IgA) asociovaných s PLT je rychlá a efektivní metoda (obr. 2), mělo by však být pamatováno na to, že původní metody (imunofluorescence, ELISA) nenahrazuje, ale doplňuje [13,14].
Image 2. Detekce Ig asociovaných s PLT. 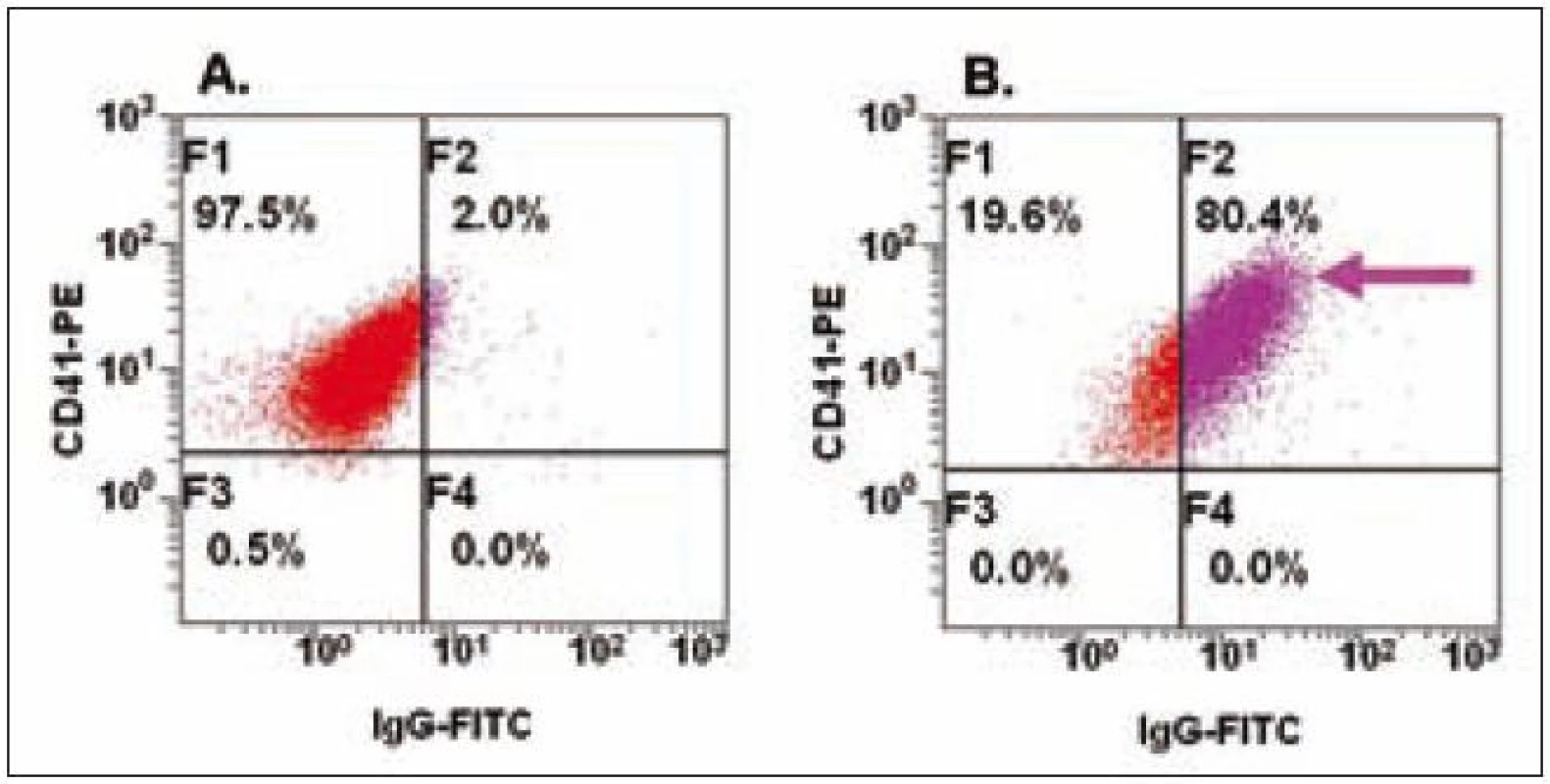
Na obrázku A jsou u zdravé kontroly znázorněny CD41+ PLT bez navázaných protilátek izotypu IgG, zatímco na obrázku B je šipkou u pacienta znázorněna vazba protilátek IgG izotypu. V současné době se v transfuzním lékařství využívá krevních produktů zbavených leukocytů (WBC), což vede ke snížení nepříznivých efektů u pacientů. Množství zbytkových WBC v leukodepletovaném produktu by mělo být nižší než 1 × 106, a právě FC se ukazuje jako vhodná metoda pro analýzu počtu WBC ve srovnání s mikroskopií či dalšími přístupy. Analýza založená na detekci jaderných buněk – vizualizovaných interkalací propidium jodidu – a zhodnocení jejich absolutního počtu pomocí fluorescenčních kalibračních partikulí je vhodná pro rutinní kontrolu kvality transfuzních přípravků [15].
Pro monitorování aktivace PLT v transfuzních přípravcích může být využito dvou skutečností, jednak aktivací vzrůstá exprese CD62P a CD63 a současně by mělo docházet k internalizaci CD42b [16].
Analýza PLT obratu
U pacientů s trombocytopenií je důležité vědět, co způsobuje nízký počet PLT, jelikož se zde uplatňují zejména dva mechanizmy – zvýšená dřeňová produkce se současnou zvýšenou destrukcí PLT v periferii, či snížená dřeňová produkce. Analýzou retikulovaných trombocytů (RP), nově vzniklých nezralých PLT obsahujících zbytkové množství RNA, může být zjištěna příčina trombocytopenie. Přestože existují postupy umožňující analýzu RP pomocí průtokového cytometru, je doporučováno využívat pro tato stanovení automatizovaný hematologický analyzátor, který pracuje objektivně a hlavně stále stejně [17,18]. U silných trombocytopenií, kdy automatické analyzátory mohou nadhodnocovat počet PLT, lze pro přesnou analýzu využít FC detekci za použití specifické monoklonální protilátky a kalibračních fluorescenčních partikulí [19].
Závěr
Trombocyty jsou stále v ohnisku zájmu zejména při studiu procesů zodpovědných za poruchy hemostázy. Vhodně zvolené metody a postupy mohou nejen usnadnit jejich analýzu, ale zejména vést k validním výsledkům dále uplatnitelným na klinické či výzkumné úrovni.
Mgr. Lucie Kovářová, Ph.D.
www.fnbrno.cz
e-mail: lkovarova@fnbrno.cz
Doručeno do redakce: 1. 4. 2010
Sources
1. Brown M, Wittwer C. Flow cytometry: principles and clinical applications in hematology. Clin Chem 2000; 46 : 1221–1229.
2. Gibbins JM, Mahaut-Smith MP. Platelets and Megakaryocytes. New Jersey: Humana Press 2004; 1. vol.: Functional Assays: 225–253.
3. Lindahl TL, Ramström S. Methods for evaluation of platelet function. Transfus Apher Sci 2009; 41 : 121–125.
4. Nurden AT. Glanzmann thrombasthenia. Orphanet J Rare Dis 2006; 1 : 10.
5. Beltrame MP, Malvezzi M, Zanis J et al. Flow cytometry as a tool in the diagnosis of Bernard-Soulier syndrome in Brazilian patients. Platelets 2009; 20 : 229–234.
6. Miller JL. Glycoprotein analysis for the diagnostic evaluation of platelet disorders. Semin Thromb Hemost 2009; 35 : 224–232.
7. Giannini S, Mezzasoma AM, Guglielmini G et al. A new case of acquired Glanzmann’s thrombasthenia: diagnostic value of flow cytometry. Cytometry B Clin Cytom 2008; 74 : 194–199.
8. Nurden P, Jandrot-Perrus M, Combrié R et al. Severe deficiency of glycoprotein VI in a patient with gray platelet syndrome. Blood 2004; 104 : 107–114.
9. Nishibori M, Cham B, McNicol A et al. The protein CD63 is in platelet dense granules, is deficient in a patient with Hermansky-Pudlak syndrome, and appears identical to granulophysin. J Clin Invest 1993; 91 : 1775–1782.
10. Lederbogen F, Baranyai R, Gilles M et al. Effect of mental and physical stress on platelet activation markers in depressed patients and healthy subjects: a pilot study. Psychiatry Res 2004; 127 : 55–64.
11. Barnard MR, Linden MD, Frelinger AL 3rd et al. Effects of platelet binding on whole blood flow cytometry assays of monocyte and neutrophil procoagulant activity. J Thromb Haemost 2005; 3 : 2563–2570.
12. Robert S, Poncelet P, Lacroix R et al. Standardization of platelet-derived microparticle counting using calibrated beads and a Cytomics FC500 routine flow cytometer: a first step towards multicenter studies? J Thromb Haemost 2009; 7 : 190–197.
13. Nishioka T, Yamane T, Takubo T et al. Detection of various platelet-associated immunoglobulins by flow cytometry in idiopathic thrombocytopenic purpura. Cytometry B Clin Cytom 2005; 68 : 37–42.
14. Hézard N, Simon G, Macé C et al. Is flow cytometry accurate enough to screen platelet autoantibodies? Transfusion 2008; 48 : 513–518.
15. Dijkstra-Tiekstra MJ, van der Meer PF, Pietersz RN et al. Multicenter evaluation of two flow cytometric methods for counting low levels of white blood cells. Transfusion 2004; 44 : 1319–1324.
16. Dijkstra-Tiekstra MJ, Pietersz RN, Huijgens PC. Correlation between the extent of platelet activation in platelet concentrates and in vitro and in vivo parameters. Vox Sang 2004; 87 : 257–263.
17. Monteagudo M, Amengual MJ, Muñoz Let al. Reticulated platelets as a screening test to identify thrombocytopenia aetiology. QJM 2008; 101 : 549–555.
18. Saigo K, Sakota Y, Masuda Y et al. Automatic detection of immature platelets for decision making regarding platelet transfusion indications for pediatric patients. Transfus Apher Sci 2008; 38 : 127–132.
19. Kunz D, Höffkes H, Kunz WS et al. Standardized flow cytometric method for the accurate determination of platelet counts in patients with severe thrombocytopenia. Cytometry 2000; 42 : 284–289.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2010 Issue Supplementum 1-
All articles in this issue
- Heparinem indukovaná trombocytopenie při léčbě nízkomolekulárními hepariny u dětí. Je čeho se obávat?
- Lokální intravenózní fibrinolýza u dětí a mladistvých
- Chronická imunitní trombocytopenická purpura – úspěšná léčba protilátkami anti‑CD 20
- Trombocytopenie a koagulopatie u hepatopatie: úvod do problematiky
- Monitorace parametrů koagulace a možnosti jejich ovlivnění u pacientů s jaterní cirhózou před invazivními výkony
- Imunitní trombocytopenie, diagnostika, klasifikace, diferenciální diagnostika
- Terapie imunitní trombocytopenie v graviditě
- Trombocytopenie u pacientů s průkazem antifosfolipidových protilátek nebo s antifosfolipidovým syndromem
- Diferenciální diagnostika trombocytopenie v těhotenství
- Syndrom HELLP – průběh onemocnění a aktivita markerů aktivace endotelu
- Porovnání hladin markerů aktivace endotelu v jednotlivých trimestrech.
- Využití parametru IPF (Immature platelet fraction) v laboratorní diagnostice
- Mikropartikule
- Uplatnění průtokové cytometrie v analýze trombocytů
- Změny laboratorních ukazatelů hemostázy u hepatopatií
- Úvodní slovo
- Ambulantní pacient s nově zjištěnou trombocytopenií
- Diferenciální diagnostika trombocytopenie u kriticky nemocných pacientů
- Trombocytopenie u malignit. Úvod do problematiky: příčiny, prognostický význam, význam pro terapii
- Dysplastické změny megakaryopoézy podle WHO klasifikace 2008
- Trombocytopenie u myelodysplastického syndromu
- Trombocytopenie u pacientů s akutní promyelocytární leukemií
- Využití destičkového lyzátu při kultivacích mezenchymálních kmenových buněk
- Trombocytopenie u novorozence
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Trombocytopenie a koagulopatie u hepatopatie: úvod do problematiky
- Monitorace parametrů koagulace a možnosti jejich ovlivnění u pacientů s jaterní cirhózou před invazivními výkony
- Diferenciální diagnostika trombocytopenie v těhotenství
- Využití parametru IPF (Immature platelet fraction) v laboratorní diagnostice
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

