-
Medical journals
- Career
HIV lipodystrofie
Authors: S. Snopková 1; M. Matýšková 2; K. Povolná 1; P. Polák 1; P. Husa 1
Authors‘ workplace: Klinika infekčních chorob Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MU Dr. Petr Husa, CSc. 2 Oddělení klinické hematologie FN Brno, pracoviště Bohunice, přednosta prof. MU Dr. Miroslav Penka, CSc. 1
Published in: Vnitř Lék 2010; 56(12): 1217-1222
Category: Reviews
Overview
Kombinovaná antiretrovirová terapie vede k mimořádnému snížení morbidity a mortality HIV infikovaných a zásadní změně prognózy onemocnění HIV/ AIDS. Dlouhodobé užívání antiretrovirových léčiv je spojeno se vznikem metabolických a morfologických abnormalit, z nichž některé jsou sdruženy pod nový syndrom – tzv. HIV lipodystrofie. Syndrom HIV lipodystrofie označuje změny metabolické a morfologické. K metabolickým změnám patří dyslipidemie s hypercholesterolemií a/ nebo hypertriglyceridemií, inzulinová rezistence s hyperinzulinemií a hyperlaktatemie. Morfologické změny mají charakter lipoatrofie (úbytek podkožního tuku – na tvářích, na končetinách, na hýždích a nápadná prominence povrchových žil) nebo lipohypertrofie (nárůst tukové tkáně – na hrudníku, v dorzocervikální oblasti, lipomatóza viscerálních tkání a orgánů, akumulace tuku v abdominální oblasti). Některé rysy HIV lipodystrofie jsou velmi podobné metabolickému syndromu u všeobecné populace. Proto tento nový syndrom představuje potenciální možnost pro vznik předčasné aterosklerózy a zvýšení kardiovaskulárního rizika u mladých HIV pozitivních jedinců. V článku jsou zmíněny nejvýznamnější prezentované studie sledující vztah antiretrovirové léčby a kardiovaskulárního rizika. Závěry studií nejsou jednoznačné mimo jiné také proto, že jejich délka je zejména z hlediska aterogeneze krátká. Zdá se, že největší riziko pro akceleraci subklinické aterosklerózy je spojeno s hlubokým imunodeficitem a nízkým počtem CD4+ lymfocytů a floridní nekontrolovanou HIV infekcí s vysokým počtem kopií HIV ‑ 1 RNA aktuálně cirkulujícím v plazmě. Nadále zůstává otevřenou otázkou do budoucna, zdali metabolické a morfologické změny spojené s HIV a cART nesou obdobný a srovnatelný aterogenní potenciál jako u všeobecné populace.
Klíčová slova:
antiretrovirová terapie – HIV lipodystrofie – aterogeneze – kardiovaskulární rizikoÚvod
V roce 2010 uplyne 27 let od průkazu etiologického agens syndromu získaného imunodeficitu (acquired immunodeficiency syndrom – AIDS) – viru lidského imunodeficitu (human immunodeficiency virus – HIV). V říjnu roku 2008 Luc Montagnier se svou spolupracovnicí Francoise Barré Sinoussiovou získali za identifikaci tohoto agens Nobelovu cenu za medicínu.
Od roku 1983, kdy byl virus identifikován, došlo k obrovskému pokroku v oblasti základního výzkumu a k většímu porozumění kinetiky replikace HIV, a tím i k identifikování míst, kde lze zasáhnout účinnou terapií – zabráněním vstupu viru do buňky a jeho fúzi, inhibicí enzymů reverzní transkriptázy, integrázy, virových proteáz a zablokováním maturace viru [1].
Jednotlivá léčiva blokují různá místa replikačního cyklu HIV nebo některé receptory hostitelských cílových buněk. Pro klinickou praxi je v současnédobě k dispozici 28 virostatik s anti-retrovirovu (AR) aktivitou následujících skupin: nukleosi(ti)dové inhibitory reverzní transkriptázy HIV (nucleoside/ nucleotide reverse transcriptase inhibitor – NRTI), nenukleosidové inhibitory reverzní transkriptázy HIV (non nucleoside reverse transcriptase inhibitor – NNRTI), inhibitory HIV integrázy (integrase inhibitor – II), inhibitory HIV proteázy (protease inhibitor – PI) a inhibitory vstupu (entry inhibitor – EI), mezi které patří inhibitory fúze a antagonisté chemokinových koreceptorů CCR5 a CXCR4 [2]. V aktuálním léčebném režimu pacienta je třeba vždy kombinovat nejméně 3 virostatika z nejméně 2 různých skupin. Pro takto sestavený léčebný režim se užívá označení vysoce aktivní antiretrovirová terapie (highly active antiretroviral therapy – HAART). V poslední době se preferuje termín kombinovaná antiretrovirová terapie (combination antiretroviral therapy – cART) [3,4]. Z hlediska moderní farmakoterapie je jiný způsob léčby (monoterapie, dvojkombinace) již neakceptovatelný. Pouze u HIV pozitivních těhotných žen je v některých případech indikována dvojkombinace antiretrovirotik.
Zatímco v 80. letech a v 1. polovině 90. let minulého století většina postižených HIV umírala během několika let, strategií kombinovaných léčebných režimů se podařilo dosáhnout hluboké virové suprese a následné regenerace imunologických funkcí, což vedlo k mimořádnému snížení morbidity a mortality a zásadní změně prognózy nemoci. Náležitě léčené onemocnění HIV/ AIDS je dnes považováno za typicky chronickou chorobu, která se vyvíjí řadu desítek let [4]. Před érou cART byl medián přežití mladých infikovaných lidí 7 let, zatímco v současnosti dosahuje nejméně 35 let [5].
Morfologické a metabolické změny
Krátce po zavedení cART se ukázalo, že léčiva s antiretrovirovou aktivitou jsou spojena se vznikem určitých morfologických abnormalit redistribuce tělesného tuku, které byly definovány jako nové syndromy [6]. V polovině 90. let minulého století byla popsána periferní lipodystrofie (úbytek tuku na tváři, na končetinách, na hýždích) a krátce na to byl definován tzv. smíšený lipodystrofický syndrom jako periferní lipodystrofie a současně přítomná viscerální adipozita.
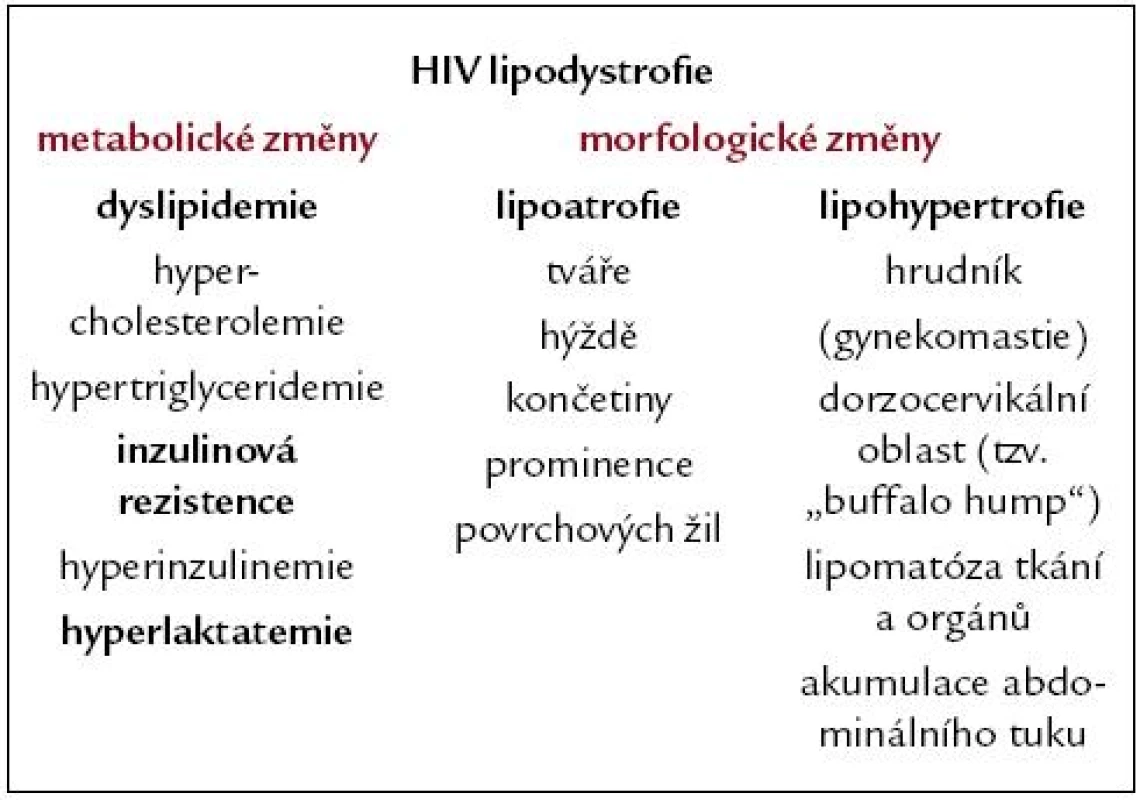
Abnormální redistribuce tělesného tuku může mít charakter lipoatrofie (úbytek podkožního tuku – na tvářích, na končetinách, na hýždích, nápadná prominence povrchových žil) nebo lipohypertrofie (nárůst tukové tkáně – na hrudníku až s obrazem gynekomastie, v dorzocervikální oblasti tzv. „buffalo hump“, lipomatóza viscerálních tkání a orgánů, akumulace tuku v abdominální oblasti) (obr. 1 – 7).
Image 1. Lipoatrofie na hýždích a dolních končetinách. 
Image 2. Lipoatrofie na dolních končetinách. 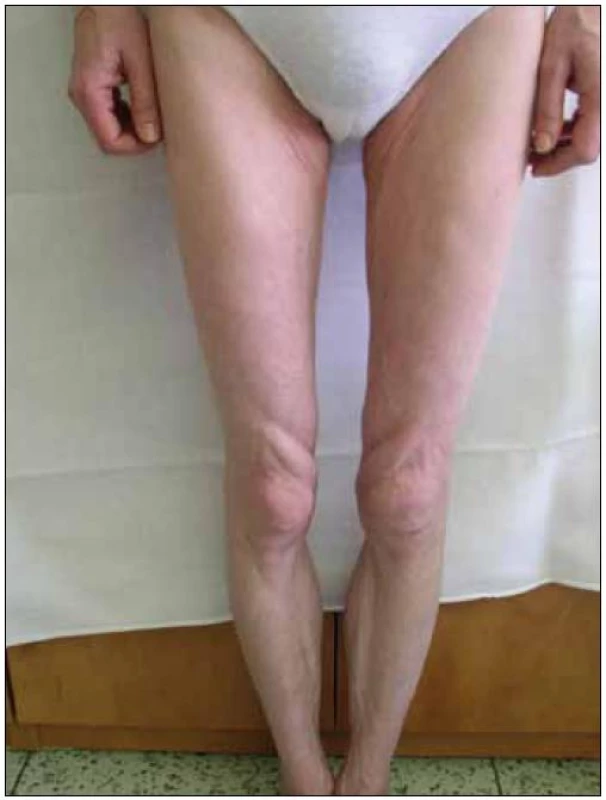
Image 3. Lipoatrofie – prominence povrchových žil na horních končetinách. 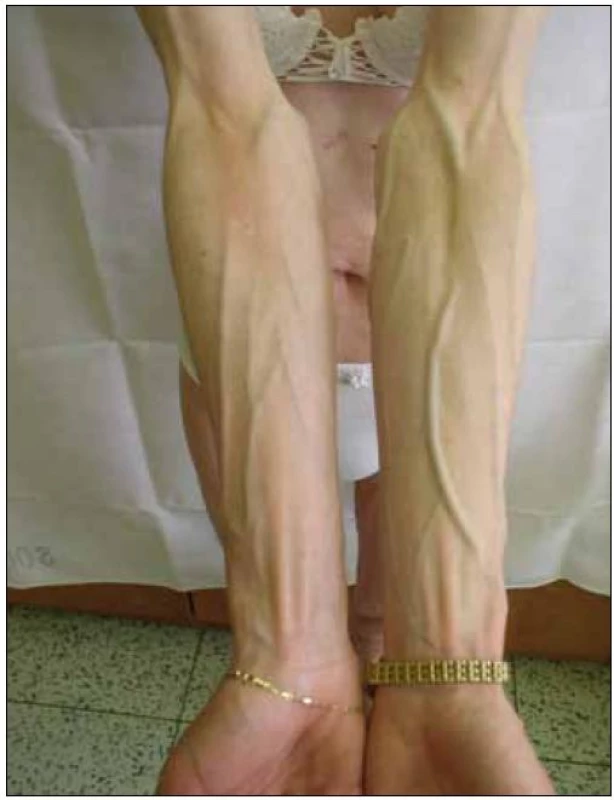
Image 4. Lipoatrofie – prominence povrchových žil na dolních končetinách. 
Image 5. Lipohypertrofie – akumulace tuku v abdominální oblasti. 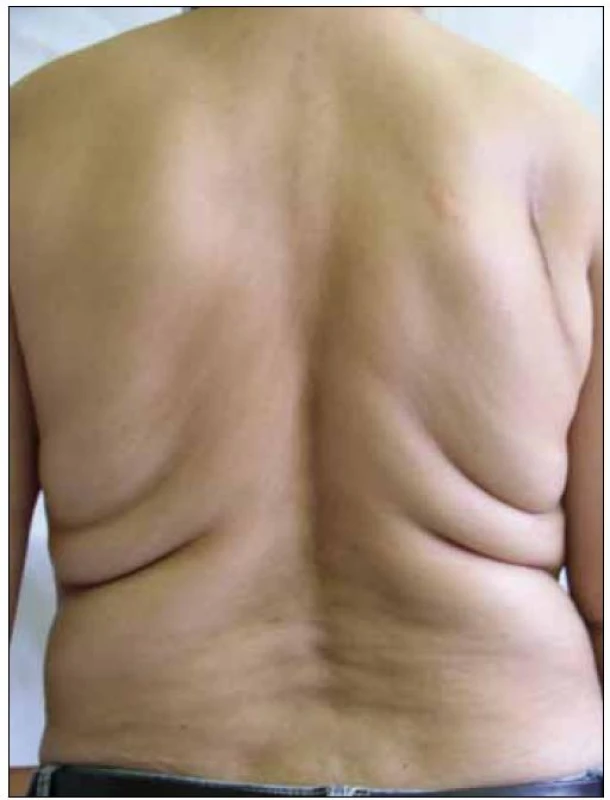
Image 6. Lipohypertrofie – akumulace tuku v abdominální oblasti. 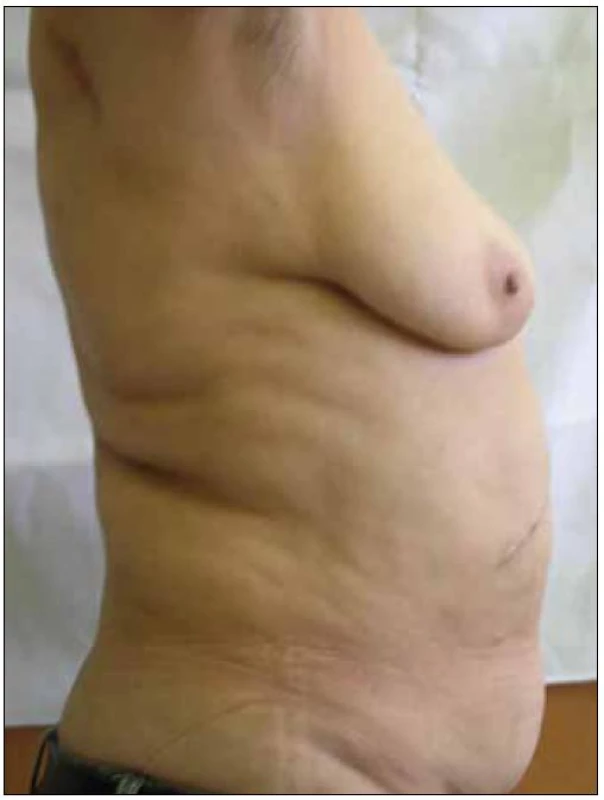
Image 7. Lipohypertrofie na hrudníku a v dorzocervikální oblasti (tzv. „buffalo hump“). 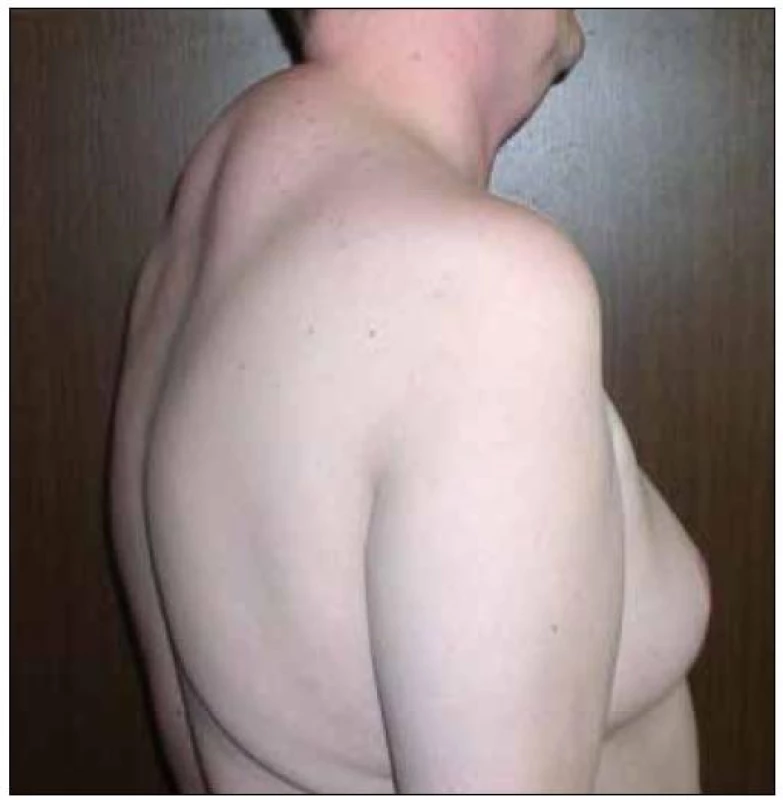
Později byly detekovány také metabolické (dyslipidemie, inzulinová rezistence a diabetes mellitus, vysoké hladiny laktátu, osteopenie, osteoporóza a další) a koagulační změny (vysoké koncentrace některých trombogenních faktorů hemostázy) [7,8]. Morfologické a metabolické změny jsou dnes souhrnně označovány jako HIV lipodystrofie (tab. 1). Množství metabolických a koagulačních jevů spojených s HIV a antiretrovirovou terapií se stále zvyšuje [9]. Proto ani definice HIV lipodystrofie není definitivní. Její prevalence u HIV pozitivních pacientů je uváděna v závislosti na použitých diagnostických kritériích mezi 13 a 84 % [7].
Přesný patofyziologický mechanizmus není stále plně objasněn. S největší pravděpodobností jde o multifaktoriální komplex různých interakcí chronické HIV infekce, geneticky determinovaných faktorů, životního stylu a efektu antiretrovirových léčiv, který se manifestuje již na úrovni nejzákladnějších metabolických cest [10,11]. Na základě studií in vitro byly dosud identifikovány některé možné mechanizmy, které by, jsou li ovlivněny AR léčivy, mohly vést k těmto změnám. Je to např. defektní aktivace a jaderná translokace sterol regulačních proteinů a porucha diferenciace adipocytů, inhibice přenašeče glukózy, proteazomální inhibice, mitochondriální toxicita a další. Tyto patofyziologické procesy nepůsobí izolovaně, ale představují obrovské množství vzájemných interakcí [12].
HIV infekce a metabolický syndrom
Etiologie a kauzální souvislosti HIV lipodystrofie jsou předmětem intenzivního studia a výzkumu. Mimo jiné také proto, že řada jejích stěžejních rysů je velmi podobná metabolickému syndromu (MS) u všeobecné populace a představuje potenciální možnost pro rozvoj předčasné aterosklerózy a zvý-šené kardiovaskulární (KV) riziko u mladých HIV pozitivních jedinců [13].
MS je definován jako cluster rizikových faktorů, které se vyskytují současně častěji, než by vyplývalo z jejich náhodného výskytu. Celkové kardiovaskulární riziko provázející MS je vyšší, než by odpovídalo součtu rizik jeho jednotlivých složek [14].
Kromě léčiv také řada mechanizmů v různých fázích přirozeného vývoje onemocnění HIV/ AIDS a chronické zánětlivé reakce může vést k akceleraci preklinické aterosklerózy a následně ke zvýšení KV rizika.
V kontextu těchto skutečností a průměrného věku HIV infikovaných, který se pohybuje kolem 30 let, by floridní virová replikace i cART mohly potenciálně přinášet některé velmi nepříznivé prognostické faktory. Tato hypotéza byla důvodem k zahájení studií vztahu HIV a cART na následné zvýšení KV rizika u HIV pozitivních.
Léčiva, virus, imunita
Tři základní skupiny antiretrovirových léčiv (NRTI, NNRTI, PI) jsou různými (ne zcela jasnými) mechanizmy spojeny se vznikem abnormalit lipidového spektra, poruch glukózového metabolizmu, koagulace a morfologických abnormalit, které mají potenciálně proaterogenní charakter a mohou ovlivnit míru KV rizika u HIV pozitivních jedinců.
Výsledky dosavadních studií jsou kontroverzní. V jedné studii bylo zjištěno vyšší KV riziko u mladších, ale nižší riziko u starších [15], několik dalších studií zjistilo zvýšení KV rizika a rizika infarktu myokardu u HIV pozitivních bez ohledu na věk [16]. Rozsáhlá observační studie The Data Collection on Adverse Events of Anti HIV Drugs (DAD) prokázala zvýšené riziko infarktu myokardu u pacientů užívajících v kombinovaných režimech nukleosidový inhibitor abacavir [17].
Některé studie naopak neprokázaly žádný vztah mezi antiretrovirovou léčbou a KV rizikem.
V AIDS Clinical Trials Group (ACTG) 5078 studii nebyl nalezen žádný vztah mezi proteázovými inhibitory a akcelerací předčasné aterosklerózy [18]. Obdobný závěr dala i ACTG 5152 studie, kde nejvýznamnější abnormální změny byly nalezeny u pacientů s floridní HIV infekcí, nekontrolovanou HIV replikací a vysokým počtem HIV 1 RNA kopií (viremie, virová nálož) v plazmě ještě před zahájením cART [19].
Multicenter AIDS Cohort Study (MACS) a Women’s Interagency HIV Study (WIHS) zjistily, že progrese subklinické aterosklerózy je u HIV pozitivních neléčených podstatně rychlejší než u pacientů léčených cART. Nebyl zjištěn žádný vztah mezi cART a aterosklerózou. Dokonce se ani nepotvrdila závislost KV rizika na délce užívání cART, zejména proteázových inhibitorů, které byly první skupinou léčiv potenciálně spojenou se vznikem proaterogenního lipidového profilu a akcelerací předčasné aterosklerózy. Jediný signifikantní závěr těchto studií byl, že největší riziko pro urychlení subklinické aterosklerózy a vyšší incidenci KV komplikací je nízký absolutní počet CD4+ lymfocytů pod 200 buněk/ mm3, tedy hluboká insuficience imunitního systému a hluboký imunodeficit [20].
Ve studii Strategies for Management of Antiretroviral Therapy (SMART) byli sledováni a srovnáváni pacienti, kteří užívali cART kontinuálně s pacienty, kteří v určitých cyklech přerušovali cART. Studie byla předčasně ukončena, protože u pacientů s přerušovanou léčbou bylo poměrně rychle po jejím zahájení zaznamenáno signifikantně více KV příhod.
Je možné, že akceleraci subklinické aterosklerózy dominantně ovlivňují jiné, na účinku antiretrovirových léčiv nezávislé mechanizmy. Důležitou roli bude hrát patrně vlastní HIV a s ním spojené imunologické faktory. HIV také indukuje chronickou systémovou zánětlivou reakci, která navozuje zvýšenou koagulaci a endotelovou dysfunkci a ve svém dalším důsledku akceleruje a stimuluje aterotrombogenezu [21 – 23].
Swiss Thai Australia Treatment Interruption (STACCATO) studie prokázala přímý vztah mezi některými biomarkery KV poškození a počtem HIV 1 RNA kopií, který je u neléčené nekontrolované infekce vždy vysoký [24].
Přibývá důkazů, že největší riziko pro vznik KV komplikací (kromě klasických rizikových faktorů) je u pacientů bez cART nebo s přerušovanou cART. To znamená u pacientů s nedostatečnou virovou supresí a vysokým počtem cirkulujících HIV 1 RNA kopií v plazmě.
Nicméně nelze vyloučit, že změny vyvíjející se v souvislosti s cART, mohou být v dalším vývoji potenciálně proaterogenní. Přesto je možné, že jde u HIV pozitivních o odlišný proces. K této úvaze vede skutečnost, že např. periferní lipodystrofie (úbytek periferní tukové tkáně) je jeden z velmi významných rysů HIV lipodystrofie a morfologických změn spojených s cART. Tyto morfologické abnormality však nejsou přítomny u HIV negativních pacientů s metabolickým syndromem.
Také histologické studie plátů v karotických arteriích u HIV infikovaných jedinců ukazují masivní zánětlivou infiltraci cévní stěny, více podobnou arteritidě než klasickému ateromatoznímu plátu. U HIV infikovaných může jít o odlišný fenotyp cévního onemocnění [25,26].
Prediktivní síla dosud prezentovaných studií je však značně omezená. Odlišné závěry jednotlivých studií jsou dány různým designem, různým zastoupením etnických skupin, studie sledují různé markery, jejichž výpovědní hodnota není často jednoznačná, mají odlišně definovaný léčebný režim, většina studií nemá HIV negativní kontrolní skupinu a není randomizovaná, v neposlední řadě délka sledování je zejména z hlediska aterogeneze velmi krátká [19].
Závěr
Rozvoj aterosklerózy je desítky let trvající proces. Obdobně onemocnění HIV/ AIDS, antiretrovirová léčba, počet CD4+ lymfocytů a imunosuprese, počet HIV 1 RNA kopií aktuálně cirkulujících v plazmě, koncentrace různých prozánětlivých mediátorů a biomarkerů je velmi dynamická a v čase proměnlivá kaskáda reakcí a pochodů. CART je k dispozici teprve 12 let, takže její reálné ovlivnění tak komplexních procesů nemůže být zatím dostatečně objektivně zhodnoceno.
Z dosavadních studií vyplývají dva jednoznačné závěry. Tradiční rizikové faktory [18,19,27] jsou pro vznik KV rizika a onemocnění stejně významné jako u HIV negativní populace a včasné zahájení cART vede k restauraci a regeneraci imunitního systému s následným benefitem pro funkci všech tkání a orgánů [19]. S tím také souvisí v současné době převládající tendence k co nejčasnějšímu zahájení cART, kdy počet buněk infikovaných HIV je co nejnižší, nikoli až ve fázi reálně přítomného imunodeficitu [28,29].
V posledních letech je vyvíjena nová generace antiretrovirových léčiv nejen ze skupin NRTI, NNRTI a PI, od které se očekává podstatně menší vliv na metabolické alterace, zejména na lipidové spektrum. Kromě toho jsou do první linie postupně uvolňována léčiva s jinými mechanizmy účinku (inhibitory integráz, inhibitory fúze a další), která byla dříve rezervována výhradně pro tzv. záchrannou terapii pro pacienty, u kterých nebylo možné již sestavit režim z NRTI, NNRTI a PI.
Nadále zůstává otevřenou otázkou do budoucna, zdali metabolické a morfologické změny spojené s HIV a cART nesou skutečně obdobný a srovnatelný aterogenní potenciál a následné kardiovaskulární riziko jako u všeobecné populace.
MU Dr. Svatava Snopková, Ph.D.
www.fnbrno.cz
e mail: svatava.snopkova@fnbrno.czDoručeno do redakce: 31. 3. 2010
Přijato po recenzi: 2. 7. 2010
Sources
1. Staňková M, Skokanová V. Dvacet pět let od objevu viru lidské imunodeficience (HIV). Prakt Lék 2008; 88, 11 : 627 – 629.
2. Sedláček D. Nové léky pro léčbu infekce HIV/ AIDS a revize evropské klasifikace HIV/ AIDS. Prakt Lék 2008; 88 : 643 – 647.
3. Boccara F. Cardiovascular complications and atherosclerotic manifestations in the HIV ‑ infected population: type, incidence and associated risk factors. AIDS 2008; 22 (Suppl 3): S19 – S26.
4. Hammer SM, Saag MS, Schechter M et al. Treatment for adult HIV infection: 2006 recommendations of the International AIDS Society ‑ USA panel. JAMA 2006; 296 : 827 – 843.
5. Lohse N, Hansen AB, Pedersen G et al. Survival of persons with and without HIV infection in Denmark, 1995 – 2005. Ann Intern Med 2007; 146 : 87 – 95.
6. Martinez E, Visnegarwala F, Grund B et al. The effects of intermittent, CD4 - guided antiretroviral therapy on body composition and metabolic parameters. AIDS 2010; 24 : 353 – 363.
7. Balasubramanyam A, Sekhar RV, Jahoor Fet al. Pathophysiology of dyslipidemia and increased cardiovascular risk in HIV lipodystrophy: a model of “systemic steatosis”. Curr Opin Lipidol 2004; 15 : 59 – 67.
8. Grinspoon S, Carr A. Cardiovascular risk and body ‑ fat abnormalities in HIV ‑ infected individuals. N Engl J Med 2005; 352 : 48 – 62.
9. McDermott AY, Terrin N, Wanke C et al. CD4+ cell count, viral load, and highly active antiretroviral therapy use are independent predictors of body composition alterations in HIV ‑ infected adults: a longitudinal study. Clin Infect Dis 2005; 41 : 1662 – 1670.
10. Jemsek JG, Arathoon E, Arlotti M et al. Body fat and other metabolic effects of atazanavir and efavirenz, each administered in combination with zidovudine plus lamivudine, in antiretroviral ‑ naive HIV ‑ infected patients. Clin Infect Dis 2006; 42 : 273 – 280.
11. Sabin CA, Worm SW, Weber R et al. Use of nucleoside reverse transcriptase inhibitors and risk of myocardial infarction in HIV ‑ infected patients enrolled in the D:A:D study: a multi‑cohort collaboration. Lancet 2008; 371 : 1417 – 1426.
12. Snopková S, Povolná K, Husa P. Metabolické komplikace a antiretrovirová léčba. Prakt Lék 2008; 88 : 630 – 634.
13. Hsue PY, Hunt PW, Schnell A et al. Role of viral replication, antiretroviral therapy, and immunodeficiency in HIV‑associated atherosclerosis. AIDS 2009; 23 : 1059 – 1067.
14. Souček M. Metabolický syndrom. Vnitř Lék 2009; 55 : 618 – 621.
15. Grunfeld C, Delaney JA, Wanke C et al. Preclinical atherosclerosis due to HIV infection: carotid intima ‑ medial thickness measurements from the FRAM study. AIDS 2009; 23 : 1841 – 1849.
16. Kingsley LA, Cuervo ‑ Rojas J, Muñoz A et al. Subclinical coronary atherosclerosis, HIV infection and antiretroviral therapy: Multicenter AIDS Cohort Study. AIDS 2008, 22 : 1589 – 1599.
17. Sabin CA, Worm SW, Weber R et al. Use of nucleoside reverse transcriptase inhibitors and risk of myocardial infarction in HIV ‑ infected patients enrolled in the D:A:D study: a multi‑cohort collaboration. Lancet 2008; 371 : 1417 – 1426.
18. Mangili A, Gerrior J, Tang AM et al. Risk of cardiovascular disease in a cohort of HIV ‑ infected adults: a study using carotid intima ‑ media thickness and coronary calcium score. Clin Infect Dis 2006; 43 : 1482 – 1489.
19. Murphy R, Costagliola D. Increased cardiovascular risk in HIV infection: drugs, virus and immunity. AIDS 2008; 22 : 1625 – 1627.
20. Kaplan RC, Kingsley LA, Gange SJ et al. Low CD4+ T ‑ cell count as a major atherosclerosis risk factor in HIV ‑ infected women and men. AIDS 2008; 22 : 1615 – 1624.
21. Hirschel B, Flanigan T. Is it smart to continue to study treatment interruptions? AIDS 2009; 23 : 757 – 759.
22. van Leuven SI, Franssen R, Kastelein JJ et al. Systemic inflammation as a risk factor for atherothrombosis. Rheumatology 2008; 47 : 3 – 7.
23. Maggiolo F, Airoldi M, Callegaro A et al. CD4 cell ‑ guided scheduled treatment interruptions in HIV ‑ infected patients with sustained immunologic response to HAART. AIDS 2009; 23 : 799 – 807.
24. Calmy A, Gayet ‑ Ageron A, Montecucco F et al. STACCATO Study Group. HIV increases markers of cardiovascular risk: results from a randomized, treatment interruption trial. AIDS 2009; 23 : 929 – 939.
25. Maggi P, Maserati R, Antonelli G. Atherosclerosis in HIV patients: a new face for an old disease? AIDS Rev 2006; 8 : 204 – 209.
26. Guillevin L. Vasculitides in the context of HIV infection. AIDS 2008; 22 (Suppl 3): S27 – S33.
27. Sterne JA, May M, Bucher HC et al. HAART and the heart: changes in coronary risk factors and implications for coronary risk in men starting antiretroviral therapy. J Intern Med 2007; 261 : 255 – 267.
28. Levy JA. HIV pathogenesis: 25 years of progress and persistent challenges. AIDS 2009; 23 : 147 – 160.
29. Sarkar I, Hauber I, Hauber J et al. HIV ‑ 1 proviral DNA exciton using an evolved recombinase. Science 2007; 316 : 1912 – 1915.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2010 Issue 12-
All articles in this issue
- Markery funkcie endotelu vo včasných štádiách esenciálnej hypertenzie a účinok antihypertenznej terapie
- HIV lipodystrofie
- Postavení metforminu jako antidiabetika první volby
- Plicní forma histiocytózy z Langerhansových buněk – hodnocení aktivity nemoci a léčebné odpovědi pomocí PET‑CT (indexu SUVmax Pulmo/ SUVmax Hepar). Popis vlastních zkušeností a přehled literatury
- Vliv saturace jódem na výskyt tyreopatií ve vybraných regionech u dospělé populace České republiky
- Aktivita osi hypotalamus- hypofýza- nadoblička u pacientov s reumatoidnou artritídou
- Hodnotenie aktivity 11β- hydroxysteroid dehydrogenázy typu 1 u pacientiek s reumatoidnou artritídou
- Genetické pozadie nádorov kôry nadobličiek – aktuality
- Imunoendokrinní vztahy u nadledvin
- Extrémně nízké hladiny SHBG jako důsledek polymorfizmu Pro156Leu v genu pro SHBG – kazuistiky dvou žen se syndromem polycystických ovarií
- Genetické pozadie nádorov adrenomedulárneho a extraadrenálneho chromafinného tkaniva – aktuality
- Porodní hmotnost a genetické pozadí rizika diabetes mellitus 2. typu u české populace
- Jodový deficit ve světě i v České republice – současný stav a perspektivy
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Extrémně nízké hladiny SHBG jako důsledek polymorfizmu Pro156Leu v genu pro SHBG – kazuistiky dvou žen se syndromem polycystických ovarií
- Plicní forma histiocytózy z Langerhansových buněk – hodnocení aktivity nemoci a léčebné odpovědi pomocí PET‑CT (indexu SUVmax Pulmo/ SUVmax Hepar). Popis vlastních zkušeností a přehled literatury
- Aktivita osi hypotalamus- hypofýza- nadoblička u pacientov s reumatoidnou artritídou
- HIV lipodystrofie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career