-
Medical journals
- Career
Plicní forma histiocytózy z Langerhansových buněk – hodnocení aktivity nemoci a léčebné odpovědi pomocí PET‑CT (indexu SUVmax Pulmo/ SUVmax Hepar). Popis vlastních zkušeností a přehled literatury
: Z. Adam 1; Z. Řehák 2; R. Koukalová 2; P. Szturz 1; T. Nebeský 3; J. Neubauer 3; M. Krejčí 1; L. Pour 1; I. Hanke 4; M. Doubková 5; Z. Merta 5; R. Hájek 1; J. Mayer 1
: Interní hematoonkologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MU Dr. Jiří Vorlíček, CSc. 2 Oddělení nukleární medicíny, centrum PET Masarykova onkologického ústavu Brno, přednosta prim. MU Dr. Karol Bolčák3 Radiolog 1
: Vnitř Lék 2010; 56(12): 1228-1250
: Case Reports
Plicní forma histiocytózy z Langerhansových buněk (Langerhans cell histiocytosis – LCH) se manifestuje dušností a kašlem bez výrazné expektorace, někdy je prvním příznakem spontánní pneumotorax. Nemoc je způsobena vznikem četných granulomů v terminálních bronchiolech, viditelných na CT s vysokým rozlišením (HRCT) jako noduly. V průběhu dalšího vývoje tyto noduly přecházejí přes kavitované noduly do silnostěnných a posléze tenkostěnných cyst. LCH může izolovaně postihovat plíce, nebo může současně postihovat více orgánů. Plicní forma LCH může kontinuálně progredovat, anebo spontánně ustoupit. Léčba je indikována v případech, kdy je postižení plic součástí multisystémového postižení nemocného nebo když je jasná progrese plicního nálezu. Standardním vyšetřením pro dokumentaci progrese nemoci je vyšetření plic pomocí HRCT. Známkou progrese je zvyšování počtu nodularit. Počet nodularit je však velmi obtížně hodnotitelný. Proměřování radioaktivity jednotlivých drobných plicních ložisek (nodularit) metodou PET není pro vysoký počet a malé rozměry nodularit možné. Na našem pracovišti registrujeme 23 pacientů s LCH, plicní forma byla diagnostikována u 7 z nich. U 6 pacientů bylo provedeno celkem 19 vyšetření PET a PET‑CT. Při PET‑CT vyšetření byla použita metoda měření maximální akumulace fluorodeoxyglukózy v definovaném sférickém objemu pravé plíce – SUVmax Pulmo. Aby bylo možné srovnávat jednotlivá vyšetření v čase na stejném i na různých přístrojích, byl pro vyhodnocování plicní aktivity zvolen poměr (index) maximální akumulace fluorodeoxyglukózy v definovaném sférickém objemu pravé plíce (SUVmax Pulmo) ku maximální akumulaci v definovaném sférickém objemu jaterní tkáně (SUVmax Hepar). U 6 pacientů s plicní formou LCH jsme hodnotili index SUVmax Pulmo/ SUVmax Hepar v průběhu vývoje nemoci. Hodnotu indexu jsme porovnávali s ostatními parametry charakterizujícími aktivitu nemoci (s HRCT plic, s funkčním plicním vyšetřením a s klinickým nálezem). Index SUVmax Pulmo/ SUVmax Hepar velmi dobře koreloval s ostatními parametry aktivity nemoci. Klasické hodnocení PET‑CT vyšetření lze použít pro detekci ložisek LCH v kostech, uzlinách a v dalších tkáních, ale ne pro disperzní postižení plicního parenchymu. Velmi slibnou metodou se jeví měření akumulace fluorodeoxyglukózy v definovaném sférickém objemu pravé plíce a vyjádření této aktivity jako poměr SUVmax Pulmo/ SUVmax Hepar. Dle našich prvních zkušeností výsledky této metody dobře korelují s dalšími parametry, které charakterizují aktivitu plicní formy LCH. Jde však o pilotní studii, která vyžaduje dalšího ověření.
Klíčová slova:
histiocytóza z Langerhansových buněk – pneumotorax – emfyzém – PET‑CTÚvod
Plicní forma histiocytózy z Langerhansových buněk (LCH) je vzácné onemocnění. Příznaky plicní formy LCH jsou netypické, kašel, mírné bolesti na hrudníku, případně dušnost a později pneumotorax. Nemoc vzniká ve formě drobných nodularit v plicním parenchymu, které pomalu přecházejí v kavitované nodularity a posléze silnostěnné a slabostěnné cysty. Jejich prasknutí může způsobit pneumotorax. V některých případech může být pneumotorax (vzniklý u mladého člověka) prvním symptomem této nemoci. Uvedené změny struktury plicní tkáně někdy provází i fibrotizace.
Uvedené plicní změny při LCH bývají mylně interpretovány jako plicní emfyzém. Diferenciálně diagnostické znaky emfyzému a plicní formy LCH, viditelné na CT s vysokým rozlišením (high resolution CT – HRCT), rozvádíme v diskuzi.
Diagnostikovat lze tuto nemoc histologickým vyšetřením plicní tkáně odebrané z místa, kde jsou přítomny mikronodularity. Alternativou je bronchoalveolární laváž, ale vyšetření přítomnosti CD1a pozitivních elementů (Langerhansových buněk) ve vzorku bronchoalveolární tekutiny však není dostupné všem pracovištím, která dělají bronchoalveolární laváže.
LCH může být omezená pouze na plicní parenchym, což mívá obvykle lepší prognózu než plicní forma LCH provázená postižením dalších orgánů (mozku, kostí, kůže, lymfatických uzlin).
Po stanovení diagnózy „plicní forma LCH“ stojí lékař před otázkou: Je tato nemoc stále aktivní a mám ji léčit? Nebo mám před sebou již důsledky dříve aktivní LCH a viditelné změny v plicích odpovídající konečné formě dříve aktivní, dnes neaktivní nemoci?
Odpovědi na tyto otázky se hledají velmi obtížně. U pacientů s LCH dochází totiž často ke spontánním remisím nemoci. Proto samotné stanovení diagnózy není současně indikací k zahájení léčby, terapie je indikována až při průkazu progresivního vývoje nemoci.
Zvyšování četnosti nodularit na kontrolních HRCT plic signalizuje progresi. Jenže kvantifikace nodulů je obtížná. Zvětšování stávajících cyst je doběhem dříve aktivního procesu, a proto tyto změny nelze hodnotit jako progresi, byť jsou dobře na HRCT zřetelné.
Dalším záchytným bodem pro rozhodování o aktivitě, a tedy o indikaci léčby, je funkční plicní vyšetření. Jenže to je velmi hrubý ukazatel a nemusí rozlišit, zda jde o důsledek doběhu end stage změn v parenchymu či současné aktivity nemoci.
HRCT a funkční plicní vyšetření však jsou stále jedinými standardně používanými metodami pro hodnocení aktivity a rozhodování o léčbě.
PET CT je metodou velmi přínosnou pro hodnocení aktivity kostních či jiných infiltrátů LCH. Low dose CT zobrazí osteolytické ložiska a PET aktivitu LCH v těchto ložiscích. Pro ložiskové formy LCH je PET CT dnes standardně doporučovanou metodou pro hodnocení aktivity nemoc. U plicní formy LCH jsou však plíce postiženy velkým počtem nodulů o velikosti několika milimetrů, které nelze současným PET CT vyšetřením detekovat jako jednotlivá drobná ložiska, takže nelze použít klasického proměřování aktivity, jak jsme zvyklí z popisů PET CT. Dle přehledu všech publikací o LCH v databázi Medline bylo asi 20 prací věnováno přínosu PET CT hodnocení aktivity LCH a pouze jedna z těchto prací popisuje využití PET CT zobrazení pro hodnocení aktivity plicní formy LCH.
Na Oddělení nukleární medicíny Masarykova onkologického ústavu vyvinuli novou metodu hodnocení aktivity plicní formy LCH s pomocí PET CT vyšetření, jejíž přínos nyní testujeme. Cílem následujícího textu je:
- popsat tuto novou metodu pro hodnocení aktivity plicní formy LCH,
- zhodnotit korelaci této metody hodnocení plicní aktivity LCH s klinickým průběhem nemoci,
- popsat průběh plicní formy LCH u našich pacientů,
- podat přehled současných znalostí o plicní formě LCH,
- přispět obrazovou dokumentací k časnější diagnostice této nemoci.
Plicní formě LCH bylo v české a slovenské literatuře věnováno již hodně publikací [1 – 7]. Ale v české a slovenské literatuře [9 – 31] jsou popsány i další projevy této nemoci a lze z nich stále čerpat poučení o mnohotvárnosti této nemoci.
Pacienti a forma hodnocení aktivy LCH
Charakteristika souboru pacientů
Na našem pracovišti máme evidováno celkem 23 pacientů s LCH, plicní postižení touto nemocí jsme prokázali u 7 z nich, u 6 byla provedena opakovaná PET CT vyšetření. Protože jsou do našeho centra odesíláni pacienti dominantně s kostním či multisystémovým postižením, je pochopitelné, že většina našich pacientů s plicní formou LCH měla současně multisystémové postižení. Pouze jeden pacient byl k nám předán ke sledování z plicního pracoviště s izolovanou plicní formou LCH. Informace o těchto pacientech s hodnocením aktivity plicního procesu podáváme ve formě stručných popisů případů. Základní údaje o pacientech jsou uvedeny v tab. 1.
1. Průběh nemoci u 7 pacientů s plicní formou LCH. 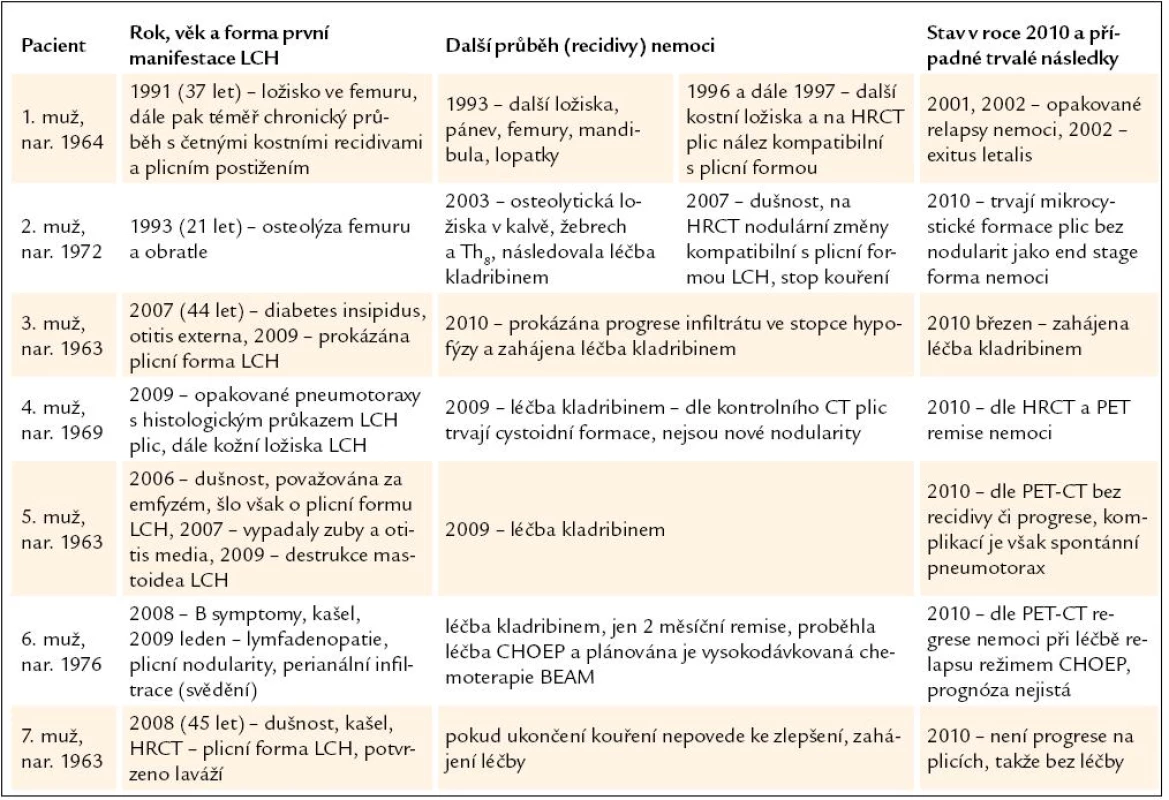
PET a PET CT vyšetření, metodika
Celkem bylo provedeno 19 PET a PET CT vyšetření u 6 nemocných. PET i PET CT vyšetření byla prováděna po 6hodinovém lačnění v euglykemii. Aplikovaná aktivita byla v rozmezí 312 – 409 MBq 18F - FDG i.v. Akumulační fáze byla 60 min. Akvizice byla prováděna na PET skeneru ECAT ACCEL SIEMENS ve 3D modu (3 vyšetření u 1 nemocného v letech 2004 – 2007) nebo později na hybridním PET CT skeneru True Point PET CT Biograph 64 SIEMENS (15 studií u 6 nemocných v letech 2008 – 2010), a to vždy v rozsahu proximální stehna – baze lební, ve 4 případech i se snímáním hlavy. Snímána byla emisní i transmisní data s korekcí absorpce a interaktivní rekonstrukcí dat. Při akvizici na PET CT skeneru je možné použít režim low dose CT (LD CT) nebo high dose CT (HD CT). Vzhledem k opakovaným kontrolám byl ve většině případů zvolen low dose CT protokol, díky kterému jsme výrazně zredukovali radiační zátěž. CT data byla rekonstruována v poli o šíři 500 nebo 700 mm dle habitu pacienta. Parametry LD - CT protokolu byly tyto: slice 5 mm, kolimace 24 × 1,2 mm, faktor stoupání (pitch) 0,8 mm. Parametry HD - CT protokolu byly zvoleny tyto: slice 5 mm, kolimace 24 × 1,2 mm, pitch 0,8 mm. Pro zvýraznění struktur plicního parenchymu byl použit rekonstrukční algoritmus: slice 1,5 – 2,0 mm, kernel B 80 f (ultra sharp), recon. increment 0,4 mm, window – lung.
Míru metabolické aktivity jsme stanovovali semikvantitativní analýzou SUVmax (maximum standardized uptake value) v měřitelné lézi (např. lymfatické uzlině, ložisku).
Vzhledem k tomu, že drobné plicní noduly byly pod rozlišovacími možnostmi PET komponenty hybridního PET CT skeneru (velikost nodulů se obvykle udává kolem 4 – 7 mm a rozlišovací schopnost PET komponenty použitého PET CT přístroje je kolem 7 mm), stanovovali jsme difuzní metabolickou aktivitu v plíci jako orgánu a tuto jsme vztahovali vždy k aktuální metabolické aktivitě referenčního jaterního parenchymu, tedy poměr SUVmax Pulmo/ SUVmax Hepar. Metabolickou aktivitu jsme měřili v horním a středním plicním poli vpravo. V horním i středním plicním poli jsme předpokládali maximum změn u dané diagnózy, navíc v dolním poli dochází k četným pohybovým artefaktům (PET snímání během dýchání, CT v zadrženém středním nádechu), vpravo proto, že se zde oblasti zájmu lépe vymezují (vzhledem k absenci perikardu a srdce) jen s vyloučením hilových struktur a pleury (kde aktivita může být vyšší i fyziologicky). S přihlédnutím k anatomickým poměrům jsme volili objem zájmu VOI (volume of interest) tvaru koule o průměru 6 – 8 cm, v játrech pak 8 – 10 cm. Při stanovení poměru aktivity plicní/ jaterní dochází i ke snížení variability mezi jednotlivými studiemi, a navíc jen tak lze porovnat i měření z různých přístrojů (v našem případě PET a PET CT).
SUVmax Pulmo/ SUVmax Hepar v rozmezí 0,2 – 0,4 jsme označovali jako – (negativní), v rozmezí 0,4 – 0,5 jsme označovali jako + (slabě pozitivní) a od 0,5 a výše jako ++ (pozitivní).
Hodnoty v rozmezí 0,2 – 0,4 zpravidla běžně vídáme u vyšetření bez onkologických i neonkologických plicních chorob, mohli bychom je považovat za fyziologické, ale žádná normálová databáze takto stanovena dosud nebyla. Při zpětné analýze vzorku 100 náhodně vybraných PET CT studií bez známé plicní onkologické nebo i neonkologické choroby jsme zjistili hodnoty menší než 0,3 u 79 % a menší než 0,4 u 96 % studií.
V jediné publikaci, která se do března roku 2010 věnovala přínosu PET CT pro hodnocení plicní aktivity LCH [32], autoři našli nejvíce aktivní ložisko na PET a toto změřili a kvantifikovali SUVmax. Tento způsob vyjádření metabolické aktivity lze považovat v onkologii za konvenční, v našich studiích to nebylo možné provést (vše bylo pod rozlišením PET komponenty přístroje, tak velké a aktivní léze jsme nenacházeli).
Jsme si vědomi, že námi zvolený způsob hodnocení není obvyklý a je při tak malých ložiscích i negativně zatížen tzv. „partial volume“ efektem.
Stručné popisy případů s hodnocením aktivity plicní choroby
1. případ, muž narozený 1964
Velmi komplikovaný průběh měla LCH u muže narozeného v roce 1964. V roce 1991 (ve 37 letech věku) se u něj postupně začala objevovat nová a nová kostní ložiska. Byl léčen chemoterapií, radioterapií a vysokodávkovanou chemoterapií. Osud tohoto pacienta jsme popsali jinde.
Zde chceme jen zdůraznit, že v průběhu léčby bylo pro neproduktivní dráždivý kašel, námahovou dušnost a nespecifické bolesti na hrudníku provedeno vyšetření plic metodou HRCT, na němž byly patrné četné nodularity a cysty. Výsledek byl kompatibilní s plicní formou histiocytózy, vzhledem k multifokálnímu postižení jsme postižení plic nepovažovali za nutné dále histologicky ověřovat. Plicní postižení bylo zřejmě důvodem k opakovaným plicním infekcím v průběhu chemoterapie i po ní. Aktivitu plicní formy jsme u tohoto pacienta nijak cíleně nevyhodnocovali, protože dominovaly subjektivní potíže způsobené recidivujícími kostními atakami, které způsobily četné patologické fraktury. Pacienta jsme ztratili ze sledování roku 2002, kdy byl přijat s další atakou pneumonie na sektorové interní oddělení, kde na tuto infekční komplikaci zemřel. Pitván nebyl.
Tento případ ilustruje, že v případě multiorgánového poškození, které atakuje i plíce, je nutno počítat s vyšším počtem infekčních komplikací v této oblasti.
2. případ, muž narozený 1972
U tohoto pacienta vznikla v roce 1993 (v 21 letech) první ataka LCH, která se projevila bolestí v pravé stehenní kosti a dále v obratli Th12. Osteolytická ložiska byla operována, čímž byla zjištěna diagnóza a léčena operačně alogenními štěpy. Po 10 letech (v roce 2003) nemoc znovu recidivovala. Nově se objevila bolest žeber, páteře. Zobrazovací metody prokázaly nová ložiska na kalvě, velké osteolytické ložisko v 7. žebru vpravo a suspektní ložiska v 4., 5. a 6. žebru. Taktéž bederní obratle byly nově postiženy vícečetnými ložisky. Histologie žebra prokázala recidivu LCH.
Protože zobrazovací metody (RTG snímky, scintigrafie skeletu, CT a MR) prokázaly mnohočetná osteolytická ložiska, přistoupili jsme k systémové chemoterapii. Pacient dostal 5 cyklů chemoterapie (2 - chlorodeoxyadenosin 5 mg/ m2 s.c. 1. – 5. den). Léčba byla ukončena v listopadu roku 2003.
V roce 2007 si nově stěžoval na dušnost a bolest v oblasti hrudního koše. Na provedených zobrazovacích vyšetřeních (scintigrafie skeletu, RTG snímky a PET CT) nebyla zřetelná progrese ve skeletu. Pro dušnost bylo provedeno HRCT vyšetření, které odhalilo cystická plicní ložiska, různé velikosti, místy splývající, ale také četné nodularity i fibrózní proužky. Tyto plicní změny odpovídaly plicní formě LCH (obr. 1 – 3). Mladý muž podstoupil také bronchoskopii s bronchoalveolární laváží, v níž převažovaly makrofágy. Nebylo však provedeno imunohistochemické vyšetření přítomnosti buněk exprimujících CD1 antigen a protein S100 a bez jejich průkazu se nemůže hodnotící vyjádřit k přítomnosti či nepřítomnosti plicní formy LCH, vyšetření však vyloučilo jiné formy plicního poškození. Po edukaci o souvislosti plicní formy LCH a kouření mladý muž přestal kouřit. Subjektivní potíže (kašel a dušnost) se po ukončení kouření zmírnily. Nadále byl kontrolován metodou PET CT, HRCT, RTG snímky a opakovaným funkčním plicním vyšetřením.
Obr. 1. Pacient narozený 1972, HRCT ze dne 27. 8. 2007. Na snímku jsou viditelné četné cystické léze s definovatelnou stěnou. Ložiska splývající v konglomeráty. 
Obr. 2. Pacient narozený 1972, HRCT, ze dne 27. 8. 2007. Nepravidelné nodularity vpravo v horním laloku plicním subpleurálně. 
Obr. 3. Pacient narozený 1972, HRCT ze dne 3. 7. 2009. Na obraze jsou zřetelná četná ložiska nižší denzity bez definovatelné stěny centrilobulárně lokalizovaná, neodlišitelná od centrilobulární formy emfyzému. 
Poslední funkční plicní vyšetření bylo v červnu roku 2009, beze změny.
V červenci roku 2009 bylo provedeno HRCT plic vyšetření se závěrem – zcela diskrétní nodularity, zatímco plicní cysty stále přetrvávají beze změn.
Na posledním kontrolním HRCT vyšetření v lednu roku 2010 je zřetelné další zmnožení cyst, jsou lépe ohraničené, tenkostěnné, oproti minulému vyšetření zřetelně odlišitelné od centrilobulárního emfyzému. Nodularity nebyly na HRCT prokazatelné.
Poslední PET CT proběhlo 26. 2. 2010. Na low dose CT popsána zcela ojedinělá opacita průměru 5 mm. Dalším patologickým nálezem byly četné tenkostěnné cystické formace od 0,5 cm do 1,2 cm s intimním vztahem k jemné cévní kresbě.
Při hodnocení PET obrazu bez ložiska patologického hypermetabolizmu glukózy, a to ani ve skeletu, ani v plicích. Metabolická aktivita v plicích se nadále snižuje. Objektivizováno poměrem SUVmax pravé plíce/ SUVmax referenčního jaterního parenchymu, která byla nyní 0,217, minule 0,286 a před tím vždy 4krát vyšší než 0,4. Zatím tedy nejnižší dosažená hodnota.
Hodnocení aktivity plicní formy LCH
Současnou aktivitu LCH v plicích hodnotíme na základě HRCT plic, PET CT a funkčního plicního vyšetření:
- na HRCT nebyly v roce 2009 již zřetelné tak četné nodularity jako při stanovení diagnózy v roce 2007. V roce 2010 dokonce již nebyla na HRCT viditelná žádná nodularita.
- poměr SUVmax Pulmo a SUVmax Hepar je stabilně klesající (tab. 2),
- výsledky funkčního plicního vyšetření jsou po sledovanou dobu bez zásadních výchylek.
2. Vývoj plicní aktivity při PET-CT vyšetření u 2. pacienta, nar. 1972. 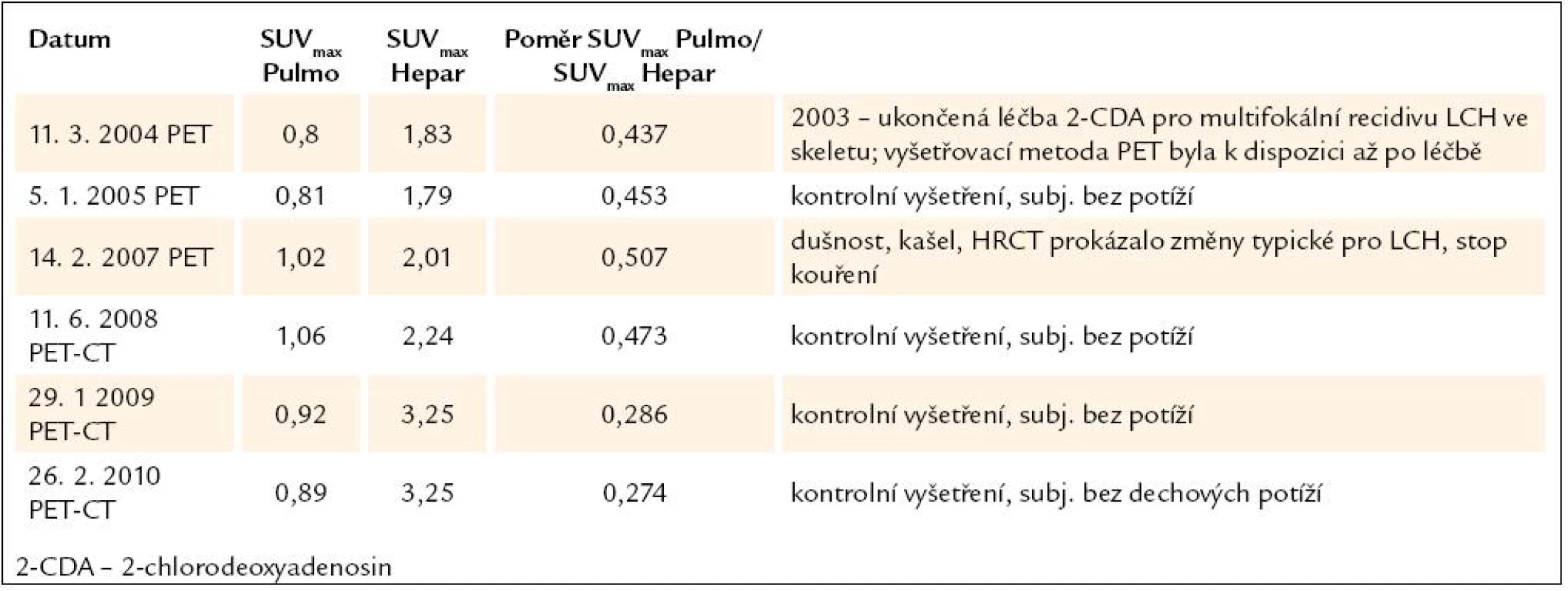
Tato vyšetření by odpovídala neaktivní plicní formě LCH s přetrvávajícími cystickými změnami po dříve proběhlé atace plicní formy LCH.
3. případ, muž narozený 1974
Tento muž (kuřák) byl zdráv až do prosince roku 2007 (33 let věku), kdy u něj byl prokázán diabetes insipidus a i deficit dalších hormonů, dominantně androgenů. Na MR mozku byla zřetelná rozšířená stopka hypofýzy s patologickým infiltrátem. Od roku 2007 se také datuje chronický zánět v oblasti obou zvukovodů, který nebyl histologicky vyšetřen, byť je to typický projev LCH. Dalším problémem bylo svědění kůže v oblasti perianální. V rámci diferenciální diagnostiky infiltrace stopky hypofýzy jsme provedli první PET CT vyšetření (duben roku 2009). V oblasti plicního parenchymu byly prokázány v low dose CT obraze četné drobné cystické útvary různého tvaru, velikosti od 0,8 do 0,9 cm, některé s poměrně dobře vyznačenou stěnou. Současně ojedinělé menší acinární opacity a okrsky zesíleného intersticia. Pleurální prostor bez výpotku. V mediastinu nebyly zvětšené uzliny (obr. 4 a 5). V PET obrazu byla jedině zvýšená kumulace radioaktivní glukózy v oblasti nazofaryngu, ale jen hraniční, jinak nebylo nalezeno nic patologického.
Obr. 4. Pacient narozený 1974, HRCT dne 29. 10. 2009. Shluk cyst s definovatelnou stěnou v horním laloku plicním, nodularity nepřítomny. 
Obr. 5. Pacient narozený 1974, HRCT dne 11. 2. 2009. Shluk cyst s definovatelnou stěnou v horním laloku plicním s nodularitami. 
Na HRCT vyšetření provedeném v únoru roku 2009 byly patrné vícečetné shluky drobných cystoidů s vcelku tenkou pravidelnou stěnou, tyto kavitace se nacházejí i samostatně. Výskyt je v relativně typické lokalitě horních laloků a proximálních segmentů laloků dolních. Obraz byl typický pro plicní formu LCH. Na kontrolním vyšetření v odstupu 1/ 2 roku se nález nemění.
U pacienta byla proto provedena bronchoalveolární laváž s průkazem 10 % CD1 pozitivních elementů obsahujících protein S - 100. Tento nález odpovídal plicnímu postižení LCH, aktivní nemocí.
Kontrolní HRCT bylo provedeno v říjnu roku 2009, zobrazilo vícečetné drobné cysty do velikosti 8 mm, cysty měly tenkou stěnu. Mimo jedné drobné mikronodularity nebyly žádné další mikronodularity zastiženy. Funkční plicní vyšetření bylo v říjnu roku 2009 bez patologických změn.
V PET obrazu nebylo 26. 2. 2010 nalezeno ložisko patologického hypermetabolizmu glukózy, v plicním parenchymu je aktivita nepatrně vyšší, ale zatím ji nemůžeme považovat za patologickou. V březnu roku 2009 bylo naměřeno SUVmax pravé plíce/ SUVmax jater 0,212 a nyní to bylo 0,274.
V prosinci roku 2009 bylo provedeno kontrolní MR mozku. Při srovnání s předchozími MR z března roku 2008 a prosince roku 2008 bylo patrné, že stále chybí typický hyperintenzivní signál neurohypofýzy. Adenohypofýza měla normální velikost bez zřetelného ložiska. Bobulovitě rozšířené infundibulum se oproti předchozí kontrole zvětšilo o 1 mm z 4,5 na 5,5 mm. Výraznější bylo i sycení ložiska postkontrastně a jeho demarkace vůči proximální části stopky. Jako vedlejší nález popsáno drobné necharakteristické ložisko 3 mm paraventrikulárně vlevo, které dříve nebylo viditelné při MR zobrazení mozku.
Vzhledem k progresi nálezu v oblasti CNS byla v březnu roku 2010 zahájena léčba 2 - chlorodeoxyadenosinem.
Hodnocení aktivity plicní formy LCH
U tohoto pacienta byly v low dose CT, ale i HRCT popsány cysty i acinární opacity a víme, že bronchoalveolární laváž u něj prokázala přítomnost pro LCH patognomonických buněk. Na kontrolním HRCT se nález nemění, ale poměr SUVmax Pulmo/ SUVmax Hepar mírně narůstá (tab. 3). Domníváme se, že v tomto případě se jedná o stále mírně aktivní LCH s mírnou progresí jak v oblasti plic, tak i v oblasti infundibula hypofýzy. Tč. probíhá chemoterapie, a tak uvidíme, jaká bude po chemoterapii změna v PET aktivitě plicního parenchymu a jak se změní obraz infiltrace hypofýzy.
3. Vývoj plicní aktivity při PET-CT vyšetření u 3. pacienta, nar. 1974 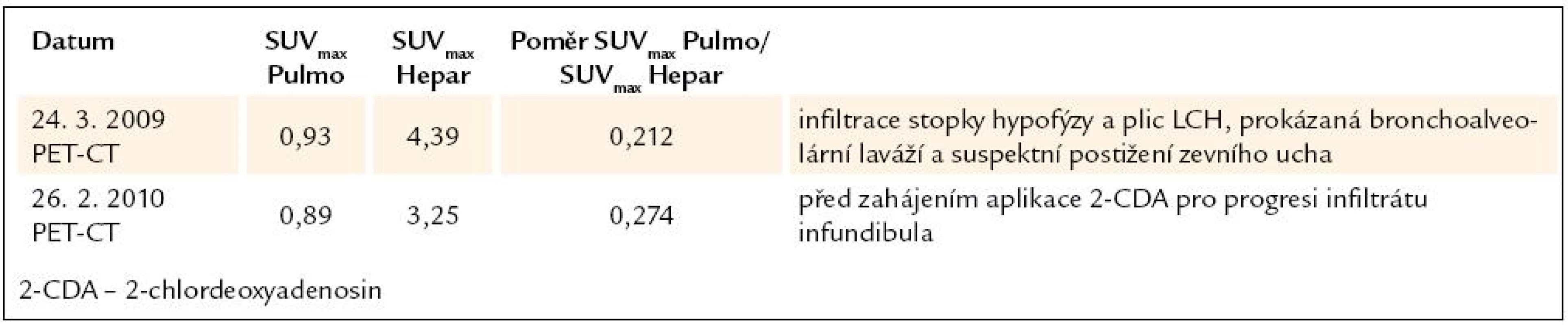
4. případ, muž narozený 1969
Ani tento muž nemá v anamnéze žádné vážnější nemoci. První pneumotorax jej překvapil v roce 2008 (ve 39 letech věku) a od té doby byl sledován na plicní klinice. Pneumotorax s nutností léčebné intervence se celkem 3krát opakoval. Teprve po 3. spontánním pneumotoraxu bylo rozhodnuto o provedení biopsie plic. Ta na základě histologického hodnocení vzorku plicního parenchymu prokázala LCH. V červenci roku 2009 byla provedena kožní excise ze kštice pro makulopapulózní vyrážku. Překvapením byl průkaz kožní formy LCH. Později byla kožní ložiska potvrzena i v intertriginózních oblastech axil, třísel i na hrudníku.
Při HRCT plic v květnu roku 2009 se zobrazily oboustranně v plicních křídlech četné splývané dutiny se zesílenou stěnou 1 – 2 mm a septy. Maximum těchto změn bylo v horních lalocích pod ventrální stěnou hrudníku a dále difuzně v dolních lalocích. Cystoidy jsou různé velikosti od několika mm až po 3 cm, mají splývající charakter a vytváří obraz hnízd. Bez patrných nodularit v plicních křídlech. Mediastinum nebylo rozšířené a uzliny nebyly zvětšené (obr. 6 a 7).
Obr. 6. Pacient narozený 1969. HRCT dne 22. 5. 2008 a 7. 12. 2009. Splývající silnostěnné cysty v konglomeráty. Tyto cysty byly důvodem ke vzniku spontánních pneumotoraxů. 
Obr. 7. Pacient narozený 1969, HRCT dne 7. 12. 2009. Splývající silnostěnné cysty v konglomeráty a byly zřejmě důvodem opakovaných pneumotoraxů. 
Na kontrolním vyšetření s odstupem 1/ 2 roku se rozsah onemocnění zásadně nemění, dochází k splývání cystoidů, dnes spíše tenkostěnných. Nadále jsou šetřeny brániční úhly.
20. 5. 2009 bylo provedeno PET CT s nálezem mnohočetných bul s maximem v horních a středních polích. Fluorodeoxyglukóza se akumulovala mírně jedině v oblasti infrahyoidní.
Funkční plicní vyšetření: středně těžká restriktivní ventilační porucha (inspirační vitální kapacita 2,51 = 47 % náležité hodnoty a TLC – total lung capacity 5,15 = 68 % náležité hodnoty).
V tomto případě jsme měli před sebou pacienta s postižením dvou orgánů, kůže a plic.
V dubnu roku 2009 byla proto zahájena léčba 2-chlorodeoxyadenosinem v kombinaci s cyklofosfamidem a dexametazonem, podáno celkem 6 cyklů léčby, poslední v září roku 2009. Došlo ke zmírnění kožních projevů, které byly v oblasti axil, ale i ve vlasaté části hlavy. Reziduální kožní projevy byly vyléčeny metodou PUVA.
Další kontrolní PET CT vyšetření bylo provedeno v březnu roku 2010. Při low dose CT opět byly zřetelné mnohočetné cystoidní formace v plicním paren-chymu, při srovnání s předchozím vyšetřením bylo zřetelné splývání bul ve větší formace. V PET obrazu bez ložisek akumulace fluorodeoxyglukózy, akumulace v plicním parenchymu se snižuje, SUVmax poměr plíce/ játra je jen 0,221, minule byl 0,570.
Hodnocení aktivity plicní formy LCH
Toho času výsledky HRCT a PET CT kontrol odpovídají neaktivní nemoci, pacient je sice limitován cystickou změnou parenchymu, ale plicní forma LCH již zřejmě není aktivní, protože nejsou zřetelné nodularity na HRCT, a dle PET CT hodnocení se taktéž snižuje difuzní aktivita v plicním parenchymu (tab. 4).
4. Vývoj plicní aktivity při PET-CT vyšetření u 4. pacienta, nar. 1969. 
5. případ, muž narozený 1963
Prvním problémem tohoto nemocného byla dušnost, a to taková dušnost, že vedla k hospitalizaci na interním oddělení v roce 2006 (ve 43 letech věku). Nějakou dobu před tím mu začaly vypadávat zuby, příčina nebyla rozpoznána, infiltrace gingivy a někdy i čelisti a uvolňování zubů jsou také typickým projevem LCH, ale pokud stomatolog o tomto projevu LCH vůbec neví a neodešle kousek tkáně na histologii, tak nemoc dále pokračuje. Tak tomu bylo i v tomto případě, příčina vypadávání zubů nebyla zubním lékařem rozpoznána.
Podobně dopadl výsledek vyšetření plicními specialisty, jejich diagnostický závěr – rozedma plic – neodpovídal pravdě.
A tak tento muž chodil na kontroly ke svým spádovým plicním specialistům, aniž by byla LCH u něho lékaři rozpoznána.
Asi od počátku roku 2008 se přidalo mokvání a výtok z ucha. Byl opakovaně ošetřován na ORL ambulanci v místě bydliště a opět bez histologického zkoumání procesu.
Koncem roku 2008 byl předán na Kliniku otorinolaryngologie a chirurgie hlavy a krku LF MU a FN u sv. Anny v Brně, kde mu udělali CT vyšetření lební baze. Vlevo bylo zastření zevního zvukovodu s destrukcí jeho dorzální stěny v rozsahu kolem 8 mm s rozpadovou dutinkou v procesus mastoideus velikosti 2 cm, která byla totálně zastřená. Porušeno bylo kostní ohraničení kraniální části svislého úseku canalis nervi facialis. Kostní ohraničení struktur vnitřního ucha včetně polokulovitých kanálků se zdálo být zachovalé. Rozrušena byla i dorzální stěna středouší, ventrální kortika procesus mastoideus a v krátkém úseku i přední hrana pyramidy v sousedství Eustachovy trubice. Stručně řečeno – rozsáhlý destruktivní proces levé pyramidy.
ORL specialisté tak stáli před otázkou, zda se jedná o zánět, či tumor. Odpověď na tuto otázku přineslo histologické vyšetření resekátu patologických tkání. Byla to LCH.
V rámci pátrání po rozsahu nemoci byla provedena následující vyšetření:
HRCT plic 17. 3. 2009 – difuzní postižení plicního parenchymu – mnohočetné silnostěnné formace bilaterálně o velikosti 3 – 80 mm, rozložení bylo náhodné, kostofrenické úhly byly šetřeny. Cysty splývaly a byla zřetelná voštinovitá struktura plic s podílem fibrózních změn. Dále byly patrné drobné nodularity v plicním parenchymu a subpleurálně. Bylo zřetelné zesílení nástěnné pleury dorzobazálně bilaterálně (obr. 8).
Obr. 8. Pacient narozený 1963, HRCT dne 16. 3. 2009 a 25. 1. 2010. Silnostěnné cysty v horním laloku plicním, drobná nodulace. 
Při vyšetření scintigrafie skeletu dne 5. 1. 2009 byla aktivita jedině v oblasti levého procesus mastoideus.
V březnu roku 2009 bylo provedeno také PET CT. Low dose CT vyšetření potvrdilo patologické změny plicního parenchymu a PET zobrazení hraniční akumulaci 18flurodeoxyglukózy v oblasti levého středního ucha – v defektu po antromastoidektomii.
Kontrolní PET CT vyšetření bylo provedeno 28. 8. 2009, na něm již nebyla akumulace fluorodeoxyglukózy v oblasti levého ucha a ubylo nodularit v plicním parenchymu.
Spirometrické vyšetření: restriktivní porucha mírného stupně, inspirační vitální kapacita byla 3,66 = 70 % náležité hodnoty, TLC – total lung capacity 4 = 65 % náležité hodnoty.
Léčba: vzhledem k postižení dvou orgánů – plic a ORL oblasti – použita radioterapie na oblasti levého ucha v dávce 20 Gy a celková chemoterapie 2 - chlorodeoxyadenosinem v monoterapii 5 mg/ m2 5 dní po sobě, celkem 6 cyklů.
Poslední PET CT kontrola proběhla v březnu roku 2010. Nově v levé dutině čelistní hyperplastické změny šíře 23 mm (sinusitida), stav po antromastoidektomii v oblasti levé pyramidy s pooperačním defektem neměnného charakteru. Low dose CT popsalo stacionární obraz sledovaných kavit v obou plicních křídlech, ale nyní bez ložiskových nodularit v plicích, které byly zřetelné na předchozích snímcích. Při PET zobrazení bez patologické akumulace radiofarmaka. I přes nepřítomnost zřetelné aktivity nemoci však došlo v březnu roku 2010 k opakování pneumotoraxu, který vyžadoval hospitalizaci na chirurgii.
Hodnocení aktivity plicní formy LCH
Na kontrolním HRCT, provedeném v lednu roku 2010, trvaly mnohočetné cystoidní změny plicního parenchymu, v mezidobí se některé cysty lehce zvětšily, jejich charakter byl však stejný. Nadále jsou patrné nepravidelné, ojedinělé, drobné nodularity, jejich množství je oproti minulému vyšetření menší. SUVmax poměr plíce/ játra je jen 0, 380, před léčbou byl 0,572.
Dle HRCT i PET CT dochází k poklesu plicní aktivity LCH (tab. 5).
5. Vývoj plicní aktivity při PET-CT vyšetření u 5. pacienta, nar. 1963. 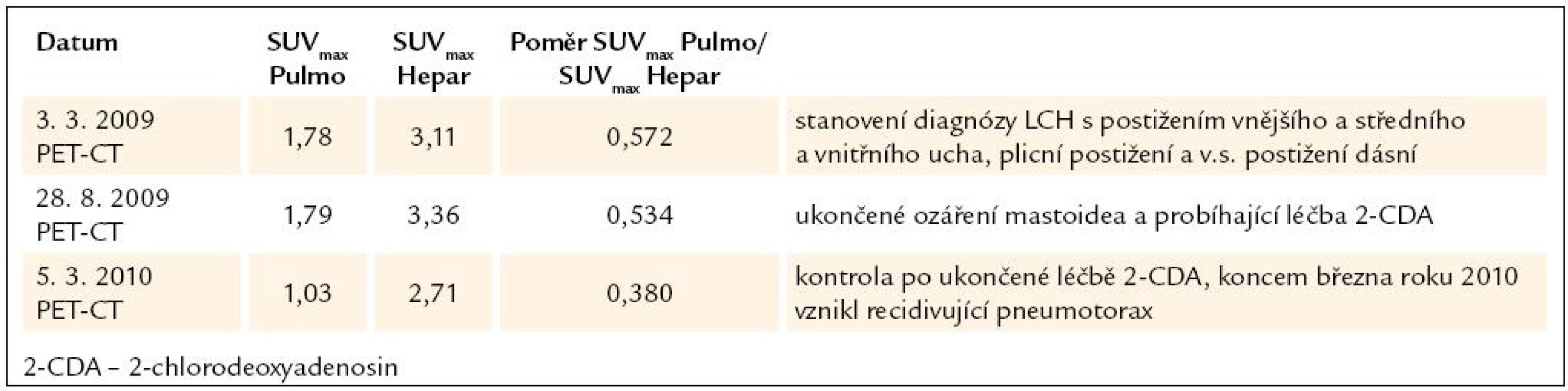
6. případ, muž narozený 1973
Tento muž byl bez vážnějších chorob až do října roku 2008 (do 35 let věku), kdy si poprvé všiml zvětšených uzlin v oblasti pravého třísla a postupně zjišťoval, že zvětšené uzliny má nejen v třísle, ale také na krku. Měl bolesti v oblasti pravého třísla a bederní krajiny a od listopadu roku 2008 se začaly objevovat undulující teploty dosahují až 38 °C. První uzlina (z nadklíčku) byla exstirpována v listopadu roku 2008 a histologický závěr zněl histiocytóza z Langerhansových buněk. První návštěva pacienta na našem pracovišti byla v únoru roku 2009. V té době měl generalizované zvětšení uzlin na krku, axilách a v tříslech, velikosti kolem 2 cm.
Dle vstupního PET CT bylo v CT obrazu zřetelné patologické zvětšení uzlin na krku, v axilách, dále v oblasti dutiny břišní, retroperitoneálně a v malé pánvi, kde byla naměřena největší velikost uzliny 3,5 cm v průměru. Tyto uzliny byly aktivní i při PET zobrazení, aktivita se pohybovala mezi 5,0 SUVmax v axilách a 12,3 SUVmax v oblasti pravých ilických uzlin. Kostní postižení nebylo v té době detekováno dle low dose CT. Při PET CT vyšetření byly v plicích popsány miliární stíny, tedy známky plicní formy LCH (obr. 9). Klinický obraz zcela jednoznačně svým průběhem odpovídal malignímu lymfomu či lymfogranulomu. S generalizovaným postižením uzlin bez výrazného postižení dalších tkání jsme se zatím u pacientů s LCH nesetkali. Proto jsme diagnózu ověřili odebráním další uzliny z třísla a dále byla provedena biopsie perianální kůže. Jak v tříselné uzlině, tak v perianální kůži byla nalezena infiltrace LCH.
Obr. 9. Pacient nar. 1973, HRCT dne 5. 11. 2009 a 28. 1. 2010. Drobné cysty a nodularity – patognomonický obraz LCH. 
Vzhledem k agresivní formě nemoci jsme se rozhodli pro provedení sběru periferních kmenových buněk po stimulačním režimu obsahujícím etoposid a cyklofosfamid, protože další léčba 2 - chlorodeoxyadenosinem by výrazně snížila vyhlídky na úspěšný sběr. Ihned po podání této chemoterapie ustaly teploty a došlo k výraznému zmenšení uzlin. Pak následovala chemoterapie 2 chlorodeoxyadenosin 5 mg/ m2 5 dní po sobě, cyklofosfamid 300 mg 5 dní po sobě a solumedrol 250 mg, celkem 6 cyklů, chemoterapie byla ukončena dne 26. 8. 2009. Pro vyhodnocení účinnosti léčby bylo po 4 cyklech provedeno v pořadí 2. PET CT vyšetření. Bylo konstatováno, že ubylo miliárních stínků na plicích a dále lymfatické uzliny již byly normální velikosti. V PET obraze došlo k normalizaci původně zvýšené akumulace fluorodeoxyglukózy. Další kontrolní PET CT vyšetření mělo být s odstupem za delší dobu až po ukončení léčby.
Jenže 5. 11. 2009 byl pacient přijat pro akutní zhoršení stavu (dušnost, teploty) k diferenciální diagnostice, zda se jedná o infekční či neoplastický původ těchto potíží. V pořadí 3. PET CT vyšetření prokázalo v low dose CT obrazu stále nezvětšené lymfatické uzliny, novinkou však byla osteolytická ložiska v kostech kyčelních, dříve nedetekovaná. PET vyšetření však již odpovídalo relapsu nemoci v doposud nezvětšených uzlinách a nově byl zřetelný na PET i CT obraze relaps v kyčelních kostech (obr. 10).
Obr. 10. PET-CT u muže narozeného 1973 s průběhem nemoci podobným lymfomu a s plicním postižením. Na prvním obrázku vlevo vyšetření před léčbou, je velmi dobře zřetelná patologicky zvýšená aktivita v oblasti krčních, axilárních, ilických a tříselných uzlin, ale nebylo zřetelné poškození kostí. Na prostředním obrázku, který byl proveden v době relapsu dva měsíce po ukončení léčby 2-chlorodeoxyadenosinem, je zřetelná patologicky zvýšená aktivita v oblasti krčních uzlin a dále v oblasti lopat kostí kyčelních, kde na low dose CT byla prokázána osteolytická ložiska. Na obrázku vpravo je vyhodnocení účinnosti léčby po dvou cyklech CHOEP a zde není zřetelná žádná patologická akumulace flurodeoxyglukózy. 
Současně bylo provedeno také HRCT vyšetření, kde byly popsány četné drobné nodularity, místy se již u některých uzlů vytvořily kavitace, a to v horních a středních lalocích. Kostofrenické úhly byly šetřeny. Patologická infiltrace pánve byla potvrzena i na MR obrazu.
Pro velmi časnou recidivu nemoci jsme tedy zahájili chemoterapii CHOEP.
Pro časné vyhodnocení léčebné účinnosti této chemoterapie bylo provedeno po 2 cyklech kontrolní PET CT vyšetření (26. 1. 2010). Low dose CT vyšetření zobrazilo přetrvávající mnohočetné nodularity v oblasti plic do 8 mm, které nabývají cystoidní vzhled. Ve srovnání s vyšetřením z listopadu roku 2009 mírná progrese velikosti opacit. V kostech kyčelních trvají osteolytické defekty. V PET zobrazení již nebyla zřetelná žádná ložiska patologického hypermetabolizmu, která byla zřetelná na předchozím PET zobrazení. To signalizuje chemosenzitivitu nemoci. Tč. má pacient ukončenou léčbu vysokodávkovanou chemoterapií BEAM s autologní transplantací.
Hodnocení aktivity plicní formy LCH
U tohoto pacienta jsme v první fázi věnovali pozornost uzlinové formě nemoci, plicní postižení nedominovalo. Nicméně již při prvním vyšetření v lednu roku 2009 byly na HRCT četné nodularity, takže aktivní plicní choroba. Při kontrole v průběhu léčby 2 chlorodeoxyadenosinem sice poměr SUVmax Pulmo/ SUVmax Hepar mírně poklesl, ale dnes zpětně vidíme, že tento pokles byl méně výrazný v průběhu léčby 2 chlorodeoxyadenosinem než při léčbě etoposidem (tab. 6) a vizuální korelaci zobrazení plic pomocí PET-CT a index SUVmax Pulmo/ SUVmax Hepar přináší obr. 11.
6. Vývoj plicní aktivity při PET-CT vyšetření u 6. pacienta, nar. 1973. 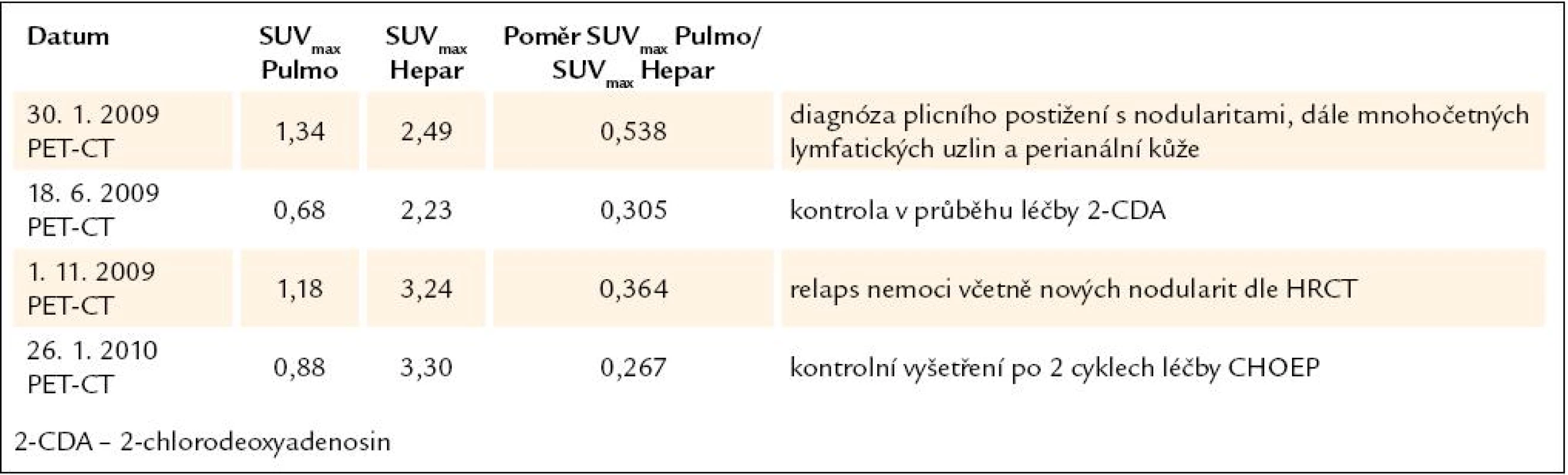
Obr. 11. Korelace PET-CT plic a indexu SUV<sub>max</sub> Pulmo/SUV<sub>max</sub> Hepar před léčbou, po 4 cyklech léčby 2-chlorodeoxyadenosinem, dále v době relapsu nemoci a po dvou cyklech léčby relapsu režimem CHOEP (cyklofosfamid, etoposid, adriamycin, vinkristin a prednison). 
U tohoto pacienta zcela zřetelně odpovídá uvedené PET CT vyšetření aktivitě nemoci. V březnu roku 2010 byla ukončena léčba CHOEP a pacient je směřován k autologní transplantaci režimem BEAM.
Aktivitu nemoci v celém těle zachycuje tab. 7.
7. Průběh nemoci a léčby u 6. pacienta, nar. 1973. 
7. případ, muž narozený 1963
I tento muž byl relativně zdráv až do března roku 2008 (do 45 let věku). Pro bronchitidu byl přeléčen antibiotiky a pro přetrvávající kašel odeslán na plicní oddělení, kde po snímku plic provedli následně HRCT a diagnostikovali mikronodulární rozsev do 5 mm bilaterálně. Následně byla provedena u tohoto nemocného bronchoalveolární laváž. Z cytologického vyšetření získané tekutiny bylo konstatováno, že jsou přítomny s velkou převahou makrofágy a téměř všechny elementy jsou protein S 100 pozitivní, CD1 pozitivní, což svědčí pro Langerhansovy buňky.
Tímto vyšetřením byla potvrzena diagnóza. Pacient, kuřák, přestal po vysvětlení kouřit.
V červenci roku 2008 bylo provedeno PET CT, na němž nebylo nic patologického popsáno. Podobný výsledek byl při kontrolním vyšetření v únoru roku 2010 – bez jakéhokoliv nového suspektního ložiska, při low dose CT zobrazení byly na plicích patrné pouze drobné cysty, nikoliv však nodularity. A dle funkčního vyšetření plic nedošlo k žádné podstatné změně.
Hodnocení aktivity plicní formy LCH
Zatím budeme tohoto muže dále sledovat metodou HRCT, funkčním plicním vyšetřením a PET CT kontrolami. V současné době je zřetelná vzestupná tendence poměru SUVmax Pulmo/ SUVmax Hepar, zda to znamená progresi, zatím není jasné (tab. 8).
8. Vývoj plicní aktivity při PET-CT vyšetření u 7. pacienta, nar. 1963. 
Diskuze
Maligní nemoci odvozené od histiocytů jsou podstatně vzácnější než nemoci odvozené od lymfoidních či od myeloidních buněk. WHO klasifikace krevních chorob z roku 2009 popisuje mimo LCH také sarkom z Langerhansových buněk [32], který může případně vznikat z LCH ložisek [33].
Etiologie LCH není jasná a odbornou literaturou se táhla dlouho diskuze, zde jde o aberantní imunologickou reakci, či zda jde o maligní klonální onemocnění. Klonální původ byl prokázán již v roce 1994 [35 – 37]. Nicméně jasné také je, že zánětlivé procesy indukují pomnožení Langerhansových buněk [38,39] a epidemiologicky je jasná souvislost mezi kouřením a plicní formou LCH. V současnosti někteří autoři považují LCH za aberantní reakci imunitního systému, zatímco jiní za klonální maligní onemocnění.
Biologie Langerhansových buněk
Langerhansovy buňky patří do linie dendritických buněk. Zralé dendritické buňky mají heterogenní původ. Mají sice společný původ v hemopoetických kmenových buňkách, z nich se ale mohou vyvíjet cestou lymfoidního nebo myeloidního prekurzoru. Společná funkce všech dendritických buněk je prezentovat antigen T buňkám.
Myeloidní dendritické buňky (DC1) mají původ v CD34 pozitivním myelomonocytárním prekurzoru, z něhož vznikají za spoluúčasti granulocyte macrophage stimulating factor – GM CSF a tumor nekrotizujícího faktoru α (TNF α). Tyto buňky lze také získat z monocytů izolovaných z krve působením GM CSF a interleukinu 4. Z těchto prekurzorů mohou vzniknout rovněž Langerhansovy buňky, zvláště v přítomnosti transforming growth factor β, který má zásadní význam pro diferenciaci směrem do Langerhansových buněk [40,41,43,44].
Později byly identifikovány další populace dendritických buněk, které se odvozují z buněk lymfatické linie pod vlivem interleukinu 3. Za určitých podmínek i tyto buňky mají potenciál se transformovat a dát vznik dendritickým buňkám [45].
Na rozdíl od dendritických buněk, které jsou přítomny téměř ve všech tkáních, jsou Langerhansovy buňky lokalizovány specificky v epidermis, v mukózních površích, včetně mukózy dýchacích cest. Langerhansovy buňky se liší od ostatních dendritických buněk přítomností specifických organel v jejich cytoplazmě – Birbeckových granul, která jsou zřetelná pouze v elektronovém mikroskopu. Birbeckova granula se podílejí na internalizaci exogenních substancí.
Langerhansovy buňky lze detekovat také na základě exprese specifických markerů (langherin CD207), což je lektin, který je asociován s Birbeckovými granuly.
V normální plicní tkáni tvoří Langerhansovy buňky síť v tracheobronchiální výstelce. V oblasti alveolů se normálně vyskytují velmi zřídka. V alveolech se jejich přítomnost zvyšuje u kuřáků a dále v době zánětu. Také v plicních tumorech je jejich počet zvýšen. Jejich počet souvisí s lokální tvorbou GM CSF [46,47].
Langerhansovy buňky, podobně jako jiné dendritické buňky, mají úlohu strážce. Tyto buňky internalizují antigeny a pak ve spolupráci s proinflamatorními signály putují do lymfatických uzlin, kde stimulují specifickou T buněčnou odpověď [48].
Morfologické projevy plicní LCH
Typickým projevem je akumulace aktivovaných Langerhansových buněk do granulomů, které se tvoří ve stěně distálních bronchiolů a později ji destruují. V těchto granulomech jsou však také přítomny lymfocyty a zánětlivé buňky včetně eozinofilů a makrofágů. Morfologicky se plicní ložiska podobají ložiskům této nemoci v jiných tkáních. Na rozdíl od ostatních tkání jsou plicní ložiska vždy mnohočetná, ale drobná, tvoří nodularity obvykle 3 – 6 mm v průměru.
Při vyšetření takové nodularity jsou ve světelném mikroskopu zřetelné Langerhansovy buňky nepravidelných tvarů, průměrné velikosti 15 μm. Mají stočené nepravidelné jádro a světle eozinofilní cytoplazmu, která neobsahuje žádné anebo ojedinělé fagocytované částice. Imunohistochemickým barvením je možné prokázat, že se jedná opravdu o Langerhansovy buňky. Používá se k tomu protilátky proti antigenu CD1a a někdy také průkaz langherinu, což je lektin specificky exprimovaný těmito buňkami. Specifické barvení proteinu S 100, dříve velmi často používané, není příliš specifické, tento protein je prokazován také na neuroendokrinních buňkách a na některých makrofázích.
V elektronovém mikroskopu je možná vizualizace Birbeckových granul, která jsou v patologických Langerhansových buňkách četnější než ve fyziologických Langerhansových buňkách [49 – 52].
Výše uvedená ložiska jsou v plicní tkáni difuzně rozprostřena, jsou neostře ohraničená od okolní zdravé tkáně. LCH granulomy dominantně postihují stěnu centrálních a terminálních bronchiolů, kterou postupně destruují. Z tohoto hlediska plicní forma LCH připomíná spíše bronchiolitidu než difuzní plicní postižení. Granulomy jsou neohraničené a dosahují do sousedních alveolárních struktur. Tyto alveoly pak obsahují zvýšené množství makrofágů s pigmentem a připomínají deskvamativní intersticiální pneumonii [53,54].
V těch částech plic, které nejsou postiženy, je normální histologický obraz plicní tkáně, obvykle s výjimkou změn způsobených kouřením. Někdy však je LCH spojena se vznikem difuzní plicní fibrózy. Nevyjasněnou otázkou je, proč tato fibróza u některých nemocných je a u jiných není přítomna.
Ložiska plicní formy LCH podléhají stejným změnám jako jiná ložiska v těle. Zpočátku je v nich hodně Langerhansových buněk, v pozdějších fázích přibývá eozinofilů a dalších zánětlivých buněk. V terminálních fázích vývoje tohoto ložiska jsou přítomny pouze ojedinělé Langerhansovy buňky nebo žádné. Makroskopický vzhled se také mění, z původního nodulu vzniká kavitovaný nodulus a posléze cystický úvar s nepatrným vazivovým lemem [48].
Epidemiologie plicní formy LCH
Plicní forma LCH u dospělých je vzácným nálezem. V některých případech může jít o projev nemoci omezený na plicní parenchym. V těchto případech se používá termín izolovaná plicní forma LCH. V jiných případech je postižení plic součástí vícesystémové formy LCH.
Izolovaná plicní forma LCH se vyskytuje dominantně u kuřáků. Incidence LCH s postižením plic není přesně zmapována. Dostupné jsou pouze relativní údaje, popisují podíl pacientů s plicní formou LCH mezi všemi nemocnými s intersticiálním plicním postižením (tab. 9). Rozsáhlejší epidemiologická data jsme našli z Japonska, kde udávají prevalenci u mužů 0,27/ 100 000, u žen 0,07/ 100 000 [55].
9. Četnost plicní formy LCH mezi ostatními pacienty s intersticiálním plicním postižením. 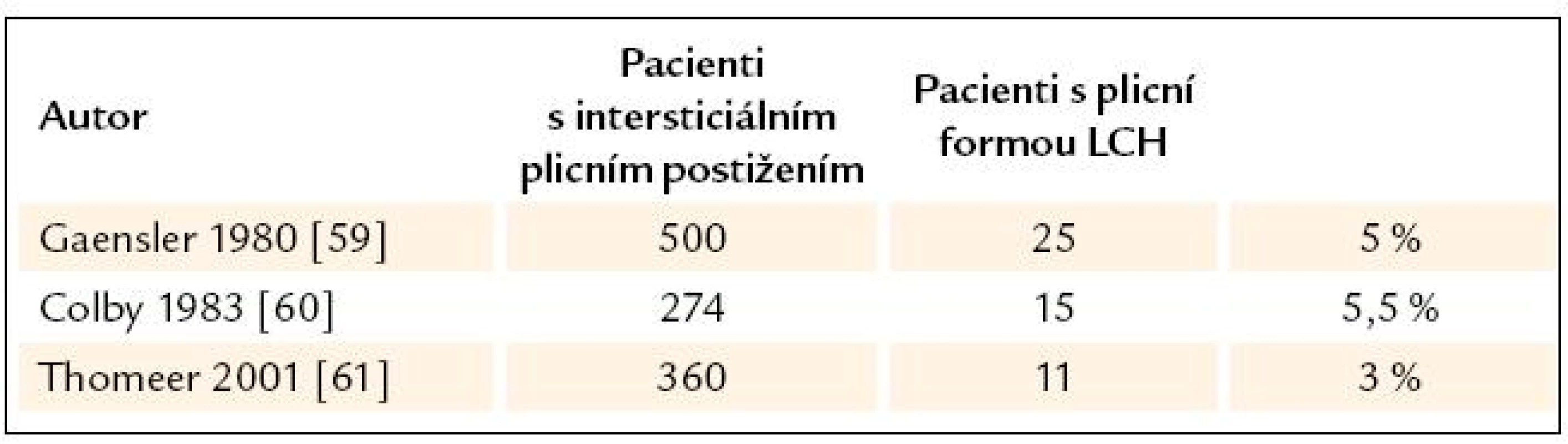
Stejně tak není přesně známa incidence všech forem LCH. Starší data uvádějí 1 – 2 případy LCH v dospělosti na 1 000 000 obyvatel. Jasné je, že výskyt LCH v populaci bude vyšší než udávaná incidence 1 – 2/ 1 000 000, protože toto onemocnění není často správně diagnostikované, pokud již způsobuje závažné symptomy. Přitom mnozí pacienti s LCH se ani k lékaři nedostaví, protože nepociťují žádné symptomy, anebo symptomy jsou jen dočasné, nemoc u nich dospěje ke spontánní remisi.
Častější používání vysoce rozlišovacího CT zobrazení (HRCT) může přispět k častějšímu rozpoznávání této plicní manifestace LCH.
Plicní forma LCH nejčastěji postihují mladé osoby ve věku 20 – 40 let a postihuje v 90 % kuřáky.
Plicní forma LCH je diagnostikována po radioterapii či chemoterapii maligních lymfomů či Hodgkinova lymfomu [56 – 58], ale také v průběhu onemocnění solidními tumory či při monoklonální gamapatii nejistého významu (MGUS). Další maligní choroby či MGUS se u pacientů s LCH vyskytují častěji než v průměrné populaci. To svědčí o alteraci imunity u pacientů s LCH a také o vhodnosti hledat při ambulantních kontrolách těchto pacientů nejen odpověď na otázku, zda nedochází k recidivě LCH, ale také odpověď na otázku, zda se neobjevují klinické a laboratorní známky dalšího maligního onemocnění.
Příznaky
Ačkoliv se jedná o difuzní plicní postižení, nemocní si často nejsou vědomi žádných potíží (nemoc se rozvíjí pomalu) nebo příznaky dávají do souvislosti s kouřením. Udává se, že při 20 – 30% postižení plicního parenchymu nodularitami a cystami LCH zůstávají výsledky funkčního plicního vyšetření v mezích normy, zřejmě díky značným kompenzačním mechanizmům plic. To znamená, že při postižení plic tohoto rozsahu nemusí být přítomny žádné plicní symptomy. To potvrzuje 3. popsaný případ, tento muž měl jasné HRCT známky plicní formy LCH, aktivita byla ověřena z bronchoalveolární laváže, a přitom neměl vůbec žádné příznaky postižení plic a výsledky plicního funkčního vyšetření měl v normě.
Zahraniční prameny udávají, že asi 25 % případů je odhaleno náhodným snímkem plic, provedeným z jiného důvodu, než je podezření na plicní formu LCH.
K lékaři nemocné přivádí některý z následujícího výčtu možných příznaků:
- suchý dráždivý kašel,
- dušnost při námaze,
- dušnost či kašel ve spojení s typickými B symptomy (subfebrilie či febrilie, noční pocení, úbytek hmotnosti),
- spontánní pneumotorax a bolest jím vyvolaná je příznakem vedoucím ke stanovení diagnózy asi u 10 – 20 % osob s plicní formou LCH.
Spontánní pneumotoraxy se nejčastěji objevují u mladých mužů [62 – 65]. Pneumotoraxy se mohou opakovat, jak demonstrujeme dvěma případy v našem souboru.
Hemoptýza není typickým příznakem nemoci, v případě hemoptýzy je nutno pečlivě vyloučit jiné diagnózy, než se uzavře původ hemoptýzy v plicní formě LCH [66].
Některé zahraniční prameny uvádějí, že plicní forma LCH u dospělých je obvykle onemocnění omezené na plicní parenchym a že průkaz postižení jiných tkání je spíše výjimečný (osteolytická ložiska do 20 %, diabetes insipidus do 5 % a případně kožní projevy nemoci) [67 – 69].
V našem souboru však máme pouze jednoho pacienta, u něhož byla prokázána primárně plicní forma LCH, ostatní naši nemocní mají multisystémovou formu onemocnění. V tomto případě bude zásadním způsobem záležet na úhlu pohledu autora textu. Pokud text vychází z pera pneumologů, je pochopitelné, že ti se budou setkávat hlavně s plicní formou LCH. Naopak, pokud text vychází z pera hematologů, tak k nim přicházejí pacienti dominantně s jinou než plicní formou LCH, a postižení plic se zjistí až po vyšetřeních, která mají za cíl stanovit rozsah nemoci.
Projevy plicní formy LCH na klasickém snímku plic
Na standardním snímku plic jsou projevy této nemoci málo zřetelné. Nejčastějším projevem je retikulomikronodulární infiltrace. Někdy mohou být na snímku plic zřetelné cysty. Změny postihují typicky horní a střední plicní pole, ubývá jich směrem bazálním a často vynechávají kostofrenické úhly [70]. Tato distribuce LCH se vysvětluje tím, že horní a střední plicní laloky jsou více ventilované než bazální části plic, a tedy, že více exogenních faktorů je vzduchem dopraveno do horních a středních částí plic než do bazálních plicních oblastí. Naopak, bazální části plic jsou více prokrvené než horní, a tak jsou hematogenní metastázy častěji detekovány v dolních plicních polích.
Infiltráty jsou velmi často mnohočetné, i když pacient nemá velké příznaky, ale jsou popsány i výjimky s izolovaným nodulem [71].
Plicní forma LCH není spojena s výpotkem či mediastinální lymfadenopatií až na naprosté výjimky [72].
V případech, kdy změny plicního parenchymu způsobené samotnou LCH nebo LCH a jí indukovanou plicní fibrotizací způsobí plicní hypertenzi, tak bývají zřetelné výrazné plicní hily.
Při pokročilé formě nemoci mohou postupně mizet plicní nodularity a dominující abnormalitou na RTG snímku jsou cysty, jež mnohdy vypadají jako plíce při emfyzému. Asi v 10 % případů však na běžném RTG snímku nemusí být nic patologického zřetelné.
Projevy plicní formy LCH v CT obraze s vysokým rozlišením (high resolution CT – HRCT)
HRCT zobrazení přineslo zásadní zlom v diagnostice plicní formy LCH. Nyní je základním vyšetřením, které by se mělo provést při podezření na tuto či jinou intersticiální plicní nemoc. HRCT přináší podrobné informace o základních plicních změnách, typických pro tuto nemoc, jimiž jsou noduly, kavitované noduly a cysty, které nemusí být zřetelné na klasickém RTG snímku [73 – 79]. Při HRCT zobrazení je možné vidět, že retikulace, zřetelná na běžném RTG snímku, je při HRCT zobrazení tvořena malými plicními cystami.
Typickými projevy plicní formy LCH jsou malé, špatně ohraničené noduly, které se postupně vyvíjejí v kavitované noduly a následně v silnostěnné a později tenkostěnné plicní cysty.
Tyto změny postihují jak periferní, tak centrální části plicního pole. Ložiska jsou fokální, jsou oddělena parenchymem, který má na HRCT normální obraz. Nodularity jsou ponejvíce v horním a středním plicním poli a mají tendenci šetřit dolní části plic. Distribuce nodulů je centrilobulární, odráží tak vazbu této nemoci na bronchioly.
S pokračující nemocí pak i na HRCT dominují cystická ložiska. Jejich velikost obvykle nepřesahuje 1 cm, ale cysty mohou postupně splývat, a vytvářet tak větší konglomeráty – dutiny.
Kontinuální HRCT sledování u vybraných nemocných prokázalo, že radiologické změny se vyvíjení od nodulu přes kavitovaný nodulus, silnostěnnou do slabostěnné cystu. Tato série HRCT snímků také prokázala, že noduly nebo kavitované noduly mohou vymizet, zatímco cysty již jsou definitivní (end stage disease) změnou [80 – 82].
V diferenciální rozvaze jsou plicní cystické změny v některých případech velmi těžko odlišitelné od centrilobulárního emfyzému. Distribuce je stejná, tedy centrilobulární a chybí zřetelně vyjádřená stěna. Sledování změn v časové ose mohou pomoci při odlišení obou entit. Někdy však mohou diferenciální rozpaky v HRCT obraze přetrvávat.
Dalšími popsanými změnami u LCH jsou lineární denzity a pak také emfyzematózní buly kuřáků. U některých nemocných je zřetelné rozšíření stínu plícnice [83]. HRCT je přínosem pro rozpoznání intersticiálních plicních procesů nejen u dospělých, ale také u dětí [84,85].
HRCT má zásadní přínos pro určení místa vhodného pro plicní biopsii.
Plicní funkce při LCH
Změny v plicních funkcích odrážejí míru anatomických změn a trvání nemoci. Za nejčastější abnormalitu je uváděna redukce difuzní kapacity plic pro CO. Bývá přítomna u 70 – 90 % nemocných. U velké části nemocných se udává také obstrukční porucha (jak jinak, jde současně o osoby závislé na kouření se značnou expozicí). Dále bývá nízká vitální kapacita (VC) a i mírně snížená celková plicní kapacita (TLC) a zvýšený reziduální objem. Poměr RC/ TLC bývá často zvýšený. Hodnota usilovného výdechu bývá snížena u 20 – 30 % vyšetřovaných a v průběhu nemoci se dále zvyšuje. Tato obstrukční porucha zrcadlí predominantně bronchiolární lokalizaci plicní formy LCH a zároveň také často chronickou kuřáckou bronchitidu. Proto Tazi uvádí, že obstrukční porucha spolu s difuzními plicními infiltráty je velmi pravděpodobně způsobena plicní formou LCH. Nemusí to však být vždy, někteří pacienti trpí čistou restriktivní poruchou [86 – 93].
Jak jsme již uvedli dříve, počáteční změny v plicním parenchymu, jasně zřetelné na HRCT, ještě nevedou k patologickým výsledkům funkčních plicních testů ani k subjektivním plicním potížím.
Bronchoskopické nálezy a přínos bronchoalveolární laváže pro stanovení diagnózy LCH
Bronchiální strom je při klasickém bronchoskopickém vyšetření normální, nebo jeví pouze nespecifické známky zánětu způsobeného kouřením. Biopsie bronchiální mukózy není nijak přínosná pro stanovení této diagnózy.
Transbronchiální biopsie může být ve výjimečných případech přínosem, pokud je získán dostatečně velký počet vzorků a všechny jsou kompletně imunohiostochemicky přešetřeny [93 – 95]. Ve větší míře byla transbronchiální punkce používána v USA, diagnostickým přínosem však byly pouze v 10 – 40 % případů. Tento nízký výtěžek je způsoben fokální distribucí ložisek v parenchymu [93 – 95].
Přínosnou metodou je však bronchoalveolární laváž, základní poznatky o této metodě uvádí Mayer [96].
Počet buněk v aspirátu z bronchoalveolární laváže je často zvýšený, obvyklé jsou počty buněk nad 106/ ml se zřetelnou predominancí alveolárních makrofágů. Zvýšená buněčnatost aspirátu z bronchoalveolární laváže je způsobena kouřením cigaret [97]. Počty alveolárních makrofágů bývají normální u nekuřáků.
Diferenciální rozpočet ve vzorku bronchoalveolární laváže může vykazovat mírný nespecifický vzestup počtu eozinofilů, obvykle méně než 10 % [67,97]. Počet lymfocytů bývá normální či mírně snížený a poměr CD4/ CD8 buněk je snížený, což je obvyklé u kuřáků.
Identifikace Langerhansových buněk mezi všemi buňkami získanými bronchoalveolární laváží je možná s pomocí monoklonální protilátky proti CD1a.
Zvýšené počty CD1a pozitivních buněk do 3 % jsou časté u kuřáků, aniž by u nich byla zřetelná plicní forma LCH. Kouření zvyšuje počet Langerhansových buněk v plicích [98]. Mírné zvýšení CD1a pozitivních buněk bylo také zjištěno u pacientů s difuzní intersticiální plicní chorobou, spojenou s alveolární hyperplazií (zvláště u difuzní intersticiální plicní fibrózy) a také v adenokarcinomech plic [67,99 – 102].
Pokud se použije jako hranice pozitivity nález > 5 % CD1a+ buněk, je již specifita tohoto testu velmi vysoká, ale senzitivita zůstává nízká, 25 % [67,103 – 105].
Tazi uvádí, že u většiny dospělých s plicní formou LCH je počet CD1a pozitivních buněk nižší než uváděná hranice 5 %, podobně jako je tomu u kuřáků. Pokud bronchoalveolární laváž prokáže dostatečně zvýšený počet CD1a pozitivních buněk a HRCT má odpovídající obraz, je možné diagnózu uzavřít jako plicní forma LCH. Pokud však HRCT odpovídá plicní formě a v laváži není dostatečný počet CD1a pozitivních elementů, je nutno přikročit k dalším diagnostickým krokům – plicní biopsii z oblasti s nejvyšší četností nodularit. Podobně ale i v případě, kdy HRCT neodpovídá plicní formě a laváž vyjde pozitivní. V roce 2010 lze mezi odborníky na plicní formu stále najít jak názory, že diagnostika pomocí laváže je zcela dostačující, tak že pro diagnostiku laváž nestačí a je nutno udělat plicní biopsii.
Domníváme se, že v případech jasného HRCT nálezu by měl být pozitivní výsledek laváže ke stanovení diagnózy plicní formy LCH dostačující.
Stanovení diagnózy
Stanovení diagnózy je založeno na rozpoznání typického LCH granulomu s průkazem dendritických Langerhansových buněk, obsahujících Birbeckova granula a odpovídající CD antigeny (CD1a) [106,107]. Histologický vzorek se klasicky získává torakoskopicky z míst, kde je dle HRCT nejvíce granulomových ložisek. Vzhledem k tomu, že granulomy tvoří disperzní proces, je nutné vzít odpovídající kus tkáně a také jej celý vyšetřit metodou imunohistochemického barvení [108,109].
Pokud je však HRCT plic typické pro tuto nemoc, je na zvážení zkušeného plicního odborníka, zda provádět či neprovádět plicní biopsii. Pokud je na HRCT typická nodulárně cystická struktura plicní tkáně, jedná se o mladého kuřáka a přitom brochoalveolární laváž prokazuje vysoký počet CD1a+ elementů, není nutné obvykle ověřovat plicní formu LCH pomocí histologie.
Nicméně diferenciálně diagnosticky je nutné vědět o dalších nemocech, které mohou mít podobný obraz (mykobakteriální infekce, Wegenerova granulomatóza, kavitované plicní metastázy, alveolární plicní karcinom, septické emboly).
U dospělých může být obtížné odlišit diferencovanou formu lymfangioleiomyomatózy. V tomto případě by však sonografie a CT měla prokázat angiomyolipomy i v jiných částech těla [110].
Pokud je plicní forma LCH součástí multisystémového postižení, je možné ověřit diagnózu histologickým vyšetřením vzorku odebraného z dostupnějšího patologického ložiska v jiné tkáni či orgánu, než jsou plíce (z kosti, případně z periodontálních ložisek, imitujících zánět dásní apod.) [111,112]. V dospělosti může být kombinována např. plicní forma s postižením stopky hypofýzy a diabetes insipidus [113]. Zde naopak průkaz, že v plicích jsou noduly LCH, osvětlí, co je příčinou infiltrátu v oblasti stopky hypofýzy.
Klinický průběh a prognóza
Klinický průběh je velmi divergentní a nelze jej u konkrétního pacienta předpovědět [67,78]. Asi u 50 % nemocných má izolovaná plicní forma LCH příznivý průběh, k vymizení aktivity nemoci (vymizení plicních opacit a nodularit) dojde buď spontánně, nebo při kortikoidní léčbě. Nicméně pokud dojde k poškození plic formou cyst, je to ireverzibilní. Výsledky vyšetření plicních funkcí mají pak podobu setrvalé či progresivně se zhoršující respirační poruchy.
Asi u 20 % nemocných se objevují ihned z počátku nemoci závažnější problémy typu opakujících se pneumotoraxů anebo progresivní respirační selhání se vznikem chronického cor pulmonale.
Asi u 30 – 40 % nemocných jsou příznaky nemoci dlouhodobé, s postupnou konverzí nodularit na silnostěnné a posléze tenkostěnné plicní cysty. Je velmi obtížné rozlišit, zda jsou přítomny pouze klidné cysty nebo zda v plicním parenchymu se stále tvoří nové nodularity jako projev aktivní nemoci. Sledování nemoci je velmi obtížné, je nutné skládat dohromady výsledky všech dostupných metod, které mohou poskytnout informaci o aktivitě plicní nemoci (funkční plicní vyšetření, HRCT, PET CT vyšetření) [85,114 – 122].
Literatura uvádí následující nepříznivé prognostické faktory:
- nástup nemoci ve starším věku,
- delší doba aktivních příznaků nemoci,
- opakované pneumotoraxy,
- mimohrudní projevy nemoci (vyjma kostního postižení, které obvykle nesignalizuje horší prognózu),
- difuzně rozprostřené plicní cysty,
- závažné poruchy ventilace [90,93,123].
Závažná plicní hypertenze signalizuje špatnou prognózu [124,125].
Plicní forma LCH znamená však vyšší riziko plicního karcinomu, zvláště u kuřáků, ale také zvýšené riziko ostatních malignit [57,120,126 – 129].
Léčba
Zásadní důležitost pro vymizení této nemoci má ukončení kouření. Po zanechání kouření byla v mnoha případech popsána remise nemoci [117,118,130].
O léčbě se uvažuje v případech, kdy je po přerušení kouření zřetelná progrese nemoci. U mnoha pacientů s LCH dochází ke spontánní úpravě nebo jsou stabilní po delší dobu, takže se k léčbě vůbec nepřistoupí [131].
Efektivitu léčby je obtížné vyhodnotit. Odpovědět na otázku, zda se pořád tvoří další a další nodularity, nepřináší snímek plic a nelze očekávat ani od HRCT přesnou odpověď na tuto otázku, i když HRCT je nejdůležitějším prostředkem k hodnocení léčebné odpovědi [119]. Funkční plicní vyšetření odráží hlavně end stage změny. Zhoršování funkčního vyšetření jistě odráží progresi nemoci, regresi nemoci však nelze funkčním vyšetřením potvrdit. Dále počty případů jsou nízké, takže léčebné postupy zde nevyhodnocují žádné prospektivní randomizované studie. Poučení o možnostech léčby je proto nutné extrahovat z popisů malých skupin pacientů či z popisů jednotlivých případů.
Zcela výjimečná je asi léčba pomocí transplantace plic [132,133], protože může dojít k recidivě nemoci v postižené plíci [134 – 136].
Glukokortikoidy. Pro izolovanou plicní formu LCH ve stadiu nodulárních infiltrátů je nejčastěji používána glukokortikoidní léčba. Obvyklá dávka je 0,5 – 1,0 mg/ kg/ den, která se pomalu snižuje v průběhu 6 – 12 měsíců [67,77,137]. Od glukokortikoidní léčby se očekává, že zabrzdí aktivitu nemoci a potlačí zánětlivou reakci v LCH granulomech, a tím zabrzdí destrukci bronchiolů vedoucí ke tvorbě cyst.
Cytostatické léky (vinblastin a méně často metotrexát nebo 2 chlorodeoxyadenosin) jsou považovány za indikované v případech, kdy plicní formu LCH provází multisystémové postižení.
Pro případy izolované plicní formy LCH není totiž průkazu, že by tyto léky byly účinnější než pouhé glukokortikoidy. Z druhé strany v případech progrese při glukokortikoidech mají jistě své oprávnění i v léčbě izolované plicní formy LCH.
Prvním cytostatikem, u něhož byl prokázán požadovaný léčebné účinek, byl derivát vinka alkaloidu – vinblastin. Později se do léčby dostal metotrexát, merkaptopurin. O něco později se do léčby dostal další účinný lék, etoposid, který je účinný u plicních i mimoplicních forem [138 – 140]. Z cytostatik objevených až ke konci minulého století to byl právě 2 chlorodeoxyadenosin, který prokázal svou účinnost u multisystémového plicního postižení. Pozitivní dopad léčby 2 chlorodeoxyadenosinem na plicní formu LCH byl doložen v několika publikacích [141 – 145].
V případě kožního a dalšího multisystémového postižení lze použít kombinovanou léčbu – PUVA, prednison, merkaptopurin a vinblastin [146].
Další léky. Efekt byl popsán také po etanerceptu [147] a opakovaně po thalidomidu [148].
Z druhé strany nutno zmínit, že byla popsána reaktivace nemoci po léčbě kolitidy a infliximabem [149].
Do komplexní léčby však patří také zvládání infekcí, které se v poškozených plicích často vyskytnou, a dále operační řešení pneumotoraxů či řešení pneumotoraxů pleurodézou [116].
Stanovení rozsahu nemoci a vyhodnocování účinnosti léčby
Největším problémem je vyhodnocování aktivity nemoci, a tedy i efektivity léčby. Základním vyšetřením byly snímky skeletu detekující kostní ložiska a také scintigrafie skeletu. Měkkotkáňovou expanzi lze zachytit pomocí magnetické rezonance (MR) a vyšetřením pomocí počítačové tomografie (CT).
V literatuře se objevilo několik zmínek o přínosu scintigrafického zobrazení aktivních ložisek LCH pomocí oktreotidového skenu [150 – 152]. Tyto metody však nedošly širšího použití. Přehled všech metod používaných k detekci LCH uvádějí četní autoři [153 – 155].
V posledních letech je hodně pozornosti věnováno přínosu PET a PET CT zobrazení pro stanovení rozsahu nemoci a vyhodnocení léčebné odpovědi.
Italští autoři použili PET vyšetření k vyhodnocení účinnosti chemoterapie MACOB B 4 pacientů. PET vyšetření zobrazilo nová ložiska, která nebyla zřetelná na ostatních vyšetřeních u 2 ze 4 vyšetřených. Dosažení negativity po léčbě bylo předpokladem k dlouhodobé remisi nemoci [156]. Autoři z Houstonu publikovali stejnou zkušenost, srovnali přínos PET CT, scintigrafie kostí, CT a MR vyšetření pro stanovení rozsahu nemoci a vyhodnocení léčebné odpovědi celkem u 44 pacientů (41 dětí a 3 dospělí). Svou analýzu uzavřeli konstatováním, že celotělové PET CT zobrazí ložiska v kostech i v měkkých tkáních a informuje o léčebné odpovědi s větší přesností než scintigrafie skeletu, MR a CT [157].
PET CT je přínosem také pro detekci neurodegenerativní formy LCH. Typickým nálezem pro neurodegenerativní formu LCH je bilaterální hypometabolizmus v cerebellu, bazálních gangliích, frontálním kortexu a relativně zvýšený metabolizmus v amygdale a tyto změny předcházejí MR změnám [154,158]. Zkušenosti s PET CT u pacientů s LCH sumarizujeme v tab. 10. Do února roku 2010 byla však v Medline pouze jedna práce hodnotící PET CT u plicní formy LCH.
10. Přínos PET- CT vyšetření pro hodnocení rozsahu nemoci a účinnosti léčby. 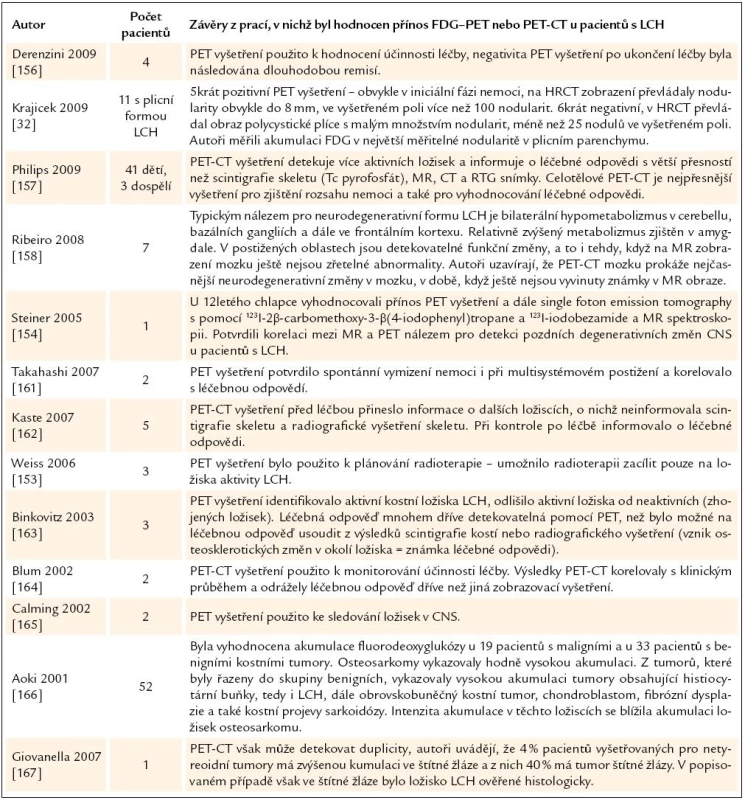
Krajicek et al [32] hodnotili přínos vyšetření PET u 11 pacientů s plicní formou LCH. Z těchto 11 pacientů bylo pozorováno zvýšení akumulace fluorodeoxyglukózy v plicním parenchymu u 5, z toho u 3 se jednalo o multiorgánové postižení. PET pozitivní pacienti měli v plicním parenchymu četné nodularity obvykle menší 8 mm a počet nodulů ve vyšetřeném poli byl vyšší než 100, zatímco PET negativní pacienti měli plicní formu LCH dominantně ve stadiu cyst s počtem nodulů ve vyšetřeném poli menším než 25. PET vyšetření je doporučováno i pro sledování dalších histiocytárních chorob – Erdheimovy Chesterovy nemoci [159,160,169,170]. Zkušenosti s PET CT u LCH shrnuje tab. 10.
Námi navržené a ověřené hodnocení plicní aktivity na základě indexu, poměru naměřené maximální hodnoty SUVmax ve sférickém prostoru pravé plíce ku maximální hodnotě SUVmax, naměřené ve sférickém prostoru jater – index SUVmax Pulmo/ SUVmax Hepar – zatím nebylo v odborné literatuře publikováno a bude vyžadovat ověření na větším souboru pacientů. Uvedený index může být jistě ovlivněn mnoha dalšími faktory. V současnosti neexistuje mimo HRCT plic a funkčního vyšetření jiná vyšetřovací metoda, která by přesněji informovala o aktivitě plicní formy LCH. Klasické PET CT vyšetření a hodnocení není u plicní formy proveditelné, protože rozměry nodularit jsou menší, než je schopna PET kamera rozlišit. Proto považujeme měření a dlouhodobé sledování indexu SUVmax Pulmo/ SUVmax Hepar za velmi užitečné doplnění v současnosti existujících zdrojů informací o plicní formě LCH. U konkrétního pacienta pak klademe důraz nejen na dosaženou absolutní hodnotu, ale hlavně na vývoj indexu v čase.
Závěr pro praxi
- U mladých pacientů se závislostí na cigaretách (kuřáků) s dlouhodobějším kašlem a případně dušností je nutno myslet na intersticiální plicní postižení a v rámci diferenciální diagnózy také na plicní formu LCH.
- Včasný průkaz plicní formy LCH a včasná léčba mohou vést k zastavení procesu, který jinak progresivně destruuje plíce.
- Změny v plicním parenchymu způsobené plicní formou LCH jsou velmi dobře viditelné na HRCT plic, zatímco na klasickém RTG snímku nemusí být zřetelné žádné patologické změny. Proto se pro vyhodnocování dynamiky plicní formy LCH standardně používá HRCT vyšetření a funkční plicní vyšetření.
- Pro difuznost procesu nebylo klasické hodnocení PET CT u plicní formy přínosné, ač je přínosné pro detekci ložisek této nemoci v jiných částech těla. Vysoká četnost plicních nodularit u aktivní formy LCH a jejich malá velikost je důvodem, proč zvýšení jejich četnosti či úbytek jejich četnosti i metabolické aktivity v nich nelze proměřovat u jednotlivých z nich. Tento problém lze obejít metodou hodnocení aktivity plicní formy LCH, která je založena na vyhodnocování maximální akumulace fluorodeoxyglukózy ve zvoleném objemu pravé plíce. Při stanovení poměru aktivity plicní/ jaterní dochází ke snížení variability mezi jednotlivými studiemi, a navíc jen tak lze porovnat i měření z různých přístrojů. SUVmax Pulmo/ SUVmax Hepar v rozmezí 0,2 – 0,4 označujeme jako normální, 0,4 – 0,5 označujeme jako slabě pozitivní, hodnoty 0,5 a výše jako pozitivní, korespondující s aktivní plicní formou LCH. Pro sledování pacientů s plicní formou LCH se ukázaly přínosné nejen výše naměřené aktuální hodnoty, ale také individuální vývoj naměřených hodnot při opakovaném sledování. Popsané hodnocení difuzní plicní aktivity LCH s pomocí PET CT vyšetření a poměru SUVmax Pulmo/ SUVmax Hepar představuje potenciální novou metodu pro hodnocení aktivity plicní formy LCH, která doplňuje výše jmenované metody.
Tato publikace byla připravena v rámci projektu MUNI/ A/ 1012/ 2009 s názvem „Optimalizace diagnostiky a terapie maligních chorob a komplikací, které tyto maligní nemoci provázejí, s využitím nových molekulárně biologických metod“, a také je součástí aktivit v rámci grantů IGA MZ: NR9225, NS10387 a NS10406.
prof. MU Dr. Zdeněk Adam, CSc.
www.fnbrno.cz
e mail: z.adam@fnbrno.czDoručeno do redakce: 1. 4. 2010
Přijato po recenzi: 25. 5. 2010
Sources
1. Horáček J. Primary pulmonary histiocytosis X. Cesk Patol 1975; 11 : 210 – 213.
2. Bittenglová R, Pešek M, Mukenšnabl P et al. Granulomatóza z Langerhansových buněk. Stud Pneumol Phtiseol 2002; 62 : 196 – 202.
3. Polák J, Fuchs B. Pulmonary histiocytosis X. Cesk Radiol 1987; 41 : 289 – 300.
4. Rožánek P, Molnar V, Rešl M. Tři případy plicní granulomatózy z Langerhansových buněk. Lék Zpr Lék Fak Univ Karlovy Hr Kralové 1998; 43 : 127 – 132.
5. Skácel Z, Marel M, Vraštilová P et al. Histiocytóza z Langerhansových buněk. Přehled literatury a vlastní pozorování. Stud Pneumol Phtiseol 2000; 60 : 150 – 156.
6. Kinkor Z. Severe pulmonary involvement in Erdheim ‑ Chester disease (case report). Cesk Patol 2001; 37 : 114 – 117.
7. Pacovská V, Bortlová A, Homolka J et al. Granulomatóza z Langerhansových buněk. Trendy Med 2002; 4 : 59 – 61.
8. Kodet R, Elleder M, Šmelhaus V et al. Disseminated histiocytosis X. Cesk Patol 1984; 20 : 19 – 26.
9. Drastík J. Histiocytosis X in otorhinolaryngology. Cesk Otolaryngol 1970; 19 : 49 – 55.
10. Fassmann A, Horáček J, Šindekla Z et al. Histocytosis X classified as Hand ‑ Schueller ‑ Christian disease in the oral cavity. Cesk Stomatol 1982; 82 : 32 – 37.
11. Hrubala D, Durovic E, Markovská N. Histiocytosis X. Prakt Zubn Lek 1984; 32 : 73 – 75.
12. Adam Z, Pour L, Krejčí M et al. Histiocytóza z Langerhansových buněk u osob dospělého věku nemoc s mnoha tvářemi. Zkušenosti jednoho pracoviště a přehled projevů nemoci. Vnitř Lék 2008; 54 : 1063 – 1081.
13. Anton M, Holoušova M, Řehůřek J et al. Histiocytoza X a dětská očnice. Čs Ophthal 1992; 48 : 176 – 180.
14. Bláha M. The hemophagocytic syndrome. Vnitř Lék 2003; 49 : 163 – 164.
15. Bunanská E, Stančoková T, Dluholucký S. Histiocytóza z Langerhansových buněk. Čes Slov Pediat 1998; 53 : 18 – 19.
16. Kodet R, Zitková M. Morphologic and roentgenologic pulmonary findings in disseminated histiocytosis X. Cesk Pediatr 1985; 40 : 634 – 638.
17. Kodetová D, Kodet R, Syrůček M et al. Sinus histiocytosis with massive lymphadenopathy – a disseminated form of the Rosai ‑ Dorfman syndrome. Cesk Patol 1996; 32 : 53 – 59.
18. Mlyncek M, Uharcek P, Durcanský D. Vulvar Langerhans’ cell histiocytosis: a case report. Acta Obstet Gynecol Scand 2006; 85 : 753 – 755.
19. Mottl H, Ganevová M, Radvanská J et al. Treatment results of Langerhans cell histiocytosis with LSH II protocol. Cas Lek Cesk 2005; 144 : 753 – 755.
20. Mottl H, Koutecký J, Ganevová M. Strategie léčby histiocytózy z Langerhansových buněk u dětí. Čes Slov Pediat 1994; 49 : 81.
21. Mottl H, Mráček J, Kabelka Z et al. Histiocytóza z Langerhansových buněk u dětí. Čs Pediat 1992; 47 : 530 – 533.
22. Mottl H, Mráček J, Kabelka Z et al. Langerhans ‑ cell histiocytosis in children. Cesk Pediatr 1992; 47 : 530 – 533.
23. Mottl H, Rob L, Stary J et al. Langerhans cell histiocytosis of vulva in adolescent. Int J Gynecol Cancer 2000; 17 : 520 – 524.
24. Pazdera J, Černý O, Jirava E et al. Histiocytosis X of Abt ‑ Letterer ‑ Siwe type with primary manifestation in the oral cavity in a 15 - months ‑ old child. Cesk Stomatol 1974; 74 : 136 – 141.
25. Schwartz A, Zich P. Eosinophilic histiocytic granuloma of the vulva and cervix. Sb Lek 1989; 91 : 1 – 4.
26. Smilek P, Krejčová B, Čada K et al. Histiocytóza z Langerhansových buněk, případ postižení spánkové kosti. Otorinolaryng Foniat 1994; 43 : 263 – 265.
27. Ščudla V, Roček V, Dušek B et al. Multifokální eozinofilní granulom v dospělosti. Vnitř Lék 1987; 33 : 1078 – 1086.
28. Šímová B, Mališ J, Neuwirt J. Klinické projevy histiocytózy z Langerhansových buněk. Zdrav Nov ČR Lék Listy 2003; 52 : 18.
29. Tichy M Jr, Tichy M, Krč I et al. Multicentrická retikulohistiocytóza. Čes Slov Derm 1999; 74 : 168 – 171.
30. Toušovská K, Slavík Z. Histiocytóza z Langerhansových buněk v dětském věku. Lék Zprav Lék Fak Univ Karlovy Hr Králové 1997; 42 : 127 – 132.
31. Velková A. Changes in the periodontium in children. Cesk Stomatol 1975; 75 : 180 – 184.
32. Krajicek BJ, Ryu JH, Hartman TE et al. Abnormal fluorodeoxyglucose PET in pulmonary Langerhans cell histiocytosis. Chest 2009; 135 : 1542 – 1549.
33. Kawase T, Hamazaki M, Ogura M et al. CD56/ NCAM ‑ positive Langerhans cell sarcoma: a clinicopathologic study of 4 cases. Int J Hematol 2005; 81 : 323 – 329.
34. Lee JS, Ko GH, Kim HC et al. Langerhans cell sarcoma arising from Langerhans cell histiocytosis: a case report. J Korean Med Sci 2006; 21 : 577 – 580.
35. Willman CL, Busque L, Griffith BB et al. Langerhans’ ‑ cell histiocytosis (histiocytosis X) – a clonal proliferative disease. N Engl J Med 1994; 331 : 154 – 160.
36. Yu RC, Chu C, Buluwela L et al. Clonal proliferation of Langerhans cells in Langerhans cell histiocytosis. Lancet 1994; 343 : 767 – 768.
37. Yousem SA, Colby TV, Chen YY et al. Pulmonary Langerhans’ cell histiocytosis: molecular analysis of clonality. Am J Surg Pathol 2001; 25 : 630 – 636.
38. Geissmann F, Dieu ‑ Nosjean MC, Dezutter C et al. Accumulation of immature Langerhans cells in human lymph nodes draining chronically inflamed skin. J Exp Med 2002; 196 : 417 – 430.
39. Geissmann F, Lepelletier Y, Fraitag S et al. Differentiation of Langerhans cells in Langerhans cell histiocytosis. Blood 2001; 97 : 1241 – 1248.
40. Tazi A, Bonay M, Grandsaigne M et al. Surface phenotype of Langerhans cells and lymphocytes in granulomatous lesions from patients with pulmonary histiocytosis X. Am Rev Respir Dis 1993; 147 : 1531 – 1536.
41. Tazi A, Bouchonnet F, Grandsaigne M et al. Evidence that granulocyte macrophage ‑ colony ‑ stimulating factor regulates the distribution and differentiated state of dendritic cells/ Langerhans cells in human lung and lung cancers. J Clin Invest 1993; 91 : 566 – 576.
42. Tazi A, Bonay M, Bergeron A et al. Role of granulocyte ‑ macrophage colony stimulating factor (GM‑CSF) in the pathogenesis of adult pulmonary histiocytosis X. Thorax 1996; 51 : 611 – 614.
43. Tazi A, Montcelly L, Bergeron A et al. Relapsing nodular lesions in the course of adult pulmonary Langerhans cell histiocytosis. Am J Respir Crit Care Med 1998; 157 : 2007 – 2010.
44. Tazi A, Moreau J, Bergeron A et al. Evidence that Langerhans cells in adult pulmonary Langerhans cell histiocytosis are mature dendritic cells: importance of the cytokine microenvironment. J Immunol 1999; 163 : 3511 – 3515.
45. Arrighi JF, Soulas C, Hauser C et al. TNF‑a induces the generation of langerin/ (CD207)+ immature Langerhans‑type dendritic cells from both CD14 – CD1a and CD14+CD1a – precursors derived from CD34+ cord blood cells. Eur J Immunol 2003; 33 : 2053 – 2063.
46. Banchereau J, Briere F, Caux C et al. Immunobiology of dendritic cells. Annu Rev Immunol 2000; 18 : 767 – 811.
47. Brabencova E, Tazi A, Lorenzato M et al. Langerhans cells in Langerhans cell granulomatosis are not actively proliferating cells. Am J Pathol 1998; 152 : 1143 – 1149.
48. Nagarjun Rao R, Moran CA, Suster S. Histiocytic disorders of the lung. Adv Anat Pathol 2010; 17 : 12 – 22.
49. Hance AJ, Basset F, Saumon G et al. Smoking and interstitial lung disease. The effect of cigarette smoking on the incidence of pulmonary histiocytosis X and sarcoidosis. Ann N Y Acad Sci 1986; 465 : 643 – 656.
50. Banchereau J, Paczesny S, Blanco P et al. Dendritic cells: controllers of the immune system and a new promise for immunotherapy. Ann N Y Acad Sci 2003; 987 : 180 – 187.
51. Mellman I, Steinman RM. Dendritic cells: specialized and regulated antigen processing machines. Cell 2001; 106 : 255 – 258.
52. Valladeau J, Duvert ‑ Frances V, Pin JJ et al. The monoclonal antibody DCGM4 recognizes Langerin, a protein specific of Langerhans cells, and is rapidly internalized from the cell surface. Eur J Immunol 1999; 29 : 2695 – 2704.
53. Vassallo R, Jensen EA, Colby TV et al. The overlap between respiratory bronchiolitis and desquamative interstitial pneumonia in pulmonary Langerhans cell histiocytosis: high‑resolution CT, histologic, and functional correlations. Chest 2003; 124 : 1199 – 1205.
54. Kambouchner M, Basset F, Marchal J et al. Three ‑ dimensional characterization of pathologic lesions in pulmonary Langerhans cell histiocytosis. Am J Respir Crit Care Med 2002; 166 : 1483 – 1490.
55. Watanabe R, Tatsumi K, Hashimoto S et al. Respiratory Failure Research Group of Japan. Clinico ‑ epidemiological features of pulmonary histiocytosis X. Intern Med 2001; 40 : 998 – 1003.
56. Egeler RM, Neglia JP, Puccetti DM et al. Association of Langerhans cell histiocytosis with malignant neoplasms. Cancer 1993; 71 : 865 – 873.
57. Neumann MP, Frizzera G. The coexistence of Langerhans’ cell granulomatosis and malignant lymphoma may take different forms: report of seven cases with a review of the literature. Hum Pathol 1986; 17 : 1060 – 1065.
58. Unger J, England D, Collins J. Miliary nodules, Hodgkin’s disease, and eosinophilic granuloma. J Thorac Imaging 1994; 9 : 71 – 73.
59. Gaensler E, Carrington C. Open biopsy for chronic diffuse infiltrative lung disease: clinical, roentgenographic, and physiological correlations in 502 patients. Ann Thorac Surg 1980; 30 : 411 – 426.
60. Colby TV, Lombard C. Histiocytosis X in the lung. Hum Pathol 1983; 14 : 847 – 856.
61. Thomeer M, Demedts M, Vandeurzen K. Registration of interstitial lung diseases by 20 centres of respiratory medicine in Flanders. Acta Clin Belg 2001; 56 : 163 – 172.
62. Kim CK, Park CB, Jin U et al. Pulmonary Langerhans’ cell histiocytosis presented with recurrent pneumothorax. Interact Cardiovasc Thorac Surg 2006; 5 : 512 – 513.
63. Krawczyk P, Czekajska ‑ Chehab E, Kieszko R et al. Difficulties in the diagnosis of rare immunological diseases manifesting with cystic lung disease and spontaneous pneumothorax: Case reports. Heart Lung 2004; 33 : 21 – 25.
64. Mendez JL, Nadrous HF, Vassallo R et al. Pneumothorax in pulmonary Langerhans cell histiocytosis. Chest 2004; 125 : 1028 – 1032.
65. Minghini A, Trogdon SD. Recurrent spontaneous pneumothorax in pulmonary histiocytosis X. Am Surg 1998; 64 : 1040 – 1042.
66. Knight RK. Haemoptysis in eosinophilic granuloma. Br J Dis Chest 1979; 73 : 181 – 186.
67. Tazi A. Adult pulmonary Langerhans’ cell histiocytosis. Eur Respir J 2006; 27 : 1272 – 1285.
68. Yağci B, Varan A, Cağlar M et al. Langerhans cell histiocytosis: retrospective analysis of 217 cases in a single center. Pediatr Hematol Oncol 2008; 25 : 399 – 408.
69. Lieberman PH, Jones CR, Steinman RM et al. Langerhans cell (eosinophilic) granulomatosis. A clinicopathologic study encompassing 50 years. Am J Surg Pathol 1996; 20 : 519 – 552.
70. Ryu JH, Colby TV, Hartman TE et al. Smoking‑related interstitial lung diseases: a concise review. Eur Respir J 2001; 17 : 122 – 132.
71. ten Velde GP, Thunnissen FB, van Engelshoven JM et al. A solitary pulmonary nodule due to eosinophilic granuloma. Eur Respir J 1994; 7 : 1539 – 1540.
72. Brambilla E, Fontaine E, Pison CM et al. Pulmonary histiocytosis X with mediastinal lymph node involvement. Am Rev Respir Dis 1990; 142 : 1216 – 1218.
73. Tazi A, Soler P, Hance AJ. Adult pulmonary Langerhans’ cell histiocytosis. Thorax 2000; 55 : 405 – 416.
74. Vassallo R, Limper AH. Pulmonary Langerhans’ cell histiocytosis. Semin Respir Crit Care Med 2002; 23 : 93 – 101.
75. Vassallo R, Ryu JH, Colby TV et al. Pulmonary Langerhans’ ‑ cell histiocytosis. N Engl J Med 2000; 342 : 1969 – 1978.
76. Vassallo R, Ryu JH, Schroeder DR et al. Clinical outcomes of pulmonary Langerhans’ ‑ cell histiocytosis in adults. N Engl J Med 2002; 346 : 484 – 490.
77. Vassallo R, Ryu JH. Pulmonary Langerhans’ cell histiocytosis. Clin Chest Med 2004; 25 : 561 – 571.
78. Sundar KM, Gosselin MV, Chung HL et al. Pulmonary Langerhans cell histiocytosis: emerging concepts in pathobiology, radiology, and clinical evolution of disease. Chest 2003; 123 : 1673 – 1683.
79. Lin MW, Chang YL, Lee YC et al. Pulmonary Langerhans cell histiocytosis. Lung 2009; 187 : 261 – 262.
80. Brauner MW, Grenier P, Mouelhi MM et al. Pulmonary histiocytosis X: evaluation with high‑resolution CT. Radiology 1989; 172 : 255 – 258.
81. Brauner MW, Grenier P, Tijani K et al. Pulmonary Langerhans cell histiocytosis: evolution of lesions on CT scans. Radiology 1997; 204 : 497 – 502.
82. Pipavath S, Godwin JD. Imaging of interstitial lung disease. Clin Chest Med 2004; 25 : 455 – 465.
83. Moore AD, Godwin JD, Müller NL et al. Pulmonary histiocytosis X: comparison of radiographic and CT findings. Radiology 1989; 172 : 249 – 254.
84. Vrielynck S, Mamou ‑ Mani T, Emond S et al. Diagnostic value of high‑resolution CT in the evaluation of chronic infiltrative lung disease in children. AJR Am J Roentgenol 2008; 191 : 914 – 920.
85. Soler P, Bergeron A, Kambouchner M et al. Is high‑resolution computed tomography a reliable tool to predict the histopathological activity of pulmonary Langerhans cell histiocytosis? Am J Respir Crit Care Med 2000; 162 : 264 – 270.
86. Aricò M, Egeler RM. Clinical aspects of Langerhans cell histiocytosis. Hematol Oncol Clin North Am 1998; 12 : 247 – 258.
87. Aricò M, Haupt R, Russotto VS et al. Langerhans cell histiocytosis in two generations: a new family and review of the literature. Med Pediatr Oncol 2001; 36 : 314 – 316.
88. Friedman PJ, Liebow AA, Sokoloff J. Eosinophilic granuloma of lung. Clinical aspects of primary histiocytosis in the adult. Medicine (Baltimore) 1981; 60 : 385 – 396.
89. Crausman RS, Jennings CA, Tuder RM et al. Pulmonary histiocytosis X: pulmonary function and exercise pathophysiology. Am J Respir Crit Care Med 1996; 153 : 426 – 435.
90. Basset F, Corrin B, Spencer H et al. Pulmonary histiocytosis X. Am Rev Respir Dis 1978; 118 : 811 – 820.
91. Schönfeld N, Frank W, Wenig S et al. Clinical and radiologic features, lung function and therapeutic results in pulmonary histiocytosis X. Respiration 1993; 60 : 38 – 44.
92. Schönfeld N. Pulmonary Langerhans cell histiocytosis. Pneumologie 2003; 57 : 159 – 165.
93. Travis WD, Borok Z, Roum JH et al. Pulmonary Langerhans cell granulomatosis (histiocytosis X). A clinicopathologic study of 48 cases. Am J Surg Pathol 1993; 17 : 971 – 986.
94. Wall CP, Gaensler EA, Carrington CB et al. Comparison of transbronchial and open biopsies in chronic infiltrative lung diseases. Am Rev Respir Dis 1981; 123 : 280 – 285.
95. Housini I, Tomashefski JF Jr, Cohen A et al. Transbronchial biopsy in patients with pulmonary eosinophilic granuloma. Comparison with findings on open lung biopsy. Arch Pathol Lab Med 1994; 118 : 523 – 530.
96. Mayer J, Skřičková J, Vorlíček J. Postižení plic u imunokompromitovaných nemocných. Diferenciální diagnostika a využití bronchoalveolární laváže. Brno: Institut pro další vzdělávání pracovníků ve zdravotnictví 1995.
97. Hance AJ. Pulmonary immune cells in health and disease: dendritic cells and Langerhans’ cells. Eur Respir J 1993; 6 : 1213 – 1220.
98. Soler P, Moreau A, Basset F et al. Cigarette smoking‑induced changes in the number and differentiated state of pulmonary dendritic cells/ Langerhans cells. Am Rev Respir Dis 1989; 139 : 1112 – 1117.
99. Casolaro MA, Bernaudin JF, Saltini C et al. Accumulation of Langerhans’ cells on the epithelial surface of the lower respiratory tract in normal subjects in association with cigarette smoking. Am Rev Respir Dis 1988; 137 : 406 – 411.
100. Auerswald U, Barth J, Magnussen H. Value of CD ‑ 1 - positive cells in bronchoalveolar lavage fluid for the diagnosis of pulmonary histiocytosis X. Lung 1991; 169 : 305 – 309.
101. Chollet S, Soler P, Dournovo P et al. Diagnosis of pulmonary histiocytosis X by immunodetection of Langerhans cells in bronchoalveolar lavage fluid. Am J Pathol 1984; 115 : 225 – 232.
102. Colasante A, Poletti V, Rosini S et al. Langerhans cells in Langerhans cell histiocytosis and peripheral adenocarcinomas of the lung. Am Rev Respir Dis 1993; 148 : 752 – 759.
103. Takizawa Y, Taniuchi N, Ghazizadeh M et al. Bronchoalveolar lavage fluid analysis provides diagnostic information on pulmonary Langerhans cell histiocytosis. J Nippon Med Sch 2009; 76 : 84 – 92.
104. Tötsch M, Guzman J, Theegarten D et al. Bronchoalveolar lavage. Pathologe 2007; 28 : 346 – 353.
105. Zeppa P, Cozzolino I, Russo M et al. Pulmonary langerhans cell histiocytosis (histiocytosis X) on bronchoalveolar lavage: a report of 2 cases. Acta Cytol 2007; 51 : 480 – 482.
106. Krenács L, Tiszalvicz L, Krenács T et al. Immunohistochemical detection of CD1A antigen in formalin‑fixed and paraffin‑embedded tissue sections with monoclonal antibody 010. J Pathol 1993; 171 : 99 – 104.
107. Wang CW, Colby TV. Histiocytic lesions and proliferations in the lung. Semin Diagn Pathol 2007; 24 : 162 – 182.
108. Emile JF, Wechsler J, Brousse N et al. Langerhans’ cell histiocytosis. Definitive diagnosis with the use of monoclonal antibody O10 on routinely paraffin‑embedded samples. Am J Surg Pathol 1995; 19 : 636 – 641.
109. Howarth DM, Gilchrist GS, Mullan BP et al. Langerhans cell histiocytosis: diagnosis, natural history, management, and outcome. Cancer 1999; 85 : 2278 – 2290.
110. Johnson S. Rare diseases. 1. Lymphangioleiomyomatosis: clinical features, management and basic mechanisms. Thorax 1999; 54 : 254 – 264.
111. Muzzi L, Pini Prato GP, Ficarrat G. Langerhans’ cell histiocytosis diagnosed through periodontal lesions: a case report. J Periodontol 2002; 73 : 1528 – 1533.
112. Nagai S. Pulmonary Langerhans’ cell histiocytosis (LCH): epidemiology and clinical courses. Intern Med 2001; 40 : 981 – 982.
113. Ouyang DL, Roberts BK, Gibbs IC et al. Isolated Langerhans cell histiocytosis in an adult with central diabetes insipidus: case report and review of literature. Endocr Pract 2006; 12 : 660 – 663.
114. Powers MA, Askin FB, Cresson DH. Pulmonary eosinophilic granuloma. 25‑year follow‑up. Am Rev Respir Dis 1984; 129 : 503 – 507.
115. Unel SY, Ozaslan H, Solmaz D et al. Reversible pulmonary Langerhans’ cell histiocytosis. JBR ‑ BTR 2009; 92 : 172 – 173.
116. Valliani L, Kanwar VS, Schwartz A. Isolated pulmonary Langerhans cell histiocytosis with recurrent bilateral pneumothoraces treated with chemotherapy and chemical pleurodesis. Pediatr Blood Cancer 2009; 53 : 128 – 129.
117. Marten K. Smoking‑related interstitial lung diseases. Rofo 2007; 179 : 268 – 275.
118. Mogulkoc N, Veral A, Bishop PW et al. Pulmonary Langerhans’ cell histiocytosis: radiologic resolution following smoking cessation. Chest 1999; 115 : 1452 – 1455.
119. Negrin‑Dastis S, Butenda D, Dorzee J e al. Complete disappearance of lung abnormalities on high‑resolution computed tomography: a case of histiocytosis X. Can Respir J 2007; 14 : 235 – 237.
120. Tomashefski JF, Khiyami A, Kleinerman J. Neoplasms associated with pulmonary eosinophilic granuloma. Arch Pathol Lab Med 1991; 115 : 499 – 506.
121. Writing Group of the Histiocyte Society. Histiocytosis syndromes in children. Lancet 1987; 1 : 208 – 209.
122. Pappas CA, Rheinlander HF, Stadecker MJ. Pleural effusion as a complication of solitary eosinophilic granuloma of the rib. Hum Pathol 1980; 11 : 675 – 677.
123. Delobbe A, Durieu J, Duhamel A. Groupe d’Etude en Pathologie Interstitielle de la Société de Pathologie Thoracique du Nord. Determinants of survival in pulmonary Langerhans’ cell granulomatosis (histiocytosis X). Eur Respir J 1996; 9 : 2002 – 2006.
124. Fartoukh M, Humbert M, Capron F et al. Severe pulmonary hypertension in histiocytosis X. Am J Respir Crit Care Med 2000; 161 : 216 – 223.
125. Favara BE, Feller AC, Pauli M et al. Contemporary classification of histiocytic disorders. The WHO Committee on Histiocytic/ Reticulum Cell Proliferations. Reclassification Working Group of the Histiocyte Society. Med Pediatr Oncol 1997; 29 : 157 – 166.
126. Hamada K, Teramoto S, Narita N et al. Pulmonary veno‑occlusive disease in pulmonary Langerhans’ cell granulomatosis. Eur Respir J 2000; 15 : 421 – 423.
127. Lombard CM, Medeiros LJ, Colby TV. Pulmonary histiocytosis X and carcinoma. Arch Pathol Lab Med 1987; 111 : 339 – 341.
128. Sadoun D, Vaylet F, Valeyre D et al. Bronchogenic carcinoma in patients with pulmonary histiocytosis X. Chest 1992; 101 : 1610 – 1613.
129. Zeid NA, Muller HK. Tobacco smoke induced lung granulomas and tumours: association with pulmonary Langerhans cells. Pathology 1995; 27 : 247 – 254.
130. Von Essen S, West W, Sitorius M et al. Complete resolution of roentgenographic changes in a patient with pulmonary histiocytosis X. Chest 1990; 98 : 765 – 767.
131. Malpas JS. Langerhans cell histiocytosis in adults. Hematol Oncol Clin North Am 1998; 12 : 259 – 268.
132. Boehler A. Lung transplantation for cystic lung diseases: lymphangioleiomyomatosis, histiocytosis x, and sarcoidosis. Semin Respir Crit Care Med 2001; 22 : 509 – 516.
133. Sulica R, Teirstein A, Padilla ML. Lung transplantation in interstitial lung disease. Curr Opin Pulm Med 2001; 7 : 314 – 322.
134. Etienne B, Bertocchi M, Gamondes JP et al. Relapsing pulmonary Langerhans cell histiocytosis after lung transplantation. Am J Respir Crit Care Med 1998; 157 : 288 – 291.
135. Gabbay E, Dark JH, Ashcroft T et al. Recurrence of Langerhans’ cell granulomatosis following lung transplantation. Thorax 1998; 53 : 326 – 327.
136. Habib SB, Congleton J, Carr D et al. Recurrence of recipient Langerhans’ cell histiocytosis following bilateral lung transplantation. Thorax 1998; 53 : 323 – 325.
137. Kasmani R, Narwal ‑ Chadha R, Naveed S et al. Isolated pulmonary Langerhans cell histiocytosis. QJM 2009; 102 : 741 – 742.
138. Konno S, Hizawa N, Betsuyaku T et al. Adult Langerhans cell histiocytosis with independently relapsing lung and liver lesions that was successfully treated with etoposide. Intern Med 2007; 46 : 1231 – 1235.
139. Koschel D, Müller ‑ Wening D. Pulmonary Langerhans ‑ cell histiocytosis. Med Klin (Munich) 2003; 98 : 461 – 463.
140. Lacronique J, Roth C, Battesti JP et al. Chest radiological features of pulmonary histiocytosis X: a report based on 50 adult cases. Torax 1982; 37 : 104 – 109.
141. Saven A, Burian C. Cladribine activity in adult Langerhans ‑ cell histiocytosis. Blood 1999; 93 : 4125 – 4130.
142. Pardanani A, Phyliky RL, Li CY et al. 2‑chlorodeoxyadenosine therapy for disseminated Langerhans cell histiocytosis. Mayo Clin Proc 2003; 78 : 301 – 306.
143. Goh NS, McDonald CE, MacGregor DP et al. Successful treatment of Langerhans cell histiocytosis with 2‑chlorodeoxyadenosine. Respirology 2003; 8 : 91 – 94.
144. Lazor R, Etienne ‑ Mastroianni B, Khouatra C et al. Progressive diffuse pulmonary Langerhans cell histiocytosis improved by cladribine chemotherapy. Thorax 2009; 64 : 274 – 275.
145. Weitzman S, Braier J, Donadieu J et al. 2’ ‑ Chlorodeoxyadenosine (2 – CdA) as salvage therapy for Langerhans cell histiocytosis (LCH). Results of the LCH ‑ S ‑ 98 protocol of the Histiocyte Society. Pediatr Blood Cancer 2009; 53 : 1271 – 1276.
146. von Stebut E, Schadmand ‑ Fischer S, Bräuninger W et al. Successful treatment of adult multisystemic Langerhans cell histiocytosis with psoralen ‑ UV ‑ A, prednisolone, mercaptopurine, and vinblastine. Arch Dermatol 2008; 144 : 649 – 653.
147. Henter JI, Karlén J, Calming U et al. Successful treatment of Langerhans’ ‑ cell histiocytosis with etanercept. N Engl J Med 2001; 345 : 1577 – 1578.
148. McClain KL, Kozinetz CA. A phase II trial using thalidomide for Langerhans cell histiocytosis. Pediatr Blood Cancer 2007; 48 : 44 – 49.
149. Rodríguez HN, García I, Alba A et al. Infliximab‑induced reactivated Langerhan’s cell histiocytosis in a patient with ulcerative colitis. Inflamm Bowel Dis 2009; 15 : 1286 – 1287.
150. Calming U, Jacobsson H, Henter JI. Detection of Langerhans cell histiocytosis lesions with somatostatin analogue scintigraphy – a preliminary report. Med Pediatr Oncol 2000; 35 : 462 – 467.
151. Weinmann P, Crestani B, Tazi A et al. 111In ‑ pentetreotide scintigraphy in patients with Langerhans’ cell histiocytosis. J Nucl Med 2000; 41 : 1808 – 1812.
152. Lastoria S, Montella L, Catalano L et al. Functional imaging of Langerhans cell histiocytosis by 111In ‑ DTPA ‑ D ‑ Phe1 - octreotide scintigraphy. Cancer 2002; 94 : 633 – 640.
153. Weiss SE, O’Connor L, Welsh JS. Refinement of radiation therapy based on PET data in an adult with Langerhans cell histiocytosis of soft tissues. Clin Adv Hematol Oncol 2006; 4 : 290 – 292.
154. Steiner M, Prayer D, Asenbaum S et al. Modern imaging methods for the assessment of Langerhans’ cell histiocytosis‑associated neurodegenerative syndrome: case report. J Child Neurol 2005; 20 : 253 – 257.
155. Schmidt GP, Reiser MF, Baur ‑ Melnyk A. Whole ‑ body imaging of bone marrow. Semin Musculoskelet Radiol 2009; 13 : 120 – 133.
156. Derenzini E, Fina MP, Stefoni V et al. MACOP ‑ B regimen in the treatment of adult Langerhans cell histiocytosis: experience on seven patients. Ann Oncol 2010; 21 : 1173 – 1118.
157. Phillips M, Allen C, Gerson P et al. Comparison of FDG ‑ PET scans to conventional radiography and bone scans in management of Langerhans cell histiocytosis. Pediatr Blood Cancer 2009; 52 : 97 – 101.
158. Ribeiro MJ, Idbaih A, Thomas C et al. 18F ‑ FDG PET in neurodegenerative Langerhans cell histiocytosis: results and potential interest for an early diagnosis of the disease. J Neurol 2008; 255 : 575 – 580.
159. Arnaud L, Malek Z, Archambaud F et al. 18F ‑ fluorodeoxyglucose‑positron emission tomography scanning is more useful in followup than in the initial assessment of patients with Erdheim ‑ Chester disease. Arthritis Rheum 2009; 60 : 3128 – 3138.
160. Tan IB, Padhy AK, Thng CH et al. Intensely hypermetabolic extra ‑ axial brainstem tumor in Erdheim ‑ Chester disease. Clin Nucl Med 2009; 34 : 604 – 607.
161. Takahashi T, Yoshimoto M, Kondoh N. Spontaneously regressed Langerhans cell histiocytosis of lymph nodes in an elderly patient. Intern Med 2007; 46 : 1757 – 1760.
162. Kaste SC, Rodriguez ‑ Galindo C, McCarville ME et al. PET‑CT in pediatric Langerhans cell histiocytosis. Pediatr Radiol 2007; 37 : 615 – 622.
163. Binkovitz LA, Olshefski RS, Adler BH. Coincidence FDG ‑ PET in the evaluation of Langerhans’ cell histiocytosis: preliminary findings. Pediatr Radiol 2003; 33 : 598 – 602.
164. Blum R, Seymour JF, Hicks RJ. Role of FDG ‑ positron emission tomography scannin in the management of histiocytosis. Leukem Lymphoma 2002; 43 : 2155 – 2157.
165. Calming U, Bemstrand C, Mosskin M et al. Brain 18FDG PET scan in central nervous system langerhans cell histiocytosis. J Pediatr 2002; 141 : 435 – 440.
166. Aoki J, Watanabe H, Shinozaki T et al. FDG PET of primary benign and malignant bone tumors: standardized uptake value in 52 lesions. Radiology 2001; 219 : 774 – 777.
167. Giovanella L, Ceriani L, Crippa S et al. Imaging in endocrinolgy: Langerhans cell histiocytosis of the thyroid gland detected by 18FDG ‑ PET/ CT. J Clin Endocrinol Metab 2007; 92 : 2866 – 2867.
168. Büchler T, Cervinek L, Belohlavek O et al. Langerhans cell histiocytosis with central nervous systém involvement: follow‑up by FDG ‑ PET during treatment with cladribine. Pediatr Blood Cancer 2005; 44 : 286 – 288.
169. Feurestein IM, Archer A, Pluda JM et al. Thin‑walled cavities, cysts, and pneumothorax in Pneumocystis carinii pneumonia: further observations with histopathologic correlation. Radiology 1990; 174 : 697 – 702.
170. Khoor A, Myers JL, Tazelaar HD et al. Pulmonary Langerhans cell histiocytosis presenting as a solitary nodule. Mayo Clin Proc 2001; 76 : 209 – 211.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2010 Issue 12-
All articles in this issue
- Markers of endothelial function in the early stages of essential hypertension and the effect of antihypertensive therapy
- HIV lipodystrophy
- Metformin as the first line antidiabetic agent
- Pulmonary Langerhans cell histiocytosis – evaluation of the disease activity and treatment response using PET‑CT (SUVmax Pulmo/ SUVmax Hepar index). Description of own experience and literature review
- Influence of jodine saturation on thyreopathy incidence in selected regions of the Czech Republic
- Activity of the hypothalamic – pituitary – adrenal axis in patients with rheumatoid arthritis
- Evaluation of 11β- hydroxysteroid dehydrogenase type 1 activity in female patients with rheumatoid arthritis
- Genetic background of adrenal cortex tumours – news
- Immunoendocrine associations in adrenal glands
- Extremly low SHBG level in consequence of Pro156Leu SHBG polymorphism – case reports of two women with polycystic ovary syndrome
- Genetic background of tumors originating from adrenomedullar and extraadrenal chromaffin tissue – update
- Birth weight and genetic risk of type 2 diabetes in Czech population
- Iodine deficiency in the world and in the Czech Republic – current status and perspectives
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Extremly low SHBG level in consequence of Pro156Leu SHBG polymorphism – case reports of two women with polycystic ovary syndrome
- Pulmonary Langerhans cell histiocytosis – evaluation of the disease activity and treatment response using PET‑CT (SUVmax Pulmo/ SUVmax Hepar index). Description of own experience and literature review
- Activity of the hypothalamic – pituitary – adrenal axis in patients with rheumatoid arthritis
- HIV lipodystrophy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

