-
Medical journals
- Career
Možnosti studia transendoteliální migrace in vitro
Authors: L. Knopfová 1; P. Bouchal 2; J. Šmarda 1
Authors‘ workplace: Ústav experimentální biologie, Přírodovědecká fakulta MU, Brno 1; Regionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav, Brno 2
Published in: Klin Onkol 2014; 27(Supplementum): 28-33
Overview
Nejzávažnější komplikací nádorových onemocnění je vznik vzdálených metastáz. K šíření do vzdálených orgánů využívají nádorové buňky často krevní cirkulaci. Vstup do krevního oběhu a průchod stěnou kapiláry do cílového sekundárního místa umožňují kolonizaci jiných orgánů a vznik život ohrožujících metastáz. Průchod stěnou cévy (transendoteliální migrace) je zásadní krok metastatické kaskády a poznání mechanizmů řídících tento proces by jistě přispělo k vytváření nových strategií pro cílenou proti ‑ metastatickou terapii. Existuje několik způsobů, jak studovat transendoteliální migraci v živých modelových organizmech (in vivo). Jejich výhoda je, že poskytují komplexní fyziologické mikroprostředí, jsou ale nákladné a technicky náročné. Proto se používají stále dokonalejší techniky pro sledování transendoteliální migrace in vitro. Jsou obecně dostupnější a méně náročné na vybavení, ale i v rámci metod studia transendoteliální migrace in vitro existuje značná variabilita ve složitosti provedení, požadavcích na speciální přístrojové vybavení, přesnosti simulace podmínek in vivo a v relevanci pro onkologické aplikace. Technické přístupy ke studiu transendoteliální migrace in vitro, jejich rozdělení, modifikace, výhody a nevýhody jsou předmětem tohoto přehledového článku.
Klíčová slova:
transendoteliální migrace – extravazace – endoteliální buňky – metastáza – transwell systémÚvod
Transendoteliální migrace (diapedéza) je proces průchodu buněk přes endotel. Může vést oběma směry: buňka může směřovat z lumen cévy/ kapiláry do parenchymu cílového orgánu (extravazace), nebo naopak vstupovat ze subendoteliální tkáně do cirkulace (intravazace). Fyziologicky k ní dochází např. během zánětu, kdy leukocyty přitahované prozánětlivými molekulami vystupují z krevního řečiště do poškozené tkáně. U nádorových onemocnění dochází k interakci s endotelem během angiogeneze a metastatického šíření nádoru. Do míst vzdálených primárnímu tumoru jsou nádorové buňky často distribuovány krevním systémem, což předpokládá dvojí průnik nádorových buněk endoteliální bariérou. Invazivní buňky unikají z tkáně primárního karcinomu do krevního řečiště, přežívají jako cirkulující nádorové buňky, v cílovém místě prostupují stěnou kapiláry a v novém mikroprostředí mohou přežívat ve stavu dormance, případně dát vznik sekundárnímu nádoru [1].
Molekulární mechanizmy řídící interakci nádorových buněk s endotelem jsou tedy s ohledem na potenciální terapeutické využití a prevenci metastatického rozsevu předmětem intenzivního výzkumu. Zkoumání transendoteliální migrace (TEM) in vivo je znesnadněno tím, že se jedná o proces probíhající uvnitř tkání organizmu, v komplexním mikroprostředí a často v obtížně predikovatelných místech [2]. Nicméně pro studium intravazace lze využít zobrazovací techniky intravitální mikroskopie, extravazaci in vivo je možné hodnotit z hlediska účinnosti na úrovni buněčných populací podle přítomnosti značených buněk v parenchymu cílových orgánů [3 – 5]. Nedostatky těchto strategií, jako jsou špatné prostorové rozlišení intravitální mikroskopie, nákladnost, nutnost použití modelových zvířat a jejich výběr, vyvažuje komplexní fyziologické mikroprostředí TEM. Alternativu těmto přístupům in vivo nabízejí systémy pro sledování TEM in vitro, jejichž rozdělení a popis je předmětem tohoto přehledového článku.
Možnosti studia transendoteliální migrace in vitro
Techniky pro studium TEM in vitro lze rozdělit podle substrátu, na němž se formuje vrstva endoteliálních buněk (endotelial cell – EC). Některé techniky využívají tzv. transwell systém, kdy EC pokrývají porézní polyesterovou nebo polykarbonátovou membránu, jiné zajišťují 3D kultivační podmínky, obvykle reprezentované 3D kolagenovým gelem převrstveným endoteliálními buňkami. Podle způsobu monitorování TEM in vitro se rozlišují metody mikroskopické a nemikroskopické. Mikroskopické i nemikroskopické metody sledování TEM můžeme dále rozdělit na ty, které analyzují jeden (konečný) časový bod procesu, a na ty, které umožňují zaznamenávat TEM v reálném čase (časosběrná mikroskopie nebo monitorování změn impedance). Podle dalšího kritéria se rozlišují statické systémy TEM in vitro, systémy fluidní a třepací („rocking“) [6 – 8]. Níže budou popsány jednotlivé techniky studia TEM in vitro a jejich modifikace.
Statické systémy
Transwell techniky pro sledování transendoteliální migrace
Základní transwell systém pro sledování TEM (obr. 1A) sestává z dvoukomorové kultivační jamky přehrazené porézním filtrem (velikost pórů obvykle 5 – 8 µm) [9 – 11]. Na horní stranu filtru jsou nasazeny EC, přitom adhezivní vlastnosti membrány jsou obvykle zlepšeny předchozím ošetřením roztoky obsahujícími složky extracelulární matrix (ECM), jako jsou fibronektin, vitronektin, kolagen, matrigel nebo želatina, za vzniku tenké vrstvy ECM [5,9,12,13]. Používají se různé typy EC: komerčně dostupné lidské EC z pupečníkové žíly (HUVEC) [10,14], primární lidské mikrovaskulární EC z různých orgánů [11,15], EC z aorty (HAEC) [16], imortalizovaná linie myších EC z pankreatu (MS1) [17], primární myší mikrovaskulární EC izolované z různých orgánů [5,8]. Jakmile EC zaplní plochu membrány a dosáhnou konfluence, což lze ověřit testem na permeabilitu EC pomocí dextranu konjugovaného s fluoroforem nebo měřením transendoteliální elektrické rezistence (TEER) [18,19], přidají se do horní části nádorové buňky. Spodní část jamky je naplněna médiem s chemoatraktantem podporujícím prostup nádorových buněk vrstvou endotelu a membránou. TEM se obvykle vyhodnocuje 4 – 24 hodin po přidání nádorových buněk (časový bod pro zastavení TEM je nutno stanovit empiricky pro každou kombinaci buněčných linií) [9,12,14,20]. Hodnotí se přítomnost nádorových buněk na spodní straně membrány, případně ve spodní části transwell jamky [5,9]. Četnost buněk se posuzuje vizuálně po fixaci, případně po barvení (pokud nejsou označeny předem) [12,14,21], nebo se kvantifikace provádí fluorimetricky, event. průtokovou cytometrií při značení buněk fluorescenčními sondami [13,20,22]. Toto výchozí uspořádání transwell experimentu je snadno sestavitelné, nevyžaduje speciální vybavení, umožňuje kvantifikaci, ale nenabízí možnost pozorovat jednotlivé fáze TEM.
Image 1. Schematické znázornění statických systémů pro detekci TEM. A. Základní složky transwell systému TEM; B. transwell model krevně-mozkové bariéry; C. modifi kace transwell metodiky: TEM v přítomnosti krevních buněk; D. transwell model pro studium intravazace in vitro; E. transwell inzert v misce se skleněným dnem pro mikroskopickou detekci TEM; F. 3D model TEM. TC – nádorová buňka, EC – endoteliální buňka 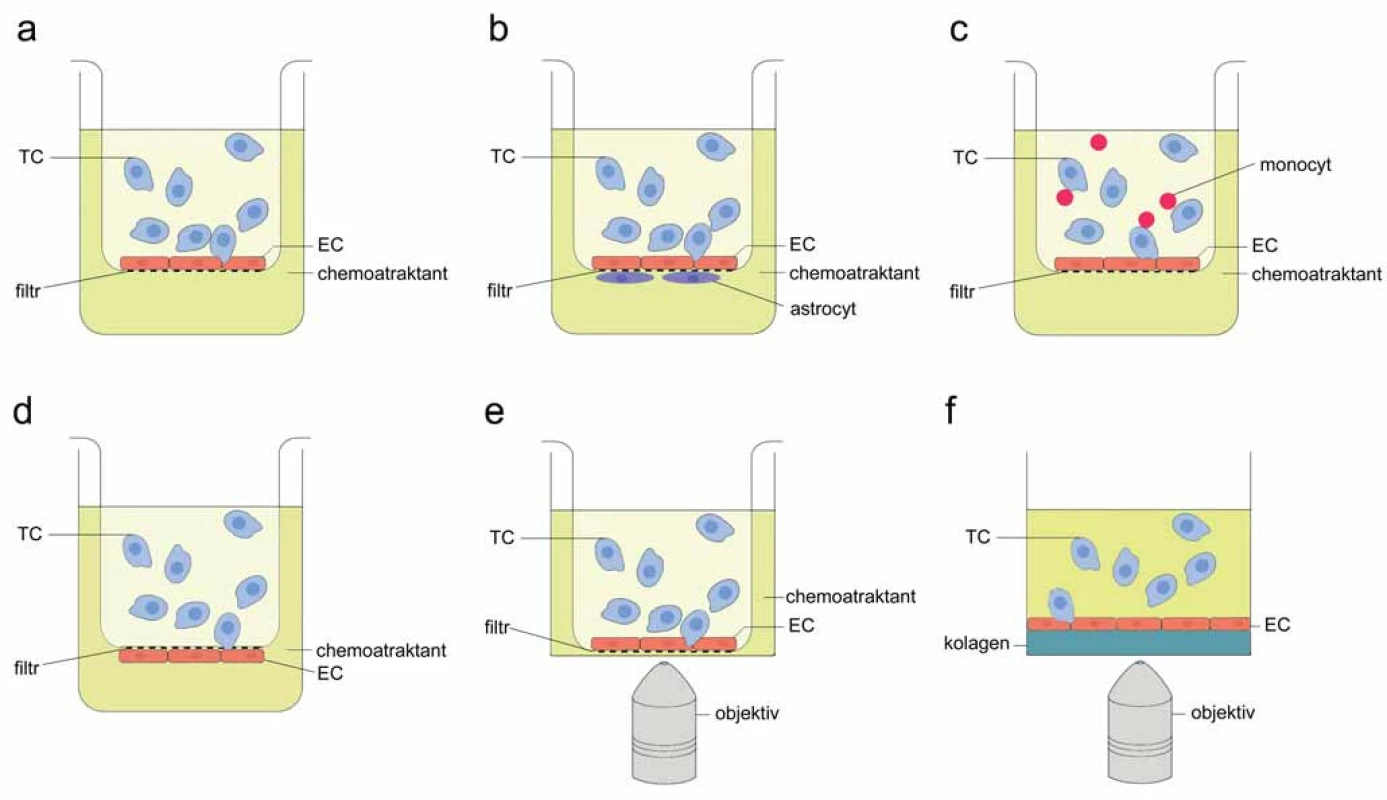
Používají se proto i různé modifikace tohoto přístupu vyvažující některé nedostatky. Jako alternativní způsob hodnocení TEM (k „end‑point“ detekci) lze použít odečítání změn impedance na spodní straně membrány transwell jamky. Kromě přístrojového vybavení (např. xCELLigence real time cell analyzer) jsou k tomu nezbytné speciálně upravené transwell jamky (CIM ‑ plates) obsahující mikroelektrody na spodní straně membrány. Nádorové buňky procházející vrstvou EC a póry v membráně se dostávají do kontaktu s mikroelektrodami. Jejich přítomnost způsobuje změnu impedance a ta se odečítá v libovolných časových intervalech. Poměrně k počtu transmigrujících buněk narůstá v čase buněčný index odpovídající změně impedance, což umožňuje monitorování TEM v reálném čase (Knopfová et al, dosud nepublikováno). Pro rozlišení signálu generovaného samotnými EC je nutno jako kontrolu měřit impedanci v jamkách, do kterých nebyly přidány nádorové buňky.
Další možnost, jak zachytit dynamiku interakce nádorových a endoteliálních buněk během TEM na transwell membránách, nabízí mikroskopie. Inzerty s membránami (horní část transwell jamky) pokrytými EC jsou po přidání suspenze označených nádorových buněk položeny na misky se skleněným dnem (obr. 1E). Během inkubace ve vyhřívané komoře mikroskopu jsou v pravidelných intervalech snímány buňky v různých rovinách vzorku (nad membránou, v úrovni membrány i pod ní) [23]. Tento přístup dovoluje zachytit buňky v jednotlivých krocích během migrace přes endotel a membránu i sekvenci těchto kroků. Takto bylo zjištěno, že mezenchymální kmenové buňky procházejí mezi EC (nikoli skrz EC) dočasně vytvořenými mezerami, které se nad transmigrující buňkou zacelují [23]. Zobrazovací techniky se však potýkají se špatnými optickými vlastnostmi transwell membrány, zajištění dostatečného rozlišení vyžaduje velmi nákladné vybavení (konfokální mikroskop pro snímání živých buněk a objektiv s dlouhou pracovní vzdáleností).
Transwell systém lze modifikovat pro speciální účely, např. pro simulaci krevně‑mozkové bariéry (obr. 1B). Malin et al uzpůsobili transwell uspořádání pro kokultivaci EC a astrocytů – na spodní část transwell membrány aplikovali primární lidské astrocyty, po jejich přisednutí inzert obrátili a do horní části nasadili linii lidských mikrovaskulárních EC z mozku (HBMEC) [11]. Podobně jako při výchozích transwell testech byly po dosažení konfluence EC ke kokultuře přidány značené nádorové buňky a po čase vyhodnocena jejich přítomnost na spodní části inzertu [11]. Jednodušší verze pokusu vynechává kultivaci astrocytů pod vrstvou EC a pro napodobení krevně‑mozkové bariéry se bazální pól primárních EC z mozku vystavuje médiu, v němž byly astrocyty kultivovány [19], případně se astrocyty nasadí na dno spodní části transwell jamky [24]. Faktory sekretované astrocyty podporují utěsnění adhezivních spojů mezi EC [19].
Obrácené pořadí jednotlivých vrstev v transwell testech TEM lze využít pro modelování intravazace (obr. 1D). V klasické transwell sestavě přicházejí nádorové buňky nejdříve do kontaktu s apikální (luminální) stranou EC, poté procházejí skrz subendoteliální ECM a membránu. Toto uspořádání simuluje extravazaci in vivo, kdy nádorové buňky opouští lumen cévy, interagují s EC a následně s bazální membránou obklopující cévu. Protože schopnost extravazace a intravazace nejsou funkčně ekvivalentní [1], používá se pro testování intravazace in vitro transwell inzert, jehož spodní strana je upravena tenkou vrstvou ECM a překryta EC [10]. Po inkubaci nutné k získání celistvé vrstvy EC se inzert obrátí a horní část se naplní suspenzí nádorových buněk. Spodní část slouží jako rezervoár kultivačního média s chemoatraktantem, případně s jinými testovanými látkami. Takto vstupují nádorové buňky nejdříve do kontaktu se subendoteliální vrstvou ECM a s bazálním pólem EC [10]. Orientace nádorových a endoteliálních buněk tak odpovídá situaci in vivo během intravazace, kdy izolovaná buňka nádoru vniká z extraluminálního prostoru do cirkulace.
Kromě astrocytů mohou být tradiční transwell TEM experimenty obohaceny dalším typem buněk, monocyty [5]. Bylo prokázáno, že myeloidní buňky se aktivně účastní TEM a diseminace nádorů in vivo [5,25,26]. Přítomnost leukocytů v kokultuře nádorových a endoteliálních buněk přispívá k simulaci fyziologicky relevantních podmínek extravazace. Postup i složky transwell experimentu zůstávají stejné, jen se do horní části jamky k suspenzi nádorových buněk přidá pětinásobné množství monocytů (obr. 1C). Tato varianta transwell systému pomáhá lépe odhadovat metastatickou aktivitu buněk in vivo. Například nádorové buňky MC ‑ 38 neschopné za normálních podmínek migrovat vrstvou primárních EC procházejí endotelem v přítomnosti primárních monocytů izolovaných z kostní dřeně myší [5].
Trojrozměrné modely transendoteliální migrace in vitro
Zatímco transwell systémy se pro svou jednoduchost hojně používají pro kvantifikaci TEM in vitro, nefyziologická bariéra, jakou je porézní membrána, komplikuje získání informací o morfologii buněk, organizaci biomembránových struktur a/ nebo mezibuněčných kontaktů během jednotlivých fází TEM [27]. Deformaci buněk během průchodu transwell membránou je možno předejít použitím trojrozměrných gelů jako substrátů pro formování monovrstvy EC [27,28] (obr. 1F). Jako 3D fibrilární matrix se obvykle používá extrakt bazální membrány (matrigel) [15] nebo kolagen typu I [22,28], který v neutrálním pH a při teplotě 37 °C tuhne za vzniku průsvitné gelové struktury, jejíž pevnost je dána koncentrací kolagenu. Tloušťka gelu limituje rozlišení, pro vyšší rozlišení (63 – 100× objektiv) jsou nezbytné gely tenčí než 100 µm [28]. Roztok kolagenu nebo matrigelu se aplikuje na kultivační misku se skleněným dnem, po ztuhnutí se povrch gelu může ještě upravit fibronektinem a na něj se v požadované hustotě nasadí EC [29]. Růst EC lze snadno vizuálně kontrolovat. Ke konfluentním buňkám se přidá suspenze značených testovaných buněk. Ke značení se používají fluorescenční sondy permeabilní pro membránu živých buněk, jako je CellTraceTM, CellTrackerTM, Calcein AM, karboxyfluorescein diacetát sukcinimidyl ester CFSE, případně transfekce plazmidy kódujícími fluorescenční proteiny [15,22,28]. Je možné takto označit také specifické buněčné struktury, např. F ‑ actin pomocí LifeAct peptidu konjugovaného s fluorescenční značkou, a sledovat tak dynamickou distribuci cílového proteinu během TEM [28].
Vyhodnocení TEM spočívá ve snímání několika rovin kokultury (nad i pod úrovní EC) konfokálním mikroskopem a následné analýze obrazu, která umožňuje i jistou míru kvantifikace. Pro porovnání míry TEM se stanoví četnost buněk nad a pod vrstvou EC [22]. Kromě účinnosti TEM se dají sledovat další parametry, jako je polarizace buněk, forma diapedézy (transcelulární nebo paracelulární), formování membránových struktur a jiné [30]. Videomikroskopicky lze snímat jedno místo vzorku v čase, nebo lze buňky v požadovaném časovém intervalu fixovat a použitím specifických protilátek určit subcelulární distribuci a/ nebo kolokalizaci sledovaných proteinů [22,28]. S použitím 3D modelu TEM se podařilo zachytit dramatické změny tvaru transmigrujících buněk doprovázené reorganizací aktinového cytoskeletu a charakterizovat stadia extravazace in vitro [15].
Fluidní systémy
Paralelní průtokové modely
Oba popsané modely (transwell i 3D) patří do skupiny statických systémů pro sledování TEM in vitro. To znamená, že v nich nedochází k proudění tekutiny, která by simulovala cirkulaci krve uvnitř cév. Proudění nosné tekutiny a tzv. smykové napětí (shear stress) nicméně významně ovlivňují morfologické i funkční charakteristiky EC, adhezi cirkulujících nádorových buněk ke stěně cévy a transmigraci [31]. Proto byly vytvořeny fluidní systémy pro výzkum TEM.
Nejjednodušší fluidní systém se skládá z kultivační komůrky s otvory pro přítok a odtok média (parallel ‑ plate flow chamber) [13] (obr. 2A). Na dno průtokové komůrky se vkládá sklo (předem ošetřené některou složkou ECM) pokryté vrstvou EC. Do komůrky je pumpou vtlačováno médium (rychlost proudění je regulována), do něj se přidá studovaná buněčná populace a mikroskopicky se hodnotí adheze k EC při různě vysokém smykovém napětí (0,5 – 40 dyn/ cm2, fyziologický rozsah v mikrovaskulatuře 0,5 – 5 dyn/ cm2, ve velkých cévách 10 – 40 dyn/ cm2) [13,16,32,33].
Image 2. Schematické znázornění fluidních systémů pro detekci TEM. A. Paralelní fluidní model, boční pohled; B. transwell průtokový systém, boční pohled; C. kapilární fluidní model krevně-mozkové bariéry, pohled shora; D. kapilární mikrofluidní zařízení pro sledování extravazace, pohled shora; E. kapilární mikrofluidní systém pro sledování intravazace, pohled shora. TC – nádorová buňka, EC – endoteliální buňka, PDMS – polydimetylsiloxan, ECM – extracelulární matrix 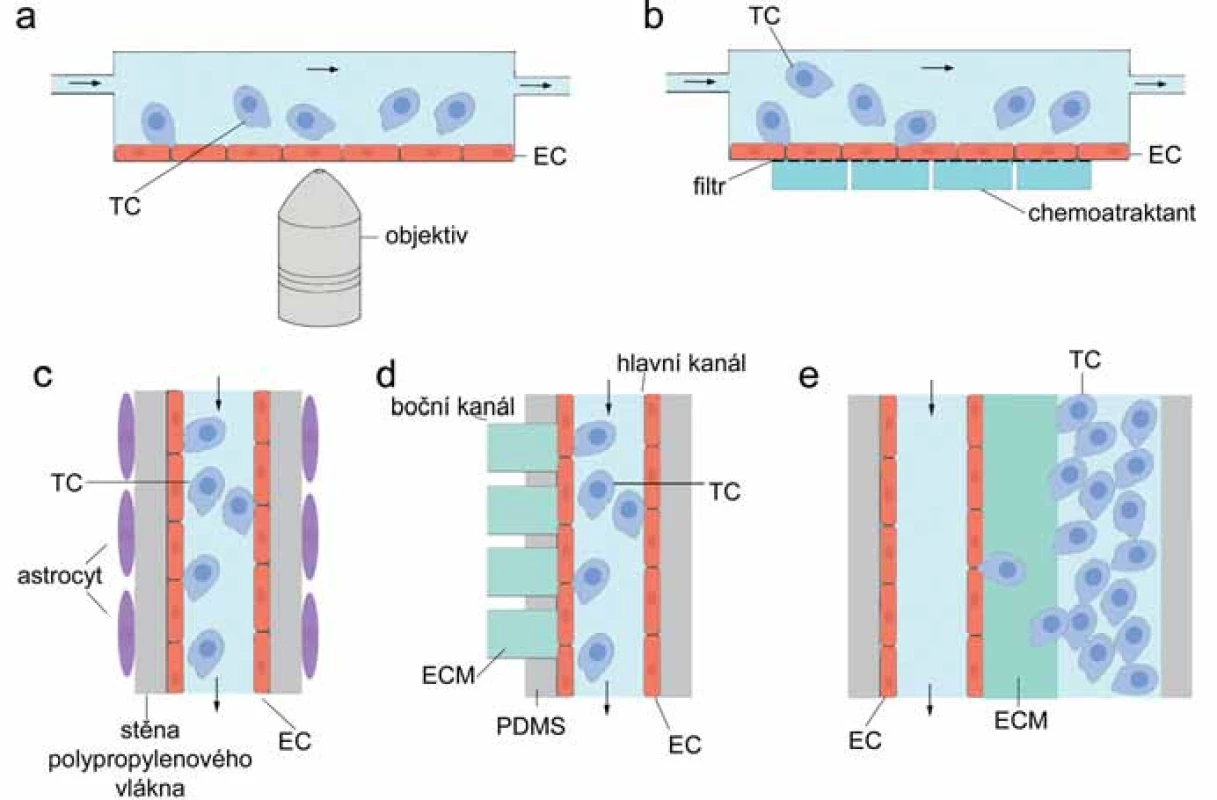
I fluidní systémy poskytují prostor pro obohacení kokultury EC a nádorových buněk o další buněčné typy. Začlenění monocytů do průtokových modelů TEM se ukazuje jako výhoda při snaze předvídat chování buněk in vivo. Například metastatické buňky prsního karcinomu (linie MDA ‑ MB ‑ 231) interagují v průtokových podmínkách s endotelem in vitro výhradně v přítomnosti monocytů, s nimiž tvoří stabilní agregáty [16]. Monocyty takto asistují nádorovým buňkám vystaveným hemodynamickému působení při zachycení na vrstvě EC [16].
Transwell průtokový model
S podobným výsledkem byla testována TEM buněk melanomu v přítomnosti krevních buněk [34,35]. Kromě fluidního modelu popsaného výše použili Dong et al transwell kultivační systém adaptovaný pro průtokové podmínky – porézní membrána tvoří substrát pro EC, prostor pod membránou slouží jako zásobárna chemoatraktantu, prostor nad membránou je uzavřen a otvory v horní části se vhání a odtéká médium se suspenzí nádorových a krevních buněk (obr. 2B) [34]. Tento transwell fluidní systém umožňuje sledovat migraci skrz vrstvu EC, zatímco paralelní průtokový systém zaznamenává adhezi nádorových buněk k EC a interkalaci. TEM buněk melanomu je v průtokových podmínkách ve srovnání se statickými podmínkami zhoršena, nicméně ji významně stimuluje interakce s krevními neutrofily [34,35].
Kapilární průtokové modely
Fluidní systém, který by sloužil jako model krevně‑mozkové bariéry in vitro, navrhli Cucullo et al [32,36]. Trojrozměrný průtokový model, jenž zahrnuje luminální působení smykového napětí na mozkové EC i abluminální vliv astrocytů, umožňuje reprodukovat fyzikální a biochemické vlastnosti intaktní krevně‑mozkové bariéry (obr. 2C) [36]. Nosnou konstrukci původního modelu tvoří polypropylenové duté vlákno vložené do uzavřené komůrky s otvory pro přísun a odtok média a se skleněným dnem. Dovnitř vlákna jsou injikovány EC tak, aby po přisednutí a dělení tvořily výstelku dutiny. Do extraluminálního prostoru jsou aplikovány astrocyty, které pak pokrývají vlákno z vnější strany. Do vlákna je pumpou vtlačováno médium a silikonové trubice zajišťují výměnu CO2/ O2. Vnitřní průměr vlákna je asi 600 µm a tloušťka stěny 200 µm. Průměr pórů ve stěně vlákna může být až 4 µm, což umožňuje extravazaci buněk z lumen kapiláry [32]. Výhoda tohoto dynamického systému je zajištění kontrolovaného 3D růstu buněčných složek krevně‑mozkové bariéry v průtokovém systému umělých kapilár. Pro výzkum TEM nádorových buněk nebyl tento model dosud významně využíván.
Propracovaný mikrofluidní model TEM, který zahrnuje všechny základní složky mikroprostředí krevní kapiláry in vivo (dutinu s výstelkou EC, proudění média a smykové napětí, perivaskulární 3D ECM), vytvořili Zhang et al [6]. Mikrofluidní zařízení představuje skleněná podložka pokrytá vrstvou polydimetylsiloxanu, průsvitným organickým polymerem s vysokou propustností pro plyny. V něm je vytvořena soustava kanálků – hlavní kanál s otvory pro přítok a odtok média, do něhož kolmo ústí několik bočních kanálků (obr. 2D). Tyto jsou následně až po ústí do hlavního kanálu naplněny matrigelem (nebo jiným hydrogelem simulujícím ECM) a slouží jako perivaskulární matrix. Hlavní kanál je po všech stranách vystlán EC, proudí jím médium a simuluje dutinu cévy. TEM je monitorována v místě, kde boční kanálky ústí do hlavního. Tam nádorové buňky (označené fluorescenční sondou) aplikované do média nemusejí překonávat žádné umělé bariéry a vstupují do kontaktu pouze s (jinak fluorescenčně značenými) EC a subendoteliální ECM. V matrix bočních kanálků je navíc možno vytvořit gradient libovolných chemoatraktantů a zkoumat tak jejich vliv na účinnost TEM [6]. Podobný design mikrofluidního systému, kdy nádorové buňky unášené proudem média interagují s EC a migrují skrz ně do 3D matrix tvořené kolagenem typu I, využili Jeon et al pro modelování extravazace in vitro [7]. Přechod z dutiny kanálu vytvořeného v polydimetylsiloxanu přes vrstvu EC do hydrogelu v bočním kanálku podstoupí 39 % injikovaných nádorových buněk linie MDA ‑ MB ‑ 231 během prvních 24 hodin [7].
Pro sledování intravazace za fluidních podmínek v 3D mikroprostředí existuje speciální systém, který reprodukuje rozhraní mezi primárním nádorem a endotelem a umožňuje mikroskopii v reálném čase a ve vysokém rozlišení [37]. Systém dvou paralelních mikrokanálků, jež jsou propojeny vrstvou kolagenového gelu, dovoluje nezávislé nasazení endoteliálních a nádorových buněk (obr. 2E). EC formují uvnitř kanálu dutou 3D kapilární strukturu, nádorové buňky invadují hydrogel, narážejí na bazální stranu EC a transmigrují do dutiny paralelního kanálku. Systém umožňuje regulovat průtok, obohacovat mikroprostředí dalšími buněčnými typy, např. makrofágy, vytvářet koncentrační gradient testovaných látek a napodobovat tak situaci doprovázející intravazaci in vivo [37]. Takto se podařilo prokázat, že endotel funguje jako bariéra v migraci nádorových buněk, jejíž permeabilita může být modulována faktory sekretovanými primárním nádorem [37].
Třepací („rocking“) systém pro analýzu transendoteliální migrace
Protože fluidní modely často vyžadují speciální vybavení a nejsou snadno dostupné, navrhli Bapu et al nahradit jednosměrný proud tekutiny obousměrným, který by v kultivačních nádobkách vznikal kýváním nebo třepáním [8]. Jejich model umožňuje mikroskopicky hodnotit míru adheze nádorových buněk k EC rostoucím v monovrstvě na skleněném povrchu [8]. Usuzujeme, že podobného efektu se stejnými výhodami by se docílilo s použitím transwell jamek vystavených po dobu dvou a více hodin kývání, a tedy proudění média.
Závěr
Existuje řada metodických přístupů ke studiu TEM in vitro. Transwell systémy jsou upřednostňovány pro jednoduchost a dostupnost při prvotních odhadech míry TEM různých typů buněk, nebo za působení širokého spektra různých látek. Složitější statické modely jsou nezbytné pro zachycení dynamiky TEM, případně pro identifikaci fáze procesu, která byla zasažena za testovaných podmínek. Fluidní systémy, zejména kapilární, zlepšují in vitro možnosti rekapitulace komplexních fyziologických podmínek in vivo, a tím pomáhají lépe odhadovat výsledky experimentálních zásahů v živém organizmu. Stále dokonalejší techniky pro detekci TEM in vitro reprezentují nezbytnou alternativu k postupům in vivo, jež nabízejí výsledky relevantní pro klinické aplikace, ale nejsou pro svou nákladnost a experimentální náročnost vždy dostupné. Protože interakce nádorových buněk a endotelu determinují úspěšnost nádorové diseminace, představují potenciální cíl proti ‑ metastatické terapie a mechanizmy regulující TEM jsou tak významným tématem onkologického výzkumu.
Práce byla podpořena Evropským fondem pro regionální rozvoj a státním rozpočtem České republiky (OP VaVpI – RECAMO, CZ.1.05/2.1.00/03.0101).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Mgr. Lucia Knopfová, Ph.D.
Ústav experimentální biologie
Přírodovědecká fakulta MU
Kotlářská 2
611 37 Brno
e-mail: knopfova@sci.muni.cz
Obdrženo: 3. 2. 2014
Přijato: 27. 3. 2014
Sources
1. Reymond N, d‘Água BB, Ridley AJ. Crossing the endothelial barrier during metastasis. Nat Rev Cancer 2013; 13(12): 858 – 870. doi: 10.1038/ nrc3628.
2. Stoletov K, Kato H, Zardouzian E et al. Visualizing extravasation dynamics of metastatic tumor cells. J Cell Sci 2010; 123(Pt 13): 2332 – 2341. doi: 10.1242/ jcs.069443.
3. Wyckoff JB, Jones JG, Condeelis JS et al. A critical step in metastasis: in vivo analysis of intravasation at the primary tumor. Cancer Res 2000; 60(9): 2504 – 2511.
4. Gligorijevic B, Wyckoff J, Yamaguchi H et al. N ‑ WASP ‑ mediated invadopodium formation is involved in intravasation and lung metastasis of mammary tumors. J Cell Sci 2012; 125(Pt 3): 724 – 734. doi: 10.1242/ jcs.092726.
5. Wolf MJ, Hoos A, Bauer J et al. Endothelial CCR2 signaling induced by colon carcinoma cells enables extravasation via the JAK2 - Stat5 and p38MAPK pathway. Cancer Cell 2012; 22(1): 91 – 105. doi: 10.1016/ j.ccr.2012.05.023.
6. Zhang Q, Liu T, Qin J. A microfluidic‑based device for study of transendothelial invasion of tumor aggregates in realtime. Lab Chip 2012; 12(16): 2837 – 2842. doi: 10.1039/ c2lc00030j.
7. Jeon JS, Zervantonakis IK, Chung S et al. In vitro model of tumor cell extravasation. PLoS One 2013; 8(2): e56910. doi: 10.1371/ journal.pone.0056910.
8. Bapu D, Khadim M, Brooks SA. Rocking adhesion assay system to study adhesion and transendothelial migration of cancer cells. Methods Mol Biol 2014; 1070 : 37 – 45. doi: 10.1007/ 978 - 1 - 4614-8244 - 4_3.
9. Zen K, Liu DQ, Guo YL et al. CD44v4 is a major E ‑ selectin ligand that mediates breast cancer cell transendothelial migration. PLoS One 2008; 3(3): e1826. doi: 10.1371/ journal.pone.0001826.
10. Peyri N, Berard M, Fauvel ‑ Lafeve F et al. Breast tumor cells transendothelial migration induces endothelial cell anoikis through extracellular matrix degradation. Anticancer Res 2009; 29(6): 2347 – 2355.
11. Malin D, Strekalova E, Petrovic V et al. αB ‑ crystallin: a novel regulator of breast cancer metastasis to the brain. Clin Cancer Res 2014; 20(1): 56 – 67. doi: 10.1158/ 1078 - 0432.CCR ‑ 13 - 1255.
12. Ma C, Rong Y, Radiloff DR et al. Extracellular matrix protein betaig ‑ h3/ TGFBI promotes metastasis of colon cancer by enhancing cell extravasation. Genes Dev 2008; 22(3): 308 – 321. doi: 10.1101/ gad.1632008.
13. Haddad O, Chotard ‑ Ghodsnia R, Verdier C et al. Tumor cell/ endothelial cell tight contact upregulates endothelial adhesion molecule expression mediated by NFkappaB: differential role of the shear stress. Exp Cell Res 2010; 316(4): 615 – 626. doi: 10.1016/ j.yexcr.2009.11.015.
14. Li J, Guillebon AD, Hsu JW et al. Human fucosyltransferase 6 enables prostate cancer metastasis to bone. Br J Cancer 2013; 109(12): 3014 – 3022. doi: 10.1038/ bjc.2013.690.
15. Voura EB, English JL, Yu HY et al. Proteolysis during tumor cell extravasation in vitro: metalloproteinase involvement across tumor cell types. PLoS One 2013; 8(10): e78413. doi: 10.1371/ journal.pone.0078413.
16. Evani SJ, Prabhu RG, Gnanaruban V et al. Monocytes mediate metastatic breast tumor cell adhesion to endothelium under flow. FASEB J 2013; 27(8): 3017 – 3029. doi: 10.1096/ fj.12 - 224824.
17. Kim C, Lee HS, Lee D et al. Epithin/ PRSS14 proteolytically regulates angiopoietin receptor Tie2 during transendothelial migration. Blood 2011; 117(4): 1415 – 1424. doi: 10.1182/ blood ‑ 2010 - 03 - 275289.
18. Ma C, Wang XF. In vitro assays for the extracellular matrix protein‑regulated extravasation process. CSH Protoc 2008. doi: 10.1101/ pdb.prot5034.
19. Fazakas C, Wilhelm I, Nagyoszi P et al. Transmigration of melanoma cells through the blood ‑ brain barrier: role of endothelial tight junctions and melanoma ‑ released serine proteases. PLoS One 2011; 6(6): e20758. doi: 10.1371/ journal.pone.0020758.
20. Haidari M, Zhang W, Wakame K. Disruption of endothelial adherens junction by invasive breast cancer cells is mediated by reactive oxygen species and is attenuated by AHCC. Life Sci 2013; 93(25 – 26): 994 – 1003. doi: 10.1016/ j.lfs.2013.10.027.
21. Leroy ‑ Dudal J, Demeilliers C, Gallet O et al. Transmigration of human ovarian adenocarcinoma cells through endothelial extracellular matrix involves alphav integrins and the participation of MMP2. Int J Cancer 2005; 114(4): 531 – 543.
22. Reymond N, Im JH, Garg R et al. Cdc42 promotes transendothelial migration of cancer cells through β1 integrin. J Cell Biol 2012; 199(4): 653 – 668. doi: 10.1083/ jcb.201205169.
23. Matsushita T, Kibayashi T, Katayama T et al. Mesenchymal stem cells transmigrate across brain microvascular endothelial cell monolayers through transiently formed inter ‑ endothelial gaps. Neurosci Lett 2011; 502(1): 41 – 45. doi: 10.1016/ j.neulet.2011.07.021.
24. Díaz ‑ Coránguez M, Segovia J, López ‑ Ornelas A et al.Transmigration of neural stem cells across the blood brain barrier induced by glioma cells. PLoS One 2013; 8(4): e60655. doi: 10.1371/ journal.pone.0060655.
25. Qian BZ, Pollard JW. Macrophage diversity enhances tumor progression and metastasis. Cell 2010; 141(1): 39 – 51. doi: 10.1016/ j.cell.2010.03.014.
26. Hoos A, Protsyuk D, Borsig L. Metastatic growth progression caused by PSGL ‑ 1 - mediated recruitment of monocytes to metastatic sites. Cancer Res 2014; 74(3): 695 – 704. doi: 10.1158/ 0008 - 5472.CAN ‑ 13 - 0946.
27. Cain RJ, d‘Água BB, Ridley AJ. Quantification of transendothelial migration using three ‑ dimensional confocal microscopy. Methods Mol Biol 2011; 769 : 167 – 190. doi: 10.1007/ 978 - 1 - 61779 - 207 - 6_12.
28. Estecha A, Sánchez ‑ Martín L, Puig ‑ Kröger A et al. Moesin orchestrates cortical polarity of melanoma tumour cells to initiate 3D invasion. J Cell Sci 2009; 122(Pt 19):3492 – 3501. doi: 10.1242/ jcs.053157.
29. Muller WA, Luscinskas FW. Assays of transendothelial migration in vitro. Methods Enzymol 2008; 443 : 155 – 176. doi: 10.1016/ S0076 - 6879(08)02009 - 0.
30. Carman CV. High‑resolution fluorescence microscopy to study transendothelial migration. Methods Mol Biol 2012; 757 : 215 – 245. doi: 10.1007/ 978 - 1 - 61779 - 166 - 6_15.
31. Resnick N, Yahav H, Shay ‑ Salit A et al. Fluid shear stress and the vascular endothelium: for better and for worse. Prog Biophys Mol Biol 2003; 81(3): 177 – 199.
32. Cucullo L, Marchi N, Hossain M et al. A dynamic in vitro BBB model for the study of immune cell trafficking into the central nervous system. J Cereb Blood Flow Metab 2011; 31(2): 767 – 777. doi: 10.1038/ jcbfm.2010.162.
33. Adams Y, Rowe JA. The effect of anti‑rosetting agents against malaria parasites under physiological flow conditions. PLoS One 2013; 8(9): e73999. doi: 10.1371/ journal.pone.0073999.
34. Dong C, Slattery MJ, Liang S et al. Melanoma cell extravasation under flow conditions is modulated by leukocytes and endogenously produced interleukin 8. Mol Cell Biomech 2005; 2(3): 145 – 159.
35. Liang S, Slattery MJ, Wagner D et al. Hydrodynamic shear rate regulates melanoma ‑ leukocyte aggregation, melanoma adhesion to the endothelium, and subsequent extravasation. Ann Biomed Eng 2008; 36(4): 661 – 671. doi: 10.1007/ s10439 - 008 - 9445 - 8.
36. Cucullo L, McAllister MS, Kight K et al. A new dynamic in vitro model for the multidimensional study of astrocyte ‑ endothelial cell interactions at the blood ‑ brain barrier. Brain Res 2002; 951(2): 243 – 254.
37. Zervantonakis IK, Hughes ‑ Alford SK, Charest JL et al.Three ‑ dimensional microfluidic model for tumor cell intravasation and endothelial barrier function. Proc Natl Acad Sci USA 2012; 109(34): 13515 – 13520. doi: 10.1073/ pnas.1210182109.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2014 Issue Supplementum-
All articles in this issue
- Programovaná buněčná smrt v nádorových buňkách
- Využití průtokové cytometrie pro analýzu mitochondriální buněčné smrti
- Metody studia buněčné migrace a invazivity nádorových buněk
- Možnosti studia transendoteliální migrace in vitro
- Mechanizmy lékové rezistence a nádorové kmenové buňky
- Funkční testy pro detekci nádorových kmenových buněk
- Mikroprostředí nádoru – možnosti výzkumu v podmínkách in vitro
- Elektrochemická analýza nukleových kyselin, bílkovin a polysacharidů v biomedicíně
- Sekvenování nové generace a možnosti jeho využití v onkologické praxi
- Vývoj metod založených na PCR a jejich aplikace v onkologickém výzkumu a praxi
- Metody pro studium protein‑proteinových a protein‑ligandových interakcí
- Analýza proteinů pomocí hmotnostní spektrometrie
- p‑ SRM, SWATH a HRM – cílené proteomické přístupy na hmotnostním spektrometru TripleTOF 5600+ a jejich aplikace v onkologickém výzkumu
- Analýza fosfoproteínov a signálnych dráh kvantitatívno‑ proteomickými metódami
- Nové trendy ve studiu glykosylace proteinů u onkologických onemocnění
- Současné trendy ve využívání PET radiofarmak k onkologické diagnostice
- „Techneciová krize“ – příčiny, možná řešení a dopad na diagnostiku planární scintigrafií a SPECT
- Vitamin D jako významný steroidní hormon u karcinomu prsu
- Detekce protein‑proteinových interakcí metodami FRET a BRET
- Detekce proteinů, proteinových interakcí a modifikací s využitím „proximity ligation assay“ in situ
- Exprese a purifikace proteinů
- Kvantitativní hmotnostní spektrometrie a její využití v onkologii
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Exprese a purifikace proteinů
- Metody studia buněčné migrace a invazivity nádorových buněk
- Sekvenování nové generace a možnosti jeho využití v onkologické praxi
- Analýza proteinů pomocí hmotnostní spektrometrie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

