-
Medical journals
- Career
Limitácie využitia sliny ako diagnostickej tekutiny v klinickej praxi
Authors: K. Janšáková 1; P. Celec 1,2,3; Ľ. Tóthová 1,4
Authors‘ workplace: Ústav molekulárnej biomedicíny, Lekárska fakulta Univerzity Komenského, Bratislava, Slovensko 1; Ústav patologickej fyziológie, Lekárska fakulta Univerzity Komenského, Bratislava, Slovensko 2; Katedra molekulárnej biológie, Prírodovedecká fakulta Univerzity Komenského, Bratislava, Slovensko 3; Fyziologický ústav, Lekárska fakulta Univerzity Komenského, Bratislava, Slovensko 4
Published in: Klin. Biochem. Metab., 26, 2018, No. 1, p. 21-26
Overview
Slina ako diagnostická tekutina má viaceré výhody – najmä neinvazívny a jednoduchý odber, ktorý možno opakovať. Množstvo publikovaných štúdií poukázalo na širokú paletu salivárnych markerov systémových alebo orálnych chorôb. Napriek tomu sa však do rutinnej klinickej praxe analýza sliny nedostala. Okrem nízkej koncentrácie meraných látok je príčinou najmä vysoká technická i biologická variabilita, a tým nízka reprodukovateľnosť získaných výsledkov. Kľúčovou je pre-analytická fáza vrátane prípravy pacienta, realizácie odberu, ale aj spracovanie a skladovanie vzoriek slín. Z hľadiska interpretácie je dôležitým aspektom chýbajúci normalizačný faktor. Napriek nesporným výhodám sliny je v budúcnosti nutné zamerať sa na štandardizáciu analytických i pre-analytických metód. Štandardizácia týchto postupov a interpretácie výsledkov je nevyhnutnou podmienkou pre použitie sliny v klinickej praxi.
Kľúčové slová:
analýza biomakromolekúl, salivácia, slina.Úvod
V posledných rokoch sa sline ako diagnostickej tekutine venuje stále viac výskumných prác (obr. 1). Napriek tomu, že sa za zlatý štandard v diagnostike považuje krv, slina má v porovnaní s krvou mnoho výhod. Slinu je možné odoberať neinvazívne, opakovane, od jedincov prakticky všetkých vekových kategórií.
Image 1. Increased interest in salivary research since 2000. Data are obtained from the database PubMed when searching for a keyword “saliva” 
Ukázalo sa, že v sline je možné analyzovať rôzne látky ako napr. cytokíny, hormóny, protilátky a zároveň prítomnosť rôznych typov buniek umožňuje analýzu nukleových kyselín [1, 2]. Detekcia a kvantifikácia slinných biomarkerov môže byť užitočná pri včasnej diagnostike a monitoringu orálnych [3], či systémových chorôb [1]. Hoci má slina množstvo výhod, existujú aj viaceré špecifické problémy spojené s odberom a manipuláciou sliny, ako aj s interpretáciou získaných výsledkov. Prác zameraných na problémy jej klinickej aplikácie chýbajú. Cieľom tohto prehľadu je poukázať na obmedzenia sprevádzajúce pre-analytickú fázu spracovania sliny, ktoré výrazne limitujú interpretovateľnosť následných analýz.
Faktory ovplyvňujúce produkciu slín
Za fyziologických okolností dochádza k produkcii priemerne 1 až 1,5 l sliny denne. Intenzita tvorby sliny je individuálna a je ovplyvnená mnohými faktormi (obr. 2). Salivácia je riadená autonómnym nervovým systémom. Parasympatikus indukuje sekréciu väčšieho množstva sliny, sympatikus zodpovedá za reguláciu sekrécie jednotlivých zložiek sliny [17]. Na rýchlosť a intenzitu salivácie vplýva cirkadiánny rytmus, pričom najvyššie hodnoty dosahuje v poobedných hodinách a následne postupne klesá [18].
Image 2. Factors influencing the production of saliva include e.g. gender, age, autonomous nerve system, circadian rhythm, water intake, sensoric stimuli, oral and systemic health status, and medication and cure 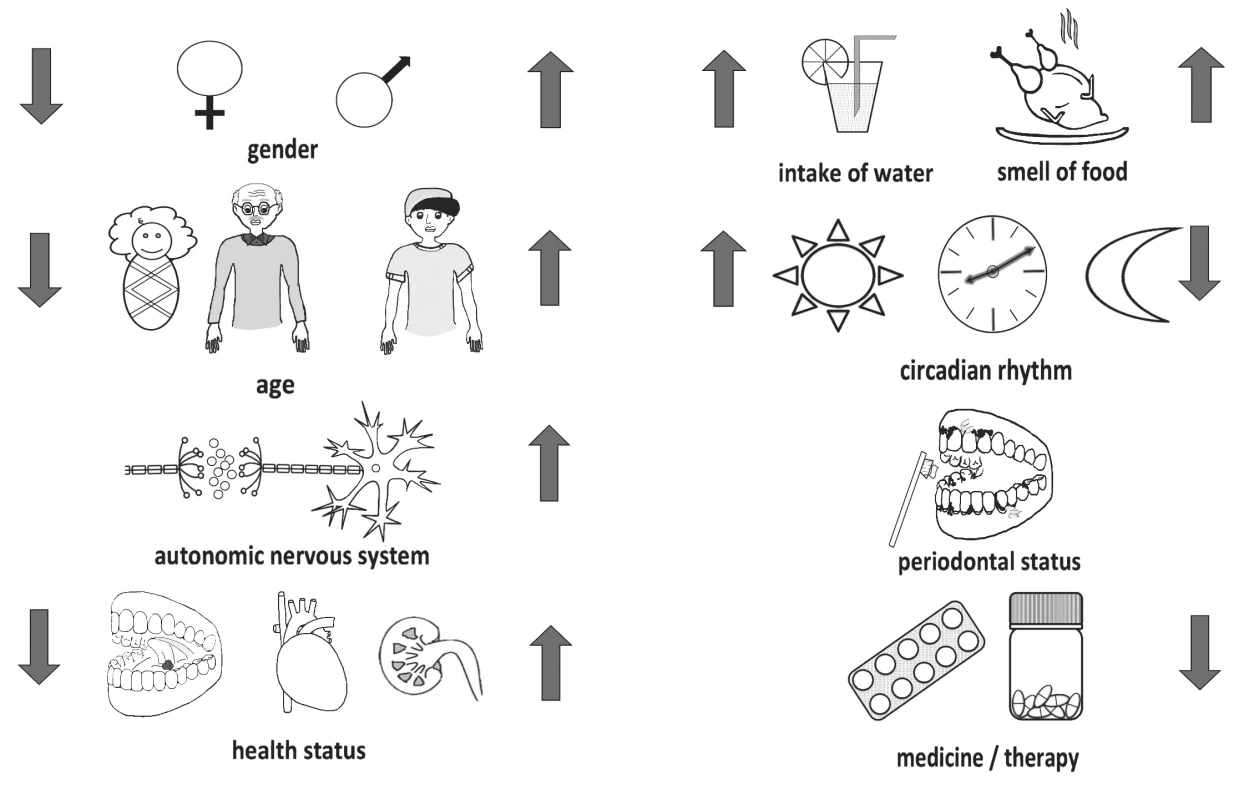
Zloženie slín je ovplyvnené aj stavom parodontu [3]. Prítomný zápal má za následok zmenu zloženia sliny, prípadne vplýva na samotnú saliváciu. Stav parodontu rovnako ako aj zloženie sliny je výrazne ovplyvnené fajčením a prípadnou nízkou úrovňou ústnej hygieny, ktoré majú za následok indukciu tvorby zápalových markerov [19, 20].
Zdravotný stav ako taký vplýva na všetky fyziologické procesy vrátane salivácie a zloženia sliny. Choroba ako napr. Sjögrenov syndróm vedie k patologicky zníženej produkcii sliny a vyššej viskozite sliny [21]. Kvôli užívaniu rôznych liečiv môže prechodne dôjsť ku xerostómii kedy ukončenie terapie zvyčajne vedie k obnoveniu salivácie [22].
Z uvedených dôvodov je pre dizajn štúdie zaoberajúcej sa analýzou sliny nevyhnutné stanoviť inklúzne ako aj exklúzne kritériá týkajúce sa zdravotného stavu v zmysle orálnych a rovnako aj systémových chorôb s dopadom na ústnu dutinu. V ideálnom prípade by bolo vhodné zabezpečiť stomatologické vyšetrenie, ktorého súčasťou by bolo komplexné zhodnotenie stavu parodontu.
Odber sliny
Vzorky sliny je možné odoberať so stimuláciou salivácie alebo bez nej (obr. 3).
Image 3. Saliva collecting methods: unstimulated collection, stimulated collection using different stimulants and collection kits. 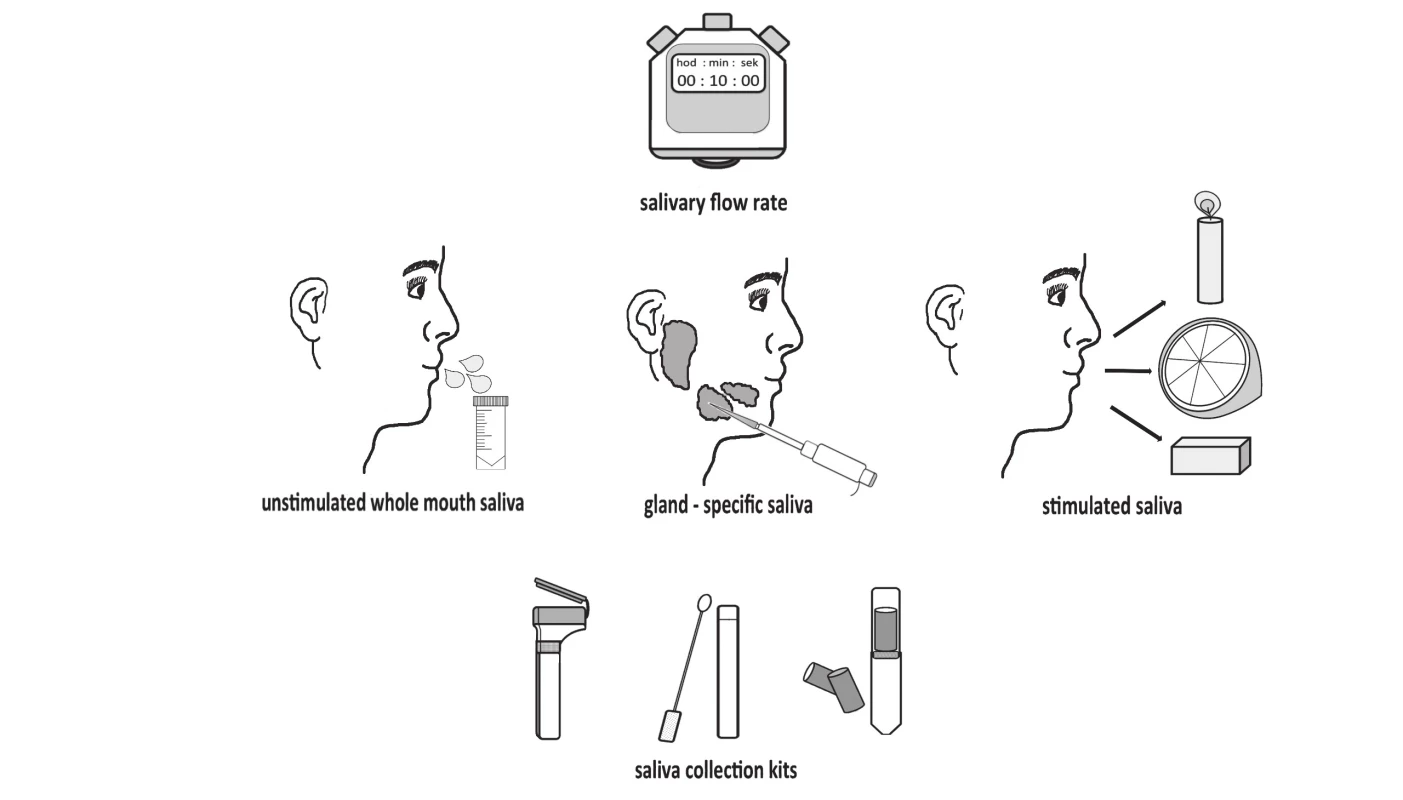
Najjednoduchší a často využívaný je odber celkovej nestimulovanej sliny po pasívnom hromadení sliny v ústnej dutine [1, 3]. Takýto odber vyžaduje dlhší čas na získanie želaného objemu sliny. Naproti tomu stimulácia salivácie poskytuje mnohé výhody, ktoré uľahčia samotný odber, ale pridá aj ďalší faktor ovplyvňujúci zloženie sliny. Získaný objem sliny je síce väčší a slina je menej viskózna, ale je to najmä v dôsledku väčšieho množstva vody. Na druhej strane, čas potrebný na odber sliny je v porovnaní s nestimulovaným odberom kratší a odber je pre probanda určite komfortnejší [23]. Jedným z najbežnejších spôsobov stimulácie salivácie je použitie komerčne dostupných odberových sád Salivette (Sarstedt, Nemecko). Salivácia je mechanicky indukovaná prostredníctvom bavlneného tampónu bez prísad alebo zároveň senzoricky tampónom obohateným o kyselinu citrónovú. Hlavnou nevýhodou je, že indukcia salivácie má za následok zmenu v sekrécii špecifických biomarkerov tak, že koncentrácia niektorých klesá a iných stúpa [24]. Podľa doposiaľ publikovanej literatúry bola odpublikovaná iba jediná prehľadová štúdia popisujúca vplyv rôznych spôsobov stimulovaného odberu sliny a ich limitácie. V tejto práci autori zdôrazňujú, že odlišné spôsoby stimulácie salivácie vedú k zmenám v koncentrácii steroidných hormónov v sline. Stimulácia salivácie však môže ovplyvniť výsledky z viacerých hľadísk. Môže nastať interferencia samotnej stimulačnej látky s analyzačným činidlom, stimulačná látka môže indukovať tvorbu špecifických biomarkerov alebo môže dôjsť k zachyteniu niektorých zložiek sliny, akými sú napr. mucíny v prípade použitia bavlnených tampónov [23]. Spôsob odberu sliny by mal byť preto zvolený s ohľadom na cieľový biomarker. Pre každý meraný parameter je potrebné zaviesť protokol, ktorý by určoval, aký spôsob odberu sliny je najvhodnejší. V prípade niektorých analýz totiž nie je potrebné zistiť koncentráciu biomarkera, podstatná je jeho prítomnosť ako napr. v prípade protilátok pri HIV [7].
V sline sa nachádzajú obdobné biomarkery ako v krvi, avšak koncentrácia týchto biomarkerov je výrazne nižšia. Z tohto dôvodu je nevyhnutné mať väčší objem vzorky slín na následné analýzy ako v prípade plazmy [14]. Dĺžka, resp. rýchlosť salivácie predstavuje významný faktor, ktorý by mal byť zohľadnený aj pri interpretácii výsledkov. Avšak ani táto časť postupu nie je štandardizovaná. V niektorých publikáciách nie je dĺžka salivácie zaznamenaná. Naopak, býva uvedené, že pacient bol požiadaný o vzorku sliny v objeme do 10 ml, a či bolo toto kritérium splnené, nie je uvedené [19, 20]. Takýmto spôsobom nie je jasné, či sa medzi pacientmi a zdravými jedincami líši rýchlosť salivácie prípadne či je daná choroba spojená so zníženou produkciou sliny.
Triviálnym nie je ani načasovanie odberu sliny. Odber sliny nalačno umožňuje presnejšiu analýzu markerov, resp. rozdiely medzi pacientmi a zdravými jedincami sú jasnejšie vzhľadom na nižšiu interindividuálnu variabilitu [25]. V závislosti od analyzovaného markera sa odber sliny ale môže uskutočniť aj cez deň. Aby nedošlo ku kontaminácii vzorky, probandom sa odporúča, aby nekonzumovali žiadnu potravu a nepili nápoje minimálne 30 minút pred odberom sliny [2]. Kontaminácia z jedla môže napr. falošne zvýšiť koncentráciu proteínov vo vzorke, ktorá už následne nie je vhodná na analýzu. Medzi takéto znehodnotenie vzorky patrí nielen kontaminácia jedlom či nápojmi, ale u žien aj make-upom (obr. 4). V prípade, ak jedinec trpí gingivitídou, periodontitídou alebo absolvoval dentálnu hygienu krátko pred samotným odberom vzorky, môže nastať kontaminácia krvou. Menej intenzívna kontaminácia, resp. kontaminácia s nižšími koncentráciami hemoglobínu neovplyvňuje niektoré merania [26]. Spôsob odberu sliny môže výrazne zasahovať aj do interpretácie výsledkov. Porovnávanie výsledkov medzi jednotlivými laboratóriami, resp. štúdiami môže spôsobiť ich chybnú interpretáciu z dôvodu rôznych podmienok odberu. Je náročné, priam až nemožné porovnávať výstupy štúdií, ktoré sa líšia napr. tým, či vzorky slín boli získané stimuláciou alebo nie. Najmä, ak nie je jasné, ktorý biomarker je akým spôsobom odberu ovplyvnený [23].
Image 4. Contamination of saliva samples and its impact on analysis. 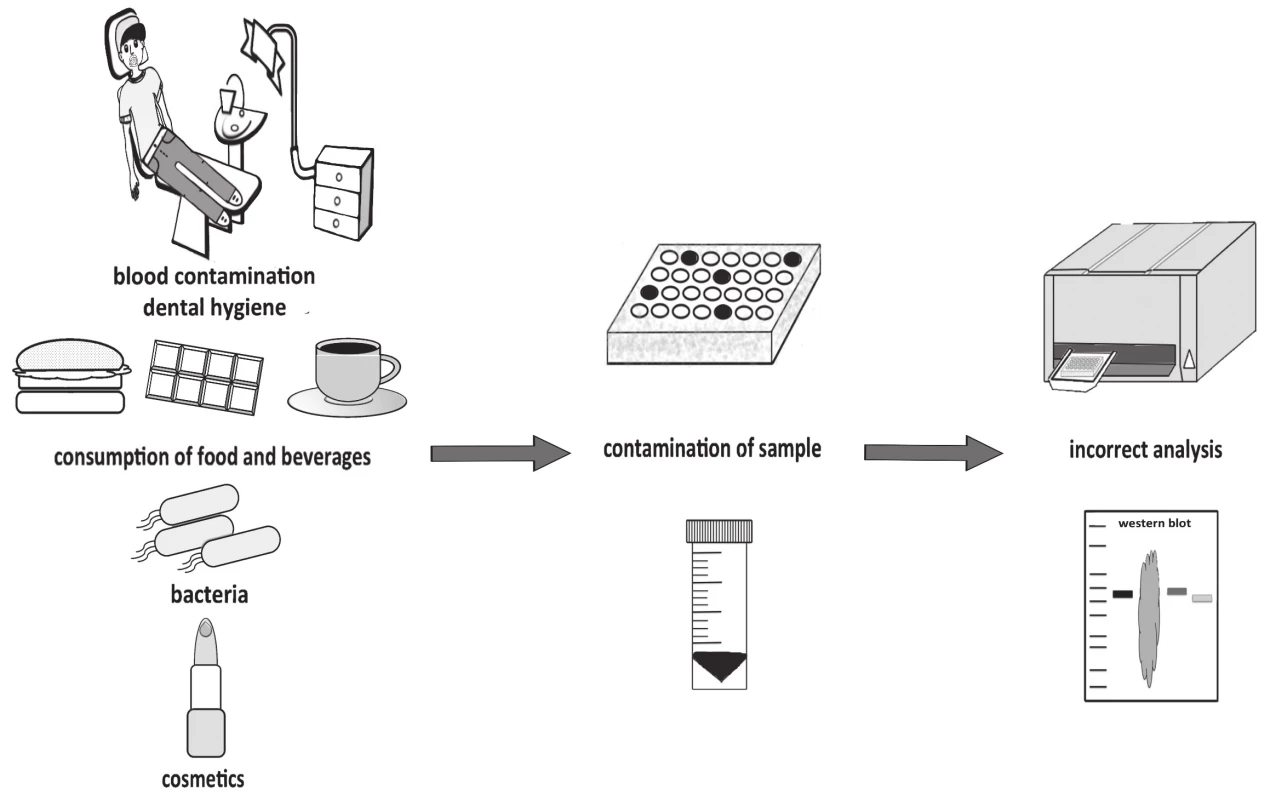
Table 1. Table describing examples of commonly analysed biomarkers in whole mouth saliva; CRP – C-reactive protein; HPLC – high performance liquid chromatography; IC – ion chromatography; LC-MS – liquid chromatography mass spectrometry; MALDI-TOF MS - matrix assisted laser desorption ionization-time of flight mass spectrometry; RT-LAMP – reverse transcriptase loop-mediated isothermal amplification 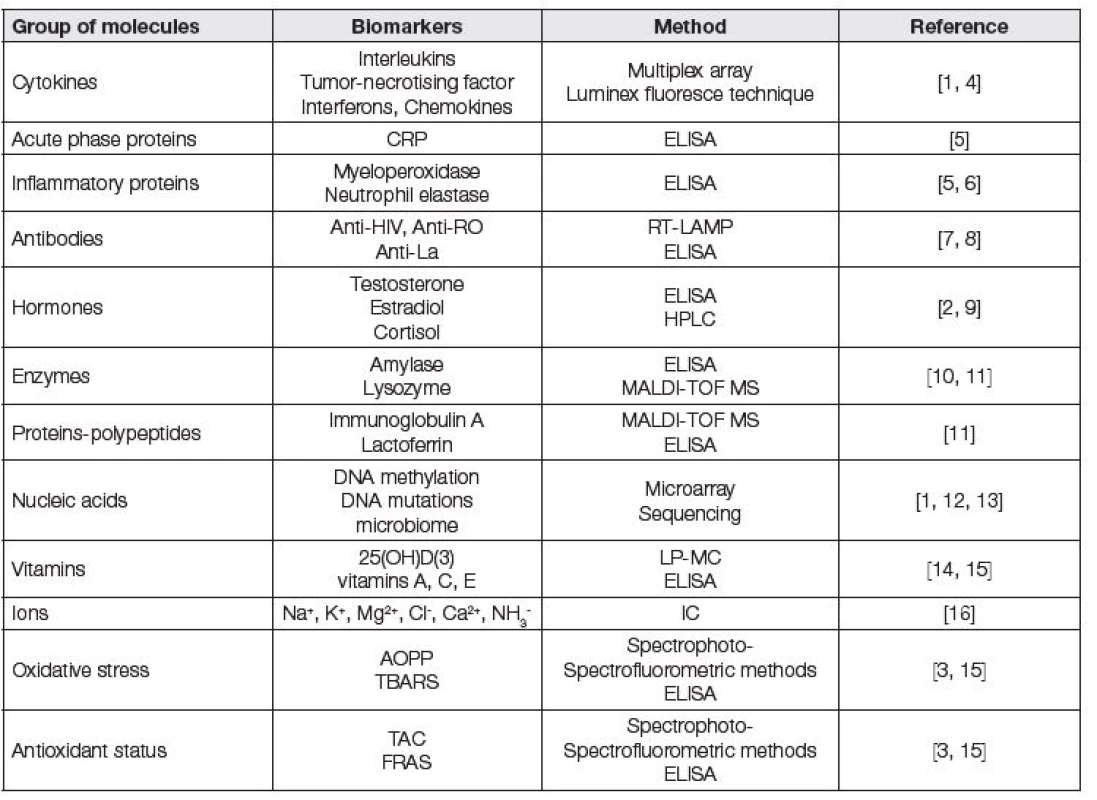
Spracovanie a skladovanie vzoriek
Spôsob, akým sú vzorky po odbere ďalej spracované, ovplyvňuje stabilitu biomarkerov. Na rozdiel od plazmy, ktorá nemá bunky, celková slina obsahuje bunky bakteriálneho ako aj ľudského pôvodu. Centrifugácia odstráni bunky, nečistoty a znižuje viskozitu sliny, čím uľahčuje ďalšiu manipuláciu so vzorkou. Zároveň však dochádza k zníženiu koncentrácie celkových proteínov obsiahnutých vo vzorke a tým aj niektorých biomarkerov [27].
Zamrazenie vzoriek sliny pred ich ďalším spracovaním, resp. bezprostredne po odbere spôsobuje lýzu prítomných buniek a uvoľnenie ich obsahu. Takýmto spôsobom sa do vzorky dostáva vyššie množstvo proteáz, ktoré môžu spôsobiť degradáciu proteínových biomarkerov. Ideálne by bolo, ak by aj v rámci odberu sliny boli dostupné odberové sady, resp. skúmavky so stabilizátorom. Pri odbere krvi bráni koagulácii EDTA alebo heparín, v prípade sliny by zrejme malo ísť o zmes inhibítorov proteáz, prípadne nukleáz, ktoré by bránili rozkladu makromolekúl po odobratí sliny [28].
Samotnú analýzu vzoriek slín môže výrazne ovplyvniť aj proces skladovania vzoriek. V publikáciách býva zvyčajne uvedené, či boli vzorky skladované na -20 °C alebo -80 °C. Avšak to, ako dlho bola vzorka skladovaná, prípadne koľkokrát bola rozmrazená a opätovne zmrazená, sa štandardne neuvádza. Zistilo sa, že dĺžka skladovania vzorky pri teplote +20 °C v rôznych časových intervaloch koreluje s mierou degradácie proteínov. Proteíny proti degradácii neochránilo ani pridanie inhibítorov proteáz [28]. Neplatí to však pre každý biomarker, napr. v prípade testosterónu sa nepozorovali žiadne zmeny v jeho koncentrácii v časovom období až do jedného mesiaca [2]. Tieto výsledky poukazujú na fakt, že niektoré markery obsiahnuté v sline si zachovávajú svoju integritu aj niekoľko dní po odbere a vzorky nie je nutné zmrazovať okamžite. Hoci zmrazovanie a rozmrazovanie vzorky nemalo vplyv na steroidy, nemusí to platiť pre ostatné biomarkery s inou molekulovou hmotnosťou [28]. Po odobratí vzorky je tak ďalší postup opäť závislý od konkrétneho analyzovaného biomarkera.
Analýza vzoriek a interpretácia výsledkov
Nespornou limitáciou analýzy sliny je vysoká inter - a intra-individuálna variabilita, ktorej dôsledkom je nízka reprodukovateľnosť výsledkov [29]. Na odstránenie variability je nevyhnutné realizovať ďalšie štúdie, ktoré identifikujú zdroje variability. Je potrebné sa zamerať na biologickú variabilitu ako aj technickú variabilitu. V rámci štúdií je potrebné mať dostatočne veľký počet vzoriek a jasne definované inklúzne i exklúzne kritéria. Jedným z hlavných problémov je chýbajúci normalizačný faktor, akým je napr. v prípade moču kreatinín. V súčasnosti sa používajú tri spôsoby normalizácie, resp. prepočtu výsledkov. Jedným z nich je prepočet koncentrácie analyzovanej látky na celkové množstvo proteínov v sline [1]. Ďalším spôsobom je prepočet koncentrácie biomarkera na rýchlosť salivácie tzv. „salivary flow rate“ [30]. Najčastejšie sa však výsledok analýzy neprepočítava na žiaden normalizačný faktor [1].
Spoločne teda prítomná variabilita ako aj rôzne prístupy k normalizácii jednotlivých biomarkerov sťažujú interpretáciu výsledkov a ich porovnanie medzi štúdiami, respektíve laboratóriami. Určenie jednotného normalizačného faktora by mohlo byť nápomocné aj k zavedeniu referenčných hodnôt pre jednotlivé salivárne biomarkery, čo je kľúčový predpoklad pre ich zavedenie do rutinnej individuálnej diagnostiky.
Záver
Napriek neustálemu nárastu záujmu o slinu ako diagnostickú tekutinu vedie k použitiu sliny v klinickej praxi ešte veľmi dlhá cesta. Použitie sliny sprevádza séria limitácií a otázok, ktoré spolu navzájom súvisia a majú dopad na výsledok analýz. Podstatnou časťou pre-analytickej fázy je spôsob odberu vzorky. Rôzne spôsoby stimulácie salivácie vedú k zmenám v koncentrácii špecifických biomarkerov. Centrifugácia je dôležitým krokom spracovania vzorky. Koncentrácia väčšiny biomarkerov sa medzi centrifugovanou a necentrifugovanou slinou líši, pričom viskozita vzorky i variabilita sa centrifugáciou znižuje. Nízka reprodukovateľnosť analýz salivárnych markerov poukazuje na potrebu štandardizácie postupov. Cieľom výskumu diagnostického potenciálu slín by teda nemalo byť iba hľadanie nových biomarkerov, ale aj zjednotenie postupov v rámci pre-analytickej fázy. Technická variabilita však nie je univerzálna. Protokoly pre odber, spracovanie a skladovanie vzoriek tak budú musieť byť vypracované pre každý analyzovaný biomarker samostatne.
Všetky fázy manipulácie so slinou spolu navzájom úzko súvisia a predstavujú pomyslený začarovaný kruh. Postupným odstránením limitácií a cielenými zmenami v postupoch je možné dosiahnuť, že slina bude raz plnohodnotne akceptovaná a využívaná v rutinnej klinickej diagnostike.
Střet zájmů: Autoři prohlašují, že nejsou ve střetu zájmů.
Do redakce došlo 26. 7. 2018
Adresa pro korespondenci
Doc. MUDr. Ing. RNDr. Peter Celec, DrSc., MPH
Ústav molekulárnej biomedicíny
Lekárska fakulta
Univerzita Komenského
Sasinkova 4, 811 08 Bratislava
Email: petercelec@gmail.com
Tel: +421 2 59357371
Fax: +421 2 59357631
Sources
1. Said, H. S., Suda, W., Nakagome, S. et al. Dysbiosis of salivary microbiota in inflammatory bowel disease and its association with oral immunological biomarkers. DNA Res, 2014, 21(1): p. 15-25.
2. Durdiakova, J., Fabryova, H., Koborova, I., Ostatnikova, D. and Celec, P. The effects of saliva collection, handling and storage on salivary testosterone measurement. Steroids, 2013, 78(14): p. 1325-31.
3. Banasova, L., Kamodyova, N., Jansakova, K. et al. Salivary DNA and markers of oxidative stress in patients with chronic periodontitis. Clin. Oral Investig., 2015, 19(2): p. 201-7.
4. Browne, R.W., Kantarci, A., LaMonte, M.J. et al. Performance of multiplex cytokine assays in serum and saliva among community-dwelling postmenopausal women. PLoS One, 2013, 8(4): p. e59498.
5. Patel, N., Belcher, J., Thorpe, G., Forsyth, N.R. and Spiteri, M.A. Measurement of C-reactive protein, procalcitonin and neutrophil elastase in saliva of COPD patients and healthy controls: correlation to self-reported wellbeing parameters. Respir. Res., 2015, 16: p. 62.
6. Hirschfeld, J., Dommisch, H., Skora, P. et al. Neutrophil extracellular trap formation in supragingival biofilms. Int. J Med. Microbiol., 2015, 305(4-5): p. 453-63.
7. Chen, Z., Zhu, H., Malamud, D. et al. A Rapid, Self-confirming Assay for HIV: Simultaneous Detection of Anti-HIV Antibodies and Viral RNA. J AIDS Clin. Res., 2016, 7(1).
8. Franceschini, F. and Cavazzana, I. Anti-Ro/SSA and La/SSB antibodies. Autoimmunity, 2005, 38(1): p. 55-63.
9. Gao, W., Stalder, T. and Kirschbaum, C. Quantitative analysis of estradiol and six other steroid hormones in human saliva using a high throughput liquid chromato-graphy-tandem mass spectrometry assay. Talanta, 2015, 143: p. 353-358.
10. Moslemi, M., Sattari, M., Kooshki, F. et al. Relationship of Salivary Lactoferrin and Lysozyme Concentrations with Early Childhood Caries. J Dent. Res. Dent. Clin. Dent. Prospects, 2015, 9(2): p. 109-14.
11. Yao, Y., Berg, E.A., Costello, C.E., Troxler, R.F. and Oppenheim, F.G. Identification of protein components in human acquired enamel pellicle and whole saliva using novel proteomics approaches. J Biol. Chem., 2003, 278(7): p. 5300-8.
12. Palanisamy, V. and Wong, D.T. Transcriptomic analyses of saliva. Methods Mol. Biol., 2010, 666: p. 43-51.
13. Wilmot, B., Fry, R., Smeester, L. et al. Methylomic analysis of salivary DNA in childhood ADHD identifies altered DNA methylation in VIPR2. J Child Psychol. Psychiatry, 2016, 57(2): p. 152-60.
14. Higashi, T., Shibayama, Y., Fuji, M. and Shimada, K. Liquid chromatography-tandem mass spectrometric method for the determination of salivary 25-hydroxyvitamin D3: a noninvasive tool for the assessment of vitamin D status. Anal. Bioanal. Chem., 2008, 391(1): p. 229-38.
15. Abdolsamadi, H., Rafieian, N., Goodarzi, M.T. et al. Levels of salivary antioxidant vitamins and lipid peroxidation in patients with oral lichen planus and healthy individuals. Chonnam. Med. J, 2014, 50(2): p. 58-62.
16. Tanaka, M., Matsunaga, K. and Kadoma, Y. Correlation in inorganic ion concentration between saliva and plaque fluid. J Med. Dent. Sci., 2000, 47(1): p. 55-9.
17. Proctor, G.B. and Carpenter, G.H. Regulation of salivary gland function by autonomic nerves. Auton Neurosci., 2007, 133(1): p. 3-18.
18. Dawes, C. Circadian rhythms in human salivary flow rate and composition. J Physiol, 1972, 220(3): p. 529-45.
19. Gupta, N., Gupta, N.D., Goyal, L. et al. The influence of smoking on the levels of matrix metalloproteinase-8 and periodontal parameters in smoker and nonsmoker patients with chronic periodontitis: A clinicobiochemical study. J Oral Biol. Craniofac. Res., 2016, 6(Suppl 1): p. S39-S43.
20. Hong, S.W., Seo, D.G., Baik, J.E. et al. Differential profiles of salivary proteins with affinity to Streptococcus mutans lipoteichoic acid in caries-free and caries-positive human subjects. Mol. Oral Microbiol., 2014, 29(5): p. 208-18.
21. Chaudhury, N.M., Proctor, G.B., Karlsson, N.G., Carpenter, G.H. and Flowers, S.A. Reduced Mucin-7 (Muc7) Sialylation and Altered Saliva Rheology in Sjogren’s Syndrome Associated Oral Dryness. Mol. Cell Proteomics, 2016, 15(3): p. 1048-59.
22. Scully, C. Drug effects on salivary glands: dry mouth. Oral Dis., 2003, 9(4): p. 165-76.
23. Granger, D.A., Kivlighan, K.T., Fortunato, C. et al. Integration of salivary biomarkers into developmental and behaviorally-oriented research: problems and solutions for collecting specimens. Physiol. Behav., 2007, 92(4): p. 583-90.
24. Kamodyova, N. and Celec, P. Salivary markers of oxidative stress and Salivette collection systems. Clin. Chem. Lab. Med., 2011, 49(11): p. 1887-90.
25. Ishikawa, S., Sugimoto, M., Kitabatake, K. et al. Effect of timing of collection of salivary metabolomic biomarkers on oral cancer detection. Amino Acids, 2017, 49(4): p. 761-770.
26. Kamodyova, N., Banasova, L., Jansakova, K. et al. Blood Contamination in Saliva: Impact on the Measurement of Salivary Oxidative Stress Markers. Dis. Markers, 2015, 2015: p. 479251.
27. Mohamed, R., Campbell, J.L., Cooper-White, J., Dimeski, G. and Punyadeera, C. The impact of saliva collection and processing methods on CRP, IgE, and Myoglobin immunoassays. Clin. Transl. Med., 2012, 1(1): p. 19.
28. Chevalier, F., Hirtz, C., Chay, S. et al. Proteomic Stu-dies of Saliva: A Proposal for a Standardized Handling of Clinical Samples. Clinical Proteomics, 2007, 3(1): p. 13-21.
29. Lettrichova, I., Tothova, L., Hodosy, J., Behuliak, M. and Celec, P. Variability of salivary markers of oxidative stress and antioxidant status in young healthy individuals. Redox Rep., 2015.
30. Vijay, A., Inui, T., Dodds, M., Proctor, G. and Carpenter, G. Factors That Influence the Extensional Rheo-logical Property of Saliva. PLoS One, 2015, 10(8): p. e0135792.
Labels
Clinical biochemistry Nuclear medicine Nutritive therapist
Article was published inClinical Biochemistry and Metabolism

2018 Issue 1-
All articles in this issue
- Analytický systém online extrakce na pevné fázi ve spojení s tandemovou spektrometrií a jeho klinické využití
- Úvodní studie měření FGF 23 metodou LIAISON FGF 23
- Limitácie využitia sliny ako diagnostickej tekutiny v klinickej praxi
- Vitamin K a jeho význam v laboratorní medicíně
- Stanovení karbohydrát-deficientního transferinu (CDT) různými analytickými technikami
- Clinical Biochemistry and Metabolism
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Stanovení karbohydrát-deficientního transferinu (CDT) různými analytickými technikami
- Vitamin K a jeho význam v laboratorní medicíně
- Analytický systém online extrakce na pevné fázi ve spojení s tandemovou spektrometrií a jeho klinické využití
- Úvodní studie měření FGF 23 metodou LIAISON FGF 23
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

