-
Medical journals
- Career
Stanovení karbohydrát-deficientního transferinu (CDT) různými analytickými technikami
: P. Kušnierová 1,2; V. Bartoš 1,2; Z. Vavřina 2; M. Polok Rajska 3; P. Loučka 3; F. Všianský 1; D. Zeman 1,2; Z. Švagera 1,2; K. Šafarčík 1,2
: Ústav laboratorní diagnostiky, Oddělení klinické biochemie, Fakultní nemocnice Ostrava 1; Katedra biomedicínských oborů, Lékařská fakulta, Ostravská univerzita 2; SPADIA Lab, a. s. 3
: Klin. Biochem. Metab., 26, 2018, No. 1, p. 35-40
Cíl studie:
Stanovení CDT různými analytickými metodami s cílem nalezení nejvhodnější alternativy za původně používaný HPLC systém.Typ studie:
Metodická studie.Materiál a metody:
Do studie bylo zařazeno 140 pacientských vzorků z různých odborných ambulancí Moravskoslezského kraje s podezřením na abusus alkoholu. Stanovení CDT probíhalo dle validovaných postupů na analytických systémech Variant (HPLC; Bio-Rad), MINICAP (kapilární elektroforéza; Sebia) a BN ProSpec (imunonefelometrie; Siemens Healthineers). Ke statistickému zpracování dat byl využit program Excel a MedCalc, verze 16.1.2.Výsledky:
Byly verifikovány metody stanovení CDT na systémech BN ProSpec, Variant a MINICAP. Při hodnocení preciznosti měření za podmínek opakovatelnosti vykazoval nejmenší hodnoty variačních koeficientů (CV) analytický systém BN ProSpec (CV 2,17 – 5,10 %), současně vykazoval i nejmenší odchylku od deklarovaných hodnot komerčních kontrolních materiálů na obou hladinách (0,38 %; resp. -0,86 %). Na základě Passing-Bablokovy regrese nejlepší vzájemnou shodu vykazoval Variant vs. MINICAP (y = -0,466 + 1,128 x). Největší proporcionální chybu při vzájemném porovnání všech tří systémů vykazoval BN ProSpec. Při jejich hodnocení pomocí Bland-Altmanových diferenčních grafů byly zjištěny rostoucí hodnoty Bias. V oblasti vyšších koncentrací poskytuje BN ProSpec oproti ostatním systémům nižší hodnoty CDT %. Kappa statistika potvrdila nejlepší diagnostickou shodu mezi systémy Variant vs. MINICAP (κ = 0,851), nejhorší mezi systémy Variant vs. BN ProSpec (κ = 0,696).Závěr:
Na základě měření kontrolních materiálů vykazoval systém BN ProSpec nejlepší výsledky preciznosti i pravdivosti. Současně na základě kappa statistiky byla prokázána velmi dobrá shoda mezi analyzátory Variant a MINICAP, resp. BN ProSpec, nicméně díky jednoduchému, rychlému a bezproblémovému stanovení, volíme BN ProSpec jako nejvhodnější náhradu stávajícího dosluhujícího systému Variant.Klíčová slova:
karbohydrát-deficientní transferin, vysokoúčinná kapalinová chromatografie, kapilární elektroforéza, imunonefelometrie.Úvod
Karbohydrát-deficientní transferin (CDT) je dnes obecně přijímán jako jeden z objektivních markerů abusu alkoholu [1]. Transferin je glykoprotein syntetizovaný v hepatocytech, skládající se z polypeptidového řetězce se dvěma vazebnými místy pro železo (Fe3+) a ze dvou N-terminálních variabilně rozvětvených oligosacharidových jednotek s negativně nabitými konci, tvořenými zbytky kyseliny sialové. I za fyziologických podmínek tyto transferinové substruktury vykazují výraznou variabilitu a transferin tedy představuje skupinu izoforem, které se navzájem liší počtem navázaných iontů železa, substitucí aminokyselin v polypeptidovém řetězci a stupněm větvení oligosacharidových komplexů. V závislosti na struktuře oligosacharidového řetězce je možná vazba až osmi molekul kyseliny sialové. Podle stupně sializace rozeznáváme asialo-, monosialo-, až oktasialotransferin [1 - 3]. Za karbohydrát-deficientní transferin (CDT) byl na základě doporučení pracovní skupiny pro standardizaci CDT pod záštitou IFCC určen jako primární cílová molekula disialotransferin [4].
Denní příjem etanolu v množství 50-80 g (přibližně 0,75 l vína anebo 1,5 l piva) po dobu 2-4 týdnů vede k narušení syntézy N-oligosacharidových komplexů v Golgiho aparátu. To má za následek zvýšenou koncentraci izoforem transferinu, které mají navázané dvě, jednu anebo žádnou kyselinu sialovou, a tedy zvýšení CDT. Naopak, při abstinenci trvající aspoň 2-3 týdny se sializace normalizuje a hladina CDT se snižuje. CDT je tedy možné využívat i jako marker pro kontrolu abstinenční terapie [5-8].
Senzitivita CDT je podle řady studií různá, pohybuje se okolo 83 % u alkoholických hepatopatií a 49 % a více u alkoholiků bez jaterního onemocnění, ještě vice vzrůstá při kombinaci s dalšími laboratorními parametry [9-13]. Specificita CDT je naopak poměrně nízká, protože je také závislá na stavu metabolismu železa a hladině transferinu. Z tohoto důvodu je doporučeno vydávat hodnoty CDT v podobě relativního množství (% CDT z celkového transferinu) [4].
Doporučenou metodou stanovení CDT je vysokoúčinná kapalinová chromatografie (HPLC). Společně s kapilární elektroforézou (CE) představuje ve světě nejčastěji užívané laboratorní techniky.
Naším cílem bylo porovnat výše zmíněné analytické systémy HPLC a CE s imunonefelometrickým stanovením (IN) s cílem nalézt nejvhodnější alternativu za původně používaný HPLC systém.
Metodika
Do studie bylo zařazeno 140 vzorků pacientů z různých odborných ambulancí Moravskoslezského kraje s podezřením na abusus alkoholu. Ke stanovení CDT v séru byly použity tři analytické metody, dvě separační techniky - HPLC na analyzátoru Variant a CE na analyzátoru MINICAP, a IN na analyzátoru BN ProSpec. V případě automatizovaného analyzátoru Variant byla použita diagnostická souprava Ready-Prep % CDT by HPLC™, REF 195-6670, firmy Bio-Rad. Jednotlivé izoformy transferinu byly po předchozí přibližně 45 min. přípravě vzorku, separovány na anexu s UV detekcí (λ = 460 nm). Touto metodou bylo možné vysoce specificky a selektivně detekovat pouze transferiny saturované železem. Procentuální zastoupení CDT (% CDT) bylo vypočteno z podílu velikosti plochy pod píkem CDT a součtu velikostí ploch píků všech sializovaných izoforem transferinu [17].
V případě stanovení CDT na plně automatizovaném analyzátoru MINICAP byla použita diagnostická souprava MINICAP CDT, REF 2208, firmy Sebia. Tento analyzátor využívá princip kapilární elektroforézy ve vodném roztoku, při kterém jsou elektricky nabité molekuly děleny dle své elektroforetické pohyblivosti v alkalickém prostředí. Systém MINICAP má dvě kapiláry v paralelním zapojení, což umožňuje dvě paralelní analýzy pro kvantifikaci CDT. Vzorek bez předcházející úpravy byl po naředění specifickým ředícím roztokem v analyzátoru aspirován na anodovém konci kapiláry. Po vložení vysokého napětí probíhala separace izoforem CDT. Detekce probíhala na katodovém konci kapiláry při 200 nm. Výsledkem byl kompletní profil transferinu, jednotlivé isoformy transferinu byly detekovány v pořadí: asialo-, disialo-, trisialo-, tetrasialo - a pentasialotransferin. Málo sializované isoformy, disialotransferin asociovaný v některých případech s asialotransferinem, vytváří pík CDT [18 20].
Stanovení CDT na plně automatizovaném analyzátoru BN ProSpec pomocí diagnostické soupravy N Latex CDT Kit, REF OPCS, firmy Siemens Healthineers, bylo založeno na kompetitivní reakci mezi CDT ze vzorku a polystyrénovými částicemi potaženými CDT ve snaze navázat se na specifické monoklonální protilátky proti lidskému CDT. Při přítomnosti CDT ve vzorku se objevila jen malá nebo žádná agregace částic polystyrénu, naopak v jeho nepřítomnosti částice polystyrénu agregovaly. Čím vyšší byl obsah CDT ve vzorku, tím nižší byl signál rozptýleného světla. Kvantifikace byla provedena srovnáním se standardním vzorkem o známé koncentraci. Vyhodnocení bylo provedeno automaticky, výsledky byly vydávány v mg/l. Ve vzorku byla stanovena také koncentrace transferinu v g/l a následně vypočteno % CDT [21].
Ke statistickému zpracování dat byl využit program Excel a MedCalc, verze 16.1.2. U všech použitých testů byla statistická významnost posuzována na hladině p = 0,05.
K posouzení preciznosti a pravdivosti měření byly použity komerční kontrolní materiály: % CDT Kontrolní sada (REF 195-6669, Bio-Rad), NORMAL CDT CONTROL (REF 4795, SEBIA), HIGH CDT CONTROL (REF 4772, Sebia), N CDT Control 1 a 2 (součást diagnostické soupravy, REF OPCS, Siemens Healthineers) a vzorky směsného séra na dvou koncentračních hladinách.
Výsledky
Při posuzování opakovatelnosti byly nejnižší hodnoty variačního koeficientu získány na analyzátoru BN ProSpec, a to jak v případě firemních kontrolních materiálů (Tabulka 1), tak v případě směsných sér (Tabulka 2). Stejně tak, i při posouzení odchylky od deklarovaných hodnot komerčních kontrolních materiálů (Δkom), byly nejlepší výsledky dosaženy na analyzátoru BN ProSpec (Tabulka 1). Na základě porovnání dosažených hodnot Δkom s maximální přípustnou odchylkou 9,8 %, odvozené z biologické variability CDT, byla její nevyhovující hodnota shledána pouze na analyzátoru MINICAP na hladině 1.
1. Assessment of repeatability and trueness of individual analyzers using commercial controls; Variant, MINICAP, BN ProSpec. 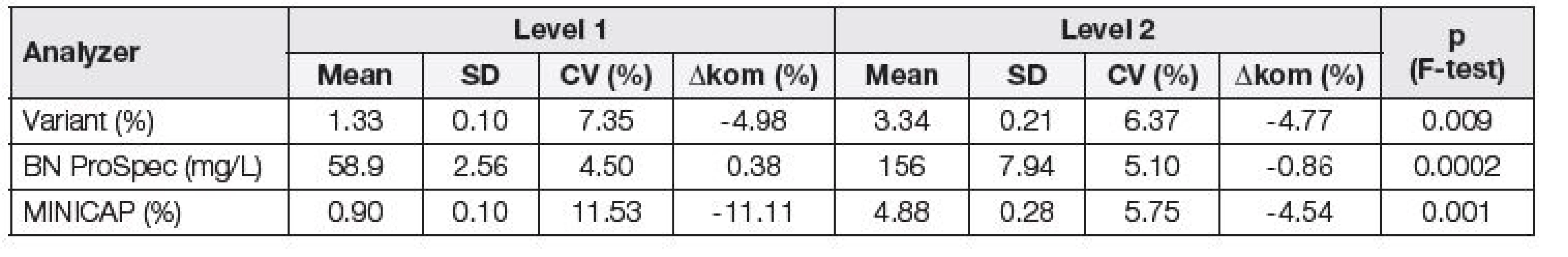
2. Assessment of repeatability of individual analyzers using pooled serum (normal and pathology pool); Variant, MINICAP, BN ProSpec. 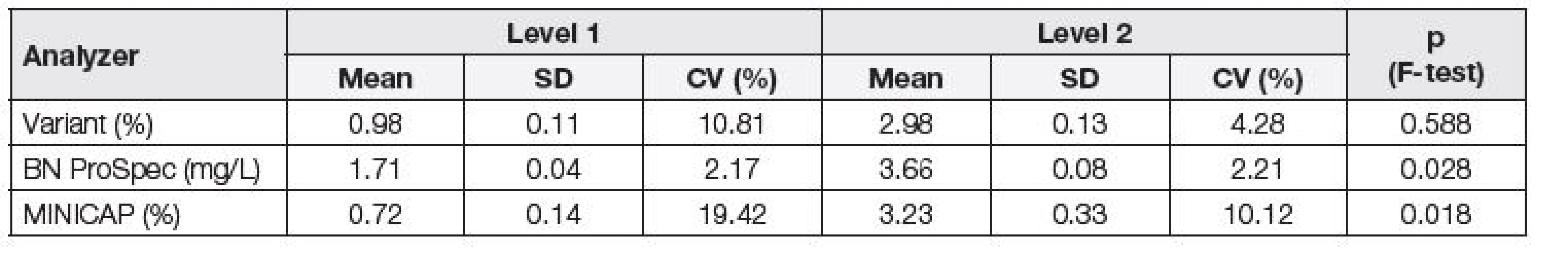
Pomocí F-testu byla posuzována závislost preciznosti na koncentraci. V případě porovnání hodnot všech tří systémů za použití komerčních kontrolních materiálů bylo zjištěno, že směrodatná odchylka (SD) je statisticky významně závislá na koncentraci (Tabulka 1), kdežto při použití směsných sér tato závislost nebyla prokázána na systému Variant (Tabulka 2), což je možno vysvětlit vlivem matrice vzorku.
Nejlepší shoda mezi hodnocenými systémy byla pomocí Passing-Bablokovy regresní analýzy prokázána v případě analyzátorů Variant a MINICAP (jedná se o principiálně bližší metody). Při porovnání analyzátorů Variant vs. BN ProSpec a současně MINICAP vs. BN ProSpec byla zjištěna výrazná proporcionální chyba 32 %, respektive 40 %, což je možné vysvětlit odlišným principem stanovení. Mezi analyzátory Variant a MINICAP byla chyba pouze 12 % (obr. 1).
1. The method comparison by Passing – Bablok regression analysis; 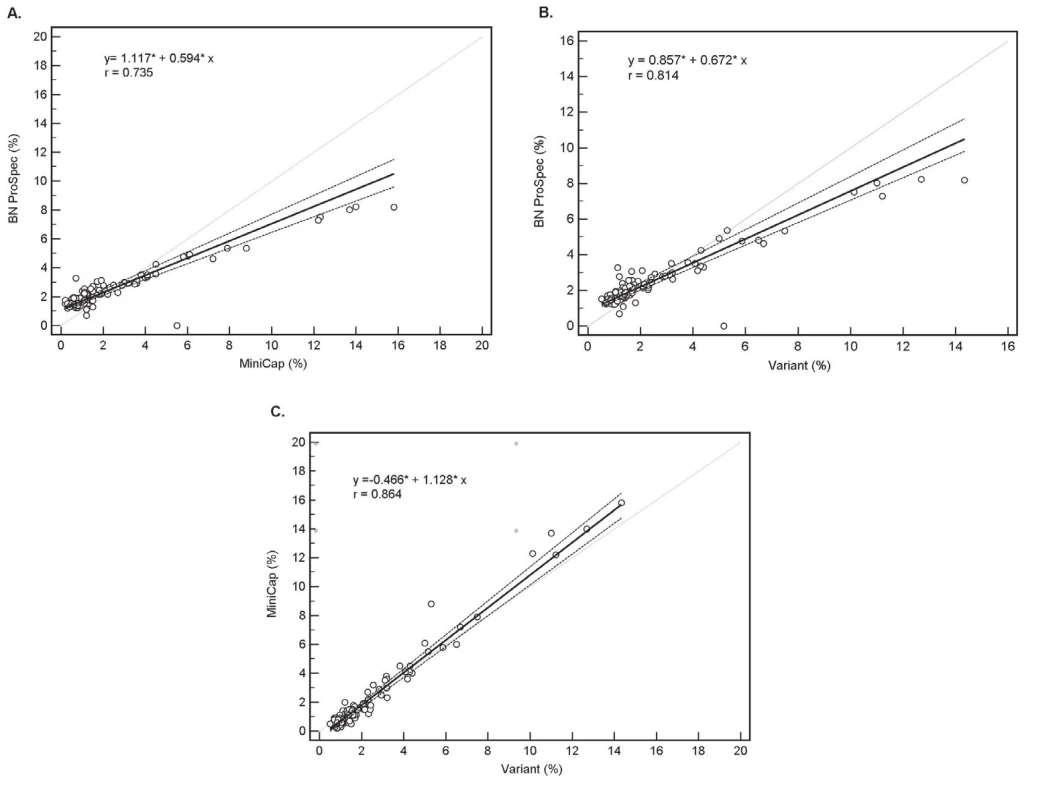
Existence nejmenších rozdílů mezi systémy Variant a MINICAP vyplynula rovněž ze vzájemného porovnání jednotlivých dvojic analyzátorů provedené pomocí metody diferenčních grafů dle Bland-Altmana (obr. 2). Ve všech diferenčních grafech byl navíc pozorován statisticky významný lineární trend nárůstu diferencí v závislosti na podílu CDT ve vzorku. Tento trend samozřejmě ovlivňuje validitu výpočtu rozdílu mezi jednotlivými metodami. V případě porovnání systémů Variant vs. MINICAP bylo zjištěno, že MINICAP poskytuje ve vyšších koncentracích vyšší hodnoty % CDT než Variant, kdežto ze zbývajících dvou srovnání, tj. Variant vs. BN ProSpec a MINICAP vs. BN ProSpec, vyplynulo, že BN ProSpec poskytuje u vyšších koncentrací nižší hodnoty % CDT. Současně bylo zjištěno, že do koncentrace 2 % CDT byly mezi výsledky pozorovány pouze náhodné rozdíly, kdežto při koncentraci nad 2 % CDT byla pozorována statisticky významná proporcionální diference výsledků.
2. Assessment the agreement among three analytical systems by using Bland–Altman Difference plot 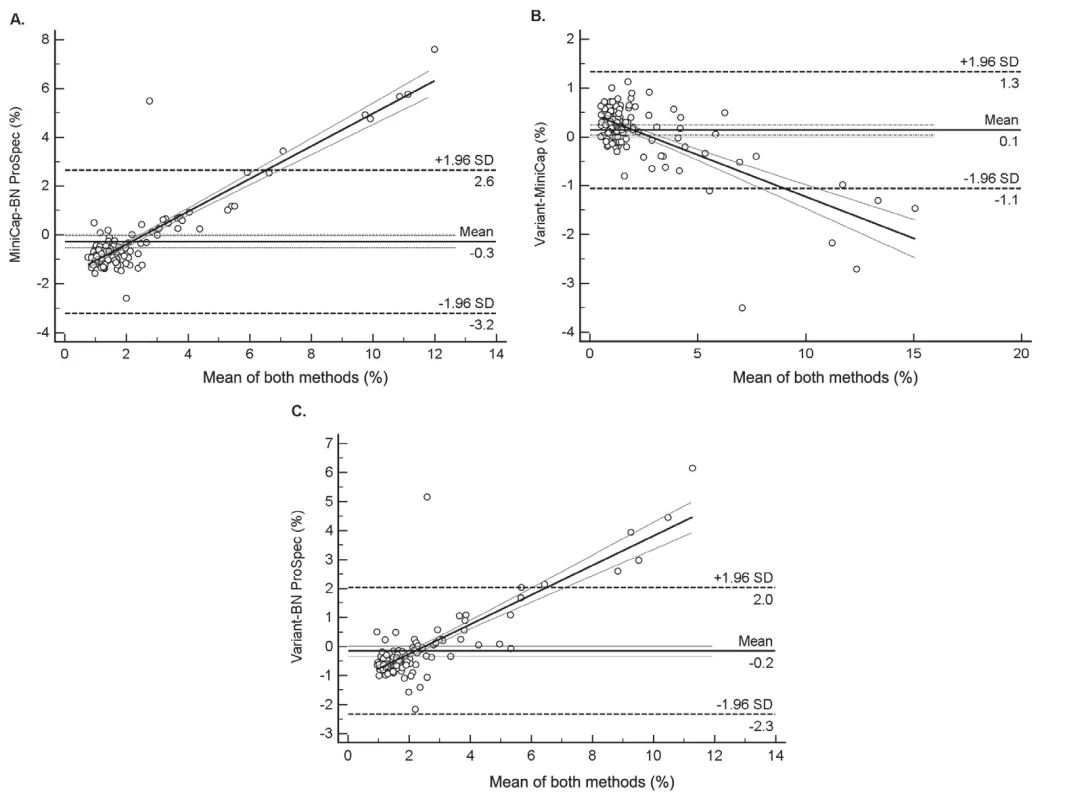
Dále bylo provedeno porovnání metod na základě shody klinické interpretace výsledků. Z důvodu rozdílných referenčních intervalů byla pro tento účel použita Kappa statistika. Všech 140 kvantitativních výsledků získaných každým analytickým systémem bylo převedeno na kvalitativní výsledky (negativní/pozitivní) pomocí cut-off hodnoty používané pro daný systém. Nejvyšší kappa koeficient, κ = 0,851 (95 % Cl = 0.751 – 0.951), resp. výborná shoda mezi testovanými systémy, byla prokázána mezi analyzátory Variant a MINICAP; dobrá shoda pak mezi MINICAP a BN ProSpec, κ = 0,768 (95 % Cl = 0.643 – 0.892) a Variant vs. BN ProSpec, κ = 0,696 (95% Cl = 0.558 – 0.834). Pomocí čtyřpolní tabulky byl současně zjištěn počet neshodných výsledků. Nejméně jich bylo nalezeno při srovnání systémů Variant vs. MINICAP.
Diskuse
Stanovení CDT je významným biochemickým markerem při identifikaci pacientů s nadměrným dlouhodobým užíváním alkoholu a při potvrzení/monitorování abstinence. Diagnostická účinnost stanovení CDT může být ještě zvýšena kombinací stanovení CDT společně s vyšetřením gama-glutamyltransferázy (GGT) a středního objemu erytrocytů (MCV). Procentuální zastoupení CDT nám dále umožňuje minimalizovat vliv koncentrace železa a omezení funkce jater na výsledek CDT [14-16].
Byly testovány a srovnávány tři analytické metody stanovení CDT. Každá z nich má svá omezení/úskalí.
V případě HPLC se jedná o problematické stanovení vzorků se zvýšeným podílem trisialotransferinu (> 7 %), u nichž může být zaznamenána přítomnost izoformy monosialotransferinu, kterou nelze odlišit a separovat od disialotransferinu. Diskutabilní může být v případě metody HPLC i CE interpretace výsledků analýzy vzorků s přítomnou genetickou heterozygotní B - anebo D-variantou transferinu. Omezením sice může být skutečnost, že se jednotlivé izoformy B a C, respektive C a D mohou přesmykovat, a tím způsobovat falešně snížené či zvýšené číselné hodnoty CDT, na druhou stranu však o přítomnosti této genetické varianty (na rozdíl od IN) informují díky tvaru chromatogramu [22, 23, 24].
Současně všemi třemi systémy můžeme zaznamenat falešně zvýšené hodnoty CDT u pacientů s vrozenou poruchou glykosylace, tzv. CDG syndromu, se závažným selháním jater (primární biliární cirhóza, chronická virová hepatitida a hepatocelulární karcinom), v těhotenství, při užívání estrogenů a u osob s anémií s nedostatkem železa.
Naopak falešně snížené hodnoty % CDT mohou být pozorovány u pacientů trpících anémií nebo onemocněním jater s abnormálně nízkou celkovou koncentrací transferinu (25).
Problém při imunonefelometrickém stanovení představují vzorky lipemické, vzorky pacientů s obsahem heterofilních protilátek a vzorky s velmi nízkou koncentrací transferinu (<1,2 g/L).
V případě CE se jeví jako obtížně interpretovatelné vzorky s monoklonální složkou nebo s vysokým polyklonálním pozadím, vzorky hemolytické, s obsahem fibrinogenu či odebrané do zkumavek s přídavkem antikoagulačního činidla (citrát, EDTA).
Na základě srovnání našich výsledků s výsledky publikovanými ve studii Bortolottiho a spol. [26] vyplývá, že bylo při stanovení CDT dosaženo obdobné shody mezi analytickými systémy IN, HPLC a CE. Při porovnání metody IN s HPLC byly získány podobně jako v naší studii pro podíl CDT < 4,5 % vyšší výsledky metodou IN, u výsledků s vyšší hodnotou % CDT, HPLC nadhodnocovala IN. Naopak, při srovnání CE s HPLC, na rozdíl od našich výsledků, HPLC poskytovala pro podíl CDT < 4,5 % vyšší hodnoty % CDT. Autoři se také zabývali možností využití stanovení CDT pro forenzní účely a doporučují v rámci prvního screeningu kombinací metod CE a IN především z důvodu jejich vysoké automatizace a produktivity, zatímco metodu HPLC, jako referenční metodu, využívat ke konfirmaci výsledku. Kromě toho poukazují na skutečnost, že kombinované použití CE nebo IN s HPLC splňuje požadavky používání technik založených na různých fyzikálních a chemických principech.
Současně i autoři Schellenberg a spol. [27] prokázali vysokou korelaci mezi přímou nefelometrií (BN ProSpec) a metodou CE na analyzátoru Capillarys, resp. imunoturbidimetrickou metodou s předchozí separací pomocí iontové výměny na separačních mikrokolonách (% CDT TIA). Dosažení vyšší korelace vysvětlují autoři zahrnutím vysokého počtu vzorků srovnávaných ve studii (n = 295) [28]. Naopak u vzorků s hodnotou CDT pod cut-off hodnotou pozorovali pouze slabou korelaci. Tuto heterogenitu pak vysvětlují nepřesností metod v nízkých koncentracích a současně metodologickou diferencí.
Vzhledem k výsledkům získaným naší studií a z výše citovaných prací je možné říci, že testované analytické systémy, BN ProSpec a MINICAP, jsou konzistentní alternativou ke stávajícímu systému Variant pracujícím na principu HPLC využívanému k rutinnímu měření CDT.
Závěr
Z hodnocených analytických systémů vykazoval BN ProSpec nejlepší výsledky preciznosti (opakovatelnosti) i pravdivosti měření. A i přestože BN ProSpec neposkytoval tak dobrou shodu výsledků s původním HPLC systémem Variant jako analyzátor MINICAP (kappa statistika), byl díky vysoké preciznosti, plné automatizovatelnosti, možností komunikace s LIS, lepší možnosti kvantifikace výsledků u problematických vzorků a v neposlední řadě i díky nutnosti náhrady stávajícího dosluhujícího systému, zvolen jako vhodnější alternativa jeho obměny.
Střet zájmů: Autoři prohlašují, že nejsou ve střetu zájmů.
Do redakce došlo 22. 8. 2017
Adresa pro korespondenci:
RNDr. Pavlína Kušnierová, Ph.D.
Oddělení klinické biochemie, Ústav laboratorní diagnostiky
Fakultní nemocnice Ostrava
17. listopadu 1790/5, 708 52 Ostrava-Poruba
e-mail: pavlina.kusnierova@fno.cz
Sources
1. Arndt, T., Carbohydrate-deficient transferrin as a marker of chronic alcohol abuse: a critical review of preanalysis, ana-lysis, and interpretation. Clin. Chem., 2001, 47, p.13-27.
2. Martiaková, K., Galajda, P., Mokáň, M. Diagnostika chronického abúzu alkoholu - význam CDT transferínu. Súčasná klinická prax, 2007, 4, p: 14-17.
3. de Jong, G., van Dijk, J.P., van Eijk H.G. The biology of transferrin. Clin. Chim. Acta., 1990, 190, p. 1-46.
4. Jeppsson, J.O., Arndt, T., Schellenberg, F., Wielders, J.P.M., Anton, R.F., Whitfield, J.B., Helander, A. International Federation of Clinical Chemistry and Laboratory Medicine Working Group on Standardization of Carbohydrate-deficient Transferin (IFCC-WG-CDT). Toward standardization of carbohydrate-deficient transferin (CDT) measurements: I. Analyte definition and proposal of a candidate reference method. Clin. Chem. Lab. Med., 2007, 45, p. 558–562.
5. Anton, R.F., Lieber, C., Tabakoff, B. Carbohydrate-deficient transferrin and gamma-glutamyltransferase for the detection and monitoring of alcohol use: Results from a multisite study. Alcohol Clin. Exp. Res., 2002, 26, p. 1215–1222.
6. Burke, V., Puddey, I.B., Rakic, V., Swanson, N.R., Dimmitt, S.B., Beilin, L.J., Ching, S., Beilby, J.P. Carbohydrate-deficient transferrin as a marker of change in alcohol intake in men drinking 20 to 60 g of alcohol per day. Alcohol Clin. Exp. Res., 1998, 22, p. 1973–1980.
7. Mikkelsen, I.M., Kanitz, R.D., Nilssen, O., Huseby, N.E. Carbohydrate-deficient transferrin: Marker of actual alcohol consumption or chronic alcohol misuse? Alcohol Alcohol, 1998, 33, p. 646–650.
8. Schmidt, L.G., Schmidt, K., Dufeu, P., Ohse, A., Rommelspacher, H., Muller, C. Superiority of carbohydrate-deficient transferrin to gamma-glutamyltransferase in detecting relapse in alcoholism. Am. J. Psychiatry., 1997, 154, p. 75–80.
9. Jeppsson, J.O., Kristensson, H., Fimiani, C. Carbohydrate-deficient transferrin quantified by HPLC to determine heavy consumption of alcohol. Clin. Chem., 1993, 39, p. 2115–2120.
10. Sillanaukee, P., Seppa, K., Koivula, T. CDT by anion-exchange chromatogramy followed by RIA as a marker of heavy drinking among men. Alcohol Clin. Exp. Res., 1993, 17, p. 230–233.
11. Nystrom, M., Perasalo, J., Salaspuro, M. Carbohydrate-deficient transferrin (CDT) in serum as a possible indicator of heavy drinking in young university students. Alcohol Clin. Exp. Res., 1992, 16, p. 93–97.
12. Nilssen, O., Huseby, N.E., Hoyer, G., Brenn, T., Schirmer, H., Forde, O.H. New alcohol markers—how useful are they in population studies: the Svalbard study 1988–89. Alcohol Clin. Exp. Res., 1992, 16, p. 82–86.
13. Godsell, P.A., Whitfield, J.B., Conigrave, K.M., Hanratty, S.J., Saunders, J.B. Carbohydrate deficient transferrin levels in hazardous alcohol consumption. Alcohol Alcohol, 1995, 30, p. 61–66.
14. Allen, J.P. Use of biomarkers of heavy drinking in health care practice. Mil. Med., 2003, 168, p. 364-367.
15. Anttila, P., Järvi, K., Latvala, J., Blake, J.E., Niemelä, O. A new modified gama-% CDT method improves the detection of problem drinking: studies in alcoholics with or without liver disease. Clin. Chim. Acta., 2003, 338, p. 45-51.
16. Schwan, R., Albuisson, E., Malet, L., Loiseaux, M.N., Revnaud, M. Schellenberg F, Brousse G., Llorca PM. The use of biological laboratory markers in the diagnosis of alcohol misuse: an evidence-based approach. Drug Alcohol Depend, 2004, 74, p. 273-279.
17. BIO-RAD. Návod k použití: Ready-Prep % CDT by HPLCTM. Ref. 195-6670. [online]. [cit. 2017-06-20]. Dostupný na WWW: http://www.bio-rad.com/it-it/product/ready-prep-cdt-hplc.
18. SEBIA. Návod k použití: MINICAP CDT. Ref. 2208. [online]. cit. 2017-06-20]. Dostupný na WWW: http://extranet.sebia.com/sites/site/files/pdfs/12208_cz.pdf
19. Landers, J.P. Clinical Capillary Electrophoresis. Clin. Chem., 1995, 41, p. 495–509.
20. Oda R.P. et al. Capillary electrophoresis as a clinical tool for the analysis of protein in serum and other body fluids. Electrophoresis, 1997, 18, p. 1715-1723.
21. Siemens Healthineers. Návod k použití: N Latex CDT Kit, Ref. OPCS, 2012/11.
22. Helander, A., Wielders, J.P., Te Stroet, R., Bergstrom, J.P. Comparison of HPLC and capillary electrophoresis for confirmatory testing of the alcohol misuse marker carbohydrate-deficient transferrin. Clin. Chem., 2005, 51, p.1528–1531.
23. Helander, A., Bergstrom, J., Freeze, H.H. Testing for congenital disorders of glycosylation by HPLC measurement of serum transferin glycoforms. Clin. Chem. 2004, 50, p. 954–958.
24. Carchon, H.A., Chevigne, R., Falmagne, J.B., Jaeken, J. Diagnosis of congenital disorders of glycosylation by capillary zone electrophoresis of serum transferrin. Clin. Chem. 2004, 50, p.101–111.
25. Helander, A., Eriksson, G., Stibler, H., Jeppsson, J.-O. Interference of transferrin isoform types with carbohydrate-deficient transferrin quantification in the identification of alcohol abuse. Clin. Chem. 2001, 47, p.1225-1233.
26. Bortolotti, F., Trevisan, M.T., Micciolo, R., Canal, L., Vandoros, A.,Palmbach, T.M., Tagliaro, F. Re-assessment of the cut-off levels of Carbohydrate Deficient Transferrin (CDT) for automated immunoassay and multi-capillary electrophoresis for application in a forensic context. Clin. Chim. Acta., 2013, 416, p. 1-4.
27. Schellengerf, F., Girre, C., Nalpas, B., Plat, A., Tome, A., Pages, J.C. Analytical evaluation of a new capillary electrophoresis method for carbohydrate-deficient transferrin measurement. Clin. Chim. Acta., 2007, 382, p. 48-53.
28. Fermo, I., Germagnoli, L., Soldarini, A., et.al. Capillary zone electrophoresis for determination of carbohydrate-deficient transferin in human serum. Electrophoresis 2004, 25, p. 469-475.
Labels
Clinical biochemistry Nuclear medicine Nutritive therapist
Article was published inClinical Biochemistry and Metabolism

2018 Issue 1-
All articles in this issue
- Online solid phase extraction analytical system coupled to tandem mass spectrometry for clinical applications.
- Initial study of FGF 23 measurement by LIAISON FGF 23 method
- Limitation of the use of saliva as diagnostic fluid in clinical practice
- Vitamin K and its importance in laboratory medicine
- Determination of Carbohydrate Deficient Transferrin (CDT) by various analytical techniques
- Clinical Biochemistry and Metabolism
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Determination of Carbohydrate Deficient Transferrin (CDT) by various analytical techniques
- Vitamin K and its importance in laboratory medicine
- Online solid phase extraction analytical system coupled to tandem mass spectrometry for clinical applications.
- Initial study of FGF 23 measurement by LIAISON FGF 23 method
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career



