-
Medical journals
- Career
Evolocumab – protilátka proti PCSK9 s mohutným hypolipidemických účinkem
Authors: M. Vráblík
Authors‘ workplace: Centrum preventivní kardiologie, III. interní klinika 1. LF UK a VFN v Praze
Published in: Kardiol Rev Int Med 2015, 17(4): 362-366
Category: Cardiology Review
Overview
Přibližně před deseti lety byl objeven nový protein označený proprotein konvertáza subtilisin kexin 9 (PCSK9) významně ovlivňující hladiny sérového LDL cholesterolu. Ve velmi krátké době výzkum vyústil v přípravu specifických monoklonálních protilátek blokujících tento protein. Evolokumab je jednou z prvních dostupných humánních monoklonálních protilátek proti PCSK9. Blokáda PCSK9 vede ke zvýšení počtu recirkulujících LDL receptorů na povrchu hepatocytu a k poklesu LDL cholesterolu (i dalších aterogenních lipidů) v séru o 50 – 70 % nad rámec dosažitelný ostatními dostupnými terapiemi. Bezpečnost a účinnost evolokumabu je testována v rozsáhlém výzkumném programu PROFICIO. Tato nová terapeutická možnost představuje naději pro obtížně léčitelné nemocné s familiární hypercholesterolemií nebo intolerancí statinů a do budoucna možná i pro další pacienty s velmi vysokým a vysokým kardiovaskulárním rizikem nedosahující cílových hodnot LDL cholesterolu běžnými postupy.
Klíčová slova:
kardiovaskulární riziko – LDL cholesterol – evolokumab – PCSK9 – monoklonální protilátky
Využití monoklonálních protilátek v různých medicínských odvětvích není novinkou. Gastroenterologie, dermatologie, revmatologie a samozřejmě onkologie využívá možností této cílené léčby již delší dobu s úspěchem. Výhody takové terapie známe: cílená léčba se podává parenterálně, neinterferuje s žádnou současně podávanou konvenční terapií, má většinou vysokou účinnost a svým přesným zacílením predikovatelný účinek a méně účinků nežádoucích. Dávkovací interval může být delší a adherence k terapiím zvláště při asistovaném podávání ve zdravotnickém zařízení se blíží 100 %. Na druhé straně můžeme vyjmenovat i některé nevýhody: parenterální podání mohou někteří považovat za nepohodlné, pro některé pacienty jde o nepřekonatelnou překážku. Reakce v místě aplikace se liší podle typu podávané látky, ale lze říci, že vždy se podání aktivní látky projevuje vyšším výskytem lokálních reakcí v místě vpichu než u placeba. Imunitní reakce vyvolaná exogenně podávanými proteiny může spouštět tvorbu neutralizujících protilátek snižujících efektivitu léčby [1].
V léčbě akutního koronárního syndromu používají kardiologové monoklonální protilátky proti destičkovému glykoproteinovému receptoru IIb/ III (abciximab) již nějakou dobu [2]. Do oblasti (preventivní) kardiologie přichází koncept využití cílené terapie teprve nyní. O to razantnější vstup však zažíváme. Nejdále dospěly klinické testy sledující vliv interference specifických monoklonálních protilátek proti proprotein konvertáza subtilisin kexin 9 (PCSK9). Evolocumab jako jeden z nejpokročilejších reprezentantů této nové lékové skupiny byl v Evropě dokonce již registrován Evropskou lékovou agenturou jako léčivo indikované k léčbě hypercholesterolemie s obchodním názvem Repatha. Shrnutí důležitých poznatků o evolocumabu přináší následující přehled.
Inhibice PCSK9 – účinná cesta k příznivému ovlivnění lipidového metabolizmu
PCSK9 je devátým objeveným zástupcem rodiny serinových proteáz. Její maximální expresi nacházíme v buňkách jaterní a střevní tkáně. Zatím jedinou identifikovanou funkcí je regulace exprese receptoru pro LDL cholesterol (LDL‑c). PCSK9 tvoří komplex s LDL receptorem na povrchu buňky. Po navázání LDL částice se celý komplex internalizuje do cytoplazmy. Vazba PCSK9 na LDL receptor změní konformaci receptorového proteinu a znemožní uvolnění LDL částice z vazby na receptor. V tomto případě se celý komplex LDL receptor + LDL částice + PCSK9 degraduje v lyzozomu. Tímto mechanizmem brání PCSK9 normálnímu průběhu recyklace LDL receptoru a jeho zpětnému vystavení na plazmatické membráně, procesu, který bez přítomnosti PCSK9 může proběhnout až 150× v průběhu „životnosti“ LDL receptorového proteinu. Aktivita PCSK9 tedy reguluje počet LDL receptorů na povrchu buněk [3]. Je‑li zvýšená, počet aktivních receptorů klesá a koncentrace LDL‑c stoupá. PCSK9 poprvé identifikovali vědci u osob s fenotypem familiární hypercholesterolemie, nositelů genových variant zvyšujících aktivitu proteinu (tzv. gain of function mutations – mutace zvyšující funkci) [4]. V případě snížení aktivity PCSK9 nastává děj přesně opačný a osoby s geneticky podmíněným poklesem funkce PCSK9 jsou charakterizovány hypocholesterolemií. V epidemiologických studií sledujících osoby s hypocholesterolemií (hypobetalipoproteinemií) zachytili výzkumníci nositele mutací v genu pro PCSK9 snižující jeho funkci, kteří byli charakterizováni velmi nízkými koncentracemi LDL‑c. Za ilustrativní lze považovat příběh 40leté vysokoškolsky vzdělané ženy, matky dvou dětí, která se živila jako cvičitelka aerobiku. Pozornost vzbudila zjištěná koncentrace jejího LDL‑c, která byla 0,36 mmol/ l. Genetické vyšetření u ní odhalilo dvě různé mutace snižující funkci PCSK9 – byla tedy složeným heterozygotem s prakticky nedetekovatelnými hladinami PCKS9 v séru. Oba rodiče i někteří sourozenci vyšetřené probandky byli heterozygoty pro mutace v genu pro PCSK9 a jejich hladiny LDL‑c se pohybovaly pod 1. percentilem populačních rozmezí (obr. 1).
Image 1. Rodokmen probandky (označena šipkou) s dvěma mutacemi snižujícími funkci PCSKS9. 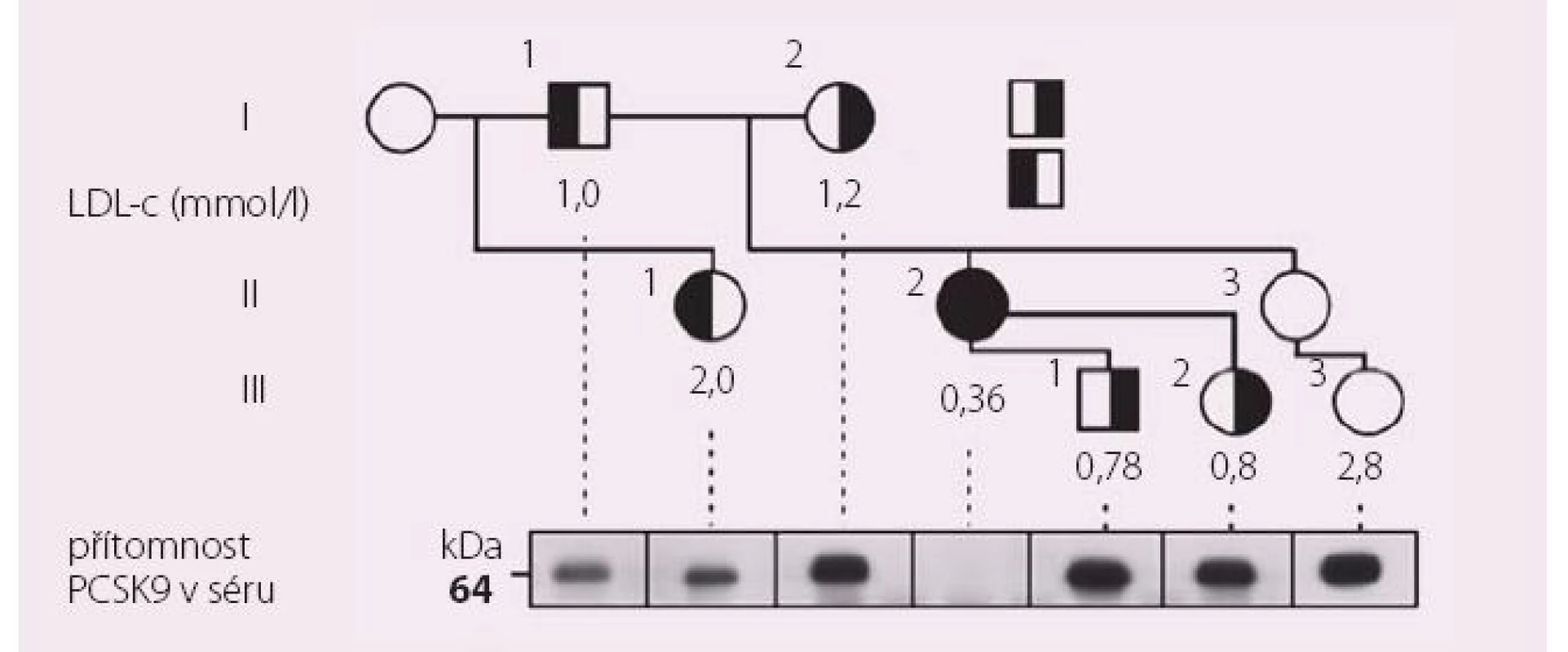
Přitom i stručná charakteristika popsané osoby ukazuje na několik důležitých aspektů praktické absence PCKS9 aktivity. To, že vede k poklesu LDL‑c do velmi nízkých hodnot, není překvapením. Představuje však důležitou informaci o bezpečnosti jak nízké aktivity PCSK9, tak i velmi nízkých hladin LDL‑c. Ty bývají často dávány do souvislosti s různými riziky, mezi nimiž pravidelně dominují myopatie, poruchy kognitivních funkcí a také riziko poruch produkce steroidních hormonů včetně pohlavních. Fakt, že popsaná žena s celoživotně nízkou hladinou LDL‑c intenzivně cvičila, měla vysokoškolské vzdělání a dvě zdravé děti ilustruje, že nízké koncentrace LDL‑c v séru samy o sobě žádnou z těchto funkcí zásadně neporušují [5]. Následovala další pozorování, která dokumentovala podobný efekt geneticky podmíněného snížení funkce PCSK9 nejen na hladiny sérových lipidů, ale také na riziko ischemické choroby srdeční. Výsledky 15letého sledování kohorty více než 3 300 Afroameričanů sledovaných v rámci studie ARIC vyvolaly velký ohlas – mezi sledovanými bylo identifikováno 85 nositelů mutace v genu pro PCSK9 se snížením funkce tohoto proteinu. Tito probandi měli o 28 % nižší průměrné hladiny LDL‑c. Tento nevelký, ale celoživotní rozdíl mezi „běžnou populační“ úrovní LDL cholesterolemie vyústil v dramatický pokles rizika ischemické choroby srdeční (ICHS) o 88 % [6].
Zájem o PCSK9 jako o potenciální terapeutický cíl na sebe nenechal dlouho čekat a začala práce na přípravě farmakologických možností blokády funkce tohoto proteinu. Ty zahrnují výzkum tzv. malých molekul blokujících PCSK9 intracelulárně, vývoj anti‑sense technologií interferujících s translací mRNA pro PCSK9 nebo mimetických peptidů napodobujících vazebné místo LDL receptoru pro PCSK9 s neutralizující funkcí. Nejpokročilejším se jistě stal koncept monoklonálních protilátek, který postoupil do posledních fází klinického zkoušení.
Evolocumab – plně humánní protilátka proti PCSK9
Evolocumab je plně humánní monoklonální imunoglobulin G2 s vysokou afinitou k LDL receptorové vazebné doméně pro PCSK9. Evolocumab se podává subkutánně a má nelineární farmakokinetiku, což znamená, že plazmatická koncentrace léčiva nestoupá spojitě v závislosti na dávce. Opakované dávky evolocumabu nad 140 mg aplikovaných jednou za 14 dnů ale již vykazují farmakokinetiku lineární s dosažením vrcholové koncentrace léčiva 72 hod po podání [7].
Klinické hodnocení evolocumabu
Můžeme říci, že klinické testování inhibitorů PCSK9 představuje největší výzkumný farmaceutický program v současné kardiologii. Evolocumab prochází testováním účinnosti a bezpečnosti v různých populacích a klinických situacích v programu PROFICIO (obr. 2).
Image 2. Přehled studií programu PROFICIO testující evolocumab. 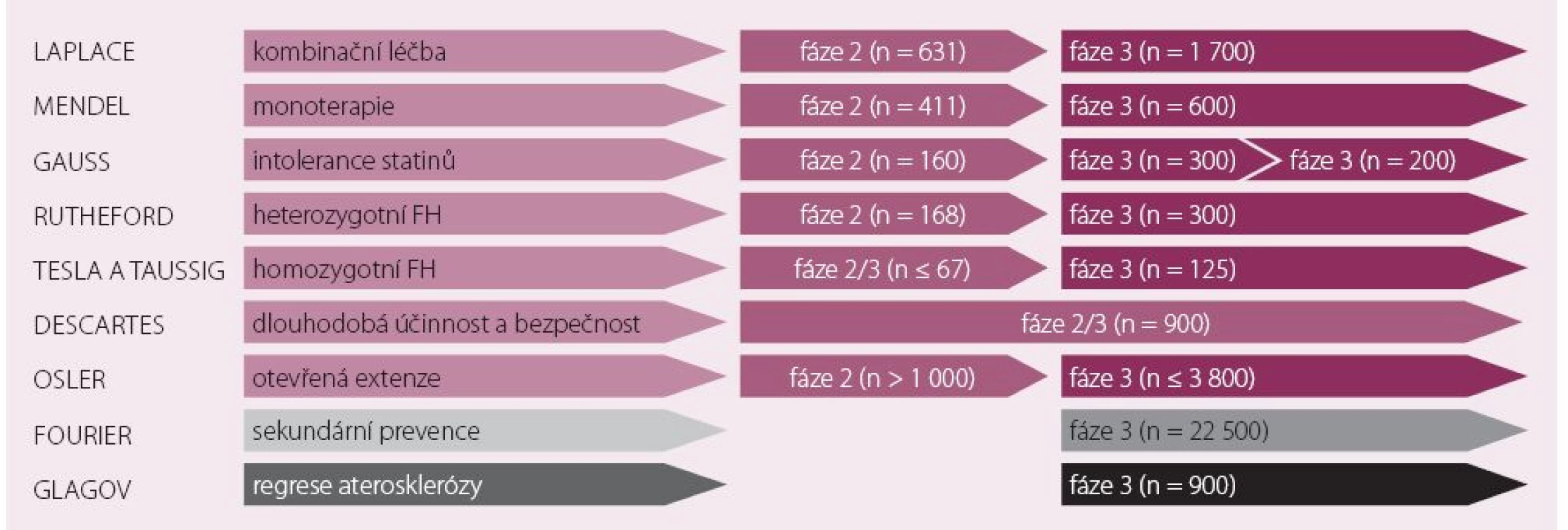
Rozsáhlé výzkumné programy s mnoha souběžně probíhajícími a na sebe navazujícími studiemi řeší řadu úkolů, které postupně rozebereme.
Úkol číslo 1 – definice vhodných populací
První úkol pro návrh výzkumného programu testování evolocumabu (i ostatních PCSK9 inhibitorů) představovala definice populací pro testování. Pozornost se zaměřila vcelku logicky v první řadě na nemocné s familiární hypercholesterolemií (FH), u nichž je potřeba dalšího prostředku ke snížení významně zvýšených hladin LDL‑c naléhavá. Evolocumab byl testován u heterozygotních nositelů FH ve studii RUTHEFORD a u homozygotů v projektu TESLA. Studie TAUSSIG sledovala stejnou populaci nemocných, ale hodnotila význam přidání evolocumabu do léčby pacientů podstupujících lipoproteinovou aferézu. Další skupinou klinických studií jsou projekty hodnotící evolocumab u pacientů s hypercholesterolemií a vysokým kardiovaskulárním rizikem v monoterapii (MENDEL) nebo kombinaci s dalšími hypolipidemiky (LAPLACE). Specifickou cílovou skupinu pro testování představují nemocní s intolerancí statinů, na které se zaměřily studie GAUSS 1 a GAUSS 2. Účinnost a bezpečnost v delším časovém horizontu jednoho roku sledovala studie DESCARTES. Autoři výzkumného programu předem plánovali vyhodnocení bezpečnostních a účinnostních parametrů ze sloučených databází vybraných studií, které bylo publikováno pod akronymem OSLER. Jistě ale největší očekávání vzbuzuje výsledek dlouhodobé studie FOURIER sledující výskyt kardiovaskulárních příhod u vysoce rizikové populace [8].
Úkol číslo 2 – definice vhodné dávky
Nalezení vhodné dávky a dávkovacího intervalu založeného na znalosti farmakokinetiky bylo úkolem studií I. a II. fáze. U 56 zdravých dobrovolníků vedlo podávání evolocumabu k poklesu LDL‑c o 64 %, zatímco u nemocných s hypercholesterolemií (zařazených do dalšího projektu fáze Ib) koncentrace LDL‑c klesla až o 81 % ve srovnání s placebem [9,10]. Současně byl dokumentován pokles hladin lipoproteinu (a)(Lp(a)) o 38 %. Očekávatelné bylo snížení hladin apolipoproteinu B (apoB) o 59 %. V obou studiích bylo zjištěno, že evolocumab má detekovatelný efekt od dávek > 20 mg a že dávka 420 mg a vyšší poskytuje snížení LDL‑c o více než 60 %. Následující studie fáze II (MENDEL) testovala široké dávkové rozmezí evolocumabu od 70 do 140 mg à 14 dnů nebo 280 – 420 mg à 4 týdny (obr. 3) [11].
Image 3. Pokles LDL-c ve srovnání se vstupní hodnotou v závislosti na dávce evolocumabu ve studii MENDEL. 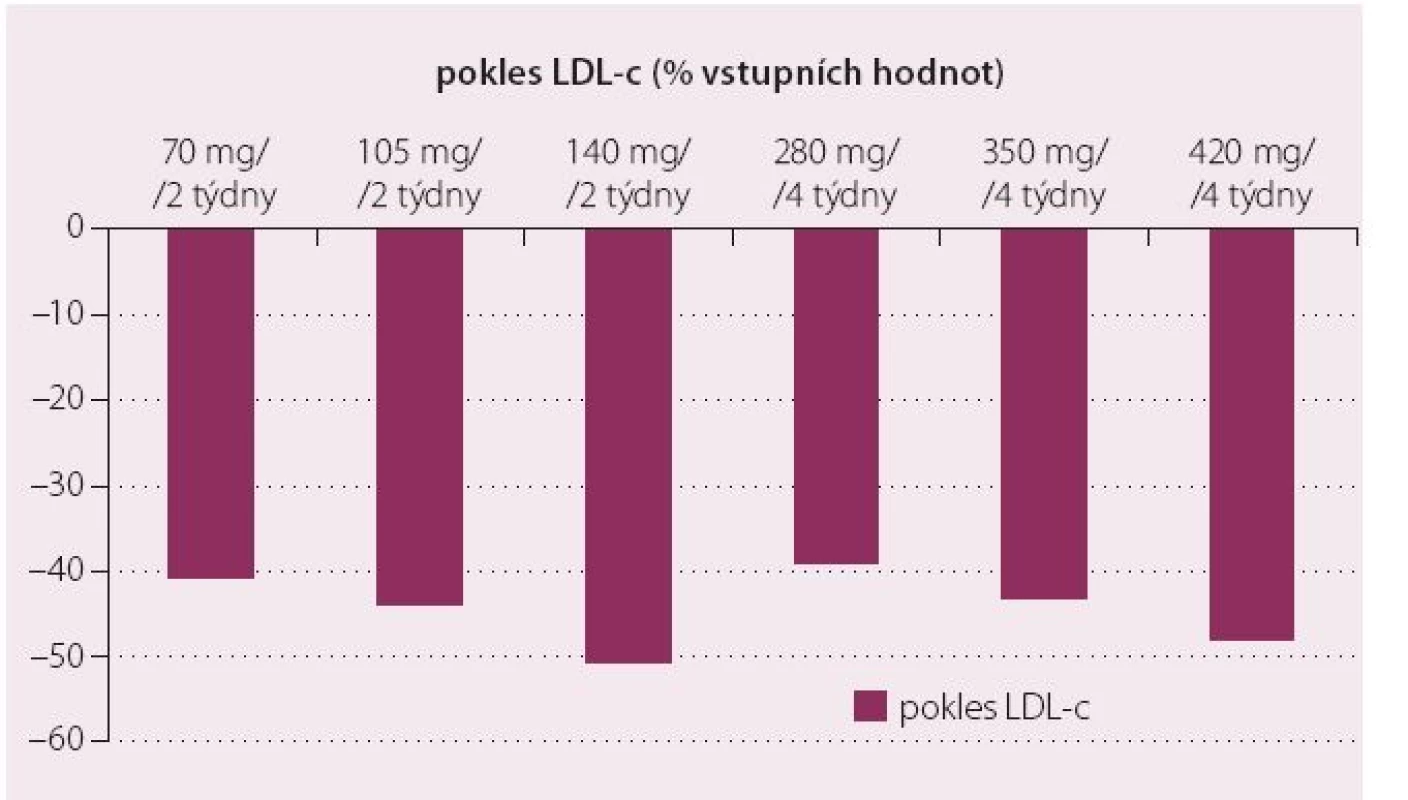
Účinnost evolocumabu byla závislá na dávce a maxima dosahovala při podávání 140 mg ve dvoutýdenních intervalech nebo 420 mg 1× měsíčně – v obou případech snížení LDL‑c dosahovalo přibližně 50 % vstupních hodnot. Podobné uspořádání i výsledky měla i studie LAPLACE TIMI 57, v níž bylo sledováno 631 hypercholesterolemických pacientů po dobu tří měsíců [12]. Výsledky potvrdily pozorování studie MENDEL, opět byl zaznamenán výrazný pokles LDL‑c (70 % pacientů léčených evolocumabem dosáhlo cílové hodnoty LDL‑c < 1,8 mmol/ l) provázený snížením hladiny apoB, non‑HDL‑c, triglyceridů a v neposlední řadě Lp(a). Koncentrace Lp(a) klesly v závislosti na dávce o 18 – 32,3 %. Tento efekt opakovaně demonstrovaly nejen další studie s evolocumabem, ale i s ostatními monoklonálními protilátkami proti PCSK9, a jde o žádoucí efekt celé třídy těchto nových léčiv. Kumulace údajů o účinnosti evolocumabu probíhala v dalších studiích, které reportují pozoruhodně konzistentní údaje z různých pacientských populací.
Úkol číslo 3 – místo evolocumabu v léčbě pacientů s familiární hypercholesterolemií
Podobně jako ostatní PCSK9 inhibitory věnoval i evolocumab ve svém výzkumném programu zvláštní místo nemocným s FH. Zaměření na pacienty s FH je správné a logické, neboť představují skupinu osob, u kterých je potřeba dalších možností ke snížení hladin LDL‑c zvláště naléhavá.
Studie RUTHEFORD randomizovala 168 heterozygotů FH k léčbě evolocumabem v dávkách 350 nebo 420 mg à 4 týdny (přidávaným ke standardní léčbě) a 56 FH pacientů k terapii placebem na dobu 12 týdnů [13]. Snížení LDL‑c dosáhlo u léčených nižší dávkou 43 % a u pacientů léčených 420 mg 1× za 4 týdny dokonce 55 % ve srovnání s placebovou skupinou. Tyto změny opět provázelo významné snížení triglyceridů (o 15 – 20 %), hladin Lp(a) o 23 – 32 % a vzestup HDL‑c o 7 %.
Zvláštní pozornost zasluhují klinické studie s homozygoty FH, kterým současné možnosti farmakoterapie nepřinášejí dostatečný efekt, a proto jsou tito nemocní častými kandidáty lipoproteinové aferézy. Ve studii TESLA sledovali investigátoři 50 pacientů s homozygotní formou FH a zjistili průměrný pokles LDL‑c při podávání evolocumabu o 30,9 % [14]. Samozřejmě, u pacientů s tzv. receptor ‑ negativní formou homozygotní FH (tj. mutací způsobující úplnou absenci funkčního proteinu LDL receptoru v homozygotní konstituci) nemá inhibice PCSK9 žádný vliv na lipoproteinové hladiny. Většina homozygotů FH má však „naštěstí“ kauzální mutaci způsobující snížení vazebné afinity nebo jiné z funkcí LDL receptoru a má různě velkou zbytkovou receptorovou aktivitu. Tu lze využít pro zprostředkování efektu inhibice PCSK9, a vysvětlit tak i významný efekt evolocumabu u těchto vzácných a těžce postižených pacientů. Další rozšíření znalostí o účinnosti evolocumabu u pacientů s FH přinesla studie TAUSSIG [15]. Ta testovala význam přidání evolocumabu k léčbě pacientů s homozygotní (n = 34) nebo těžkou heterozygotní (n = 18) FH léčených LDL aferézou. Evolocumab snížil hladiny LDL‑c u homozygotních pacientů o 17 % a u heterozygotů dokonce o 65 %. 15 % pacientů s homozygotní FH a 31 % FH heterozygotů ve studii snížilo frekvenci nebo zcela ukončilo léčbu LDL aferézou. Studie ukázala další směr využití inhibice PCSK9 u nejzávažněji postižených nemocných s hypercholesterolemií.
Úkol číslo 4 – ověření účinnosti a snášenlivosti u nemocných se statinovou intolerancí
Při rozšiřujících se indikacích statinů máme absolutně narůstající počet pacientů neschopných tolerovat statiny nebo jejich dávku dostatečně vysokou k dosažení léčebných cílů. Pro takové nemocné představují nové terapie naději ke zlepšení lipidogramu a také prognózy. Studie GAUSS 1 a GAUSS 2 testovaly nemocné neschopné tolerovat alespoň dva různé statiny v účinných dávkách [16,17]. Obě ukázaly obdobné vlivy na lipidogram jako výše komentované projekty, především pokles LDL‑c o více než 50 %. Tolerance léčby zařazenými byla velmi dobrá (srovnatelná s placebem) a opět se potvrdilo, že nežádoucí účinky nepůsobí snižování hladin cholesterolu, ale jsou vázány na konkrétní způsob, kterým jej dosahujeme.
Úkol číslo 5 – ověření účinnosti a bezpečnosti v delším časovém období
Většina úvodních studií programu PROFICIO s evolocumabem trvala tři měsíce. Proto bylo nutné zjistit účinnost a toleranci léčby v delším časovém období. Téměř roční sledování nemocných s nedostatečně kontrolovanou hypercholesterolemií, do jejichž léčby byl přidán evolocumab v dávce 420 mg 1× měsíčně ve studii DESCARTES, ukázalo, že nová léčba „přidává“ dalších přibližně 50 % snížení LDL‑c všem, bez závislosti na typu a dávce souběžně podávané medikace (obr. 4).
Image 4. Změna hladin LDL-c ve srovnání se vstupními koncentracemi při podávání evolocumabu ve studii DESCARTES (týden 12 a týden 52). 
Ve studii DESCARTESS dosáhlo celkem82,3 % pacientů cílových hodnot LDL‑c < < 1,8 mmol/ l [18].
Nejdůležitější data z hlediska dlouhodobého efektu a bezpečnosti terapie přinese studie FOURIER, která na souboru 22 500 pacientů s kardiovaskulárním onemocněním testuje vliv evolocumabu na výskyt KV příhod. Studie probíhá od roku 2013 s předpokládaným ukončením v roce 2018 [19].
Úkol číslo 6 – ověření bezpečnosti evolocumabu
Vzhledem k faktu, že evolocumab je humánní monoklonální protilátka, lze očekávat teoreticky několik možných okruhů nežádoucích účinků. První by byla způsobena působením protilátky v dalších tkáňových strukturách mimo žádoucí interferenci s PCSK9. Druhý okruh nežádoucích reakcí zahrnuje akutní formy hypersenzitivity (anafylaktické reakce). Třetí očekávatelnou možností je vznik neutralizujících protilátek proti podávaným monoklonálním protilátkám. Všechny studie s evolocumabem sledují výskyt nežádoucích účinků. Studie OSLER byly navrženy jako dlouhodobé pokračování studií fází II (OSLER 1) a fází III (OSLER 2) se zaměřením na sledování dlouhodobé účinnosti a bezpečnosti evolocumabu. Výsledky souhrnného sledování 4 465 pacientů hodnocených po mediánu sledování 11,1 měsíce byly publikovány v letošním roce [20]. Mezi 2 976 pacienty randomizovanými k evolocumabu muselo terapii přerušit 71 osob (2,4 %). Reakci v místě vpichu mělo 129 sledovaných (4,3 %), 190 pacientů léčených evolocumabem mělo svalové obtíže (6,4 vs. 6,0 % v placebové větvi). Změna kognitivních funkcí byla zaznamenána u 27 ze skupiny léčené evolocumabem (0,9 %) a u čtyř, jimž bylo podáváno placebo (0,3 %). Důležité je, že výskyt nežádoucích účinků nekoreloval s hladinou LDL‑c dosaženou při léčbě. Protilátky schopné vazby na evolocumab byly v průběhu studie zjištěny u devíti pacientů léčených aktivní léčbou a u čtyř na placebu, produkce neutralizačních protilátek limitujících účinnost léčby nebyla zjištěna. Souhrnně můžeme říci, že bezpečnost evolocumabu se zatím zdá být velmi dobrá s nečetnými a většinou nezávažnými nežádoucími účinky.
Vedlejším pozorováním studie OSLER bylo podstatné snížení výskytu kardiovaskulárních příhod dosahující více než 50 %. Tento výsledek berme jako slibný, ale jde „pouze“ o explorativní analýzu dat primárně bezpečnostní studie OSLER a nesmíme jej považovat za jednoznačný průkaz účinnosti.
Závěr
Výsledky probíhajících i uzavřených projektů sledujících podávání inhibitorů PCSK9 vypadají velmi nadějně. Evolocumab shromáždil během výzkumného programu PROFICIO pozoruhodné množství dat, které dokládají, že pacienti léčbu dobře tolerují a hypolipidemický efekt je pronikavý i ve skupinách nejobtížněji ovlivnitelných pacientů s FH i v homozygotní konstituci. Evolocumab má tedy jistě „právo“ na indikaci v léčbě hypercholesterolemie. Naplní‑li se očekávání a budou‑li výsledky dlouhodobých mortalitních studií v souladu s těmi dosud publikovanými, otevře se další nová možnost léčby a prevence aterotrombotických cévních komplikací i širší populaci osob s vysokým cévním rizikem. Jako vždy musíme mírnit optimizmus a vyčkávat výsledků klinických hodnocení, v centru naší pozornosti bude zejména dlouhodobá tolerance a účinnost těchto nových léčiv .
Podpořeno částečně grantem IGA MZ ČR 14186.
Doručeno do redakce: 9. 9. 2015
Přijato po recenzi: 18. 9. 2015
doc. MUDr. Michal Vrablík, Ph.D.
www.vfn.cz
michal.vrablik@lf1.cuni.cz
Sources
1. Catapano AL, Papadopoulos N. The safety of therapeutic monoclonal antibodies: Implications for cardiovascular disease and targeting the PCSK9 pathway. Atherosclerosis 2013; 228 : 18 – 28. doi: 10.1016/ j.atherosclerosis.2013.01.044.
2. Tamhane UU, Gurm HS. The chimeric monoclonal antibody abciximab: a systematic review of its safety in contemporary practice. Expert Opin Drug Saf 2008; 7 : 809 – 819. doi: 10.1517/ 14740330802500353.
3. Seidah NG. PCSK9 as a therapeutic target of dyslipidemia. Expert Opin Ther Targets 2009; 13 : 19 – 28. doi: 10.1517/ 14728220802600715.
4. Abifadel M, Varret M, Rabes JP et al. Mutations in PCSK9 cause autosomal dominant hypercholesterolemia. Nat Genet 2003; 34 : 154 – 156.
5. Zhao Z, Tuakli ‑ Wosornu Y, Lagace TA et al. Molecular characterization of loss ‑ of ‑ function mutations in PCSK9 and identification of a compound heterozygote. Am J Hum Genet 2006; 79 : 514 – 523.
6. Cohen JC, Boerwinkle E, Mosley Jr TH et al. Sequence variations in PCSK9, low LDL, and protection against coronary heart disease. N Engl J Med 2006; 354 : 1264 – 1272.
7. Cicero AFG, Colletti A, Borghi C. Profile of evolocumab and its potential in the treatment of hyperlipidemia. Drug Des Devel Ther 2015; 9 : 3073 – 3082. doi: 10.2147/ DDDT.S67498.
8. Stein EA, Wasserman SM, Dias C et al. AMG ‑ 145, Evolocumab. Drugs Fut 2013; 38 : 451 – 459.
9. Dias CS, Shaywitz AJ, Wasserman SM et al. Effects of AMG 145 on low ‑ density lipoprotein cholesterol levels: results from 2 randomized, double‑blind, placebo ‑ controlled, ascending‑dose phase 1 studies in healthy volunteers and hypercholesterolemic subjects on statins. J Am Coll Cardiol 2012; 60 : 1888 – 1898.
10. Cicero AF, Tartagni E, Ertek S. Efficacy and safety profile of evolocumab (AMG145), an injectable inhibitor of the proprotein convertase subtilisin/ kexin type 9: the available clinical evidence. Expert Opin Biol Ther 2014; 14 : 863 – 868. doi: 10.1517/ 14712598.2014.902929.
11. Koren MJ, Scott R, Kim JB et al. Effects of AMG145 on low ‑ monoclonal antibody to proprotein convertase subtilisin/ kexin type 9 as monotherapy in patients with hypercholesterolaemia (MENDEL): a randomised, double‑blind, placebo ‑ controlled, phase 2 study. Lancet 2012; 380 : 1995 – 2006.
12. Kohli P, Desai NR, Giugliano RP et al. Design and rationale of the LAPLACE ‑ TIMI 57 trial: a phase II, double‑blind, placebo ‑ controlled study of the efficacy and tolerability of a monoclonal antibody inhibitor of PCSK9 in subjects with hypercholesterolemia on background statin therapy. Clin Cardiol 2012; 35 : 385 – 391. doi: 10.1002/ clc.22014.
13. Raal F, Scott R, Somaratne R et al. Low ‑ density lipoprotein cholesterol ‑ lowering effects of AMG 145, a monoclonal antibody to proprotein convertase subtilisin/ kexin type 9 serine protease in patients with heterozygous familial hypercholesterolemia: the Reduction of LDL‑C with PCSK9 Inhibition in Heterozygous Familial Hypercholesterolemia Disorder (RUTHERFORD) randomized trial. Circulation 2012; 126 : 2408 – 2417. doi: 10.1161/ CIRCULATIONAHA.112.144055.
14. Raal FJ, Honarpour N, Blom DJ et al. The TESLA Investigators. Inhibition of PCSK9 with evolocumab in homozygous familial hypercholesterolemia (TESLA Part B): a randomised, double‑blind, placebo ‑ controlled trial. Lancet 2015; 385 : 341 – 350. doi: 10.1016/ S0140 ‑ 6736(14)61374 ‑ X.
15. Bruckert E, Bláha V, Stein E et al. Trial assessing long‑term use of PCSK9 inhibition in patients with genetic LDL disorders (TAUSsIG). Efficacy and safety in patients with familial hypercholesterolemia receiving lipid apheresis. Poster sessions, AHA Scientific Sessions, Chicago 2014.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2015 Issue 4-
All articles in this issue
- Myokarditidy a zánětlivé kardiomyopatie
- Obrovskobuněčná myokarditida a sarkoidóza srdce – update 2015
- Perikarditidy
- Vénové vaskulárne choroby – aktuálny naliehavý problém klinickej medicíny
- Diagnóza, klasifikácia a princípy manažmentu cerebrovaskulárnej aterosklerotickej choroby z hľadiska angiológie
- Evolocumab – protilátka proti PCSK9 s mohutným hypolipidemických účinkem
- Infekční endokarditida – diagnostika a doporučené postupy
- Srdeční vrozené vady v dospělosti
- Klinický přístup k pacientovi s aortální stenózou
- Indikace k intervenci a volba nejvhodnějšího postupu u mitrálních regurgitací
-
Vztah a klinický význam chronického onemocnění ledvin u pacientů s poruchami srdečního rytmu a/ nebo s implantabilními elektrickými přístroji
Zkrácená komentovaná verze oficiálního stanoviska Evropské společnosti pro srdeční rytmus -
Jak léčit dyslipidemii u pacientů s renální insuficiencí
Výběr z doporučení KDIGO s klinickým komentářem - Dávkování antibiotik u pacientů léčených hemoeliminačními metodami
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Perikarditidy
- Myokarditidy a zánětlivé kardiomyopatie
- Srdeční vrozené vady v dospělosti
- Infekční endokarditida – diagnostika a doporučené postupy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

