-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Retroperitoneální fibróza – diagnostika a léčba
Retroperitoneal fibrosis – diagnosis and treatment
Idiopathic retroperitoneal fibrosis (IRF) is a rare condition characterized by the development of a peri-aortic and peri-iliac tissue showing chronic inflammatory infiltrates and pronounced fibrosis. Ureteral entrapment with consequent obstructive uropathy is one of the most common complications which can lead to acute renal failure and, in the long term, to varying degrees of chronic kidney disease. Common symptoms at onset include lower back, abdominal or flank pain. Pain is frequently referred to the hip, to the groin and to the lateral regions of the leg, often with nocturnal exacerbations and not responding to position changes. The disease is commonly associated with signs of systemic inflammatory response (malaise, fever, and anorexia and weight loss). Glucocorticoids are considered the cornerstone of the therapy. The use of other immunosuppressive agents, including cyclophosphamide, azathioprine, methotrexate, mycophenolate mofetil and biological agents such as rituximab, tocilizumab and infliximab have been reported as a valuable option mostly in case reports, cases series and small studies. These agents allowed to reduce cumulative dose of glucocorticoids and their adverse effects. Combined therapy is preferable for all patients who suffer from significant glucocorticoid - related toxicity or in cases where glucocorticoids alone are insufficient to treat the condition.
Keywords:
Cyclophosphamide – rituximab – retroperitoneal fibrosis – IgG4 related disease
Autoři: Z. Adam 1; A. Čermák 2; Z. Adamová 3; Z. Řehák 4; R. Koukalová 4; L. Pour 1
Působiště autorů: Interní hematologická a onkologická klinika, Lékařská fakulta Masarykovy univerzity a Fakultní nemocnice Brno 1; Urologická klinika Masarykovy univerzity a Fakultní nemocnice Brno 2; Chirurgické oddělení Nemocnice ve Frýdku-Místku, chirurgické oddělení, Vsetínská nemocnice 3; Oddělení nukleární medicíny, Masarykův onkologický ústav Brno 4
Vyšlo v časopise: Rozhl. Chir., 2022, roč. 101, č. 6, s. 265-272.
Kategorie: Souhrnné sdělení
doi: https://doi.org/10.33699/PIS.2022.101.6.265–271Souhrn
Idiopatická retroperitoneální fibróza je vzácné onemocnění charakterizované rozvojem fibroinflamatorních infiltrátů v periaortální a periiliakální oblasti s výraznou fibrózou. Zavzetí ureteru do těchto fibrózních hmot způsobuje poruchu drenáže ledviny s rozvojem obstruktivní uropatie a renálního selhání. Častým příznakem této nemoci jsou bolesti v bederní oblasti, břišní bolesti. Bolesti jsou často pociťovány v oblasti třísla a mohou vyzařovat do laterální strany stehna, často se zhoršují v noci a nejsou ovlivnitelné změnou polohy. Chorobu často provázejí projevy systémové zánětlivé odpovědi (patologická únava, horečka, anorexie a úbytek hmotnosti). Základem léčby retroperitoneální fibrózy jsou glukokortikoidy. Onemocnění je ale také léčitelné imunosupresivy (cyklofosfamid, azathioprin, metotrexát, mycofenolát mofetil) a biologickou léčbou (rituximab, tocilizumab a infliximab). Účinek těchto léků byl popsán formou popisů případů či malých souborů pacientů. Umožní snížit kumulativní dávku glukokortikoidů a jejich nežádoucí účinky. Kombinovaná léčba je vhodná pro všechny pacienty, u nichž je léčba glukokortikoidy spojena s intenzivními nežádoucími účinky anebo když samotná glukokortikoidní léčba nevede k ústupu nemoci.
Klíčová slova:
rituximab – cyklofosfamid – retroperitoneální fibróza – IgG4 related disease
ÚVOD
Bolesti v bederní krajině mají poměrně širokou paletu příčin, od nejčastějších deformativních změn přes ankylozující spondylartritidu, bolesti způsobené destrukcí obratlů mnohočetným myelomem až po bolesti, které jsou způsobeny patologickými procesy v pánvi. Jednou z příčin bolesti v bederní oblasti je také retroperitoneální fibróza. Tato poměrně vzácná diagnóza přivádí pacienty k lékaři často s bolestmi v průběhu ureteru, které se promítají jak do lumbální krajiny, tak do levého či pravého hypogastria, mohou vyzařovat do oblasti třísla a u mužů i do varlete. Na cílené otázky pacient obvykle odpoví, že bolest má intermitentní až kolikovitý charakter, takže často vznikne podezření na litiázu v ureteru.
Idiopatická retroperitoneální fibróza byla popsána již dávno, v roce 1948, ale teprve od roku 2012 víme, že může být asociována s „ IgG4-related disease“, takže v roce 2022 mluvíme o retroperitoneální fibróze asociované s „IgG4-related disease“ či bez průkazu této asociace. Nemoc se může projevit dalšími příznaky: systémovými zánětlivými projevy, hydronefrózou, renální insuficiencí, případně nově diagnostikovanou hypertenzí či zhoršením již stávající hypertenze. I když nemoc diagnostikují a léčí urologové, tak kroky těchto pacientů často vedou nejdříve k chirurgovi či praktickému lékaři. Tito lékaři však pouze vyslovují podezření a musejí poslat pacienta na urologii k další diagnostice a léčbě [1–7]. K urologům přivádí nemocné důsledek retroperitoneální fibrózy, hydronefróza.
Definice nemoci a její incidence
Retroperitoneální fibróza je termín používaný pro nález fibrotických retroperitoneálních infiltrátů, které často způsobují obstrukci ureteru. Název má tato choroba po urologovi, který ji popsal již v roce 1948, Ormondova choroba [8]. Onemocnění a chirurgické řešení poprvé popsal francouzský urolog Albarran v roce 1905. V roce 1948 publikoval Ormond nálezy u dvou pacientů a přinesl podklady k vyčlenění retroperitoneální fibrózy jako samostatné klinické jednotky, i když na dlouhou dobu bez znalosti skutečné etologie. Retroperitoneální fibróza, která je charakterizována zánětlivou proliferací pojivové tkáně, vede k dislokaci a útlaku ureterů v oblasti L4-S1 a k hydronefróze. K urologovi je pacient odeslán k vyšetření a provedení diferenciální diagnostiky, vyloučení obstrukce litiázou nebo nádorovým onemocněním. Hydronefróza může být asymptomatická, zjištěná jako náhodný nález při jiném vyšetření. Vzhledem k nevýrazným počátečním potížím je onemocnění diagnostikováno pozdě a manifestuje se až komplikacemi vzniklými na podkladě komprese vývodných cest močových. Diagnostikován může být různý stupeň ledvinové nedostatečnosti. Až třetina pacientů přichází s afunkční ledvinou a 10 % v uremii při bilaterální hydronefróze. Někdy se prezentuje jako pyelonefritida, až sepse v důsledku obstrukční uropatie.
Retroperitoneální fibróza se dříve členila na idiopatickou formu, která činila více než 75 % všech případů, a na sekundární, u níž se předpokládaly určité vyvolávající příčiny (maligní procesy v pánvi, radioterapie na tuto oblast, operace v této oblasti apod.). Hledána byla souvislost s léky a bylo vzneseno podezření, že některé léky mohou přispívat k jejímu vzniku. Tyto zprávy mají původ v observačních studiích. V případě lékových souvislostí není zcela jasné, zda šlo o časovou koincidenci nebo příčinnou souvislost. Nejvíce suspektní se z tohoto hlediska jevily léky odvozené od ergotaminu [9,10].
Po roce 2012, kdy byla nově definována jednotka „IgG - 4-related disease“, se idiopatická retroperitoneální fibróza rozčlenila na retroperitoneální fibrózu s průkazem „IgG - 4-related disease“ a idiopatickou retroperitoneální fibrózu bez průkazu „IgG4 related disease“. Toto dělení však nemá zásadní terapeutické důsledky. Retroperitoneální fibróza je vzácné onemocnění, její incidence není v ČR zmapována. Zahraniční prameny uvádějí incidenci 0,1–1,3 případu/100 000 osob. Poměr mužů a žen je 2 : 1 až 3 : 1. Nemoc je nejčastěji diagnostikována ve věku 55–60 let [11,12].
Klinické příznaky a laboratorní nálezy
Systémové příznaky a bolesti
Systémové zánětlivé projevy (patologická únava, nechuť k jídlu, úbytek hmotnosti a případně subfebrilie) mohou ohlašovat počátek onemocnění.
Pravidelně je tato nemoc provázena bolestí v bederní oblasti, případně bolestí břicha, kterou pacienti často lokalizují do průběhu ureteru neboli do levého či pravého hypogastria. Někdy je bolest pociťována i v třísle. A občas také pacienti udávají bolesti v bederní oblasti, takže může dojít i mylné interpretaci, že to jsou bolesti způsobené deformativními změnami páteře [11,12]. Bolesti jsou obvykle tupé, nejsou ovlivnitelné změnou polohy, často jsou intenzivněji pociťované v noci a zmenšují se při používání nesteroidních antiflogistik. Postižení ureteru může občas imitovat koliku. Onemocnění může mít vliv na peristaltiku, takže obstipace je někdy dalším symptomem, popisovaným pacienty. Obstipace však obvykle nebývá závažná [4–7].
Urologické příznaky
K urologům přivádějí nemocné důsledky retroperitoneální fibrózy, hydronefróza buďto asymptomatická, nebo s různě vyjádřenými příznaky obstrukce vývodných cest močových a poškození ledvinných funkcí, případně zánětlivá komplikace.
Mimo již výše zmíněné kolikovité bolesti patří k dalším urologickým příznakům bolesti varlete, hydrokéla, případně varikokéla. Varikokéla je důsledkem komprese spermatické žíly retroperitoneální fibrózou. (Pozor, varikokéla může být také příznakem karcinomu ledviny, pokud při tomto tumoru vznikne trombóza ledvinné žíly, která může přestoupit i na spermatickou žílu, ústící do ledvinné žíly!).
Při retroperitoneální fibróze mohou být postižena i nervová vlákna, a tak dalším problémem bývá erektilní dysfunkce. Vzácnějšími příznaky jsou hematurie a dysurie [13–15].
Nejčastější závažnou komplikací retroperitoneální fibrózy je komprese ureteru v oblasti pánve, a to buď jednostranná, nebo oboustranná. To závisí na rozsahu retroperitoneální fibrózy. Pokud je tento proces limitovaný na periaortální oblast, tak ke kompresi ureteru nemusí dojít, pokud proces postihuje oblast periiliakální, tak ke kompresi ureteru dochází. Někdy může postižení dalšího ureteru následovat roky od počátku nemoci.
Zajímavým nálezem při stanovení diagnózy je hypoplazie ledviny či její atrofie (průměr <8,5 cm). Tento jev italští urologové popsali u 8–30 % pacientů [16,17]. Příčina hypoplazie ledviny u pacientů s retroperitoneální fibrózou není objasněna. Zvažuje se ovlivnění renální arterie chorobou v době před stanovením diagnózy. V některých případech retroperitoneální fibróza postihla i cévní zásobení ledvin, což způsobilo renovaskulární hypertenzi [16,17].
Nově diagnostikovaná hypertenze či zhoršení kompenzace již stávající hypertenze jsou pozorovány až u jedné třetiny pacientů [4–7,13–17].
Cévní příznaky a komplikace
Pokud výjimečně při retroperitoneální fibróze dojde i k postižení cév a ke tvorbě aneurysmat v predilekčních oblastech, tedy v oblasti břišní aorty a ilických arterií, je třeba tato aneurysmata sledovat a případně léčebně zasáhnout, a to buď chirurgicky, nebo endovaskulárně [16,17].
Častější než arteriální komplikace jsou komplikace žilní, nejčastěji komprese dolní duté žíly, což vede k otokům dolních končetin. Může však dojít i k narušení lymfatického toku, takže otoky mají pak smíšenou příčinu žilní i lymfatickou. Nicméně zřejmě díky pomalému rozvoji komprese dolní duté žíly se často stihnou včas vytvořit kolaterály. Takže zde obvykle nedochází k trombózám a plicním emboliím [16,17].
Cévní komplikace nemusejí být vždy vázané na oblast dolní části aorty a ilických tepen, ale proces může mít i ascendentní průběh a dosahovat k odstupům mezenterických cév a truncus celiacus, způsobit stenózu a ischemické komplikace.
Méně než jedna třetina pacientů s abdominální formou retroperitoneální fibrózy má také aneurysmatické postižení hrudní aorty [16,17]. Klinické příznaky sumarizuje Tab. 1. Pokud nemoc není včas léčena, tak může být dokonce příčinou ileózního stavu [18].
Tab. 1. Klinické projevy nemoci
Tab. 1: Clinical manifestations of the disease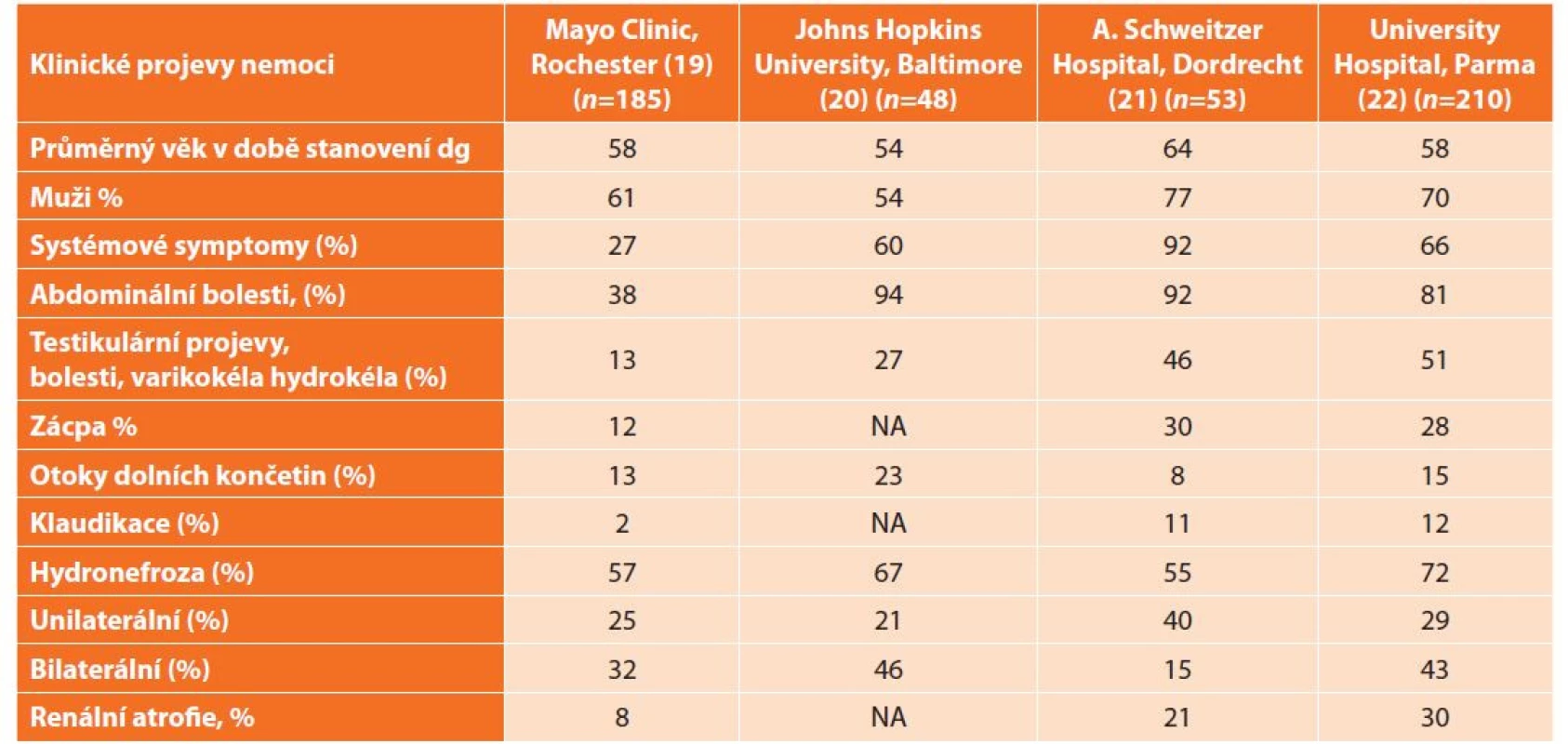
Vysvětlivka: NA = není analyzováno Laboratorní nálezy
Sedimentace erytrocytů (a hodnota CRP) je zvýšená u většiny pacientů, takže tyto parametry je možné použít pro sledování nemocných, pokud byly před léčbou patologické. Vysoké hodnoty jsou provázeny intenzivními systémovými příznaky. Problém je, že vývoj těchto parametrů nekoreluje s vývojem fibrotického ložiska. Ani k časné detekci relapsu nelze tyto laboratorní parametry použít. Mnozí pacienti splní morfologickou diagnózu „IgG4-related disease“ a mohou mít i vysoké hodnoty IgG4 v séru, normální hodnoty však tuto diagnózu nevylučují. Laboratorní nálezy jsou shrnuty v Tab. 2. Pacienti s idiopatickou retroperitoneální fibrózou mají často patologické hodnoty antinukleárních protilátek, protilátek proti štítné žláze, pozitivní průkaz revmatoidního faktoru [16,17].
Tab. 2. Laboratorní projevy nemoci
Tab. 2: Laboratory manifestations of the disease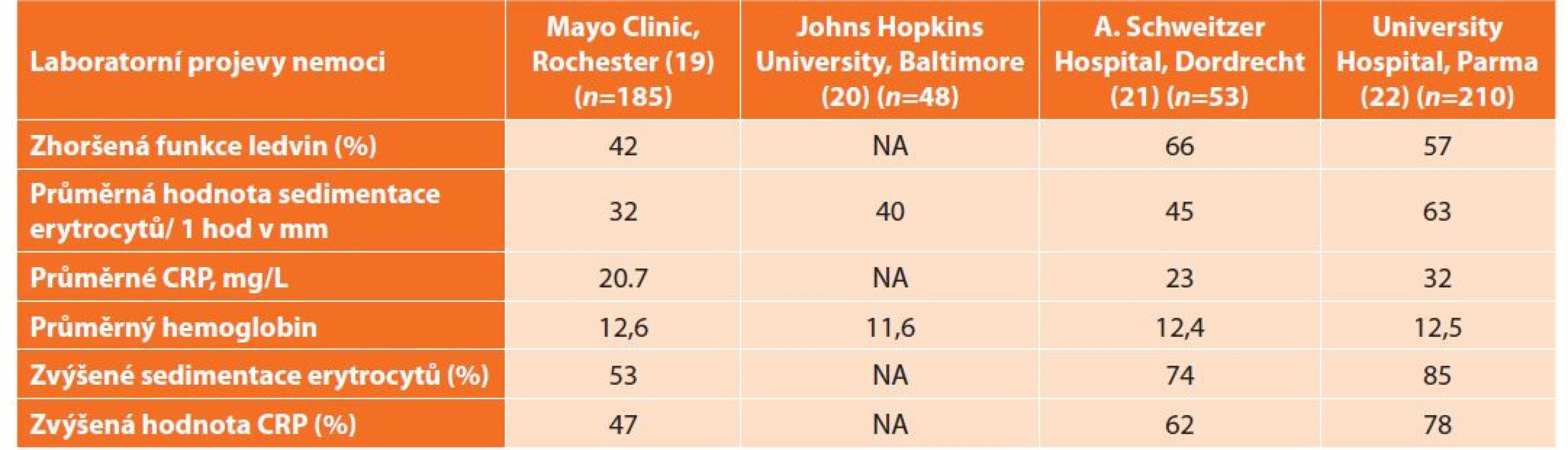
Vysvětlivka: NA = není analyzováno Patofyziologie nemoci
Termín retroperitoneální fibróza je používán již od roku 1948 [8], ale neodpovídá přesně topografii této nemoci. Nemoc v podstatě postihuje adventicii abdominální aorty a ilických arterií a přechází na okolní retroperitoneum. Takže nejde o postižení retroperitonea v celém rozsahu [23]. Histologické vyšetření odebraného vzorku tkáně odpovídá kombinaci chronického zánětu s fibrotizací. Někdy může proces přecházet dokonce i na hrudní aortu. Proto byl také použit termín chronická periaortitida, která může zahrnovat i zánětlivá aneurysmata abdominální aorty a perianeurysmatickou fibrózu. Zánětlivé infiltráty obsahují četné lymfocyty, plazmatické buňky a makrofágy. Pokud poměr IgG4+/IgG+ je >40 %, je splněno kritérium „IgG4-related disease“, v opačném případě jde o idiopatickou retroperitoneální fibrózu. Augusto Vaglio a další italští autoři [16,17] uvádějí, že kolem 50 % případů retroperitoneální fibrózy má prokazatelné znaky „IgG4-related disease“, podobné závěry mají i práce z dalších center [24,25].
Před definováním nemoci zvané „IgG4-related disease“ byla retroperitoneální fibróza řazena do skupiny chorob, kterou v ČR v roce 1999 Kučera a Kratochvíl popsali a nazvali „lokalizované fibrotické procesy“ [26,27].
Příčinou jak idiopatické retroperitoneální fibrózy, tak s „IgG4-related disease“ asociované retroperitoneální fibrózy je patologická imunitní reakce. Poměrně jasný důkaz pro tuto etiologii v souvislosti s genem HLADRB1-03 byl zveřejněn v roce 2018, i když autoimunitní etiologie byla zvažována již dříve [28,29]. Je totiž již dlouho známo, že u pacientů s retroperitoneální fibrózou jsou podstatně častěji diagnostikovány další autoimunitní choroby než u stejně staré průměrné populace. Kolik z těchto dříve popsaných asociací by bylo dnes možno interpretovat jako projevy „IgG4-related disease“, není jasné. Nejčastější byly autoimunitní choroby štítné žlázy, dále pak revmatoidní artritida, ankylozující spondylartritida a discitida, ANCA asociované vaskulitidy, systémový lupus erythematodes, psoriáza a různé typy glomerulonefritid [30,31]. Rozlišení, zda proces souvisí či nesouvisí s „IgG4-related disease“, je velmi obtížné a do jisté míry je to proces arbitrární, závisející na počtu IgG4+ plazmocytů v ložisku [32,33].
Histopatologii této choroby se podrobně zabývají články psané našimi předními patology [34,35,36].
Stanovení diagnózy
Zobrazovací metody a biopsie
Idiopatická retroperitoneální fibróza je nejčastěji diagnostikována pomocí CT či magnetické rezonance. Metodou CT se zobrazí jako homogenní plaky na anterolaterální straně aorty, které případně zasahují na ilické arterie. Popisuje se mediální deviace ureteru a/ nebo komprese či obstrukce dolní duté žíly. Tyto masy mají stejnou denzitu jako svaly a různý enhancement po podání kontrastu. Při zobrazení magnetickou rezonancí mají také specifický obrat [37].
Retroperitoneální fibróza poměrně intenzivně vychytává fluorodeoxyglukózu [FDG], a proto FDG-PET/CT je pro tuto diagnózu velmi užitečné vyšetření. Umí detekovat reziduální aktivitu po ukončení léčby, a tak včas informovat o počínajícím relapsu nemoci. A mimoto může FDG-PET/CT detekovat další patologie asociované s touto nemocí [38].
Zobrazovací vyšetření však pouze vznesou podezření na toto onemocnění, pro definitivní diagnostiku je však vždy nutná histologie podezřelé tkáně.
Diferenciální diagnóza
Ve stejné lokalizaci se mohou nacházet maligní choroby s podobným zobrazovacím nálezem (retroperitoneální lymfomy, metastázy různých karcinomů a případně sarkomy). Také v případech karcinoidu se popisuje souvislost s retroperitoneální fibrózou. Podobný CT obraz mohou způsobit také pánevní tuberkulóza či aktinomykóza [16,17].
Retroperitoneální fibrózu také způsobuje Erdheimova - Chesterova choroba, při ní ale fibróza predilekčně postihuje perirenální prostory. Také obrovská buněčná arteritis (Takayasu arteritis) může způsobit difuzní zesílení stěny aorty, a tak imitovat retroperitoneální fibrózu, ale ta nepostihuje okolí tepen a nepostihuje uretery [16,17,39,40].
Léčba
Léčba retroperitoneální fibrózy se postupně vyvíjí [41,42]. Urologická léčba má za cíl obnovit drenáž ledviny a odstranit obstrukci ureteru. Pokud lze, používají urologové JJ stent. V případech, kdy stentem nelze vyřešit drenáž ledviny, je nutná nefrostomie [4–7,17,18]. Tento přehled je zaměřen na medikamentózní léčbu, proto vývoj urologických léčebných postupů zde není rozveden.
Medikamentózní léčbu můžeme rozdělit do tří kategorií:
• léčba glukokortikoidy v monoterapii,
• léčba glukokortikoidy v kombinaci s imunosupresivy,
• léčba glukokortikoidy v kombinaci s anti CD20 protilátkou,
• léčba dalšími biologickými léky.
Glukokortikoidy
Glukokortikoidy v monoterapii byly dlouho léčbou volby a stále jsou. Názory na dávky glukokortikoidů se pochopitelně různí. Obvykle se používal prednison v iniciální dávce 0,6–1,0 mg/kg/den a tato dávka byla jen velmi pomalu snižována s cílem dostat se na dávku 5–7,5 mg/den, dle jiných autorů 2,5–5 mg až po 6–9 měsících velmi pozvolného snižování dávky. Iniciální dávka prednisonu 0,6–1,0 mg/kg/den se obvykle podává 2–4 týdny a snižuje se o 5 mg každé 1–2 týdny až na udržovací dávku (2,5–5 mg/den), která se podává po dobu 2–3 měsíců [43].
Jiné léčebné schéma doporučuje iniciální dávku prednisonu 1 mg/kg/den po dobu 1 měsíce a v případě léčebné odpovědi s následným postupným snižováním v druhém až čtvrtém měsíci na cílovou dávku 10 mg/den ve čtvrtém měsíci léčby. A tato dávka je pak v dalších 6 měsících postupně snižována do vysazení [17,18]. Pokud se podařilo tuto léčbu realizovat bez redukce dávek, tak počet léčebných odpovědí se uváděl mezi 75 % až 95 %. Léčebná odpověď byla definována jako zmenšení průměru patologické masy o 50 % a zlepšení laboratorních ukazatelů, pokud byly patologické [17,18]. Pokud je léčebná odpověď dostatečná a fibrotické masy ustoupí natolik, že vymizí komprese ureteru, pak je možno pokusit se odstranit stent, pokud byl zaveden [43,44].
Monoterapie prednisonem, zvláště pokud je dlouhodobá, je spojena s četnými nežádoucími účinky (infekce, žaludeční vředy, psychické poruchy, atrofie kůže, vznik diabetu mellitu či zhoršení již stávajícího diabetu mellitu). A dalším problémem jsou časté relapsy po přerušení léčby prednisonem. A proto byly hledány léčebné postupy, které umožnily snížit dávky glukokortikoidů či zkrátit interval jejich podávání. Prvním z testovaných léků byl tamoxifen.
Tamoxifen
Antiestrogen tamoxifen má mít mimo jiné také antifibroproliferativní aktivitu, a tak se jeho použití zvažovalo jako alternativa glukokortikoidů či jejich doplněk. V monoterapii byl léčebný efekt popsán u 65 % pacientů. Léčba tamoxifenem v monoterapii či v kombinaci s prednisonem byla použita v několika starších studiích [45,46]. Srovnání prednisonu a tamoxifenu v rámci udržovací léčby bylo provedeno pouze v jedné studii a zde se však léčba tamoxifenem ukázala méně účinnou než udržovací léčba prednisonem [47]. A proto tamoxifen již není tak často používán, jeho použití je doporučováno v případně kontraindikace glukokortikoidů. Kombinace tamoxifenu s prednisonem se používala v případech špatné tolerance monoterapie glukokortikoidy. V posledních letech se upřednostňují raději kombinace prednisonu s léky ze skupiny imunosupresiv.
Klasická imunosupresiva
Pro léčbu idiopatické retroperitoneální fibrózy jsou používána stejná imunosupresiva, jaká jsou používána v kombinacích při léčbě „IgG4-related disease“.
Metotrexát byl použit v kombinaci s glukokortikoidy v podobném schématu jako u revmatických chorob: 15–20 mg 1 týdně po dobu 12 měsíců. Po 12 měsících bylo na ošetřujícím lékaři, zda podávání metotrexátu ukončil či v něm pokračoval [48–50].
U pacientů s retroperitoneální fibrózou spojenou s periaortitidou potencoval účinek glukokortikoidů velmi účinně také cyklofosfamid [51–54].
Z našich autorů popsal Průcha příznivý účinek azathioprinu [55]. A také mykofenolát mofetil v kombinaci s prednisonem byl u této diagnózy s úspěchem použit [56–63]. Léčebný efekt měl i cyklosporin, i když o cyklosporinu je méně publikací než o mykofenolát mofetilu [64,65].
Z přehledu popisů případů či malých souborů pacientů vyplývá, že uvedené léky (metotrexát, cyklofosfamid, azathioprin mykofenolát mofetil a cyklosporin) potencují účinek prednisonu, což umožňuje jeho redukci a zkrácení doby podávání. Kombinace s uvedenými léky lze tedy doporučit pro běžnou léčbu. Žádná studie však neřešila, který z citovaných léků považovat do kombinace za nejvhodnější. Pouze jedna studie hodnotila soubor 26 pacientů, z nichž 15 bylo léčeno azathioprinem a prednisonem, zatímco ostatní byli léčeni cyklofosfamidem. Azathioprin (2,5 mg/kg/den) byl podáván 6 měsíců a pak redukován na 1,5 mg/kg/ den a ponechán po dalších 6 měsíců. Cyklofosfamid byl podáván buď perorálně v dávce 2 mg/kg/den po dobu tří měsíců a pak snižován a vysazen po 6 měsících léčby, anebo byl podáván v měsíčních pulzech 1000 mg/ m2 po dobu 6 měsíců. Šlo o retrospektivní studii, která neumožnila přímé srovnání. Autoři této studie uzavírají: „kombinace prednisonu s imunosupresivy dosahuje vysoké počty léčebných odpovědí a umožňuje redukovat dávky prednisonu a tím i jeho toxicitu“ [66].
Náš názor je, aby lékař zvolil do kombinace ten lék, s jehož podáváním má dostatečnou praxi a umí včas odhalit jeho nežádoucí účinky, protože i s léky je třeba mít zkušenost.
Anti CD20 monoklonální protilátka – rituximab
Idiopatická retroperitoneální fibróza je autoimunitní choroba a v její patogenezi hrají důležitou roli B-lymfocyty. A proto se v posledních letech dostává do popředí léčba rituximabem. Tento lék cíleně ničí B-lymfocyty, které se podílejí tvorbou cytokinů na rozvoji fibroinflamatorního procesu. Rituximab sice obecně tlumí B-buněčnou imunitu podobně jako glukokortikoidy, ale jinak má podstatně méně nežádoucích účinků (užší spektrum působení) než glukokortikoidy. První publikace popisující příznivý účinek rituximabu u pacienta s chronickou periaortitidou a retroperitoneální fibrózou se objevila nedávno, v roce 2012 [67].
A pak se začaly objevovat další publikace potvrzující léčebný přínos rituximabu u pacientů s touto diagnózou [68–71].
Od roku 2018 se objevují klinické studie testující rituximab u retroperitoneální fibrózy. První a zatím největší studie byla provedena a publikována autory z Bostonu. Do studie bylo zařazeno 26 pacientů s retroperitoneální fibrózou. Z těchto 26 pacientů bylo 19 hodnoceno jako retroperitoneální fibróza související s „IgG4-related disease“, a 7 pacientů bylo hodnoceno jako idiopatická retroperitoneální fibróza neboli nebyla prokázána souvislost s dalším onemocněním či noxou. Všichni pacienti byli léčeni rituximabem. Celkem 19 (73 %) dostávalo rituximab v monoterapii a zbytek v kombinaci s glukokortikoidy. Rituximab byl podáván v celkové dávce 1000 mg ve 14denních intervalech, minimálně 2× po sobě vždy s premedikací obsahující metylprednisolon 100 mg, antihistaminika a acetaminofen (650 mg). Všech 19 pacientů, kteří měli rituximab v monoterapii, si před léčbou stěžovalo na bolesti a tyto bolesti po léčbě pominuly. U 25 léčených bylo provedeno opakované radiografické vyhodnocení, u 22 (88 %) došlo k radiografickému zlepšení, zmenšení infiltrátu Z deseti pacientů, kteří měli zavedený stent do ureteru a/nebo perkutánní nefrostomii, se podařilo u 4 (40 %) odstranit stent či katétr. Léčebné odpovědi byly u pacientů s rituximabem a glukokortikoidy podobné jako u pacientů s rituximabem v monoterapii, Tato studie potvrdila účinek rituximabu u pacientů s retroperitoneální fibrózou i v monoterapii [72].
Druhou studii hodnotící přínos rituximabu publikovala Veronika Boyeva, et al. z Kanady. U všech deseti pacientů byl potvrzen zobrazovacími vyšetřeními ústup této nepříjemné choroby [73]. Autoři této studie však upozorňují na otázky, které stále čekají za zodpovězení. Zatím není jasné, jak dlouho léčebná odpověď navozená rituximabem vydrží. Není jasné, zda dopředu plánovat nějakou formu udržovací léčby. Předejít recidivám je důležité, protože nemocné ohrožují anurií a následným chronickým renálním selháním s nutností dialýzy [73].
Třetí studie, která byla do konce roku 2021 publikována, je z Florencie. Do této studie bylo zařazeno 20 nemocných s idiopatickou retroperitoneální fibrózou bez průkazu souvislosti s „IgG4-related disease“. Opět prokázali velmi dobrou toleranci rituximabu a vysoký počet léčebných odpovědí [74].
Z těchto publikací vyplývá, že rituximab je pro nemocné s idiopatickou retroperitoneální fibrózou velkým přínosem. Umožňuje snížit dávky glukokortikoidů a délku jejich podávání, a tak omezit rozvoj jejich nežádoucích účinků.
Tocilizumab a infliximab
V procesu vzniku retroperitoneální fibrózy má důležitou úlohu interleukin-6. Proto byla u rezistentních případů testována léčba tocilizumabem. V roce 2021 jsou k dispozici 4 publikace, jež popisují její léčebný efekt [75–78].
Přínos infliximabu byl zatím popsán pouze v jedné studii v roce 2012 [79], siltuximab v této indikaci čeká na vyzkoušení.
ZÁVĚR
Léčba retroperitoneální fibrózy obvykle vyžaduje instrumentální urologickou léčbu a léčbu medikamentózní. Prednison byl a stále zůstává základem této léčby. Dlouhodobé podávání prednisonu je však spojeno s četnými závažnými komplikacemi. Proto uvádíme přehled léčebných postupů, v nichž přidání léku ze skupiny imunosupresiv a/nebo rituximabu umožní snížit kumulativní dávku glukokortikoidů, tím snížit i intenzitu nežádoucích účinků glukokortikoidů a dosáhnout dobré léčebné odpovědi.
Italští autoři ve svém recentním přehledu uvádějí, že počet relapsů dle jejich zkušeností dosahuje až 72 %. Je tedy nutné pečlivé sledování, případně naplánování udržovací léčby. Nemoc je sice často provázena elevací zánětlivých markerů, ty však přesně neodrážejí rozvoj fibrotických hmot v retroperitoneu. Základem pro sledování a včasné započetí léčby recidivy jsou zobrazovací metody. Dříve to bylo klasické CT anebo MR zobrazení, dnes je to hlavně kombinované zobrazení FDG-PET/CT nebo FDG-PET/MR [80––83].
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
MUDr. Zuzana Adamová
Chirurgické oddělení Nemocnice ve Frýdku-Místku
e-mail: adamova@nemfm.cz
ORCID: 0000-0002-0799-1885
Zdroje
1. Průcha M, Beňo P, Bartůněk M, et al. Idiopatická retroperitoneální fibróza – Ormondova choroba: kazuistika. Vnitřní lékařství 2008;54(3):282–286.
2. Němec P, Rybníčková S, Fabián P, et al. Idiopathic retroperitoneal fibrosis: an unusual cause of low back pain. Clinical rheumatology 2008;27(3):381–384.
3. Němec P, Rybníčková S, Fabian P, et al. Idiopatická retroperitoneální fibróza: Méně častá příčina bolestí dolní části zad. Použití tamoxifenu v terapii onemocnění. Česká revmatologie 2008;16(1):23–29.
4. Fedorko M, Krhovský M. Perirenální retroperitoneální fibróza. Urologie pro praxi 2009;10(5):299–301.
5. Kašík J, Kolombo I, Porš J, et al. Primární retroperitoneální fibróza – morbus Ormond. Urologie pro praxi 2008;9 (3):128 – 132.
6. Sobotka R, Hanuš T. Primární retroperitoneální fibróza, Urologie pro praxi 2006;7(4):156–159.
7. Pulcer J, Staněk R, Kokoř T, et al. Fokální Ormondova choroba (idiopatická retroperitoneální fibróza). Urologie pro praxi 2015;16(Suppl. A).
8. Ormond JK. Bilateral ureteral obstruction due to envelopment and compression by an inflammatory retroperitoneal process. J Urol. 1948;59 : 1072–107.
9. Kharagjitsing H, van Eekeren R, van Puijenbroek EP, et al. Retroperitoneal fibrosis and β-blocking agents: Is there an association? Br J Clin Pharmacol. 2021;87(7):2891–2901. doi:10.1111/bcp. 14702.
10. Brasselet D, Chouchana L, Vial T, et al. Drug-induced retroperitoneal fibrosis: a case/non-case study in the French Pharmaco Vigilance Database. Expert Opin Drug Saf. 2020;19(7):903–914. doi:1 0.1080/14740338.2020.1766022.
11. van Bommel EF, Jansen I, Hendriksz TR, et al. Idiopathic retroperitoneal fibrosis: prospective evaluation of incidence and clinicoradiologic presentation. Medicine (Baltimore) 2009;88 : 93–201. doi:10.1097/ MD.0b013e3181afc420.
12. Mizushima I, Kawano M. Renal involvement in retroperitoneal fibrosis: Prevalence, impact and management challenges. Int J Nephrol Renovasc Dis. 2021;14 : 279–289. doi:10.2147/IJNRD. S239160.
13. Švihra J, Študent V. Retroperitoneálna fibróza. Urologie pro praxi 2016;17(1):14 – 16.
14. Průcha M, Kolombo I, Štádler P. Ormond‘ s disease – IgG4-related disease. Prague Medical Report 2015;116 (3):181 – 192. doi:10.14712/23362936.2015.57.
15. Posová H. Ormondova nemoc: Imunopatologické stavy v kazuistikách. Mladá fronta, 2016.2016 : 159–163.
16. Raglianti V, Rossi GM, Vaglio A. Idiopathic retroperitoneal fibrosis: an update for nephrologists. Nephrol Dial Transplant. 2021;36(10):1773–1781. doi:10.1093/ndt/ gfaa083.
17. Fenaroli P, Maritati F, Vaglio A. Into clinical practice: Diagnosis and therapy of retroperitoneal fibrosis. Curr Rheumatol Rep. 2021;23(3):18. doi:10.1007/s11926-020 - 00966-9.
18. Kolář J, Pavrovský J, Balaš V, et al. Ileus jako první projev retroperitoneální fibrózy. Rozhledy v chirurgii. 1972;51(6):341–344.
19. Kermani TA, Crowson CS, Achenbach SJ. Idiopathic retroperitoneal fibrosis: a retrospective review of clinical presentation, treatment, and outcomes. Mayo Clin Proc. 2011;86 : 297–303. doi:10.4065/ mcp.2010.0663.
20. Scheel PJ Jr, Feeley N. Retroperitoneal fibrosis: the clinical, laboratory, and radiographic presentation. Medicine (Baltimore) 2009;88 : 202–207. doi:10.1016/j. rdc.2013.02.004
21. Cronin CG, Lohan DG, Blake MA, et al. Retroperitoneal fibrosis: a review of clinical features and imaging findings. AJR Am J Roentgenol. 2008;191 : 423–431. doi:10.2214/AJR.07.3629
22. Vaglio A, Maritati F. Idiopathic Retroperitoneal Fibrosis. JASN 2016;27(7):1880 – 1889. doi:10.1681/ASN.2015101110.
23. Marvisi C, Accorsi Buttini E, Vaglio A. Aortitis and periaortitis: The puzzling spectrum of inflammatory aortic diseases. Presse Med. 2020;49(1):104018. doi:10.1016/j.lpm.2020.104018.
24. Nikiphorou E, Galloway J, Fragoulis GE. Overview of IgG4-related aortitis and periaortitis. A decade since their first description. Autoimmun Rev. 2020;19(12):102694. doi:10.1016/j.autrev. 2020.102694.
25. Palmisano A, Urban ML, Corradi D. Chronic periaortitis with thoracic aorta and epiaortic artery involvement: a systemic large vessel vasculitis? Rheumatology (Oxford) 2015;54 : 2004–2009. doi:10.1093/rheumatology/kev225.
26. Kučera M. Lokalizované fibrotické procesy. Referátový výběr z revmatologie 1999;39:(1):36–40.
27. Kučera M, Kratochvíl P. Lokalizované fibrotické procesy (onemocnění) léčebné možnosti. Referátový výběr z revmatologie 2000;40(4):273–277.
28. Martorana D, Marquez A, Carmona FD, et al. A large-scale genetic analysis reveals an autoimmune origin of idiopathic retroperitoneal fibrosis. J Allergy Clin Immunol. 2018;142(5):1662–1665. doi:10.1016/j.jaci.2018.06.045.
29. Clevenger JA, Wang M, MacLennan GT, et al. Evidence for clonal fibroblast proliferation and autoimmune process in idiopathic retroperitoneal fibrosis. Hum Pathol. 2012;43 : 1875–1880. doi: 10.1016/j.humpath.2012.01.012.
30. Peisen F, Thaiss WM, Ekert K, et al. Retroperitoneal fibrosis and its differential diagnoses: The role of radiological imaging. Rofo 2020;192(10):929–936. doi:10.1055/a-1181-9205.
31. Kawano M, Saeki T, Nakashima H. IgG4-related kidney disease and retroperitoneal fibrosis: An update. Mod Rheumatol. 2019;29(2):231–239. doi:10.1080/143975 95.2018.1554321.
32. Forestier A, Buob D, Mirault T, et al. No specific imaging pattern can help differentiate IgG4-related disease from idiopathic retroperitoneal fibrosis: 18 histologically proven cases. Clin Exp Rheumatol. 2018;36(3):371–375.
33. Rossi GM, Rocco R, Accorsi Buttini E, et al. Idiopathic retroperitoneal fibrosis and its overlap with IgG4-related disease. A. Intern Emerg Med. 2017;12 : 287–299. doi:10.1007/s11739-016-1599-z.
34. Laco J, Podhola M, Kamarádová K, et al. Idiopathic vs. secondary retroperitoneal fibrosis: a clinicopathological study of 12 cases, with emphasis to possible relationship to IgG4-related disease. Virchows Archiv 2013;463 (5):721–730. doi:10.1007/ s00428-013-1480-7.
35. Hermanová M. Idiopatická retroperitoneální fibróza – editorial. Vnitřní lékařství 2011;57(5):439–440.
36. Michaligová A, Plank L, Ježíková A, et al. Ormondova choroba (idiopatická retroperitoneálna fibróza). Vnitřní lékařství 2011;57(5):511–515.
37. Miniberger M, Kašpar M, Drechslerová J, et al. Ormondův syndrom (syndrom retroperitoneální fibrózy). Diagnostické obtíže u necharakteristické formy onemocnění při vyšetření výpočetní tomografií. Česká radiologie 1998;52(4):214–220.
38. Řehák Z, Němec P, Fabian P, et al. Využití pozitronové emisní tomografie (18F-FDG PET) v diagnostice idiopatické retroperitoneální fibrózy – kazuistika. Slovenská rádiológia 2009;16(1):68–73.
39. Roussel E, Callemeyn J, Van Moerkercke W. Standardized approach to idiopathic retroperitoneal fibrosis: a comprehensive review of the literature. Acta Clin Belg. 2020;75(4):239–244. doi:10.1080/178432 86.2019.1609152.
40. Wang K, Wang Z, Zeng Q, et al. Clinical characteristics of IgG4-related retroperitoneal fibrosis versus idiopathic retroperitoneal fibrosis. PLoS One. 2021;16(2):e0245601. doi:10.1371/journal. pone.0245601. doi:10.1371/journal. pone.0245601.
41. Novák I, Morávek P, Baše J, et al. Dlouhodobé výsledky léčby nemocných s retroperitoneální fibrózou, Rozhledy v chirurgii 1994;73(6):287–290.
42. Radoňák J, Vajo J, Toncr I, et al. Neobvyklá lokalizovaná forma retroperitoneálnej fibrózy. Rozhledy v chirurgii 1999;78(8):378–380.
43. van Bommel EF, Siemes C, Hak LE, et al. Long-term renal and patient outcome in idiopathic retroperitoneal fibrosis treated with prednisone. Am J Kidney Dis.2007;49 : 615–625. doi:10.1053/j.ajkd. 2007.02.268.
44. Mizushima I, Inoue D, Yamamoto M, et al. Clinical course after corticosteroid therapy in IgG4-related aortitis/periaortitis and periarteritis: a retrospective multicenter study. Arthritis Res Ther. 2014;16:R156. doi:10.1186/ar4671.
45. Brandt AS, Kamper L, Kukuk S, et al. Tamoxifen monotherapy in the treatment of retroperitoneal fibrosis. Urol Int. 2014;93 : 320–325. doi:10.1055/s-0031-1273450.
46. van Bommel EF, Pelkmans LG, van Damme H, et al. Long-term safety and efficacy of a tamoxifen-based treatment strategy for idiopathic retroperitoneal fibrosis. Eur J Intern Med. 2013;24 : 444 – 450. doi:10.1016/j.ejim.2012.11.010.
47. Vaglio A, Palmisano A, Alberici F, et al. Prednisone versus tamoxifen in patients with idiopathic retroperitoneal fibrosis: an open-label randomized controlled trial. Lancet 2011;378 : 338–346. doi:10.1016/S0140-6736(11)60934-3.
48. Scavalli AS, Spadaro A, Riccieri V, et al. Long-term follow-up of low-dose methotrexate therapy in one case of idiopathic retroperitoneal fibrosis. Clin Rheumatol. 1995;14(4):481–484. doi:10.1007/ BF02207688.
49. Alberici F, Palmisano A, Urban ML, et al. Methotrexate plus prednisone in patients with relapsing idiopathic retroperitoneal fibrosis. Ann Rheum Dis. 2013;72 : 1584–1586. doi:10.1136/annrheumdis - 2013-203267.
50. Scavalli AS, Di Rocco G, Giannotti D, et al. Two-years follow-up of low-dose methotrexate and 6-methylprednisolone therapy in a patient with idiopathic retroperitoneal fibrosis. Eur Rev Med Pharmacol Sci. 2012;16(15):2171–2174.
51. Binder M, Uhl M, Wiech T, et al. Cyclophosphamide is a highly effective and safe induction therapy in chronic periaortitis: a long-term follow-up of 35 patients with chronic periaortitis. Ann Rheum Dis. 2012;71 : 311–312. doi:10.1136/annrheumdis - 2011-200148.
52. Kohler HP, Laeng RH, Egger C, et al. Systemische Fibrose (generalisierte Form des Morbus Ormond). Bericht über einen Fall, der mit Cyclophosphamid und Kortikosteroiden eine komplette Remission erlangte Schweiz Med Wochenschr. 1995;125(44):2131–2136.
53. Colomer Rubio E, Blanes Gallego A, et al. Mesenteric panniculitis with retroperitoneal involvement resolved after treatment with intravenous cyclophosphamide pulses. An Med Interna. 2003;20(1):31–33.
54. Moroni G, Gallelli B, Banfi G, et al. Longterm outcome of idiopathic retroperitoneal fibrosis treated with surgical and/or medical approaches. Nephrol. Dial. Transplant. 2006;21 : 2485–2490. doi:10.1093/ ndt/gfl228.
55. Průcha M, Kolombo I, Štádler P. Combination of steroids and azathioprine in the treatment of Ormond’s disease – a single centre retrospective analysis. PragueMed Rep. 2016;117 : 34–41. doi:10.14712/23362936.2016.3.
56. Grotz W, von Zedtwitz I, Andre M, et al. Treatment of retroperitoneal fibrosis by mycophenolate mofetil and corticosteroids. Lancet 1998;352(9135):1195. doi:10.1016/S0140-6736(05)60533-8.
57. Witschi M, Gugger M, Nicod LP. Treatment of mediastinal fibrosis with mycophenolate mofetil. Respiration. 2009;78(3):330 – 333. doi:10.1159/000209508.
58. Adler S, Lodermeyer S, Gaa J, et al. Successful mycophenolate mofetil therapy in nine patients with idiopathic retroperitoneal fibrosis. Rheumatology (Oxford) 2008;47(10):1535–1538. doi:10.1093/ rheumatology/ken291.
59. Jois RN, Kerrigan N, Scott DG. Mycophenolate mofetil for maintenance of remission in idiopathic retroperitoneal fibrosis. Rheumatology (Oxford) 2007;46(4):717 – 718. doi:10.1093/rheumatology/kel417.
60. Khalil F, Mir MA, Venuto RC. Mycophenolate mofetil in the treatment of retroperitoneal fibrosis. Clin Rheumatol. 2008;27(5):679–681. doi:10.1007/s10067 - 007-0826-4.
61. Scheel PJ Jr, Feeley N, Sozio SM. Combined prednisone and mycophenolate mofetil treatment for retroperitoneal fibrosis: a case series. Ann Intern Med. 2011;154 : 31–36.PMCID:PMC3540636.
62. Scheel PJ Jr, Piccini J, Rahman MH, et al. Combined prednisone and mycophenolate mofetil treatment for retroperitoneal fibrosis. J Urol. 2007;178(1):140–143. doi:10.1016/j.juro.2007.03.057.
63. Swartz RD, Lake AM, Roberts WW, et al. Idiopathic retroperitoneal fibrosis: a role for mycophenolate mofetil. Clin Nephrol. 2008;69(4):260–268. doi:10.5414/ cnp69260.
64. Marzano A, Trapani A, Leone N, et al. Treatment of idiopathic retroperitoneal fibrosis using cyclosporin. Ann Rheum Dis. 2001;60(4):427–428. doi:10.1136/ ard.60.4.427.
65. Al-Harthy F, Esdaile J, Berean KW, et al. Multifocal idiopathic fibrosclerosis: treatment of 2 cases with cyclosporine. J Rheumatol. 2006;33(2):358–361. PMID:16465670.
66. Marcolongo R, Tavolini IM, Laveder F, et al. Immunosuppressive therapy for idiopathic retroperitoneal fibrosis: a retrospective analysis of 26 cases. Am J Med. 2004;116 : 194–197. doi:10.1016/j.amjmed. 2003.08.033.
67. Maritati F, Corradi D, Versari A, et al. Rituximab therapy for chronic periaortitis. Ann Rheum Dis. 2012;71 : 1262–1264. doi:10.1136/annrheumdis-2011-201166.
68. Almeqdadi M, Al-Dulaimi M, Perepletchikov A, et al. Rituximab for retroperitoneal fibrosis due to IgG4-related disease: A case report and literature review. Clin Nephrol Case Stud. 2018;6 : 4–10. doi:10.1136/annrheumdis-2011-201166.
69. Carruthers MN, Topazian MD, Khosroshahi A, et al. Rituximab for IgG4-related disease: a prospective, open-label trial. Ann Rheum Dis. 2015;74 : 1171–1177. doi:10.1136/annrheumdis-2014-206605.
70. Dedinská I, Svetlík D, Adamicova K, et al. Treatment of Ormond disease and idiopathic membranous glomerulonephritis by using rituximab. Iran J Kidney Dis. 2016;10(5):332–335.
71. Hamdan A, Moeen Z, Tariq H, et al. An interesting case of immunoglobulin G4-related retroperitoneal fibrosis treated with rituximab. Cureus 2021;13(9):e17940. doi:10.7759/cureus.17940.
72. Wallwork R, Wallace Z, Perugino C, et al. Rituximab for idiopathic and IgG4-related retroperitoneal fibrosis. Medicine (Baltimore) 2018;97(42):e12631. doi:10.1097/ MD.0000000000012631.
73. Boyeva V, Alabsi H, Seidman MA, et al. Use of rituximab in idiopathic; retroperitoneal fibrosis. BMC Rheumatol. 2020;4 : 40. doi:10.1186/s41927-020-00140-9.
74. Urban ML, Maritati F, Palmisano A, et al. Rituximab for chronic periaortitis without evidence of IgG4-related disease: a longterm follow-up study of 20 patients. Ann Rheum Dis. 2020;79(3):433–434. doi:10.1136/annrheumdis-2019-216258.
75. Benucci M, Damiani A, Li Gobbi F, et al. Jaccoud‘s arthropathy, an unusual manifestation of idiopathic retroperitoneal fibrosis: rapid improvement of symptoms after tocilizumab treatment. Reumatismo. 2017;69 (2):88–91. doi:10.4081/reumatismo. 2017.968.
76. Perrotta FM, Fici M, Guerra G, et al. Chronic periaortitis with retroperitoneal fibrosis successfully treated with first line tocilizumab monotherapy: a case report. Clin Exp Rheumatol. 2017;35 Suppl 103(1):226–227.
77. Vaglio A, Catanoso MG, Spaggiari L, et al. Interleukin-6 as an inflammatory mediator and target of therapy in chronic periaortitis. Arthritis Rheum. 2013;65(9):2469–2475. doi:10.1002/ art.38032.
78. Loricera J, Blanco R, Castaeda S, et al. Tocilizumab in refractory aortitis: study on 16 patients and literature review. Clin Exp Rheumatol. 2014;32(3 Suppl 82):S79–89.
79. Catanoso MG, Spaggiari L, Magnani L, et al. Efficacy of infliximab in a patient with refractory idiopathic retroperitoneal fibrosis. Clin Exp Rheumatol. 2012;30(5):776–778.
80. Pelkmans LG, Aarnoudse AJ, Hendriksz TR, et al. Value of acute-phase reactants in monitoring disease activity and treatment response in idiopathic retroperitoneal fibrosis. Nephrol Dial Transplant. 2012;27 : 2819–2825. doi:10.1093/ ndt/gfr779.
81. Vaglio A, Versari A, Fraternali A, et al. (18) F-fluorodeoxyglucose positron emission tomography in the diagnosis and followup of idiopathic retroperitoneal fibrosis. Arthritis Rheum 2005;53 : 122–125. doi:10.1002/art.20914.
82. Jansen I, Hendriksz TR, Han SH, et al. 18F-fluorodeoxyglucose position emission tomography (FDG-PET) for monitoring disease activity and treatment response in idiopathic retroperitoneal fibrosis. Eur J Intern Med 2010;21 : 216–221. doi:10.1016/j.ejim.2010.02.008.
83. Němec P, Řehák Z, Fabián P. Využití pozitronové emisní tomografie (18F-FDG PET) v diagnostice chronických periaortitid. Vnitřní lékařství 2008;54(11):1093 – 1099. PMID:19069683.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2022 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Je defenzivní medicína problémem chirurgů?
- Defenzivní medicína a vliv hrozby soudních sporů na lékaře
- Retroperitoneální fibróza – diagnostika a léčba
- Akromikoklavikulární luxace u zlomenin lopatky – pathoanatomie poranění
- Bilaterálna versus unilaterálna implantácia totálnej náhrady kolenného kĺbu – porovnanie klinických a funkčných výsledkov v dvojročnom sledovaní
- Opožděně diagnostikovaná ruptura bránice po tupém traumatu hrudníku – 2 kazuistiky
- Omentální torze jako vzácná příčina bolestí v pravém subkostálním prostoru − kazuistika
- Atraumatický akutní kompartment syndrom − kazuistika
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Retroperitoneální fibróza – diagnostika a léčba
- Atraumatický akutní kompartment syndrom − kazuistika
- Defenzivní medicína a vliv hrozby soudních sporů na lékaře
- Bilaterálna versus unilaterálna implantácia totálnej náhrady kolenného kĺbu – porovnanie klinických a funkčných výsledkov v dvojročnom sledovaní
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



