-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
GIST tenkého střeva v terénu neurofibromatózy jako zdroj masivního krvácení
GIST of the small bowel in neurofibromatosis terrain as a source of massive bleeding
Neurofibromatosis type I (Morbus Von Recklinghausen) is an autosomal dominant disorder. The major diagnostic criteria include multiple cutaneous neurofibromas, café au lait spots, that are rarely found in the gastrointestinal tract. 5–25% of these lesions, however, may develop into gastrointestinal stromal tumours. We report the case of a 69-year-old woman with Von Recklinghausen disease. She was admitted due to gastrointestinal bleeding. During surgery we found, among multiple neurofibromatic intestinal lesions, macroscopically different bleeding tumours. They were completely removed. Histological examination revealed gastrointestinal stromal tumour.
Using an immunohistological assay, we examined stored specimens from previous operations on the same patient: one anal polyp removed a year ago and tumours removed 32 years ago and regarded as polyps then were re-classified as gastrointestinal stromal tumours.
In the discussion, the authors address the issue of which examination of the intestine would be appropriate to find out the source of bleeding in the small intestine and how to distinguish intestinal stromal tumours in the terrrain of intestinal neurofibromatosis. Another issue addressed is a screening examination in patients with skin forms of Recklinghausen’s disease.
To successfully manage intestinal bleeding, close cooperation among the surgeon, the endoscopist and the radiologist is indispensable. In order to quickly establish the right diagnosis and subsequently target treatment promptly, it is very helpful to know the patient’s exact personal medical history and also the possible complications of chronic diseases.Key words:
neurofibromatosis – stromal – tumour – bleeding – intestinal tract
Autoři: R. Slováček 1; Z. Adamová 1; P. Mičulka 2
Působiště autorů: Chirurgické oddělení Vsetínské nemocnice, a. s., přednosta: MUDr. J. Sankot 1; Oddělení patologické anatomie Vsetínské nemocnice a. s., přednosta: MUDr. P. Mičulka 2
Vyšlo v časopise: Rozhl. Chir., 2014, roč. 93, č. 3, s. 143-146.
Kategorie: Kazuistika
Souhrn
Neurofibromatóza I. Typu (Morbus von Recklinghausen) je autosomálně dominantně dědičné onemocnění, kdy se kromě známých a zjevných kožních lézí mohou neurofibromy vzácně tvořit i v gastrointestinálním traktu. V tomto případě však mohou v 5–25 % přecházet v gastrointestinální stromální tumory. V případě námi prezentované 69leté pacientky s neurofibromatózou I. typu byly při krvácení z trávicího traktu nalezeny v terénu mnohočetné neurofibromatózy tenkého střeva makroskopicky odlišné, krvácející léze, které byly kompletně exstirpovány. Histologicky pak byly verifikovány jako gastrointestinální stromální tumory. Při imunohistologickém vyšetření archivovaných preparátů z předchozích operací pacientky byly takto překlasifikovány jak léze rekta odstraněná před rokem, tak „polypy“ tenkého střeva, odstraněné před 32 lety.
V diskuzi autoři rozebírají možnosti vyšetření zdroje krvácení tenkého střeva a odlišení gastrointestinálních stromálních tumorů v terénu neurofibromatózy střeva. Další diskutovanou otázkou je aktivní vyhledávání gastrointestinálních tumorů u pacientů s kožní formou Mb. Recklinghausen.
Pro úspěšné řešení krvácení z gastrointestinálního traktu je nezbytná dobrá spolupráce mezi chirurgem, endoskopujícím lékařem a rentgenologem. K rychlejší diagnostice a následné léčbě je velmi prospěšná přesná znalost osobní anamnézy pacienta a možných komplikací chronických onemocnění.Klíčová slova:
neurofibromatóza – stromální – tumor – krvácení – trávicí traktÚvod
Neurofibromatóza I. typu ( Morbus von Recklinghausen) je autosomálně dominantně dědičné onemocnění s různou penetrancí genu, přibližně 50 % případů se prezentuje jako nová nemoc.
Hlavními diagnostickými kritérii jsou mnohočetné kožní fibromy, skvrny café au lait, pigmentové hamartomy duhovky a pozitivní rodinná anamnéza. Gen pro neurofibromatózu I (NF1) je identifikován na chromozomu 17. Gastrointestinální lokalizace lézí není u NF 1 neobvyklá, může se vyskytnout v různých formách – od hyperplazie neurální tkáně po gastrointestinální stromální a endokrinní tumory. V gastrointestinálním traktu (GIT) se neurofibromy častěji vyskytují v tenkém střevě, v tlustém střevě a rektu se vyskytují extrémně vzácně [1].
Gastrointestinální stromální tumory (GIST) jsou neepitelové nádory trávicího traktu tvořené vřetenovitými buňkami, které jsou diferencovány z tzv. Cajalových buněk. Ty jsou součástí střevní stěny a fungují jako peristaltický pacemaker. GISTy jsou nejčastějšími mezenchymálními nádory trávicího ústrojí (60 %), ale z celkového počtu nádorů trávicího traktu tvoří jen 2–5 %. Nejčastěji se objevují ve věku 55–65 let. Typicky postihují žaludek (60–70 %), ale mohou se vyskytnout i v tenkém střevě (20–25 %), tlustém střevě (5 %) a jícnu (do 5 %). Vzácný je jejich nález mimo trávicí trubici [2] Tab. 1.
Tab. 1. Výskyt GIST Tab. 1: Incidence of GIST 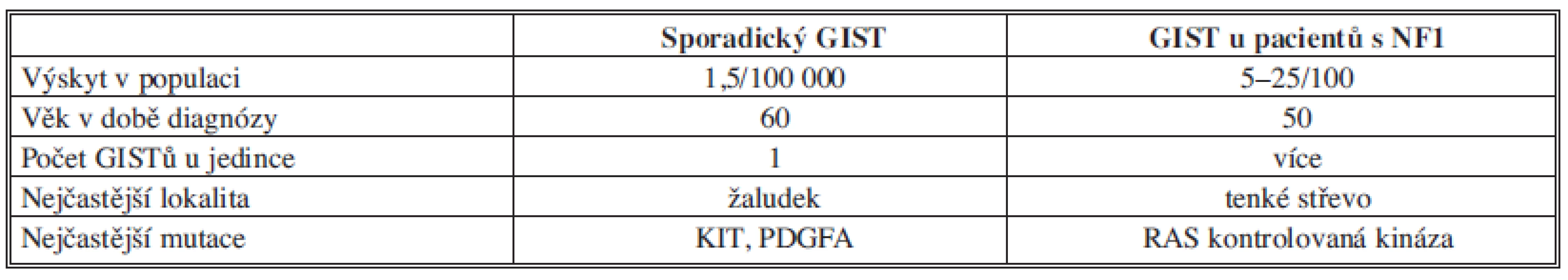
Jako zvláštní forma GISTu je v literatuře uváděn výskyt tohoto tumoru v terénu neurofibromatózy I. typu, kdy bývá mnohočetný a nejčastěji postiženou částí trávicího traktu bývá tenké střevo. Každý GIST je nutné považovat za potenciálně maligní, podle lokalizace pak nádory tenkého střeva mívají horší prognózu [3].
Kazuistika
Na naše oddělení byla přijata 69letá pacientka s neurofibromatózou I. typu (Mb. Recklinghausen), která u ní byla diagnostikována ve 44 letech věku (Klinika chorob kožních a pohlavních FN Olomouc). V anamnéze byla uvedena následující data týkající se GIT: v 37 letech operace „střevních polypů“, kdy bylo odstraněno cca 80 cm tenkého střeva. V 66 letech měla pacientka ataku melény, jako zdroj byla při gastroskopii zjištěna erozivní gastritis. V 67 letech pacientka prodělala cholecystektomii pro pokročilou gangrenózní cholecystitidu s předoperační stentáží choledochu cestou ERCP. V 68 letech byla u pacientky provedena transanálně excize susp. neurofibromu rekta, který byl histologicky popsán jako neurilemom (Schwannom) s pozitivou S-100 proteinu (Obr. 1).
Obr. 1. Neurofibromatóza kůže Fig. 1: Neurofibromatosis of the skin 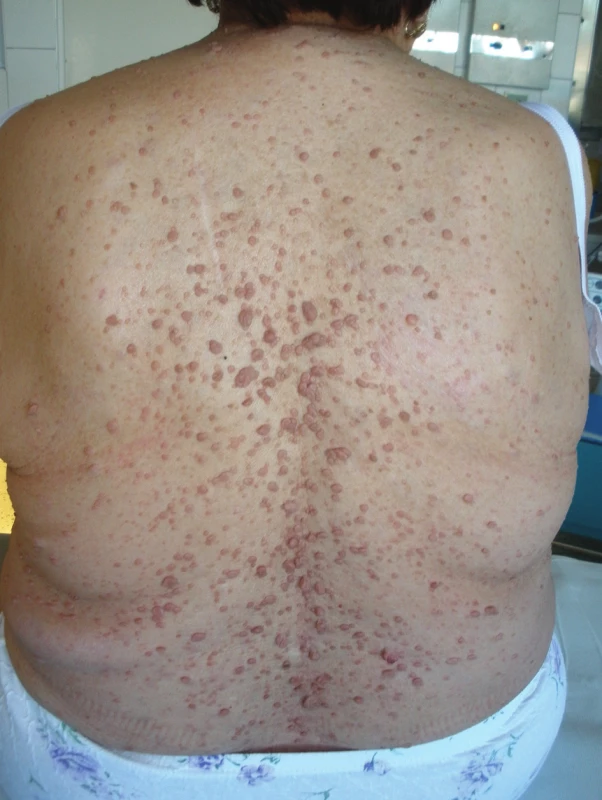
V září 2009 se pacientka dostavila na chirurgickou ambulanci pro den trvající černou stolici. Nezvracela, byla bez bolestí, před touto atakou neměla žádné potíže. Při přijetí byla oběhově stabilní, TK 130/70 mm Hg, 90 pulzů/min. Vstupní hemoglobin byl 99 g/l, postupně klesal až na 52 g/l. Při klinicky zjevném krvácení a poklesu hemoglobinu byl podáván terlipresin 1 mg i.v. každé
4 hodiny, krevní převody, do operace celkem 7 TU; koagulační faktory či mražená plazma při dobrých koagulačních parametrech nebyly podávány. Pacientka byla po celou dobu oběhově stabilní.
V den přijetí 2. 9. 2009 byla provedena akutní gastroskopie s nálezem těžké difuzní gastritidy, ale bez přítomnosti krve. Zahájili jsme podávání plné dávky blokátoru protonové pumpy (PPI) parenterálně, kontinuálně. Při pokračujících známkách krvácení měla pacientka opakovaně melénu s neúplně natrávenou krví; byla provedena 3. 9. 2009 kolonoskopie s nálezem mnohočetné klidové divertikulózy sigmatu, bez známek čerstvého krvácení, s prosáknutím Bauhinské chlopně a polypem dna céka (histologicky byl verifikován zánětlivý polyp). Dominovalo velké množství částečně natrávené krve přitékající z horních partií tenkého střeva. Vzhledem k oběhové stabilitě pacientky a snížení frekvence melén při konzervativní léčbě jsme neindikovali další vyšetření.
4. 9. 2009 ráno se znovu objevila masivní meléna s příměsí čerstvé krve. Po domluvě s radiologem jsme indikovali angioCT splanchnické oblasti, při kterém byly patrny mnohočetné polypoidní útvary tenkého střeva. V pars ascendens duodena (D4) a na duodenojejunálním přechodu se zobrazují 2 větší kulovité útvary, z jednoho z nich je patrný signifikantní únik kontrastní látky do lumina střeva, což představuje jasné známky akutního krvácení (Obr. 2,3).
Obr. 2. CT nativ – tumorózní léze duodena Fig. 2: Plain CT – tumorous lesions of the duodenum 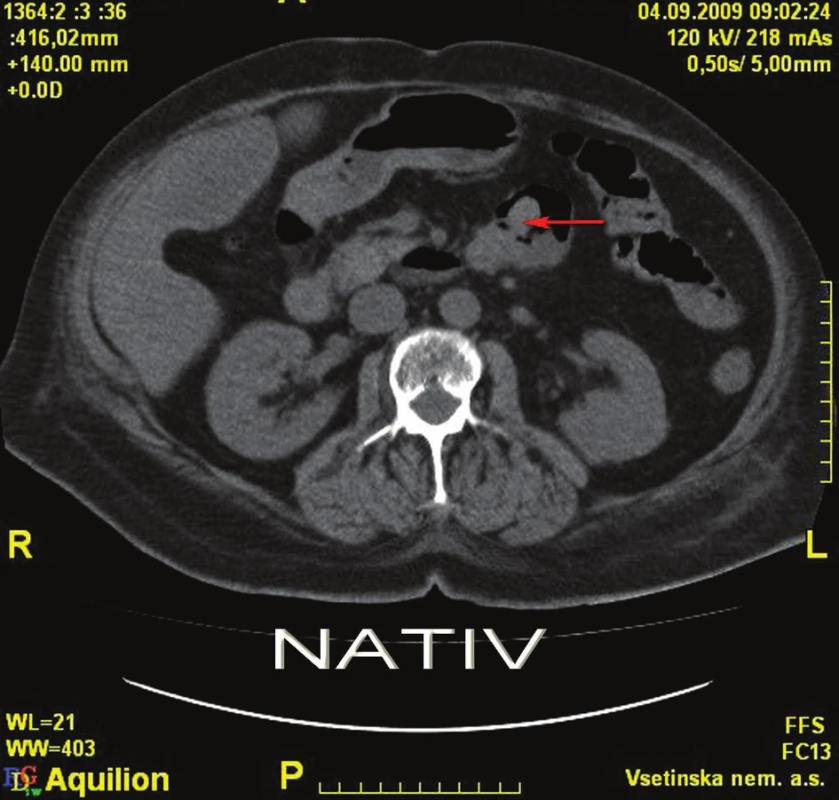
Obr. 3. CT kontrast – krvácení z tumoru Fig. 3: Enhanced CT – bleeding from the tumour 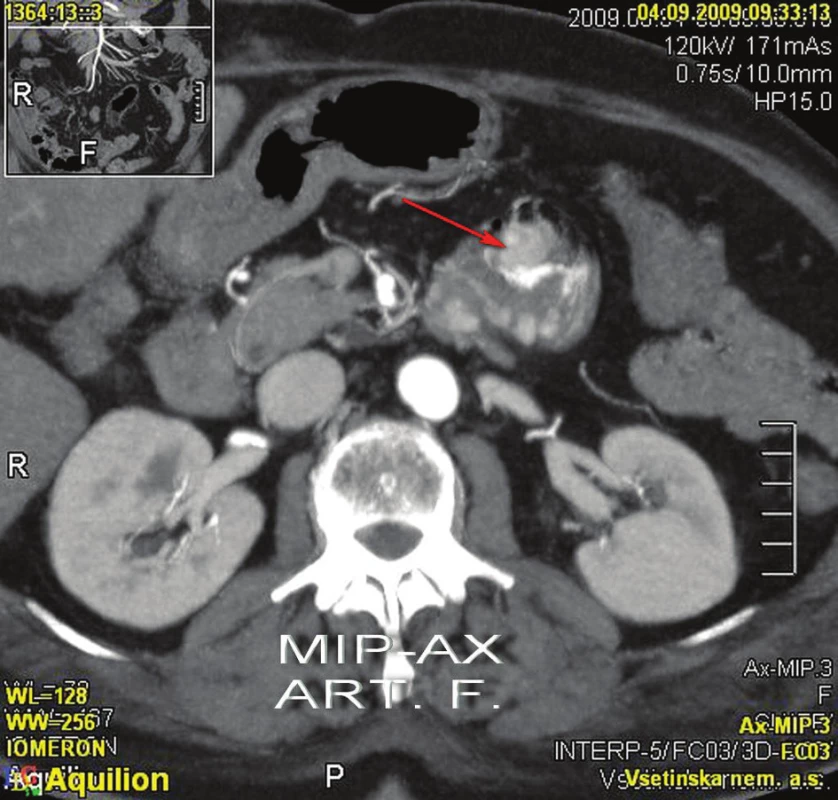
Proto vzhledem k nálezu pokračujícího významného krvácení při známém zdroji i jeho lokalizaci indikujeme urgentní operační revizi.
Při operaci ze 2 samostatných enterotomií exstirpujeme 2 kulovité útvary, orální v D4 velikosti 2,5 cm, aborální v oblasti Treitzovy řasy na zadní stěně střeva o průměru 2 cm. Na jeho vrcholu je drobná nekróza s pulzujícím krvácením. V průběhu tenkého střeva nalézáme četné, předpokládáme že neurofibromatózní uzlíky (Obr. 4).
Obr. 4. Exstirpovaný tumor Fig. 4: Removed tumour 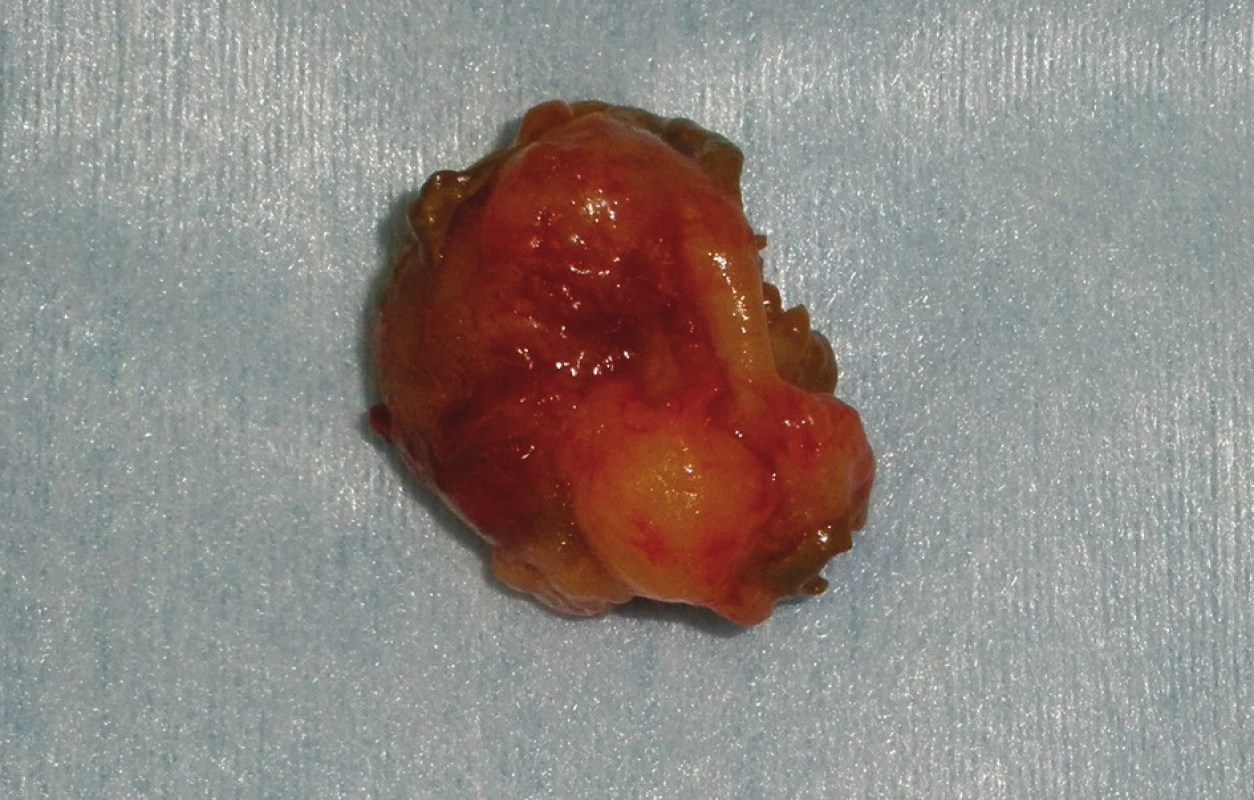
Pooperační průběh je již bez komplikací, po odchodu zbytkové melény již není známek dalšího krvácení, během 2 dnů ještě podáváme 2 TU erymasy k úpravě hladiny hemoglobinu. Pooperačně má pacientka do 3. dne subfebrilie, rána je bez známek infektu, hojí se per primam. Od 3. dne se obnovuje pasáž střevní a po odchodu zbytků starší krve či melény je dále hnědá stolice. Od 3. dne rovněž zatěžujeme střevo postupně perorálním příjmem, který pacientka dobře toleruje. 4. pooperační den překládáme pacientku z JIP na standardní oddělení. 11. pooperační den je propuštěna domů.
Při histologickém a imunohistochemickém vyšetření byly oba exstirpované tumory verifikovány jako GIST nízkého stupně malignity (CD 117 pozitivní, CD 31 pozitivní, S 100 pozitivní).
Během dalšího sledování pacientky v onkologické ambulanci (CEA, kolonoskopie, CT břicha) nebyla během 3 let zjištěna recidiva či progrese onemocnění. V současné době je pacientka bez subjektivních potíží, s pravidelnou stolicí, přítomnost krve ve stolici nepozoruje.
Diskuze
Případ naší pacientky je medicínsky zajímavý hned z několika hledisek, při jeho řešení jsme narazili na několik problematických bodů. Asi nejjednodušší se z tohoto pohledu jeví problematika krvácení do zažívacího traktu. Algoritmus diagnostiky a následné léčby je všeobecně přijatý. Ložisková léze na tenkém střevě je však hůře dosažitelná endoskopicky, enteroskop není zvláště v akutním stavu běžně k dispozici. My jsme k ozřejmění zdroje krvácení využili angioCT s velmi dobrým výsledkem. Krvácení však musí být dostatečně intenzivní, aby se intraluminálně unikající kontrastní látka zobrazila (minimálně 2 ml/min) [4].
Při operační revizi jsme odstranili jednak jednoznačně krvácející tumor, jednak druhé největší ložisko v popsané oblasti – dle pooperačního histologického vyšetření radikálně, ve zdravých okrajích. Potvrdili jsme nález z CT, že se v aborálním duodenu a jejunu nacházejí mnohočetné drobné noduly. Otázkou ale zůstává, které z nich jsou neurofibromy a které již GISTy.
Při zjištění, že se nejedná o neurofibromy, ale o GISTy, jsme nechali zpětně vyšetřit histologický materiál z předchozích excizí. Schwannom exstirpovaný z rekta předchozí rok byl po imunohistochemickém vyšetření při pozitivitě CD117 překlasifikován na GIST. Ještě větším překvapením bylo imunohistochemické vyšetření preparátu resekátu střeva z roku 1977. I zde vykazoval tumor pozitivitu na CD 117, a byl tedy po 32 letech překlasifikován z polypu střeva na gastrointestinální stromální tumor nízkého stupně malignity. Vzhledem k R0 resekci daných tumorů a nízkému stupni malignity neindikoval onkolog adjuvantní léčbu imatinib mesylátem a pacientka je pouze dispenzarizována.
Jaké metody však zvolit pro další sledování? Gastroskopie a kolonoskopie nejsou problémem, u naší pacientky byly opakovaně negativní. Pro sledování duodenojejuna je prováděno CT vyšetření. Může však jen srovnávat velikost mnohočetných neurofibromatózních uzlů v časovém odstupu, ale neodliší včasně změnu neurofibromu v GIST. Z tohoto pohledu se jako nejpřínosnější ukazuje PET/CT, při kterém lze rozlišit ložiska vychytávající fluorin-18-fluorodeoxy glukózy (FDG-PET) v aktivním tumoru, zatímco neurofibromy tuto látku neakumulují [2,5].
Pro sledování aktivity ložisek bude tato metoda přínosnější než dvoubalonová enteroskopie, kde u mnohočetných drobných lézí lze obtížně určit podezřelejší ložiska [6,7].
Poslední problematickou oblastí, na kterou jsme narazili, je otázka aktivního vyhledávání GIST mezi pacienty s neurofibromatózou I. typu. Podle literárních údajů je riziko vzniku GIST v terénu neurofibromatózy 5–25 %, a to hlavě v tenkém střevě, kde se tyto nádory vyskytují s vyšším stupněm malignity. Naše pacientka má 42letou dceru a 20letou vnučku a u obou je prokázána neurofibromatóza I. typu. Jedná se jednak o metodu, kterou pro vyhledávání použít, jednak o to, kdo má tato vyšetření koordinovat. Pracoviště kožního lékařství mají v péči pouze kožní noxy, pracoviště onkologie se pak starají o pacienty se suspektní nebo již prokázanou neoplazií.
V současnosti převládá názor, že se případné GIST u pacientů s neurofibromatózou aktivně nevyhledávají, ale při známkách gastrointestinálních obtíží jsou vyšetřeni některou z endoskopických metod nebo lépe PET/CT [2].
Závěr
Krvácení do zažívacího traktu představuje vždy potenciálně závažný stav. Při dobře fungujícím mezioborovém týmu chirurg – endoskopující lékař – radiolog je většina těchto stavů rychle a úspěšně vyřešena. Krvácející léze na tenkém střevě nebývají časté a jsou většinou obtížněji prokazatelné.
Jistým rychlým návodem zde může být důsledná osobní anamnéza a znalost možných komplikací při chronických onemocněních.
MUDr. Radim Slováček
Smetanova 1477
755 01, Vsetín
e-mail: slovacek@nemocnice-vs.cz
Zdroje
1. Behranwala KA, Spalding D, Wotherspoon A, et al. Small bowel gastrointestinal stromal tumours and ampularry cancer in Type I neurofibromatosis. World Journal of Surgical Onkology 2004;2 : 1.
2. Páral J, Lochman P, Kalábová H, Hadži-Nikolov D. GIST: Novodobé poznatky a léčebné modality. Rozhledy v chirurgii 2012;91 : 189–198.
3. Tsukuda K, Ikeda E, Takagi S, et al.Multiple Gastrointestinal Stromal Tumors in Neurofibromatosis Type 1 Treated with Laparoscopic Surgery. Acta Med Okayama 2007;61 : 47–504.
4. Ferda J. CT angiografie. Praha, Galén 2004 : 272–273.
5. Van den Abeele AD. The lessons of GIST-PET and PET/CT: a new paradigm for imaging. Onkologist 2008;13(Suppl):8–13.
6. Takakuraa K, Kajiharaa M, Sasakia S, et al.Use of Balloon Enteroscopy in Preoperative Diagnosis of Neurofibromatosis-Associated Gastrointestinal Stromal Tumours of the Small Bowel. Case Rep Gastroenterol 2011;5 : 308–314.
7. Matek J, Krška Z. GIST jako invaginace na tenkém střevě. Rozhledy v chirurgii 2009;88 : 425 – 427.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2014 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Současný stav v péči o polytrauma
- Poranenia extenzorového aparátu v zóne I – mallet deformita
- Analýza komplikací a klinicko-patologických faktorů ve vztahu k laparoskopické cholecystektomii
- Princípy chirurgie III
- Standardizace patologického vyšetření resekátu pankreatu
- Sagitální typ bércové amputace u pacientů se syndromem diabetické nohy
- GIST tenkého střeva v terénu neurofibromatózy jako zdroj masivního krvácení
- Patologická tekutinová kolekce mezenteria, diferenciální diagnostika mezenteriální cysty – kazuistika
- Václav Novák a Josef Kalný – dvě nevzpomenutá životní výročí
- Význam chirurgické patologie pro onkochirurgii
- Obecné zásady práce s resekovanými tkáněmi a orgány určenými pro histopatologické vyšetření – požadavky patologů na chirurgy
- Lymfatické metastazování očima patologa
- Problematika diferenciální diagnostiky primárních nádorů jater
- Organizace a využívání tkáňové banky nádorů
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Lymfatické metastazování očima patologa
- Patologická tekutinová kolekce mezenteria, diferenciální diagnostika mezenteriální cysty – kazuistika
- Sagitální typ bércové amputace u pacientů se syndromem diabetické nohy
- Poranenia extenzorového aparátu v zóne I – mallet deformita
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



