-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Sarkosin v moči pacientů se zhoubným nádorem prostaty
Sarcosine in urine of patients with prostate carcinoma
Prostate specific antigen (PSA) is currently the most important marker for prostate cancer, but still belongs to markers where is the necessity to disrupct damaged tissue. Therefore, markers, through which it would be possible to identify prostate cancer by analysis of urine, are being looked for. Non-protein amino acid sarcosine is one of the substances whose potential could be used in the diagnosis of prostate cancer from urine. According to several studies, sarcosine is rated as significantly better marker of developing prostate cancer than PSA, and therefore the aim of this study was to optimize a simple test for sarcosine in the urine of patients diagnosed with prostate cancer and healthy controls. For determination of sarcosine, there were used 55 male urine samples, 23 controls and 32 patients. In this study, we confirmed that the concentration of sarcosine were determinable (within the range from 120 to 1500 μM with average of 505 ± 410 μM) in urine samples of patients diagnosed with prostate cancer. Sarcosine concentrations in healthy subjects were below detection limit of the method. The obtained positive results suggest that detection of sarcosine might have a potential in the diagnosis of prostate cancer.
Key words:
sarcosine, tumour marker, prostate cancer, high performance liquid chromatography (HPLC)
Autoři: N. Cernei 1; O. Zítka 1; S. Skaličková 1; J. Gumulec 3; M. Masařík 3; R. Hrabec 4; V. Adam 1,2; R. Kizek 1,2
Působiště autorů: Ústav chemie a biochemie, Mendelova univerzita v Brně, Děkan: prof. Ing. Ladislav Zeman, CSc. 1; Středoevropský technologický institut, Vysoké učení technické v Brně, Ředitel: prof. Ing. Radimír Vrba, CSc. 2; Ústav patologické fyziologie, Lékařská fakulta, Masarykova univerzita, Přednostka: prof. MUDr. Anna Vašků, CSc. 3; Urologické oddělení, Fakultní nemocnice u sv. Anny v Brně, Primář: MUDr. Arne Rovný 4
Vyšlo v časopise: Prakt. Lék. 2012; 92(8): 444-448
Kategorie: Z různých oborů
Souhrn
Prostatický specifický antigen (PSA) představuje v současnosti nejdůležitější marker nádorových onemocnění prostaty, avšak patří mezi markery kde dochází k narušení integrity tkáně. Proto jsou hledány markery, pomocí kterých by bylo možné identifikovat karcinom prostaty pouhou analýzou moči. Jednou z látek, jejichž potenciál by se mohl v diagnostice karcinomu prostaty využít, je neproteinogenní aminokyselina sarkosin. Podle několika studií je sarkosin hodnocen jako výrazně lepší marker rozvíjejících se nádorů prostaty než PSA, a proto bylo cílem této práce zavedení jednoduchého testu na hladinu sarkosinu v moči pacientů s diagnostikovaným zhoubným nádorem prostaty a zdravé kontrolní skupiny. Pro analýzu sarkosinu bylo použito celkem 55 vzorků mužské moči; 23 kontrolních vzorků a 32 vzorků od pacientů s rakovinou prostaty (z Urologické kliniky FN u sv. Anny). V této studii jsme potvrdili, že koncentrace sarkosinu u vzorků moči pacientů s diagnostikovaným zhoubným nádorem prostaty jsou detekovatelné (v rozmezí 120–1500 μM a průměrnou koncentrací 505 ± 410 μM). Koncentrace sarkosinu u zdravých osob byla pod limitem detekce metody. Získané pozitivní výsledky naznačují, že detekce sarkosinu může mít potencionální význam v diagnostice zhoubného nádoru prostaty.
Klíčová slova:
sarkosin, nádorový marker, karcinom prostaty, vysoce účinná kapalinová chromatografie (HPLC)Úvod
Zhoubný karcinom prostaty je maligní nádorové onemocnění prostaty, které je charakterizováno nekoordinovaným růstem prostatických buněk se ztrátou jejich původní funkce (1). Přesný mechanismus vzniku a progrese karcinomu prostaty není objasněn (2), ale již dnes je identifikováno několik rizikových faktorů, které výrazně zvyšují vznik tohoto onemocnění. Jedná se především o věk, genetické predispozice, etnický původ a způsob životního stylu (3). Nejvýznamnějším rizikovým faktorem pro vznik karcinomu prostaty je věk, kdy s každou dekádou života roste pravděpodobnost jeho výskytu na dvojnásobek (4, 5). Dalšími zmíněnými rizikovými faktory, které pravděpodobně přispívají ke vzniku nádorových onemocnění prostaty, jsou genetické dispozice (6, 7). Riziko výskytu karcinomu prostaty je asi trojnásobné, jestliže byly v rodině identifikovány rizikové profily jako rakovina prsu a karcinom prostaty (8). Vliv má také etnický původ (9), nejvyšší incidence karcinomu prostaty byly zjištěny u amerických černochů, vyšší je také u indoevropské populace (10). Důležitou roli při vzniku a rozvoji tohoto nádorového onemocnění hrají také androgeny. Z tohoto pohledu můžeme rozdělit karcinomy prostaty na androgen dependentní a non dependentní (11, 12).
Vývoj nádoru prostaty je velmi pozvolný, přičemž agresivní forma se objevuje bez zjevných stimulů (13). Neagresivní forma zhoubného nádoru pacienta omezuje minimálně a po léta se příliš nemění (14). Avšak rozlišení obou variant je totiž velmi obtížné (15). V současné době neexistuje test, který by byl schopen jednoznačně potvrdit či vyvrátit přítomnost karcinomu prostaty a zároveň informovat o pokročilosti a umístění karcinomu (16). Jedná se tedy spíše o soubor vyšetření, která lze rozdělit na ta, která vedou k podezření na karcinom prostaty (vyšetření per rectum a hladiny prostatického specifického antigenu (17)), dále na histologická vyšetření (transrektální sonografie s biopsií prostaty) (18), a ostatní vyšetření, která slouží k určení pokročilosti onemocnění (CT (19), magnetická rezonance (20) nebo pozitronová emisní tomografie (21)). Běžné diagnostické postupy zahrnují odebrání bioptického vzorku, což je pro pacienta velice stresující (22), a je třeba zdůraznit, že i přes značný pokrok v invazivní diagnostice stále hrozí i nežádoucí komplikace (23).
Klíčovým faktorem pro léčbu nádorových onemocnění prostaty je včasná diagnostika a určení stádia nemoci, na nichž pak závisí celková onkologická léčba. V současnosti jsou nejrozšířenější způsoby léčby ozařování, radikální prostatektomie, hormonální léčba (orchiektomie nebo hormonální injekce) a v neposlední řadě chemoterapie (24). Ozařování je vhodné zejména pro kontrolu růstu rakovinových buněk a prevence jejich dalšího šíření (25). Používají se cílené paprsky radioaktivního záření, na které jsou maligní buňky vysoce citlivé (26). Operativní odstranění předstojné žlázy a žláz k nim přilehlých se používá u nádorů, které dosud nemetastazovaly do dalších tkání (27). Jedním ze standardních postupů léčby je hormonální terapie. U pacientů je buď provedeno odstranění varlat nebo podávání hormonálních injekcí s cílem snížit hladinu mužských hormonů (zejména testosteronu) na minimální hladinu (28). V případě, že všechny přístupy k léčbě rakoviny prostaty jsou neúspěšné, nasazuje se chemoterapie. Nejčastěji je podáván docetaxel, avšak jsou testovány nová cystostatika, napříkald Cabazitaxel (29). I když je úspěšnost léčby rakoviny prostaty poměrně dobrá (mortalita 30 mužů z 100000), je třeba se této problematice ve vědecké sféře více věnovat, protože právě u včasně diagnostikovaných pacientů je úspěšnost léčby největší.
Nádorové markery u nádorů prostaty
Prostatický specifický antigen (PSA) byl poprvé popsán v roce 1977 a v současnosti představuje nejdůležitější marker nádorových onemocnění prostaty (30). Slouží jak ke stanovení diagnózy, tak k určení pokročilosti choroby i monitoringu úspěšnosti léčby, avšak jeho sensitivita (49–91 %) a specifita (68–80 %) nejsou dostatečně vysoké, aby mohl být považován za ideální marker (31). Z chemického hlediska se jedná o jednořetězcový glykoprotein o velikosti 34000 kDa, podílející se na likvefakci spermií, který je vylučován epiteliálními buňkami prostaty, a to jak normálními, tak nádorovými (32). PSA je uvolňován do oběhu a vyskytuje se ve formě vázané (asi 85 %) a ve formě volné (fPSA) (33). Zvýšená hladina PSA v krvi signalizuje změny stavu prostaty, tedy nejen karcinom, ale i benigní hyperplazie, apod. (34). Hladina PSA v krvi u níž je podezření na tumor zanedbatelné je v intervalu 0–4 ng/ml. Většina mužů s karcinomem prostaty má hladinu PSA v rozmezí 10 až 20 ng/ml, avšak nejsou neobvyklé ani hodnoty stokrát nebo dokonce tisíckrát vyšší (34).
Mezi nové potenciální markery, které mohou být využitelné při diagnostice pokročilosti karcinomu prostaty, patří alfa-metyl CoA-racemáza (AMACR). Jedná se o peroxizomální a mitochondriální enzym účastnící se beta-oxidace větvených mastných kyselin, katabolizmu metabolitů žlučových kyselin a metabolizmu ibuprofenu. Zvýšení hladin tohoto proteinu je popsáno u většiny adenokarcinomů a u prostatické intraepiteliální neoplázie vysokého stupně (35). Nízké hladiny tohoto markeru jsou popsány u benigní hyperplázie a u atypické adenomatózní hyperplázie (36–38). Proto jsou hledány neinvazivní markery, pomocí kterých by bylo možné identifikovat karcinom prostaty pouhou analýzou moči (39). Nejpoužívanějšími jsou PCA3 (prostatický antigen3) a annexin A3 (40). Jednou z látek, jejichž potenciál by se mohl v diagnostice karcinomu prostaty využít, je neproteinogenní aminokyselina sarkosin.
Sarkosin a jeho vztah k nádorovému onemocnění prostaty
Sarkosin s chemickým vzorcem CH3NHCH2COOH byl poprvé izolován a pojmenován německým chemikem Justusem von Liebigem v roce 1847. Z chemického hlediska se jedná o přírodní, netoxickou a bezbarvou pevnou látku, která je dobře rozpustná ve vodě (41). Sarcosin je methylderivát glycinu, někdy nazývaný N-methylglycin (42), který vzniká v těle savců jako meziprodukt metabolismu cholinu (43). Metabolismus cholinu je ukázán na obr. 1. V roce 2010 byla v prestižním časopise Nature uveřejněna studie, která naznačuje významnou roli sarkosinu u nádorových buněk (42), přičemž je diskutována možnost využití sarkosinu jako markeru raných stádií vývoje zhoubného karcinomu prostaty (44). Velmi výhodné je i to, že v moči zdravých pacientů není přítomen vůbec nebo ve velmi malých koncentracích. Tím se snižuje riziko falešně pozitivních a falešně negativních výsledků. Vědecká obec je však v tvrzeních ohledně vhodnosti sarkosinu jako markeru nejednotná (45). I přes to, že bylo zjištěno, že sarkosin je zapojen do metabolismu aminokyselin a metylačních procesů, které probíhají během progrese nádorových onemocnění prostaty (42), objevují se i publikace, které přímo vyvracejí spojení sarkosinu se zhoubnými nádory (25). Nicméně metabolismus syntézy aminokyselin popř. jejich modifikací je nádorovým onemocněním zcela jistě ovlivněn, jak ukazuje práce publikovaná v časopise Science odhalující významnou roli glycinu v nádorovém metabolismu (46). Pro hledání dalších důkazů je nutné zapojit do studia další metody pro jeho stanovení, aby bylo možno potvrdit či vyvrátit nastolené hypotézy (47). Podle několika studií je sarkosin hodnocen jako výrazně lepší marker rozvíjejících se nádorů prostaty (48) než prostatický specifický antigen (PSA), a proto bylo cílem této práce zavedení jednoduchého testu na stanovení hladiny sarkosinu v moči pacientů s diagnostikovaným zhoubným karcinomem prostaty a zdravé kontrolní skupiny.
Obr. 1. Biochemické dráhy tvorby a oxidace sarkosinu 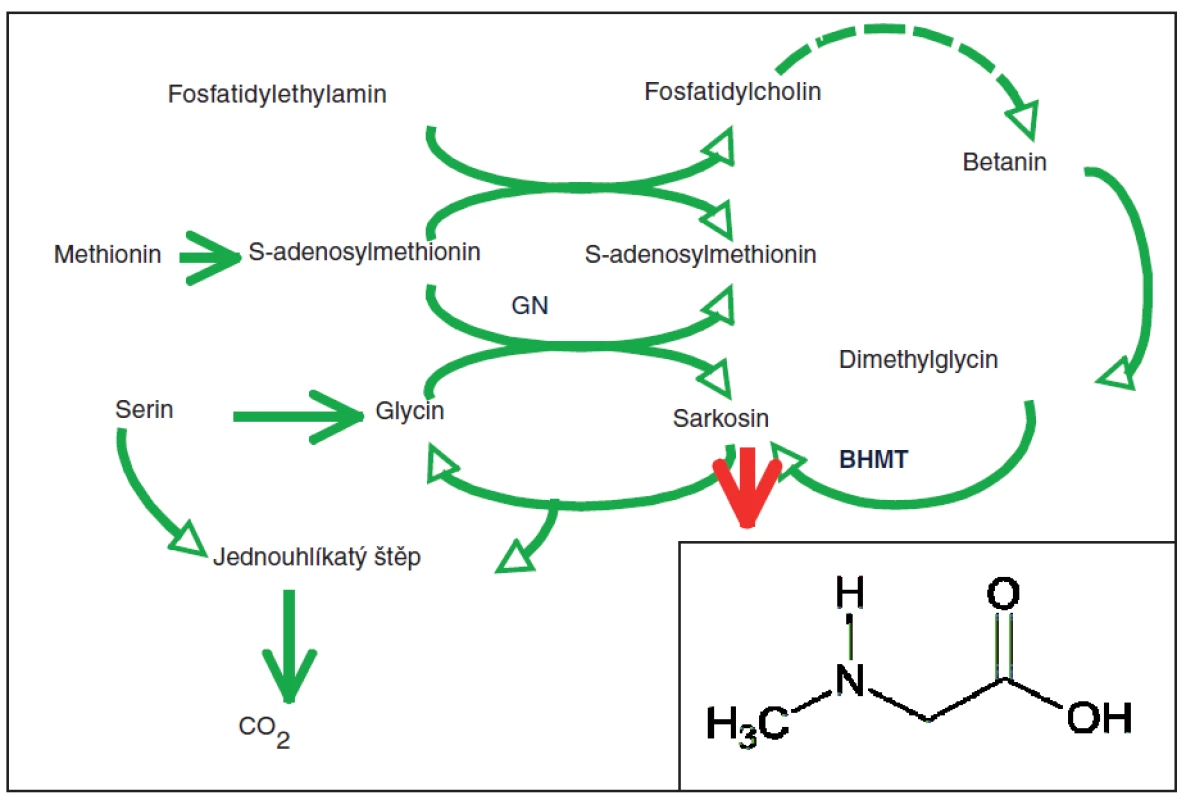
Na první dráze je fosfatidylethylamin opakovaně methylován pomocí S-adenosylmethioninem až na fosfatidylcholin za výtěžku betainu, který je následně přeměněn na sarkosin pomocí enzymu homocystein methyltransferasy (BHMT). Na další dráze, je sarkosin formován při transformaci methylové skupiny S-adenosylmethioninu na glycin za účasti enzymu glycin Nmethyltransferázy (GNMT) (převzato z Mitchell et al.: (43) a upraveno). Materiál a metody
Biologické vzorky
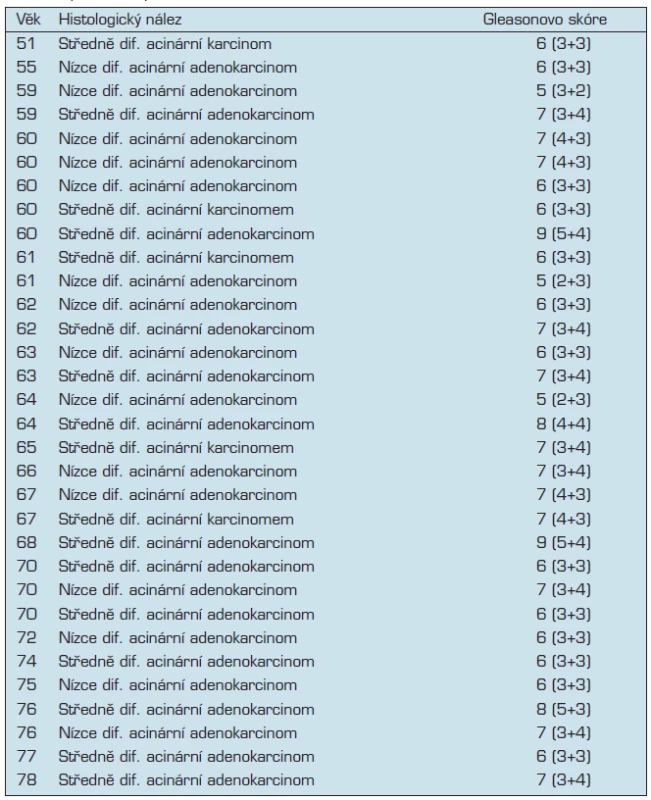
Pro analýzu sarkosinu bylo použito celkem 55 vzorků mužské moči; 23 kontrolních vzorků a 32 vzorků od pacientů s nádory prostaty (z Urologické kliniky FN U sv. Anny) podrobnosti jsou uvedeny v tabulce č. 1.
Všechny biologické vzorky byly použity se souhlasem etické komise Lékařské fakulty Masarykovy univerzity v Brně. Před analýzou sarkosinu pomocí kapalinové chromatografie byly vzorky 10x naředěny v pufru (Thidioglikol – 5 ml, N3Na – 0,10 g, NaCl – 11,50 g a C6H8O7 – 14 g /na 1000 ml) a následně promíchány na Wortexu (Wortex Genie) a uchovány při 4 °C. Sarkosin byl detekován pomocí přístroje AAA 400 od firmy INGOS (Praha, Česká republika). Přístroj pracuje na principu středotlaké kapalinové chromatografie s ionexovou kolonou, ninhydrinovou derivatizací a fotometrickou detekcí. Pro samotnou analýzu byla použita gradientová eluce.
Statistické hodnocení
K posouzení normálního rozložení dat byl použit Shapiro-Wilk test. K porovnání hladiny sarkosinu mezi skupinami byl použit neparametrický Mann-Whitney U test. Pro identifikaci souvislostí mezi hladinou sarkosinu a věkem byl stanoven Pearsonův korelační koeficient. Hladina významnosti k zamítnutí nulové hypotézy pro všechny byla stanovena na p < 0,001.
Metodika hodnocení
Z literatury je zřejmé, že koncentrace sarkosinu v moči zdravého jedince je velmi nízká a pro řadu metod téměř pod limitem detekce. Proto se obecně uznává fakt, že u zdravého člověka je koncentrace sarkosinu nulová. Možnost využití sarkosinu jako markeru karcinomu prostaty je tedy velmi zvažována (34, 49–52). Veškeré zaznamenané hodnoty pod limitem detekce tedy byly považovány za fyziologické . Hodnoty koncentrace sarkosinu v rozmezí od 50 nM výše byly označeny jako patologický nález.
Výsledky
V biologických vzorcích je vždy řešenou otázkou složitost matrice a vysoké koncentrace jak organických, tak anorganických látek. Pro analýzu je důležitá esenciální příprava vzorků. V této studii byla použita iontově výměnná kapalinová chromatografie ve spojení s post kolonovou derivatizací pomocí ninhydrinu (53). Komplexní bioanalytickou studii jsme uskutečnili dříve a získané výsledky jsme popsali v práci Cernei et al. (54).
V této studii bylo hodnoceno 32 pacientů trpících acinárním karcinomem s průměrným věkem 65 let. Ve většině případů se jedná o skupinu s rizikovým GS – Gleason skóre (hodnota 5–7), které udává architektonické rozložení nádorových ložisek. Ve studii jsou však zahrnuti 4 pacienti, jejichž GS se pohybuje v rozmezí 8–9, tedy s velmi špatnou prognózou. V naší studii jsme potvrdili, že koncentrace sarkosinu ve vzorcích moči pacientů s diagnostikovaným zhoubným nádorem prostaty jsou detekované v rozmezí 100 až 500 μM a průměrnou koncentrací 505 ± 410 μM. Koncentrace sarkosinu u zdravých osob byla pod limitem detekce metody. Data nemají normální rozložení (Shapiro-Wilk p = 0,4), k dalšímu zhodnocení byl proto zvolen neparametrický U test tab. 2. Na základě získaných výsledků lze soudit, že hladina sarkosinu u mužů s pozitivní diagnózou karcinomu prostaty je signifikantně zvýšena ve srovnání s hladinou u kontrolních testovaných močí (p < 0,001). V souboru pacientů byla dále zjištěna silná závislost mezi věkem pacientů a hladinou sarkosinu v moči – snižující se hladina se zvyšujícím se věkem (korelační koeficient r = -0,88 při p < 0,001). Zjištěné zvýšení hladiny oproti kontrolní skupině naznačuje, že detekce sarkosinu může mít potenciální význam v diagnostice zhoubného nádoru prostaty. Problematice se nadále intenzivně věnujeme a připravujeme rozsáhlejší studii.
Tab. 2. Hladina sarkosinu v moči pacientů. 
* hladina p pro Mann-Whitney U test.
Diskuze
V současnosti se začínají objevovat nové metody pro spolehlivou detekci sarkosinu z moče jak zdravých lidí, tak i trpících nádorovým onemocněním prostaty s cílem potvrzení či vyvrácení sarkosinu jako markeru rakoviny prostaty. Velmi dobré výsledky stanovení sarkosinu z moče přináší plynová chromatografie s hmotnostní detekcí. Metoda je zde natolik citlivá, že umožňuje stanovit sarkosin ve velmi nízkých koncentracích (211 ng.ml-1) (51), avšak tato metoda neumožňuje rozlišení sarkosinu od jeho izomeru, a alaninu, který je chemicky velmi podobný a může proto přinášet nesprávné, falešně pozitivní výsledky. Proto se další studie zaměřují na přípravu vzorků a to pomocí extrakce na tuhé fázi (SPE). Soliman et al dokázali pomocí SPE extrakce a kapilární elektroforézy s hmotnostní spektrometrií (CE–ESI-MS/MS) dosáhnout limit detekce metody 0,017 μM a separaci sarkosinu od jeho isoforem. Pomocí této metody byly následně analyzovány vzorky moče zdravých osob ve kterých nebyl detekován sarkosin (55). Tyto výsledky tedy korespondují s naším tvrzením, že sarkosin není přítomen v moči zdravých lidí.
Zvýšená hladina sarkosinu by tak mohla být využitelná pro diagnostiku velice agresivních forem karcinomu prostaty (56). Přítomnost sarkosinu v moči, který s vysokou pravděpodobností signalizuje přítomnost nádoru, může ulehčit včasnou diagnózu a hlavně usnadnit popsání agresivních forem onemocnění (57). V této pilotní studii zjištěná klesající tendence sarkosinu v závislosti na věku pacientů si žádá další ověření na větším souboru pacientů. Tuto korelaci, která dosud nebyla v literatuře popsána, je žádoucí zdůvodnit nalezením dalších souvislostí mezi klinicko-patologickými daty. I přes stále otevřené využití sarkosinu jako nádorového markeru (47) je potřebné jeho roli u v procesu zhoubného bujení detailně studovat.
Závěr
Naše pilotní výsledky prokazují spojitost mezi zvýšenou koncentrací sarkosinu a diagnostikovaným nádorovým onemocněním prostaty. Z výsledků je patrné, že prezentovaná metoda je využitelná ke stanovení sarkosinu jako jednoho z potenciálních markerů nádorového onemocnění prostaty. Hlavní výhodou této metody je její citlivost a robustnost. Vysokou přidanou hodnotou je možnost orientačního stanovení sarkosinu již ze vzorku ranní moči. Analýza jednoho vzorku trvá celkem 45 minut.
Poděkování
Práce na tomto projektu byla podpořena projekty CEITEC CZ.1.05/1.1.00/02. 0068 a NANOSEMED GA AV KAN 208130801.
Korespondenční autor:
Prof. Ing. René Kizek, Ph.D.
Ústav chemie a biochemie a Středoevropský technologický institut v Brně
Mendelova univerzita
Zemědělská 1665/1
613 00 Brno – Černá Pole
E-mail: kizek@sci.muni.cz
Zdroje
1. Boyd, L.K., Mao, X.Y., Xue, L.Y. et al.: High-resolution genome-wide copy-number analysis suggests a monoclonal origin of multifocal prostate cancer. Gene Chromosomes Cancer, 2012, 51, p. 579–589.
2. Shimojo, H., Kobayashi, M., Kamigaito, T. et al.: Reduced glycosylation of alpha-dystroglycans on carcinoma cells contributes to formation of highly infiltrative histological patterns in prostate cancer. Prostate, 2011, 71, p. 1151–1157.
3. Chang, H.H., Chen, B.Y., Wu, C.Y. et al.: Hedgehog overexpression leads to the formation of prostate cancer stem cells with metastatic property irrespective of androgen receptor expression in the mouse model. J. Biomed. Sci. 2011, 18, p. 1–6.
4. Song, L.M., Zhu, Y.C., Han, P. et al.: A Retrospective Study: Correlation of histologic inflammation in biopsy specimens of Chinese men undergoing surgery for benign prostatic hyperplasia with serum prostate-specific antigen. Urology, 2011, 77, p. 688–692.
5. Astigueta, J.C., Abad, M.A., Morante, C. et al.: Characteristics of metastatic prostate cancer ocurring in patients under 50 years of age. Actas Urol. Esp. 2010, 34, p. 327–332.
6. Huang, C.N., Huang, S.P., Pao, J.B. et al.: Genetic polymorphisms in androgen receptor-binding sites predict survival in prostate cancer patients receiving androgen-deprivation therapy. Ann. Oncol. 2012, 23, p. 707–713.
7. Bjartell, A.: Genetic markers and the risk of developing prostate cancer. Eur. Urol. 2011, 60, p. 29–31.
8. Lindstrom, S., Schumacher, F.R., Cox, D. et al.: Common genetic variants in prostate cancer risk prediction-results from the NCI Breast and Prostate Cancer Cohort Consortium (BPC3). Cancer Epidemiol. Biomarkers Prev. 2012, 21, p. 437–444.
9. Fedewa, S.A., Etzioni, R., Flanders, W.D. et al.: Association of insurance and race/ethnicity with disease severity among men diagnosed with prostate cancer, National Cancer Database 2004-2006. Cancer Epidemiol. Biomarkers Prev. 2010, 19, p. 2437–2444.
10. Hall, M.J., Ruth, K., Giri, V.N.: Rates and predictors of colorectal cancer screening by race among motivated men participating in a prostate cancer risk assessment program. Cancer, 2012, 118, p. 478–484.
11. Vindrieux, D., Reveiller, M., Chantepie, J. et al.: Down-regulation of DcR2 sensitizes androgen-dependent prostate cancer LNCaP cells to TRAIL-induced apoptosis. Cancer Cell Int. 2012, 11, p. 1–14.
12. Paquet, S., Fazli, L., Grosse, L. et al.: Differential expression of the androgen-conjugating UGT2B15 and UGT2B17 enzymes in prostate tumor cells during cancer progression. J. Clin. Endocrinol. Metab. 2012, 97, p. E428–E432.
13. Tang, Y., Chen, Y.K., Jiang, H.M. et al.: Promotion of tumor development in prostate cancer by progerin. Cancer Cell Int. 2010, 10, p. 1–10.
14. Dhom, G. Pathology of benign and malignant prostate tumors. Urol.-Ausg. A. 1992, 31, p. W47-W55.
15. Catalona, W.J., Richie, J.P., Ahmann, F.R. et al.: Comparison of digital rectal examination and serum prostate-specific antigen in the early detection of prostate-cancer - results of a multicancer clinical - trial of 6,630. J. Urol. 1994, 151, p. 1283–1290.
16. Armstrong, A.J., Eisenberger, M.A., Halabi, S. et al.: Biomarkers in the management and treatment of men with metastatic castration-resistant prostate cancer. Eur. Urol. 2012, 61, p. 549–559.
17. Prensner, J.R., Rubin, M.A., Wei, J.T. et al.: Beyond PSA: The next generation of prostate cancer biomarkers. Sci. Transl. Med. 2012, 4, p.
18. van Vugt, H.A., Roobol, M.J., Busstra, M. et al.: Compliance with biopsy recommendations of a prostate cancer risk calculator. BJU Int. 2012, 109, p. 1480-1488.
19. Lattanzi, J., McNeely, S., Hanlon, A. et al.: Daily CT localization for correcting portal errors in the treatment of prostate cancer. Int. J. Radiat. Oncol. Biol. Phys. 1998, 41, p. 1079–1086.
20. Borin, J., Zhang, B., Siddiqui, K. et al.: Improved detection of prostate cancer using multi-parametric magnetic resonance imaging (MRI): Correlation of in vivo and ex vivo scans with whole mount histological sections. J. Endourol. 2007, 21, p. A29–A29.
21. Schoder, H., Larson, S.M.: Positron emission tomography for prostate, bladder, and renal cancer. Semin. Nucl. Med. 2004, 34, p. 274–292.
22. Bitencourt, A.G.V., Tyng, C.J., Pinto, P.N.V. et al.: Percutaneous biopsy based on PET/CT findings in cancer patients technique, indications, and results. Clin. Nucl. Med. 2012, 37, p. E95–E97.
23. Djavan, B., Zlotta, A., Remzi, M. et al.: Optimal predictors of prostate cancer on repeat prostate biopsy: A prospective study of 1,051 men. J. Urol. 2000, 163, p. 1144–1148.
24. Mundy, A.R., Andrich, D.E.: Posterior urethral complications of the treatment of prostate cancer. BJU Int. 2012, 110, p. 304–325.
25. Bolla, M., Gonzalez, D., Warde, P. et al.: Improved survival in patients with locally advanced prostate cancer treated with radiotherapy and goserelin. N. Engl. J. Med. 1997, 337, p. 295–300.
26. Zelefsky, M.J., Fuks, Z., Hunt, M. et al.: High dose radiation delivered by intensity modulated conformal radiotherapy improves the outcome of localized prostate cancer. J. Urol. 2001, 166, p. 876–881.
27. Bill-Axelson, A., Holmberg, L., Ruutu, M. et al.: Radical prostatectomy versus watchful waiting in early prostate cancer. N. Engl. J. Med. 2005, 352, p. 1977–1984.
28. Small, E.J., Vogelzang, N.J. Second-line hormonal therapy for advanced prostate cancer: A shifting paradigm. J. Clin. Oncol. 1997, 15, p. 382–388.
29. Sartor, A.O., Fitzpatrick, J.M.: Urologists and oncologists: adapting to a new treatment paradigm in castration-resistant prostate cancer (CRPC). BJU Int. 2012, 110, p. 328–335.
30. Fukushima, K., Satoh, T., Baba, S. et al.: Alpha 1,2-fucosylated and beta-N-acetylgalactosaminylated prostate-specific antigen as an efficient marker of prostatic cancer. Glycobiology. 2010, 20, p. 452–460.
31. Page, S.T., Hirano, L., Gilchriest, J. et al.: Dutasteride reduces prostate size and prostate specific antigen in older hypogonadal men with benign prostatic hyperplasia undergoing testosterone replacement therapy. J. Urol. 2011, 186, p. 191–197.
32. White, K.Y., Rodemich, L., Nyalwidhe, J.O. et al.: Glycomic characterization of prostate-specific antigen and prostatic acid phosphatase in prostate cancer and benign disease seminal plasma fluids. J. Proteome Res. 2009, 8, p. 620–630.
33. Mao, Q.Q., Zheng, X.Y., Jia, X.L. et al.: Relationships between total/free prostate-specific antigen and prostate volume in Chinese men with biopsy-proven benign prostatic hyperplasia. Int. Urol. Nephrol. 2009, 41, p. 761–766.
34. Jiang, Y.Q., Cheng, X.L., Wang, C.A. et al.: Quantitative determination of sarcosine and related compounds in urinary samples by liquid chromatography with tandem mass spectrometry. Anal. Chem. 2010, 82, p. 9022–9027.
35. Gumulec, J., Masařík, M., Křížková, S. a kol.: Bioanalytické studium nádorovych markerů karcinomu prostaty na úrovni RNA a proteinu. Prakt. Lék. 2011, 91, s. 469-474.
36. Xu, J.C., Stolk, J.A., Zhang, X.Q. et al.: Identification of differentially expressed genes in human prostate cancer using subtraction and microarray. Cancer Res. 2000, 60, p. 1677–1682.
37. Evans, A.J.: Alpha-Methylacyl CoA racemase (P504S): overview and potential uses in diagnostic pathology as applied to prostate needle biopsies. J. Clin. Pathol. 2003, 56, p. 892–897.
38. Rubin, M.A., Zhou, M., Dhanasekaran, S.M. et al.: Alpha-methylacyl coenzyme A racemase as a tissue biomarker for prostate cancer. JAMA 2002, 287, p. 1662-1670.
39. Rigau, M., Morote, J., Mir, M.C. et al.: PSGR and PCA3 as biomarkers for the detection of prostate cancer in urine. Prostate, 2010, 70, p. 1760–1767.
40. Cao, D.L., Ye, D.W., Zhang, H.L. et al.: A multiplex model of combining gene-based, protein-based, and metabolite-based with positive and negative markers in urine for the early diagnosis of prostate cancer. Prostate 2011, 71, p. 700–710.
41. Jamaspishvili, T., Kral, M., Khomeriki, I. et al.: Urine markers in monitoring for prostate cancer. Prostate Cancer Prostatic Dis. 2010, 13, p. 12–19.
42. Sreekumar, A., Poisson, L.M., Rajendiran, T.M. et al.: Metabolomic profiles delineate potential role for sarcosine in prostate cancer progression. Nature. 2009, 457, p. 910-914.
43. Mitchell, A.D., Benevenga, N.J.: Importance of sarcosine formation in methionine methyl carbon oxidation in rat. J. Nutr. 1976, 106, p. 1702–1713.
44. Masarik, M., Gumulec, J., Cernei, N. et al.: Sarcosine as a new marker for prostate tumours. Int. J. Mol. Med. 2010, 26, p. S47–S47.
45. Issaq, H.J., Veenstra, T.D. Is sarcosine a biomarker for prostate cancer? J. Sep. Sci. 2011, 34, p. 3619–3621.
46. Jain, M., Nilsson, R., Sharma, S. et al.: Metabolite profiling identifies a key role for glycine in rapid cancer cell proliferation. Science. 2012, 336, p. 1040–1044.
47. Struys, E.A., Heijboer, A.C., van Moorselaar, J. et al.: Serum sarcosine is not a marker for prostate cancer. Ann. Clin. Biochem. 2010, 47, p. 282–282.
48. Dahl, M., Bouchelouche, P., Kramer-Marek, G. et al.: Sarcosine induces increase in HER2/neu expression in androgen-dependent prostate cancer cells. Mol. Biol. Rep. 2011, 38, p. 4237–4243.
49. Wu, H., Liu, T.T., Ma, C.G. et al.: GC/MS-based metabolomic approach to validate the role of urinary sarcosine and target biomarkers for human prostate cancer by microwave-assisted derivatization. Anal. Bioanal. Chem. 2011, 401, p. 635–646.
50. Meyer, T.E., Fox, S.D., Issaq, H.J. et al.: A Reproducible and High-Throughput HPLC/MS Method To Separate Sarcosine from alpha - and beta-Alanine and To Quantify Sarcosine in Human Serum and Urine. Anal. Chem. 2011, 83, p. 5735–5740.
51. Cavaliere, B., Macchione, B., Monteleone, M. et al.: Sarcosine as a marker in prostate cancer progression: a rapid and simple method for its quantification in human urine by solid-phase microextraction-gas chromatography-triple quadrupole mass spectrometry. Anal. Bioanal. Chem. 2011, 400, p. 2903–2912.
52. Jentzmik, F., Stephan, C., Miller, K. et al.: Sarcosine in urine after digital rectal examination fails as a marker in prostate cancer detection and identification of aggressive tumours. Eur. Urol. 2010, 58, p. 12–18.
53. Garner, R.C., Whattam, M.M., Taylor, P.J.L. et al.: Analysis of United-Kingdom purchased species for aflatoxins using an immunoaffinity column cleanup procedure followed by high-performance liquid-chromatography analysis and postcolumn derivatization with pyridinium bromide perbromide. J. Chromatogr. 1993, 648, p. 485–490.
54. Cernei, N., Zitka, O., Ryvolova, M. et al.: Spectrometric and electrochemical analysis of sarcosine as a potential prostate carcinoma marker. Int. J. Electrochem. Sci. 2012, 7, p. 4286–4301.
55. Solimana, L.C., Huia, Y., Hewavitharanab, A.K. et al.: Monitoring potential prostate cancer biomarkers in urine by capillary electrophoresis–tandem mass spectrometry. J. Chromatogr. A. 2012, doi.org/10.1016/j.chroma.2012.07.021.
56. Chen, X.F., Overcash, R., Green, T. et al.: The tumor suppressor activity of the transmembrane protein with epidermal growth factor and two follistatin motifs 2 (TMEFF2) correlates with its ability to modulate sarcosine levels. J. Biol. Chem. 2011, 286, p. 96–110.
57. Cao, D.L., Ye, D.W., Zhu, Y. et al.: Efforts to resolve the contradictions in early diagnosis of prostate cancer: a comparison of different algorithms of sarcosine in urine. Prostate Cancer Prostatic Dis. 2011, 14, p. 166–172.
Štítky
Praktické lékařství pro děti a dorost Praktické lékařství pro dospělé
Článek Jubilea
Článek vyšel v časopisePraktický lékař
Nejčtenější tento týden
2012 Číslo 8- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
-
Základy kognitivní, afektivní a sociální neurovědy
XXII. Freud 2012 - Přehled doporučení pro předpis pohybové aktivity v primární prevenci onemocnění
- Nanočástice a nanostruktury v biomedicínských aplikacích
- Sarkosin v moči pacientů se zhoubným nádorem prostaty
- K čemu slouží elektronické cigarety? Aktuální poznatky pro praxi
- Intersticiální plicní procesy a postižení bronchiolů
- Marihuana: rizika a krátká intervence
- Měření kvality života u seniorů s demencí
- Dlouhodobá prognóza pacientů hospitalizovaných pro akutní srdeční selhání
- Praktičtí lékaři jsou nepostradatelným článkem veřejného zdravotnictví
- Odběr, transport a zpracování biologických materiálů ke stanovení návykových látek
- XVI. medzinárodný kongres pre výživu a metabolizmus pri chorobách obličiek
- Lékař a spisovatel František Langer
- Syllaba Ladislav – profesor interny
- Jubilea
-
Základy kognitivní, afektivní a sociální neurovědy
- Praktický lékař
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Marihuana: rizika a krátká intervence
- Intersticiální plicní procesy a postižení bronchiolů
- Přehled doporučení pro předpis pohybové aktivity v primární prevenci onemocnění
- Sarkosin v moči pacientů se zhoubným nádorem prostaty
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání