-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Kompartmentová chirurgia jazyka
Compartmental tongue surgery
Introduction: Compartmental tongue surgery is a surgical method that aims at removing of the tumor-affected half of the tongue and the regional lymph nodes en bloc in a standardized way to decrease an option of the locoregional recurrence. Material and methods: Description of the surgical technique, review of the literature and our first experience in the group of 11 patients is presented. Results: Out of 11 patients, 9 males and 2 females, with disease of the clinical stage I–IV, locoregional control has been achieved in 9 patients (81.8%). One female had a local recurrence, 1 female a regional recurrence. Five patients died, one female patient with regional recurrence, 2 patients with distant metastases, 1 patient due to duplex malignancy and 1 patient due to other reasons. R0 resection was detected in 8 patients and the other 3 patients had a close resection margin at different stages of the disease. The postoperative defect was reconstructed in 10 patients with an infrahyoid myocutaneous pedicled flap and in 1 patient with pectoralis myocutaneous flap. Conclusions: Compartment tongue surgery in indicated cases seems to be a good method for achievement of the locoregional control of the disease and negative margins. The data need to be confirmed on a larger group of patients with evaluation of other, particularly functional, parameters.
Keywords:
glossectomy – tongue cancer – tongue surgery
Autoři: M. Almaši
Působiště autorů: ORL oddelenie, Východoslovenský onkologický ústav, a. s., Košice
Vyšlo v časopise: Otorinolaryngol Foniatr, 71, 2022, No. 4, pp. 202-209.
Kategorie: Původní práce
doi: https://doi.org/10.48095/ccorl2022202Souhrn
Úvod: Kompartmentová chirurgia pri karcinóme jazyka je chirurgická metóda, ktorej cieľom je štandardizovane odstrániť nádorom postihnutú polovicu jazyka a regionálne krčné lymfatické uzlíny vcelku, a tým znížiť možnosť vzniku lokoregionálnej recidívy. Materiál a metodika: V práci je popísaná chirurgická technika, prehľad literatúry a prezentácia prvých skúseností na súbore 11 pacientov. Výsledky: Z 11 pacientov, 9 mužov a 2 žien s ochorením I.–IV. klinického štádia, sa lokoregionálna kontrola dosiahla u 9 pacientov (81,8 %). Jedna pacientka mala lokálnu recidívu, 1 pacientka regionálnu recidívu. Piati pacienti zomreli, 1 pacientka s regionálnou recidívou, 2 pacienti so vzdialenými metastázami, 1 pacient na metachrónnu duplexnú malignitu a 1 pacient na inú príčinu. R0 resekcia bola u 8 pacientov a blízky resekčný okraj mali ostatní 3 pacienti v rôznych štádiách ochorenia. Pooperačný defekt sa rekonštruoval u 10 pacientov infrahyoidným muskulokutánnym stopkatým lalokom a u 1 pacienta pektorálnym muskulokutánnym stopkatým lalokom. Záver: Kompartmentová chirurgia jazyka sa v indikovaných prípadoch javí ako dobrá metóda na dosiahnutie lokoregionálnej kontroly a negatívnych okrajov. Údaje je potrebné potvrdiť na väčšom súbore pacientov so zhodnotením aj ďalších, najmä funkčných parametrov.
Klíčová slova:
glosektómia – karcinóm jazyka – chirurgia jazyka
Úvod
Chirurgická liečba karcinómu jazyka je v súčasnosti prvou voľbou vo všetkých štádiách ochorenia. Vo včasných štádiách majú síce resekcia nádoru a samostatná rádioterapia podobné výsledky v prežívaní, ale kumulovaná analýza onkologických a funkčných výsledkov preferuje chirurgiu pred ožarovaním [1, 2]. Pri pokročilých štádiách, postihnutí regionálnych lymfatických uzlín a pozitívnych chirurgických okrajoch sa prognóza ochorenia výrazne zhoršuje, čo si vyžaduje kombinovanú liečebnú stratégiu s využitím chirurgickej aj onkologickej liečby [3, 4].
Donedávna neexistovala presne zadefinovaná chirurgická liečba karcinómu jazyka. Tzv. široká excízia nádoru s dostatočným makroskopickým resekčným okrajom sa robila podľa skúseností a preferencií daného pracoviska. Podobne neštandardizovane sa postupovalo pri blokových krčných disekciách, ktoré sa niekde robili en bloc spolu s resekciou jazyka, inde oddelene. Snahu o zavedenie jednotného, anatomicky zadefinovaného konceptu publikovali Calabrese et al. roku 2009 [5]. Inšpirovali sa kompartmentovou chirurgiou sarkómov, ktorú aplikovali na telo jazyka, rozdelené na dve oddelené polovice s presným ohraničením a kontinuálnym prepojením s lymfatickým systémom. Tento koncept, ktorého cieľom bolo zníženie lokoregionálnej recidívy karcinómu jazyka, pomenovali kompartmentová chirurgia jazyka (compartmental tongue surgery – CTS). Vďaka prijatiu CTS ako liečebného štandardu hlavne lokálne pokročilých nádorov, postihujúcich ipsilaterálne vnútorné a vonkajšie svaly jazyka, ako aj jej sľubným onkologickým výsledkom bez významného funkčného deficitu sa CTS dostala do navrhovanej klasifikácie glosektómií [6] ako glosektómia typ IIIB (compartmental hemiglossectomy) (obr. 1).
Obr. 1. Schéma kompartmentovej hemiglosektómie – glosektómia typ IIIB (upravené podľa Ansarin et al. [6]).
Fig. 1. Drawing of the compartmental hemiglossectomy – glossectomy type IIIB (adjusted according to Ansarin et al. [6]).![Schéma kompartmentovej hemiglosektómie
– glosektómia typ IIIB
(upravené podľa Ansarin et al. [6]).<br>
Fig. 1. Drawing of the compartmental
hemiglossectomy – glossectomy
type IIIB (adjusted according to Ansarin
et al. [6]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/3c6e79744d840ce17518b72adfe53b55.jpg)
Cieľom CTS je znížiť možnosť lokálnej recidívy, eliminovať resekciu s pozitívnym okrajom a taktiež prítomnosť satelitných lézií alebo mikrometastáz v regionálnych lymfatických uzlinách. To možno dosiahnuť, ak sa disekcia uzlín urobí spolu s kompartmentovou hemiglosektómiou v presne definovaných anatomických hraniciach.
Opis chirurgickej techniky
Samotnej operácii predchádza dôkladné predoperačné zhodnotenie a doporučenie liečby na základe histologického vyšetrenia, určenia rozsahu a štádia ochorenia pomocou klinického vyšetrenia, zobrazovacích metód, ako MR (obr. 2), prípadne CT, vylúčenie vzdialených metastáz, posúdenie compliance pacienta, výkonnostného stavu a stavu jeho výživy, ako aj informovaný súhlas pacienta so všetkými plánovanými operačnými výkonmi.
Obr. 2. MR pacienta s karcinómom hrany a tela jazyka vľavo (šípka) indikovaného na CTS.
Fig. 2. MRI of the patient with carcinoma of the tongue margin and body (arrow) indicated for CTS.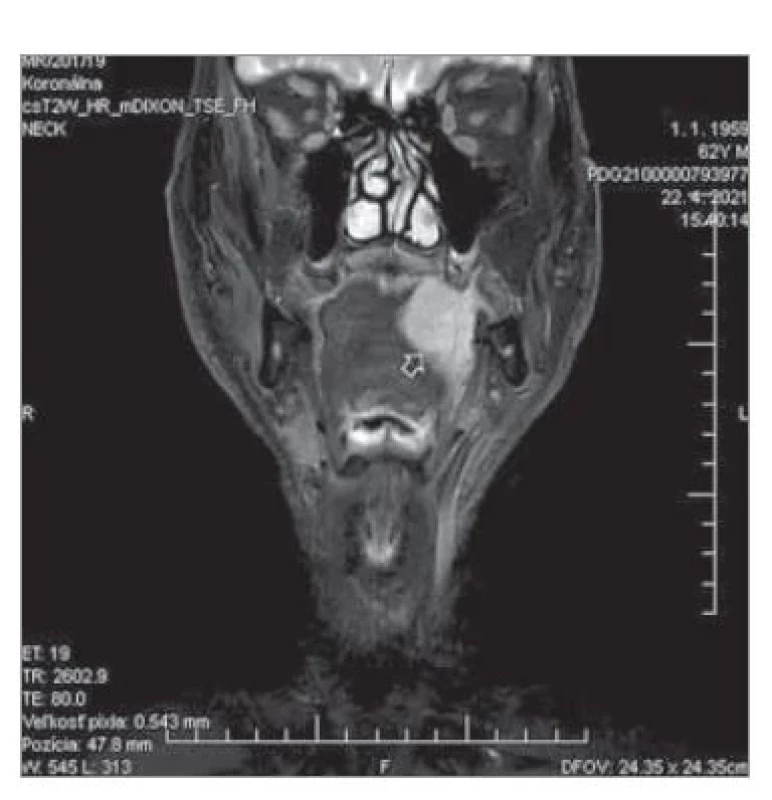
Operáciu možno začať zaisťovacou tracheotómiou v lokálnej alebo celkovej anestézii a zavedením nazogastrickej sondy. Vzhľadom ku použitej rekonštrukčnej technike sa na našom pracovisku tracheotómia robí pred ukončením operácie. Kožná incízia sa volí podľa prístupu, či výkon bude robený technikou „pull through“, alebo cez paramediálnu mandibulotómiu. Ak sa používa pri rekonštrukcii miestny stopkatý lalok (infrahyoidný, submentálny, platyzmálny a i.), možno incíziu upraviť podľa typu použitého laloka (obr. 3). V takom prípade je potrebné si najprv pripraviť lalok, aby sa neskoršou preparáciou nenarušila jeho stopka. Disekcia pokračuje spôsobom zdola nahor, teda z krku do dutiny ústnej. Najprv sa urobí ipsilaterálna krčná bloková disekcia I–IV a disekát sa ponechá pripojený ku spodine ústnej fibroadipóznym glandulárno-stromálnym mostíkom, ktorý obsahuje sublinguálnu žľazu, linguálny nerv, vénu a fibrózno-lymfatické tkanivo, spájajúce primárny tumor s krčným lymfatickým systémom. Tento mostík sa nazýva T-N trakt [3, 5]. Následne sa z krčného prístupu odpoja od svojich odstupov a úponov jednotlivé svaly – m. mylohyoideus a hyoglossus od hyoidu, a ak sú infiltrované, aj m. stylohyoideus a m. geniohyoideus. Oba mm. mylohyoidei sa v strednej čiare natupo oddelia, čím sa umožní preniknúť medzi mm. geniohyoidei a genioglossi v rovine septa smerom dozadu a prepalpovať hranice tumoru zvnútra. Identifikuje sa ipsilaterálna a. lingualis a n. hypoglossus a prerušia sa v blízkosti hyoidu. Takto je zdola zabezpečený perfektný prístup až ku valekulám a koreňu jazyka. M. mylohyoideus sa odpojí od svojho odstupu na mandibule a n. lingualis sa pretne čo najbližšie ku báze lebky a taktiež m. styloglossus čo najbližšie ku processus styloideus. Pokračuje sa intraorálne ponechaním manžety sliznice spodiny ústnej približne 5 mm širokej paramandibulárne, kvôli neskoršej rekonštrukcii, ak to umožňuje rozsah tumoru. Pretne sa ipsilaterálny m. genioglossus od symfýzy a pokračuje sa hemiglosektómiou opäť zdola nahor, čím sa oba prístupy prepoja. Špičku jazyka, ak je dostatočne ďaleko od okrajov tumoru, možno ponechať. Po oddelení v oblasti septa a anterolaterálne pozdĺž mandibuly možno resekovanú polovicu jazyka spustiť nadol na krk (tzv. pull through alebo mandibular lingual release prístup) (obr. 4) a bezpečne dokončiť disekciu vzadu. Ak je nádor lokalizovaný veľmi laterálne a vzadu, je vhodnejšie použiť transmandibulárny prístup. Po dokončení hemiglosektómie je celý preparát odstránený (obr. 5), urobená vizuálna kontrola okrajov a pri pochybnosti o ich dostatočnosti aj rýchla peroperačná histológia.
Obr. 3. Vyznačenie kožnej incízie s dizajnom kožného ostrova infrahyoidného laloka.
Fig.3 Outline of the skin incision with the skin island design of the infrahyoid flap.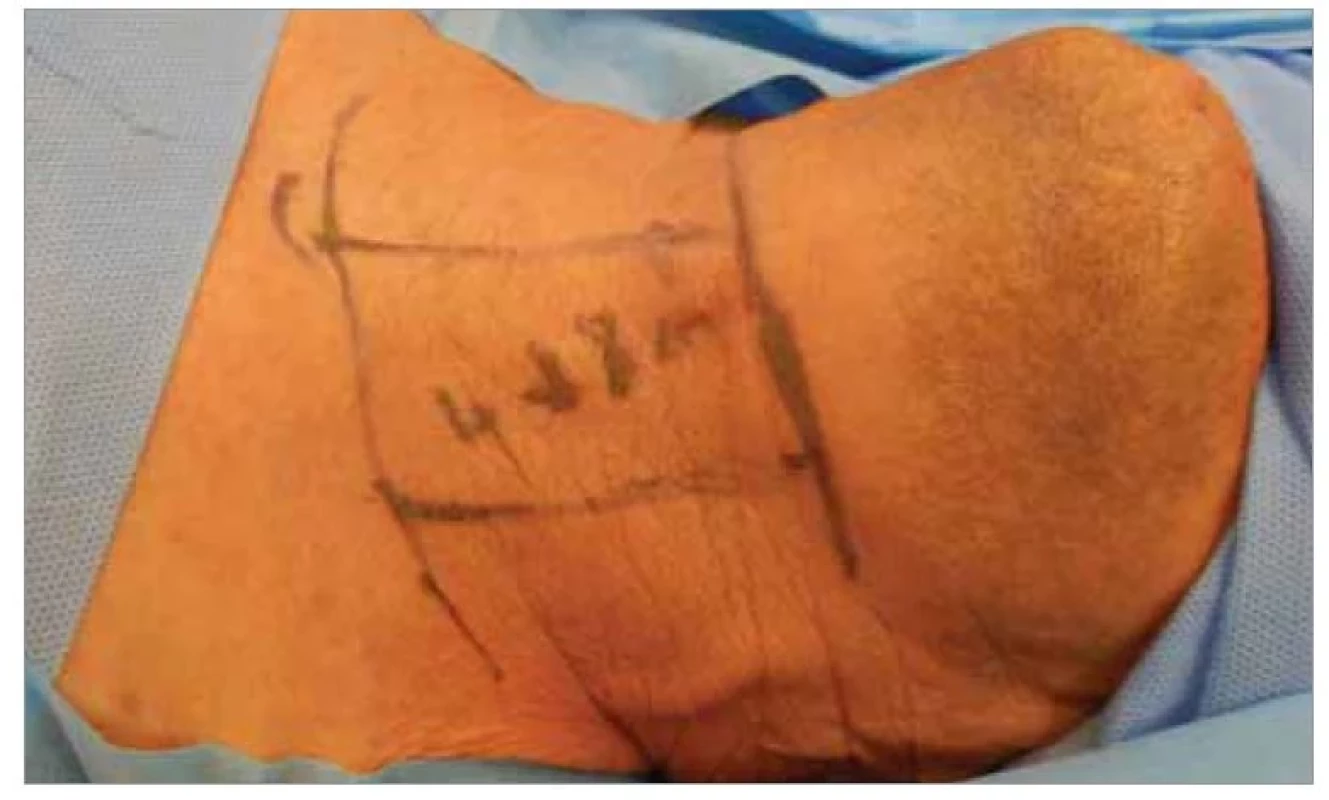
Obr. 4. Pull through fáza operácie. Preparát polovice jazyka s tumorom (ostré šípky) uvoľnený smerom nadol na krk, spojený s oblasťou I (hviezdička). Infrahyoidný lalok uvoľnený a pripravený pre rekonštrukciu (šípka).
Fig. 4. Pull through phase of the operation. Specimen of the hemitongue with tumor (arrowheads) released down to the neck , attached to level I (asterisk). Infrahyoid flap raised and prepared for reconstruction (arrow).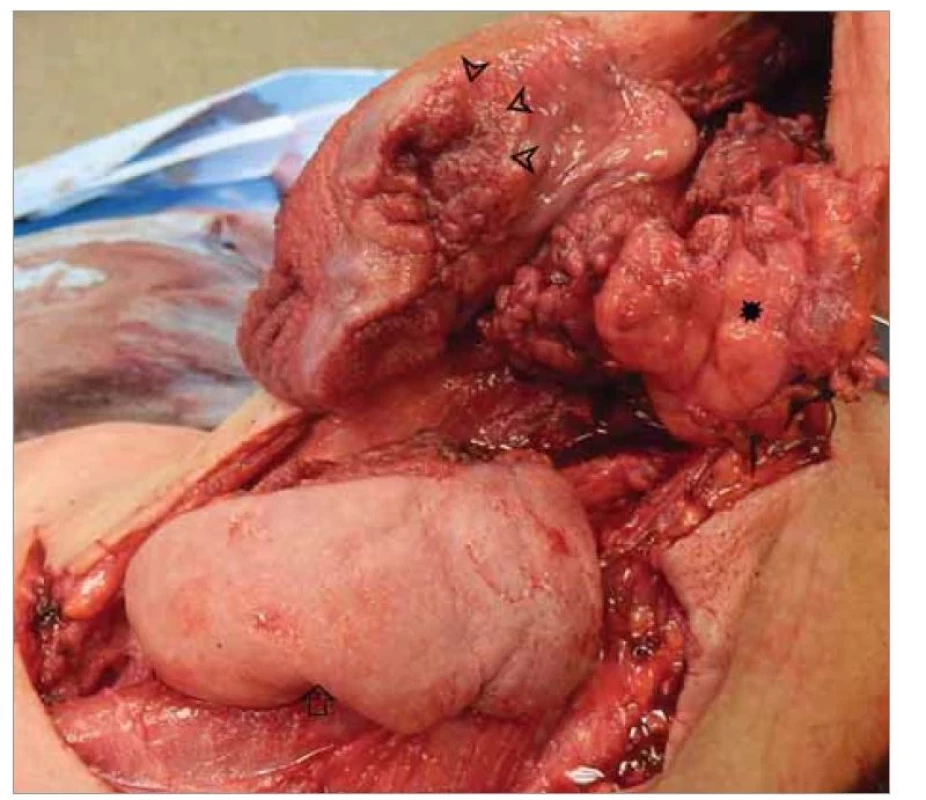
Obr. 5. Preparát polovice jazyka s tumorom a blokového disekátu spojených T-N traktom.
Fig. 5. Specimen of the hemitongue with tumor attached to the neck dissection specimen by T-N tract.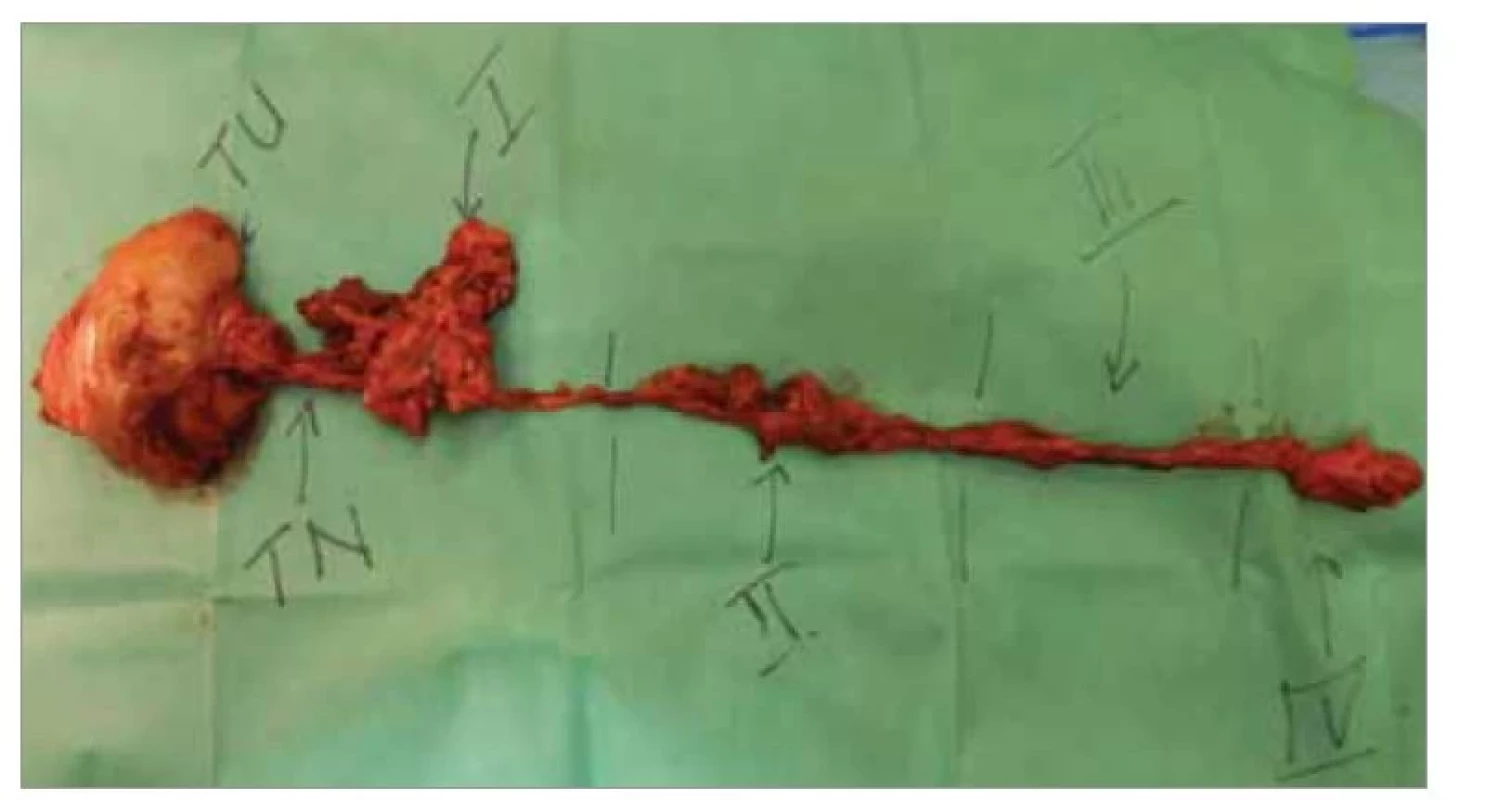
Na rekonštrukciu sa v súčasnosti najčastejšie využíva mikrovaskulárny anterolaterálny lalok zo stehna (ALT). Na našom pracovisku s úspechom využívame stopkaté laloky – infrahyoidný muskulokutánny lalok (obr. 6) alebo pektorálny muskulokutánny lalok.
Obr. 6. Výsledný stav CTS s rekonštrukciou infrahyoidným lalokom vpravo 2 mesiace po operácii.
Fig. 6. Outcome of CTS with infrahyoid flap reconstruction on the right 2 months after operation.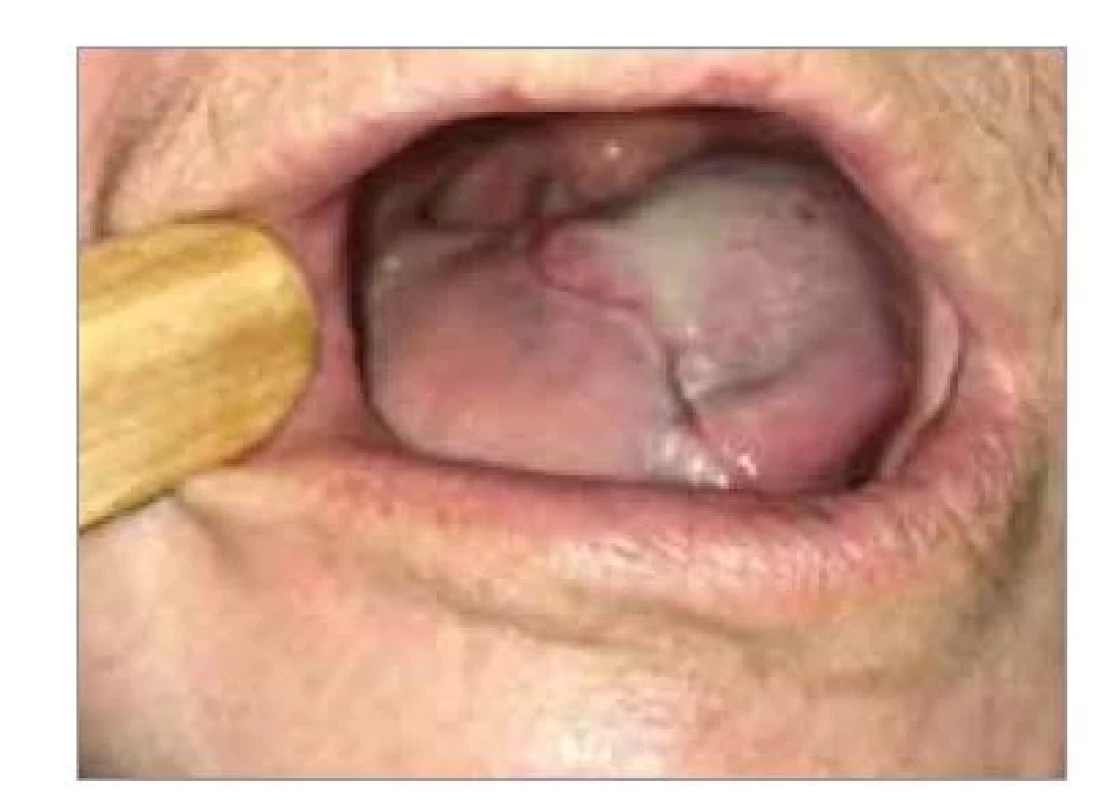
Materiál a metodika
Prospektívna štúdia analyzuje pilotný súbor 11 pacientov, operovaných technikou CTS za obdobie 2016–2020. Sledované parametre boli pohlavie, vek, lokalita nádoru, histológia, pTpN klasifikácia, rozsah chirurgického výkonu, adjuvantná onkologická liečba, primárna alebo záchranná operácia, resekčné okraje, prítomnosť recidívy po liečbe, doba sledovania, celkové prežívanie, prežívanie na základné ochorenie, komplikácie po liečbe, doba trvania tracheotómie a zavedenia nazogastrickej sondy, resp. PEG, doba hospitalizácie. Všetci pacienti boli o charaktere operácie a jej rozsahu poučení, čo potvrdili podpisom informovaného súhlasu.
Výsledky
Z 11 operovaných pacientov boli 9 muži a 2 ženy, vo veku od 55–72 rokov, vekový medián bol 63 rokov. Všetci pacienti mali urobenú CTS s blokovou krčnou disekciou. Jeden pacient mal obojstrannú blokovú disekciu a 1 pacient superselektívnu blokovú disekciu oblasti I. Išlo o pacienta s recidívou a po predošlej resekcii tumoru jazyka s ipsilaterálnou blokovou disekciou oblastí II–V. Desať pacientov bolo operovaných z kombinovaného transorálno-transcervikálneho prístupu (pull-through), 1 pacient s recidívou a šírením nádora na laterálnu stenu dutiny ústnej a orofaryngu bol operovaný z transmandibulárneho prístupu. Dvaja pacienti mali urobenú marginálnu mandibulektómiu. Osem pacientov bolo operovaných primárne a 3 pacienti pre recidívu po predošlej onkologickej liečbe. U 10 pacientov bol pri rekonštrukcii použitý infrahyoidný muskulokutánny stopkatý lalok, u 1 pacienta muskulokutánny stopkatý lalok z m. pectoralis maior. Jeden pacient mal včasnú pooperačnú komplikáciu, arteriálne krvácanie z vetvičky druhostrannej a. lingualis dorsalis na 3. pooperačný deň, vyžadujúcu si revíziu a ligatúru cievy. Traja pacienti mali čiastočnú nekrózu kožného ostrova infrahyoidného laloka, vyžadujúcu si len lokálny debridement, bez potreby revízie v celkovej anestézii a opätovnej rekonštrukcie defektu.
U všetkých pacientov bol histologicky potvrdený skvamocelulárny karcinóm p16 negatívny, G1–2, prevažne hrany a tela jazyka, u 7 pacientov vpravo, u 4 vľavo. Štyri pacienti mali šírenie nádora aj na spodinu ústnu, z toho 1 pacient aj retromolárne. Dvaja pacienti mali I. štádium a 2 II. štádium ochorenia. U 6 pacientov sa zistilo III. štádium ochorenia a IVA štádium bolo u 1 pacienta. Dvaja pacienti mali pT1 štádium, 3 pT2 štádium a 6 pacienti pT3 štádium ochorenia. pN1 štádium sa zistilo u 4 pacientov a pN2 u 1 pacienta. Žiadny pacient nemal resekciu s pozitívnym chirurgickým resekčným okrajom. U 8 pacientov bola R0 resekcia, u ostatných 3 pacientov sa zistil blízky laterálny resekčný okraj (1,5–4 mm).
Lokoregionálna recidíva sa rozvinula u oboch pacientiek, ďalší 2 pacienti mali recidívu základného ochorenia v pľúcach. Interval sledovania pacientov bol od 7 mesiacov do 33 mesiacov. Celkové prežívanie pacientov bolo 54,5 %, prežívanie pri základnom ochorení 66,6 %, lokoregionálna kontrola 81,8 %. V skupine 8 pacientov po primárnej chirurgickej liečbe bola lokoregionálna kontrola 87,5 %, v skupine 3 pacientov po záchrannej liečbe bola lokoregionálna kontrola 66,6 %. Jedna pacientka zomrela na regionálnu recidívu, 2 pacienti na vzdialené metastázy v pľúcach. Všetci traja pacienti mali ochorenie v III. štádiu, pacientka bola predtým liečená na ipsilaterálny duplex karcinóm hypofaryngu rádioterapiou. Jeden pacient zomrel na duplexný karcinóm pľúc, u 1 pacienta sa príčina smrti nezistila. Jedna pacientka s lokálnou recidívou v oblasti tonzilárneho lôžka prežíva 30 mesiacov, absolvovala II. sériu rádioterapie v kombinácii s Erbituxom, bez známok pokračovania ochorenia, ale so vznikom osteorádionekrózy ramena sánky. Adjuvantná rádioterapia bola indikovaná u 3 pacientov s pT3 a pN1–N2b, rádioterapia spolu s chemoterapiou u 1 pacienta s pT3pN0 a blízkym laterálnym resekčným okrajom. Tracheotómia bola zrušená u všetkých pacientov priemerne na 11. deň (6–35. deň), nazogastrická sonda bola u 8 pacientov odstránená priemerne na 14. deň (7–30. deň). Traja pacienti s komplikovaným hojením potrebovali PEG, maximálna zdokumentovaná doba potreby PEG bola 11 mesiacov. Všetci traja pacienti si už PEG dali zrušiť. Priemerná doba hospitalizácie bola 18,9 dní (14–29 dní). Prezentácia súboru pacientov je v tab. 1.
Tab. 1. Prezentácia súboru pacientov.
Tab. 1. Presentation of the patient file.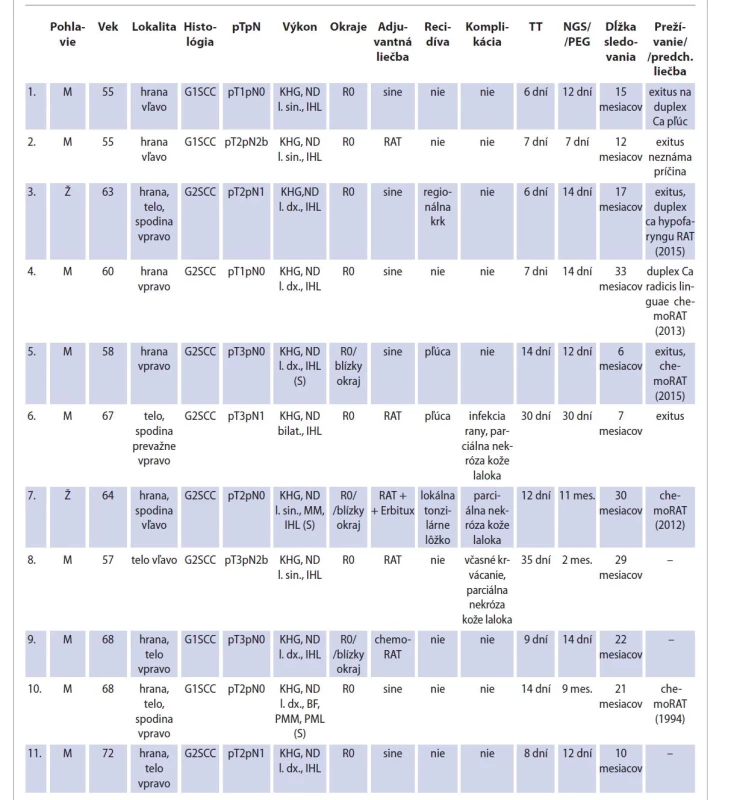
M – muž, Ž – žena, SCC – skvamocelulárny karcinóm, TT – tracheotómia, NGS – nazogastrická sonda, PEG – perkutánna endoskopická gastrostómia, KHG – kompartmentová hemiglosektómia, ND – bloková krčná disekcia, IHL – infrahyoidný lalok, MM – marginálna mandibulektómia, PMM – paramediálna mandibulotómia, BF – bukofaryngektómia, PML – pektorálny muskulokutánny lalok, S – záchranná operácia Diskusia
Jazyk je jedným z najzložitejších orgánov ľudského tela z anatomického aj funkčného hľadiska. Usporiadanie jeho svalových vláken umožňuje unikátnu pohyblivosť potrebnú pri artikulácii a deglutinácii, ale taktiež spolu s priebehom nervov a ciev predstavuje línie najmenšieho odporu pre včasnú inváziu nádoru a tvorbu metastáz. Hrúbka nádorovej infiltrácie je úmerná pravdepodobnosti vzniku okultných metastáz, čo napr. pri hrúbke 8 mm predstavuje riziko ich vzniku až 41 % [1, 2, 7]. Niektorí autori z tohto dôvodu doporučujú elektívnu blokovú disekciu spolu s liečbou primárneho nádoru už pri hrúbke infiltrácie 4 mm [8–11].
Primárny nádor jazyka je prepojený s ipsilaterálnym krčným lymfatickým aparátom prostredníctvom T-N traktu. Potreba zachovania integrity T-N traktu je dôležitá kvôli jeho potenciálnemu postihnutiu satelitnými ložiskami a mikrometastázami [12–14]. Satelitné noduly sa navyše vyskytujú aj v perineurálnom a perivaskulárnom tkanive hlavne pri pokročilých nádoroch (T3–T4). Táto skutočnosť favorizuje en bloc resekciu primárneho nádoru spolu s blokovou disekciou.
Koncept anatomického kompartmentu modifikoval chirurgický prístup liečby sarkómov s cieľom nahradiť širokú abláciu radikálnou resekciou danej anatomickej oblasti s možnosťou zachovania funkcie orgánu [15]. Kompartmentová chirurgia sarkómov umožnila signifikantne znížiť lokálnu recidívu na 10–20 % [16, 17]. Je to dôsledok odstránenia aj malých satelitných lézií prítomných v danom kompartmente, ktoré sa ešte zobrazovacími metódami nedajú identifikovať, a preto by len široká excízia tumoru nepostačovala. Jazyk možno charakterizovať ako symetrický orgán zložený z dvoch kompartmentov s vnútornými a vonkajšími svalmi (m. hyoglossus, genioglossus, palatoglossus a styloglossus), n. lingualis, a. a v. lingualis, terminálnej časti n. hypoglossus a sublinguálnej žľazy. Tieto štruktúry sú párové a oddelené stredovým linguálnym septom, čím je obsah oboch kompartmentov izolovaný. CTS je definovaná ako en bloc excízia všetkých štruktúr, ktoré sú cestami najmenšieho odporu pre šírenie nádoru, teda svaly jazyka, cievy, nervy a lymfatické cievy, ako aj odstránenie štruktúr, ktoré nie sú priamo súčasťou kompartmentu, ale môžu predstavovať potenciálne cesty šírenia. Sú to najmä sublinguálne a submandibulárne žľazy, mm. mylohyoidei a stromálne tkanivo, tvoriace T-N trakt. CTS sa takto stáva štandardizovanou chirurgickou technikou, ktorej cieľom je znížiť možnosť lokálnej recidívy, R1 resekcie a eliminovať prítomnosť satelitných ložísk alebo mikrometastáz v lymfatických uzlinách pozdĺž T-N traktu. Funkcia reziduálneho tkaniva jazyka je aj napriek potrebe rekonštrukcie porovnateľná s výsledkami pri širokej excízii [3, 18].
Na našom pracovisku sme začali metódu CTS používať roku 2016. Naplno ju rozvíjame od roku 2019, kedy bol autor na krátkom štúdijnom pobyte v Istituto Europeo di Oncologia v Miláne, kde táto koncepcia pre chirurgiu jazyka vznikla. Náš operačný postup sa odlišuje použitím stopkatého infrahyoidného laloka pri rekonštrukcii, zatiaľ čo vo veľkých centrách je preferovaný mikrovaskulárny fasciokutánny ALT lalok, prípadne fasciokutánny lalok z predlaktia, tzv. čínsky. Ojedinele sa používajú aj iné stopkaté laloky, napr. submentálny [19], ale použitie infrahyoidného laloka pri CTS zatiaľ nebolo popísané. Pektorálny lalok používame len pri transmandibulárnom prístupe, kvôli jeho väčšiemu objemu a horšej manipulácii. Infrahyoidný lalok je na rozdiel od ALT laloka alebo čínskeho laloka muskulokutánny, takže aj pri nekróze kožného ostrova sval dostatočne kryje pooperačný defekt a bráni vzniku orokutánnej fistuly.
Začíname odberom laloka, s ktorým máme veľmi dobré skúsenosti aj pri iných operáciách v dutine ústnej, a pokračujeme blokovou krčnou disekciou a CTS zdola nahor. Podľa možností preferujeme prístup „pull through“, ktorý šetrí mandibulu a vo väčšine prípadov dostatočne exponuje oblasť nádoru. V prípade anterolaterálneho šírenia na spodinu ústnu a gingivu výkon rozširujeme o marginálnu mandibulektómiu, ako u oboch našich pacientiek. Transmandibulárny prístup cez paramediálnu mandibulotómiu rezervujeme pre nádory šíriace sa na laterálnu stenu orofaryngu, ako to bolo u jedného z našich pacientov. Po odstránení kompartmentu s blokovým disekátom a rekonštrukciou defektu výkon končíme zaisťovacou tracheotómiou. Tú zrušíme zvyčajne v priebehu druhého pooperačného týždňa spolu s odstránením nazogastrickej sondy, takže pacienti odchádzajú domov dekanylovaní a po inštruktáži nácviku prehĺtania. Pri sekundárnom hojení defektu alebo príznakoch aspirácie tekutín je indikovaná dočasná PEG, ako to bolo v prípade 3 našich pacientov.
Na CTS indikujeme pacientov už od T2 štádia. Každý pacient pred operáciou má predoperačné MR, prípadne aj intraorálne usg vyšetrenie, kde si overujeme hlavne hĺbku invázie (DOI). Aj pri T2 nádoroch hrany a tela jazyka pri dodržaní bezpečného povrchového okraja 1,5–2 cm dosahuje často resekčná línia smerom mediálne takmer k linguálnemu septu. Takto dosiahneme R0 resekciu na povrchu aj v hĺbke a eliminujeme potrebu zbytočnej adjuvantnej onkologickej liečby kvôli pozitívnemu alebo blízkemu resekčnému okraju. Funkcia jazyka bude porušená približne v takom rozsahu, ako pri širokej excízii. U 2 našich pacientov bolo klinické T2 štádium preklasifikované na pT1, pričom išlo o nádory s rozmermi na hornej hranici. U T1 nádorov preferujeme výkony menšieho rozsahu v súlade s doporučeniami v klasifikácii glosektómií [6]. U pokročilých T3–T4 nádorov CTS rozširujeme o bukofaryngektómiu pri laterálnom šírení, pri zasahovaní nádoru mediálne až k septu aj o resekciu lemu zdravej sliznice na druhej strane spolu s vnútornými svalmi dorza jazyka, ktorých priečne vlákna prebiehajú nad septom. Nie je nutné posúvať resekciu paramediálne od septa na zdravú stranu v celom rozsahu, nakoľko septum je dostatočnou anatomickou bariérou, ktorá bráni šíreniu nádora kontralaterálne v hĺbke. Pri resekcii kontralaterálnej sliznice a pod ňou prebiehajúcich priečnych svalových vláken musíme dobre ošetriť krvácajúce vetvičky a. lingualis dorsalis, ktoré môžu byť príčinou včasného pooperačného krvácania. V našom súbore sme takto museli revidovať 1 pacienta. Naopak, na strane nádoru je krvácanie minimálne vďaka podväzu ipsilaterálnej a. lingualis.
Calabrese et al. [3] publikovali onkologické výsledky pri CTS a porovnali ich s výsledkami pri klasickej širokej excízii. Z celkového počtu 143 pacientov podstúpilo CTS 50 pacientov. Zistili vzostup lokálnej kontroly (o 16,8 %, p = 0,006), lokoregionálnej kontroly (o 24,4 %, p = 0,011) a celkového 5-ročného prežívania (o 27,3 %) v prospech súboru pacientov po CTS. Zároveň zistili vyšší podiel vzdialených metastáz, čo tiež svedčilo pre lepšiu lokálnu kontrolu v súbore CTS. Piazza et al. [20] mali v súbore 35 pacientov po primárnej operácii za 2, resp. 5 rokov výbornú lokálnu kontrolu (100 %, resp. 100 %), lokoregionálnu kontrolu (93,8 %, resp. 84,5 %) a celkové prežívanie (80 %, resp. 80 %). Naopak, v súbore 10 pacientov po záchrannej CTS bola za 2 roky lokálna kontrola 66,7%, lokoregionálna kontrola 36 % a celkové prežívanie len 26,7 %. Carta et al. [21] dosiahli v súbore 80 pacientov za 5-ročné obdobie lokálnu kontrolu u 73,2 % pacientov, lokoregionálnu kontrolu u 67,4 % a celkové prežívanie 66,8 %. Títo autori CTS indikujú pri posterolaterálnej alebo paramediálnej lokalizácii tumoru už v T1 štádiu. Tirelli et al. [22] naopak preferujú en bloc resekciu, a teda aj CTS len pri pokročilých nádoroch s inváziou m. mylohyoideus, prípadne priamym prerastaním nádoru do lymfatických uzlín krku. Argumentujú nízkym podielom postihnutia T-N traktu mimo T4N+ štádia ochorenia, signifikantne vyšším celkovým prežívaním, lokálnou aj lokoregionálnou kontrolou v prospech oddelenej krčnej aj orálnej fázy operácie a nevyhnutnosťou rekonštrukcie defektu s použitím mikrovaskulárnych lalokov. Do pozornosti dávajú najmä dôslednú disekciu perimarginálnych lymfatických uzlín s vyšším výskytom mikrometastáz (20,5 %). Tagliabue et al. [23] zistili vysoké riziko vzniku vzdialených metastáz pri postihnutí T-N traktu v pokročilých štádiách ochorenia. Signifikantne nižšiu incidenciu lokoregionálnej recidívy v prípade en bloc resekcie primárneho nádora jazyka a blokovej disekcie u pacientov s T2–T3 nálezom zistili v metaanalýze 8 štúdií s celkovým počtom 796 pacientov Wang et al. [24]. Recidíva po CTS sa popisuje od 22–28 % [3, 21]. V našom súbore, kde 8 pacientov podstúpilo primárnu operáciu a 3 pacienti záchrannú operáciu, bola v prvej skupine lokoregionálna kontrola, aj keď za pomerne krátke obdobie 7–33 mesiacov 87,5 %. Zomrela len pacientka s regionálnou recidívou na krku, celkovo v tejto skupine zomreli 4 pacienti (50 %). Lokoregionálna kontrola v druhej skupine bola u dvoch pacientov (66,6 %), hoci aj u pacientky s lokálnou recidívou je ochorenie po reiradiácii a biologickej liečbe pod kontrolou. V každej skupine zomrel 1 pacient na vzdialené metastázy v pľúcach. V súlade s výsledkami niektorých autorov [20] sa nám javí, že lepšia lokoregionálna kontrola je v súbore pacientov, ktorí podstúpili primárnu operáciu. Na relevantné zhodnotenie výsledkov sú však potrebné väčšie súbory pacientov.
Lepšia lokoregionálna kontrola pri CTS je daná tiež výrazným znížením výskytu pozitívnych resekčných okrajov aj v oblasti spodiny resekcie. V našom súbore sme nezaznamenali žiadneho pacienta s R1 resekciou tumoru. U 8 pacientov sa dosiahla R0 resekcia. V súlade s najnovšími doporučeniami možno aj blízky okraj hodnotiť ako R0 resekciu, s poznámkou o blízkom okraji [25]. Na posúdenie okrajov často využívame peroperačnú histológiu, čo umožňuje v prípade blízkeho okraja zabezpečenie korešpondujúcej negatívnej okrajovej excízie, čo potom spĺňa kritériá R0 resekcie. Na rozdiel od včasných T1–T2 štádií sú pokročilé štádiá indikované na multimodálnu liečbu bez ohľadu na charakter okrajov. Adjuvantná onkologická liečba je však odôvodnená aj u včasných nádorov pri dokumentovanej perineurálnej a lymfovaskulárnej invázii, ktoré sú považované za významné negatívne prognostické faktory [26].
Funkčné výsledky CTS hodnotením prehĺtania a reči dotazníkovou metódou kvality života boli zatiaľ prezentované v dvoch štúdiách [19, 20]. V oboch pacienti udávali žiadne alebo len mierne prehĺtacie ťažkosti v 73–90 %, ťažkosti s tuhou stravou resp. tekutinami v 10–26 %. Žiadne alebo len mierne artikulačné ťažkosti malo 90–97 % pacientov. Grammatica et al. [27] zistili, že CTS nemá signifikantný vplyv na reč, ale hlavne v prípade multimodálnej liečby zaznamenali subklinickú aspiráciu potravy s jej retenciou vo valekulách. Kľúčovou pre zachovanie funkcie jazyka sa javí správna voľba a realizácia rekonštrukcie. V našom súbore mali výraznejšie ťažkosti s prehĺtaním tuhej stravy len 2 pacienti, u ktorých bolo sekundárne hojenie defektu kvôli parciálnej nekróze kože laloka a zatekanie tekutiny bolo pozorované u 1 pacienta po CTS s bukofaryngektómiou. Títo pacienti vyžadovali PEG, ktorý bol po úprave príjmu tekutín a stravy zrušený.
V chirurgickej liečbe pokročilejších štádií nádorov jazyka má CTS jednoznačne svoje miesto.
V súčastnosti je snaha o štandardizáciu chirurgickej techniky aj pri včasných nádoroch cT1/T2cN0. Tzv. anatomicky definovaný transorálny prístup má nahradiť vágne charakterizovanú „širokú excíziu“. Jeho cieľom je najprv makroskopické zhodnotenie T-N traktu a podľa nálezu prípadná konverzia resekcie na CTS [28].
Záver
Kompartmentová chirurgia jazyka je štandardizovaná chirurgická metóda resekcie nádoru v presne anatomicky ohraničenom kompartmente spolu s lymfatickým systémom krku. Jej cieľom je eliminovať obvodové povrchové, ako aj longitudinálne hĺbkové šírenie nádoru a vznik recidív kvôli pozitivite resekčných okrajov, prítomnosti satelitných ložísk a mikrometastáz v lymfatických uzlinách. Jednoznačným prínosom tejto metódy je zlepšenie lokoregionálnej kontroly pri dobrých funkčných výsledkoch. Vyhodnotenie jej postavenia v záchrannej chirurgickej liečbe si vyžaduje ďalšie sledovanie.
Prehlásenie o konflikte záujmov
Autor práce prehlasuje, že v súvislosti s témou, vznikom a publikovaním tohto článku nie je v žiadnom konflikte záujmov. Vznik a publikácia článku neboli podporované žiadnou farmaceutickou firmou.
Poďakovanie
Autor ďakuje svojim spolupracovníkom z ORL oddelenia Východoslovenského onkologického ústavu, a. s., v Košiciach za pomoc pri operáciách.
ORCID autora
M. Almaši ORCID 0000-0002-3605-4559.
Prijato k recenzii: 8. 11. 2021
Prijato do tlače: 3. 1. 2022
MUDr. Milan Almaši, PhD.
ORL oddelenie
Východoslovenský onkologický ústav, a. s.
Rastislavova 43
040 01 Košice
Zdroje
1. Rana M, Iqbal A, Warraich R et al. Modern surgical management of tongue carcinoma: a clinical retrospective research over a 12 years period. Head Neck Oncol 2011; 3 : 43. Doi: 10.1186/1758-3284-3-43.
2. Shah JP, Gil Z. Current concepts in management of oral cancer: surgery. Oral Oncol 2009; 45 (4–5): 394–401. Doi: 10.1016/j.oraloncology. 2008.05.017.
3. Calabrese L, Bruschini R, Giugliano G et al. Compartmental tongue surgery: long term oncologic results in the treatment of tongue cancer. Oral Oncol 2011; 47 (3): 174–179. Doi: 10.1016/j.oraloncology.2010.12.006.
4. Karatzanis AD, Psychogios G, Mantsopoulos K et al. Management of advanced carcinoma of the base of tongue. J Surg Oncol 2012; 106 (6): 713–718. Doi: 10.1002/jso.23135.
5. Calabrese L, Giugliano G, Bruschnini R et al. Compartmental surgery in tongue tumors: description of a new surgical technique. Acta Otorhinolaryngol Ital 2009; 29 (5): 259–264.
6. Ansarin M, Bruschini R, Navach V et al. Classification of glossectomies: proposal for tongue cancer resections. Head Neck 2019; 41 : 821–827. Doi: 10.1002/hed.25466.
7. Woolgar JA. Histopathological prognosticators in oral and oropharyngeal squamous cell carcinoma. Oral Oncol 2006; 42 (3): 229–239. Doi: 10.1016/j.oraloncology.2005.05.008.
8. O’Brien CJ, Lauer CS, Fredricks S et al. Tumor thickness influences prognosis of T1 and T2 oral cavity cancer: but what thickness? Head Neck 2003; 25 (11): 937–945. Doi: 10.1002/hed.10324.
9. Fukano H, Matsuura H, Hasegawa Y et al. Depth of invasion as a predictive factor for cervical lymph node metastasis in tongue carcinoma. Head Neck 1997; 19 (3): 205–210. Doi: 10.1002/ (sici) 1097-0347 (199705) 19 : 3<205:: aid-hed7>3.0.co; 2-6.
10. Pimenta Amaral TM, Da Silva Freire AR, Carvalho AL et al. Predictive factors of occult metastasis and prognosis of clinical stages I and II squamous cell carcinoma of the tongue and floor of the mouth Oral Oncol 2004; 40 (8): 780–786. Doi: 10.1016/j.oraloncology.2003.10.009.
11. Spiro RH, Huvos AG, Wong GY et al. Predictive value of tumor thickness in squamous carcinoma confined to the tongue and floor of the mouth. Am J Surg 1986; 152 (4): 345–350. Doi: 10.1016/0002-9610 (86) 90302-8.
12. Ganly I, Patel S, Shah J. Early stage squamous cell cancer of the oral tongue: clinicopathologic features affecting outcome. Cancer 2012; 118 (1): 101–111. Doi: 10.1002/cncr.26229.
13. Preis M, Hadar T, Soudry E et al. Early tongue carcinoma: analysis of failure. Head Neck 2012; 34 (3): 418–421. Doi: 10.1002/hed.21754.
14. Yang, TL, Ko JY, Chang YL. Involved margin of tongue cancer: the impact of tumor satellites on prognosis. Head Neck, 2008; 30 (7): 845–851. Doi: 10.1002/hed.20789.
15. Bowden L, Booher RL. The principles and technique of resection of soft parts for sarcoma. Surgery1958; 44 (6): 963–977.
16. FongY, Coit DG, Woodruff M et al. Lymph node metastasis from soft tissue sarcoma in adults. An analysis of data from a prospective database of 1772 sarcoma patients. Ann Surg 1993; 217 (1): 72–77. Doi: 10.1097/00000658-199301000-00012.
17. Gortzak E, van Coevorden F. Soft tissue sarcoma-messages from completed randomized trials. Eur J Surg Oncol 1995; 21 (5): 469–471. Doi: 10.1016/s0748-7983 (95) 96639-0.
18. Calabrese L, Tagliabue M, Maffini F et al. From wide excision to a compartmental approach in tongue tumors: what is going on? Curr Opin Otolaryngol Head Neck Surg 2013; 21 (2): 112–117. Doi: 10.1097/MOO.0b013e32835e28d2.
19. Roshdy S, Elbadrawy M, Khater A et al. Compartmental tongue resection with submental island flap reconstruction for large carcinoma of the oral tongue, Oral Maxillofac Surg 2017; 21 (3): 289–294. Doi: 10.1007/s10006-017-0627-0.
20. Piazza, C, Grammatica A, Montalto N et al. Compartmental surgery for oral tongue and mouth cancer: oncologic outcomes. Head Neck 2019; 41 (1): 110–115. Doi: 10.1002/hed.25480.
21. Carta F, Quartu D, Mariani C et al. Compartmental surgery with microvascular free flap reconstruction in patients with T1–T4 squamous cell carcinoma of the tongue: analysis of risk factors and prognostic value of the 8th edition AJCC TNM staging system Front Oncol 2020; 10 : 984. Doi: 10.3389/fonc.2020.00984.
22. Tirelli G, Piccinato A, Antonucci P et al. Surgical resection of oral cancer: en bloc versus discontinuous approach. Eur Arch Oto Rhino Laryngol 2020; 277 (11): 3127–3135. Doi: 10.1007/ s00405-020-06016-5.
23. Tagliabue M, Gandini S, Maffini F et al. The role of the T-N tract in advanced stage tongue cancer, Head Neck 2019; 41 (8): 2756–2767. Doi: 10.1002/hed.25761.
24. Wang HC, Zheng Y, Pang P et al. Discontinuous versus incontinuity neck dissection in squamous cell carcinoma of the tongue and floor of the mouth: comparing the rates of locoregional recurrence. J Oral Maxillofacial Surg 2018; 76 (5): 1123–1132. Doi: 10.1016/ j.joms.2017.11.021.
25. Vošmik M, Laco J, Klozar J et al. Konsensuální doporučení České kooperativní skupiny pro nádory hlavy a krku (2019): definice resekčních okrajů, reportování krčních disekcí a vyšetřování HPV/p16. Cesk Patol 2021; 57 (1): 53–56.
26. Hinni ML, Ferlito A, Brandwein - Gensler MS et al. Surgical margins in head and neck cancer: A contemporary review. Head Neck 2013; 35 (9): 1362–1370. Doi: 10.1002/hed.23110.
27. Grammatica A, Piazza C, Montalto N et al. Compartmental surgery for oral tongue cancer: objective and subjective functional evaluation Laryngoscope 2021; 131 (1): 176–183. Doi: 10.1002/lary.28627.
28. Calabrese L, Pietrobon G, Fazio E et al. Anatomically-based transoral surgical; approach to early-stage oral tongue squamous cell carcinoma. Head Neck 2020; 42 (5): 1105–1109. Doi: 10.1002/hed.26095.
Štítky
Audiologie a foniatrie Dětská otorinolaryngologie Otorinolaryngologie
Článek vyšel v časopiseOtorinolaryngologie a foniatrie
Nejčtenější tento týden
2022 Číslo 4- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Fexofenadin – nesedativní a imunomodulační antihistaminikum v léčbě alergických projevů
- Pacienti s infekcemi HPV a EBV a možnosti léčebné intervence pomocí inosin pranobexu
- Suché sliznice a chrapot pod kontrolou: Co může lékař nabídnout pacientům?
- Isoprinosine nově bez indikačních a preskripčních omezení
-
Všechny články tohoto čísla
- Editorial
- Úloha FEES a dysfagiologického týmu v péči o pacienty po CMP v Nemocnici České Budějovice
- Kompartmentová chirurgia jazyka
- Vrodená cytomegalovírusová infekcia z pohľadu otorinolaryngológa
- Chronické rinosinusitidy odontogenní etiologie
- Orofaryngeální forma tularemie s kožními projevy: Sweetův syndrom
- Ochrnutie hrtana spôsobené generalizovanou infekciou vírusom varicela zoster – kazuistika
- Poděkování recenzentům
- Neobvyklý případ dvojité fistulizace branchiogenní cysty
- Monografie – Respirační papilomatóza
- Erratum
- 20. Česko-německé ORL dny, 15.–17. září 2022 v Plzni
- 6th Congress of European ORL-HNS
- 61. Otologický den v Hradci Králové
- Otorinolaryngologie a foniatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Chronické rinosinusitidy odontogenní etiologie
- Kompartmentová chirurgia jazyka
- Vrodená cytomegalovírusová infekcia z pohľadu otorinolaryngológa
- Úloha FEES a dysfagiologického týmu v péči o pacienty po CMP v Nemocnici České Budějovice
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



