-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Výskyt a antibiotická rezistence enterobakterií izolovaných z klinického materiálu od pacientů s akutní leukemií
Occurrence and Antibiotic Resistance of Enterobacteriaceae in Acute Leukemia Patients
Background:
Acute leukemia (AL) is a heterogeneous group of malignant hematopoietic diseases and is divided into two basic types: acute myeloid leukemia (AML) and acute lymphoblastic leukemia (ALL). Patients with these diseases are highly immunosuppressed and therefore at a high risk of serious infections. This study aimed to perform active surveillance of enterobacteria, which cause these infections, and to determine their antibiotic resistance in patients with AL who were hospitalized at the Hemato-Oncology Center of University Hospital Olomouc.
Materials and methods:
This study involved 49 patients with AL, of whom 37 had AML (16 women and 21 men) and 12 had ALL (6 women and 6 men). The mean age of the patients was 50.5 years. Samples of clinical material were obtained over 12 months (September 2015 to August 2016) and subjected to standard microbiological examinations. Bacterial strains were identified by MALDI-TOF MS, and their antibiotic susceptibility was established by microdilution method.
Results:
A total of 292 samples were obtained from patients with AL. Some of these samples were excluded from analysis to prevent the inclusion of identical strains from the same patient. Consequently, 146 clinical samples obtained from the following nine types of clinical materials were analyzed – throat swabs (n = 47), stools (n = 40), urine (n = 33), hemocultures (n = 11), buccal swabs (n = 5), perianal swabs (n = 4), wound swabs (n = 3), sputum (n = 2), and puncture fluid (n = 1). The most prevalent enterobacteria was Escherichia coli (n = 42), followed by Klebsiella spp. (n = 46), specifically Klebsiella pneumoniae (n = 34) and Klebsiella oxytoca (n = 12), and Enterobacter cloacae (n = 19). The most of enterobacteria were highly resistant to many tested antibiotics.
Conclusions:
Antibiotic-resistant enterobacteria colonize patients with hemato-oncological diseases and can cause serious infections. These antibiotic-resistant microorganisms are a serious and frequent problem. These findings together with the high level of immunosuppression mean that patients with hemato-oncological diseases are at a high risk of developing serious infections and consequently active surveillance is crucial.
Keywords:
leukemia – Enterobacteriaceae – antibacterial drug resistance – cross infections
This study was supported by „Research Support Foundation Vaduz – Comprehensive Study at the Issue of Oncological Diseases“ a IGA_LF_ UP_2016_022.
The authors declare they have no potential confl icts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Submitted: 28. 11. 2017
Accepted: 28. 5. 2018
Autoři: Zatloukalová Simona 1; Holý Ondřej 1; Petrželová Jana 2; Mlynárčik Patrik 2; Vlčková Jana 1; Röderová Magdaléna 2; Horáková Dagmar 1; Kollárová Helena 1
Působiště autorů: Ústav preventivního lékařství, LF UP v Olomouci 1; Ústav mikrobiologie, LF UP v Olomouci 2
Vyšlo v časopise: Klin Onkol 2018; 31(4): 282-288
Kategorie: Původní práce
doi: https://doi.org/10.14735/amko2018282Souhrn
Východiska:
Akutní leukemie (AL) je heterogenní skupina maligních onemocnění hematopoézy, rozděluje se na dva základní typy, a to akutní myeloidní leukemie (AML) a akutní lymfoidní leukemie (ALL). Pacienti s těmito onemocněními patří mezi těžce imunosuprimované a je u nich velké riziko vzniku závažných infekcí. Cílem studie bylo sledování výskytu enterobakterií – původců těchto infekcí – u pacientů s AL hospitalizovanými na Hemato-onkologické klinice Fakultní nemocnice v Olomouci a zjištění jejich antibiotické rezistence.
Materiál a metodika:
Do studie bylo zapojeno 49 pacientů s AL, z toho 37 s AML (16 žen a 21 mužů) a 12 s ALL (6 žen a 6 mužů); průměrný věk pacientů byl 50,5 roku. V průběhu 12 měsíců (od září 2015 do srpna 2016) by od těchto pacientů získávány vzorky klinického materiálu, které byly podrobeny základnímu mikrobiologickému vyšetření. Bakteriální kmeny byly identifikovány pomocí MALDI-TOF MS. Citlivost na antibiotika byla stanovena pomocí mikrodiluční metody.
Výsledky:
Celkově bylo od pacientů s AL získáno 292 vzorků, které byly dále podrobeny selekci na základě několika kritérií, aby bylo zamezeno zahrnutí identických kmenů získaných od téhož pacienta. Výsledkem byl výběr 146 klinických vzorků z 9 typů klinických materiálů (47× výtěr z krku, 40× stolice, 33× moč, 11× hemokultura, 5× výtěr z dutiny ústní, 4× perianální stěr, 3× stěr z rány, 2× sputum, 1× punktát). Nejvíce prevalentní enterobakterií byla Escherichia coli (42×), dále zástupci Klebsiella spp. (46×), a to Klebsiella pneumoniae (34×) a Klebsiella oxytoca (12×), a Enterobacter cloacae (19×). Mnohé izoláty vykazovaly rezistenci na testovaná antibiotika.
Závěr:
Pacienti s hematoonkologickými onemocněními jsou kolonizováni rezistentními enterobakteriemi, což pro ně představuje potenciální nebezpečí vzniku závažných infekcí. Obecně je výskyt těchto rezistentních zástupců z čeledi Enterobacteriaceae v dnešní době závažným problémem se zvyšujícím se výskytem. Tato fakta a vysoká imunosuprese jsou faktory, které hematoonkologické pacienty řadí do zvlášť ohrožené skupiny, v níž je aktivní surveillance naprosto klíčová.
Klíčová slova:
leukemie – enterobakterie – bakteriální léková rezistence – infekce spojené se zdravotní péčí
Východiska
Akutní leukemie (AL) je heterogenní skupina maligních hematologických onemocnění vyznačujících se různorodým klinickým a laboratorním nálezem. Hlavní charakteristikou tohoto onemocnění je přítomnost blastů v kostní dřeni – dle příslušnosti těchto nezralých buněk k myeloidní či lymfoidní linii se AL dělí na akutní myeloidní (AML) a akutní lymfoblastickou leukemii (ALL) [1,2].
V roce 2015 bylo v ČR celkem 8 547 pacientů s leukemickým onemocněním (zahrnuje diagnózy C91–C95, prevalence je 81/100 tisíc obyvatel), incidence byla 1 353 pacientů [3]. ALL tvoří pouze 20 % všech AL a jedná se o nejčastější nádorové onemocnění u dětí – objevuje se především mezi 2. a 5. rokem života a následně u dospělých starších 50 let [4,5]. Oproti tomu AML je nejčastější AL vůbec a její výskyt roste s věkem [2,6]. Prognóza je pro AML i ALL značně různorodá – odvíjí se od diagnózy, věku pacienta, přidružených onemocnění a dalších faktorů [5–7]; mezi mírami přežití mužů a žen nejsou výrazné rozdíly [8,9]. Za poslední dvě dekády zaznamenáváme zvyšování incidence i prevalence leukemických onemocnění, zároveň ale pozorujeme příznivý vývoj v přežívání pacientů i v mortalitě na leukemická onemocnění v Evropě – toho bylo dosaženo především díky pokrokům v moderní léčbě hematologických malignit [9,10].
Daní za vysokou účinnost této léčby je ale vysoký výskyt opakujících se akutních infekčních komplikací. Infekce u pacientů vznikají na podkladě vysoké imunosuprese dané dlouhodobou neutropenií a komplexní léčbou vyžadující časté hospitalizace (systémová chemoterapie, radioterapie, transplantace krvetvorných buněk). Často mají proměnlivý a velmi chudý klinický obraz vyznačující se pouze zvýšenou teplotou – tento stav je pak označován jako febrilní neutropenie nebo také horečka neznámého původu. Mají různorodou etiologii a navzdory všem stupňům jejich prevence se tento problém zatím nedaří eliminovat [2,5,11–15].
Jedněmi z nejčastějších původců infekcí získaných právě na hematoonkologických klinikách jsou enterobakterie – to dokumentuje např. Kolář et al ve studii, která zahrnovala dvanáct českých a slovenských hematologických center, v nichž celých 60 % všech izolátů u pacientů s bakteriemii představovaly enterobakterie spolu s Pseudomonas aeruginosa [16]. Hematoonkologická oddělení jsou navíc typická svým výrazným selekčním tlakem na veškeré mikroorganizmy vedoucím ke vzniku rezistence. Tyto rezistentní enterobakterie jsou celosvětově rozšířené a čím dál tím častěji se vyskytují ve zdravotnických zařízeních, kde vyvolávají outbreaky onemocnění mezi pacienty [17].
Cílem studie bylo sledovat u pacientů s ALM a ALL výskyt enterobakterií, které právě u těchto imunosuprimovaných jedinců mohou být příčinou vzniku závažných infekcí, jejich četnost a antibiotické rezistence.
Materiál a metody
Sběr vzorků
V rámci projektu Comprehensive study at the issue of oncological diseases, který probíhal na Lékařské fakultě Univerzity Palackého v Olomouci, byly pacientům s AML a ALL hospitalizovaným na Hemato-onkologické klinice (HOK) Fakultní nemocnice Olomouc odebírány vzorky klinického materiálu. Sběr vzorků začal v září v roce 2015 a byl ukončen v srpnu roku 2016. Všichni pacienti před zahájením odběrů vzorků podepsali informovaný souhlas. Odběr vzorků probíhal v pravidelných intervalech v závislosti na tom, jak se jednotliví pacienti dostavovali na HOK. V rámci pravidelného screeningu jim byly prováděny výtěry z krku a odebírány vzorky moči a stolice (formou rektálního výtěru), další klinicky materiál byl odebírán v případě zhoršení zdravotního stavu v důsledku onemocnění. Vzorky byly následně zpracovány klasickými mikrobiologickými metodami, a to podle typu odebraného materiálu.
Kultivace
Při kultivaci bylo využito standardních mikrobiologických metod. Klinický materiál byl vyočkován na pevné kultivační půdy, kultivace probíhala při zvýšené tenzi CO2 při teplotě 35 ± 1 °C po dobu 18–24 hod. Hemokultury byly vloženy do hemokultivačního systému BACTEC a kultivace probíhala po dobu 5 dnů při teplotě 35 ± 1 °C. Vzorky krve s pozitivním nálezem byly vyočkovány na pevné půdy a opět kultivovány při teplotě 35 ± 1 °C po dobu 18–24 hod.
Identifikace pomocí MALDI-TOF
Při nálezu signifikantního patogenu byla provedena identifikace kmene metodou MALDI-TOF (Matrix Assisted Laser Desorption Ionization – Time of Flight) pomocí přístroje IVD MALDI biotyper. Příprava vzorků, samotná identifikace a analýza dat probíhala dle Sauer et al [18].
Stanovení citlivosti enterobakterií k vybraným antibiotikům pomocí mikrodiluční metody
Stanovení kvantitativní citlivosti na antibiotika bylo provedeno mikrodiluční metodou pro stanovení minimální inhibiční koncentrace (minimum inhibitory concentration – MIC). Bylo použito 18 antibiotik ředěných v mikrotitrační destičce dvojnásobnou geometrickou řadou – ampicilin, ampicilin/sulbaktam, cefuroxim, gentamycin, kotrimoxazol, kolistin, ofloxacin, aztreonam, piperacilin, piperacilin/tazobaktam, cefotaxim, ceftazidim, cefepim, meropenem, ciprofloxacin, tigecyklin, tobramycin a amikacin. Po naočkování byly destičky kultivovány 18–24 hod při teplotě 35 ± 1 °C, výsledky byly vyhodnoceny podle testovacích kritérií EUCAST (European Committee on Antimicrobial Susceptibility Testing) 2016.
Výsledky
Vyšetřovaný soubor
Rozdělení vyšetřovaného souboru dle věku, pohlaví a diagnózy ukazuje tab. 1 – jednalo se o celkem 49 pacientů, z toho 12 pacientů mělo diagnózu ALL (24,5 %; z toho 6 žen a 6 mužů), a 37 pacientů mělo diagnózu AML (75,5 %; z toho 16 žen a 21 mužů). Procentuální zastoupení AML a ALL ve studovaném souboru kopíruje současný trend ve výskytu AL [1].
Tab. 1. Distribuce pacientů v souboru dle věku, diagnózy a pohlaví. 
ALL – akutní lymfoidní leukemie, AML – akutní myeloidní leukemie Průměrný věk pacientů byl 50,5 roku. Počet pacientů s AML se zvyšoval spolu s věkem, jak je pro toto onemocnění typické. Charakteristické zvýšení výskytu ALL ve dvou vlnách (v nízkém věku a ve věku nad 50 let) pozorováno nebylo, což je možné přisoudit nízkému počtu pacientů s ALL ve studii.
Výběr vzorků
Celkem bylo od 49 pacientů získáno 292 vzorků (průměrně 6 vzorků od 1 pacienta – nejvíce 22, nejméně 1). Nejčastěji to byly výtěry z krku (104×), stolice (90×), moč (53×), hemokultura (16×) a výtěr z dutiny ústní (12×), minoritně byly zastoupeny další klinické materiály – perianální stěr 7×, stěr z rány 5×, sputum 3×, punktát 1× a výtěr z nosu 1×.
Po vykonání všech analýz byly vzorky dále podrobeny selekci na základě několika kritérií, aby bylo zamezeno zahrnutí identických kmenů získaných od téhož pacienta. V potaz byly brány klinický materiál, popř. místo, z nějž byl vzorek odebrán, časový faktor a celkové výsledky fenotypové citlivosti na antibiotika. Výsledkem selekce byl výběr 146 vzorků z 9 typů klinických materiálů (47× výtěr z krku, 40× stolice, 33× moč, 11× hemokultura, 5× výtěr z dutiny ústní, 4× perianální stěr, 3× stěr z rány, 2× sputum, 1× punktát).
Bakteriální nález
Nejvíce prevalujícími enterobakteriemi byly Escherichia coli (41×), Klebsiella pneumoniae (34×), Enterobacter cloacae (19×) a Klebsiella oxytoca (12×), dále pak bylo identifikováno dalších 15 druhů enterobakterií (tab. 2).
Tab. 2. Enterobakterie izolované od pacientů s akutními leukemiemi. 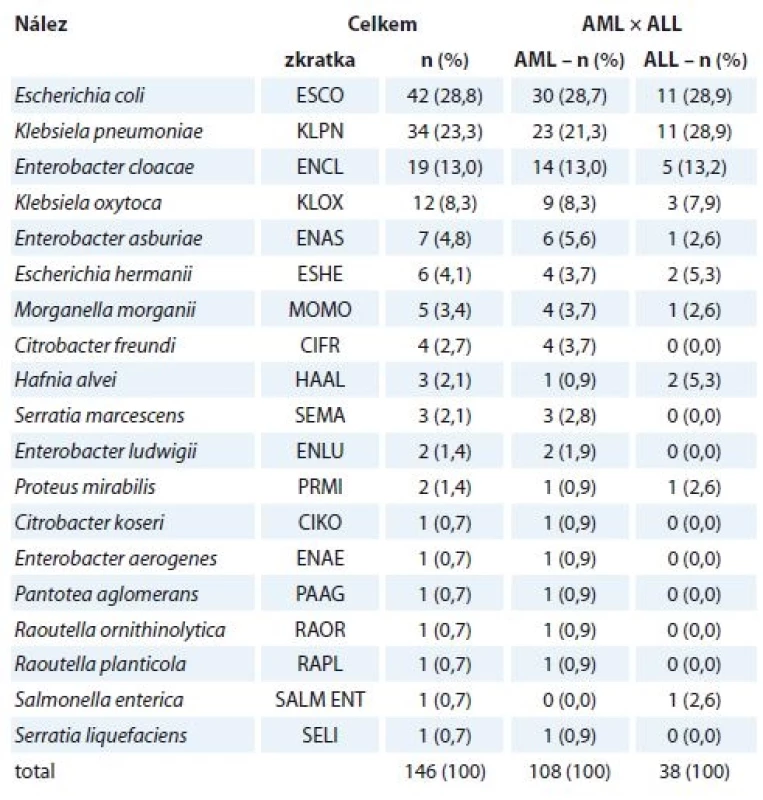
AML – akutní myeloidní leukemie, ALL – akutní lymfoidní leukemie Escherichia coli, Klebsiella pneumoniae, Enterobacter cloacae a Klebsiella oxytoca byly nejčastějšími nálezy u pacientů s AML i u pacientů s ALL. Také distribuce těchto původců dle pohlaví (bez ohledu na diagnózu) byla, co se pořadí týče, totožná. Escherichia coli byla dominující enterobakterií ve stěrech z dutiny ústní, hemokulturách, močích a punktátech; ve výtěrech z krku, stěrech z perianálu a ve stolici převládala Klebsiella pneumoniae.
Rezistence na antibiotika
Přehled rezistence na antibiotika udává tab. 3. U všech čtyř hlavních původců jsou pozorovány zvýšené míry rezistence na mnohá z testovaných antibiotik. Více než polovina izolátů Escherichia coli byla rezistentní na peniciliny (~ 57,3 %) a na aztreonam (55,6 %); zhruba třetina pak na cefalosporiny (~ 34,7 %), fluorochinolony (~ 40,3 %) a kotrimoxazol (31,7 %); také byly nalezeny dva izoláty rezistentní na karbapenemové antibiotikum meropenem. U izolátů Klebsiella pneumoniae byly pozorovány nejvyšší míry rezistence vůči penicilinům (~ 72,6 %), cefalosporinům (~ 65,4 %), fluorochinolonům (~ 55,9 %) a kotrimoxazolu (82,4 %) s aztreonamem (70 %); zhruba třetina izolátů byla odolná vůči aminoglykosidům (~ 37,8 %). Více než polovina izolátů Enterobacter cloacae byla rezistentní vůči penicilinům (~ 68,3 %) a cefalosporinům (~ 63,8 %), nižší míry rezistence byly vůči aminoglykosidům (~ 35,0 %) a aztreonamu (47,4 %) s kotrimoxazolem (40,0 %). Izoláty Klebsiella oxytoca vykazovaly nejvyšší míru rezistence vůči penicilinům (~ 60,4 %) a cefalosporinům (~ 50 %), dále pak vůči kotrimoxazolu (58,3 %) a aztreonamu (50,0 %); zhruba třetina byla rezistentní vůči fluorochinolonům (~37,5 %) a čtvrtina vůči aminoglykosidům (~ 25,0 %). Nebyly nalezeny žádné izoláty Klebsiella pneumoniae, Enterobacter cloacae a Klebsiella oxytoca rezistentní na meropenem.
Tab. 3. Výsledky testování MIC. 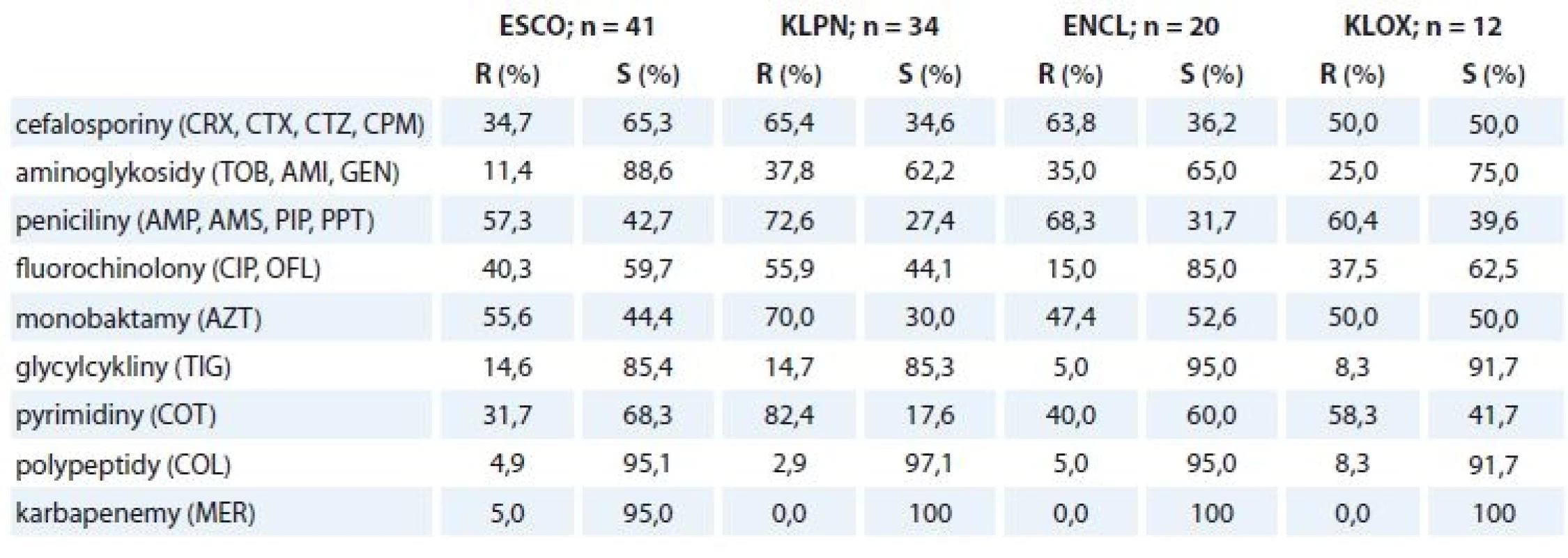
MIC – minimální inhibiční koncentrace, ESCO – Escherichia coli, KLPN – Klebsiella pneumoniae, ENCL – Enterobacter cloacae, KLOX – Klebsiella oxytoca, S – senzitivní, R – rezistentní, CRX – cefuroxim, CTX – cefotaxim, CTZ – ceftazidim, CPM – cefepim, TOB – tobramycin, AMI – amikacin, GEN – gentamycin, AMP – ampicilin, AMS – ampicilin/sulbaktam, PIP – piperacilin, PPT – piperacilin/tazobaktam, CIP – ciprofl oxacin, OFL – ofl oxacin, AZT – aztreonam, TIG – tigecyklin, COT – kotrimoxazol, COL – kolistin, MER – meropenem Diskuze
Cílem studie bylo sledovat u pacientů s AML a ALL výskyt enterobakterií, které právě u těchto imunosuprimovaných jedinců mohou být příčinou vzniku závažných infekcí, jejich prevalenci a antibiotické rezistence.
Studie potvrdila vysoký stupeň kolonizace pacientů s AL rezistentními zástupci čeledi Enterobacteriaceae. Nejčastějšími izoláty byly Escherichia coli, Klebsiella pneumoniae, Enterobacter cloacae a Klebsiella oxytoca – všechny tyto mikroorganizmy jsou v současné literatuře popisovány jako problém se vzrůstajícím trendem a kvůli svým rezistencím i s vysokou závažností a limitovanými možnostmi řešení. Bakteriální rezistence mikroorganizmů je globálním problémem a reálnou hrozbou pro medicínu i celé lidské společenství. Existují různé mechanizmy vzniku odolnosti vůči antibiotikům – mikroorganizmy produkují enzymy inaktivující antibiotika, mění permeabilitu své bakteriální stěny a cytoplazmatické membrány, modifikují cílová místa antibiotik nebo využívají tzv. bakteriálního efluxu, kterým zvýšeně vylučují antibiotika z buňky. Tyto mechanizmy se vyvíjejí především na základě selekčního tlaku, který se významně uplatňuje právě na hematoonkologických klinikách, odkud je pak hlášen vysoký výskyt mikroorganizmů odolných vůči mnohým antibiotikům i onemocnění jimi způsobených [18–22].
Kolonizace pacientů s AL rezistentními mikroorganizmy je tedy významným rizikovým faktorem pro vznik následných infekcí spojených se zdravotní péčí. Escherichia coli je enterobakterie nejčastěji izolovaná od neutropenických pacientů a způsobuje nejrůznější typy infektů, např. infekce krevního řečiště, urogenitálního traktu nebo ran, sepse, pneumonie aj. [23–27]. Rod Klebsiella spp. je původcem cca 8 % všech infekcí získaných během hospitalizace v USA a v Evropě, zástupci klebsiel také patří mezi hlavní patogeny spojené se zdravotní péčí u imunosuprimovaných jedinců [28,29]. Klebsiella pneumoniae způsobuje infekce močového traktu, pneumonie, intraabdominální infekce, bakteriémie, infekce ran apod. u dospělých i dětských pacientů [30–32]; oproti tomu Klebsiella oxytoca je častým původcem bakteremie u novorozenců [33]. Enterobacter cloacae je oportunní patogen s ubikvitérním výskytem, způsobuje např. bakteriemie, infekce dolních cest dýchacích, močového traktu, kůže a měkkých tkání či endokarditidy. Je možný přenos krevními deriváty a různými druhy zdravotnických pomůcek a přístrojů, např. stetoskopy, endoskopy nebo zařízeními pro měření intraarteriálního krevního tlaku [34]. Asociace mezi kolonizací a následnou infekcí není výsadní pouze pro enterobakterie – byla prokázána i u řady dalších původců, např. u enterokoků rezistentních k vankomycinu (VRE), Pseudomonas aeruginosa nebo Stenotrophomonas maltophilia [35].
Právě infekce jsou nejdůležitější preventabilní příčiny úmrtí hematoonkologických pacientů. Jejich riziko a závažnost se odvíjejí od stupně a délky trvání neutropenie [11,36]. Udává se, že riziko úmrtí na infekční komplikace leukemie nebo její léčby je 1–2 % u pacienta před dosažením remise a 2 % u pacienta v remisi [5]. Infekce jsou také primárními příčinami úmrtí u pacientů po transplantaci krvetvorných buněk, a to u 8 % pacientů po autologní transplantaci a u 17–20 % pacientů po alogenní transplantaci [37]. V posledních letech převažují mezi hematoonkologickými pacienty infekce způsobené multirezistentními gramnegativními původci [21,38], z nichž dominantními (65–80 %) jsou právě zástupci čeledi Enterobacteriaceae [19]. Infekty jsou jak endogenní (způsobené střevní i mimostřevní mikroflórou), tak exogenní. Kolonizace představuje riziko nejen pro daného pacienta, ale také pro další hospitalizované v rámci stejného centra, kteří osídleni těmito mikroorganizmy nejsou – k přenosu může dojít v případě zanedbání hygieny nebo neúčinné prevence. Dalším významným zdrojem těchto mikroorganizmů může být zdravotnický personál, přenos se může uskutečnit během poskytování jakékoli zdravotní péče [14,39].
Nejzávažnějšími infekty jsou pro pacienty na hematoonkologiích infekce krevního řečiště, které postihují 11–38 % z nich a jejichž letalita je až 40 %. Dlouhodobě je jejich nejčastějším původcem Escherichia coli – způsobí až třetinu infektů krevního řečiště, často je rezistentní na několik druhů antibiotik a obvykle je nutná léčba karbapenemy [38,40]. V této studii byla Escherichia coli nejvíce prevalentní enterobakterií v hemokulturách (45 %), jeden z izolátů byl navíc rezistentní k meropenemu a dalším 12 z testovaných antibiotik, citlivý byl pouze ke kotrimoxazolu, kolistinu, ciprofloxacinu a aminoglykosidům amikacinu a tobramycinu. Právě léčbu infekcí krevního řečiště aminoglykosidy (především amikacinem) doporučuje ke zvážení studie Ma et al jako možnost, jak omezit šířící se rezistenci vůči karbapenemům, širokospektrým a značně odolným rezervním antibiotikům, která se užívají jako poslední možnost léčby závažných a život ohrožujících infekcí [40].
Vznik rezistence je spojen nejen s terapeutickým, ale také s profylaktickým užíváním antibiotik, což je pro pacienty s AL typické. Běžnou praxí je užívání fluorochinolonů, ačkoliv proti těmto antibiotikům je v dnešní době rezistentních 35–85 % izolátů Escherichia coli a Klebsiella pneumoniae od neutropenických pacientů [21]. Podobné výsledky byly pozorovány i v tomto případě, kdy bylo rezistentních 40 % izolátů Escherichia coli a 56 % izolátů Klebsiella pneumoniae. Je dokumentováno, že třetina pacientů s touto profylaxí má střeva kolonizována mikroorganizmy rezistentními vůči fluorochinolonům (nejen z čeledi Enterobacteriaceae), což opět představuje riziko vzniku infektu. Na druhou stranu zastavení profylaktického užívání fluorochinolonů pro zabránění zvyšující se rezistence enterobakterií je zatíženo zvýšenou mortalitou hematoonkologických pacientů v důsledku sepse [21,41].
V rámci této problematiky je na místě zavedení a management efektivních preventivních opatření proti přenosu rezistentních mikroorganizmů, a to nejen u čeledi Enterobacteriaceae. Studie ukázaly, že nejefektivnější z těchto opatření je důsledná hygiena rukou vodou, mýdlem a dezinfekčními prostředky na alkoholové bázi. Je nutná dezinfekce povrchů, podlah a objektů podle nastavených klinických doporučených postupů. Další možností je umístění pacientů po transplantaci na izolační pokoje s přetlakem vyznačující se vysokým stupněm čistoty a monitoringem prostředí. V těchto místnostech je výskyt patogenních i podmíněně patogenních mikroorganizmů minimální a pacient zde setrvává v době, kdy je u něj kvůli prolongované neutropenii nejvyšší riziko vzniku infekce [11,35–37,42–44].
Je zapotřebí dobře zvažovat profylaktické i terapeutické podání antibiotik, které musí být racionální a individuální, co se týče druhu léčiva, jeho dávkování i délky užívání. Před samotným podáním je nutné provedení relevantní mikrobiologické diagnostiky, která lékaře nasměruje k výběru vhodného antibiotika. Kromě toho je zapotřebí zvažovat celkový stav pacienta – posoudit hloubku neutropenie, protinádorovou léčbu a její specifický dopad na infekci, předchozí infekční komplikace, již užitou antibakteriální profylaxi, základní stav onemocnění, komorbidity a další faktory. Konzultace a spolupráce s mikrobiologem je v případě rezistentních bakterií nezbytná [45].
Dále je nutná aktivní surveillance nastavená pro detekci kolonizace asymptomatických pacientů rezistentními kmeny – např. Ariza-Heredia et al uvádí, že zavedením kontrolních rektálních výtěrů v týdenních intervalech bylo významně omezeno klonální šíření vankomycin-rezistentních enterokoků [42]. Surveillance také přispívá k dobré znalosti lokální epidemiologické situace, umožňuje pozorovat její trendy a přizpůsobovat tomu preventivní i léčebná opatření užívaná v rámci daného pracoviště. Mezi další kroky patří zavedení dekolonizačních procesů u pacientů a popř. i u personálu [21] a zásady bariérové ošetřovatelské péče zahrnující užívání ochranných oděvů a pomůcek, jednorázových materiálů nebo individualizaci pomůcek [46]. Samozřejmostí musí být dodržování preventivních opatření nejen personálem, ale také pacienty samotnými a všemi osobami, které dané oddělení navštíví.
Závěr
Studie prokázala výskyt rezistentních enterobakterií mezi pacienty s AL na Hemato-onkologické klinice Fakultní nemocnice Olomouc. Nejvyšší prevalence byla pozorována u Escherichia coli, Klebsiella pneumoniae, Enterobacter cloacae a Klebsiella oxytoca – všechny tyto enterobakterie jsou diskutovány v odborné literatuře jako velice častí původci infekcí u všech hematoonkologických pacientů. U všech také byly pozorovány vysoké míry rezistence na mnohá z testovaných antibiotik.
Tato problematika je aktuální a významný problém moderní medicíny. Skutečnosti vycházející z této i mnohých dalších podobných studií probíhajících ve světě jen podtrhují důležitost aktivní surveillance a zavádění komplexních preventivních opatření, které zabrání dalšímu přenosu těchto původců a sníží riziko infekce i předčasného úmrtí pacienta. Rezistence mikroorganizmů jako taková je pak globálním problémem vyžadujícím řešení, aby lidstvo zabránilo tomu, že tak cenná léčiva, jako jsou antibiotika, přestanou být zcela účinná. Je ale nutné si uvědomit, že rezistence mikroorganizmů je velkou daní, kterou moderní medicína platí za svou stále se zvyšující úroveň a prodloužení délky života mnohých pacientů.
Studie byla podpořena „Research Support Foundation Vaduz – Comprehensive Study at the Issue of Oncological Diseases“ a IGA_LF_ UP_2016_022. T
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
RNDr. Ondřej Holý, Ph.D.
Ústav preventivního lékařství LF UP v Olomouci
Hněvotínská 3 775 15 Olomouc
e-mail: holy.ondrej@seznam.cz
Obdrženo: 28. 11. 2017
Přijato: 28. 5. 2018
Zdroje
2. Šálek C. Diagnostika a léčba akutních leukemií. Intern Med 2012; 14 (10): 366–372.
3. Novotvary 2015. Úřad zdravotnických informací a statistiky České republiky. [online]. Dostupné na: www: http: //www.uzis.cz/publikace/novotvary-2015.
4. Folber F, Hrabovský Š, Doubek M. Akutní lymfoblastická leukemie dospělých. Onkologie 2015; 9 (3): 125–127.
5. Starý J. Akutní leukémie u dětí. Onkologie 2010; 4 (2): 120–124.
6. Karas M. Akutní myeloidní leukémie u nemocných nad 60 let, možnosti její léčby a potenciální role alogenní transplantace krvetvorných buněk. Onkologie 2011; 5 (2): 91–95.
7. Pui CH, Robison LL, Look AT. Acute lymphoblastic leukaemia. Lancet 2008; 371 (9617): 1030–1043. doi: 10.1016/S0140-6736 (08) 60457-2.
8. Lo-Coco F, Fouad TM, Ramadan SM. Acute leukaemia in women. Womens Health 2010; 6 (2): 239–249. doi: 10.2217/whe.10.4.
9. Bertuccio P, Bosetti C, Malvezzi M et al. Trends in mortality from leukaemia in Europe: An update to 2009 and projection to 2012. Int J Cancer 2013; 132 (2): 427–436. doi: 10.1002/ijc.27624.
10. Malvezzi M, Carioli G, Bertuccio P et al. European cancer mortality predictions for the year 2016 with focus on leukaemias. Ann Oncol 2016; 27 (4): 725–731.
11. Bodey GP. Managing Infections in the Immunocompromised Patient. Clin Infect Dis 2005; 40 (Suppl 4): S239. doi: 10.1086/427328.
12. Cetkovský P. Horečka neznámého původu u granulocytopenických nemocných (tzv. febrilní neutropenie). Klin Farmakol Farm 2007; 21 (2): 67–73.
13. Cohen J. Infection in the immunocompromised host. In: Warrel DA, Cox TM, Firth JD (eds). Oxford Textbook of Medicine [monograph on the internet]. Oxford: Oxford University Press; 2012. Available from: http: //oxfordmedicine.com/view/10.1093/med/9780199204854.001.1/med-9780199204854-chapter-070204.
14. Cooper JD, Kethireddy S, Kumar A. Infections in the Immunosuppressed and Immunocompromised Patient. ICU Management 2015; 15 (3).
15. Matoušková I, Holý O. Bakteriální kontaminace vnitřního vzduchu transplantační jednotky. Epidemiol Mikrobiol Imunol 2013; 62 (4): 153–159.
16. Kolář M, Htoutou-Sedláková M, Hanulík V. Multirezistentní gramnegativní bakterie i hematoonkologicky nemocných. Postgrad Med 2012; 14 (5): 6–10.
17. Holý O, Matoušková I, Raida L. Výskyt gramnegativních bakterií v prostředí transplantační jednotky Hemato-onkologické kliniky Olomouc. Epidemiol Mikrobiol Imunol 2012; 61 (4): 103–109.
18. Sauer S, Friewald A, Maier T et al. Classification and identification of bacteria by mass spectrometry and computational analysis. PLoS One 2008; 3 (7): e2843. doi: 10.1371/journal.pone.0002843.
19. Abdollahi A, Hakimi F, Doomanlou M et al. Microbial and antibiotic susceptibility profile among clinical samples of patients with acute leukemia. Int J Hematol Oncol Stem Cell Res 2016; 10 (2): 61–69.
20. Hrabák J, Chudáčková E, Walková R. Matrix-assisted laser desorption ionization-time of flight (MALDI-TOF) mass spektrometry for detection of antibiotic resistence mechanisms: from research to routine diag-nosis. Clin Microbiol Rev 2013; 26 (1): 103–114. doi: 10.1128/CMR.00058-12.
21. Ruhnke M, Arnold R, Gastmeier P. Infection control issues in patients with haematological malignancies in the era of multidrug-resistant bacteria. Lancet Oncol 2014; 15 (13): e606–e619. doi: 10.1016/S1470-2045 (14) 70344-4.
22. Kolář M, Urbánek K, Hanulík V et al. Vliv antibiotické léčby na vývoj bakteriální rezistence. Klin Farmakol Farm 2011; 24 (4): 181–183.
23. Peleg AY, Hooper DC. Hospital-Acquired Infections Due to Gram-negative Bacteria. N Engl J Med 2010; 362 (19): 1804–1813. doi: 10.1056/NEJMra0904124.
24. Khan HA, Ahmad A, Mehboob R. Nosocomial infections and their control strategies. Asian Pac J Trop Biomed 2015; 5 (7): 509–514. doi: 10.1016/j.apjtb.2015.05.001.
25. Madappa T. Escherichia coli (E coli) infections. [online]. Available from: https: //emedicine.medscape.com/article/217485-overview.
26. Taj M, Farzana T, Shah T et al. Clinical and microbiological profile of pathogens in febrile neutropenia in hematological malignancies: a single center prospective analysis. J Oncol 2015; 2015 : 596504. doi: 10.1155/2015/596504.
27. Chen CY. Tsay W, Tang JL et al. Epidemiology of bloodstream infections in patients with haematological malignancies with and without neutropenia. Epidemiol Infect 2010; 138 (7): 1044–1051. doi: 10.1017/S0950 268809991208.
28. Hansen DS, Hazel MA, Abiola T et al. Recommended test panel for differentiation of klebsiella species on the basis of a trilateral interlaboratory evaluation of 18 biochemical tests. J Clin Microbiol 2004; 42 (8): 3665–3669. doi: 10.1128/JCM.42.8.3665-3669.2004.
29. Chou HC, Lee CZ, Li-chen MA et al. Isolation of a chromosomal region of klebsiella pneumoniae associated with allantoin metabolism and liver infection. Infect Immun 2004; 72 (7): 3783–3792. doi: 10.1128/IAI.72.7.3783-3792.2004.
30. Hádžić S, Čustović A, Smajlović J et al. Distribution of nosocomial infections caused by Klebsiella pneumoniae ESBL strain. J Environ Occup Sci 2012; 1 (3): 141–146. doi: 10.5455/jeos.20121205084327.
31. Podschun R, Ullmann U. Klebsiella spp. as nosocomial pathogens: epidemiology, taxonomy, typing methods, and pathogenicity factors. Clin Microbiol Rev 1998; 11 (4): 589–603.
32. Marra AR, Wey SB, Castelo A et al. Nosocomial bloodstream infections caused by Klebsiella pneumoniae: impact of extended-spectrum beta-lactamase (ESBL) production on clinical outcome in a hospital with high ESBL prevalence. BMC Inf Dis 2006; 6 : 24. doi: 10.1186/1471-2334-6-24.
33. Qutreshi S. Klebsiela Infections. [online]. Available from: https: //emedicine.medscape.com/article/219907 - overview.
34. Fraser S. Enterobacter Infections. [online]. Available from: https: //emedicine.medscape.com/article/216845 - overview.
35. Gustinetti G, Mikulska M. Bloodstream infections in neutropenic cancer patients: A practical update. Virulence 2016; 7 (3): 280–297. doi: 10.1080/21505594.2016.1156821.
36. Ram R, Farbman L, Leibovici L et al. Characteristics of initial compared with subsequent bacterial infections among hospitalised haemato-oncological patients. Int J Antimicrob Agents 2012; 40 (2): 123–126. doi: 10.1016/j.ijantimicag.2012.05.001.
37. Tomblyn M, Chiller T, Einsele H et al. Guidelines for preventing infectious complications among hematopoietic cell transplant recipients: a global perspective recommendations. Biol Blood Marrow Transplant 2009; 15 (10): 1143–1238. doi: 10.1016/j.bbmt.2009.06.019.
38. Trecarichi EM, Pagano L, Candoni A et al. Current epidemiology and antimicrobial resistence data for bacterial bloodstream infections in patients with hematologic malignancies: an Italian multicentre prospective study. Clin Microbiol Infect 2015; 21 (4): 337–343. doi: 10.1016/j.cmi.2014.11.022.
39. Matoušková I, Holý O. Monitoring of the environment at the transplant unit – hemato-oncology clinic. Int J Environ Res Publ Health 2014; 11 (9): 9480–9490. doi: 10.3390/ijerph110909480.
40. Ma J, Ning LI, Liu YY et al. Antimicrobial resistance patterns, clinical features, and risk factors for septic shock and death of nosocomial E. coli bacteremia in adult patients with hematological disease: a monocenter retrospective study in China. Medicine 2017; 96 (21): e6959. doi: 10.1097/MD.0000000000006959.
41. Bow EJ. Fluoroquinolones, antimicrobial resistance and neutropenic cancer patients. Curr Opin Infect Dis 2011; 24 (6): 545–553. doi: 10.1097/QCO.0b013e32834cf054.
42. Ariza-Heredia EJ, Chemaly RF. Infection control practices in patients with hematological malignancies and multidrug resistant organisms: special considerations and challenges. Clin Lymphoma Myeloma Leuk 2014; 14 (Suppl): S104–S110. doi: 10.1016/j.clml.2014.06.021.
43. Holý O, Matoušková I. The importance of cleanrooms for the treatment of haemato-oncological patients. Wspolczesna Onkol 2012; 16 (3): 266–272. doi: 10.5114/wo.2012.29298.
44. Matoušková I, Raida L, Holý O. Výskyt gramnegativních nefermentujících bakterií v prostředí transplantační jednotky Hemato-onkologické kliniky FN Olomouc. Epidemiol Mikrobiol Imunol 2012; 61 (4): 110–115.
45. Doubek M, Mayer J (eds). Postupy diagnostiky a léčby leukemií a jejich infekčních komplikací u dospělých pacientů: doporučení České leukemické skupiny – pro život (CELL) [monografie na internetu]. Česká leukemická skupina – pro život; 2013. Dostupné na: http: //www.hematology.cz/doporuceni/klinika-files/guidelines_cell_2013.pdf.
46. Kapounová G. Ošetřovatelství v intenzivní péči. Praha: Grada Publishing 2007.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek Precizovaná onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2018 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Nejasný stín na plicích – kazuistika
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Precizovaná onkologie
- Využití mikroRNA ve slinách pro diagnostiku nádorových onemocnění
- Expresní analýza OIP5-AS1 u nemalobuněčného karcinomu plic
- Kombinovaný bioinformatický a literární přístup k identifikaci dlouhých nekódujících molekul RNA, které modulují signalizaci přes receptor vitaminu D u karcinomu prsu
- Monoklonální gamapatie nejasného významu (MGUS)
- Metastáza do lymfatických uzlín na krku pri neznámom primárnom tumore
- Výskyt a antibiotická rezistence enterobakterií izolovaných z klinického materiálu od pacientů s akutní leukemií
- Malígne melanómy kože vyrastajúce na nohe
- Metastázy karcinomu prsu do baze lební
- Primární branchiogenní karcinom
- Fludarabín v liečbe indolentného lymfómu s chylothoraxom
- Terapeutické účinky specifických inhibitorů CDK4/6 při léčbě pokročilých HR-pozitivních a HER2-negativních pokročilých karcinomů prsu
- Nové techniky IGRT – sledování povrchu těla pacienta (SIGRT)
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Monoklonální gamapatie nejasného významu (MGUS)
- Metastáza do lymfatických uzlín na krku pri neznámom primárnom tumore
- Výskyt a antibiotická rezistence enterobakterií izolovaných z klinického materiálu od pacientů s akutní leukemií
- Využití mikroRNA ve slinách pro diagnostiku nádorových onemocnění
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



