-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Sekundární angiosarkomy po konzervativní léčbě nádorů prsu
Secondary Angiosarcomas after Conservation Treatment for Breast Cancers
Backgrounds:
The cancerogenic effect of ionizing radiation was documented just several years after it started to be used as a treatment option. Ionizing radiation produces a small but detectable risk of carcinoma as well as bone and soft tissue sarcomas. Over the past 20 years angiosarcomas arising from the area of the irradiated breast have been reported with increasing frequency as the number of women undergoing the breast conserving surgery with consecutive radiotherapy has increased also. Angiosarcomas can originate from either lymphatic or capillary endothelium, namely lymphangiosarcomas and haemangiosarcomas . The most of haemangiosarcomas arising from the breast skin developed in the irradiated area after breast conserving procedure – secondary angiosarcomas. Lymphangiosarcoma is typically associated with longstanding extremity lymphedema – Stewart-Treves syndrome.Cases:
We report three cases of angiosarcomas which occured in this region after breast conserving treatment and we also review the literature.Conclusion:
Paradoxically, the decrease in the use of radiotherapy to the post-mastectomy chest wall and the axillary area is expected to reduce the incidence of angiosarcomas, while the increase in the use of breast conserving procedure plus radiotherapy could lead to increased incidence of angiosarcomas in the residual breast tissue. Special attention should be paid to skin leasions and changes occuring after breast conserving treatment and especially to the ones with the skinthickening. The early detection and diagnosis has the crucial prognostic value.Key words:
secondary angiosarcoma – radiotherapy – breast cancer – breast conserving treatment
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
23. 5. 2011Accepted:
19. 9. 2011
Autoři: R. Vojtíšek 1; Z. Kinkor 2; J. Fínek 1
Působiště autorů: Radioterapeutické a onkologické oddělení, FN Plzeň 1; Šiklův ústav patologie, LF UK v Plzni a FN Plzeň 2
Vyšlo v časopise: Klin Onkol 2011; 24(5): 382-388
Kategorie: Kazuistiky
Souhrn
Východiska:
Kancerogenní efekt ionizujícího záření byl prokázán již pár let poté, co se začalo používat v lékařství. Ionizující záření působí malé, přesto detekovatelné riziko vzniku nejen karcinomů, ale i sarkomů kostí a měkkých tkání. V posledních dvaceti letech jsou v literatuře stále častěji popisovány angiosarkomy vycházející z ozářeného prsu, což je způsobeno tím, že přibývá množství žen, které byly léčeny konzervativními chirurgickými postupy s nutností následné radioterapie. Angiosarkomy mohou vycházet buď z endotelu lymfatických cév – lymfangiosarkomy, anebo z endotelu krevních cév – hemangiosarkomy. Většina hemangiosarkomů vyrůstajících na kůži prsu vznikla v ozářeném terénu po záchovném chirurgickém výkonu – tzv. sekundární angiosarkomy. Lymfangiosarkom vzniká typicky na končetině s chronickým lymfedémem – Stewartův-Trevesův syndrom.Případy:
V našem článku popisujeme tři případy angiosarkomů vzniklých v ozářeném prsu po konzervativní léčbě karcinomu prsu, které jsme pozorovali na našem pracovišti. Ve všech případech se jednalo o hemangiosarkom. Rovněž předkládáme literární přehledZávěr:
Paradoxní je, že pokles v použití radioterapie na oblast hrudní stěny a oblast axily by mohl vést k redukci incidence angiosarkomů, zatímco zvýšení použití konzervativních operačních postupů s následnou radioterapií může tuto frekvenci naopak zvyšovat. Je potřeba věnovat zvláštní péči kožním lézím a změnám vzniklým po prs záchovných výkonech a zejména těm, kde je přítomno zesílení kožního krytu, protože i zde má zásadní prognostický význam časná diagnóza.Klíčová slova:
sekundární angiosarkom – radioterapie – karcinom prsu – prs šetřící léčbaÚvod
Kancerogenní efekt ionizujícího záření byl prokázán již pár let poté, kdy se začalo používat v lékařství. Několik případů kožních nádorů u pracovníků chronicky exponovaných ionizujícímu záření popsali na počátku 20. století Porter a White [1]. Ionizující záření působí malé, přesto detekovatelné riziko vzniku nejen karcinomů, ale i sarkomů kostí a měkkých tkání. Radiačně indukované sarkomy byly poprvé zaznamenány ve 20. letech minulého století ve Spojených státech amerických u pracovníků natírajících radiem hodinkové ciferníky [2]. Radiačně indukované sarkomy, konkrétně fibrosarkom a osteosarkom, po radioterapii nádoru prsu byly poprvé literárně popsány Warrenem a Sommerem v roce 1936 [3], resp. Hatcherem v roce 1945 [4]. Nejčastějšími postradiačními sarkomy v různých lokalizacích jsou maligní fibrózní histiocytom [5,6], fibrosarkom [7], osteosarkom a angiosarkom [8]. Angiosarkomy jsou jednou z nejméně častých forem postradiačních sarkomů, ale jednou z nejčastějších forem vyrůstajících v prsním parenchymu [9]. V posledních dvaceti letech jsou v literatuře stále častěji popisovány angiosarkomy vycházející z ozářeného prsu, což je způsobeno tím, že přibývá množství žen, které byly léčeny konzervativními chirurgickými postupy s nutností následné radioterapie [10–12].
Angiosarkomy mohou vycházet buď z endotelu lymfatických cév – lymfangiosarkomy, anebo z endotelu krevních cév – hemangiosarkomy. Dříve byly popisovány dohromady vlivem špatné a neucelené klasifikace. I dnes, přes použití nejrůznějších imunohistochemických metod, jsou často kategorizovány společně [13]. Hemangiosarkomy jsou obvykle lokalizovány na kůži nebo na povrchových měkkých tkáních [14] a většina z těch, vyrůstajících na kůži prsu, vznikla v ozářeném terénu po záchovném chirurgickém výkonu [9] – tzv. sekundární angiosarkomy. Kožní lymfangiosarkom vzniká typicky na končetině s chronickým lymfedémem – klasickým příkladem je Stewartův-Trevesův syndrom [15].
Virtanen et al [16] uvádí při desetiletém follow-up kumulativní věkově standardizovanou incidenci sekundárních angiosarkomů všech lokalizací 0,02/1 000 pacientů neléčených radioterapií. Naproti tomu po radioterapii (± chemoterapii) je kumulativní incidence sekundárních angiosarkomů 0,06/1 000 pacientů. Vyšší riziko je zejména u pacientů léčených jak radioterapií, tak i chemoterapií. Relativní riziko vzniku angiosarkomu u pacientek, které podstoupily léčbu karcinomu prsu je podle National Cancer Institute 15,9 [17].
Na našem pracovišti jsme za posledních 10 let pozorovali výskyt sekundárního angiosarkomu prsu u 3 pacientek, jejichž kazuistiky budou dále v textu následovat. Literárně je popsáno pouze něco málo přes stovku případů sekundárního angiosarkomu po konzervativní chirurgické léčbě karcinomu prsu.
Kazuistika č. 1
72letá pacientka podstoupila v 12/2004 parciální resekci pravého prsu a exenteraci axily s nálezem invazivního duktálního karcinomu v dolním vnitřním kvadrantu (pT2pN1b1M0, G1, ER 86 %, PR 42 %, MiB1 17 %, HER2/neu negativní, uzliny 2/19 pozitivní). Následně absolvovala v období 2–4/2005 adjuvantní radioterapii pravého prsu a svodné lymfatické oblasti 50 Gy X svazkem s dávkovou eskalací na oblast lůžka tumoru o 17,6 Gy elektronovým svazkem. Akutní postradiační kožní reakce měla charakter syté erytematózní dermatitidy difuzně a deskvamační dermatitidy v pravém nadklíčku. Poté byla léčena adjuvantní hormonální terapií v celkové době 5 let (tamoxifen 2 roky, exemestan 3 roky).
Při následných USG a MG kontrolách bylo zjištěno pouze zesílení kožního krytu pravého prsu a postoperační a postradiační změny periareolárně a směrem k dolnímu vnitřnímu kvadrantu. Klinicky byla kůže klidná. V 2/2008 byl již klinicky patrný drobný hematom v horním vnitřním kvadrantu (pacientka udávala pád ze štaflí), v 3/2008 při USG vyšetření bylo opět popsáno pouze zesílení kožního krytu. Na další klinické kontrole v 5/2008 bylo již zjištěno v oblasti, kde byl původně hematom, vyvýšené ložisko s navalitými okraji a černou krustou na povrchu, bradavka pravého prsu byla výrazně zarudlá. Ihned byla odeslána na chirurgické oddělení a indikována k ablaci pro suspektní recidivu základního onemocnění. Na předoperačně provedeném CT vyšetření v 5/2008 byl popsán nepravidelný tumorózní útvar v pravém prsu o velikosti 4,5 × 5 cm (obr. 1). Týž měsíc podstoupila pacientka ablaci pravého prsu s následujícím histologickým nálezem – v kůži a podkoží polokulovité ložisko 25 × 25 × × 7 mm, povrchově ulcerované, prokrvácené až vaskularizované, tmavě červené barvy. V dermis zastižena rozsáhle prokrvácená tkáň, desmoplasticky změněná s ložisky low grade hemangiosarkomu (obr. 2). Následně bylo indikováno pouhé pečlivé sledování. V 8/2008 byl v mediálním okraji jizvy klinicky patrný výsev cca 4 ložisek lividního charakteru s hematomem v podkoží, v laterálním okraji jizvy 2 ložiska. V 9/2008 jí byla provedena široká excize obou pólů jizvy s tímto histologickým nálezem – v papilární i retikulární dermis zastižena ložiska infiltrativně rostoucího low grade hemangiosarkomu. Nadále bylo opět doporučeno pouze sledování. Při USG vyšetření v 4/2009 byly nalezeny 2 suspektní uzliny v levém axilárním výběžku a v přední axilární řase, v 5/2009 byla provedena punkce jedné uzliny pod USG kontrolou – v materiálu byly nalezeny struktury high grade angiosarkomu, který byl tvořen nepravidelnými kapilárními strukturami a místy měl nediferencovanou vřetenobuněčnou složku. Nádorové buňky byly CD34, F8, AE1, AE3, CAM5.2 negativní a CD31, aktin pozitivní, proliferační aktivita 25 %. Následně v 6/2009 podstoupila pacientka ablaci levého prsu – na rozhraní dolních kvadrantů a těsně pod bradavkou byla nalezena tmavě fialově červená ložiska průměru 8 mm, 30 mm, 4 mm a 8 mm, těsně pod kůží. Histologicky byla všechna ložiska tvořena strukturami infiltrativně rostoucího angiosarkomu na úrovni výrazně fibrotické dermis. Ve dvou ze sedmi nalezených lymfatických uzlin byly nalezeny metastázy angiosarkomu. V 7/2009 se kolem jizvy vpravo objevila 3 ložiska vzhledu hematomu, imponující však jako recidivy. V 11/2009 byly zjištěny v mediální a střední části jizvy vpravo zarudlé kožní infiltráty (obr. 3), při kontrole v 2/2010 byly bez výraznější progrese a v 6/2010 se na jejich místě objevily lividní lentikuly (obr. 4). Na další kontroly se již pacientka nedostavila, podle telefonického rozhovoru s ní dochází k lokální progresi, ulceraci a krvácení, ložiska jsou převazována na spádovém chirurgickém pracovišti.
Obr. 1. CT obraz hemangiosarkomu pravého prsu (pacient č. 1). Nepravidelný tumorózní útvar v pravém prsu o velikosti 4,5 x 5 cm. 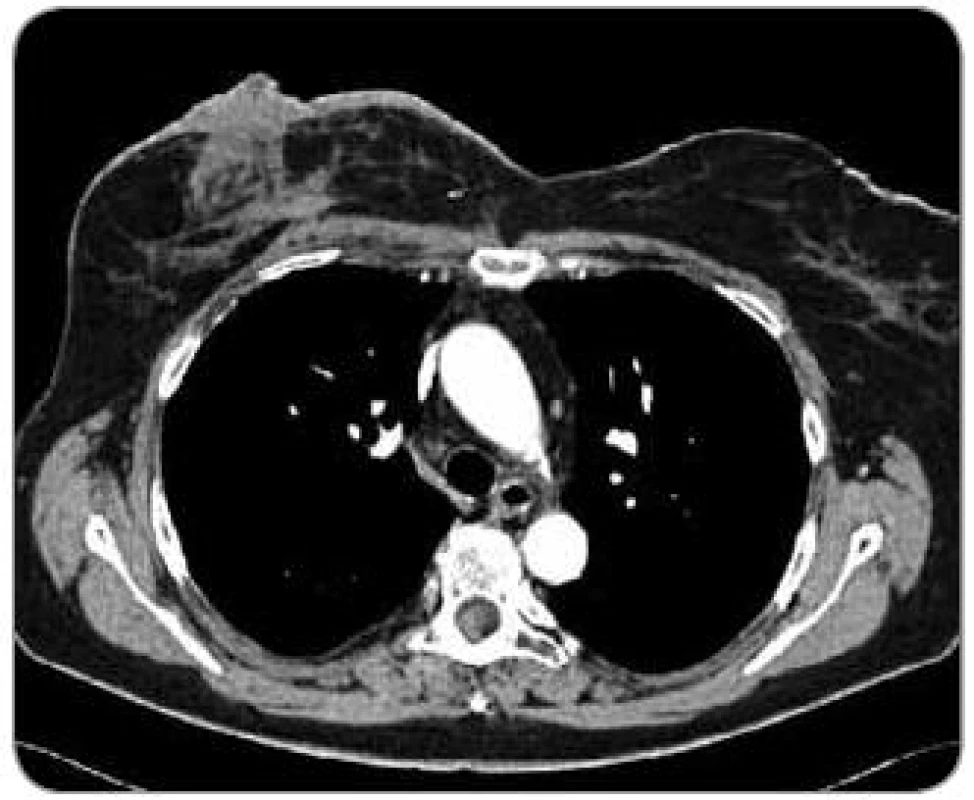
Obr. 2. Histologický obrázek hemangiosarkomu (pacient č. 1). Pod epidermis se nachází sklerotická až hyalinně přeměněná dermis s četnými ložisky hemoragií. Pouze místy lze zastihnout izolované či v drobných hnízdech uspořádané epiteloidně vyhlížející elementy simulující recidivu karcinomu. Tumor byl na několik cytokeratinů (epitelový marker) negativní, a naopak nádorové elementy exprimovaly CD31, CD34 a FVI (cévní markery), což vedlo k diagnóze angiosarkomu. 
Obr. 3. Zarudlé kožní infiltráty ve střední a mediální části jizvy po pravostranné ablaci prsu signalizující recidivu angiosarkomu (pacient č. 1). 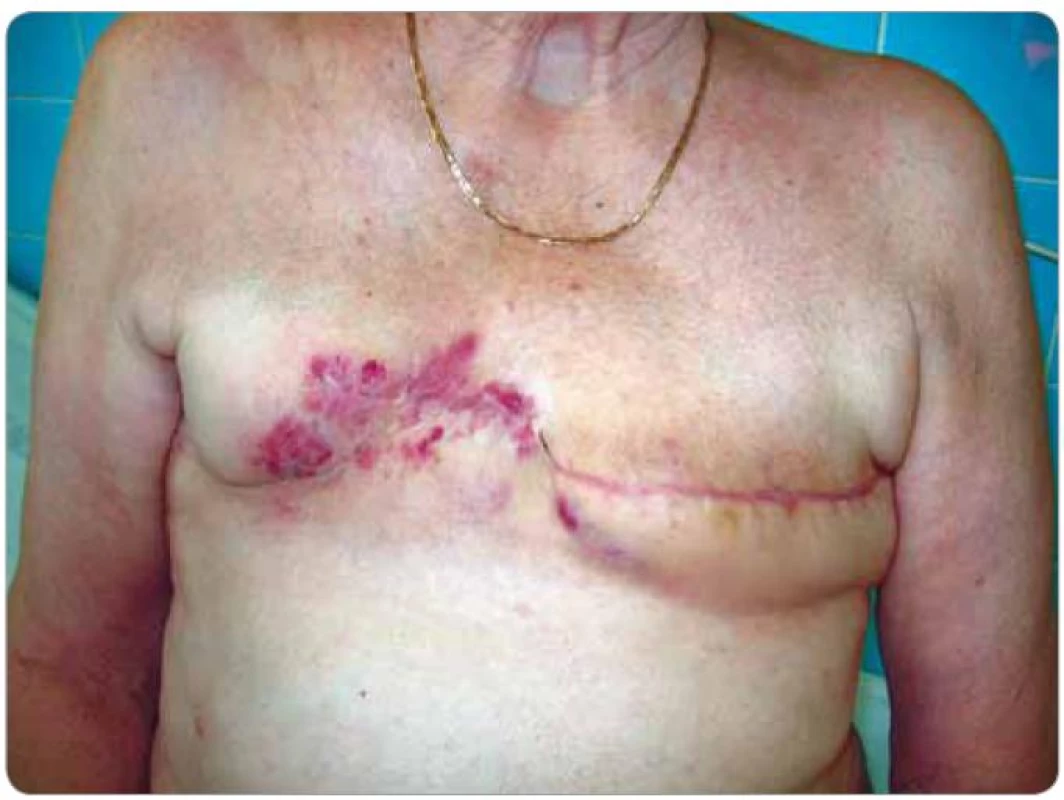
Obr. 4. Lividní lentikuly ve střední části jizvy, které se objevily 6 měsíců od vzniku kožních infiltrátů na obr. 3 (pacient č. 1). 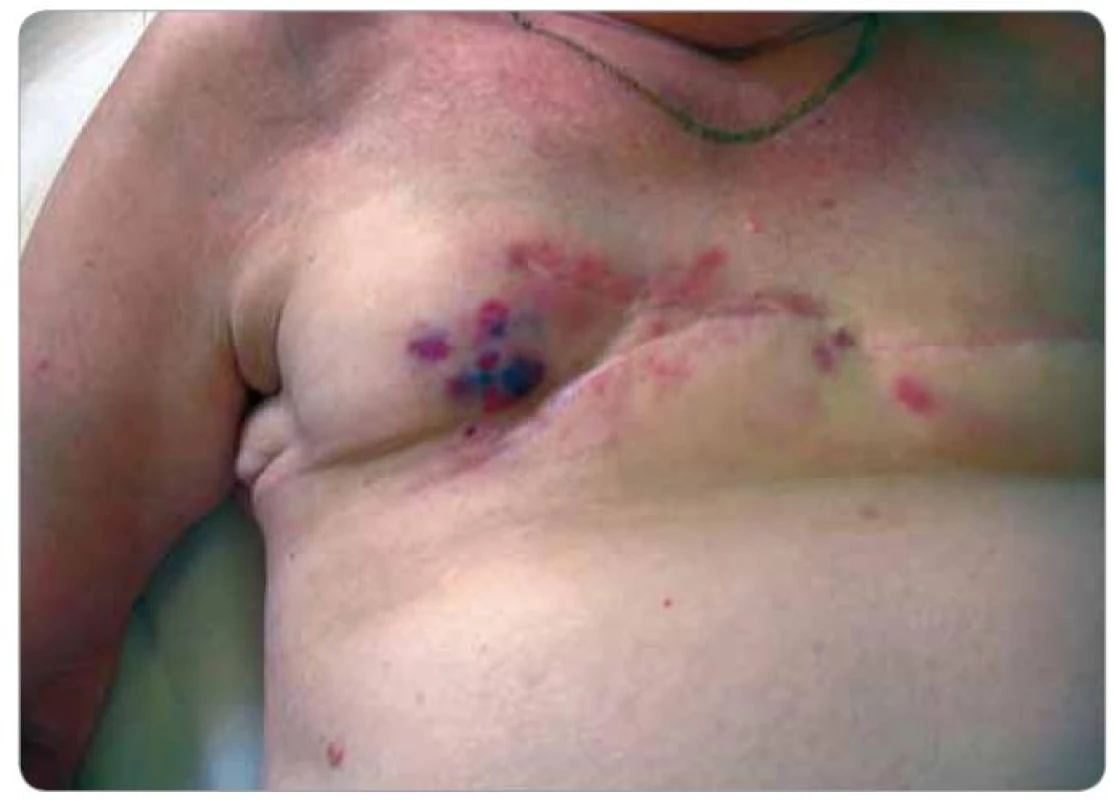
Kazuistika č. 2
67letá pacientka podstoupila v 9/2004 parciální resekci levého prsu a exenteraci axily s nálezem invazivního duktálního karcinomu v horním zevním kvadrantu (pT1cpN0M0,G2, ER 94 %, PR 78 %, MiB1 22 %, HER2/neu negativní). Následně v období 11/2004–1/2005 absolvovala adjuvantní radioterapii levého prsu, axily a nadklíčku 50 Gy X svazkem s dávkovou eskalací na oblast lůžka tumoru o 13,2 Gy elektronovým svazkem. Akutní postradiační kožní reakce měla charakter vlhké deskvamační dermatitidy v levé axile a pod levým prsem. Dále pokračovala v adjuvantní hormonální terapii tamoxifenem v celkové době 5 let do 9/2009.
Klinicky byl v levém prsu patrný lymfedém již od ukončení radioterapie, při USG kontrole v 9/2005 byl popsán nápadný lymfedém v jeho horním zevním kvadrantu a nad celým levým prsem nápadně ztluštěný kožní kryt. Při další USG kontrole v 3/2006 byly popsány výraznější fibrózní změny v ozářeném prsu. Při klinické kontrole v 9/2008 byl levý prs klinicky již bez lymfedému, byly však patrny teleangiektázie kolem levého klíčku, které se ještě zvýraznily do další kontroly v 3/2009. Při USG kontrole v 3/2009 byly opět popsány pouze postradiační změny levého prsu. V 8/2009 byla pacientka odeslána chirurgem na kožní kliniku pro suspektní melanom na levém prsu – nález kožního lékaře: v levém nadklíčku radiodermatitida s četnými teleangiektáziemi, pod prsním dvorcem nepravidelná ploška asi 2,5 × 1 cm tmavě fialová, ve dvou místech s černou krustou. Klinicky i dermatoskopicky cévní léze – hematom. Bez nutnosti excize, kontrola za měsíc. V 9/2009 absolvovala kontrolu na radioterapeutické ambulanci, při které udávala občasné krvácení z ložiska. Oba prsy byly bez hmatné rezistence, pod dvorcem levého prsu tmavě červené až černé nepravidelné ložisko vystupující cca 2–3 mm nad niveau, v jeho blízkosti je červené ploché kulovité ložisko na ploše cca 1 cm2 (obr. 5), v levém nadklíčku postradiační teleangiektázie. I přes stanovisko dermatologa byla ihned odeslána na chirurgickou ambulanci s doporučením excize a obavou z diagnózy angiosarkomu. Na chirurgickém oddělení jí byla provedena probatorní excize útvarů s následujícím histologickým nálezem – centrálně tmavě červené a fialové nepravidelné vyklenutí cca 25 × 20 mm, na řezu prokrvácené, dosahující subkutánního tuku, drobné oranžové ložisko 15 × 14 mm neostrých okrajů na povrchu kůže. Histologicky low grade angiosarkom v rozsahu dermis rozsáhle prokrvácený s krvácením zasahujícím i do subkutis. Dermis je výrazně fibrotická. Popsané ložisko menších rozměrů bez známek angiosarkomu. Onkologem byla následně doporučena ablace prsu, kterou pacientka podstoupila v 10/2009 – histologicky již bez nálezu nádorového bujení. Pacientka byla v klinické remisi až do 4/2011, kdy se objevily nafialovělé drobné papulky na ploše cca 2 cm2 v oblasti laterálního okraje jizvy po ablaci (obr. 6). Okamžitě byla provedena široká excize a histologicky verifikována lokální recidiva low grade hemangiosarkomu. Další léčba zatím indikována nebyla.
Obr. 5. Postradiační hemangiosarkom (pacient č. 2). Tmavě červené až černé nepravidelné ložisko cca 3 mm nad niveau, další červené ploché ložisko v jeho blízkosti mediálně. 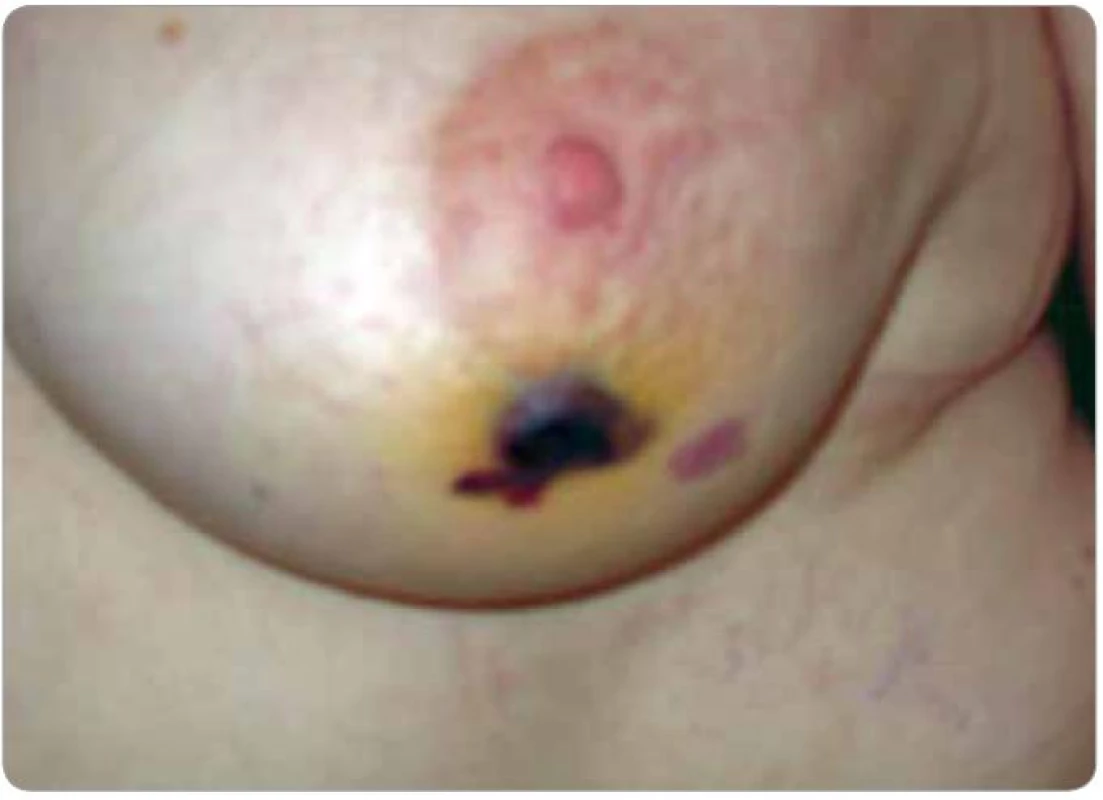
Obr. 6. Lokální recidiva hemangiosarkomu (pacient č. 2). Nafialovělé papulky v laterální části jizvy po ablaci. 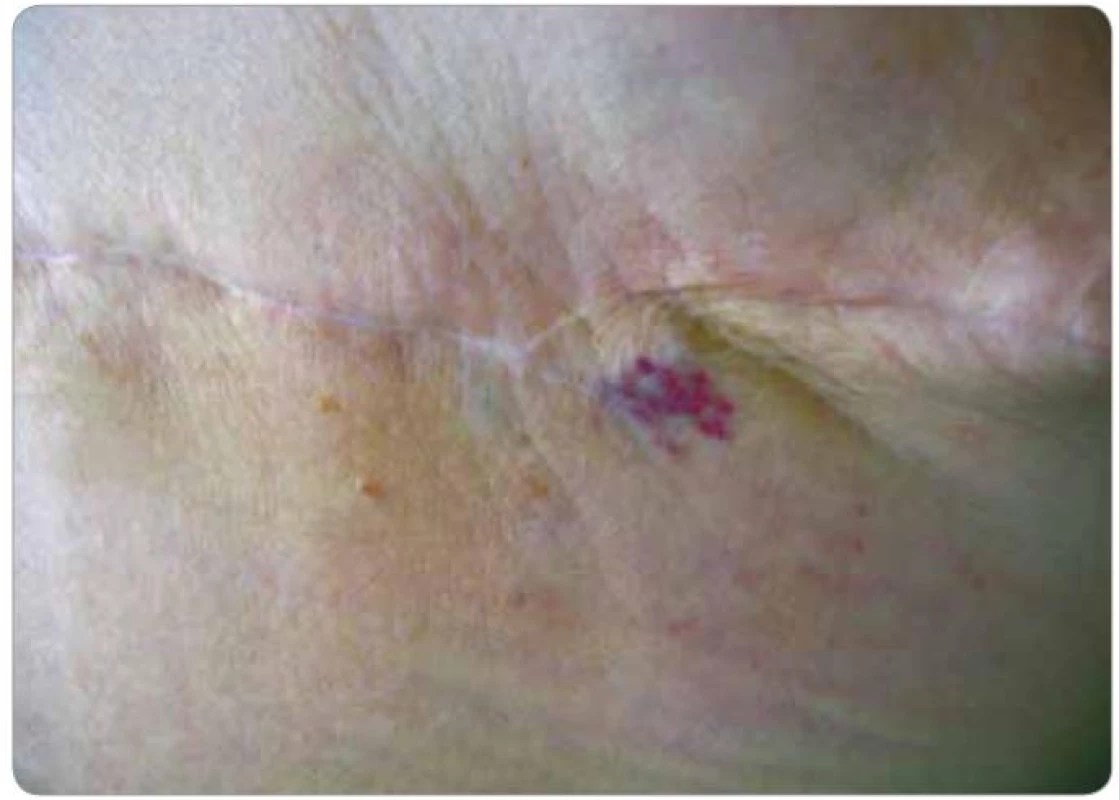
Kazuistika č. 3
55letá pacientka podstoupila v 11/1998 parciální resekci levého prsu a exenteraci levé axily s nálezem duktálního invazivního karcinomu v horním zevním kvadrantu (pT1pN1M0, G2, ER 100 %, PR 80 %, MiB1 7 %), následně absolvovala adjuvantní radioterapii levého prsu a svodné lymfatické oblasti 50 Gy X svazkem s eskalací dávky na oblast lůžka tumoru do 66 Gy v období od 12/1998 do 2/1999. Během léčby se objevila akutní erytematózní dermatitida s ložiskem vlhké deskvamace kolem levého klíčku a byl přítomen lymfedém prsu (již od operace). Rovněž pokračovala v adjuvantní hormonální terapii tamoxifenem v celkové době 5 let.
Na mamografických, ultrasonografických a klinických kontrolách byly až do 1/2005 popisovány pouze pooperační a postradiační změny v oblasti horního zevního kvadrantu se zesílením kožního krytu a lymfedémem levého prsu. Po udávaných opakovaných EKG vyšetřeních a holterizaci v 5/2005 jí zůstalo zarudnutí na kůži levého prsu v dolním vnitřním kvadrantu, které postupně přešlo v puchýřek. Na USG vyšetření v 8/2005 nebylo v levém prsu nalezeno ložisko, ale v místě eflorescence byl 10 mm velký okrsek prosáklé kůže, nešířící se hlouběji do podkoží, na MG v 8/2005 pouze zesílení kožního krytu. Ložisko o velikosti 7 × 5 mm jí bylo excidováno – histologicky v dermis zastižen středně dobře až špatně diferencovaný duktální invazivní karcinom, infiltrace do epidermis nebyla zjištěna. Imunohistochemické vyšetření hormonálních receptorů a nádorových markerů: ER – pozitivní u méně než 1 % nádorových buněk, PR – pozitivní u méně než 1 % nádorových buněk, HER2/neu – negativní (skóre 0), proliferační marker MiB1 – pozitivní v 90 % nádorových buněk. Při klinickém vyšetření v 8/2005 (po excizi) bylo zjištěno v dolním vnitřním kvadrantu vlevo plošné erysipeloidní zarudnutí kůže o průměru 4,5 cm vzhledu pomerančové kůry, v centru se dohojuje jizvička se stehy, pod kůží zduření až charakteru rezistence asi 3 × 4 cm – hodnoceno jako relaps erysipeloidního charakteru. V 8/2005 absolvovala 1 cyklus chemoterapie schématem FAC (5-fluorouracil, doxorubicin, cyklofosfamid), ale pak byla na žádost onkologa provedena revize biopsie – vzhledem k téměř negativnímu výsledku imunohistochemického vyšetření hormonálních receptorů byla ještě provedena další imunohistochemická barvení: cytokeratiny AE1-3, K903, CK7 a CAM5.2 byly negativní, CD34 negativní, faktor VIII a CD31 pozitivní. Nález byl tedy reklasifikován jako epiteloidní high grade hemangiosarkom. Chemoterapeutické schéma bylo změněno a od 9/2005 zahájila léčbu kombinací MAID (doxorubicin, ifosfamid, dakarbazin). Do 12/2005 absolvovala celkem 4 cykly tímto schématem, klinicky byla patrná lokální regrese nálezu – na levém prsu mírná postradiační pigmentace a edém, již bez zarudnutí kolem jizvy, původní ložisko obtížně diferencovatelné, spíše jen ztužení než rezistence. V 1/2006 podstoupila levostrannou mastektomii – amputát prsu byl celý prokrájen ve 4mm lamelách, žádný tumor však již nalezen nebyl. V 2/2006 podstoupila ještě 1 cyklus chemoterapie MAID. Klinicky byla v 6/2006 jizva bez lokálního relapsu. USG kontrola v 4/2007 bez patologického nálezu. Na další kontroly již nedocházela – dle dostupné nemocniční dokumentace byla v 4/2010 naživu (remisi nebo progresi nebylo možno z dostupných nálezů posoudit).
Diskuze
Co se etiopatogeneze sekundárních angiosarkomů týká, existuje určitý rozdíl mezi angiosarkomem prsu či hrudní stěny a lymfangiosarkomem horní končetiny. Vzniku lymfangiosarkomu horní končetiny předchází většinou lymfedém této končetiny vzniklý po chirurgickém výkonu v axile s následnou adjuvantní radioterapií nebo i bez ní. Poprvé byl tento typ sarkomu popsán v souvislosti s dlouhotrvajícím lymfedémem horní končetiny jako Stewartův-Trevesův syndrom [15]. Postižená končetina nebývá, jak je zřejmé, přímo ozařovaná, ke zvýšení rizika tedy přispívá radioterapie nepřímo, prostřednictvím lymfatické blokády vedoucí ke vzniku lymfedému. Aby bylo možné označit angiosarkom prsu či hrudní stěny za postradiační, měl by splňovat klasická Cahanova kritéria radiací indukovaného sarkomu, a to histologicky potvrzený sarkom vyrůstající z ozářené oblasti po dlouhé periodě latence [21]. Sekundární angiosarkomy mají multifaktoriální etiologii, nejvíce zkoumanými faktory jsou chronické edematózní, fibrotické a vaskulární změny prsu po operačním výkonu s následnou radioterapií. Mechanizmus vzniku radiačně indukovaného angiosarkomu a Stewartova-Trevesova syndromu je tedy v podstatě velmi podobný – celulární edém a následný vznik angiosarkomu [19]. Navíc zde hraje roli přímé poškození struktury DNA ionizujícím zářením. Pouze molekulární genetika může zjistit radiačně indukované poškození, např. k-ras onkogen nebyl nalezen v angiosarkomech vzniklých po radioterapii [22]. Budeme-li se věnovat edému prsu jako nejvíce citovanému etiologickému faktoru, je třeba si uvědomit, že všechny pacientky léčené konzervativním nebo radikálním chirurgickým zákrokem mají vždy ovlivněnu lymfatickou drenáž prsu [19] a mají přítomný určitý stupeň edému, ať už přechodný, subklinický, nebo perzistující, ačkoliv tento není vždy klinicky evidentní [23]. Edematózně fibrotický prs je imunologicky vulnerabilní místo, které je predisponováno ke vzniku vaskulárních tumorů díky kontinuálnímu působení angiogenních stimulů [24]. Lepší pochopení patogeneze angiosarkomů může ve svém důsledku vést k lepšímu cílení účinné léčby. Ovlivnění působení vaskulárního endoteliálního růstového faktoru (VEGF), který je velmi potentním angiogenním faktorem a který byl také prokázán v angiosarkomech [25,26], může zlepšit léčebné výsledky.
Na rozdíl od jiných postradiačních sarkomů se kožní angiosarkomy často objevují za kratší časový interval po radioterapii [9]. Cozen et al [13] udávají průměrnou dobu mezi diagnózou karcinomu prsu a vznikem angiosarkomu hrudní stěny či prsu 4,4 roku. V jiných pracích jsou udávány mediány latence mezi radioterapií a diagnózou angiosarkomu prsu 4,1 roku [9], 5,2 roku [10], 96 měsíců [18], 75 měsíců [27] a 74 měsíců [20]. Námi uvedené případy splňují kritéria postradiačního sarkomu podle Cahanových kritérií, a doby latence od ukončení radioterapie do objevení prvních příznaků angiosarkomu také odpovídají literárně uváděným údajům, konkrétně 34, 55 a 75 měsíců.
Literárně popsaných případů sekundárních angiosarkomů po léčbě karcinomu prsu je velmi málo. V roce 2003 publikovali Monroe et al [12] rozsáhlý literární přehled týkající se angiosarkomů vyrůstajících v ozářeném prsu po konzervativním chirurgickém výkonu a zaznamenali pouze 93 do té doby literárně popsaných případů. V Národním onkologickém ústavu v Budapešti bylo mezi lety 1980 a 2004 zaznamenáno 9 případů postradiačního angiosarkomu po léčbě karcinomu prsu (8× angiosarkom prsu po konzervativním výkonu, 1× angiosarkom hrudní stěny po předchozí mastektomii), jak o tom referovali v roce 2001 Polgár et al [11] a v roce 2006 Fodor et al [27]. Hodgson et al [10] v roce 2007 zveřejnili 31 případů sekundárního angiosarkomu prsu zaznamenaných ve Floridském onkologickém datovém systému (Florida Cancer Data System) v období 1981–2000. Na základě údajů Finského onkologického registru bylo zjištěno, že se u pacientek léčených pro karcinom prsu v období 1953–2003 objevil sekundární angiosarkom ve 14 případech. Ve všech případech se jednalo o hemangiosarkom [16]. Dva případy Stewartova-Trevesova angiosarkomu detailně popisují Autio et al [29]. Tyto dva případy se objevily v 90. letech na kožním oddělení Helsinské univerzitní nemocnice a typicky postihly horní končetinu v chronicky edematózním terénu za 10 let od radikální mastektomie, axilární exenterace a adjuvantní radioterapie.
Angiosarkomy nemívají typický klinický průběh, proto se také velmi obtížně diagnostikují. Často se prezentují jako nebolestivé erytematózní nebo červenožluté oblasti, případně jako modré, červené, fialové nebo černé uzlíky. Může být také přítomen edém a někdy bývají asociované se zesílením kožního krytu [9]. Ne vždy lze diferencovat palpovatelný tumor [20]. Mohou se objevovat jako solitární nebo mnohočetná ložiska, a to v poměru přibližně 1 : 1 [27]. Obvykle se jedná o agresivní léze, které často lokálně relabují a vzdáleně metastazují [14]. Nejčastější místo „vzdálené“ diseminace je kontralaterální prs, a to cestou kožní lymfatiky [12]. Dále často metastazují do plic, jater, kostí a lymfatických uzlin [14,20,27]. Nejdůležitějším momentem v rámci diagnostiky je proto časná klinická detekce lékařem, který musí na možnost vzniku sekundárního angiosarkomu myslet. Diagnóza může být nepřesná v případě, že proběhlo pouze cytologické vyšetření [20] a byla-li bioptována jen malá část léze [19]. Nádorové buňky bývají pozitivní na faktor VIII-related antigen a CD31/CD34+ [27]. Velmi důležité je odlišení low grade a high grade lézí – ty jsou velmi agresivní, rychle rostoucí a časně recidivují [12]. Zobrazovací metody mají v diagnostice angiosarkomu spíše doplňkový význam v rámci primární diagnostiky. Mamografie může prokázat zesílení kožního krytu [12,27], přesto až 33 % pacientek má negativní nález na MG [30]. Zdá se, že důležitější úlohu může hrát MR [12]. Co se diferenciální diagnostiky týká, musí se dobře diferencované angiosarkomy odlišit od prostého angiomu a od atypické vaskulární léze (AVL), které také mohou vzniknout v ozářeném prsu po záchovné operaci. AVL se typicky prezentují jako vyvýšené diskrétní kožní uzlíky, obvykle solitární [9], anebo jako erytematózní plaky, a v současné době je třeba vnímat je jako prekurzory angiosarkomů [34]. Je také nutné odlišit angiosarkomy od kožních metastáz karcinomu prsu, zejména erysipeloidní – tyto však nemají modročervenou barvu jako angiosarkom. Snadné odlišení umožní histologické vyšetření. Erysipel prsu má rychlý nástup, je spojen s horečkou a zvýšenou hodnotou CRP. Vaskulitida zase není tak lokalizovaná jako angiosarkom. Angiosarkomy mohou někdy působit jako prosté změny po traumatu [12]. Riziko mylné diagnózy není zanedbatelné a není řídké [11,19]. I v jednom námi prezentovaném případu došlo (kazuistika č. 3) k falešné diagnóze recidivy duktálního karcinomu, což bylo následně po revizi přehodnoceno.
Největší šanci na přežití dává radikální mastektomie s axilární disekcí, event. široká lokální excize [18,20,28]. I přesto nelze mastektomii považovat za dostatečnou léčebnou metodu [19]. K zajištění lokální kontroly je třeba využít také pooperační radioterapii [9]. Ta může být přínosná i v situacích, kdy je tumor inoperabilní [18]. Zdá se, že by optimálním frakcionačním režimem mohla být akcelerovaná hyperfrakcionovaná radioterapie, ať už pooperačně, nebo předoperačně, vzhledem k přítomnosti velké růstové frakce v nádorové populaci [31]. Je-li radioterapie použita k primární léčbě angiosarkomu nebo k další léčbě relapsu, je možné jí kombinovat s hypertermií, jejíž léčebné účinky v této indikaci byly také literárně popsány – DelMastro et al [19], Weber et al [28]. Úloha systémové léčby není ještě zdaleka zhodnocena [12,31], odpověď na současná cytostatika (antracykliny, dakarbazin, ifosfamid, fluorouracil) je špatná [18], což však nebyl případ pacientky popsané v kazuistice č. 3, která po kombinaci doxorubicin, ifosfamid a dakarbazin dosáhla kompletní patologické odpovědi. Je možné použít také paklitaxel, který se používá u angiosarkomů jiných lokalizací [32]. Také je možné využít inhibitory proteinových kináz a cílenou léčbu proti nádorovým cévním strukturám [12].
Prognóza sekundárního angiosarkomu je vzhledem k často pozdní diagnóze, nediferencovanému původu a následné hematogenní a lymfogenní diseminaci velmi špatná [29].
Nejdůležitějším prognostickým faktorem pro vznik vzdálené diseminace a také pro přežití je histopatologický fading [14,33]. Rovněž rozsah kožních lézí je významným prediktorem přežití [27]. Medián přežití se pohybuje v různých pracích mezi 12 a 26 měsíci [18,20,27].
Závěr
Pokles v použití radioterapie na oblast hrudní stěny a oblast axily by mohl vést k redukci incidence angiosarkomů, zatímco zvýšení použití konzervativních operačních postupů s následnou radioterapií může tuto frekvenci naopak zvyšovat [13,19]. Pokles incidence lymfangiosarkomu horní končetiny je dán také ústupem od radikální Halstedtovy operace v posledních 30 letech. Je potřeba věnovat zvláštní péči kožním lézím a změnám vzniklým po prs záchovných výkonech [27], a zejména těm, kde je přítomno zesílení kožního krytu. Tyto tumory rostou velmi rychle a difuzně [20]. V budoucnu bude třeba provést další analýzy zaměřené na vztah dávka-odpověď [16]. Vzhledem k nízké prevalenci však nelze očekávat randomizované klinické studie [12].
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
MUDr. Radovan Vojtíšek
Radioterapeutické a onkologické oddělení
FN Plzeň
Alej Svobody 80
304 60 Plzeň
e-mail: vojtisekr@fnplzen.cz
Obdrženo: 23. 5. 2011
Přijato: 19. 9. 2011
Zdroje
1. Porter CA, White CJ. Multiple Carcinomata following Chronic X-ray Dermatitis. Ann Surg 1907; 46(5): 649–671.
2. Fry SA. Studies of U.S. radium dial workers: an epidemiological classic. Radiat Res 1998; 150 (Suppl 5): S21–S29.
3. Warren S, Sommer GN. Fibrosarcoma of the soft parts with special reference to recurrence and metastasis. Arch Surg 1936; 33 : 425–450.
4. Hatcher CH. Development of sarcoma in bone subjected to roentgen or radium irradiation. J Bone Joint Surg 1945; 27 : 179–195.
5. Turner WH, Greenall MJ. Sarcoma induced by radiotherapy after breast conservation surgery. Br J Surg 1991; 78(11): 1317–1318.
6. Fitzpatrick PJ. Lymphangiosarcoma and breast cancer. Can J Surg 1969; 12(2): 172–177.
7. Pierce SM, Recht A, Lingos TI et al. Long-term radiation complications following conservative surgery (CS) and radiation therapy (RT) in patients with early stage breast cancer. Int J Radiat Oncol Biol Phys 1992; 23(5): 915–923.
8. Karlsson P, Holmberg E, Johansson KA et al. Soft tissue sarcoma after treatment for breast cancer. Radiother Oncol 1996; 38(1): 25–31.
9. Fineberg S, Rosen PP. Cutaneous angiosarcoma and atypical vascular lesions of the skin and breast after radiation therapy for breast carcinoma. Am J Clin Pathol 1994; 102(6): 757–763.
10. Hodgson NC, Bowen-Wells C, Moffat F et al. Angiosarcomas of the breast: a review of 70 cases. Am J Clin Oncol 2007; 30(6): 570–573.
11. Polgár C, Orosz Z, Szerdahelyi A et al. Postirradiation angiosarcoma of the chest wall and breast: issues of radiogenic origin, diagnosis and treatment in two cases. Oncology 2001; 60(1): 31–34.
12. Monroe AT, Feigenberg SJ, Mendenhall NP. Angiosarcoma after breast-conserving therapy. Cancer 2003; 97(8): 1832–1840.
13. Cozen W, Bernstein L, Wang F et al. The risk of angiosarcoma following primary breast cancer. Br J Cancer 1999; 81(3): 532–536.
14. Brennan MF, Winter S, Maki RG. Sarcomas of the Soft Tissues and Bone. In: DeVita, Hellman and Rosenberg’s Cancer: Principles and Praktice of Oncology. 8th ed. Philadelphia: Lippincott Williams&Wilkins 2008 : 1741–1793.
15. Stewart FW, Treves N. Lymphangiosarcoma in postmastectomy lymphedema; a report of six cases in elephantiasis chirurgica. Cancer 1948; 1(1): 64–81.
16. Virtanen A, Pukkala E, Auvinen A. Angiosarcoma after radiotherapy: a cohort study of 332,163 Finnish cancer patients. Br J Cancer 2007; 97(1): 115–117.
17. Huang J, Mackillop WJ. Increased risk of soft tissue sarcoma after radiotherapy in women with breast carcinoma. Cancer 2001; 92(1): 172–180.
18. Kim MK, Huh SJ, Kim DY et al. Secondary angiosarcoma following irradiation-case report and review of the literature. Radiat Med 1998; 16(1): 55–60.
19. Del Mastro L, Garrone O, Guenzi M et al. Angiosarcoma of the residual breast after conservative surgery and radiotherapy for primary carcinoma. Ann Oncol 1994; 5(2): 163–165.
20. Marchal C, Weber B, de Lafontan B et al. Nine breast angiosarcomas after conservative treatment for breast carcinoma: a survey from French comprehensive Cancer Centers. Int J Radiat Oncol Biol Phys 1999; 44(1): 113–119.
21. Cahan WG, Woodward HQ, Highinbotham NL et al. Sarcoma arising in irradiated bone: report of eleven cases. Cancer 1948; 1(1): 3–29.
22. Joshi MG, Crosson AW, Tahan SR. Paget’s disease of the nipple and angiosarcoma of the breast following excision and radiation therapy for carcinoma of the breast. Mod Pathol 1995; 8(1): 1–4.
23. Clarke D, Martinez A, Cox RS et al. Breast edema following staging axillary node dissection in patients with breast carcinoma treated by radical radiotherapy. Cancer 1982; 49(11): 2295–2299.
24. Ruocco V, Schwartz RA, Ruocco E. Lymphedema: an immunologically vulnerable site for development of neoplasms. J Am Acad Dermatol 2002; 47(1): 124–127.
25. Zietz C, Rössle M, Haas C et al. MDM-2 oncoprotein overexpression, p53 gene mutation, and VEGF up-regulation in angiosarcomas. Am J Pathol 1998; 153(5): 1425–1433.
26. McLaughlin ER, Brown LF, Weiss SW et al. VEGF and its receptors are expressed in a pediatric angiosarcoma in a patient with Aicardi’s syndrome. J Invest Dermatol 2000; 114(6): 1209–1210.
27. Fodor J, Orosz Z, Szabó E et al. Angiosarcoma after conservation treatment for breast carcinoma: our experience and a review of the literature. J Am Acad Dermatol 2006; 54(3): 499–504.
28. Weber B, Marchal C. Three cases of breast angiosarcomas after breast-conserving treatment for carcinoma. Radiother Oncol 1995; 37(3): 250–252.
29. Autio P, Kariniemi AL. Angiosarcoma. A rare secondary malignancy after breast cancer treatment. Eur J Dermatol 1999; 9(2): 118–121.
30. Liberman L, Dershaw DD, Kaufman RJ et al. Angiosarcoma of the breast. Radiology 1992; 183(3): 649–654.
31. Feigenberg SJ, Mendenhall NP, Reith JD et al. Angiosarcoma after breast-conserving therapy: experience with hyperfractionated radiotherapy. Int J Radiat Oncol Biol Phys 2002; 52(3): 620–626.
32. Fata F, O’Reilly E, Ilson D et al. Paclitaxel in the treatment of patients with angiosarcoma of the scalp or face. Cancer 1999; 86(10): 2034–2037.
33. Ray ME, McGinn CJ. Soft Tissue Sarcomas (Excluding Retroperitoneum). In: Perez and Brady’s Principles and Practice of Radiation Oncology. 5th ed. Philadelphia: Lippincott Williams & Wilkins 2008 : 1808–1821.
34. Patton KT, Deyrup AT, Weiss SW. Atypical vascular lesions after surgery and radiation of the breast: a clinicopathologic study of 32 cases analyzing histologic heterogeneity and association with angiosarcoma. Am J Surg Pathol 2008; 32(6): 943–950.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2011 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Nejasný stín na plicích – kazuistika
-
Všechny články tohoto čísla
- Hsp90 – cíl protinádorové terapie
- Předoperační chemoradioterapie v kombinaci s bevacizumabem u karcinomu konečníku
- Co pacientky potřebují vědět před operací mamárního karcinomu
- Neuroendoskopická biopsie tumoru mozku
- Cetuximab zvyšuje antiproliferativní účinek trastuzumabu u buněk karcinomu prsu s nadměrnou expresí ERBB2 – předběžná studie
- Adaptivní IG-IMRT karcinomu prostaty
- Parciální regrese ložisek Erdheimovy-Chesterovy nemoci v CNS po léčbě 2-chlorodeoxyadenosinem a jejich kompletní vymizení při léčbě lenalidomidem
- Sekundární angiosarkomy po konzervativní léčbě nádorů prsu
- Výsledky terapie metastatického renálního karcinomu lékem everolimus – analýza údajů z klinického registru RENIS
- Zápis ze schůze výboru České onkologické společnosti ČLS JEP konané dne 20. 9. 2011 v Olomouci
- Onkochirurg doc. MUDr. Zdeněk Pačovský, CSc., zemřel
- Recenze
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Parciální regrese ložisek Erdheimovy-Chesterovy nemoci v CNS po léčbě 2-chlorodeoxyadenosinem a jejich kompletní vymizení při léčbě lenalidomidem
- Neuroendoskopická biopsie tumoru mozku
- Sekundární angiosarkomy po konzervativní léčbě nádorů prsu
- Onkochirurg doc. MUDr. Zdeněk Pačovský, CSc., zemřel
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



