-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Neuroendoskopická biopsie tumoru mozku
Neuroendoscopic Biopsy of a Brain Tumor
Backrounds:
Neuroendoscopic biopsy is one of the techniques that can be used for histological verification of a suspected brain tumor. The use of neuroendoscopy is particularly useful for cystic tumors and para - and intraventricular brain tumors that are risky for stereotactic biopsy. The technique of navigated neuroendoscopy enables biopsy sampling under visual control, haemostasis of biopsy site and treatment of cerebrospinal fluid pathways obstruction.Patients and Methods:
Neuroendoscopic technique was used for biopsy in one patient with a solid brain tumor. 23 patients (12 males, mean age 49.7 years, range 21–75 years and 11 females, mean age 59.1 years, range 22–76 years) with a suspected cystic brain tumor underwent neuroendoscopic biopsy. Suspected intra - or paraventricular brain tumor presented indication for neuroendoscopic biopsy in 36 patients (20 males, mean age 43.9 years, range 6–80 years and 16 females, mean age 46.2 years, range 11–78 years).Results:
High grade glioma was most frequently diagnosed in patients with cystic brain tumors, followed by low grade gliomas and metastatic tumors. Diagnostic sample was obtained from all patients. Tumor resection was performed in 7 patients with a cystic tumor after neuroendoscopic biopsy and histological findings were identical in 70.1% of them. Similarly, high grade glioma was most frequently diagnosed in patients with intra or paraventricular tumors, followed by tumors originating from pineal region tissues. Diagnostic sample was obtained from 94.3% of patients. Tumor resection was performed in 5 patients after neuroendoscopic biopsy and histological findings of the resected tissue was identical with neuroendoscopic biopsy in 4 of them (80%).Conclusions:
Neuroendoscopy is a safe biopsy technique for a subset of patients who are high risk for the use of stereotactic biopsy, with comparable results. Neuroendoscopy also provides for cerebrospinal fluid circulation obstruction treatment. The use of neuronavigation or stereotactic planning is particularly useful for the planning of an optimal surgical approach, helps to maintain anatomical orientation in distorted anatomy and facilitates haemostasis in case of intraoperative bleeding.Key words:
brain tumor – neuroendoscopy – stereotaxy – biopsy
Supported by VZ MŠMT 0021622404 and MZCR IGA NS 10411-3.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
11. 3. 2011Accepted:
20. 6. 2011
Autoři: Z. Novák; J. Chrastina; I. Říha; R. Jančálek
Působiště autorů: Neurochirurgická klinika, LF MU a FN u sv. Anny v Brně
Vyšlo v časopise: Klin Onkol 2011; 24(5): 348-355
Kategorie: Původní práce
Souhrn
Východiska:
Neuroendoskopická biopsie je jednou z možností histologické verifikace předpokládaného tumoru mozku. Využití je velmi výhodné u cystických tumorů a tumorů lokalizovaných para - a intraventrikulárně, které jsou rizikové pro stereotaktickou biopsii. Technika navigované neuroendoskopie umožňuje provedení biopsie pod vizuální kontrolou, hemostázu místa odběru a řešení blokády mozkových cest.Soubor pacientů a metody:
Neuroendoskopie byla využita k provedení biopsie u jednoho pacienta se solidním mozkovým tumorem. Neuroendoskopická biopsie byla provedena u 23 pacientů s předpokládaným cystickým tumorem mozku (12 mužů, průměrný věk 49,7 roku, rozmezí 21–75 let a 11 žen, průměrný věk 59,1 roku, rozmezí 22–76 let). Předpokládaný intra - nebo paraventrikulární tumor mozku byl indikací pro endoskopickou biopsii u 36 pacientů (20 mužů, průměrný věk 43,9 roku, rozmezí 6–80 let a 16 žen, průměrný věk 46,2 roku, rozmezí 11–78 let).Výsledky:
U pacientů s cystickými tumory byl nejčastějším výsledkem biopsie high grade gliom následovaný low grade gliomy a metastatickými lézemi. Diagnostický závěr bylo možné učinit u všech pacientů. U 7 pacientů byla po neuroendoskopické verifikaci provedena resekce tumoru z kraniotomie a histologické nálezy byly identické u 70,1 %. Podobně u pacientů s intra - nebo paraventrikulárními tumory byl nejčastějším nálezem high grade gliom následovaný tumory vycházejícími z tkání pineální oblasti. Diagnostický vzorek byl získán u 94,3 % pacientů. U 5 pacientů s intraventrikulárními tumory byla s odstupem po neuroendoskopické operaci provedena resekce. Histologický obraz resekovaného tumoru u 4 pacientů (80 %) odpovídal výsledku endoskopické biopsie.Závěry:
Neuroendoskopie u části pacientů rizikových pro stereobiopsii umožňuje bezpečný odběr histologického materiálu a řešení blokády cirkulace mozkomíšního moku. Využití neuronavigace nebo stereotaktického plánování umožňuje optimální přípravu operačního přístupu, napomáhá orientaci při změněných anatomických poměrech a řešení peroperačního krvácení.Klíčová slova:
tumor mozku – neuroendoskopie – stereotaxe – biopsieVýchodisko
Histologická verifikace tumoru mozku před zahájením komplexní onkologické terapie je v současné době považována za nutnost, protože ani nejnovější zobrazovací metody neumožňují jednoznačnou druhovou diagnostiku mozkového nádoru. Mimo vyšetření tkáně nádoru získané při resekčním výkonu lze k odběru vzorku využít stereotaktickou techniku a techniku neuroendoskopickou.
Stereotaktická punkční biopsie mozkového tumoru je riziková nejen u cévnatých tumorů a nádorů v blízkosti komplexních cévních struktur (pineální oblast, kavernózní splav a okolí Sylviovy rýhy), ale také u cystických tumorů a tumorů nacházejících se v mozkových komorách nebo v jejich okolí. Odběr vzorku je zde spojen s rizikem krvácení do dutiny nádorové cysty nebo komorového systému, které může zůstat dlouho asymptomatické a manifestovat se až při kritické intrakraniální hypertenzi. Přímá vizuální kontrola místa odběru vzorku umožňuje vyhnout se cévám ve stěně nádorové cysty nebo komory a provést případně hemostázu bipolární koagulací. Navíc neuroendoskopie umožňuje volbu místa odběru tkáně ze stěny cysty nebo komory na základě makroskopického obrazu při přímé inspekci, protože stěna nádorové cysty může být tvořena normální tkání s ostrůvky nádorové tkáně. Podobně je možné adekvátně zvolit místo odběru vzorku z intraventrikulárního nebo paraventrikulárního nádoru s ohledem např. na cévní struktury ve stěně komory a oblasti prorůstání paraventrikulárního nádoru do komory [1].
Mimo zlepšení bezpečnosti a diagnostické výtěžnosti bioptického odběru je nutné vzít do úvahy i terapeutické možnosti neuroendoskopie. Obsah nádorové cysty je možné v průběhu neuroendoskopického výkonu aspirovat podobně jako při stereotaktické punkci, ale zároveň je možné cystu drénovat do komorového systému. U pacientů s tumorem blokujícím tok mozkomíšního moku je možné obnovit průchodnost mozkových cest např. přímým výkonem na tumoru nebo vytvořením alternativní cesty – bypassu mozkové cirkulace (např. endoskopická fenestrace spodiny III. komory při blokádě mozkovodu, endoskopická septostomie při blokádě foramen Monroi).
Cílem sdělení je prezentace zkušeností s využitím neuroendoskopické techniky pro diagnostiku mozkových tumorů, především tumorů cystických, para - a intraventrikulárních.
Soubor pacientů a metody
Technika stereotakticky navigované endoskopie byla na Neurochirurgické klinice LF MU a FN u sv. Anny zavedena roku 1997. Neuroendoskopické operace byly prováděny převážně u pacientů s hydrocefalem a arachnoidálními cystami, ovšem první neuroendoskopická biopsie tumoru mozku byla provedena již roku 1999. Plánování neuroendoskopických operací bylo zpočátku prováděno pomocí stereotaktického rámového systému Zamorano Dujovny se softwarem Praezis, ovšem od roku 2004 používáme neuronavigační systém Brain Lab Vector Vision Sky.
V neurochirurgii je možné používat endoskopy rigidní i flexibilní, ovšem vzhledem ke kvalitě obrazu a možnosti plánování s volbou optimální trajektorie považujeme za výhodnější pro využití v neuroonkologii systémy rigidní.
Plánování neuroendoskopického výkonu by mělo splňovat dva požadavky: optimální dosažení cílové struktury z hlediska plánovaného výkonu a minimalizaci rizika ohrožení důležitých neurovaskulárních struktur v okolí trajektorie nebo cílové struktury.
U cystických tumorů je nutné stanovit bezpečné místo pro vstup endoskopu do cysty mimo cévní struktury v její stěně. Zvolená trajektorie by měla dále umožnit bezpečnou biopsii předpokládaného nádorového uzlu ve stěně cysty. Místo fenestrace cysty do komory volíme mimo cévní struktury obvykle v místě, kde je septum separující komoru a cysty nejtenčí, a tedy nejlépe identifikovatelné. Obrácený postup, fenestrace cystického tumoru do mozkové komory přístupem přes mozkovou komoru, je méně častý.
Při plánování trajektorie pro biopsii intraventrikulárního tumoru je rozhodující lokalizace léze a nutnost dalších výkonů, zvláště výkonů s cílem obnovení pasáže mozkomíšního moku (fenestrace septa pellucida, fenestrace spodiny III. komory). Naplánovaný přístup by měl umožnit bezproblémovou konverzi na otevřenou neurochirurgickou operaci nejen v případě peroperačního krvácení, ale také pro dosažení rozsáhlejší resekce, než umožňuje neuroendoskopický výkon.
Pro tumory v oblasti frontálního rohu a přední části těla postranní komory je nejvhodnější transfrontální přístup. Tumory v zadní části těla postranní komory mohou být dosaženy v závislosti na jejich přesné lokalizaci a vztahu k okolním strukturám z parietooccipitálního přístupu. Přístup z parietooccipitální oblasti je možné využít i pro tumory v oblasti trigona a temporálního rohu. Možným přístupem do temporálního rohu je i transtemporální přístup cestou gyrus temporalis medius.
Pro plánování trajektorie pro transforaminální neuroendoskopický přístup k tumoru ve III. komoře je nutné zohlednit, zda se léze nachází v přední, střední nebo zadní části III. komory (obr. 1).
Obr. 1. Směrnice trajektorií pro neuroendoskopickou operaci v jednotlivých částech II. komory. a) přední část II. komory, b) střední část III . komory, c) zadní část II. komory. 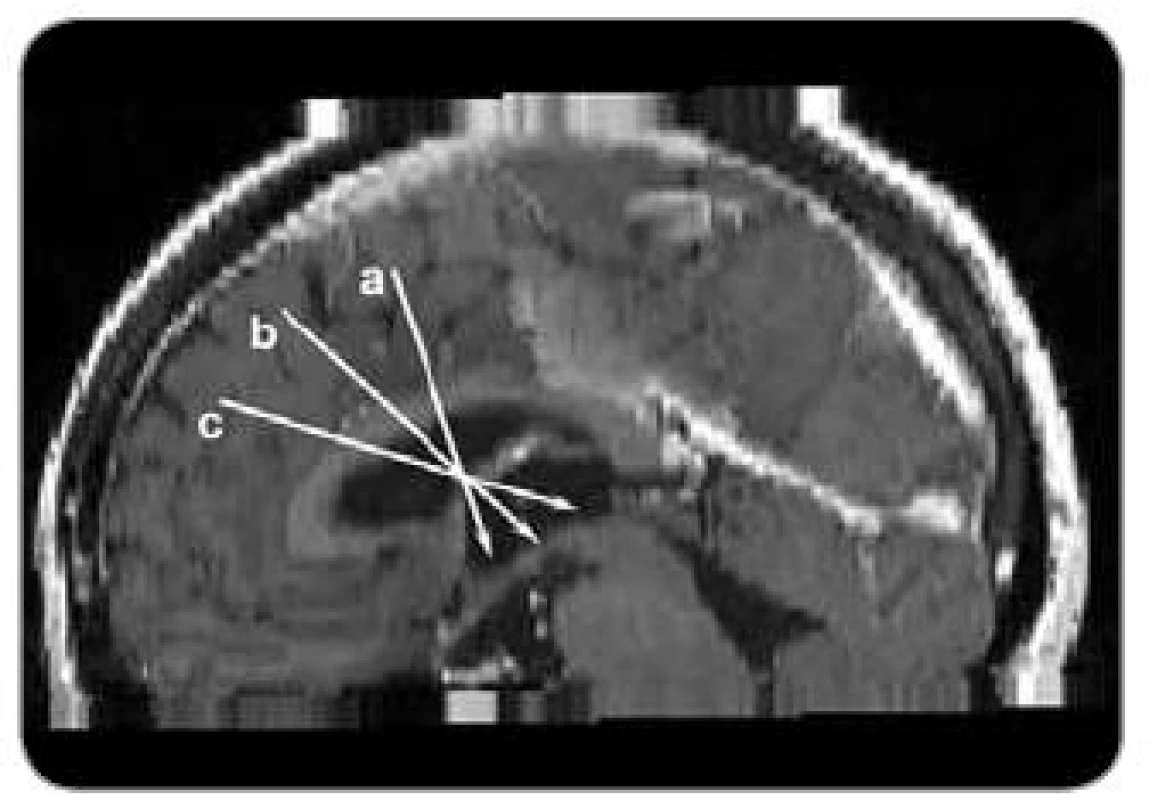
Technika neuroendoskopické biopsie byla v letech 2003–2011 využita u 1 pacienta, 57letého muže se solidním tumorem thalamu, u něhož nebyl možný transventrikulární přístup, u 23 pacientů s předpokládaným cystickým tumorem mozku a 36 pacientů s para - nebo intraventrikulárním tumorem mozku. V souboru pacientů s předpokládaným cystickým tumorem bylo 12 mužů (průměrný věk 49,7 roku, rozmezí 21–75 let) a 11 žen (průměrný věk 59,1 roku, rozmezí 22–76 let). V souboru pacientů s para - a intraventrikulárními tumory bylo 20 mužů (průměrný věk 43,9 roku, rozmezí 6–80 let) a 16 žen (průměrný věk 46,2 roku, rozmezí 11–78 let).
Výsledky
Pacient se solidním tumorem
U pacienta se solidním tumorem v oblasti thalamu byl výsledkem neuroendoskopické biopsie histologický průkaz anaplastického astrocytomu gr. III.
Soubor pacientů s cystickými tumory
Nejčastějším výsledkem histologického vyšetření materiálu získaného při endoskopické biopsii cystického tumoru mozku byl glioblastoma multiforme gr. IV (8 pacientů, průměrný věk 58,0 roku, rozmezí 37–76 let) a anaplastický astrocytom gr. III (3 pacienti, průměrný věk 51 let, rozmezí 31–63 let) – viz obr. 2. Méně často byl prokázán low grade gliom – 2 pacienti s pilocytickým astrocytomem gr. I (muž 38 let a žena 22 let), fibrilární astrocytom gr. II (muž 21 let), oligodendrogliom gr. II (žena 57 let), gangliogliom gr. I (žena 57 let) a pleomorfní xantoastrocytom gr. II (muž 37 let). U jednotlivých pacientů byla při histologickém vyšetření odebrané tkáně prokázána metastáza (ovariální karcinom – žena, 67 let a plicní karcinom – žena, 72 let). Podobně u jednotlivých pacientů byl prokázán mozkový lymfom (žena, 62 let) a ektopický cystický kraniofaryngeom zadní jámy lební (muž, 63 let). U 2 pacientů makroskopický obraz hladkostěnné cysty bez patologické vaskularizace nebo uzlíků nádorové tkáně a histologické vyšetření exaktně odebraných vzorků vyloučily mozkový tumor. Diagnostický vzorek byl tedy získán u všech pacientů.
Obr. 2. Muž, 64 let, klinicky nitrolební hypertenze, levostranná hemiparéza, pro meningizmus hospitalizace KICH. a) MRI mozku s nálezem cystické expanze frontálně vpravo s přetlakem středočárových struktur, b) endoskopická revize s odběrem biopsie ze stěny cysty, fenestrace cysty do komory, histologicky anaplastický astrocytom; CT s odstupem 3 týdnů po výkonu, c) MRI kontrola s odstupem přibližně 2 let po výkonu. Po komplexní onkologické léčbě přežití 3 roky, stav po plicní embolii v pooperačním období. 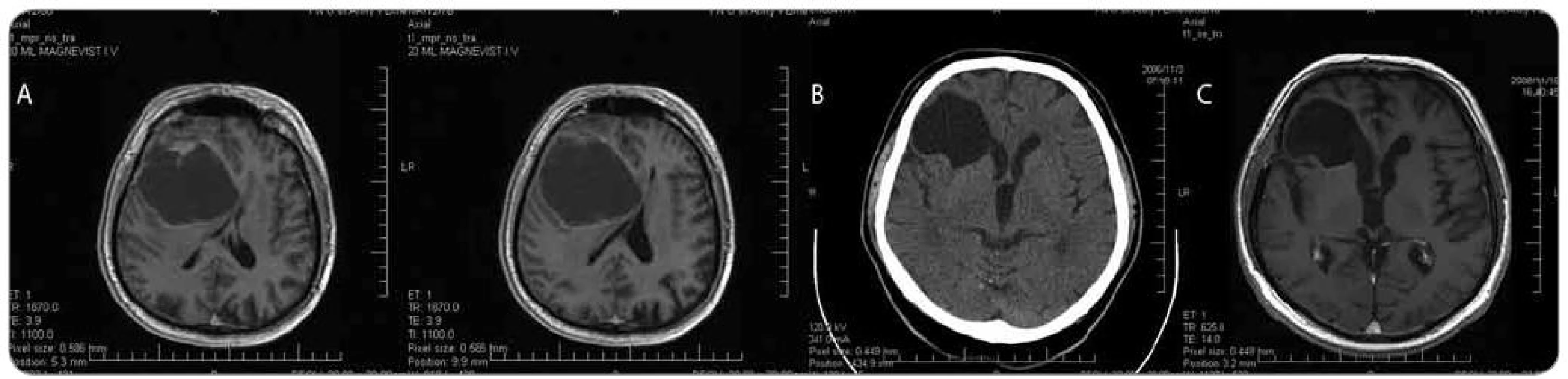
U 6 pacientů z uvedeného souboru byla neuroendoskopická biopsie provedena ze stěny pseudocysty po resekci mozkového tumoru s následnou komplexní onkologickou terapií. Indikací bylo expanzivní chování pseudocysty, nově se objevující sytící se léze ve stěně cysty v MRI obraze nebo změny v PET obraze. U 4 pacientů výsledek histologického vyšetření přesně odpovídal nálezu při resekčním výkonu (66 %), u jednoho pacienta byl výsledkem endoskopické biopsie astrocytom gr. II (při resekci anaplastický astrocytom gr. III) a u dalšího pacienta endoskopická biopsie prokázala multiformní glioblastom gr. IV (při resekci anaplastický astrocytom gr. III).
U 7 pacientů po neuroendoskopickém odběru histologie následoval další výkon – neurochirurgická resekce u 6 pacientů a stereotaktická biopsie s následnou resekcí u 1 pacientky. Histologické nálezy při obou výkonech byly identické u 5 pacientů (70,1 % pacientů) a odlišné u dvou. V případě 57leté nemocné ženy byl překvapivým výsledkem histologického vyšetření neuroendoskopicky odebraného vzorku z progredující cystické expanze gangliogliom gr. I. Vyšetření tkáně získané při následné resekci tumoru ovšem prokázalo multiformní glioblastom gr. IV. U další pacientky ve věku 56 let sice po neuroendoskopické biopsii cystické expanze s fenestrací do komory (histologie oligodendrogliom gr. II) došlo k významné regresi objemu cysty, ovšem zároveň se objevilo fokální postkontrastní sycení v MRI obraze. Proto byl proveden resekční výkon a histologické vyšetření odebraných vzorků prokázalo anaplastický oligodendrogliom gr. III.
U pacientky s opakovanými atakami intracerebrálního krvácení v parietálním laloku nepřineslo histologické vyšetření tkáně z okolí hematomu získané při stereotaktické evakuaci hematomu validní výsledek. Až neuroendoskopická biopsie prokázala primární lymfom mozku.
Pro pochybnost o diagnostické přínosnosti vzorku odebraného technikou stereotaktické biopsie u cystického tumoru mozku byla bezprostředně po stereobiopsii provedena ještě neuroendoskopická biopsie. Diagnostický závěr po vyšetření obou vzorků byl identický a prokázal metastázu ovariálního karcinomu.
Intra - a paraventrikulární tumory
Při histologickém vyšetření odebraného vzorku byl nejčastěji prokázán high grade gliom – glioblastoma multiforme gr. IV u 6 pacientů (4 ženy, 2 muži, průměrný věk 53 let, rozmezí 36–61 let) a anaplastický astrocytom gr. III u 5 pacientů (3 muži, 2 ženy, průměrný věk 46,5 roku, rozmezí 28–53 let). Častým nálezem byly i tumory vycházející z pineální krajiny – pinealoblastom gr. IV (4 pacienti, 2 muži, 2 ženy, průměrný věk 49,7 roku, 14–77 let), pinealocytom gr. I (muž, 17 let) a papilární tumor glandula pinealis gr. II (žena, 43 let). U 2 pacientů byl prokázán centrální neurocytom gr. II (2 muži, 42 a 80 let). Low grade gliomy byly zjištěny u 5 pacientů (2 pacienti s pilocytickým astrocytomem gr. I – muž 6 let, žena 34 let, gangliogliom gr. I u 1 pacienta – 34 let, subependymální astrocytom gr. I u 1 pacientky – žena 11 let a pleomorfní xantoastrocytom gr. II u 1 pacienta – muž 20 let) – viz obr. 3. U 2 pacientů po komplexní terapii pro prokázaný tumor mozku (2 muži, 37 a 30 let) byl výsledek histologického vyšetření popsán jako astroglióza. Kraniofaryngeom byl ve sledovaném období ošetřen u 3 pacientů (fenestrace a maximální možná resekce stěny cysty s obnovením pasáže mokových cest a preventivní endoskopickou fenestrací spodiny III. komory – 1 muž 47 let, 2 ženy 20 a 78 let). Intraventrikulárně a paraventrikulárně rostoucí mozkový lymfom byl prokázán u 3 pacientů (2 ženy, 1 muž, průměrný věk 64,3 roku, rozmezí 58–69 let). U 1 pacienta byl prokázán rozsáhlý intraventrikulární rozsev maligního melanomu (muž, 65 let). U další pacientky ventrikuloskopie prokázala u předpokládaného supraselárního tumoru s cystickou složkou rozsáhlý nádorový rozsev postihující celý komorový systém včetně středočárových struktur. Výsledkem histologického vyšetření byl supratentoriální primitivní neuroektodermální tumor (PNET) gr. IV. U 2 pacientů neumožnilo vyšetření odebraného vzorku diagnostický závěr. Výtěžnost neuroendoskopické techniky byla tedy 94,3 %.
Obr. 3. Muž, 20 let, klinicky nitrolební hypertenze, v prvním stadiu endoskopická septostomie, fenestrace cysty, histologická verifikace (pleomorfní xanthoastrocytom II ). a) plánování trajektorií pro neuroendoskopické operace, b) endoskopický obraz před fenestrací pseudocysty a po její fenestraci, c) MRI obraz po provedené resekci. 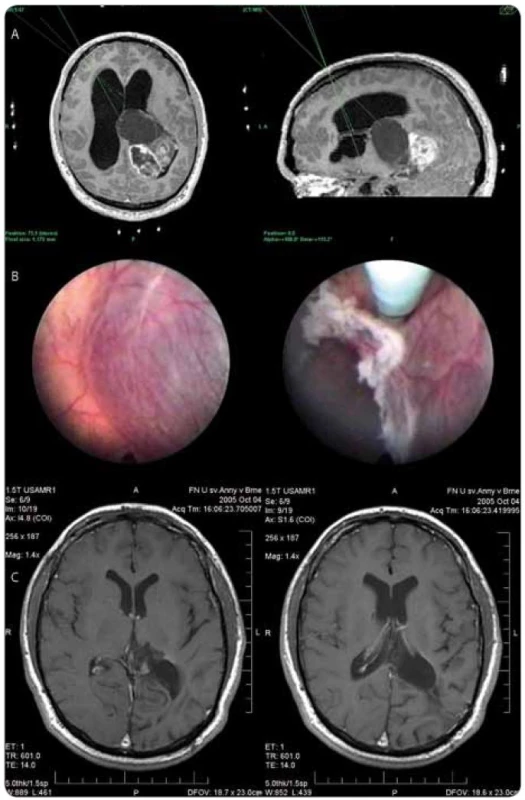
Endoskopická fenestrace spodiny III. komory jako řešení hydrocefalu byla provedena u 20 pacientů. U 3 pacientů bylo i přes neuroendoskopickou fenestraci spodiny III. komory nutné zavedení shuntu pro hydrocefalus s nitrolební hypertenzí (diseminovaný pinealoblastom gr. IV, papilární tumor pinealis gr. II s peroperačním zakrvácením, PNET gr. IV po endoskopické biopsii a následné resekci). Endoskopická fenestrace byla tedy funkční u 85 % pacientů. Na druhé straně byla u 2 pacientů provedena neuroendoskopická operace pro malfunkci shuntu zavedeného pro intraventrikulární tumor na jiných pracovištích (muž 40 let, žena 44 let). U 1 pacienta s pinealocytomem gr. I byla provedena endoskopická rebiopsie pro klinicky asymptomatickou mírnou progresi cystické složky tumoru popsanou radiologicky. Biopsie prokázala pouze gliotickou tkáň.
U 1 pacienta byla prokázána vzácná nádorová duplicita – centrální neurocytom gr. II vycházející ze struktur septa pellucida potvrzený neuroendoskopicky a paraventrikulární metastáza melanomu, následně mikrochirurgicky exstirpovaná.
U 4 pacientů byla po provedené neuroendoskopii provedena resekce tumoru. U 3 pacientů (75 %) histologický obraz přesně odpovídal výsledku neuroendoskopické biopsie (PNET gr. IV, pleomorfní xantoastrocytom gr. II a anaplastický astrocytom gr. III). U jedné pacientky byla provedena neuroendoskopická biopsie expanze postihující spodinu III. komory prorůstající i do mesiotemporálních struktur. I když pooperační MRI kontrola potvrdila korektní lokalizaci místa odběru, histologické vyšetření vzorku nepřineslo diagnostický závěr. Vzhledem k progresi části nádoru postihující mesiotemporální struktury byla indikována resekce této části nádoru a histologické vyšetření prokázalo pilocytický astrocytom gr. I.
U dalšího pacienta byla indikovaná neuroendoskopická biopsie kalcifikované thalamické expanze (v minulosti provedena radioterapie), jelikož stereotaktická technika neumožnila odběr vzorku tuhé tkáně. Histologické vyšetření exaktně odebraného vzorku neumožnilo diagnostický závěr.
U 1 pacienta byla neuroendoskopická biopsie provedena pro reziduum tumoru septa pellucida po resekci v roce 1996 (histologicky tehdy prokázán oligodendrogliom gr. II). Výsledkem histologického vyšetření byl centrální neurocytom. U 1 pacienta bylo neuroendoskopicky odstraněno kalcifikované reziduum kraniofaryngeomu velikosti do 1 cm v těsném vztahu ke stěně III. komory.
U 2 pacientů byl po neuroendoskopické operaci přítomen neurologický přechodný deficit s úpravou (5,7 %). U 2 pacientů bylo nutné pro peroperační krvácení zavést dočasnou zevní komorovou drenáž, z toho u jedné již výše zmíněné pacientky bylo nutné zavedení ventrikuloperitoneálního shuntu.
Diskuze
Neuroendoskopická technika je využívána především u pacientů s expanzemi mokového prostoru (např. hydrocefalus a arachnoidální cysty) [2]. S nástupem počítačové tomografie se začínají objevovat zmínky o využití neuroendoskopie pro biopsii tumorů mozku [3,4].
Solidní tumory
Při diagnostické výtěžnosti stereotaktické biopsie (až 98 %) [5] je využití neuroendoskopické techniky u solidních tumorů mozku popisováno výjimečně. Jednou z výjimek je popis využití neuroendoskopické techniky pro provedení biopsie u 6 pacientů se solidními intraparenchymovými tumory (3 maligní gliomy, 3 lymfomy) [6]. I když je četnost hemoragických komplikací stereotaktických biopsií nízká (Kreth se spolupracovníky uvádějí morbiditu ve vztahu k hemoragii 0,9 % a mortalitu 0,9 %, asymptomatické krvácení u 9,6 % odběrů) [5], není zanedbatelná a zvláště u maligních tumorů lokalizovaných v hlubokých strukturách mozku existuje zvýšené riziko vzniku hemoragické komplikace s možným závažným funkčním dopadem na kvalitu života nemocného. Endoskopická kontrola místa odběru bioptického vzorku může redukovat riziko hemoragických komplikací stereotaktické biopsie tumoru mozku. Využití neuroendoskopu napomáhá i zlepšení diagnostické výtěžnosti biopsie, protože odběr lze provést mimo nekrotické oblasti tumoru [7]. Potenciálně přínosné pro diagnostickou výtěžnost nejen u solidních tumorů může být i využití fluorescence s podáním 5 ALA (5 aminolevulonové kyseliny) spolu s Xe zdrojem světla v endoskopu pro identifikaci nádorové tkáně [8].
Cystické tumory
Operační výkony pro cystické léze jsou jednou z nejobvyklejších indikací neuroendoskopie. Zásadním rozdílem mezi operacemi nádorových a arachnoidálních cyst jsou odlišné optické podmínky nádorové cysty ve srovnání s průsvitným prostředím arachnoidální cysty obsahující mozkomíšní mok (např. tekutina charakteru motorového oleje u cyst Rathkeho výchlipky, žlutohnědá tekutina s cholesterinovými krystalky u kraniofaryngeomu a čokoládová tekutina po krvácení do tumoru) [2]. Podobně je nutné zohlednit i vlastnosti stěny nádorové cysty s ohledem na cévní zásobení. Při poranění cévy v oblasti vstupu endoskopu do dutiny cysty optické prostředí cysty zamlžuje krev vytékající zpoza endoskopu, což může činit problémy při inspekci dutiny cysty a také při hemostáze.
Tirakotai se spoluautory analyzoval soubor neuroendoskopicky ošetřených intrakraniálních cystických lézí. Ve skupině 127 ošetřených pacientů bylo 69 maligních cystických tumorů. Autoři prokazují i bezpečnost výkonů – nulová mortalita a morbidita pouze 3,1 % [9]. Neuroendoskopická resekce [10] nebo resekce s neuroendoskopickou vizualizací [11] tumorózního knoflíku u některých cystických lézí může být i kauzální léčbou (některé cystické astrocytomy, angioretikulom). Další možností využití neuroendoskopu je zavedení drenáže cysty pod endoskopickou kontrolu s napojením na rezervoár (např. Ommaya), což umožňuje opakované aspirace obsahu cysty. V průběhu endoskopické operace může být provedena i resekce sept dělících nádorovou cystu na vícečetné kompartmenty [1]. Součástí neuroendoskopického výkonu je i vytvoření fenestrace cysty do mozkové komory, která byla u pacientů v našem souboru provedena ve směru z cysty do komory. Je ovšem možné provést i fenestraci do cysty přístupem z komory mozku, avšak pacienti s paraventrikulárně uloženými cystickými tumory byli zahrnuti ve skupině paraventrikulárních lézí.
Intra - a paraventrikulární tumory
Neuroendoskopické výkony se opírají o předoperační navigaci a operace vycházejí z předem naplánovaného přístupu, který bere do úvahy lokalizaci a způsob růstu nádoru, typ plánované operace a umístění elokventních oblastí. Pro tumory postihující třetí komoru, oblast frontálního rohu a cella media postranní komory je nejvíce využíván transfrontální transkortikální přístup. Occipitální přístup umožňuje přístup do trigona postranní komory, temporálního rohu podél jeho dlouhé osy a do oblasti cella media. Jiné možné přístupové cesty (např. transtemporální) jsou využívány méně často. Zvolený přístup by měl umožnit i konverzi na otevřenou mikrochirurgickou operaci, a to jak v téže operační době s endoskopickým výkonem, tak i s odstupem v závislosti na řešení intrakraniální hypertenze a biologickém charakteru expanze [1].
Užití neuroendoskopické techniky bylo považováno za omezené u pacientů s intraventrikulárními tumory a úzkými komorami pro předpokládané vyšší riziko výkonu. Ovšem využití stereotaxe a neuronavigace umožňuje nejen bezpečné zavedení endoskopu i do úzké komory, ale především optimalizaci trajektorie pro bezpečný výkon s minimální manipulací endoskopem. Dokládají to i výsledky Naftela se spolupracovníky, kteří srovnali výsledky neuroendoskopických výkonů u dětských pacientů s úzkými komorami a ventrikulomegalií. I když se jednalo o relativně malý soubor (24 pacientů), možnost dosažení stanoveného cíle operace byla srovnatelná u pacientů s úzkými i širokými komorami (83 % a 89 %). U pacientů se širokými komorami byly naopak častější pooperační hemoragické komplikace, i když za příčinu autoři považují biologický charakter tumoru (častější komplikace u maligních tumorů) a menší zkušenost chirurga [12]. Podobné stanovisko zaujímá i Souweidane, který prezentuje data ze souboru 80 pacientů s intraventrikulárním tumorem (15 bez ventrikulomegalie, z toho 3 pacienti s koloidními cystami a 65 pacientů s hydrocefalem). U 11 pacientů byl patologický proces lokalizován ve III. komoře a u 4 pacientů v postranní komoře. V souboru pacientů bez ventrikulomegalie se u všech podařilo zakanylovat komoru a splnit cíl operace. U žádného z pacientů nenastaly peroperační komplikace a po operaci nebyl pozorován rozvoj hydrocefalu [13].
Bezpečnost a diagnostickou výtěžnost neuroendoskopického ošetření para - a intraventrikulárních tumorů v souboru 46 pacientů prokazuje Tirakotai se spolupracovníky [14]. U 20 pacientů byl přítomen hydrocefalus, který byl nejčastěji řešen endoskopickou fenestrací spodiny III. komory nebo zavedením stentu. Histologicky byl nejčastěji prokázán astrocytom (23), kraniofaryngeom (7) a metastáza (2) a právě histologický nález byl klíčový pro rozhodnutí o další terapii. Výkon byl zatížen pouze minimálními komplikacemi (přechodný neurologický deficit u 3 pacientů, nulová mortalita). Podobně nízkou četnost hemoragických komplikací po neuroendoskopické operaci pro intraventrikulární tumor v souboru 86 pacientů (3,5 %) popisuje Luther. U jednoho pacienta byla komplikace příčinou neurologického deficitu [15].
Diagnostická ventrikuloskopie při neuroendoskopické operaci doplňuje informace získané při předoperačním klinickém, laboratorním a radiologickém vyšetření. Jednou z možností je i průkaz nebo vyloučení intraventrikulární nádorové diseminace (obr. 4). Tento nález je popisován u dětských pacientů s germinomem a meduloblastomem a u dospělých s generalizovaným maligním tumorem, mozkovým lymfomem a maligním gliomem [16]. Stav je chirurgicky radikálně neřešitelný, ovšem neuroendoskopie umožňuje paliaci potíží spojených s intrakraniální hypertenzí (bolest hlavy, nauzea a zvracení). Provedení endoskopické fenestrace spodiny III. komory je při nádorovém postižení velmi obtížné, ale možné po snesení tumorózních náletů ze spodiny III. komory. K výhodám endoskopického ošetření ve srovnání se zavedením shuntu patří především eliminace možnosti malfunkce shuntu při blokádě nádorovými buňkami a vyloučení vzniku vzdálených metastáz cestou implantovaných shuntů. Potenciální diagnostický a terapeutický přístup provedené biopsie při nádorové diseminaci by neměl převýšit riziko poškození vitálních struktur, zvláště v okolí akveduktu a spodině III. komory [1].
Obr. 4. Operační obraz metastatických depozit v komorovém systému. Biopsie nebyla odebrána (žena, 40 let, Ca mammae, dle CT obraz hydrocefalu). 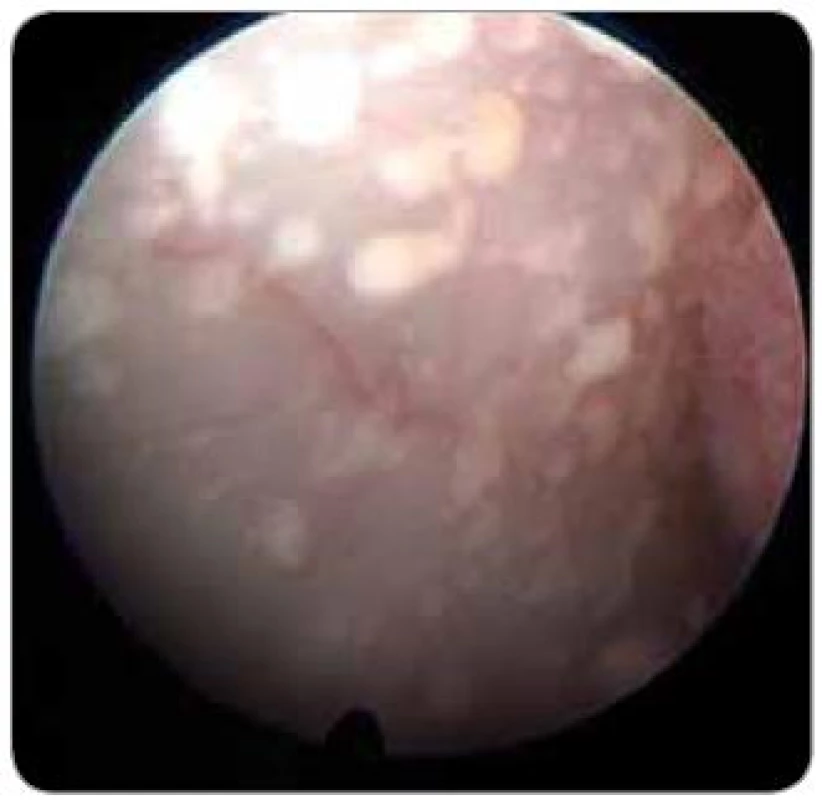
Otázkou možné subarachnoidální diseminace intraventrikulárního tumoru po provedení endoskopické fenestrace spodiny III. komory u tumorů zadní části III. komory nebo pineální oblasti se zabýval Luther se spolupracovníky. Pacientky rozdělili podle rizika leptomeningeální diseminace v závislosti na histologickém charakteru nádoru. Identifikovali 22 pacientů s vysokým rizikem leptomeningeální diseminace a u dvou z těchto pacientů bylo skutečně prokázáno leptomeningeální postižení nádorovým rozsevem, což při analýze podle Kaplan-Meiera odpovídá dvouletému intervalu bez prokázaného metastatického rozsevu pro 94,7 % pacientů. Výsledek odpovídá literárně popisovanému riziku diseminace rizikových tumorů v rozmezí 8–24 % [17].
Srovnání se stereobiopsií
Při srovnání diagnostické výtěžnosti neuroendoskopické a stereotaktické biopsie je nutné zohlednit rizikovost pacientů indikovaných k neuroendoskopické biopsii pro eventuální stereobiopsii a nespokojit se se snižováním výtěžnosti neuroendoskopické biopsie ve srovnání se zmiňovanou vysokou výtěžností stereobiopsie na vybraných světových pracovištích. Jak dokazují vlastní výsledky i následující data, obě techniky naplňují požadavek adekvátní histologické verifikace mozkových tumorů jako podmínky adekvátní komplexní terapie tumorů mozku [16,18].
Navíc i při diagnostické výtěžnosti neuroendoskopické biopsie 61 % dosáhli Macarthur se spolupracovníky dlouhodobého řešení hydrocefalu u 83 % pacientů. K tomu přibližně u 10 % pacientů neuroendoskopie umožnila rozsáhlou nebo parciální resekci nádorové tkáně [19]. Podobně ve skupině 23 pacientů s intra - a paraventrikulárními tumory rizikových pro resekci a nevhodných pro resekční výkon získali Fiorindi a Longatti 69,6 % diagnostických vzorků, 13,1 % vzorků bylo informativních a 17,3 % vzorků bylo nediagnostických [20].
Podobné diagnostické výtěžnosti dosáhli Ahn a Goumnerova v souboru 31 dětských pacientů s paraventrikulárními a intraventrikulárními tumory (33 biopsií). Diagnostická výtěžnost odebraných vzorků v kombinaci s odběry moku na onkomarkery byla 70,1 % a autoři prokázali lepší výtěžnost u tumorů v postranní komoře a pineální krajině než u thalamických a tektálních lézí. Dlouhodobá účinnost endoskopické fenestrace spodiny III. komory byla 82 %. Soubor byl zatížen 6,1 % komplikací [21].
Vynikající výsledky endoskopické verifikace lézí lokalizovaných v oblasti foramen Monroi a III. komory s využitím navigované neuroendoskopie prezentují Prat a Galeano, kteří u všech pacientů získali diagnostické vzorky. I když snadněji dostupné léze postihující přední část III. komory a okolí foramen Monroi převažovaly nad lézemi v oblasti glandula pinealis a zadní části III. komory, dosažené výsledky to nikterak nesnižuje. Navigaci považovali za velmi užitečnou při změněných anatomických poměrech nebo krvácení [22].
Naše výsledky jsou srovnatelné z hlediska získání diagnostických vzorků – 100% u cystických lézí a 94,3% u pacientů s intra - a paraventrikulárními lézemi. Při srovnání diagnostického výsledku neuroendoskopické biopsie a resekce tumoru bylo zjištěno 75 % korelace u intraventrikulárních a 70,1 % u cystických lézí i při limitovaném souboru pacientů, což odpovídá literárním datům popisujícím výtěžnost neuroendoskopické biopsie [14,19]. Podobné výsledky byly zjištěny i při analýze funkční stability endoskopického řešení blokády mozkových cest, kdy pouze u 15 % pacientů s hydrocefalem byla po neuroendoskopickém výkonu nutná implantace ventrikuloperitoneálního shuntu z důvodu intrakraniální hypertenze při trvající blokádě mozkových cest.
Závěr
Neuroendoskopická technika umožňuje bezpečný odběr histologického materiálu u pacientů s cystickými tumory a tumory se vztahem ke komorovému systému. Navíc neuroendoskopie umožňuje restoraci cirkulace mozkomíšního moku a u některých pacientů lze provést i resekci nádorové tkáně. Na neuroendoskopický výkon může navazovat konverze na otevřený neurochirurgický výkon v jedné době nebo s časovým odstupem (po stabilizaci stavu pacienta a dle výsledku histologického vyšetření). Diagnostická výtěžnost u pacientů s cystickými a paraventrikulárními expanzemi (rizikovými pro stereotaktickou biopsii) je se stereotaktickou biopsií srovnatelná. Využití neuronavigace nebo stereotaktického plánování napomáhá optimální přípravě operačního přístupu, jehož výsledkem je diagnostická výtěžnost odběru a bezpečnost pro pacienta.
Podpořeno VZ MŠMT 0021622404 a MZCR IGA NS 10411-3.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
MUDr. Jan Chrastina, Ph.D.
Neurochirurgická klinika
LF MU a FN u sv. Anny v Brně
Pekařská 53
656 91 Brno
e-mail: jan.chrastina@fnusa.cz
Obdrženo: 11. 3. 2011
Přijato: 20. 6. 2011
Zdroje
1. Novák Z, Chrastina J, Říha I. Atlas of neuroendoscopic surgery. Praha: Maxdorf Jesenius 2007.
2. Novák Z, Chrastina J. Neuroendoskopie – historické poznámky. Endoskopie 2006; 15(3): 48–53.
3. Fukushima T, Ishijima B, Hirakawa K et al. Ventriculofiberscope: new technique for endoscopic diagnosis and operation. Technical note. J Neurosurg 1973; 38(2): 251–256.
4. Fukushima T. Endoscopic biopsy of intraventricular tumors with the use of a ventriculofiberscope. Neurosurgery 1978; 2(2): 110–113.
5. Kreth FW, Muacevic A, Medele R et al. The risk of haemorrhage after image guided stereotactic biopsy of intra-axial brain tumours – a prospective study. Acta Neurochir (Wien) 2001; 143(6): 539–545.
6. Nakano T, Ohkuma H, Asano K et al. Endoscopic treatment for deep-seated or multiple intraparenchymal tumors: technical note. Minim Invasive Neurosurg 2009; 52(1): 49–52.
7. Akai T, Shiraga S, Sasagawa Y et al. Intra-parenchymal tumor biopsy using neuroendoscopy with navigation. Minim Invasive Neurosurg 2008; 51(2): 83–86.
8. Ritz R, Feigl GC, Schuhmann MU et al. Use of 5-ALA fluorescence guided endoscopic biopsy of a deep seated primary malignant brain tumor. J Neurosurg 2010; 114(5): 1410–1413.
9. Tirakotai W, Schulte DM, Bauer BL et al. Neuroendoscopic surgery of intracranial cysts in adults. Childs Nerv Syst 2004; 20(11–12): 842–851.
10. Novak Z. Endoscopic cure of cerebellar hemangioblastoma. Bratisl Lek Listy 2004; 105(1): 8–10.
11. Di X. Multiple brain tumor nodule resections under direct visualization of a neuronavigated endoscope. Minim Invasive Neurosurg 2007; 50(4): 227–232.
12. Naftel RP, Shannon CN, Reed GT et al. Small ventricle neuroendoscopy for pediatric brain tumors management. J Neurosurg Pediatr 2011; 7(1): 104–110.
13. Souweidane MM. Endoscopic surgery for intraventricular brain tumors in patients without hydrocephalus. Neurosurgery 2005; 57 (Suppl 4): 312–318.
14. Tirakotai W, Hellwig D, Bertalanffy H et al. The role of neuroendoscopy in the management of solid or solid-cystic intra - and periventricular tumors. Childs Nerv Syst 2007; 23(6): 653–658.
15. Luther N, Cohen A, Souweidane MM. Hemorrhagic sequelae from intracranial neuroendoscopic procedures for intraventricular tumors. Neurosurg Focus 2005; 19(1): E9.
16. Lakomý R, Burkoň P, Burkoňová D et al. Nové možnosti léčby glioblastoma multiforme. Klin Onkol 2010; 23(6): 381–387.
17. Luther N, Stetler WR Jr, Dunkel IJ et al. Subarachnoid dissemination of intraventricular tumors following simultaneous endoscopic biopsy and third ventriculostomy. J Neurosurg Pediatr 2010; 5(1): 61–67.
18. Jurga L, Malý M. Úskalia kombinovanej rádio a chemoterapie maligných gliómov. Klin Onkol 2006; 19(6): 317–321.
19. Macarthur DC, Buxton N, Punt J et al. The role of neuroendoscopy in the management of brain tumours. Br J Neurosurg 2002; 16(5): 465–470.
20. Fiorindi A, Longatti P. A restricted neuroendoscopic approach for pathological diagnosis of intraventricular and paraventricular tumours. Acta Neurochir (Wien) 2008; 150(12): 1235–1239.
21. Ahn ES, Goumnerova L. Endoscopic biopsy of brain tumors in children: diagnostic success and utility in guiding treatment strategies. J Neurosurg Pediatr 2010; 5(3): 255–262.
22. Prat R, Galeano I. Endoscopic biopsy of foramen of Monro and third ventricle lesions guided by frameless neuronavigation: usefulness and limitations. Clin Neurol Neurosurg 2009; 111(7): 579–582.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2011 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Hsp90 – cíl protinádorové terapie
- Předoperační chemoradioterapie v kombinaci s bevacizumabem u karcinomu konečníku
- Co pacientky potřebují vědět před operací mamárního karcinomu
- Neuroendoskopická biopsie tumoru mozku
- Cetuximab zvyšuje antiproliferativní účinek trastuzumabu u buněk karcinomu prsu s nadměrnou expresí ERBB2 – předběžná studie
- Adaptivní IG-IMRT karcinomu prostaty
- Parciální regrese ložisek Erdheimovy-Chesterovy nemoci v CNS po léčbě 2-chlorodeoxyadenosinem a jejich kompletní vymizení při léčbě lenalidomidem
- Sekundární angiosarkomy po konzervativní léčbě nádorů prsu
- Výsledky terapie metastatického renálního karcinomu lékem everolimus – analýza údajů z klinického registru RENIS
- Zápis ze schůze výboru České onkologické společnosti ČLS JEP konané dne 20. 9. 2011 v Olomouci
- Onkochirurg doc. MUDr. Zdeněk Pačovský, CSc., zemřel
- Recenze
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Parciální regrese ložisek Erdheimovy-Chesterovy nemoci v CNS po léčbě 2-chlorodeoxyadenosinem a jejich kompletní vymizení při léčbě lenalidomidem
- Neuroendoskopická biopsie tumoru mozku
- Sekundární angiosarkomy po konzervativní léčbě nádorů prsu
- Onkochirurg doc. MUDr. Zdeněk Pačovský, CSc., zemřel
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



