-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Parciální regrese ložisek Erdheimovy-Chesterovy nemoci v CNS po léčbě 2-chlorodeoxyadenosinem a jejich kompletní vymizení při léčbě lenalidomidem
Partial Regression of CNS Lesions of Erdheim-Chester Disease after Treatment with 2-chlorodeoxadenosine and Their Full Remission Following Treatment with Lenalidomide
Introduction:
Erdheim-Chester disease is a very rare syndrome affecting adult population. It typically causes hyperostosis of long bones, retroperitoneal fibrosis and widening of the aortic wall. Patients frequently suffer from disease-associated fevers and pain in the lower limbs. No guidelines are available for the treatment of this rare ailment. Therefore, we describe our experience with lenalidomide in a patient with poor treatment response to 2-chlorodeoxyadenosine.Case:
Diabetes insipidus and neurological problems developing over 4 years were the first signs of the disease. The disease was diagnosed from histology of the bone marrow extracted from the ilium. At diagnosis, the patient had multiple infiltrates in the brain, widened wall of the thoracic and abdominal aorta, fibrotic changes to retroperitoneum and typical hyperostosis of the long bones of lower limbs with high accumulation of technetium pyrophosphate as well as fluorodeoxyglucose. First line treatment involved 2-chlorodeoxyadenosine 5 mg/m2 s.c. for 5 consecutive days every 28 days. There was no clear treatment response identifiable on the MR scan of the brain following the third cycle and thus 4th–6th2 + cyclophosphamide 150 mg/m2 + dexamethasone 24 mg day 1–5 every 28 days. After the 6th cycle, MR showed partial regression of the brain lesions. PET-CT showed an increased accumulation of fluorodeoxyglucose in bone lesions. Second line treatment involved lenalidomide 25 mg/day days 1–21 every 28 days. Lenalidomide tolerance was excellent; the number of neutrophils and thrombocytes was within the physiological range throughout the treatment period. Follow-up MR showed complete remission of the brain lesions, while follow-up PET-CT showed further increase in fluorodeoxyglucose accumulation in the bones of lower limbs.Conclusion:
Treatment with 2-chlorodeoxyadenosine-based regimen provided partial remission of Erdheim-Chester disease lesions in the brain, while treatment with lenalidomide resulted in complete remission of these lesions. Fluorodeoxyglucose continues to accumulate in the long bones of lower limbs. We are unable to elucidate the reasons for complete remission of the disease in the brain as per the MR and its progression in the long bones according to PET-CT. Further testing of lenalidomide in the treatment of this disease is required to support further use of this perspective treatment option.Key words:
Erdheim-Chester disease – juvenile xanthogranuloma – osteosclerosis – skeletal scinigraphy – PET-CT – lenalidomide – 2-chlorodeoxyadenosine – cladribin – retroperitoneal fibrosis
This study was supported by the research programme of the Ministy of Health of the CR FUNDIN MZ0MOU2005 and prepeared as part of the Internal Grant Agency of the Czech Republic grants NT 12215-4, the Ministry of Education, Youth and Sports of the CR grants MSM0021622434, LC06027 and the Ministry of Health of the Czech Republic’s Internal Grant Agency grants IGA MZd NT11154, NT12130, NT12215 and NS10408.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
14. 3. 2011Accepted:
16. 5. 2011
Autoři: Z. Adam 1; A. Šprláková 2; Z. Řehák 3; R. Koukalová 3; P. Szturz 1; M. Krejčí 1; L. Pour 1; L. Zahradová 1; L. Červinek 1; L. Křen 4; M. Moulis 1; M. Hermanová 5; M. Mechl 2; J. Prášek 6; R. Hájek 1; Z. Král 1; J. Mayer 1
Působiště autorů: Interní hematoonkologická klinika, LF MU a FN Brno 1; Radiologická klinika, LF MU a FN Brno 2; Oddělení PET CT, Masarykův onkologický ústav, Brno 3; Ústav patologie, LF MU a FN Brno 4; Ústav patologické anatomie, LF MU a FN Brno 5; Klinika nukleární medicíny, Brno 6
Vyšlo v časopise: Klin Onkol 2011; 24(5): 367-381
Kategorie: Kazuistiky
Souhrn
Úvod:
Erdheimova-Chesterova nemoc je velmi vzácná choroba dospělých. Typicky způsobuje hyperostózu dlouhých končetin, fibrózu retroperitonea, zesílení stěny aorty a může tvořit i infiltráty ve stopce hypofýzy a v dalších částech mozku. Pacienti často mívají teploty způsobené touto nemocí a bolesti v dolních končetinách. Vzácnost těchto případů je důvodem, proč pro léčbu této nemoci neexistují žádná doporučení. Proto popisujeme naše zkušenosti s aplikací lenalidomidu u pacienta s malou léčebnou odpovědí po 2-chlorodeoxyadenosinu.Případ:
Prvním příznakem nemoci byl diabetes insipidus a v průběhu 4 let postupně se rozvíjející neurologické problémy (dysartrie, pravostranná hemiparéza). Diagnóza byla stanovena histologickým vyšetřením kostní dřeně lopaty kosti pánevní. V době stanovení diagnózy měl nemocný již vícečetné infiltráty v mozku, zesílenou stěnu hrudní a břišní aorty, fibrotické změny v retroperitoneu a typickou hyperostózu dlouhých kostí dolních končetin s vysokou akumulací jak techneciumpyrofosfátu, tak i fluorodeoxyglukózy. Léčbu jsme zahájili monoterapií 2-chlorodeoxyadenosinem 5 mg/m2 s.c. 5 dní po sobě ve 28denních cyklech. V průběhu třetího cyklu na provedeném MRI mozku nebyla zřetelná léčebná odpověď, a tak 4.–6. cyklus probíhal ve složení 2-chlorodeoxyadenosin 5 mg/m2 + cyklofosfamid 150 mg/m2 + dexametazon 24 mg 1.–5. den ve 28denním cyklu. Po 6 cyklech bylo provedeno kontrolní MRI vyšetření mozku, které prokázalo parciální regresi ložisek. Kontrolní PET-CT vyšetření však prokázalo nárůst akumulace fluorodeoxyglukózy v kostních ložiscích nemoci. V rámci léčby druhé linie byl podán lenalidomid 25 mg denně 1.–21. den ve 28denních cyklech. Tolerance lenalidomidu byla excelentní, počet neutrofilů a trombocytů byl po celou dobu léčby ve fyziologickém rozmezí. Kontrolní MRI vyšetření prokázalo úplné vymizení ložisek v mozku. Kontrolní PET-CT vyšetření však prokázalo další nárůst akumulace fluorodeoxyglukózy v kostních ložiscích dolních končetin.Závěr:
U pacienta došlo k parciální regresi ložisek Erdheimovy-Chesterovy nemoci v mozku po léčbě 2-chlorodeoxyadenosinovým režimem a ke kompletní regresi ložisek v mozku po léčbě lenalidomidem. V oblasti dlouhých kostí po celou dobu léčby narůstá akumulace fluorodeoxyglukózy. Příčinu, proč došlo v oblasti mozku ke kompletní regresi nemoci dle MRI hodnocení, zatímco v oblasti dlouhých kostí nemoc dle PET-CT vyšetření progreduje, neumíme vysvětlit. Lenalidomid je pro tuto nemoc perspektivní lék vyžadující další testování.Klíčová slova:
Erdheimova-Chesterova choroba – juvenilní xantogranulom – osteoskleróza – scintigrafie skeletu – PET-CT – lenalidomid – 2-chlorodeoxyadenosin – cladribin – retroperitoneální fibrózaÚvod
Všechny choroby, které se odvíjejí od buněk histiocytární řady (do níž patří i dendritické buňky), se vyskytují vzácně. Jejich přehled uvádí tab. 1 [1]. Nemoci patřící do skupiny diseminovaného juvenilního xantogranulomu jsou charakterizované přítomností proliferujících histiocytů, podobných histiocytům v kožních xantogranulomech. Histiocyty v těchto ložiscích mají pěnitou (xantomatózní) komponentu a kolem nich jsou v různé míře přítomny obrovské buňky Toutonova typu. V některých případech se zdařil průkaz klonality těchto histiocytů [1].
Tab. 1. Přehled všech histiocytárních forem a dále přehled forem onemocnění, které mohou způsobovat pěnité histiocyty, jejichž ložiska histologickým popisem odpovídají juvenilnímu xantogranulomu. 
Nejčastější z této skupiny nemocí je solitární kožní xantogranulom, který obvykle nepřechází do agresivnější formy. Většina takzvaných hlubokých forem juvenilního xantogranulomu, které postihují viscerální orgány a pojivové tkáně, se vyskytuje u mladých osob ve věku do 10 let, nejčastěji však v průběhu prvního roku života. Výjimkou je Erdheimova-Chesterova nemoc, která postihuje dospělé osoby.
Erdheimova-Chesterova nemoc je zvláštní forma juvenilního xantogranulomu s typickou kumulací patologických buněk v kostní dřeni dlouhých kostí končetin. Důsledkem je zvýšená tvorba hydroxyapatitu v těchto kostech, zesílení jejich struktury (hyperostóza), což může být provázeno paradoxně úbytkem hydroxyapatitu (osteoporózou) v obratlích nepostižených touto chorobou. Nemoc dále postihuje aortu a způsobuje zesílení její stěny a vznik periaortální fibrózy. Fibróza v okolí ledvin a v retroperitoneu může oblenit tok uretry, a připomínat tak idiopatickou retroperitoneální fibrózu (Ormondovu chorobu). Masivní infiltrace kostní dřeně dlouhých kostí nezpůsobuje anémii či cytopenii obecně, protože v dospělém věku již je v těchto dlouhých kostech krvetvorná kostní dřeň fyziologicky nahrazena dření tukovou [2]. Asi u třetiny nemocných s touto chorobou je postižena stopka hypofýzy a případně i další části mozku [3].
Nemoc se může přihlásit B symptomy (subfebrilie či febrilie, úbytek hmotnosti, noční pocení). Laboratorní změny provázející Erdheimovu-Chesterovu chorobu jsou nespecifické, objevují se zvýšené hodnoty CRP, leukocytů a fibrinogenu, odpovídají tedy změnám při zánětlivé reakci organizmu.
Erdheimova-Chesterova nemoc byla již v českém a slovenském písemnictví popsána, byť počet publikací věnovaných této diagnóze není velký [4–14].
Podrobněji o patologii non-Langerhans cell histiocytóz pojednává článek profesora Planka [15] a o jejich klinických projevech pak další texty [16,17].
Popis případu
Klinické příznaky a změny typické pro tuto chorobu na rentgenovém, radioizotopovém, CT a MRI zobrazení a v laboratorním vyšetření
Muž narozený 1965 byl až do roku 2004 (do svých 39 let) zcela zdráv. Prvním příznakem nemoci byla polydipsie a polyurie. Diagnóza centrálního diabetu insipidu byla potvrzena koncentračním testem v září 2004. Tvorba ostatních hypofyzárních hormonů byla v mezích normy. Na prvním MRI vyšetření mozku v roce 2004 nebyla popsána žádná patologie v oblasti hypofýzy. Od zavedení substituce adiuretinem zůstal tento muž až do června 2006 bez dalších zdravotních problémů.
Teprve až kontrolní MRI v červnu 2006 objevilo patologické zesílení stopky hypofýzy na 4–5 mm. Protože zatím nebylo rozpoznáno základní onemocnění, pokusili se lékaři získat vzorek tkáně ze stopky hypofýzy pro histologické vyšetření. V červenci 2006 byla provedena endoskopická, stereotakticky navigovaná ventrikulocisternoanastomóza s parciální resekcí (elektrokoagulací) stopky hypofýzy a byl odebrán drobný vzorek k histologickému vyšetření.
Ve vyšetřeném vzorku z oblasti stopky hypofýzy byla zastižena glioneuronální tkáň s mírnou proliferací gliové komponenty, ložisková lymfocytární celulizace tvořená smíšenou populací T a B lymfocytů, s mírnou převahou T lymfocytů a perivaskulární akcentací. Nález byl z hlediska patomorfologie zcela nespecifický.
Po neurochirurgickém zákroku došlo u pacienta k rozvoji kompletního panhypopituitarizmu v ose tyreotropní, gonadotropní, kortikotropní, s nutností substituční terapie (Hydrocortizon 10–10–5 mg, Euthyrox 75 µg 1 × 1, Sustanon 1 amp i. m. ve 3týdenním intervalu, Minirin spray 2× denně), při které byl pacient dobře kompenzován.
Při dalších kontrolních MRI zobrazeních mozku v roce 2006, 2007 i 2008 postupně přibývala ložiska v mozkové tkáni a v lednu 2008 se objevilo největší ložisko v mesencefalu.
Od ledna 2008 se u pacienta začala objevovat porucha řeči charakteru dysartrie, zprvu velmi mírná, a proto pacientem přecházená, postupně však porucha získávala na závažnosti.
V objektivním neurologickém nálezu byla mimo dysartrii středního stupně dále reflexologická převaha na pravé dolní končetině a porucha alternujících pohybů levé ruky. Končetiny byly bez parézy. Subjektivně pacient popisoval ještě parestezie pravostranných končetin a zvýšenou únavnost.
Nemoc zřetelně progredovala, a přitom stále nebyla pojmenována. V rámci hledání případného tumoru bylo v listopadu 2008 provedeno celotělové PET vyšetření a celotělová scintigrafie skeletu. Byla patrná patologická akumulace obou radiofarmak (fluorodeoxyglukózy i techneciumpyrofosfátu) v dlouhých kostech. Zřetelně zvýšená kumulace techneciumpyrofosfátu byla v obou klavikulách, obou humerech, v kostech předloktí (radiu a ulně), v obou femurech (maximálně v distální části), v obou tibiích (maximálně v proximální části), v pánvi, v os ischiadikum vlevo, os ilium a pubis, u pravého kyčelního kloubu, v oblasti sakroiliakálního skloubení a v přilehlé části lopaty. Dále bylo zřetelné ložisko v pravé lopatce mediálně, v horní čelisti vlevo. V kalvě byla zřetelná difuzně nehomogenně vysoká aktivita s ložisky vpravo parietálně a frontálně bilaterálně (obr. 1–3).
Obr. 1. Scintigrafie skeletu: zvýšená aktivita radiofarmaka je vidět především v dlouhých kostech – oba humery ve střední třetině, v distálních částech obou femurů, v proximálních částech obou tibií, v obou klavikulách, v oblasti pánve – os ischii vlevo, os pubis vpravo, os ilium pravo, v oblasti levého SI skloubení, dále v oblasti maxily vlevo, difuzně vyšší aktivita v oblasti kalvy s ložisky vpravo parietálně a částečně frontálně bilat. 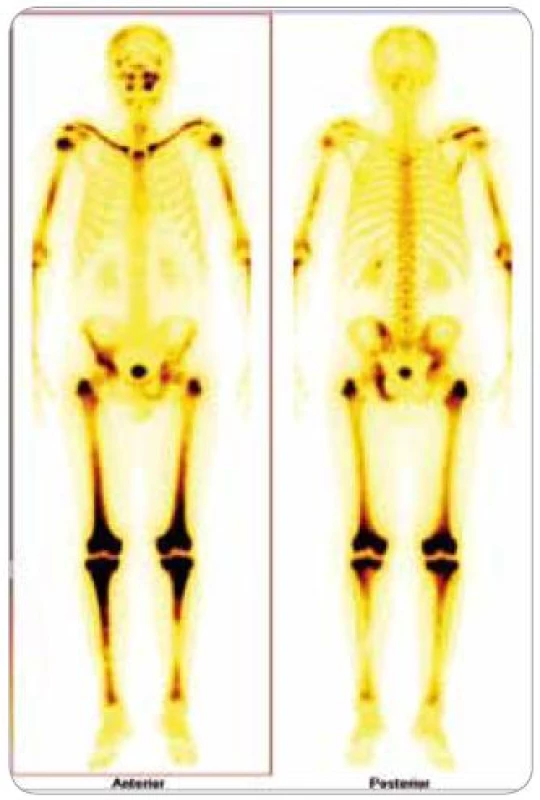
Obr. 2. Scintigrafie skeletu: podrobnější zobrazení pánve metodou SPECT . Jsou zřetelná ložiska se zvýšenou aktivitou radiofarmaka. 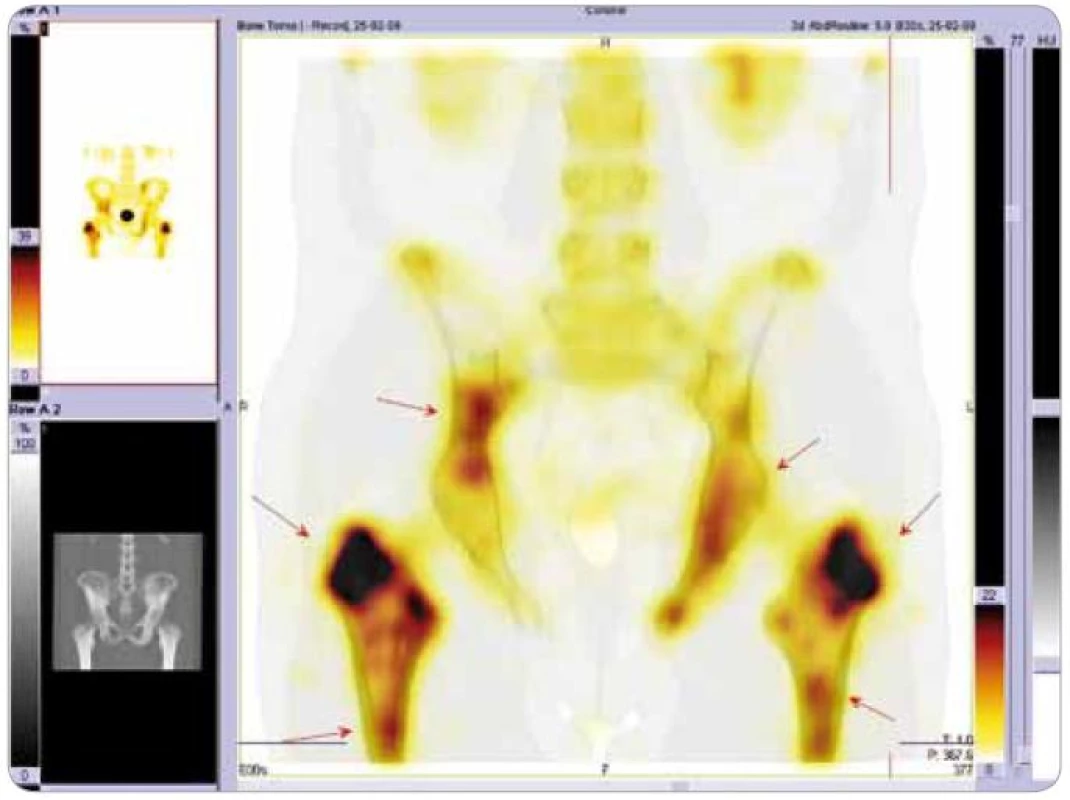
Obr. 3. Scintigrafie skeletu, podrobné zobrazení kalvy metodou SPECT . Šipkami jsou označena ložiska zvýšeného vychytávání radiofarmaka. 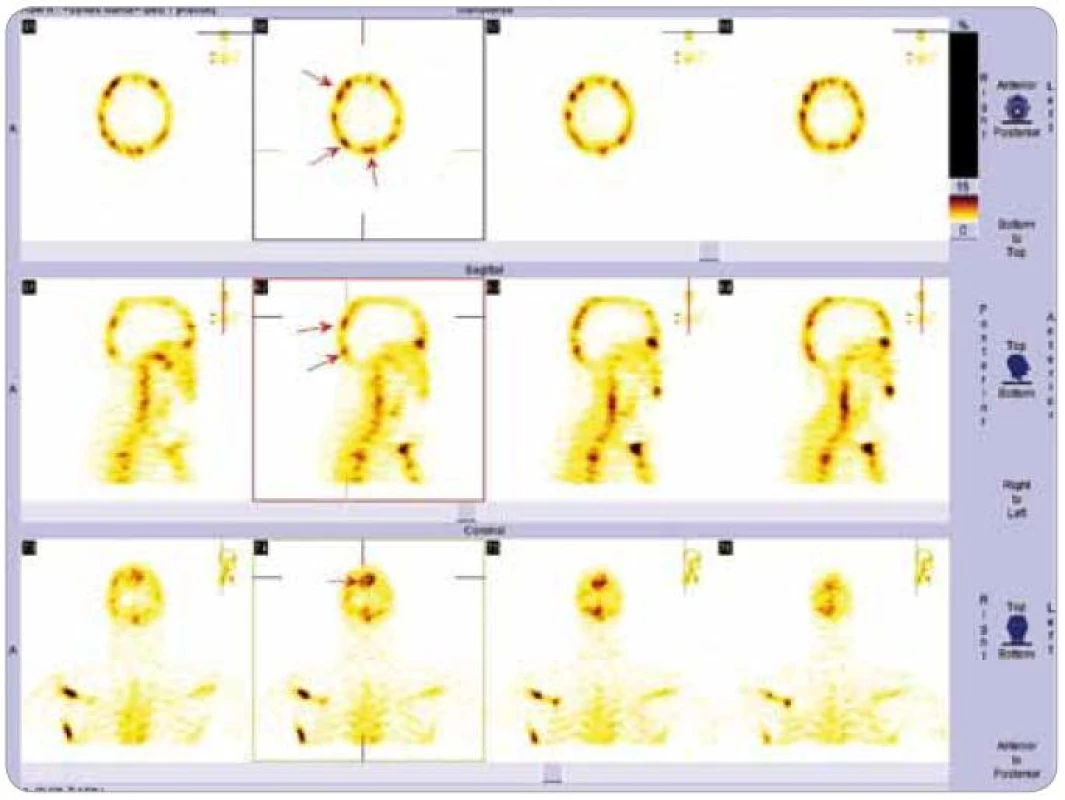
Koncem listopadu 2008 byl pacient předán z neurologického pracoviště na Interní hematoonkologickou kliniku FN Brno.
Při prvním vyšetření na tomto pracovišti si muž stěžoval na zvýšenou únavu a slabost pravostranných končetin až typu pravostranné hemiparézy. Neurolog konstatoval přetrvávající pravostrannou hemiparézu lehkého stupně.
Vzhledem k tomu, že předchozí PET vyšetření a následně scintigrafie skeletu byla typická pro Erdheimovu--Chesterovu chorobu, byla provedena necílená trepanobiopsie lopaty kosti kyčelní. Při provádění tohoto zákroku jsme si byli vědomi, že nemoc nepostihuje kostní dřeň difuzně a že při nediagnostickém výsledku bude zapotřebí cíleného odběru z ložiska s nejvýraznějšími patologickými změnami dle zobrazovacích vyšetření. Náhodně jsme se však strefili do ložiska nemoci v pánvi, a tak další cílený odběr již nebyl nutný.
Histologický průkaz pěnitých histiocytů typického imunofenotypu (CD68+, CD1a-, S100-) v kostní dřeni
Při histologickém hodnocení válečku kostní dřeně, získaného trepanobiopsií z oblasti spina iliaca posterior superior lopaty kosti pánevní, byla zjištěna ložiskovitá infiltrace kostní dřeně shluky histiocytů s abundantní pěnitou cytoplazmou na pozadí osteosklerózy a sekundární myelofibrózy. Ložiska zaujímala 40–60 % délky trepanobioptického válečku. Imunohistochemicky byly zjištěny pěnité histiocyty CD68+, CD1a-, vyšetření proteinu S100 nebylo hodnotitelné (obr. 4). Při cytologickém hodnocení roztěru na sklíčko nebyly tyto patologické buňky zachyceny.
Obr. 4. Histologické hodnocení válečku kostní dřeně. Barvení hematoxylin – eozin, zvětšení 200x. Pěnité a vřetenité histiocyty nahrazují hemopoetické buňky kostní dřeně. 
Změny typické pro tuto nemoc na rentgenových snímcích a sonografickém vyšetření
U pacienta jsme provedli rentgenové vyšetření celého skeletu. Patologické odchylky byly zřetelné pouze v oblasti pánve, kde bylo patrné zahuštění spongiózy. Nejvíce patologických změn bylo na kostech stehenních, ale i v tibiích – oboustranné zvýšení opacity stehenních kostí, zesílení kompakty, která zužuje projasnění nitrodřeňové dutiny (obr. 5, 6). Rentgenový snímek plic a sonografické vyšetření dutiny břicha byly bez patologického nálezu.
Obr. 5. Zobrazení tibie metodou multidetektorového CT , koronární řez. Zřetelná zesílení hydroxyapatitových struktur kortikalis i spongiózy. 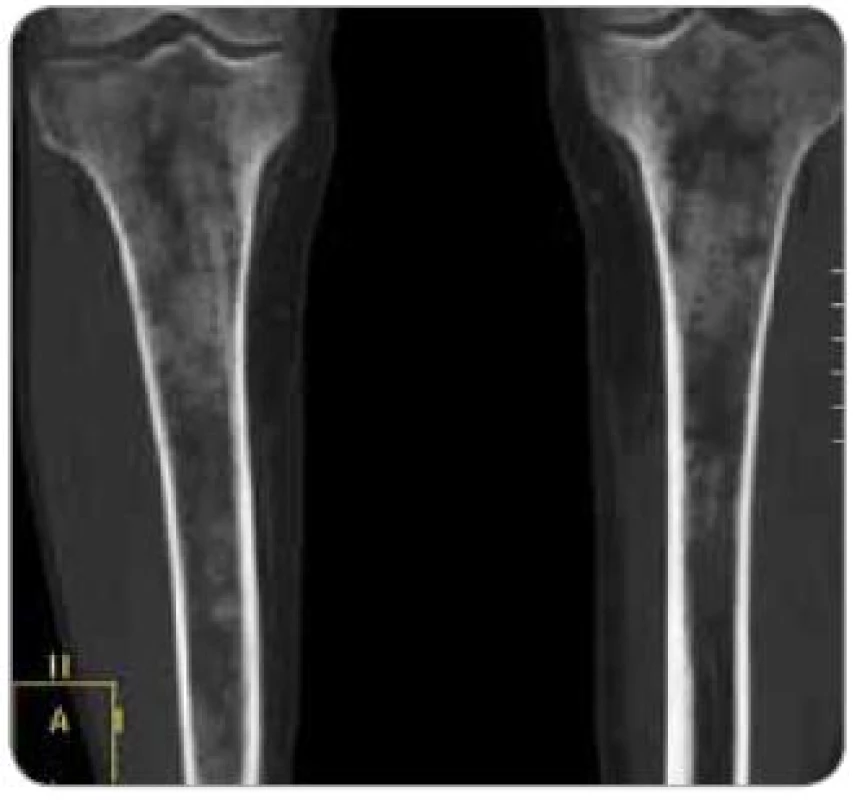
Obr. 6. Zobrazení tibie metodou multidetektorového CT , axiální řez. Zřetelná osteoporotická struktura s osteosklerotickými ložisky. 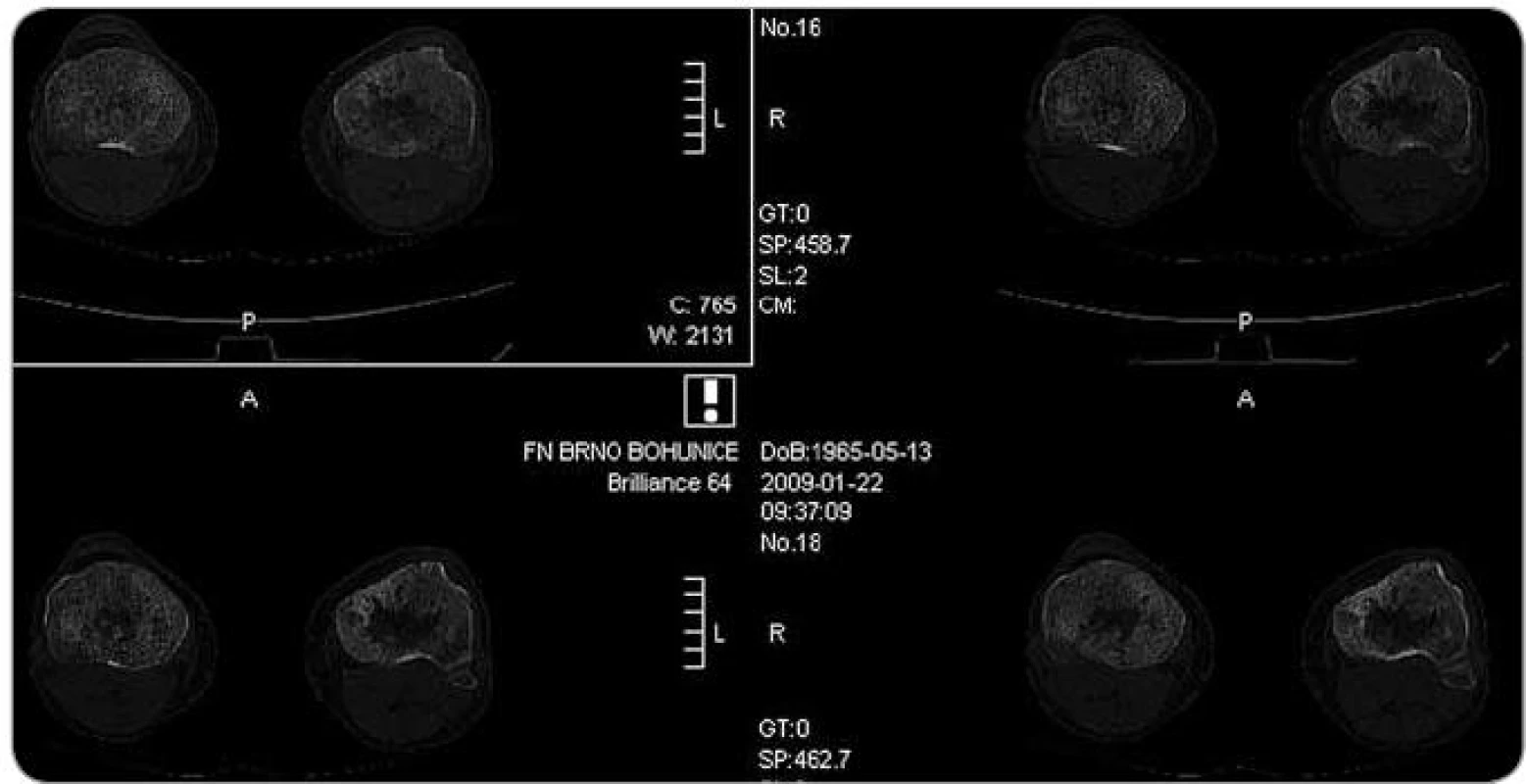
Vyšetření kostní hustoty metodou DEXA
Měření kostní hustoty metodou DEXA v oblasti 4 bederních obratlů (L1-L4) prokázalo osteoporózu, T skóre mělo hodnotu -2,7 SD (standard deviation) a stejně tak Z skóre -2,7 SD. Nejnižší kostní hustota byla naměřena v oblasti třetího bederního obratle: -3,1 SD. Přístroj nebyl nastaven na měření kostní hustoty v dlouhých kostech, takže rentgenologicky zřetelnou hyperostózu v dlouhých kostech nemůžeme metodou DEXA kvantifikovat.
CT vyšetření mediastina a břišní dutiny
V plicním parenchymu a mediastinu nebylo popsáno nic patologického, jedinou zřetelnou odchylkou od normy v oblasti hrudníku bylo zesílení dorzální stěny sestupné aorty až na 6 mm. Nález na abdominálních orgánech, vyjma difuzního zesílení stěny sestupné aorty, byl normální. V oblasti retroperitonea však byla popsána zvýšená denzita tuku a fibrózní změny retroperitoneálně perirenálně oboustranně a také kolem aorty (obr. 7). V zachycených kostech bylo popsáno sklerotické ložisko v obratli Th4.
Obr. 7. Zobrazení břišní dutiny metodou CT – zřetelná fibróza v oblasti retroperitonea. 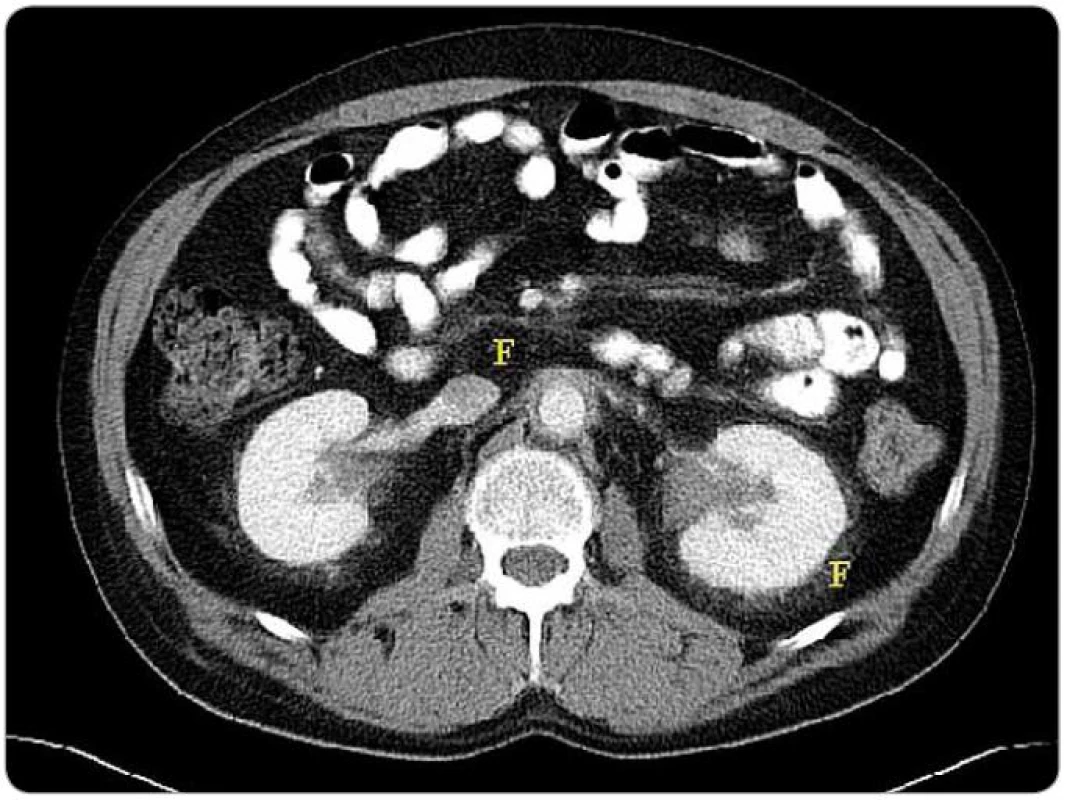
Celotělové MRI zobrazení skeletu
Byly zhotoveny koronární T1 STIR, DWIBS obrazy a sagitální T1 a STIR na oblast páteře. V kostní dřeni dlouhých kostí byl výrazně abnormní nález, splývavá ložiska smíšené intenzity v T1 v obou tibiích, fibulách, femurech, humerech, ulnách i radiích. Dolní končetiny byly postiženy více než horní, ložiska částečně šetřila epifýzy dlouhých kostí horní končetiny. Skelet pánve byl postižen jen částečně, patrné byly nehomogenity oblastí ilických kostí s převahou vlevo. Na difuzních vážených obrazech byla jednoznačná restrikce difuze ve všech popsaných oblastech. V oblasti páteře je abnormní signál pouze v oblasti těla Th4, stejně jako v periferii. V těle Th11 je 20mm hemangiom. Páteřní kanál je volný. Obraz odpovídá rozsáhlému postižení kostní dřeně periferního skeletu, zatímco v páteři je patrné pouze jedno ložisko (obr. 8, 9).
Obr. 8. Celotělové MR vyšetření v T1 váženém obraze a koronární rovině. Patrný je abnormálně snížený signál z kostní dřeně s maximem v oblasti obou femurů a tibií (šipky) oboustranně. Nehomogenity jsou přítomné i v proximálních metafýzách obou humerů. Jedná se o obraz kumulace abnormálních histiocytů, které tak nahrazují normální tukovou kostní dřeň a působí snížení signálu v T1 obrazech. 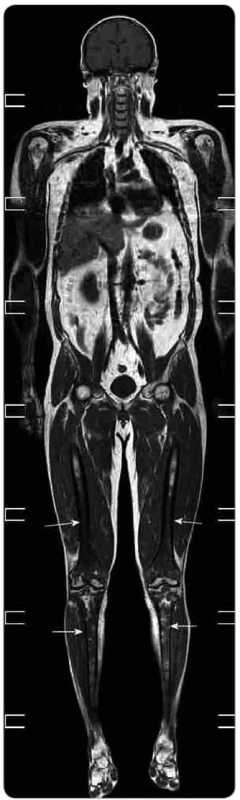
Obr. 9. Celotělové MR vyšetření ve STI R zobrazení (typ saturace tukové tkáně) a koronární rovině. Při saturaci signálu z tukové tkáně dobře vyniká abnormální signál ve výše popsaných oblastech, a to velmi dobře i v obou humerech (šipky). I zde se jedná o přímé zobrazení nakumulovaných histiocytů, jejichž vyšší signál je dobře diferencovatelný od normální kostní dřeně. 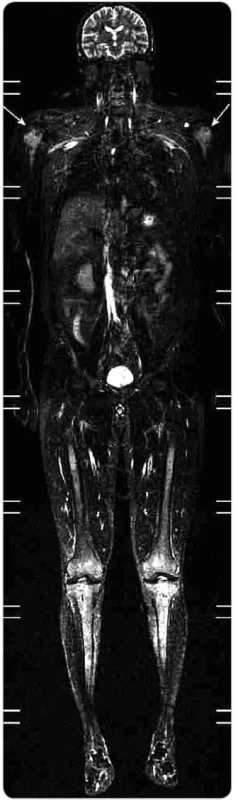
Celotělové PET-CT
FDG-PET sken prokázal difuzně zvýšenou akumulaci fluorodeoxyglukózy (FDG) v místech CT strukturálních změn skeletu, míra akumulované aktivity do výše SUV 3,6. Zvýšená akumulace FDG byla také v zesílených stěnách hrudní a břišní aorty.
Laboratorní a další vyšetření
Laboratorní vyšetření před zahájením léčby: leukocyty 14,9 × 109/l, erytrocyty 4,67 × 1012/l, hemoglobin 125 g/l, trombo 524 × 109/l; v diferenciálním krevním rozpočtu převládala neutrofilie, patologické krvinky nebyly zachyceny. Dále byla zvýšena koncentrace fibrinogenu na 5,9 g/l. Základní biochemické vyšetření bylo zcela normální, pouze hodnota CRP byla zvýšena na 72 mg/l, aniž by byla přítomna infekce. Vzhledem k pacientem uváděnému snížení fyzické zdatnosti jsme provedli echokardiografické vyšetření, které nezachytilo nic patologického, ejekční frakce byla 65 %.
Léčba
Léčba 2-chlorodeoxyadenosinem a později lenalidomidem
Léčba byla zahájena stimulačním cytostatickým režimem (cyklofosfamid 2 g/m2 den 1 a etoposid 200 mg/m2 i.v. infuze den 1–3) se sběrem kmenových hemopoetických buněk z periferní krve (PBSC) v únoru 2009. Stimulační režim se sběrem kmenových krvetvorných buněk jsme použili v první linii léčby z toho důvodu, že po léčbě 2-chlorodeoxyadenosinem (cladribinem) se často sběr PBSC nezdaří a vzhledem k mladému věku jsme chtěli mít rezervu pro případnou vysokodávkovanou chemoterapii. Měsíc od ukončení sběru PBSC, v březnu 2009, byla zahájena léčba 2-chlorodeoxyadenosinem (Litac) v dávce 5 mg/m2 s.c. 5 dní po sobě v 28denních intervalech. Průkaz osteoporózy v páteři, kontrastující s hyperostózou dlouhých kostí dolních končetin, je indikací k zahájení léčby bisfosfonáty. Zvolili jsme zoledronát.
Vzhledem k tomu, že na MRI mozku provedeném po třetím cyklu 2-chlorodeoxyadenosinu v monoterapii nebyly zřetelné známky léčebné odpovědi, byl od čtvrtého cyklu (červen 2009) podáván 2-chlorodeoxyadenosin (5 mg/m2) s cyklofosfamidem (150 mg/m2) a dexametazonem (24 mg celková dávka), vše 1.–5. den 28denního cyklu. Poslední, šestý cyklus této léčby byl ukončen 5. 8. 2009.
V březnu 2010 pro přetrvávání ložisek v mozku dle MRI zobrazení a pro vzestup akumulace fluorodeoxyglukózy v kostních ložiscích nemoci dle PET-CT hodnocení byla zahájena léčba lenalidomidem (Revlimidem) v dávce 25 mg, podávané denně po dobu 21 dnů se 7denní pauzou. Stejné schéma běžně používáme u mnohočetného myelomu. Celkem bylo podáno 5 cyklů této léčby, poslední tabletu lenalidomidu pacient dostal 9. listopadu 2010.
Hodnocení účinnosti léčby 2-chlorodeoxyadenosinem
Po ukončení této léčby pacient udával, že dříve měl bolesti v oblasti tibií a femurů a že lýtková kost byla na dotek velmi citlivá. Tyto potíže vymizely.
PET-CT hodnocení
U pacienta jsme prováděli opakovaná PET-CT vyšetření (tab. 2). PET-CT měření bylo provedeno po prvním cyklu chemoterapie v dubnu 2009 a následně v říjnu 2009. Z tabulky je zřetelné, že nedošlo k poklesu akumulace fluorodeoxyglukózy v žádné z měřených lokalizací.
Tab. 2. Výsledky vyšetření PET -CT vyjádřené jak hodnotou SUV<sub>max</sub>, tak indexem SUV<sub>max</sub> v ložisku/SUV<sub>max</sub> hepar. Pro srovnání jednotlivých vyšetření mezi sebou je vhodnější uvedený poměrný index. 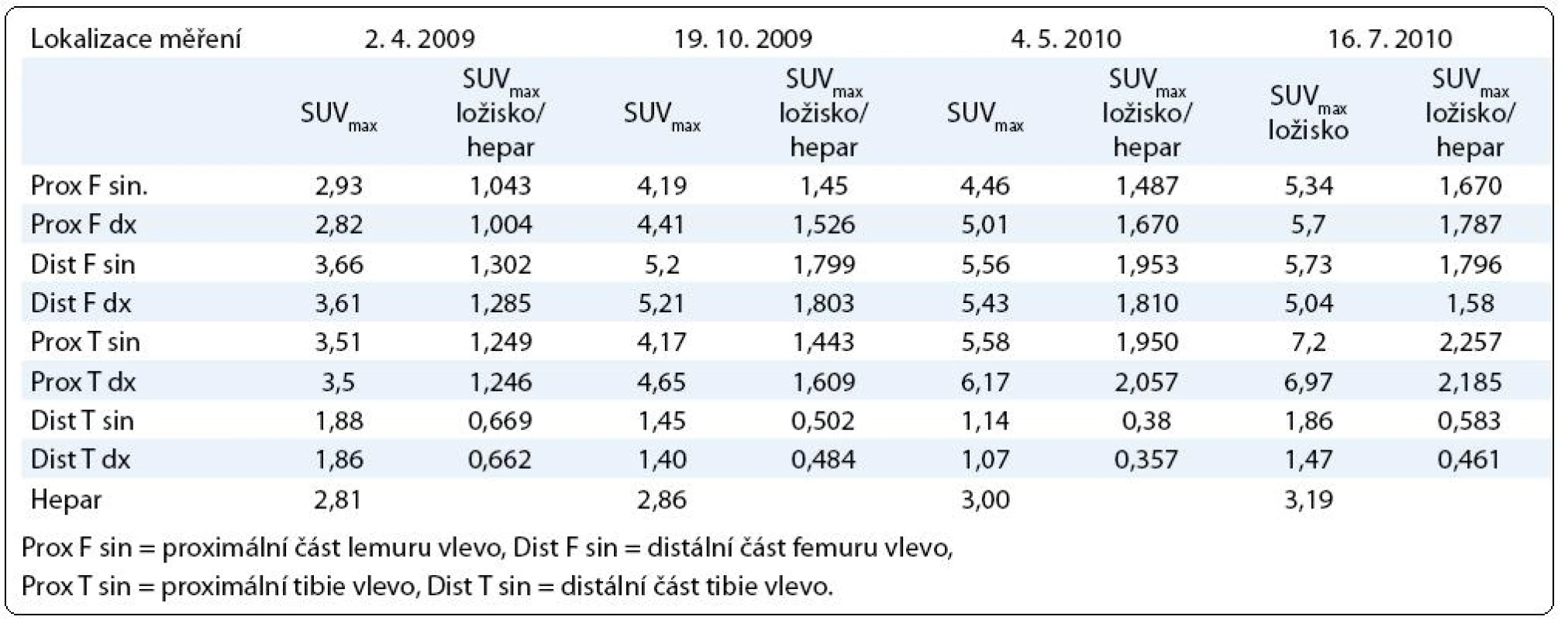
MRI mozku
- Vyšetření 22. 1. 2009 považujeme za referenční před léčbou (obr. 10). První kontrola byla provedena v průběhu třetího cyklu 2-chlorodeoxyadenosinu (28. 5. 2009) a na ní se obraz nijak neměnil, velikost i sycení ložisek infra i supratentoriálně zůstalo stejné (obr. 11).
- Další vyšetření bylo provedeno při posledním cyklu 2-chlorodeoxyadenosinového režimu. V červenci (9. 7. 2009) byla již patrná regrese velikosti ložiska vlevo při postranní komoře z původních 7 mm na 4 mm, sytost po aplikaci kontrastní látky byla rovněž méně nápadná.
- Při první kontrole po ukončení léčby 2-chlorodeoxyadenosinovým režimem (21. 9. 2009) byla regrese všech ložisek na první pohled významná, ložiska v kmeni se již téměř nesytila a největší ložisko supratentoriálně vlevo se sytilo jen tečkovitě. Nicméně ložiska po ukončené léčbě pořád přetrvávala, byť ve zmenšeném rozměru.
Obr. 10. MR zobrazení mozku z 22. 1. 2009, tedy před léčbou. Na MR je viditelné postižení kmene, mozečku a bílé hmoty supratentoriálně, ložiska T1 hypo, T2 hyperintenzní, postkontrastně se sytící, restrikce difuze na DWI , bez korelace na ADC. 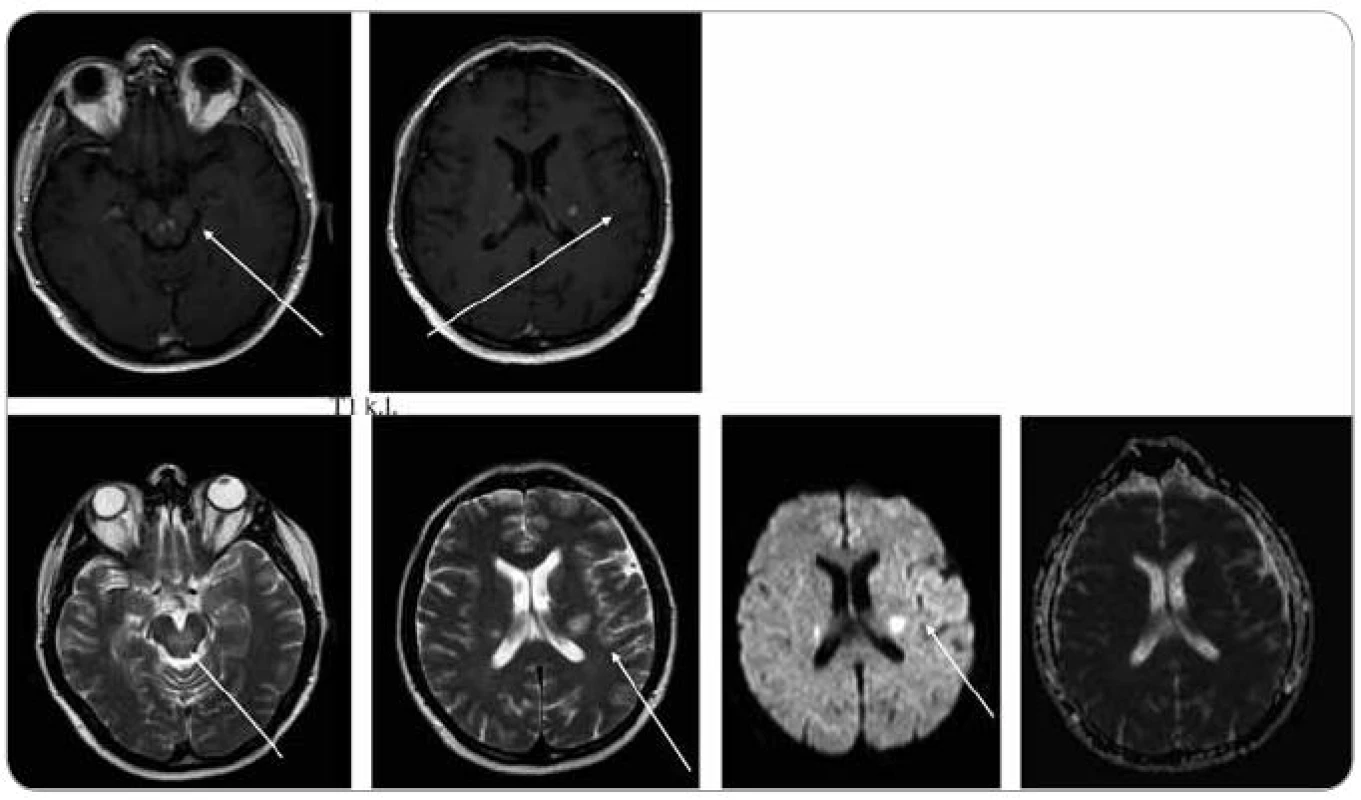
Obr. 11. MR zobrazení mozku z 28. 5. 2009. Pokud považujeme první vyšetření (22. 1. 2009) jako vyšetření referenční před léčbou, pak se na první kontrole v průběhu léčby (28. 5. 2009) obraz nijak nemění, velikost i sycení ložisek infra i supratentoriálně je stejné. 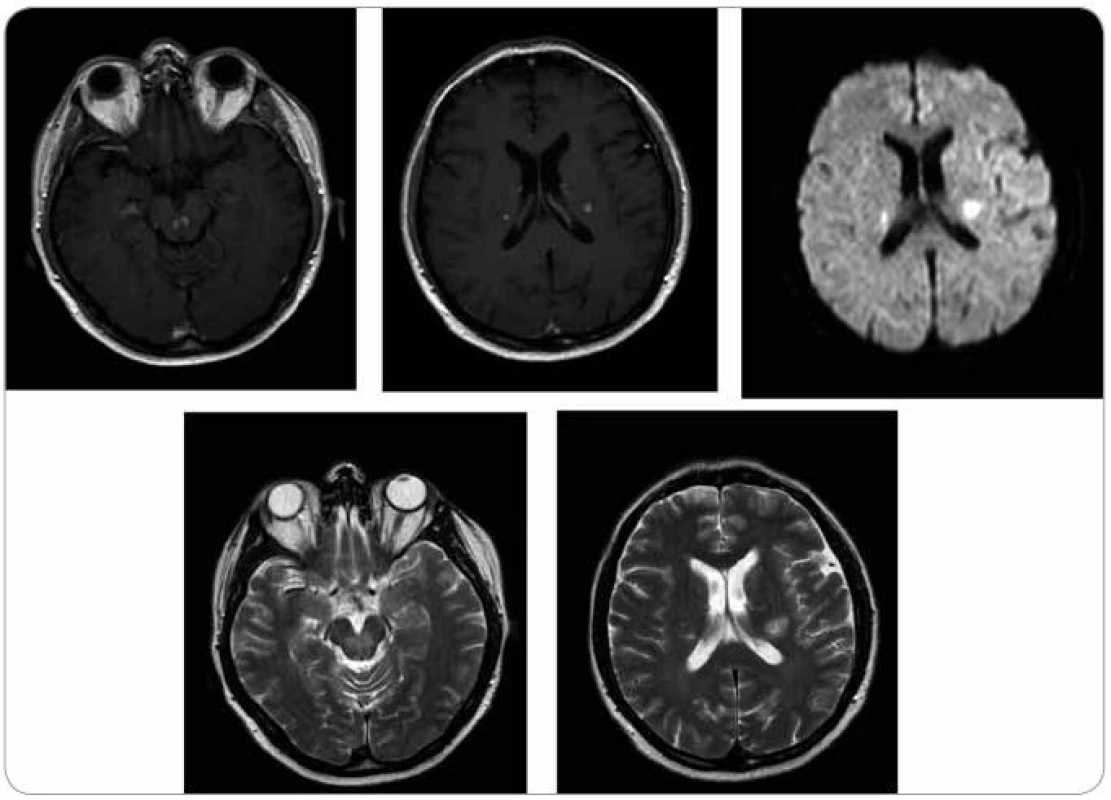
Hodnocení účinnosti léčby lenalidomidem (Revlimidem)
Efekt léčby lenalidomidem jsme vyhodnocovali opakovaně pomocí PET-CT vyšetření a dále pomocí MRI zobrazení mozku.
Poslední MRI vyšetření bylo provedeno dne 28. 5. 2010. Tehdy MRI zobrazení již prokázalo kompletní regresi ložisek v mozku. Tedy úplnou normalizaci obrazu v průběhu léčby lenalidomidem (obr. 12).
Obr. 12. MR zobrazení mozku z 9. 7. 2009. Na vyšetření v době aplikace posledního cyklu 2-chlorodeoxyadenosinu je patrná již regrese velikosti ložiska vlevo při postranní komoře, z původních 7 mm na 4 mm, sytost po aplikaci kontrastní látky je rovněž méně nápadná (zde je nutno vzít v úvahu, že byla aplikována stejná kontrastní látka gadovist ve stejném množství, tedy hodnocení sytosti je při dodržení standardního protokolu možné, jeho přesná kvantifikace se však při MR vyšetření neprovádí, subjektivní chyba je vyvážena hodnocením dvou nezávislých lékařů). Na dalším vyšetření 21. 9. 2009 (po ukončení 2-chlorodeoxyadenosinu) je již regrese všech ložisek na první pohled významná, ložiska v kmeni se již téměř nesytí a největší ložisko supratentoriálně vlevo se sytí jen tečkovitě. Na vyšetření 28. 5. 2010 (při léčbě lenalidomidem) je již regrese kompletní, bez znalosti předcházejících vyšetření zde již nelze dohledat přesné umístění patologických ložisek. Tedy normalizace obrazu. 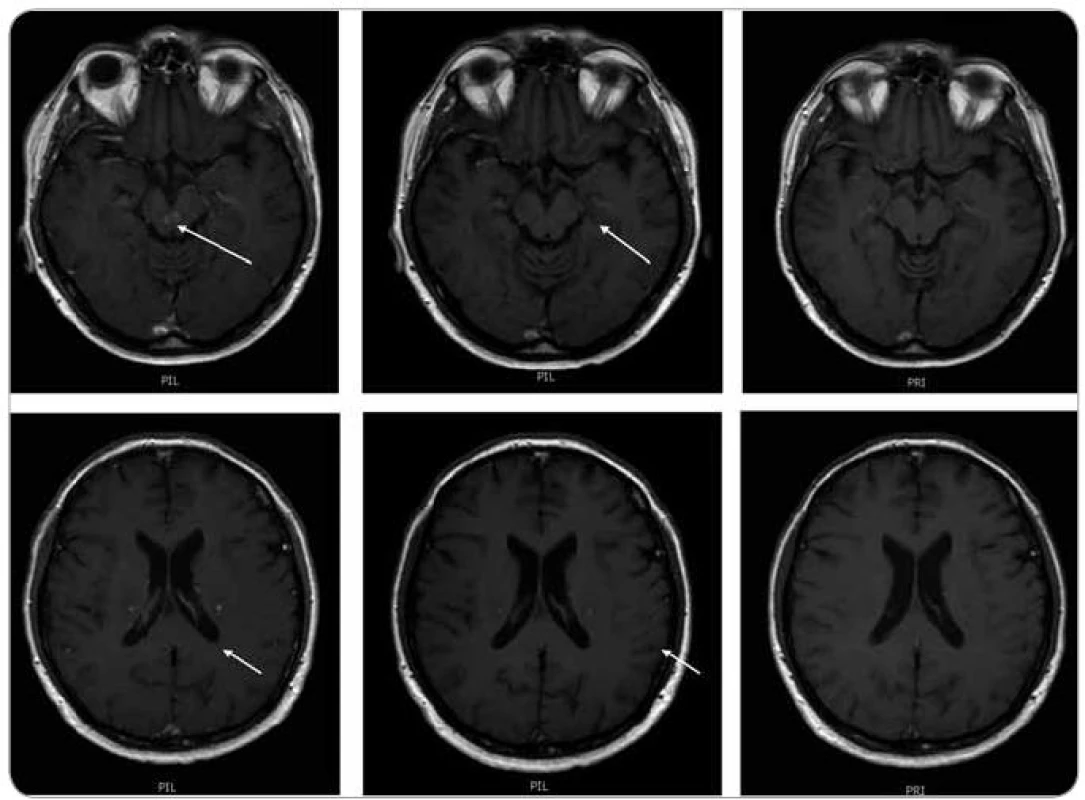
Při PET-CT kontrole však došlo k dalšímu nárůstu akumulace fluorodeoxyglukózy, korespondující se zvýšenou metabolickou aktivitou v měřených lokalizacích (tab. 2).
Potíže nemocného se zmírnily, ale nevymizely zcela. Dysartrie, obtížná chůze, závratě mají menší intenzitu než před léčbou.
V klinickém nálezu se objevila velká xantalesmata kolem očí, nejdříve na levém oku, později na pravém. Takže známky kožní progrese (obr. 13, 14).
Obr. 13. Xantalesma kolem očí pacienta, která se postupně zvětšují. 
Obr. 14. Xantalesma kolem očí pacienta, která se postupně zvětšují. 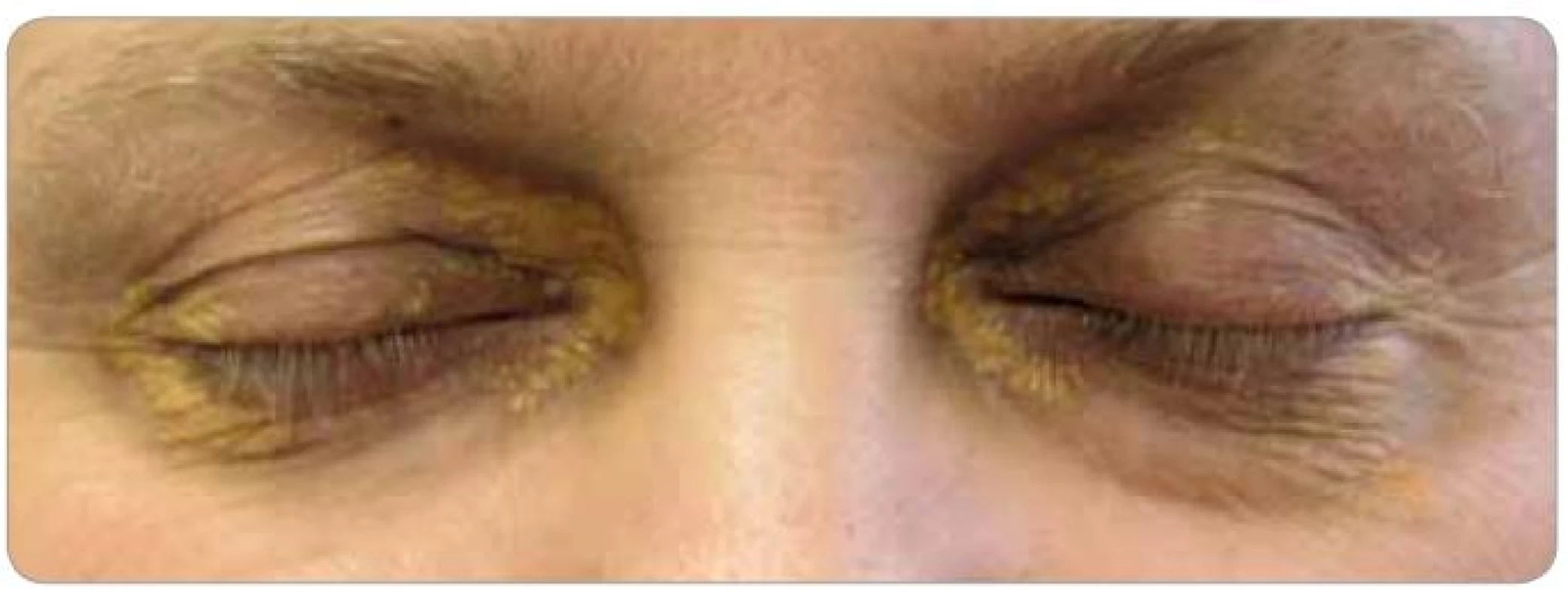
Hodnocení laboratorních parametrů v průběhu léčby
U Erdheimovy-Chesterovy nemoci není znám žádný laboratorní marker pro sledování aktivit nemoci, který by bylo možné použít. Z biochemických parametrů bylo před zahájením léčby zvýšené CRP bez známek infekce, hodnoty CRP dosahovaly 72,6, 45,0 … 53,0 mg/l. V prosinci 2009, po ukončené léčbě 2-chlorodeoxyadenosinem, byla hodnota CRP 10,0 mg/l a po ukončené léčbě lenalidomidem se pohybuje v rozmezí 10–20 mg/l. Krevní obraz byl po celou dobu léčby zcela v mezích normy.
Tolerance léčby
Pacient snášel bez subjektivních potíží jak 2-chlorodeoxyadenosin, tak následující léčbu lenalidomidem. Je velmi překvapivé, že tato léčba u něj neměla žádnou hematologickou toxicitu, počet neutrofilů v průběhu léčby lanalidomidem nepoklesl pod 2,0 × 109/l.
Shrnutí hodnocení léčby
Při hodnocení léčebné odpovědi na 2-chlorodeoxyadenosin a následně na lenalidomid jednoznačně vidíme, že léčba 2-chlorodeoxyadenosinem vedla k částečné regresi infiltrátů v CNS, které pak při léčbě lenalidomidem regredovaly zcela. Takže zobrazovací vyšetření dokumentují kompletní remisi v CNS. V opozici k tomuto příznivému vývoji v mozku dle MRI zobrazení jsou nálezy z PET-CT vyšetření, dokumentující neustále se zvyšující akumulaci fluorodeoxyglukózy v kostních ložiscích.
Diskuze a přehled publikovaných informací o Erdheimově--Chesterově nemoci
Úvod
V roce 1930 byl zveřejněn popis dvou nemocných s popisným názvem „lipoidgranulomatosis“, kterážto nemoc se klinicky i mikroskopicky odlišovala od Handovy-Schillerovy-Christianovy nemoci. Oba popsaní pacienti měli symetrickou sklerózu diafýzy a metafýzy dolních končetin a mimokostní postižení [18]. V roce 1972, tedy o 42 roků později, popsal Jaffe podobný případ a vytvořil jméno Erdheimova-Chesterova nemoc tím, že k prvnímu autorovi připojil jméno jeho vídeňského kolegy, Jakoba Erdheima, který se na prvním popisu podílel [19].
Původně byla tato nemoc považována za jednu z forem histiocytóz z Langerhansových buněk, ale tento pohled byl postupně pozměněn a Erdheimova--Chesterova nemoc byla přiřazena do skupiny diseminovaného juvenilního xantogranulomu [1,20].
Průběh nemoci je velmi individuální a odpovídá stupni poškození organizmu, nezřídka byl popisován fatální průběh. Údajů o prognóze je málo, největší soubor zveřejnila Catherine Veyssier-Belot, která uvádí, že z 37 nemocných 22 zemřelo v průběhu 2,7letého sledování [26]. Plicní fibróza s dušností a srdeční selhání jsou nejčastější příčiny úmrtí. Neurologické postižení může způsobovat ataxii či parézy, poruchu kognitivních funkcí a vést k postupnému zhoršování funkce CNS [3].
Vzhledem k tomu, že jde o málo známou nemoc, připojujeme podrobný přehled projevů a typické scintigrafické, CT a MRI obrazy s cílem přispět k časnější diagnostice.
Definice Erdheimovy-Chesterovy nemoci
Erdheimova-Chesterova nemoc je řazená do kategorie „non Langerhans cell histiocytosis“ a představuje systémovou formu diseminovaného juvenilního xantogranulomatózního onemocnění dle WHO klasifikace (tab. 1). Nemoc způsobují proliferující pěnité histiocyty, které obsahují hojné množství lipidů. Klinické příznaky jsou způsobeny osteosklerózou dolních končetin. Do obrazu nemoci patří dále fibróza a histiocytární infiltrace oblasti retroperitonea, mediastina, plic, srdce, sleziny a jater, kůže či orbity a CNS. Postižení CNS má obvykle za následek neurologické příznaky a panhypopituarizmus. Někteří nemocní mají i kožní projevy [21–23]. Erdheimova-Chesterova nemoc se objevuje v dospělém věku. Věkové rozpětí nemocných s Erdheimovou-Chesterovou chorobou je 21–77 let s věkovým průměrem 54 let [24–26].
Klinické příznaky
Klasickým a téměř vždy přítomným projevem je osteoskleróza tibií a femurů, která může působit bolesti. Mimokostní postižení je u této nemoci popisováno v 50 % případů.
Více než polovina nemocných má další příznaky nemoci: horečku nejasného původu, úbytek hmotnosti, slabost, exoftalmus, diabetes insipidus, dysurii, bolesti břicha způsobené obstrukční uropatií, která vzniká důsledkem fibrotických změn v retroperitoneu. Mozek je postižen u jedné třetiny nemocných (u 60 z 203 popsaných případů) [3]. Postižení CNS způsobuje ataxii, parézy a diabetes isipidus. Pokud je postižen mozek, jsou nejčastějšími problémy cerebelární příznaky (ataxie, 41 %) a pyramidální příznaky (parézy, 45 %). Méně často jsou přítomny bolesti hlavy, neuropsychiatrické či kognitivní poruchy, senzorické poruchy či parézy hlavových nervů [27]. Diabetes insipidus bývá přítomen u 47 % nemocných, kteří mají postižení CNS [28–30]. V některých případech byly prvními příznaky bolesti kostí [31] nebo kožní příznaky [32].
U našeho pacienta byl prvním příznakem diabetes insipidus, který byl od roku 2004 po celé další 4 roky jediným příznakem této nemoci, teprve později se přidaly další neurologické symptomy – poruchy řeči, ataxie a lehká pravostranná hemiparéza, takže ve shodě s projevy popisovanými v literatuře.
Projevy nemoci v jednotlivých lokalizacích
Hlava
V oblasti hlavy je nejčastěji popisována infiltrace kůže kolem orbity (xantogranulomatózní kožní projevy kolem očnice) a někdy také infiltrace orbity vedoucí k exoftalmu [33–36]. U našeho pacienta se xantogranulomová ložiska na kůži kolem oči objevila až po mnoha letech průběhu nemoci.
Centrální nervový systém (CNS)
Mimokostní postižení se uvádí v 50 % případů, neurologické příznaky popsali Lachenal et al u 60 z 203 zveřejněných případů [3]. Postižení CNS je tvořeno ložisky, která vychytávají kontrastní látky, a ty v nich setrvávají až po dobu dvou týdnů. Byly popsány i projevy nitrolební hypertenze a přítomnost městnavé papily [37–40]. MRI zobrazení může pomoci v diferenciální diagnostice cerebrálního postižení.
Neurologické postižení je možno rozdělit do tří typů [41]:
- První typ je charakteristický infiltráty v oblasti kmene, v cerebelu a v mozku. Vyskytuje se u 44 % pacientů.
- Druhým typem (37 %) je meningeální postižení s tumory, které tvarem odpovídají meningeomům, a s nodulárním zduřením dura mater.
- Třetí typ (19 %) je spojením obou předchozích – infiltrativního postižení CNS a meningeálního postižení.
Optimálním způsobem jejich znázornění je MRI, ložiska dávají zvýšený signál v T2 váženém obraze a sytí se po aplikaci gadolinia v T1 váženém obraze. Byla popsána prolongované retence kontrastní látky [3,42–45].
Hypofýza a hypotalamus
Diabetes insipidus bývá přítomen asi u 25 % případů. Tito nemocní mívají na MRI vyšetření ztrátu hyperintenzního signálu z posteriorního laloku hypofýzy a zesílení infundibula, případně infiltraci stopky hypofýzy. Tyto změny vedou k atrofii zadního laloku hypofýzy [39,46].
Diabetes insipidus bývá v některých případech prvním projevem nemoci, pak následují MRI vyšetření prokazující infiltraci v oblasti stopky hypofýzy. Někdy bývá v době stanovení diagnózy zjištěna i snížená hladina gonadotropinů a dalších hormonů [47–51].
Nález infiltrace v oblasti stopky hypofýzy je velký diferenciálně diagnostický problém. Je sice možné provedení biopsie tohoto infiltrátu, ale ne vždy biopsie infiltrátu vede k diagnóze. Sheu popisuje punkci infiltrátů s nálezem pseudoinflamatorní infiltrace a teprve až sekčně se potvrdila souvislost s Erdheimovou--Chesterovou nemocí [52]. V diferenciální diagnostice infiltrátů v oblasti infundibula a stopky hypofýzy připadá v úvahu neurosarkoidóza, Erdheimova--Chesterova nemoc, histiocytóza z Langerhansových buněk a lymfocytární hypofyzitida. Proto se při diferenciální diagnostice infiltrace stopky hypofýzy vždy doporučuje provedení vyšetření dolních končetin, zda nejsou známky Erdheimovy-Chesterovy nemoci, a dále vyšetření lokalizací typických pro systémové projevy histiocytózy z Langerhansových buněk a vyšetření plicních hilů, zda nejsou zvětšené hilové uzliny, což je zase typické pro sarkoidózu [53–63].
Také u našeho pacienta budila izolovaná infiltrace hypofýzy značné diagnostické rozpaky. Provedená stereotakticky navigovaná biopsie s odběrem materiálu k histologickému vyšetření přinesla pouze morfologický obraz zánětlivé infiltrace podobně, jak popsali i výše citovaní autoři. Proč cílená biopsie nepřinesla v našem případě ani v jiných, v literatuře popsaných případech histologickou diagnózu, můžeme pouze spekulovat a uvést analogii s neurodegenerativními projevy histiocytózy z Langerhansových buněk (LCH), kde byly i sekčně nalezeny pouze lymfocytární infiltráty a bylo spekulováno, že celé neurodegenerativní poškození může mít podklad maligní chorobou indukované degenerativní změny. Je možné, že infiltraci CNS pěnitými histiocyty provází intenzivní zánětlivá reakce, a proto cílené biopsie stopky hypofýzy tuto diagnózu nemusí odhalit.
Hrudník
V oblasti hrudníku může nemoc infiltrovat plíce a vést k plicní fibróze a může způsobit respirační insuficienci. Při zobrazovacích vyšetřeních jsou popisovány intersticiální infiltráty [64–70].
Infiltrace perikardu způsobuje perikardiální výpotek, který je nejčastějším kardiálním projevem této nemoci [71,72]. Dále byla popsána infiltrace myokardu, chlopní, koronárních arterií. Specifickým projevem je periaortální fibróza, takzvaná coated aorta [2,73–77]. K monitorování postižení srdce byla použita scintigrafie pomocí Ga-67 [78].
Selhání plic či kardiální slabost jsou nejčastějšími příčinami úmrtí těchto osob [73].
Při vyšetření hrudníku u našeho pacienta metodou CT s aplikací kontrastu, stejně jako při vyšetření břišní dutiny bylo popsáno zesílení stěny aorty, což odpovídá literárnímu popisu coated aorta.
Břicho
V oblasti břicha se nemoc nejčastěji projevuje retroperitoneálními infiltráty a fibrotizací. Tyto projevy vedou k obstrukční nefropatii. Zobrazovacími vyšetřeními je prokazatelná retroperitoneální a perirenální infiltrace a fibrotické změny. Pokud dominuje aktivita nemoci v oblasti retroperitonea, je možná záměna s Ormondovou chorobou (idiopatická retroperitoneální fibróza) [79,80]. Literatura popisuje případy, kdy byly provedeny biopsie této zdánlivě maligní infiltrace retroperitonea a histologické hodnocení odebraného materiálu vyznělo nespecificky: „pojivová fibrózní tkáň s fokálními známkami zánětu“ [81,82]. Diferenciálně diagnostické postupy při nálezu retroperitoneální fibrózy uvádějí citované publikace [83–85]. V některých případech právě retroperineální infiltrace, fibrotizace byla první známkou této nemoci [86,87], která případně způsobila hydronefrózu [88] či akutní renální selhání [89–91]. Zcela výjimečně je přítomna infiltrace jater a dalších parenchymatózních orgánů [92].
Popisovaný pacient má sice již na CT zřetelné známky retroperitoneální fibrózy, ale zatím není narušen odtok moče z ledvin. Odtok moče však budeme monitorovat radioizotopovým vyšetřením ledvin a sonograficky, abychom zavčas zjistili vznik obstrukční nefropatie.
Dolní a horní končetiny
Radiografické abnormality kostí končetin jsou typické, pravidelně se vyskytují symetricky na dolních, méně často horních končetinách. Denzita kosti je ložiskovitě či difuzně zvýšena, je patrné zesílení trabekul, skleróza a zesílení kortikalis. Proces postihuje hlavně diafýzy, metafýzy s minimálními změnami v epifýzách. Chester se domníval, že infiltrace kostní dřeně histiocyty naplněnými tukem byl primární jev a kostní reakce se sklerózou byla sekundární. To zůstalo pouze domněnkou a doposud není jasné, co spouští procesy vedoucí ke sklerotizaci kostí. Při MRI vyšetření je patrný obraz patologického signálu z postižených kostí [93–97].
Odchylky metabolizmu skeletu od normálu je možné zobrazit jak pomocí klasické scintigrafie skeletu s aplikací techneciumpyrofosfátu, tak pomocí FDG-PET vyšetření. Scintigrafie skeletu však znázorňuje změny kostního metabolizmu intenzivněji než FDG-PET zobrazení. Naopak FDG-PET může prokázat mimokostní patologie [98–105].
Publikace z poslední doby však vyzdvihují zásadní přínos PET-CT vyšetření pro vyhodnocování léčebné odpovědi [106], a proto i v našem případě je PET-CT základem vyhodnocování léčebné odpovědi.
U našeho pacienta je již na rentgenových snímcích patrné zesílení kompakty stehenní kosti a dále v oblasti pánve; při CT vyšetření byly popsány i sklerotické změny v obratli, byť postižení páteře není pro tuto nemoc typické.
Scintigraficky byl obraz zcela jednoznačně patologický, s vysoce zvýšeným vychytáváním techneciumpyrofosfátu v patologických kostních ložiscích.
Zobrazení PET-CT bylo provedeno až v průběhu léčby, viz popis, ale zvýšená akumulace fluorodeoxyglukózy je patrná nejen v kostech se změněnou strukturou (SUV 3,6), ale i ve stěnách velkých tepen. Nález zcela koreluje s nálezem celotělového MRI, jehož výsledek uvádíme na obr. 18, 19 a 20.
Laboratorní známky
S průběhem nemoci souvisejí zvýšení zánětlivých parametrů (CRP), leukocytóza, trombocytóza, vysoká hodnota fibrinogenu a sedimentace erytrocytů [1–3].
Tyto parametry (CRP, fibrinogen, leukocytóza, trombocytóza) jsou zvýšené i u našeho pacienta.
Stanovení diagnózy
Morfologická diagnóza
Tato nemoc nejasného původu je histologicky charakterizována infiltrací histiocyty obsahujícími tuk (pěnitými histiocyty) a dále Toutonovými obrovskými mnohojadernými buňkami. Tyto buňky tvoří xantogranulomatózní a infiltrativní ložiska. Imunohistochemické vyšetření prokazuje u těchto buněk typický imunofenotyp (CD68+, CD1a-, S100-). Dle literatury je zde kolísání v expresi, a tedy pozitivitě znaku S100. U minoritního počtu pacientů s Erdheimovou-Chesterovou nemocí byl pozitivní, zatímco u většiny byl negativní [1,15,24,26,107–110]. Naproti tomu v expresi CD1a antigenu, jehož průkaz je typický pro LCH, byla shodně popsána negativita ve všech případech Erdheimovy-Chesterovy nemoci [24,111]. Zcela výjimečný je popis průkazu nekrózy kostní dřeně [112] anebo hemofagocytóza [113,114].
V námi popisovaném případě trepanobiopsie s histologickým hodnocením válečku jasně popsaly patologickou infiltraci kostní dřeně, značně masivní, dosahující 40–60 %, s odpovídajícími imunofenotypickými znaky.
Diferenciální diagnóza
V rámci diferenciální diagnózy je třeba odlišit Rosaiovu-Dorfmanovu nemoc (sinusovou histiocytóza s masivní lymfadenopatií), která způsobuje oboustranné zvětšení krčních uzlin. Histiocyty jsou u této nemoci podobné jako při popisované nemoci, ale na rozdíl od ní je často přítomný kontakt histiocytů s lymfocyty (emperipolesis). Buňky sinusové histiocytózy jsou silně pozitivní pro S100 [115–117]. Podobně může vypadat střádací nemoc způsobená polyvinylpyrolidinem [24].
Od histiocytózy z Langerhansových buněk (LCH) se Erdheimova-Chesterova choroba odlišuje v několika aspektech. Jednoznačným rozdílem je symetrická distribuce sklerotických změn skeletu u Erdheimovy-Chesterovy nemoci, zatímco u LCH se vyskytují nesymetrická osteolytická ložiska. LCH se vyskytuje u dětí a mladých dospělých, zatímco Erdheimova-Chesterova nemoc u osob mezi 21 a 77 lety věku. Průměrný věk postižených byl 54 let [24,26].
Léčba
Optimální léčba není známa, jsou známy pouze popisy případů, u nichž se zkoušely různé léčebné postupy. Obecně se dá říci, že optimální léčba není známa a prognóza je nejistá. Chemoterapie, radioterapie a steroidy nemají ve všech případech léčebný efekt a ke spontánní remisi na rozdíl od eozinofilního granulomu nedochází [26].
Nemoc se léčí podobně jako histiocytóza z Langerhansových buněk. Někteří autoři popisují příznivý účinek vinka-alkaloidů a kortikoidů [104]. Další s různými výsledky testovali léčbu pomocí cyklofosfamidu, případně metotrexátu a etoposidu [107,118,119].
Také interferon alfa byl u těchto pacientů používán v dávce 3–9 milionů jednotek 3× týdně. Dočasná částečná regrese nemoci byla popsána u nadpolovičního počtu nemocných [120,121]. V jednom případě navodil interferon alfa roky trvající kompletní remisi choroby [118].
Pokud se podávaly kortikoidy, byly účinné ve vysokých pulzních dávkách nebo injekčně přímo do ložisek nemoci. Nicméně uvádí se, že léčebný efekt kortikosteroidů i chemoterapie je podstatně menší než u LCH [120].
Cladribin neboli 2-chlorodeoxyadenosin je s úspěchem používán u histiocytózy z Langerhansových buněk a v několika případech bylo popsáno zásadní zlepšení u nemocných s Erdheimovou-Chesterovou nemocí [122,123] i u postižení CNS juvenilní xantogranulomatózou [124]. Používá se v dávce 0,14 mg//kg/den 5 dní po sobě. Přehled léčebných postupů uvádí Haroche [73] a informace o léčbě shrnuje tab. 3.
Tab. 3. Přehled publikovaných léčebných postupů. 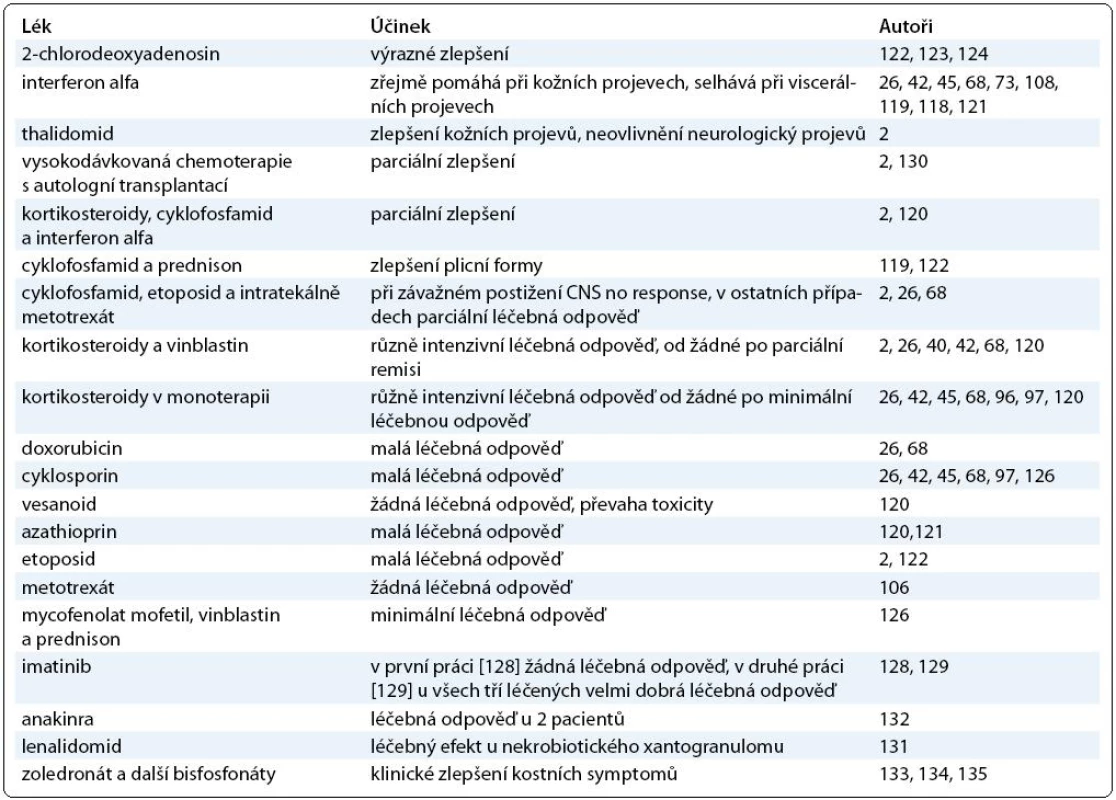
V jedné publikaci je popsán přínos kombinace prednisonu, vinblastinu a mykofenolát mofetilu [125].
Testována byla i léčebná aplikace stroncia pro bolesti v dolních končetinách [118]. Radioterapie má prokázaný paliativní a analgetický efekt při ozáření bolestivých končetin v dávce 24 Gy, zatímco dávka 10 Gy neměla žádoucí účinek. Zkušenosti s radioterapií CNS infiltrátů jsou malé, literatura popisuje 7 pacientů léčených cílenou radioterapií na CNS infiltráty, z toho u třech byla zaznamenána progrese a tři měli stabilní nález po dalších 6 měsíců. Radioterapii lze využít k léčbě retrobulbárních infiltrátů, ale i tam je úspěch malý, Hoffmann uvádí, že záření v dávce 20 Gy nepřineslo efekt [94]. Z publikací vyplývá, že naděje na dosažení dlouhodobé regrese infiltrátů v CNS radioterapii není velká [126,127], lze ji použít na bolestivé změny končetin [107].
Z biologické léčby byl testován imatinib. Z 37 vyšetřených histologických preparátů byla u 32 prokázána v histiocytech přítomnost genu PDGFRbeta (86,5 %). Celkem bylo imatinibem léčeno 6 pacientů s Erdheimovou-Chesterovou nemocí. V průběhu sledování se ukázalo, že léčebná odpověď na imatinib závisí od lokalizace procesu. V oblasti CNS došlo u 75 % léčených k progresi, zatímco postižení kardiovaskulárního aparátu zůstalo v průběhu léčby stabilní. Haroche uzavírá, že v uvedených případech nebyl prokázán zásadní přínos imatinibu pro tyto nemocné [128]. Novější publikace popisuje léčebnou odpověď po imatinibu u tří pacientů [129]. Role imatinibu si tedy zaslouží jistě další testování u těchto nemocných. V několika případech byla s malým efektem použita i vysokodávkovaná chemoterapie s autologní transplantací kostní dřeně [130].
Do biologické léčby lze zařadit i aplikaci thalidomidu, pouze v jednom případě byl popisován přínos [2]. Do konce roku 2010 nebyla v Medline publikace popisující přínos lenalidomidu u Erdheimovy-Chesterovy nemoci, zveřejněna byla pouze jedna zpráva popisující výborný léčebný efekt lenalidomidu u nekrobiotického xantogranulomu, což je nemoc řazená dle WHO klasifikace krevních nemocí z roku 2008 do skupiny juvenilního xantogranulomu, podobně jako Erdheimova-Chesterova nemoc [131]. Tato fakta nás vedla k podání lenalidomidu našemu pacientovi. V roce 2010 se také objevila první zpráva o léčebném účinku preparátu anakinra [132].
Do komplexní léčby patří také bisfosfonáty, výrazné zlepšení bylo popsáno po zoledronátu, zřejmě díky jeho brzdivému vlivu na produkci zánětlivých cytokinů makrofágy a jejich migraci [133–135].
Naše pracoviště má velmi dobré zkušenosti se 2-chlorodeoxyadenosinem u histiocytózy z Langerhansových buněk. 2-chlorodeoxyadenosin jsme použili také u jiného pacienta s Erdheimovou-Chesterovou nemocí a dosáhli jsme velmi dobré léčebné odpovědi dle klinického i PET-CT hodnocení, s výrazným poklesem akumulace fluorodeoxyglukózy v dlouhých kostech. To bylo důvodem, proč jsme se rozhodli pro 2-chlorodeoxyadenosin i u tohoto pacienta. V tomto popisovaném případě však 2-chlorodeoxyadenosinový léčebný režim dosáhl pouze částečné regrese infiltrátů v CNS dle MRI hodnocení a nevedl k žádnému poklesu akumulace fluorodeoxyglukózy v dlouhých kostech. Proto jsme v rámci léčby druhé linie podali lenalidomid, lék, u něhož byla popsána excelentní účinnost u jiné nemoci ze skupiny juvenilního xantogranulomu, konkrétně u pacienta s nekrobiotickým xantogranulomem. Výsledkem lenalidomidové léčby byla kompletní remise infiltrátů v CNS dle MRI zobrazení, zatímco míra akumulace fluorodeoxyglukózy v dlouhých kostech se po celou dobu léčby zvyšovala. Tuto diskrepanci neumíme vysvětlit.
Závěr
Jak Erdheimova-Chesterova nemoc, tak i LCH mají afinitu k stopce hypofýzy a hypotalamu. Při postižení těchto struktur je nutno vždy diferenciálně diagnosticky myslet na histiocytární onemocnění. A protože biopsie stopky hypofýzy či hypotalamu může způsobit trvalé poškození pacienta, jak tomu bylo i v našem případě, je nutné vždy pátrat, zda nejsou přítomny extrakraniální příznaky některé z nemocí, které připadají v úvahu. Pro diferenciální diagnózu je nejdůležitější celotělové PET-CT vyšetření, které může prokázat extrakraniální projevy té nemoci, které vedla k poškození CNS.
Pro léčbu Erdheimovy-Chesterovy nemoci nebyl definován optimální postup. 2-chlorodeoxyadenosin se zdá být jednou z velmi účinných variant jak dle popisu v literatuře, tak i dle našich zkušeností. U jiného našeho pacienta tato léčba vedla k remisi s velmi výrazným poklesem akumulace fluorodeoxyglukózy v dlouhých kostech.
V tomto popisovaném případě však léčba 2-chlorodeoxyadenosinem vedla pouze k parciální remisi infiltrátů v mozku, zatímco míra akumulace 2-fluorodeoxyglukózy se zvyšovala. Při léčbě druhé linie, lenalidomidem, došlo k úplnému vymizení infiltrátů v CNS dle MRI vyšetření, ale k dalšímu nárůstu intenzity akumulace fluorodeoxyglukózy v dlouhých kostech dolních končetin. Pro uvedenou odlišnost léčebné odpovědi v jednotlivých lokalizacích neznáme vysvětlení.
Poděkování
Léčba pacienta se uskutečnila za laskavé podpory firmy Celgene s.r.o. z projektu Compassionate Use Program určeného pro pacienty se vzácnými hematoonkologickými onemocněními.
Tato práce byla podpořena výzkumným záměrem MZd ČR: FUNDIN MZ0MOU2005 a připravena v rámci aktivity následujících grantů: grantu IGA ČR NT 12215-4, grantů MŠMT MSM0021622434, LC06027 a grantů IGA MZd NT11154, NT12130, NT12215 a NS10408.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
prof. MUDr. Zdeněk Adam, CSc.
Interní hematoonkologická klinika
FN Brno
Jihlavská 20
625 00 Brno
e-mail: z.adam@fnbrno.cz
Obdrženo: 14. 3. 2011
Přijato: 16. 5. 2011
Zdroje
1. Sverdlow SH, Campo E, Harris NL et al. WHO Classification of tumours of haematopoietic and lymphoid tissues. Lyon: IARC Press 2008.
2. Dickson BC, Pethe V, Chung CT et al. Systemic Erdheim--Chester disease. Virchows Arch 2008; 452(2): 221–227.
3. Lachenal F, Cotton F, Desmurs-Clavel H et al. Neurological manifestations and neuroradiological presentation of Erdheim-Chester disease: report of 6 cases and systematic review of the literature. J Neurol 2006; 253(10): 1267–1277.
4. Kinkor Z, Koudela K Jr, Koudela K et al. Warfarinem vyvolaná hemoragická pseudocysta malé pánve u ženy s vrozeným genetickým defektem koagulace komplikovaná usuračním pseudoxantomem pánevní kosti napodobujícím Erdheim-Chesterovu nemoc. Acta Chir Orthop Traum Čech 2007; 74(2): 114–117.
5. Kinkor Z. Severe pulmonary involvement in Erdheim-Chester disease (case report). Cesk Patol 2001; 37(3): 114–117.
6. Kinkror Z. Závažné plicní postižení u Erdheim-Chesterovy nemoci. Čs Patol 2001; 37/46(3): 114–117.
7. Kolář J, Kučera V, Povýšil C et al. Erdheim-Chester disease. Rofo 1984; 141(6): 698–701.
8. Mergancová J, Kubes L, Elleder M. Xanthogranulomatous processes in the area of the large vessels. Cesk Patol 1986; 22(3): 145–150.
9. Mergancová J, Kubeš L, Elleder M. A xanthogranulomatous process encircling large blood vessels (Erdheim--Chester disease). Czech Med 1988; 11(1): 57–64.
10. Kučera V, Čáp V, Kužel J et al. Vzácná příčina osteosklerózy: Erdheimův-Chesterův syndrom. ČS Radiol 1984; 38(6): 393–402.
11. Janková H, Říhová E. Juvenilní xanthogranulom. Oftalmologie 2007; 3 : 214–218.
12. Vašáková M. Co je to Erdheimova nemoc? Kazuist Alergol Pneumol ORL 2006; 3(4): 22–25.
13. Mottl H, Koutecký J, Ganevová M. Strategie léčby histiocytózy z Langerhansových buněk u dětí. Čes-slov Pediat 1994; 49(2): 81.
14. Mottl H, Starý J. Histiocytóza z Langerhansových buněk u dětí – klinická diagnostika a současná léčba. Čes-slov Pediat 2007; 62(4): 200–225.
15. Plank L. Diagnostická patológia non-Langerhans cell histiocytóz. Vnitř Lék 2010; 56 (Suppl 2): 2S39–2S63.
16. Adam Z, Zahradová L, Krejčí M et al. Difuzní plošná normolipemická xantomatóza a nekrobiotický xantogranulom, asociované s monoklonální gamapatií – přínos PET-CT pro stanovení rozsahu nemoci a zkušenosti s léčbou. Popis dvou případů a přehled literatury. Vnitř Lék 2010; 56(11): 1158–1168.
17. Zahradová L, Adam Z, Feit J et al. Nekrobiotický xanthogranulom vzácná kožní komplikace u nemocného s mnohočetným myelomem. Vnitř Lék 2010; 56 (Suppl 2): 2S179–2S182.
18. Chester W. Über lipoigranulomatóse. Virchows Arch 1930; 279 : 561–602.
19. Jaffe HL. Hematologic, degenerative and inflammatory disease of bones and joints. Philadelphia, PA: Lea and Febiger 1972 : 531–541.
20. Miller RL, Sheeler LR, Bauer TW et al. Erdheim-Chester disease. Case report and review of the literature. Am J Med 1986; 80(5): 1230–1236.
21. Corradi D, Maestri R, Palmisano A et al. Idiopathic retroperitoneal fibrosis: clinicopathological features and diferencial diagnosis. Kidney Int 2007; 72(6): 742–753.
22. Alper MG, Zimmerman LE, Piana FG. Orbital manifestatiton of Erdheim-Chester disease. Trans Am Ophthalmol Soc 1983; 81 : 64–85.
23. Garg T, Chander R, Gupta T et al. Erdheim-Chester disease with cutaneous features in an Indian patient. Skinmed 2008; 7(2): 103–106.
24. Kenn W, Eck M, Allolio B et al. Erdheim-Chester disease: evidence for a disease entity different from Langerhans cell histiocytosis? Three cases with detailed radiological and immonohistochemical analysis. Hum Pathol 2000; 31(6): 734–739.
25. Kenn W, Stäbler A, Zachoval R et al. Erdheim-Chester disease: a case report and literature overview. Eur Radiol 1999; 9(1): 153–158.
26. Veyssier-Belot C, Cacoub P, Caparros-Lefebvre D et al. Erdheim-Chester disease: clinical and radiologic characteristics of 59 cases. Medicine (Baltimore) 1996; 75(3): 157–169.
27. Perras B, Petersen D, Lorch H et al. Psychoneuroendocrine disturbances in a patient with a rare granulomatous disease. Exp Clin Endocrinol Diabetes 2002; 110(5): 248–252.
28. Brodkin CL, Wszolek ZK. Neurologic presentation of Erdheim-Chester disease. Neurol Neurochir Pol 2006; 40(5): 397–403.
29. De Abreu MR, Chung CB, Biswal S et al. Erdheim-Chester disease: MR imaging, anatomic, and histopathologic correlation of orbital involvement. AJNR Am J Neuroradiol 2004; 25(4): 627–630.
30. Salsano E, Savoiardo M, Nappini S et al. Late-onset sporadic ataxia, pontine lesion, and retroperitoneal fibrosis: a case of Erdheim-Chester disease. Neurol Sci 2008; 29(4): 263–267.
31. Sistermann R, Katthagen BD. Erdheim-Chester disease: a rare cause of knee and leg pain. Arch Orthop Trauma Surg 2000; 120(1–2): 112–113.
32. Yanagi T, Kato N, Yamane N et al. Verruca plana-like papules as a new manifestation of Erdheim-Chester disease. Arch Dermatol 2007; 143(7): 952–953.
33. Sivak-Callcott JA, Rootman J, Rasmussen SL et al. Adult xanthogranulomatous disease of the orbit and ocular adnexa: new immunohistochemical findings and clinical review. Br J Ophthalmol 2006; 90(5): 602–608.
34. Watermann DF, Kiesewetter F, Frosch PJ. Skin manifestations of Erdheim-Chester disease. Case report and review of the literature. Hautarzt 2001; 52(6): 510–517.
35. Hammond MD, Niemi EW, Ward TP et al. Adult orbital xanthogranuloma with associated adult-onset asthma. Ophthal Plast Reconstr Surg 2004; 20(4): 329–332.
36. Karcioglu ZA, Sharara N, Boles TL et al. Orbital xanthogranuloma: clinical and morphologic features in eight patients. Ophthal Plast Reconstr Surg 2003; 19(5): 372–381.
37. Kujat C, Martin J, Püschel W. Die Erdheim-Chester Krankheit. Radiologe 1991; 31 : 297–306.
38. Fink MG, Levinson DJ, Brown NL et al. Erdheim-Chester disease. Case report with autopsy finding. Arch Pathol Lab Med 1991; 115(6): 619–623.
39. Tien RD, Brasch RC Jackson DE et al. Cerebral Erdheim--Chester disease: persistent enhancement with Gd-DTPA on MR images. Radiology 1989; 172(3): 791–792.
40. Martinez R. Erdheim-Chester disease: MR of intraaxilal and extraaxial brein stem lesion. AJNR Am J Neuroradiol 1995; 16(9): 1787–1790.
41. Ernemann U, Skalej M, Hermisson M et al. Primary cerebral non-Langerhans cell histiocytosis: MRI and differential diagnosis. Neuroradiology 2002; 44(9): 759–763.
42. Babu RR, Lansen TA, Chadburn A et al. Erdheim-Chester disease of the central nervous system. Report of two cases. J Neurosurg 1997; 86(5): 888–892.
43. Bohlega S, Alwatban J, Tulbah A et al. Cerebral manifestation of Erdheim-Chester disease: clinical and radiologic findings. Neurology 1997; 49(6): 1702–1705.
44. Weidauer S, von Stuckrad-Barre S, Dettmann E et al. Cerebral Erdheim-Chester disease: case report and review of the literature. Neuroradiology 2003; 45(4): 241–245.
45. Wright RA, Hermann RC, Parisi JE. Neurological manifestations of Erdheim-Chester disease. J Neurol Neurosurg Psychiatry 1999; 66(1): 72–75.
46. Shimada S, Ono K, Hashizume Y et al. Intracranial lesion of Erdheim-Chester disease. Hum Pathol 2007; 38(6): 950–951.
47. Grothe C, Urbach H, Bös M et al. Cerebellar syndrome, exophthalmos and secondary hypogonadism in Erdheim-Chester disease. Nervenarzt 2001; 72(6): 449–452.
48. Khamseh ME, Mollanai S, Hashemi F et al. Erdheim--Chester syndrome, presenting as hypogonadotropic hypogonadism and diabetes insipidus. J Endocrinol Invest 2002; 25(8): 727–729.
49. Kovacs K, Bilbao JM, Fornasier VL et al. Pituitary pathology in Erdheim-Chester disease. Endocr Pathol 2004; 15(2): 159–166.
50. Oweity T, Scheithauer BW, Ching HS et al. Multiple system Erdheim-Chester disease with massive hypothalamic-sellar involvement and hypopituitarism. J Neurosurg 2002; 96(2): 344–351.
51. Tritos NA, Weinrib S, Kaye TB. Endocrine manifestations of Erdheim-Chester disease (a distinct form of histiocytosis). J Intern Med 1998; 244(6): 529–535.
52. Sheu SY, Wenzel RR, Kersting R et al. Erdheim-Chester disease: a case report with multisystemic manifestation including testes, thyroid, and lymph nodes and a review of literature. J Clin Pathol 2004; 57(11): 1225–1228.
53. Bullmann C, Faust M, Hoffmann E et al. Five cases with central diabetes insipidus and hypogonadism as first presentation of neurosarcoidosis. Eur J Endocrinol 2000; 142(4): 365–372.
54. Mahnel R, Tan KH, Fahlbusch R et al. Problems in differential diagnosis of non Langerhans cell histiocytosis with pituitary involvement: case report and review of literature. Endocr Pathol 2002; 13(4): 361–368.
55. Sheen KC, Chang CC, Chang TC et al. Thikened pituitary stalk with central diabetes insipidus: report of 3 cases. J Formos Med Assoc 2001; 100(3): 198–204.
56. Takao T, Asaba K, Tanaka H et al. A case of of lymphocytic infundibuloneurohypophysitis schowing diabetes inspidus followed by anterior hypopituitarism associated with trombnasthenia. Endocr J 2000; 47(3): 285–291.
57. Tashiro T, Sano T, Xu B et al. Spectrum of different types of hypophysitis: a clinicopathologic study hypophysitis in 31 cases. Endocr Pathol 2002; 13(3): 183–185.
58. Mohn A, Fahlbusch R, Dörr HG. Panhypopituitarism associated with diabetes insipidus in a girl with a suprasellar arachnoid cyst. Horm Res 1999; 52(1): 35–38.
59. Folkerth RD, Price DL Jr, Schwartz M et al. Xanthomatous hypophysitis. Am J Surg Pathol 1998; 22(6): 736–741.
60. Athanasou NA, Barbatis C. Erdheim-Chester disease with epiphyseal and systemic disease. J Clin Pathol 1993; 46(5): 481–482.
61. Augoustides JG, Szeto WY. Unmasked diabetes insipidus after pericardial drainage and biopsy for pericardial effusion in association with Erdheim-Chester disease. J Thorac Cardiovasc Surg 2008; 136(1): 217–218.
62. Rushing EJ, Kaplan KJ, Mena H et al. Erdheim-Chester disease of the brain: cytological features and differential diagnosis of a challenging case. Diagn Cytopathol 2004; 31(6): 420–422.
63. Reithmeier T, Trost HA, Wolf S et al. Xanthogranuloma of the Erdheim-Chester type within the sellar region: case report. Clin Neuropathol 2002; 21(1): 24–28.
64. Allen TC, Chevez-Barrios P, Shetlar DJ et al. Pulmonary and ophthalmic involvement with Erdheim-Chester disease: a case report and review of the literature. Arch Pathol Lab Med 2004; 128(12): 1428–1431.
65. Kambouchner M, Colby TV, Demenge C et al. Erdheim-Chester disease with prominent pulmonary involvement associated with eosinophillic granuloma of mandibular bone. Histopathology 1997; 30(4): 353–358.
66. Krüger S, Krop C, Wibmer T et al. Erdheim-Chester disease: a rare cause of interstitial lung disease. Med Klin (Munich) 2006; 101(7): 573–576.
67. Protopapadakis C, Antoniou KM, Nicholson AG et al. Erdheim-Chester disease: pulmonary presentation in a case with advanced systemic involvement. Respiration 2009; 77(3): 337–340.
68. Shamburek RD, Brewer HB Jr, Gochuico BR. Erdheim--Chester disease: a rare multisystem histiocytic disorder associated with interstitial lung disease. Am J Med Sci 2001; 321(1): 66–75.
69. Rush WL, Andriko JA, Galateau-Salle F et al. Pulmonary pathology of Erdheim-Chester disease. Mod Pathol 2000; 13(7): 747–754.
70. Vašáková M, Fiala P, Kinkor Z. Erdheim-Chester disease: a case report. Monaldi Arch Chest Dis 2001; 56(2): 115–117.
71. Vaglio A, Corradi D, Maestri R et al. Pericarditis heralding Erdheim-Chester disease. Circulation 2008; 118(14): e511–e512.
72. Serratrice J, Granel B, De Roux C et al. “Coated aorta”: a new sign of Erdheim-Chester diseae. J Rheumatol 2000; 27(6): 1550–1553.
73. Haroche J, Amoura Z, Dion E et al. Cardiovascular involvement, an overlooked feature of Erdheim-Chester disease: report of 6 new cases and a literature review. Medicine (Baltimore) 2004; 83(6): 371–392.
74. Bassou D, El Kharras A, Taoufik AT et al. Cardiac Erdheim-Chester. Intern Med 2009; 48(1): 83–84.
75. Dion E, Graef C, Haroche J et al. Imaging of thoracoabdominal involvement in Erdheim-Chester disease. AJR Am J Roentgenol 2004; 183(5): 1253–1260.
76. Granier M, Micheau A, Serre I. A rare cause of cardiac tumour: an Erdheim-Chester disease with cardiac involvement co-existing with an intracerebral Langerhans cell histiocytosis. Eur Heart J 2008; 29(16): 1929–1935.
77. Loeffler AG, Memoli VA. Myocardial involvement in Erdheim-Chester disease. Arch Pathol Lab Med 2004; 128(6): 682–685.
78. Kudo Y, Iguchi N, Sumiyoshi T et al. Dramatic change of Ga-67 citrate uptake before and after corticosteroid therapy in a case of cardiac histiocytosis (Erdheim-Chester disease). J Nucl Cardiol 2006; 13(6): 867–869.
79. Loddenkemper K, Hoeyr B, Loddenkemper C et al. A case of Erdheim-Chester disease initially mistaken as Ormond’s diseae. Nat Clin Pract Rhematol 2008; 4(1): 50–55.
80. Bangard C, Lotz J, Rosenthal H et al. Erdheim-Chester disease versus multifocal fibrosis and Ormond’s disease: a diagnostic dilemma. Clin Radiol 2004; 59(12): 1136–1141.
81. Murray M, Marshall M, England E et al. Erdheim-Chester disease. Clin Radiol 2001; 56(6): 481–484.
82. Haroche J, Amoura Z, Touraine P et al. Bilateral adrenal infiltration in Erdheim-Chester disease. Report of seven cases and literature review. J Clin Endocrinol Metab 2007; 92(6): 2007–2012.
83. Pickhardt PJ, Bhalla S. Unusual nonneoplastic peritoneal and subperitoneal conditions: CT findings. Radiographics 2005; 25(3): 719–730.
84. Scheer M, Hon M, Fruauff AA et al. Perinephric xanthogranulomatosis: CT diagnosis and confirmation by CT-guided percutaneous biopsy. Clin Imaging 2000; 24(2): 64–67.
85. Surabhi VR, Menias C, Prasad SR et al. Neoplastic and non-neoplastic proliferative disorders of the perirenal space: cross-sectional imaging findings. Radiographics 2008; 28(4): 1005–1017.
86. Colin P, Ballereau C, Lambert M et al. Retroperitoneal infiltration as the first sign of Erdheim-Chester disease. Int J Urol 2008; 15(5): 455–456.
87. Moore FO, Berne JD, Fox AD. Mesenteric panniculitis and Erdheim-Chester disease: xanthogranulomatous diseases confused with malignancy. J Am Coll Surg 2007; 204(2): 326–327.
88. Droupy S, Attias, D, Eschwege P et al. Bilateral hydronefrosis in a patient with Erdheim-Chester disease. J Urol 1999; 162(6): 2084–2085.
89. O’Rourke R, Wong DC, Fleming S et al. Erdheim-Chester disease: a rare cause of acute renal failure. Australas Radiol 2007; 51: B48–B51.
90. Verdalles U, Goicoechea M, García de Vinuesa S et al. Erdheim-Chester disease: a rare cause of renal failure. Nephrol Dial Transplant 2007; 22(6): 1776–1777.
91. Wimpissinger TF, Schernthaner G, Feichtinger H et al. Compression of kidneys in Erdheim-Chester disease of retroperitoneum: open surgical approach. Urology 2005; 65(4): 798.
92. Gupta A, Aman K, Al-Babtain M et al. Multisystem Erdheim-Chester disease; a unique presentation with liver and axial skeletal involvement. Br J Haematol 2007; 138(3): 280.
93. Canbaz F, Dabak N, Baris S et al. Erdheim-Chester disease: 99mTc-MDP bone scan provides the diagnosis. Eur J Nucl Med Mol Imaging 2005; 32(8): 998.
94. Dion E, Graef C, Miquel A et al. Bone involvement in Erdheim-Chester disease: imaging findings including periostitis and partial epiphyseal involvement. Radiology 2006; 238(2): 632–639.
95. Girszyn N, Arnaud L, Villain D et al. Usefulness of combined positron emission tomography and computed tomography imaging in Erdheim-Chester disease. Rev Med Interne 2007; 28(11): 770–774.
96. Hoffmann EM, Müller-Forell W, Pitz S et al. Erdheim--Chester diseae: a case report. Graefes Arch Clin Exp Ophthalmol 2004; 242(9): 803–807.
97. Gottlieb R, Chen A. MR findings of Erdheim-Chester disease. J Comput Assist Tomogr 2002; 26(2): 257–261.
98. Nakahara T, Suzuki T, Uno K et al. 18F-FDG positron emission tomographic imaging in Erdheim-Chester disease with skeletal and extra-skeletal involvement. Leuk Lymphoma 2006; 47(5): 935–937.
99. Namwongprom S, Núñez R, Kim EE et al. Tc-99m MDP bone scintigraphy and positron emission tomography/computed tomography (PET/CT) imaging in Erdheim--Chester disease. Clin Nucl Med 2007; 32(1): 35–38.
100. Blum R, Seymour JF, Hicks RJ. Role of 18FDG-positron emission tomography scanning in the management of histiocytosis. Leuk Lymphoma 2002; 43(11): 2155–2157.
101. Palotás A, Bogáts G, Lázár M et al. Radiopharmaceutical diagnosis of Erdheim-Chester’s disease. Nucl Med Commun 2007; 28(1): 63–65.
102. Spyridonidis TJ, Giannakenas C, Barla P et al. Erdheim-Chester disease: a rare syndrome with a characteristic bone scintigraphy pattern. Ann Nucl Med 2008; 22(4): 323–326.
103. Zanglis A, Valsamaki P, Fountos G. Erdheim-Chester disease: symmetric uptake in the (99m)Tc-MDP bone scan. Hell J Nucl Med 2008; 11(3): 164–167.
104. Kim EE. Romero JA. Erdheim-Chester disease demonstrated with bone radiograph and scans. Clin Imaging 1997; 21(5): 328–331.
105. Koziolek MJ, Kunze E, Müller A et al. Erdheim-Chester disease. Dtsch Med Wochenschr 2005; 130(1–2): 25–28.
106. Arnaud L, Malek Z, Archambaud F et al. 18F-fluorodeoxyglucose-positron emission tomography scanning is more useful in followup than in the initial assessment of patients with Erdheim-Chester disease. Arthritis Rheum 2009; 60(10): 3128–3138.
107. Matsui K, Nagata Y, Hiraoka M. Radiotherapy for Erdheim-Chester disease. Int J Clin Oncol 2007; 12(3): 238–241.
108. Perlat A, Decaux O, Sébillot M et al. Erdheim-Chester disease with predominant mesenteric localization: lack of efficacy of interferon alpha. Joint Bone Spine 2009; 76(3): 315–317.
109. Vanichaniramol N, Kingpetch K, Buranasupkajorn P et al. Erdheim-Chester disease. Intern Med 2008; 47(18): 1633–1634.
110. Ono K, Oshiro M, Uemura K et al. Erdheim-Chester disease: case report with imunohistochemical and biochemical examination. Hum Pathol 1996; 27(1): 91–95.
111. Egan AJ, Boardman LA, Swensen SJ et al. Erdheim--Chester disease: clinical, radiologic and histopathologic findings in five patients with interstitial lung disease. Am J Surg Pathol 1999; 23(1): 17–26.
112. Kim NR, Ko YH, Choe YH et al. Erdheim-Chester disease with extensive marrow necrosis: a case report and literature review. Intern J Surg Pathol 2001; 9(1): 73–79.
113. Busemann C, Kallinich B, Schwesinger G et al. Erdheim-Chester disease with hemophagocytosis. Ann Hematol 2007; 86(11): 847–849.
114. Rao RN, Chang CC, Uysal N et al. Fulminant multisystem non-langerhans cell histiocytic proliferation with hemophagocytosis: a variant form of Erdheim-Chester disease. Arch Pathol Lab Med 2005; 129(2): e39–e43.
115. Lopez P, Estes ML. Immunohistochemical characterization of the histiocytes in sinus histiocytosis with massive lymphadenopathy: analysis of an extraosseal case. Hum Pathol 1989; 20(7): 711–715.
116. Bonetti F, Chilosi M, Menestrina F et al. Immunohistochemical analysis of Rosai-Dorfman histiocytosis. A disease of S-100 + CD1-histiocytes. Virchows Arch A Pathol Anat Histopathol 1987; 411(2): 129–135.
117. Foucar E, Rosai J, Dorfman R. Sinus histiocytosis with massive lymphadenopathy (Rosai-Dorfman disease): review of the entity. Semin Diagn Pathol 1990; 7(1): 19–73.
118. Braiteh F, Boxrud C, Esmaeli B et al. Successful treatment of Erdheim-Chester disease, a non-Langerhans-cell histiocytosis, with interferon-alpha. Blood 2005; 106(9): 2992–2994.
119. Bourke SC, Nicholson AG, Gibson GJ. Erdheim-Chester disease: pulmonary infiltration responding to cyclophosphamide and prednisolone. Thorax 2003; 58(11): 1004–1005.
120. Haroche J, Amoura Z, Trad SG et al. Variability in the efficacy of interferon alpha in Erdheim-Chester disease by patient and site of involfement: results in eight patients. Arthritis Rheum 2006; 54(10): 3330–3336.
121. Esmaeli B, Ahmadi A, Tang R et al. Interferon therapy for orbital infiltration secondary to Erdheim-Chester disease. Am J Ophthalmol 2001; 132(6): 945–947.
122. Myra C, Sloper L, Tighe PJ et al. Treatment of Erdheim-Chester disease with cladribine: a rational approach. Br J Ophthalmol 2004; 88(6): 844–847.
123. Sheidow TG, Nicolle DA, Heathcote JG. Erdheim--Chester disease: two cases of orbital involvement. Eye (Lond) 2000; 14(4): 606–612.
124. Rajendra B, Duncan A, Parslew R et al. Successful treatment of central nervous system juvenila xanthogranulomatosis with cladribine. Pediatr Blood Cancer 2009; 52(3): 423–415.
125. Jendro MC, Zeidler H, Rosenthal H et al. Improvement of Erdheim-Chester disease in two patients by sequential treatment with vinblastine and mycophenolate mofetil. Clin Rheumatol 2004; 23(1): 52–56.
126. Mascalchi M, Nencini P, Nistri M et al. Failure of radiation therapy for brain involvement in Erdheim-Chester disease. J Neurooncol 2002; 59(2): 169–172.
127. Miller RC, Villà S, Kamer S et al. Palliative treatment of Erdheim-Chester disease with radiotherapy: a Rare Cancer Network study. Radiother Oncol 2006; 80(3): 323–326.
128. Haroche J, Amoura Z, Charlotte F et al. Imatinib mesylate for platelet-derived growth factor receptor-beta-positive Erdheim-Chester histiocytosis. Blood 2008; 111(11): 5413–5415.
129. Janku F, Amin HM, Yang D et al. Response of histiocytoses to imatinib mesylate: fire to ashes. J Clin Oncol 2010; 28(31): e633–e636.
130. Boissel N, Wechsler B, Leblond V. Treatment of refractory Erdheim-Chester disease with double autologous hematopoietic stem-cell transplantation. Ann Intern Med 2001; 135(9): 844–845.
131. Silapunt S, Chon SY. Generalized necrobiotic xanthogranuloma successfully treated with lenalidomide. J Drugs Dermatol 2010; 9(3): 273–276.
132. Aouba A, Georgin-Lavialle S, Pagnoux C et al. Rationale for efficacy of interleukin-1 targeting in Erdheim--Chester disease. Blood 2010; 116(20): 4070–4076.
133. Srikulmontree T, Massey HD, Roberts WN. Treatment of skeletal Erdheim-Chester disease with zoledronic acid: case report and proposed mechanisms of action. Rheumatol Int 2007; 27(3): 303–307.
134. Eyigör S, Kirazli Y, Memis A et al. Erdheim-Chester disease: the effect of bisphosphonate treatment – a case report. Arch Phys Med Rehabil 2005; 86(5): 1053–1057.
135. Mossetti G, Rendina D, Numis FG et al. Biochemical markers of bone turnover, serum levels of interleukin-6/interleukin-6 soluble receptor and bisphosphonate treatment in Erdheim-Chester disease. Clin Exp Rheumatol 2003; 21(2): 232–236.
136. Tan IB, Padhy AK, Thng CH et al. Intensely hypermetabolic extra-axial brainstem tumor in Erdheim-Chester disease. Clin Nucl Med 2009; 34(9): 604–607.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2011 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Hsp90 – cíl protinádorové terapie
- Předoperační chemoradioterapie v kombinaci s bevacizumabem u karcinomu konečníku
- Co pacientky potřebují vědět před operací mamárního karcinomu
- Neuroendoskopická biopsie tumoru mozku
- Cetuximab zvyšuje antiproliferativní účinek trastuzumabu u buněk karcinomu prsu s nadměrnou expresí ERBB2 – předběžná studie
- Adaptivní IG-IMRT karcinomu prostaty
- Parciální regrese ložisek Erdheimovy-Chesterovy nemoci v CNS po léčbě 2-chlorodeoxyadenosinem a jejich kompletní vymizení při léčbě lenalidomidem
- Sekundární angiosarkomy po konzervativní léčbě nádorů prsu
- Výsledky terapie metastatického renálního karcinomu lékem everolimus – analýza údajů z klinického registru RENIS
- Zápis ze schůze výboru České onkologické společnosti ČLS JEP konané dne 20. 9. 2011 v Olomouci
- Onkochirurg doc. MUDr. Zdeněk Pačovský, CSc., zemřel
- Recenze
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Parciální regrese ložisek Erdheimovy-Chesterovy nemoci v CNS po léčbě 2-chlorodeoxyadenosinem a jejich kompletní vymizení při léčbě lenalidomidem
- Neuroendoskopická biopsie tumoru mozku
- Sekundární angiosarkomy po konzervativní léčbě nádorů prsu
- Onkochirurg doc. MUDr. Zdeněk Pačovský, CSc., zemřel
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



