-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Epidemiologie, rizikové faktory a možnosti prevence akutních leukemií
Epidemiology, risk factors and possibilities for the prevention of acute leukaemia
Acute leukaemias are malignant diseases of haematopoiesis, traditionally classified according to the affected cell line as acute lymphoblastic and acute myelogenous leukaemia. In terms of incidence, acute leukaemias are rare diseases – in the Czech Republic, only 2–3 new acute myelogenous leukaemia cases/100 000 population are diagnosed annually and less than 1 new case of acute lymphoblastic leukaemia/100 000 residents. The causes of acute leukaemias are still poorly understood. The established risk factors are age, ionizing radiation or Down’s syndrome. Moreover, a number of potential risk factors have been described to play a role in development of acute leukaemias and to multiply the risk, such as physical factors, chemicals, genetic and familial predispositions or other diseases. The presented review summarizes the knowledge of the aetiology of acute leukaemias published since 2000. It describes their epidemiological characteristics and risk factors and outlines the possibilities for their prevention.
Keywords:
acute lymphoblastic leukaemia – acute myelogenous leukaemia – risk factors – prevention
Autoři: S. Zatloukalová 1; K. Azeem 1; M. Čerňan 2; O. Holý 1
Působiště autorů: Ústav veřejného zdravotnictví, Lékařská fakulta, Univerzita Palackého v Olomouci 1; Hemato-onkologická klinika, Fakultní nemocnice Olomouc 2
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 70, 2021, č. 3, s. 208-220
Kategorie: Souhrnné sdělení
Souhrn
Akutní leukemie jsou maligní onemocnění hematopoezy, která se tradičně dělí dle postižené buněčné linie na akutní lymfoblastická (ALL) a akutní myeloidní leukemie. Z pohledu incidence se jedná o vzácná onemocnění – v ČR jsou ročně diagnostikovány 2–3 nové případy akutní myeloidní leukemie na 100 tis. obyvatel a méně než 1 nový případ akutní lymfoblastické leukemie na 100 tis. obyvatel. Příčiny vzniku akutní leukemie jsou pouze málo známé. Prokázanými rizikovými faktory jsou věk, ionizující záření nebo Downův syndrom. Kromě nich byla popsána celá řada dalších vlivů či expozic, které se pravděpodobně uplatňují při rozvoji akutní leukemie a až několikanásobně zvyšují riziko vzniku těchto hematologických malignit. Jedná se např. o fyzikální nebo chemické faktory, genetické a familiární predispozice či další onemocnění. Předkládaná přehledová práce shrnuje poznatky o etiologii akutní leukemie publikované od roku 2000. Popisuje jejich epidemiologické charakteristiky a rizikové faktory, zároveň nastiňuje možnosti prevence.
Klíčová slova:
akutní lymfoblastická leukémie – akutní myeloidní leukemie – rizikové faktory – prevence
ÚVOD
Akutní leukemie (AL) představují heterogenní skupinu maligních onemocnění krvetvorby, jejichž podkladem je maligní transformace hematopoetické kmenové buňky. AL jsou charakterizovány klonální expanzí a akumulací nezralých prekurzorů (blastů) v organismu, zejména v kostní dřeni, s útlakem fyziologické hematopoézy a z toho plynoucích projevů onemocnění [1, 2]. Podle postižené buněčné linie se onemocnění dělí na akutní myeloidní leukemii a akutní lymfoblastickou leukemii.
Akutní myeloidní leukemie (AML) vychází z myeloidní buňky. Jednotlivé typy AML jsou široce heterogenní a k jejich rozlišení se využívají klasifikační systémy (např. FAB z roku 1976 nebo WHO z roku 2016) [2, 3]. Akutní lymfoblastická leukemie (ALL) vychází z progenitoru pro lymfoidní linii nebo z již vyzrálejších lymfoidních buněk. Podle toho, jaké lymfoidní buňky jsou postiženy, se ALL rozděluje na leukemii B lymfoblastickou (B-ALL, postižena je B buněčná vývojová linie) a T lymfoblastickou (T-ALL, postižena je T buněčná vývojová linie) [1, 2]. Vzácným typem AL je akutní leukemie nejasného původu, u níž blasty mají současně imunofenotypové znaky lymfoidní i myeloidní linie. Patří sem akutní leukemie smíšeného fenotypu nebo akutní leukemie nediferencovaná [1].
Přesná příčina vzniku akutních leukemií prozatím není známa. Jednoznačným rizikovým faktorem je věk. U dětí jsou AL (hlavně ALL) v naprosté většině případů de novo onemocnění způsobená novými, nedědičnými aberacemi deoxyribonukleové kyseliny (DNA) v nezralých hematopoetických buňkách [4]. Oproti tomu u AL vznikajících v pozdějším věku (především AML) se uplatňují nejrůznější expozice působící na jednotlivce během jeho života – jedná se především o faktory životního stylu a životního prostředí, infekční agens nebo AML může vzniknout transformací z jiného myeloproliferativního onemocnění nebo myelodysplastického syndromu (MDS) [5, 6].
AKUTNÍ MYELOIDNÍ LEUKEMIE
Epidemiologie
Podle Surveillance, Epidemiology, and End Results Program (SEER) je incidence v USA 4,3/100 tis. obyvatel za rok. Incidence se konstantně zvyšovala od začátku 2. tisíciletí do roku 2012, kdy došlo k jejímu poklesu a tento trend je pozorován doposud. Smrtnost dosahuje 2,8/100 tis. obyvatel, je konstantní od roku 2000 [7]. V roce 2017 v USA žilo 64 512 osob s diagnózou AML. V Evropě je AML nejčastěji diagnostikovaná myeloidní malignita s incidencí 3,7/100 tis. obyvatel (více než 18 tis. případů ročně) [8].
V České republice (ČR) výskyt AML dlouhodobě stoupá, za posledních 20 let se incidence pohybuje mezi 2,0–3,5/100 tis. obyvatel (obr. 1). Každoročně je tak nově AML diagnostikována u několika set osob – např. v roce 2015 to bylo 397 nových onemocnění (při incidenci 3,8/100 tis. obyvatel). Spolu s incidencí narůstá i prevalence AML, kdy ke konci roku 2015 žilo v ČR celkem 1 093 osob s diagnózou AML, což odpovídá 10,4 případům/100 tis. osob [9, 10]. Mortalita vykazuje rovněž vzestupný trend, její nárůst je však méně prudký (viz obr. 1). Mezi kraje s nejvyšším výskytem AML patří kraje Plzeňský (2,9/100 tis. obyvatel), Jihomoravský (2,8/100 tis. obyvatel) a Jihočeský (2,7/100 tis. obyvatel), mortalita je zde rovněž nejvyšší v ČR (2,2–2,4/100 tis. obyvatel). Nejnižší incidence je v krajích Středočeském (1,7/100 tis. obyvatel) a Ústeckém (1,8/100 tis. obyvatel), kde je rovněž nejnižší mortalita (1,4/100 tis. obyvatel) [9, 10]. Zpravidla jsou AML více postižení muži – za rok 2017 byla incidence u mužů 3,0/100 tis. obyvatel a u žen 2,5/100 tis. obyvatel, což odpovídá celosvětovým trendům. Poměr mužů k ženám je udáván 5 : 3 [11, 12].
Obr. 1. Vývoj incidence a mortality akutní myeloidní leukemie v České republice
Zdroj: Ústav zdravotnických informací a statistiky České republiky
Figure 1. Development of incidence and mortality of acute myeloid leukemia in the Czech Republic
Source: Institute of Health Information and Statistics of the Czech Republic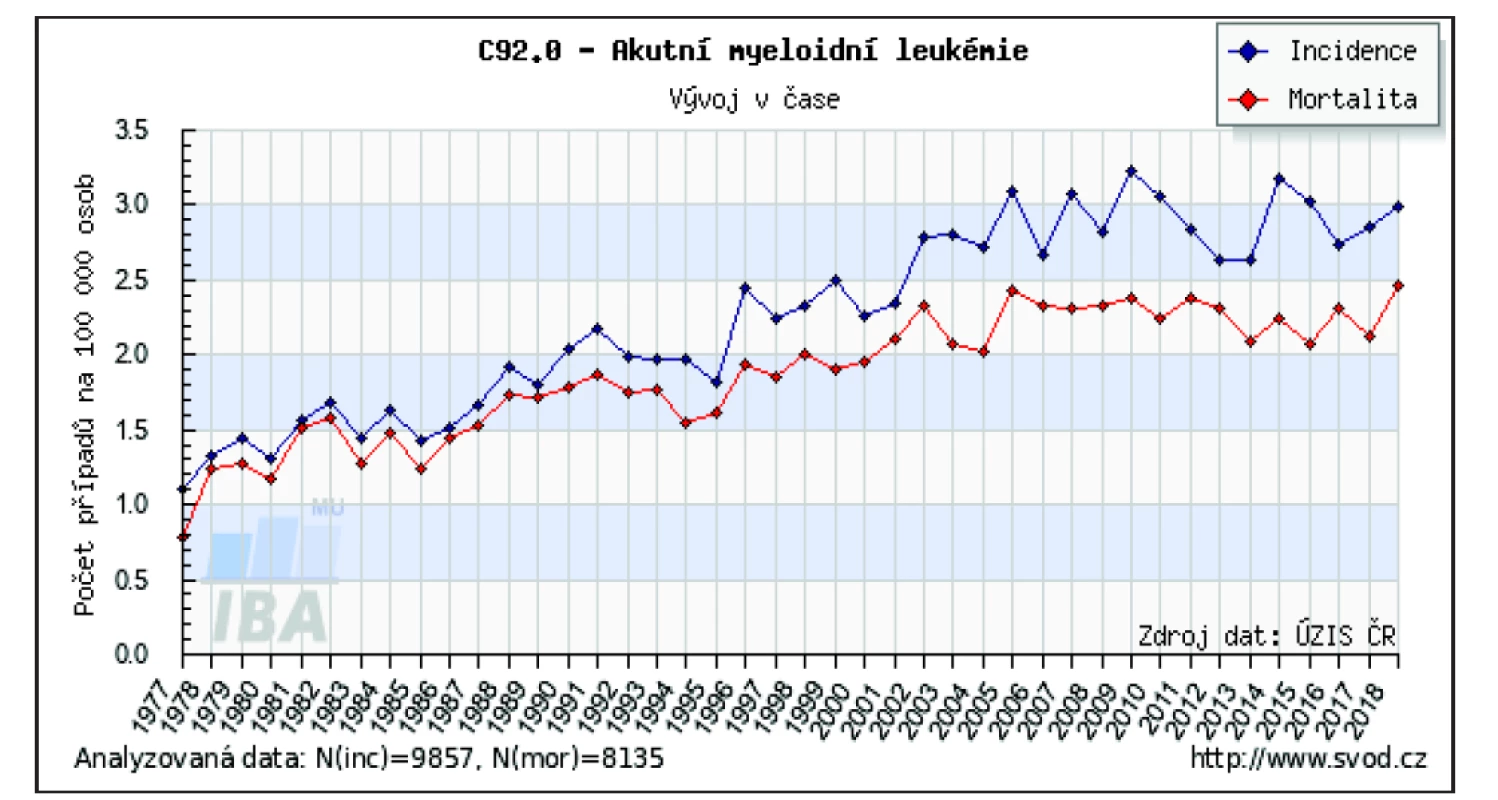
Podle výsledků z databáze DATOOL AML České leukemické skupiny – pro život (The Czech Leukemia Study Group – for Life, CELL) bylo během let 2007–2017 v šesti českých hematoonkologických centrech zaregistrováno 2 171 nemocných s AML, z toho 1 008 (46,4 %) bylo starších 60 let. U těchto pacientů se v 68 % jednalo o de novo onemocnění, zbytek byly sekundární AML, z nichž 63 % vzniklo progresí z MDS nebo myeloproliferativního onemocnění a 29 % jako AML po předchozí protinádorové léčbě (therapy related AML, t-AML) [13].
Rizikové faktory
Věk
AML je primárně onemocnění starších věkových skupin. Incidence AML u dětí se pohybuje mezi 2–3/100 tis. obyvatel, u dětí do 15 let věku AML tvoří jen 15–20 % případů a ročně je v ČR diagnostikováno 10–15 případů [14]. U starších dospělých je průměrná incidence 15/100 tis. obyvatel za rok. Šálek et al. (2012) uvádějí rostoucí incidenci spolu s věkem, a to v 50 letech 3,5/100 tis. obyvatel, v 70 letech již 15/100 tis. obyvatel a v 80 letech 22/100 tis. obyvatel [2]. Medián věku pacientů v době diagnózy AML uvádějí studie mezi 65 a 67 lety, např. ve Velké Británii je necelá polovina pacientů starší 65 let. Výskyt AML před 40. rokem života je spíše vzácností. Nárůst počtu pacientů s AML, který pozorujeme v ČR, je odrazem stárnutí české populace [2, 14, 15].
Genetické a familiární predispozice
Pouze malá část z celkového počtu případů AML vzniká podle současných znalostí na podkladu genetické či familiární predispozice. Jedny z nejvýznamnějších postižených genů jsou např. CEBPA, RUNX1 nebo GATA2, které jsou zodpovědné za regulaci myeloidní diferenciace. Kromě nich se ale uplatňuje celá řada dalších (tab. 1).
Tab. 1. Genetický podklad akutní myeloidní leukemie
Table 1. Genetic basis of acute myeloid leukemia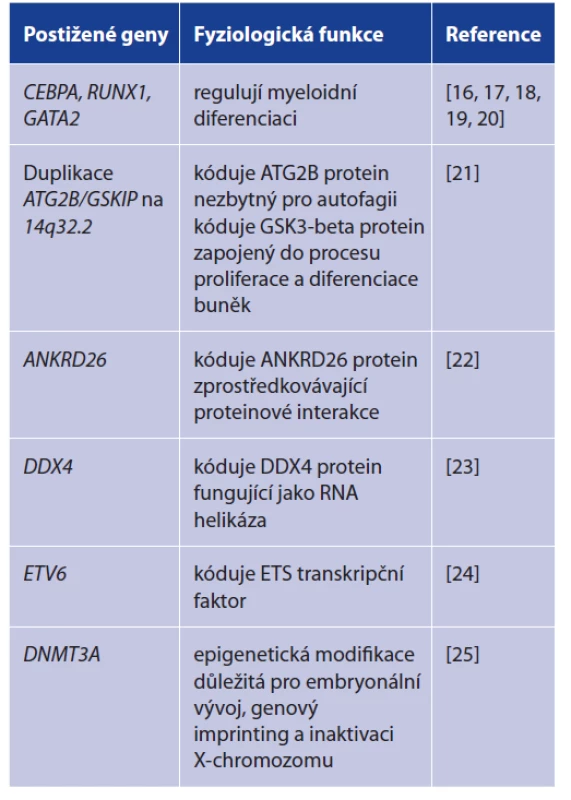
Reprodukční faktory
Výskyt AML je asociován s porodní hmotností dítěte. Vyšší riziko AML bylo pozorováno u dětí s porodní hmotností vyšší než 4 000 g (odds ratio = OR 1,40; 95% interval spolehlivosti = IS 1,11–1,76) a zároveň nižší než 2 500 g (OR 1,50; 95% IS 1,05–2,13), což naznačuje, že křivka vzájemného vztahu je tvaru “U” [26]. Zvýšené riziko vyplývající z vyšší porodní hmotnosti, respektive velikosti plodu bylo dokumentováno i u jiných dětských nádorových onemocnění, např. lymfomů nebo některých nádorů centrální nervové soustavy [27], mechanismus tohoto vztahu zatím nebyl objasněn.
Studie, které analyzovaly vliv věku matky při porodu, ukázaly na až 7násobně zvýšené riziko rozvoje AML u dětí mladších jednoho roku, které se narodily matkám po 40. roku věku (OR 6,87; 95% IS 2,12–22,25). Podobná asociace nebyla prokázána u starších dětí (1–14 let) a pro zvýšený věk otců. Možná vysvětlení tohoto jevu zahrnují vyšší expozici inhibitorům topoizomerázy II ve výživě během těhotenství, de novo mutace spojené s vyšším věkem (např. v MML genu) nebo možné působení léčiv na podporu plodnosti [28].
Expozice rodičů
Expozice pesticidům u matky během těhotenství byla spojena s téměř 2násobně vyšším rizikem rozvoje AML u dítěte (OR 1,94; 95% IS 1,19–3,18) [29]. Bailey et al. (2015) udávají až 1,5krát vyšší riziko vzniku AML při expozici 1–3 měsíce před početím (OR 1,49; 95% IS 1,02–2,16) či během těhotenství (OR 1,55; 95% IS 1,21 až 1,99) [30].
Vliv konzumace alkoholu u matky během těhotenství vykazuje statisticky významnou asociaci v rozmezí OR 1,64–2,36 v závislosti na dávce vypitého alkoholu na den [31].
Expozice matky antibiotikům před a během těhotenství zvyšuje riziko vzniku AML u dítěte více než 3krát (OR 3,20; 95% IS 1,83–5,62), což bylo dokumentováno u 18 exponovaných žen [32]. Studie nicméně pracovala s velmi malým počtem subjektů a neobjasnila, zdali na rozvoj AML měla vliv expozice antibiotikům nebo léčená infekce. K prokázání této asociace je tedy zapotřebí dalšího výzkumu.
Fyzikální faktory
Z fyzikálních faktorů se na vzniku AML podílí ionizující záření, jehož účinek byl popsán již v 90. letech minulého století a které se uplatňuje také při vzniku solidních tumorů. Záření má akutní i dlouhodobé účinky na hematopoézu a leukémie obecně se po ozáření objevují dříve než jakékoli jiné malignity [33, 34]. Například při expozici rentgenovému záření dávkou 1 Gy bylo pozorováno vyšší riziko vzniku AL v horizontu do 10 let po této expozici [34]. Kumulativní dávka ionizujícího záření nižší než < 100 mSv v dětství nebo v období dospívání zvyšuje riziko vzniku AML 2,5násobně (relativní riziko = RR 2,56; 95% IS 1,09–5,06) [33].
Důkazy o asociaci vzniku AML a expozici radonu jsou stále nedostatečné. Ačkoliv francouzská studie v roce 2006 prokázala zvýšení rizika vzniku AML u dětí po zvýšené expozici radonu v obytných prostorách, kdy v departmentech (francouzských správních celcích) s nejvyšší expozicí bylo toto riziko vyšší až o 20 % [35], při opakování studie toto zvýšené riziko již pozorováno nebylo [36].
Specifická je postterapeutická nebo také sekundární AML (t-AML), jejíž vznik je pozorován u pacientů, kteří podstupují celotělové ozáření v rámci přípravy na transplantaci nebo radioterapii (dávka 1–15 Gy) rakoviny prsu, non-Hodgkinova lymfomu, rakoviny varlat, děložního čípku aj. Rozvoj t-AML je pozorován 5–15 let od expozice, riziko je v těchto případech dvojnásobné oproti neexponovaným nemocným [5, 37]. Jelikož primární malignitou bývá nejčastěji rakovina prsu následovaná non-Hodgkinovým lymfomem, t-AML bývá dokumentována častěji u žen. Až u 35 % případů t-AML jsou pozorovány mutace TP53, tumor-supresorového genu kódujícího protein a transkripční faktor p53. Léčba těchto t-AML je náročná a většinou nepřináší dobrou odpověď na užitou terapii [38].
Chemické faktory
Řada studií potvrdila vztah mezi expozicí chemickým noxám a rozvojem AML. Jedná se například o pesticidy, především u farmářů nebo pracovníků v zemědělství [5]. Podle klasifikace Mezinárodní agentury pro výzkum rakoviny (IARC) je prozatím známo více než 20 pravděpodobných nebo podezřelých humánních karcinogenů z řad pesticidů [39]. Zemědělské expozice jsou častěji dokumentovány u osob s nižším vzděláním nebo nižšími příjmy [40].
Mezi pracovními expozicemi významně zvyšujícími riziko AML vynikají především benzen (OR 2,10; 95% IS 1,35–3,28), hnojiva (OR 2,77; 95% IS 1,30–5,93), saze či mour (OR 2,68; 95% IS 1,57–4,57), kreosot (OR 2,83; 95% IS 1,46–5,47), vinylchlorid (OR 2,81; 95% IS 1,14 až 6,92) nebo uhelný prach (OR 4,03; 95% IS 1,79–9,06) [40]. Většina těchto látek patří mezi prokázané nebo pravděpodobné lidské karcinogeny. Až 4násobné riziko vzniku AML bylo dlouhodobě (po dobu až 15 let od expozice) pozorováno u osob, které byly vystaveny dioxinům (konkrétně 2,3,7,8-tetrachlordibenzodioxinu = TCDD, což je vedlejší produkt výroby herbicidů), a to při havárii v italském městě Serveso (RR 3,8; 95% IS 1,2–12,5) [41].
U dospělých je podíl benzenu na vzniku AML prokázán, a to nejčastěji jako profesní expozice u dělníků v nejrůznějších odvětvích průmyslu [5]. U dětí je jeho role prozatím nejasná. Francouzská studie zaznamenala zvýšený výskyt AML u dětí ve spojitosti s vyšší expozicí benzenu pocházejícího z koncentrované dopravy v blízkosti bydliště dítěte. Při lokalizaci tohoto zdroje ve vzdálenosti do 150 m od místa bydliště je OR 1,2 (95% IS 1,0–1,4) a tato zjištění ukazují na potenciální roli benzenu ve vzniku AML u dětí [42]. Podobná zjištění přinesla i studie v Oklahomě, kdy bylo vyšší riziko vzniku AML pozorováno u dětí, které byly brzy po narození exponovány benzenu z dopravy v koncentracích 0,67 až 0,91 μg/m3 (OR 3,15; 95% IS 1,22–8,13), respektive vyšším než 0,91–2,03 μg/m3 (OR 3,53; 95% IS 1,35–9,27). Autoři sice připouštějí, že koncentrovaná doprava je zdrojem velkého množství nejrůznějších látek a že benzen může být pouze jednou z těch škodlivých (jako další jsou uvažovány např. částice PM10 [43]) či pouze jejich markerem [44], na druhou stranu je pravděpodobné, že benzen v prostředí přispívá ke vzniku mnoha de novo AML, které nevznikají na základě genetických predispozic [45].
Některé publikace naznačovaly vliv formaldehydu na vznik AML [46]. Podle review Allegra et al. (2019) expozice formaldehydu (ačkoliv byla prokázána kauzalita v případě rakoviny nosohltanu nebo lymfomů) nepředstavuje vyšší riziko pro vznik AML [47]. Důkazy jsou v tomto ohledu ale stále nedostatečné.
U expozice aromatickým rozpouštědlům bylo pozorováno více než 2,5násobné riziko vzniku AML (OR 2,54; 95% IS 1,19–5,42), kauzální vztah prozatím nebyl přesně objasněn [48].
U t-AML je její vznik asociován (kromě záření) s dalšími látkami používanými v rámci cytotoxické terapie, např. alkylujícími látkami, inhibitory topoizomerázy či antimetabolity. Po expozici alkylujícím látkám dochází k poškození 5. a/nebo 7. chromozomu. Leukemii předchází rozvoj MDS, období latence je průměrně 5 let a prognóza nepříznivá (medián přežití je pouhých 8 měsíců). Tato forma postihuje kolem 70 % pacientů s t-AML [49]. Expozice inhibitorům topoizomerázy II vede k rozvoji t-AML, u níž jsou často pozorovány translokace genů KMTA2A (11q23.3) nebo RUNX1 (21q22.1), které jsou klíčové pro hematopoézu. Období latence je v těchto případech kratší, v rozmezí 1–2 let, a prognóza výrazně lepší, protože onemocnění velice dobře reaguje na intenzivní indukční cyklus léčby [49].
Faktory životního stylu
Zvýšené riziko vzniku AML je spojeno s kouřením tabáku. Během kouření jsou kuřáci exponováni benzenu, formaldehydu a více než 50 dalším karcinogenům, jejichž seznam se průběžně rozrůstá. Riziko se zvyšuje s počtem denně vykouřených cigaret a s počtem let, kdy jedinec kouřil více než krabičku cigaret denně (tzv. pack-year) [50, 51]. Japonská studie ukázala poměr rizik (hazard ratio) HR 1,66 (95% IS 1,06–2,63) u kuřáků (více než 30 pack-years) oproti nekuřákům [52]. Bývalí kuřáci nemají oproti aktuálně kouřícím osobám nižší riziko vzniku AML – OR 1,43 (95% IS 1,11–1,84) oproti 1,56 (95% IS 1,12–2,16) [40]. Oproti kouření vliv konzumace alkoholu na rozvoj AML v pozdějším věku nebyl prokázán [5].
Výživa hraje významnou roli v etiologii vybraných solidních nádorů, její vliv u AML je však pouze marginální. Několik studií upozornilo na možnou souvislost vzniku AML s výživou. Zvýšené riziko bylo spojeno s konzumací červeného masa [53] a naopak klesalo se zvýšeným denním příjmem ovoce a zeleniny [54]. Byla prokázána pozitivní asociace mezi vznikem AML a hodnotou Body Mass Indexu (BMI) vyšší než 25 kg/m2 (RR 1,52; 95% IS 1,19–1,95). Předpokládaným, nicméně prozatím nepotvrzeným mechanismem je aktivace JAK/STAT signální dráhy [55]. Hosnijeh et al. (2013) tuto asociaci popisují především u žen, a to ve spojitosti s BMI v rozmezí 24,97–28,23 kg/m2 (RR 2,17; 95% IS 1,05–4,48) [56].
Infekční agens
Vztah mezi vybranými infekčními agens byl pozorován u solidních tumorů. U AML byl prokázán vztah u infekce lidským virem imunitní nedostatečnosti (HIV), kdy pacienti s rozvinutým syndromem získaného selhání imunity AIDS (Acquired Immune Deficiency syndrome = AIDS) onemocněli AML 2,5krát častěji než zdraví jedinci. Důvody, proč tomu tak je, jsou zatím neznámé. Mimo AML studie identifikovala dalších 15 typů nádorů, které se významně častěji vyskytovaly u pacientů s AIDS [57].
Další onemocnění
Kromě všech výše zmíněných faktorů je riziko výskytu AML vyšší u pacientů s některými již přítomnými onemocněními či syndromy. Tato tzv. sekundární AML se významně častěji rozvíjí u pacientů s hematologickými onemocněními, jako je např. myelodysplastický syndrom. Zdali dojde, či nedojde k přechodu do AML, je dáno jednak samotným typem MDS, cytogenetikou, procentem blastů v kostní dřeni aj. Tyto parametry jsou zahrnuty ve skórovacích systémech, např. Mezinárodním prognostickém indexu (IPSS) nebo prognostickém skórovacím indexu založeném na WHO klasifikaci (WPSS) [58]. Mezi další pak patří myeloproliferativní onemocnění, např. esenciální trombocytemie [59], nebo aplastická anemie [60]. Zvýšené riziko sekundární AML je rovněž pozorováno u pacientů se syndromy selhání kostní dřeně, jako jsou dyskeratosis congenita [61], Fanconiho anemie [62] nebo Schwachmanův-Diamondův syndrom [63]. Jedná o vzácné diagnózy s velice nízkým výskytem, proto podíl těchto sekundárních leukemií není výrazně vysoký.
AML pozorujeme častěji také u různých genetických abnormalit, z nichž nejvýznamnější je Downův syndrom (DS). Více jsou ohroženy děti – Starý et al. (2010) uvádějí 15–20krát vyšší výskyt u dětí než u dospělých s DS, AML onemocní do 2 % dětí s DS. Rozvoji AL předchází v prvních 5 letech života transientní myeloproliferativní reakce, která postihuje kolem 10 % dětí s DS. Až u třetiny z nich se v horizontu 1–3 let následně vyvíjí jinak poměrně vzácná akutní megakaryocytární leukemie. AML u dětí s DS má svůj původ v somatické mutaci genu pro transkripční faktor GATA1 [64].
AKUTNÍ LYMFOBLASTICKÁ LEUKEMIE
Epidemiologie
Podle SEER je roční incidence ALL v USA 1,7/100 tis. obyvatel, dlouhodobě se mírně zvyšuje. Mortalita dosahuje 0,4/100 tis. obyvatel za rok, oproti incidenci je dlouhodobě konstantní [65]. V Evropě je incidence ALL a lymfoblastického lymfomu odhadována na 1,28/100 tis. ročně [66].
ALL postihuje převážně bělošskou dětskou populaci a hispánské etnikum [67]. Ve srovnání s bělošskou populací (3,6/100 tis. obyvatel) je incidence ALL u černošských dětí méně než poloviční (1,5/100 tis. obyvatel). U ras se liší nejenom incidence, ale také zastoupení subtypů ALL [68]. t-ALL postihuje především černošské děti, oproti bělošským se u nich vyskytuje 1,7násobně častěji [69]. Důvody, proč tomu tak je, jsou zatím neznámé; diskutuje se o vlivu rasově specifických genetických predispozic. Ty ovlivňují nejen incidenci, ale zároveň také účinnost a výsledky léčby, které jsou u hispánských a černošských dětí výrazně horší a jsou často doprovázeny relapsy [68]. Bylo dokumentováno, že u hispánských dětí se častěji vyskytuje nová forma ALL, tzv. Ph (Philadelphia)-like ALL, jejíž transkripční profil je podobný jako u ALL s pozitivním Ph chromozomem. U tohoto typu je až v 50 % případů exprimován gen CRLF2, přičemž u této kombinace, která je významně častěji hlášena u hispánských dětí (35,3 %; ve srovnání se 7,1 % u nehispánských) byla pozorována asociace s výrazně horší prognózou [70]. Stejně tak byly u Ph-like ALL dokumentovány varianty GATA3 genu, které jsou spojené s častým výskytem relapsů [71].
V ČR je u ALL pozorován dlouhodobě setrvalý, za posledních 20 let mírně klesající trend v incidenci i mortalitě. V roce 2015 bylo v ČR nově diagnostikováno 75 nemocných, což je 0,71/100 tis. osob. Prevalence naopak roste – ke konci roku 2015 žilo v ČR 1 570 osob s tímto onemocněním, což je 14,9/100 tis. osob [12]. V roce 2017 byla v ČR incidence ALL 0,7/100 tis. obyvatel a mortalita 0,41/100 tis. obyvatel. Pokles mortality je z dlouhodobého hlediska citelnější než pokles incidence (obr. 2).
Obr. 2. Vývoj incidence a mortality akutní lymfoblastické leukemie v České republice
Zdroj: Ústav zdravotnických informací a statistiky České republiky
Figure 2. Development of incidence and mortality of acute lymphoblastic leukemia in the Czech Republic
Source: Institute of Health Information and Statistics of the Czech Republic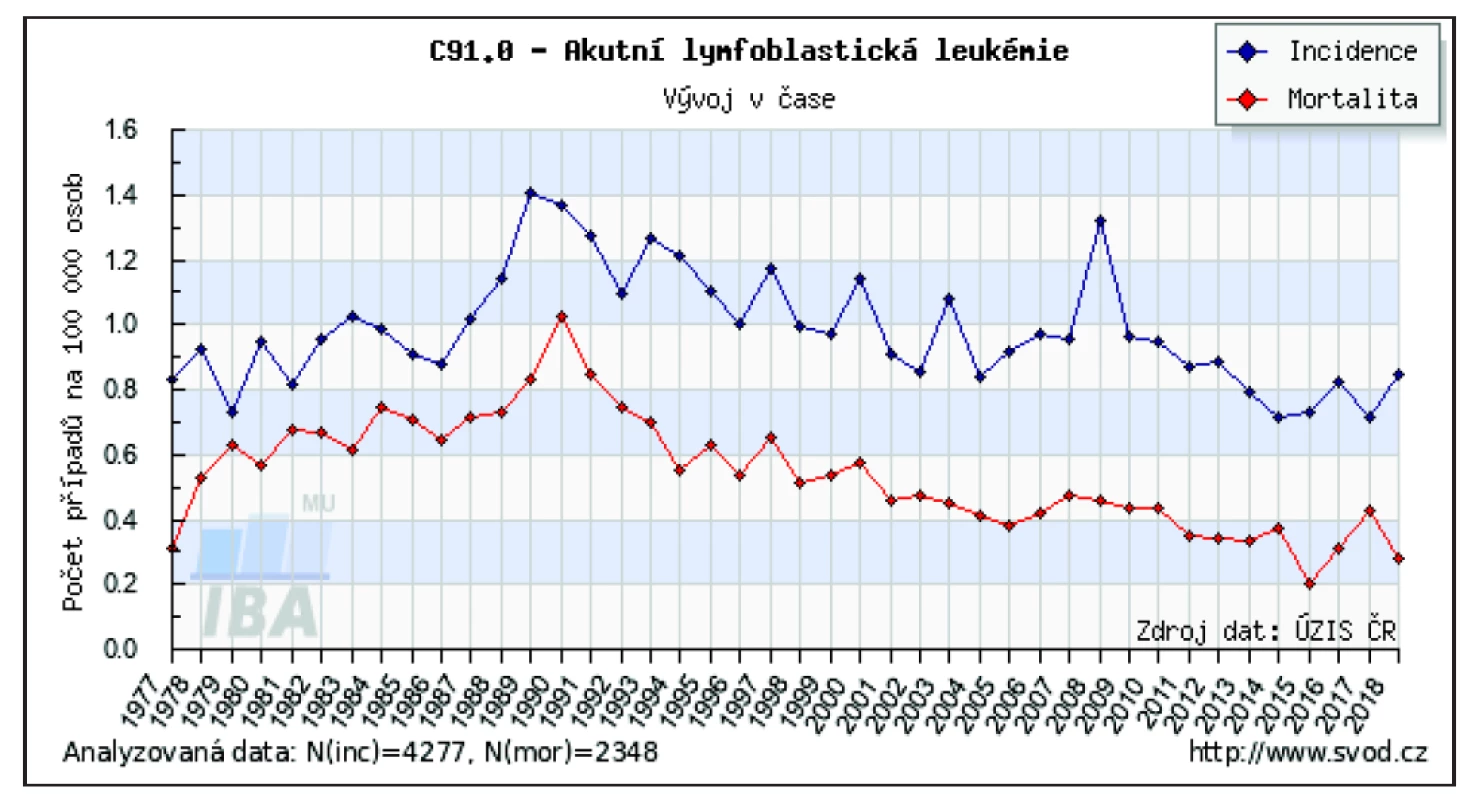
Stejně jako u AML i ALL postihuje dlouhodobě více muže než ženy, a to v poměru 1,5–1,9 : 1 [72]. Nejvyšší incidence je v ČR v Olomouckém (1,17/100 tis. obyvatel) a Moravskoslezském kraji (1,14/100 tis. obyvatel), mortalita je nejvyšší v Plzeňském a Olomouckém kraji (0,62–0,64/100 tis. obyvatel) [73].
Rizikové faktory
Věk
ALL je nejčastější onkologickou diagnózou u dětí do 15 let věku. ALL je u těchto dětí asi 5x častější než AML a tvoří kolem tří čtvrtin všech leukémií u dětské populace [14]. Incidence je 7,7/100 tis. obyvatel ve věkové skupině 1–5 let (s maximem mezi 2. a 5. rokem). U adolescentů a mladých dospělých její výskyt prudce klesá a exponenciální nárůst u starších věkových kategorií jako u AML pozorován není. U dospělé populace se roční incidence dlouhodobě pohybuje mezi 1,2–1,6/100 tis. obyvatel a představuje tak jen 1 % nádorových onemocnění dospělých a cca 20 % všech akutních leukemií [2, 15]. U dětí jsou rizikové faktory ALL výrazně lépe popsány ve srovnání s dospělými [66].
Genetické a familiární predispozice
V naprosté většině případů vznikají ALL, a to hlavně u dětí, de novo. Jejich podkladem jsou nedědičné aberace DNA v nezralých hematopoetických buňkách (tab. 2).
Tab. 2. Genetický podklad akutní lymfoblastické leukemie
Table 2. Genetic basis of acute lymphoblastic leukemia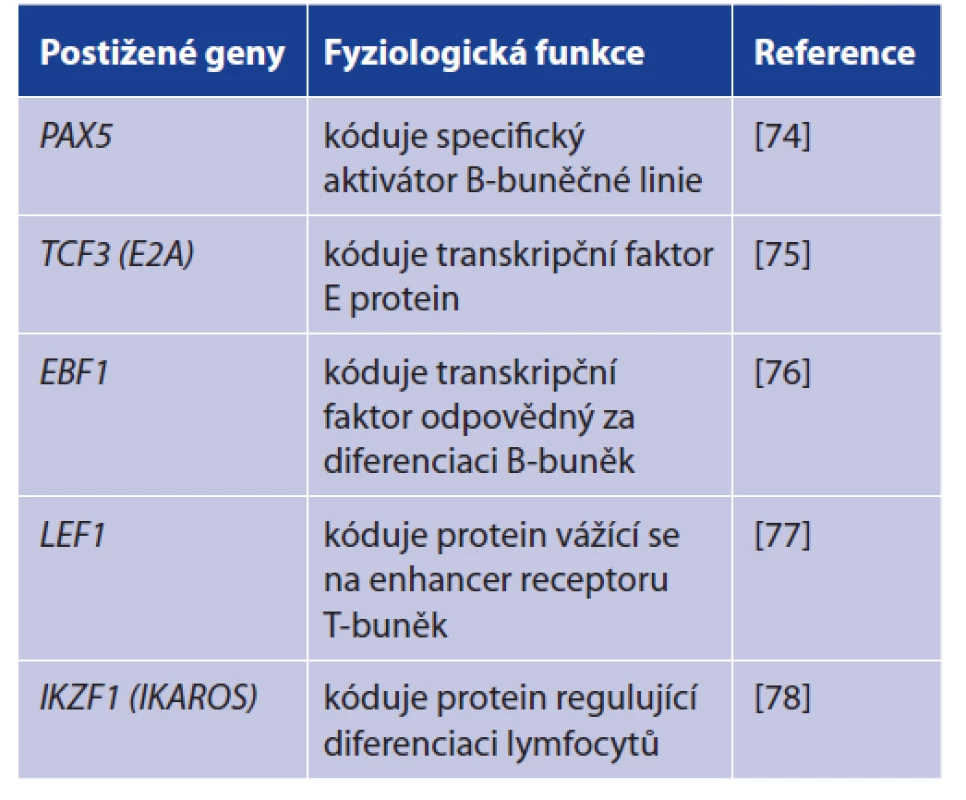
Reprodukční faktory
V rozvoji ALL se významně uplatňuje celá škála reprodukčních faktorů.
Z pohledu matky je důležitý věk a průběh předchozích těhotenství. U dětí matek starších 35 let bylo pozorováno zvýšené riziko vzniku ALL (RR 1,10; 95% IS 1,00 až 1,21). S vyšším věkem matky roste i riziko vzniku ALL u dítěte (RR 1,05; 95% IS 1,01–1,10 s každými 5 lety), tento přírůstek byl dokumentován především v Evropě (RR 1,09; 95 % IS 1,03–1,14). V zemích Severní a Latinské Ameriky bylo pozorováno zvýšené riziko u matek starších 35 let, a to až 1,5krát (RR 1,43; 95% IS 1,19–1,73), respektive téměř 4krát (RR 3,72; 95% IS 1,13–12,27) [79]. Vysoké riziko ze zemí Latinské Ameriky může souviset s převahou hispánského etnika v těchto zemích (viz výše). U dětí matek, které prodělaly potrat, nebo se jim narodilo mrtvé dítě, bylo dokumentováno souhrnné OR 1,12 (95% IS 1,05–1,18), u prodělaného potratu pak OR 2,34 (95% IS 1,19–4,60) a OR 1,33 (95% IS 1,02–1,74) u narozeného mrtvého dítěte [80].
Z pohledu otce je rizikovým faktorem jeho věk. Metaanalýza prokázala, že riziko vzniku ALL se zvyšuje o 4 % za každých 5 let odloženého rodičovství [81].
Vyšší riziko ALL bylo asociováno se způsobem porodu. Zvýšené riziko vzniku ALL bylo dokumentováno u dětí, které se narodily císařským řezem (OR 1,23; 95% IS 1,04–1,47). Možným vysvětlením by mohla být nepřítomnost stresové reakce u těchto dětí a následná maladaptivní imunitní aktivace [82, 83]. Kromě způsobu porodu je důležitá i porodní hmotnost. V řecké studii se jednalo o více než 3 500 g (OR 2,27; 95% IS 1,27–4,04 pro vznik dětské leukemie bez ohledu na typ) [84], v metaanalýze Caugheye et al. (2009) více než 4 000 g (OR 1,23; 95% IS 1,15–1,32 pro vznik pouze ALL) [26]. Oba faktory pravděpodobně mají souvislost, neboť právě vysoká porodní hmotnost dítěte je významnou a častou indikací k provedení císařského řezu [85].
Faktory rodičů
Samostatné studie, které měly za cíl objasnit vliv kouření tabáku rodičů (především otců) na vznik ALL u dětí, většinou asociaci neprokázaly a zahrnovaly málo subjektů. Metaanalýza těchto studií prokázala, pozitivní asociaci mezi kouřením otce v době početí s OR 1,15 (95% IS 1,06–1,68), respektive 1,44 (95% IS 1,2–1,68) při kouření 20 a více cigaret denně ve stejné době [86]. Tabákový kouř obsahuje několik desítek karcinogenních látek, z nichž např. benzen je u kuřáků prokazatelně leukemogenní [87] a biologická plauzibilita byla dokumentována mnoha studiemi [86, 88].
Expozice pesticidům u otce v době početí byla prokázána jako riziková pro vznik ALL u dítěte (OR 1,20; 95% IS 1,06–1,38). ALL byla v těchto případech diagnostikována v 5. roce věku dítěte či později a nejčastěji se jednalo o ALL vycházející z T buněk [29]. Bailey et al. (2015) dokumentuje kromě škodlivého vlivu expozice otce v rozmezí 1–3 měsíce před početím (OR 1,39; 95% IS 1,25–1,55) rovněž zvýšené riziko vzniku ALL při expozici matky. Při používání pesticidů v rámci domácnosti během těhotenství je OR 1,43 (95% IS 1,32–1,54) a v období krátce po narození je OR 1,36 (95% IS 1,23 až 1,51). Nejzávažnější jsou podle studie insekticidy a fungicidy užívané pro postřik rostlin a stromů, především působí-li na organismus otce krátce před početím (OR 1,49; 95% 1,14–1,95) [30].
Vystavení se barvám, hlavně olejovým, které obsahují velké množství substancí (i potenciálně karcinogenních), zvyšuje riziko vzniku ALL (OR v rozmezí 1,14–1,54, v závislosti na typu a složení použité barvy). Studie Bailey et al. (2015) zjistila nejvyšší riziko při expozici otce v době 1–3 měsíce před početím (OR 1,54; 95 % IS 1,28–1,85), a to především pro vznik B-ALL (OR 1,52; 95 % IS 1,25–1,86) [89]. Sceló et al. (2009) zjistili OR 1,65 (95 % IS 1,26–2,15) a také udávají závažnější expozici po narození (OR 1,39; 95 % IS 1,07–1,81) než v době početí. S podivem ale studie neprokázala negativní dopad expozice aromatickým rozpouštědlům na vznik AML [48].
Významným faktorem je cytomegalovirová (CMV) infekce matky během těhotenství, která zvyšuje riziko rozvoje ALL u dítěte 3,7krát (OR 3,71; 95% IS 1,71–8,95). U hispánských dětí je toto riziko ještě vyšší, skoro 6násobné (OR 5,9; 95% IS 1,9–26,0), a naopak u bělošské více než 2násobné, ale výsledky nebyly statisticky významné (OR 2,10; 95% IS 0,69–7,31). Teratogenní efekt CMV je vysvětlován jednak chromozomální nestabilitou u pacientů s vrozenou CMV infekcí a jednak pravděpodobnou schopností viru negativně ovlivnit imunitní systém hostitele. Tomu nasvědčuje i rozsáhlost genomu CMV a prozatím nevysvětlené funkce mnoha jeho genů. Přesný mechanismus však zůstává neznámý [90].
Vlivem výživy matky během těhotenství na vznik ALL se zabývaly především retrospektivní studie, které poukázaly na riziko zvýšené konzumace cukrů (OR 1,32; 95% IS 1,05–1,67), masa či masných výrobků (OR 1,25; 95% IS 1,0–1,57) [91] nebo denní příjem vitaminu B6 vyšší než 1,85 mg (OR 1,6; 95% IS 1,02–2,51). Naopak snížený příjem vitaminu B6 v rozmezí 1,39–1,85 mg vedl k OR v rozsahu hodnot 1,04–1,28, výsledky ale nebyly statisticky významné [92]. Důkazy o riziku vyplývajícího z pití kávy jsou prozatím nejednoznačné. Studie Karalexiho et al. (2019) dokumentovala OR 1,40 (95% IS 1,03–1,92) při konzumaci více než jednoho šálku denně [93], naopak Alicandro et al. (2017) riziko ve spojitosti s konzumací kávy neudávají [94]. Autoři obou studií připouštějí možný vliv kouření jako známého „confounding” faktoru a jeho častého zatajování. Vliv konzumace alkoholu u matky během těhotenství na vznik ALL prokázán nebyl [67].
Vliv užívání antibiotik před těhotenstvím a během něj je stejně jako u AML prozatím nejasný. V německé studii, zahrnující 59 exponovaných žen, bylo zjištěno OR 1,47 (95% IS 1,06–2,04) [32], naopak dánská studie podobný vztah neprokázala [95]. Stejně jako u AML i tyto studie narážely na malý počet studovaných subjektů a nerozlišily vliv antibiotik od vlivu léčené infekce.
Fyzikální faktory
Vliv rentgenového záření využívaného ve výpočetní tomografii (CT) je prozatím nejasný. Finská studie Nikillä et al. (2018) uvádí téměř 3násobně vyšší riziko vzniku ALL po 1 a více CT vyšetření v dětství (OR 2,82; 95% IS 1,05–7,56) a navýšení OR o 0,13 (95% IS 0,02 až 0,26) s každým navýšením dávky o 1 mGy. Autoři sami upozorňují na limitace studie, především na nekompletnost starších dat, zahrnutí údajů pouze z omezeného počtu zdravotnických zařízení, možnost náhodné chyby aj. [96].
Působení elektromagnetického pole na rozvoj leukemie u dětí je předmětem diskusí, zejména v souvislosti s významným rozšířením bezdrátových sítí, telefonních antén či televizního i rozhlasového vysílání. Důkazy jsou prozatím nejednoznačné – ačkoliv bylo neionizující elektromagnetické pole zařazeno IARC v roce 2002 mezi možné karcinogeny (skupina 2B), výsledky jednotlivých studií provedené poté v Severní Americe a Evropě a následné metaanalýzy [97, 98, 99, 100] poskytují pouze slabé důkazy a biologická plauzibilita zůstává neobjasněna.
Chemické faktory
Studie případů a kontrol z Dánska nalezla statisticky významný vztah mezi kumulativní expozicí radonu a vznikem ALL u dětí. Při expozici vyšší než 0,89x103 Bq/m3/rok je OR 1,63 (95% IS 1,05–2,53) [101]. Bez zajímavosti není ani fakt, že více než polovina obcí na území Dánska přitom podle měření radonu v obytných prostorách spadá do kategorie 3, kdy byla ve 3–10 % obytných prostor naměřena hodnota přes 200 Bq/m3, a zhruba 10 % obcí spadá do kategorie 4, kdy jsou tyto hodnoty naměřeny v 10–30 % obytných prostor [102]. Také incidence ALL v Dánsku se dlouhodobě zvyšuje [103]. Stejnou asociaci ale neprokázaly jiné evropské studie, např. ve Švýcarsku [104] nebo v Norsku [105]. V ČR, kde je výskyt radonu v obytných prostorech velice častý, podobná studie prozatím neprobíhala.
Riziková může být rovněž expozice dětského organismu látkám v usazeném prachu v domácnosti. Studie probíhaly v severní a střední Kalifornii a hodnotily účinky polycyklických aromatických uhlovodíků (PAU) a polychlorovaných bifenylů (PCB), které jsou známé svými významnými karcinogenními účinky, schopností perzistence v prostředí a akumulací v lidském organismu. Studie Deziel et al. (2014) pozorovala vyšší obsah PAU v prachu v domácnostech s dětmi, u nichž se objevila ALL. Jednalo se především o indeno[1,2,3-cd] pyren (OR 1,81; 95% IS 1,04–3,16) a dibenzo[a,h]antracen (OR 1,98; 95% IS 1,04–3,16). Vyšší koncentrace byly pozorovány i u dalších PAU, jak jsou benzo[a]pyren (OR 1,42; 95% IS 0,96–2,12) a benzo[k]fluoranten (OR 1,71; 95% IS 0,91–3,22), výsledky nicméně nebyly statisticky významné. Studie navíc nehodnotila jiné možnosti expozice PAU, např. v potravinách či ovzduší [106]. Ward et al. (2009) pak udávají až 2násobné riziko vzniku ALL při vystavení dítěte prachu s obsahem jakéhokoli PCB (OR 1,97; 95% IS 1,22–3,17). Zdrojem PCB je nejčastěji vnitřní prostředí, kde perzistují i po velice dlouhou dobu, např. v kobercích či rohožích, v nichž se kumulují [107].
Infekční agens
V současnosti je hojně diskutována Greavesova teorie opožděné expozice, která byla publikovaná již v 80. letech minulého století. Greaves tvrdí, že časná vystavení se běžným dětským infekčním agens mohou vést ke snížení rizika vzniku ALL, především z prekurzorových B lymfocytů, která má vrchol incidence ve věku mezi druhým a šestým rokem života [108, 109]. Vystavení se těmto agens v pozdějším věku vyvolává intenzivnější odpověď imunitního systému, během níž mohou proliferativní buňky získat mutaci vedoucí ke vzniku leukemie [109]. Platnost této teorie nebyla jistě prokázána. Jsou publikovány studie, které ji podporují – uvádějí např. nákazu parvovirem B19 [110], chřipkou [111] či enteroviry [112] nebo pravidelný kontakt se zvířaty a jejich mikroflórou v raném dětském věku [113]. Stejně tak jsou publikovány i studie, které tuto teorii spíš vyvracejí [114, 115, 116, 117]. Pro jednoznačné potvrzení či vyvrácení Greavesovy teorie je tedy zapotřebí dalšího výzkumu vlivu infekcí na rozvíjející se imunitní systém a jejich možného dopadu.
PREVENCE AKUTNÍCH LEUKEMIÍ
Vysoká heterogenita AL, jejich nízká incidence a zároveň současná úroveň poznání etiologie těchto onemocnění nabízí pro prevenci pouze omezené možnosti. Rizikových faktorů, u nichž byl etiologický vztah potvrzen, je známo pouze málo a zahrnují, např. věk, Downův syndrom nebo ionizující záření [118]. Oproti tomu o vztahu podezřelých rizikových faktorů (např. některé expozice z životního a pracovního prostředí, fyzikální nebo chemické faktory či karcinogeny) k rozvoji AL existují pouze omezené důkazy střední či nízké kvality. Jsou ověřovány především v retrospektivních studiích, které jsou významně ovlivněny recall bias nebo pracují s nedostatečnými počty subjektů. Samostatnými studiemi se závislost mezi rizikovými faktory a leukemií často nepodařilo prokázat, popř. výsledky nebyly statisticky významné, a bylo zapotřebí provedení až velkých metaanalýz.
Odhaduje se, že dosavadní vědomosti o rizikových faktorech AL objasňují vznik pouze cca 15–20 % případů onemocnění [6]. Primárně je tedy nezbytné provádět další výzkumy a studie, které budou mít za cíle:
1. identifikovat nové potenciální rizikové faktory pro vznik AL;
2. vysvětlit biologickou plauzibilitu mezi těmito rizikovými faktory a vzniklými onemocněními;
3. na základě objasnění etiologie a patogeneze leukemií přinášet další potenciální možnosti prevence jejich rozvoje.
I přes tato úskalí může být aktuálně výhodné působit alespoň na ty faktory, které ovlivnit lze.
Ke snížení rizika vzniku dětských leukemií mohou přispět sami rodiče např. neoddalováním těhotenství do vyššího věku. Odsouvání gravidity do pozdějšího věku je v současné době rozšířený trend. Zásadně se průměrný věk prvorodiček proměnil za posledních 20 let. Zatímco ještě na počátku 90. let to bylo před dosažením 25 let, již v roce 2018 to bylo 28,4 let [119]. Oddalování zakládání rodiny a těhotenství v pozdním věku (jak u otce, tak u matky) bylo navíc spojeno s výskytem dalších onemocnění, např. poruch autistického spektra [120], chromozomálních abnormalit, především Downova syndromu [121] a dalších onemocnění. Důležité je v tomto ohledu vytvoření podmínek ze strany státu, a tím i motivace pro obyvatele k zakládání rodin v nižším věku a podpora těchto mladých rodin (finančně, s ohledem na zaměstnání, bydlení).
Dalším doporučením je důsledně se vyhýbat expozicím škodlivým fyzikálním nebo chemickým působkům v domácím či pracovním prostředí. V případech, kdy to není možné (především v rámci pracovních expozic), je důležité využívat ochranných pomůcek a opatření, aby byl vliv těchto expozic co nejvíce snížen, ne-li zcela eliminován. S tím souvisí vytváření odpovídajících pracovních podmínek a dalších opatření v oblasti bezpečnosti práce na základě platné legislativy, aby nedošlo k překračování přípustných limitů – organizační opatření, technické řešení pracovišť (vzduchotechnika, hermetizace aj.), adekvántní pracovní oděvy a pomůcky, zásady osobní hygieny, likvidace perzistujících látek a soustavné monitorování expozic pracovního prostředí. To se týká především zabránění expozice ionizujícímu záření, PCB, PAU, benzenu, formaldehydu, různým typům prachu, vinylchloridu aj. Dalším krokem je pak upuštění od užívání některých škodlivých látek v pracovním prostředí (jak je upouštěno např. u skupiny PCB) a inovace technologií v průmyslu i výrobě. Prevence je v tuto chvíli cílena nejen na leukemie u dospělých (ochranou osob samotných), ale i u dětí (zabránění expozice potenciálních či nastávajících rodičů).
Největší možnosti ovlivnění jsou v rámci faktorů životního stylu. Pro prevenci rozvoje AL je důležité udržovat zdravý životní styl tak, jak je tento pojem běžně chápán. Kromě vyvarování se kouření tabáku je možné preventivně ovlivnit vznik AL stravou. Pro prevenci ALL je zásadní výživa matky během těhotenství – studie identifikovaly konkrétní faktory, které se mohou uplatnit v prevenci rozvoje onemocnění u dětí. Výživa těhotných žen by měla být bohatá na proteiny, ovoce a zeleninu, vlákninu [67, 122, 123], ryby a rybí výrobky, popř. plody moře [91, 124], a s dostatečným příjmem vitaminu A, respektive provitaminu A [122], kyseliny listové či vitaminu B12 [92]. Efekt těchto komponent výživy udává tabulka 3. Nabízí se zde možnosti edukace nastávajících rodičů, párů, které plánují potomky, a těhotných žen o škodlivých a protektivních expozicích, např. od gynekologů, praktických lékařů, specialistů z reprodukčních klinik a poraden či pediatrů.
Tab. 3. Ochranné faktory ve výživě matky během těhotenství proti vzniku akutní lymfoblastické leukemie
Table 3. Protective factors in maternal nutrition during pregnancy against acute lymphoblastic leukemia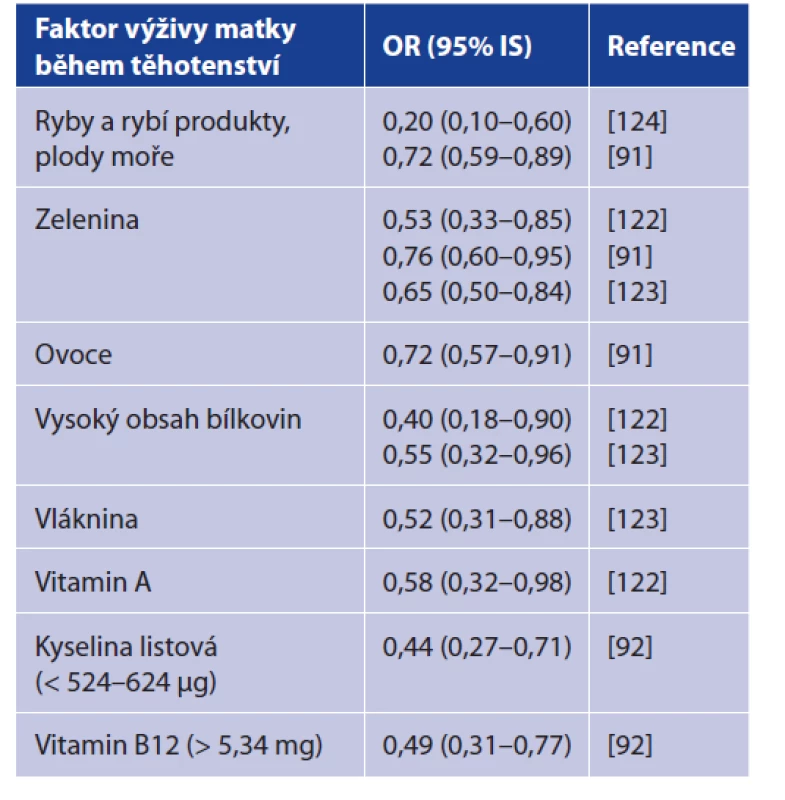
U AML je v rámci prevence jejího vzniku v pozdějším věku důležité udržování normální tělesné hmotnosti vyváženým energetickým příjmem (stravou) a výdejem (fyzickou aktivitou). Nebylo jednoznačně prokázáno, že by fyzická aktivita byla samostatným preventivním faktorem proti rozvoji AML [125], nicméně její role v udržování tělesné hmotnosti a její celkový pozitivní vliv na zdraví jedince i populace jsou nezpochybnitelné. Za protektivní tak mohou být považovány i v současnosti probíhající programy podporující zdravý životní styl, jako jsou podpora zdravé výživy, fyzické aktivity, osvěta a další kroky konané pro prevenci kouření tabáku či konzumace alkoholu v populaci.
Zejména v rámci primordiální prevence by bylo vhodné omezit expozici polutantům z dopravy, ať už formou technologických změn (snižování spotřeby, ekologičtější forma pohonu), prostřednictvím dopravních omezení či celkového snížení dopravní zátěže v okolí bydlišť [126].
Mnohé ze zmíněných expozic jsou prokázanými etiologickými faktory nebo zvyšují riziko vzniku jiných onemocnění. Malignity jsou způsobeny nejrůznějšími fyzikálními expozicemi nebo chemickými substancemi (např. benzen, tabákový kouř, radon, ionizující záření, formaldehyd, PAU, PCB). Znečištěné ovzduší, chemické látky v pracovním prostředí nebo kouření (aktivní i pasivní) vedou ke vzniku respiračních onemocnění. Faktory životního stylu se významně uplatňují ve vzniku kardiometabolických i nádorových onemocnění, přičemž často nepůsobí samostatně, ale ve svém účinku se vzájemně potencují. V rámci navržených opatření tak platí, že tyto kroky jsou klíčové nejen v prevenci akutních leukemií, ale i dalších chronických onemocnění.
ZÁVĚR
Akutní myeloidní i akutní lymfoblastická leukemie jsou vzácná hematoonkologická onemocnění. Jejich výskyt není oproti jiným nádorovým onemocněním vysoký, ale vynahrazují jej svou závažností: jedná se o vysoce agresivní malignity postihující především děti do 15 let (hlavně v případě ALL) a osoby starší 65 let (v případě AML). Data o zastoupení jednotlivých typů AL většinou nejsou dostupná či jsou pouze obtížně porovnatelná. Samostatnou kapitolu tvoří rozvojové země, kde vzhledem k nízké úrovni poskytované zdravotní péče případy leukemie mohou být (a často jistě jsou) nediagnostikovány nebo zaměněny za jiné diagnózy. Přesné určení trendů výskytu jednotlivých typů AL je tedy poměrně náročné.
Etiologie AL je v mnoha případech neznámá, ačkoliv potenciálních rizikových faktorů popisovaných ve studiích je celá řada. Často se ovšem jedná o retrospektivní studie případů a kontrol, které jsou zatíženy chybami a sledují pouze malý počet osob. Důkazy jsou u mnoha těchto faktorů nedostatečné a je nezbytné provádět další výzkumy.
Na základě dosavadních zjištění je možné stanovit některé možnosti prevence AL, které se týkají především faktorů životního stylu, faktorů rodičů osob, u nichž se leukemie v dětském věku vyvinula, nebo expozice některým chemickým substancím či fyzikálním vlivům. U těchto faktorů byla prokázána jejich role v etiopatogenezi jiných onemocnění, proto je preventabilita leukemií významně a neoddělitelně spojena s předcházením vzniku těmto nemocím. Jedná se především o onemocnění kardiovaskulární, respirační, metabolická či onkologická, která jsou zodpovědná za vysokou morbiditu i mortalitu v populacích vyspělých zemí. Vzhledem k vysoké závažnosti leukemií jistě budou tyto, byť omezené možnosti prevence vhodnější než případná složitá, komplexní a vysoce nákladná léčba již vzniklých onemocnění.
Do redakce došlo dne 12. 1. 2021.
Adresa pro korespondenci:
Mgr. Simona Zatloukalová
Ústav veřejného zdravotnictví
Lékařská fakulta Univerzity Palackého v Olomouci
Hněvotínská 976/3
775 15 Olomouc
e-mail: zatloukalova.s91@gmail.com
Zdroje
1. Penka M, Tesařová E, Blatný J, et al. Hematologie a transfuzní lékařství I: Hematologie. Praha: Grada Publishing; 2011. ISBN 978 - 80-247-3459-0.
2. Šálek C. Diagnostika a léčba akutních leukemií. Int Med Praxi, 2012;14(10):366–372.
3. Arber DA, Orazi A, Hasserjian R. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia. Blood, 2016;127(20):2391–2405.
4. Zuna J, Žaliová M. Etiologie dětských ALL a AML, molekulární genetika a minimální reziduální nemoc. Českoslov Pediatr, 2015;70(2):70–84.
5. Schottenfeld D, Fraumeni J. Schottenfeld and Fraumeni Cancer Epidemiology and Prevention. 4. vyd. Oxford: Oxford University Press; 2018.
6. Ilhan G, Karakus S, Andic N. Risk Factors and Primary Prevention of Acute Leukemia. Asian Pac J Cancer Prev, 2006;7 : 515–517.
7. National Cancer Institute: Surveillance, Epidemiology and Result Program. Cancer Stat Facts: Leukemia — Acute Myeloid Leukemia (AML) [online]. 2020 [cit. 2020-12-01]. Dostupné na www: .
8. Visser O, Trama A, Maynadié M, et al. Incidence, survival and prevalence of myeloid malignancies in Europe. Eur J Cancer, 2012;48(17):3257–3266.
9. Dušek L, Mužík J, Kubásek M, et al. SVOD – Epidemiologie zhoubných nádorů v České republice [online]. 2005 [cit. 2020 - 03-20]. Dostupné na www: .
10. Ústav zdravotnických informací a statistiky České republiky. Epidemiologie hematologických malignit v České republice [online]. 2015-09 [cit. 2020-10-18]. Dostupné na www: https:// reporting.uzis.cz/cr/res/file/reporty/060118-CR-epid-hematoonko. pdf.
11. Webový portál epidemiologie zhoubných nádorů v České republice. Report diagnózy: C92,0 – Akutní myeloidní leukémie [online]. 2020 [cit. 2020-02-18]. Dostupné na www: http://www. svod.cz/.
12. Schiffer CA, Gurbuxani S, Larson RA, et al. Clinical manifestations, pathologic features, and diagnosis of acute myeloid leukemia. UpToDate [online]. 2019 [cit. 2020-03-11]. Dostupné na www: https://www.uptodate.com/contents/clinical-manifestations - pathologicfeatures-and-diagnosis-of-acute-myeloid-leukemia.
13. Šustková Z, Semerád L, Procházková J, et al. Charakteristika a výsledky léčby pacientů s akutní myeloidní leukemií ≥ 60 let – data z databáze CELL DATOOL AML. Transfuze Hematol Dnes, 2019;25(4):340–348.
14. Deschler B, Lübbert M. Acute myeloid leukemia: Epidemiology and etiology. Cancer, 2006;107(9):2099–2107.
15. Doubek M, Mayer J (ed.). Léčebné postupy v hematologii: Doporučení České hematologické společnosti České lékařské společnosti Jana Evangelisty Purkyně. 2. akt. a dopl. vyd. Nové Město nad Metují: ČHS ČLS JEP; 2016.
16. Babushok DV, Bessler M. Genetic predisposition syndromes: when should they be considered in the work-up of MDS? Best Pract Res Clin Haematol, 2015;28(1):55–68.
17. Hahn CN, Chong EC, Carmichael CL, et al. Heritable GATA2 mutations associated with familial myelodysplastic syndrome and acute myeloid leukemia. Nat Genet, 2011;43(10):1012–1019.
18. Churpek Je, Lorenz R, Nedumgottil S, et al. Proposal for the clinical detection and management of patients and their family members with familial myelodysplastic syndrome/acute leukemia predisposition syndromes. Leuk Lymphoma, 2013;54(1):28 – 35.
19. Nickels EM, Soodalter J, Churpek J, et al. Recognizing familial myeloid leukemia in adults. Ther Adv Hematol, 2013;4(4):254 – 269.
20. Pan LL, Huang YM, Wang M, et al. Positional cloning and next-generation sequencing identified a TGM6 mutation in a large Chinese pedigree with acute myeloid leukaemia. Eur J Hum Genet, 2015;23(2):218–223.
21. Saliba J, Saint-Martin C, di Stefano A, et al. Germline duplication of ATG2B and GSKIP predisposes to familial myeloid malignancies. Nat Genet, 2015;47(10):1131–1140.
22. Husnain M, Wang T, Valdes M, et al. Multiple Myeloma in a Patient with ANKRD26-Related Thrombocytopenia Successfully Treated with Combination Therapy and Autologous Stem Cell Transplant. Case Rep Hematol, 2019;(2):9357572.
23. Schudrowitz N, Takagi S, Wessel GM, et al. Germline factor DDX4 functions in blood-derived cancer cell phenotypes. Cancer Sci, 2017;108(8):1612–1619.
24. Hock H, Shimamura A. ETV6 in Hematopoiesis and Leukemia Predisposition [online]. Semin Hematol, 2017;54(2):98–104.
25. O‘Brien G, Zyla J, Manola KN, et al. Identification of two novel mutations in human acute myeloid leukemia cases. Leuk Lymphoma, 2020;14 : 1–8.
26. Caughey RW, Michels KB. Birth weight and childhood leukemia: a meta-analysis and review of the current evidence. Int J Cancer, 2009;124(11):2658–2670.
27. O‘Neill KA, Murphy MF, Bunch KJ, et al. Infant birthweight and risk of childhood cancer: international population-based case control studies of 40 000 cases. Int J Epidemiol, 2015;44(1):153 – 168.
28. Panagopoulou P, Skalkidou A, Marcotte E, et al. Parental age and the risk of childhood acute myeloid leukemia: results from the Childhood Leukemia International Consortium. Cancer Epidemiol, 2019;59 : 158–165.
29. Bailey HD, Fritschi L, Infante-Rivard C, et al. Parental occupational pesticide exposure and the risk of childhood leukemia in the offspring: findings from the childhood leukemia international consortium. Int J Cancer, 2014;135(9):2157–2172.
30. Bailey HD, Infante-Rivard C, Metayer C, et al. Home pesticide exposures and risk of childhood leukemia: Findings from the childhood leukemia international consortium. Int J Cancer, 2015;137(11):2644–2663.
31. Karalexi MA, Dessypris N, Thomopoulos TP, et al. Parental alcohol consumption and risk of leukemia in the offspring: a systematic review and meta-analysis. Eur J Cancer Prev, 2017;26(5):433–441.
32. Kaatsch P, Scheidemann-Wesp U, Schüz J. Maternal use of antibiotics and cancer in the offspring: results of a case–control study in Germany. Cancer Causes Control, 2010;21 : 1335–1345.
33. Little MP, Wakeford R, Borrego D, et al. Leukaemia and myeloid malignancy among people exposed to low doses (<100 mSv) of ionising radiation during childhood: a pooled analysis of nine historical cohort studies. Lancet Haematol, 2018;5(8):e346–e358.
34. Weiss HA, Darby SC, Fearn T, et al. Leukemia mortality after X-ray treatment for ankylosing spondylitis. Radiat Res, 1995;142(1):1 – 11.
35. Laurent O, Ancelet S, Richardson DB, et al. Potential impacts of radon, terrestrial gamma and cosmic rays on childhood leukemia in France: a quantitative risk assessment. Radiat Environ Biophys, 2013;52(2):195–209.
36. Demoury C, Marquant F, Ielsch G, et al. Residential Exposure to Natural Background Radiation and Risk of Childhood Acute Leukemia in France, 1990–2009. Environ Health Perspect, 2017;125(4):714–720.
37. Szotkowski T, Čerňan M, Hubáček M, et al. Akutní myeloidní leukemie po předchozí protinádorové léčbě. Onkologie, 2017;11(3):115–120.
38. Heuser M. Therapy-related myeloid neoplasms: does knowing the origin help to guide treatment? Hematology Am Soc Hematol Educ, 2016;(1):24–32.
39. Schüz J, Erdmann F. Environmental Exposure and Risk of Childhood Leukemia: An Overview. Arch Med Res, 2016;47(8):607 – 614.
40. Poynter JN, Richardson M, Roesler M, et al. Chemical exposures and risk of acute myeloid leukemia and myelodysplastic syndromes in a population-based study. Int J Cancer, 2017;140(1):23–33.
41. Shallis RM, Weiss JJ, Deziel NC, et al. Challenging the concept of de novo acute myeloid leukemia: Environmental and occupational leukemogens hiding in our midst. Blood Rev, 2020;22 : 100760.
42. Houot J, Marquant F, Goujon S, et al. Residential Proximity to Heavy-Traffic Roads, Benzene Exposure, and Childhood Leukemia – The GEOCAP Study, 2002–2007. Am J Epidemiol, 2015;182(8):685–693.
43. Vinceti M, Rothman KJ, Crespi CM, et al. Leukemia risk in children exposed to benzene and PM10 from vehicular traffic: a case-control study in an Italian population. Eur J Epidemiol, 2012;27(10):781–790.
44. Janitz AE, Campbell JE, Magzamen S, et al. Benzene and childhood acute leukemia in Oklahoma. Environ Res, 2017;158 : 167 – 173.
45. Shallis RM, Weiss JJ, Deziel NC, et al. A clandestine culprit with critical consequences: Benzene and acute myeloid leukemia. Blood Rev, 2020;22 : 100736.
46. Zhang L, Tang X, Rothman N, et al. Occupational exposure to formaldehyde, hematotoxicity, and leukemia-specific chromosome changes in cultured myeloid progenitor cells. Cancer Epidemiol Biomarkers Prev, 2010;19(1):80–88.
47. Allegra A, Spatari G, Mattioli S, et al. Formaldehyde Exposure and Acute Myeloid Leukemia: A Review of the Literature. Medicina (Kaunas), 2019;55(10):638.
48. Scélo G, Metayer C, Zhang L, et al. Household exposure to paint and petroleum solvents, chromosomal translocations, and the risk of childhood leukemia. Environ Health Perspect, 2009;117(1):133–139.
49. McNerney ME, Godley LA, Le Beau MM. Therapy-related myeloid neoplasms: when genetics and environment collide. Nat Rev Cancer, 2017;17(9):513–527.
50. Fircanis S, Merriam P, Khan N, et al. The relation between cigarette smoking and risk of acute myeloid leukemia: An updated meta-analysis of epidemiological studies. Am J Hematol, 2014;89(8):E125–E32.
51. Tong HC, Yin X, Yu M, et al. A Meta-Analysis of the Relationship between Cigarette Smoking and Incidence of Myelodysplastic Syndromes. PLoS ONE, 2013;8(6):e67537.
52. Ugai T, Matsuo K, Oze I, et al. Smoking and subsequent risk of acute myeloid leukaemia: A pooled analysis of 9 cohort studies in Japan. Hematol Oncol, 2018;36(1):262–268.
53. Ma X, Lim U, Park Y, et al. Obesity, lifestyle factors, and risk of myelodysplastic syndromes in a large US cohort. Am Journal Epidemiol, 2009;169(12):1492–1499.
54. Yamamura Y, Oum R, Elhor GKY, et al. Dietary intake of vegetables, fruits, and meats/beans as potential risk factors of acute myeloid leukemia: A texas case-control study. Nutr Cancer, 2013;65(8):1132–1140.
55. Karmali R, Dalovisio A, Borgia JA, et al. All in the family: Clueing into the link between metabolic syndrome and hematologic malignancies. Blood Rev, 2015;29(2):71–80.
56. Saberi HF, Romieu I, Gallo V, et al. Anthropometric characteristics and risk of lymphoid and myeloid leukemia in the European Prospective Investigation into Cancer and Nutrition (EPIC). Cancer Causes Control, 2013;24(3):427–438.
57. Shiels M, Engels EA. Increased risk of histologically defined cancer subtypes in human immunodeficiency virus-infected individuals: Clues for possible immunosuppressionrelated or infectious etiology. Cancer, 2012;118(19):4869–4876.
58. Vondráková J. Myelodysplastický syndrom, diagnostika a léčba. Interní Med, 2010;12(11):535–539. 59. Bhatt VR. Leukemic transformation in essential thrombocythemia. Future Oncol, 2014;10(16):2593–2602.
60. Manivannan P, Purohit A, Somasundaram V, et al. Leukemic Transformation of Severe Aplastic Anemia Following Matched Allogenic Stem Cell Transplantation, Transplanted Again in CR 1. Indian J Hematol Blood Transfus, 2016;32(Suppl 1):223–227.
61. Perdigones N, Perin JC, Schiano I, et al. Clonal hematopoiesis in patients with dyskeratosis congenita. Am J Hematol, 2016;91(12):1227–1233.
62. Meyer S, Neitzel H, Tönnies H. Chromosomal aberrations associated with clonal evolution and leukemic transformation in fanconi anemia: clinical and biological implications. Anemia, 2012;2012 : 349837.
63. Link DC. Mechanisms of leukemic transformation in congenital neutropenia. Curr Opin Hematol, 2019;26(1):34–40.
64. Starý J. Akutní leukémie u dětí. Onkologie, 2010;4(2):120–124.
65. National Cancer Institute: Surveillance, Epidemiology and Result Program. Cancer Stat Facts: Leukemia — Acute Lymphocytic Leukemia (ALL) [online]. 2020 [cit. 2020-12-01]. Dostupné na www: .
66. Hoelzer D, Bassan R, Dombret H, et al. Acute lymphoblastic leukaemia in adult patients: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol, 2016;27(Suppl5): v69–v82.
67. Abiri B, Kelishadi R, Sadeghi H, et al. Effects of Maternal Diet During Pregnancy on the Risk of Childhood Acute Lymphoblastic Leukemia: A Systematic Review. Nutr Cancer, 2016;68(7):1065–1072.
68. Lim JY, Bhatia S, Robison LL, et al. Genomics of racial and ethnic disparities in childhood acute lymphoblastic leukemia. Cancer, 2014;120(7):955–962.
69. Bhatia S, Sather HN, Heerema NA, et al. Racial and ethnic differences in survival of children with acute lymphoblastic leukemia. Blood, 2002;100(6):1957–1964.
70. Harvey RC, Mullighan CG, Chen IM, et al. Rearrangement of CRLF2 is associated with mutation of JAK kinases, alteration of IKZF1, Hispanic/Latino ethnicity, and a poor outcome in pediatric B-progenitor acute lymphoblastic leukemia. Blood, 2010;115(26):5312–5321.
71. Perez-Andreu V, Roberts KG, Harvey RC, et al. Inherited GATA3 variants are associated with Ph-like childhood acute lymphoblastic leukemia and risk of relapse. Nat Genet, 2013;45(12):1494 – 1498.
72. Mihál V. Leukémie. In: Bajčiová V, Tomášek J, Štěrba J et al. Nádory adolescentů a mladých dospělých. 1. vyd. Praha: Grada Publishing; 2011. s. 43–72.
73. Webový portál epidemiologie zhoubných nádorů v České republice. Report diagnózy: C91.0 – Akutní lymfoblastická leukémie [online]. 2020 [vid. 2020-02-18]. Dostupné na www: http://www.svod.cz/
74. Shahjahani M, Norozi F, Zadeh A, et al. The role of Pax5 in leukemia: diagnosis and prognosis significance. Med Oncol, 2015;32(1):360.
75. Ross RA, Smoley SA, Williamson CM, et al. Characterization of TCF3 rearrangements in pediatric B-lymphoblastic leukemia/ lymphoma by mate-pair sequencing (MPseq) identifies complex genomic rearrangements and a novel TCF3/TEF gene fusion. Blood Cancer J, 2019;9(10):1–8.
76. Ramírez-Komo JA, Delaney MA, Straign D, et al. Spontaneous loss of B lineage transcription factors leads to pre-B leukemia in Ebf1+/–Bcl-xLTg mice. Oncogenesis, 2017;6(7):e355–e355.
77. Guo X, Zhang R, Liu J, et al. Characterization of LEF1 high expression and novel mutations in adult acute lymphoblastic leukemia. PLoS ONE, 2015;10(5).
78. Payne KJ, Dovat S. Ikaros and tumor suppression in acute lymphoblastic leukemia. Crit Rev Oncog, 2011;16(1–2):3–12.
79. Sergentanis TN, Thomopoulos TP, Gialamas SP, et al. Risk for childhood leukemia associated with maternal and paternal age. Eur J Epidemiol, 2015;30(12):1229–1261.
80. Karalexi MA, Dessypris N, Skalkidou A, et al. Maternal fetal loss history and increased acute leukemia subtype risk in subsequent offspring: a systematic review and meta-analysis. Cancer Causes Control, 2017;28(6):599–624.
81. Nybo Andersen AM, Urhoj SK. Is advanced paternal age a health risk for the offspring? Fertil Steril, 2017;107(2):312 – 318.
82. Marcotte EL, Thomopoulos TP, Infante-Rivard C, et al. Caesarean delivery and risk of childhood leukaemia: a pooled analysis from the Childhood Leukemia International Consortium (CLIC). Lancet Haematol, 2016;3(4):e176–e185.
83. Hjalgrim LL, Westergaard T, Rostgaard K, et al. Birth weight as a risk factor for childhood leukemia: a meta-analysis of 18 epidemiologic studies. Am J Epidemiol, 2003;158(8):724–735.
84. Kyriakopoulou A, Meimeti E, Moisoglou I, et al. Parental Occupational Exposures and Risk of Childhood Acute Leukemia. Mater Sociomed, 2018;30(3):209–214.
85. Walsh JM, Hehir MP, Robson MS, et al. Mode of delivery and outcomes by birth weight among spontaneous and induced singleton cephalic nulliparous labors. Int J Gynaecol Obstet, 2015;129(1):22–25.
86. Milne E, Greenop KR, Scott RJ, et al. Parental prenatal smoking and risk of childhood acute lymphoblastic leukemia. Am J Epidemiol, 2012;175(1):43–53.
87. Baan R, Grosse Y, Straif K, et al. A review of human carcinogens – Part F: chemical agents and related occupations. Lancet Oncol, 2009;10(12):1143–1144.
88. Frederiksen LE, Erdmann F, Wesseling C, et al. Parental tobacco smoking and risk of childhood leukemia in Costa Rica: A population - based case-control study. Environ Res, 2020;180 : 108827.
89. Bailey HD, Metayer C, Milne E, et al. Home paint exposures and risk of childhood acute lymphoblastic leukemia: findings from the Childhood Leukemia International Consortium. Cancer Causes Control, 2015;26(9):1257–1270.
90. Francis SS, Wallace AD, Wendt GA, et al. In utero cytomegalovirus infection and development of childhood acute lymphoblastic leukemia. Blood, 2017;129(12):1680–1684.
91. Petridou E, Ntouvelis E, Dessypris N, et al. Maternal diet and acute lymphoblastic leukemia in young children. Cancer Epidemiol Biomarkers Prev, 2005;14(8):1935–1939.
92. Bailey HD, Miller M, Langridge A, et al. Maternal dietary intake of folate and vitamins B6 and B12 during pregnancy and the risk of childhood acute lymphoblastic leukemia. Nutr Cancer, 2012;64(7):1122–1130.
93. Karalexi MA, Dessypris N, Clavel J, et al. Coffee and tea consumption during pregnancy and risk of childhood acute myeloid leukemia: A Childhood Leukemia International Consortium (CLIC) study. Cancer Epidemiol, 2019;62 : 101581.
94. Alicandro G, Tavani A, La Vecchia C. Coffee and cancer risk: a summary overview. Eur J Cancer Prev, 2017;26(5):424–432.
95. Gradel KO, Kaerlev L. Antibiotic use from conception to diagnosis of child leukaemia as compared to the background population: A nested case-control study. Pediatr Blood Cancer, 2015;62(7):1155–1161.
96. Nikkilä A, Raitanen J, Lohi O, et al. Radiation exposure from computerized tomography and risk of childhood leukemia: Finnish register-based case-control study of childhood leukemia (FRECCLE). Haematologica, 2018;103(11):1873–1880.
97. Schüz J, Ahlbom A. Exposure to electromagnetic fields and the risk of childhood leukaemia: a review. Radiat Prot Dosimetry, 2008;132(2):202–211.
98. Kabuto M, Nitta H, Yamamoto S, et al. Childhood leukemia and magnetic fields in Japan: a case-control study of childhood leukemia and residential power-frequency magnetic fields in Japan. Int J Cancer, 2006;119(3):643–650.
99. Draper G, Vincent T, Kroll ME, et al. Childhood cancer in relation to distance from high voltage power lines in England and Wales: a case-control study. BMJ, 2005;330(7503):1290.
100. Schüz J, Svendsen AL, Linet MS, et al. Nighttime exposure to electromagnetic fields and childhood leukemia: an extended pooled analysis. Am J Epidemiol, 2007;166(3):263–269.
101. Raaschou-Nielsen O, Andersen CE, Andersen HP, et al. Domestic radon and childhood cancer in Denmark. Epidemiol, 2008;19(4):536–543.
102. Andersen EC, Ulbak K, Damkjær A, et al. Radon i danske boliger: Kortlægning af lands-, amts - og kommuneværdier. Herlev: Statens Institut for Strålehygiejne: 2001.
103. Thygesen LC, Nielsen OJ, Johansen C. Trends in adult leukemia incidence and survival in Denmark, 1943–2003. Cancer Causes Control, 2009;20(9):1671–1680.
104. Hauri D, Spycher B, Huss A, et al. Domestic radon exposure and risk of childhood cancer: a prospective census-based cohort study. Environ Health Perspect, 2013;121(10):1239–1244.
105. Del Risco Kollerud R, Blaasaas KG, Claussen B. Risk of leukaemia or cancer in the central nervous system among children living in an area with high indoor radon concentrations: results from a cohort study in Norway. Br J Cancer, 2014;111(7):1413–1420.
106. Deziel NC, Rull RP, Colt JS, et al. Polycyclic aromatic hydrocarbons in residential dust and risk of childhood acute lymphoblastic leukemia. Environ Res, 2014;133 : 388–395.
107. Ward MH, Colt JS, Metayer C, et al. Residential exposure to polychlorinated biphenyls and organochlorine pesticides and risk of childhood leukemia. Environ Health Perspect, 2009;117(6):1007 – 1013.
108. Mihál V. Může délka kojení nebo časná infekce v kojeneckém věku snížit riziko vzniku leukémie u dětí? Pediatr praxi, 2004;2 : 103–104.
109. Greaves MF. Speculations on the cause of childhood acute lymphoblastic leukemia. Leukemia, 1988;2(2):120–125.
110. Kerr JR, Mattey DL. The role of parvovirus B19 and the immune response in the pathogenesis of acute leukemia. Rev Med Virol, 2015;25(3):133–155.
111. Marcotte EL, Ritz B, Cockburn M, et al. Exposure to infections and risk of leukemia in young children. Cancer Epidemiol Biomarkers Prev, 2014;23(7):1195–1203.
112. Lin JN, Lin CL, Lin MC, et al. Risk of leukaemia in children infected with enterovirus: a nationwide, retrospective, population - based, Taiwanese-registry, cohort study. Lancet Oncol, 2015;16(13):1335–1343.
113. Orsi L, Magnani C, Petridou ET, et al. Living on a farm, contact with farm animals and pets, and childhood acute lymphoblastic leukemia: pooled and meta-analyses from the Childhood Leukemia International Consortium. Cancer Med, 2018;7(6):2665 – 2681.
114. Hishamuddin P. The association between acute lymphoblastic leukemia in children and Helicobacter pylori as the marker for sanitation. BMC Res Notes, 2012;5 : 345.
115. Cardwell CR, McKinney PA, Patterson CC, et al. Infections in early life and childhood leukaemia risk: a UK case-control study of general practitioner records. Br J Cancer, 2008;99(9):1529 – 1533.
116. Rosenbaum PF, Buck GM, Brecher ML. Allergy and infectious disease histories and the risk of childhood acute lymphoblastic leukaemia. Paediatr Perinat Epidemiol, 2005;19(2):152–164.
117. Hwee J, Tait C, Sung L, et al. A systematic review and meta-analysis of the association between childhood infections and the risk of childhood acute lymphoblastic leukaemia. Br J Cancer, 2018;118(1):127–137.
118. Mezei G, Sudan M, Izraeli S, et a. Epidemiology of childhood leukemia in the presence and absence of Down syndrome. Cancer Epidemiol, 2014;38(5):479–489.
119. Český statistický úřad. Aktuální populační vývoj v kostce [online]. 2020 [cit. 2020-12-10]. Dostupné na www: .
120. Parner ET, Baron-Cohen S, Lauritsen MB, et al. Parental age and autism spectrum disorders. Ann Epidemiol, 2012;22(3):143 – 150.
121. Thompson JA. Disentangling the roles of maternal and paternal age on birth prevalence of down syndrome and other chromosomal disorders using a Bayesian modeling approach. BMC Med Res Methodol, 2019;19(1):82.
122. Jensen CD, Block G, Buffler P, et al. Maternal dietary risk factors in childhood acute lymphoblastic leukemia (United States). Cancer Causes Control, 2004;15(6):559–570.
123. Kwan ML, Jensen CD, Block G, et al. Maternal diet and risk of childhood acute lymphoblastic leukemia. Public Health Rep, 2009;124(4):503–514.
124. Ross JA, Potter JD, Reaman GH, et al. Maternal exposure to potential inhibitors of DNA topoisomerase II and infant leukemia (United States): a report from the Children‘s Cancer Group. Cancer Causes Control, 1996;7(6):581–590.
125. Rees-Punia E, Patel AV, Fallon EA, et al. Physical Activity, Sitting Time, and Risk of Myelodysplastic Syndromes, Acute Myeloid Leukemia, and Other Myeloid Malignancies. Cancer Epidemiol Biomarkers Prev, 2019;28(9):1489–1494.
126. Filippini T, Heck JE, Malagoli C, et al. A review and meta-analysis of outdoor air pollution and risk of childhood leukemia. J Environ Sci Health C Environ Carcinog Ecotoxicol Rev, 2015;33(1):36–66.
Štítky
Hygiena a epidemiologie Infekční lékařství Mikrobiologie
Článek vyšel v časopiseEpidemiologie, mikrobiologie, imunologie
Nejčtenější tento týden
2021 Číslo 3- Stillova choroba: vzácné a závažné systémové onemocnění
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Diagnostika virových hepatitid v kostce – zorientujte se (nejen) v sérologii
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- Pokud by byla k dispozici vakcína proti covid-19, chtěli byste být očkováni? A jste očkováni proti chřipce a jiným nemocem? Průzkum mezi studenty vysokých škol v době nouzového stavu
- Citlivost testů antigenu SARS-CoV-2 z hlediska testování ve velkém měřítku
- Evaluation of tuberculosis diagnostic tools, with extending MODS assay use to second line susceptibility testing
- Detailní molekulární charakterizace izolátů Neisseria meningitidis metodou sekvenace celého genomu (WGS), Česká republika, 2010–2019
- Možnosti diagnostiky lidských polyomavirů v klinické praxi
- Co víme a stále nevíme o klíšťové encefalitidě?
- Autozápalový proces v patogenéze generalizovanej pustulárnej psoriázy a perspektívy jej cielenej liečby
- Epidemiologie, rizikové faktory a možnosti prevence akutních leukemií
- Epidemiologie, mikrobiologie, imunologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Epidemiologie, rizikové faktory a možnosti prevence akutních leukemií
- Co víme a stále nevíme o klíšťové encefalitidě?
- Možnosti diagnostiky lidských polyomavirů v klinické praxi
- Autozápalový proces v patogenéze generalizovanej pustulárnej psoriázy a perspektívy jej cielenej liečby
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



