-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Nozokomiální kandidémie v České republice v letech 2012–2015: výsledky mikrobiologické multicentrické studie
Nosocomial candidemia in the Czech Republic in 2012–2015: results of a microbiological multicentre study
Background:
Candidemia is a severe and often life-threatening infection frequently occurring in critically ill patients. During the last decade, new therapeutic and prophylactic strategies influenced (at least in some patient subgroups) the epidemiological situation and the spectrum of causative Candida strains. The present multicentre study aimed to assess the current epidemiological situation of Candida strains causing invasive candidiasis (IC) in patients of tertiary care hospitals in the Czech Republic.Material and methods:
Clinical and microbiological data on patients with bloodstream yeast isolates collected in 11 tertiary care hospitals in the Czech Republic between 2012 and 2015 were analysed. The incidence of cases and species distribution were assessed by study year, age, and specialty. Moreover, an association with the Candida colonization and presence of toxigenic strains of Clostridium difficile in stool prior to blood culture positivity was analysed. For some of the strains, minimum inhibitory concentrations (MICs) of systemic antifungals were determined using standard methods.Results:
A total of 886 episodes of candidemia (921 yeast strains) were identified during the study period. The overall incidence per 1000 admissions was 0.40 (range 0.21–1.22 depending on the hospital). Almost half of the isolates belonged to the species Candida albicans (49.7 %), followed by Candida glabrata (15.3 %) and Candida parapsilosis (11.2 %). Non-albicans species of Candida significantly predominated in oncology wards (71.6 %) as compared to surgery (40.4 %) or internal medicine (52.0 %) departments. More than 70.0 % of patients stayed in intensive care units at the time of positive culture; in 65.0 % of patients, colonization with the same yeast species preceded blood culture positivity. In only 5.1 % of all patients, the previous presence of toxigenic strains of Clostridium difficile in stool was found. Fifty-six of the 921 yeast strains were tested for antifungal susceptibility, with an increase in MICs to azoles being observed for C. glabrata.Conclusion:
The incidence of candidemia in the Czech Republic did not vary significantly between 2012 and 2015, and C. glabrata was the second most common yeast species after C. albicans isolated from blood.Keywords:
epidemiology – candidemia – incidence – antifungal susceptibility testing
Autoři: I. Kocmanová 1; P. Lysková 2,3; V. Chrenkova 4; P. Olišarová 5; R. Dobiáš 3,6; H. Janouškovcová 7; H. Soukupová 8; N. Mallátová 9; L. Svobodová 3; P. Hamal 3; M. Skružná 10; N. Bartoníková 11
Působiště autorů: Oddělení klinické mikrobiologie, FN Brno 1; Laboratoř mykologie a TBC, odd. parazitologie, mykologie a mykobakteriologie, Zdravotní ústav se sídlem v Ústí nad Labem 2; Ústav mikrobiologie, LF UP v Olomouci 3; Ústav lékařské mikrobiologie, 2. LF UK a FN Motol, Praha 4; Ústav lékařské biochemie a laboratorní diagnostiky Všeobecné fakultní nemocnice a 1. LF UK v Praze, Klinická mikrobiologie a ATB centrum 5; Laboratoř klinické mykologie, odd. bakteriologie a mykologie, Zdravotní ústav se sídlem v Ostravě 6; Ústav mikrobiologie, FN Plzeň 7; Ústav lékařské mikrobiologie, 3. LF UK a FN Královské Vinohrady, Praha 8; Pracoviště parazitologie a mykologie, Centrální laboratoře Nemocnice České Budějovice 9; Oddělení klinické mikrobiologie, Pracoviště laboratorních metod, Institut Klinické a Experimentální Medicíny, Praha 10; Oddělení lékařské mikrobiologie, Krajská nemocnice T. Bati ve Zlíně 11
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 67, 2018, č. 1, s. 3-10
Kategorie: Původní práce
Souhrn
Cíl práce:
Kandidémie patří mezi poměrně časté infekční komplikace u kriticky nemocných pacientů. V posledním desetiletí se díky novým terapeutickým přístupům (zejména u některých skupin pacientů) mění spektrum kvasinek, které infekci způsobují. Předkládaná multicentrická studie si dala za úkol získat aktuální informace o epidemiologické situaci týkající se invazivních kandidóz (IC) v České republice.Materiál a metody:
Do souboru byla zařazena data pacientů s kultivačně pozitivním nálezem kvasinky v krvi z 11 mikrobiologických pracovišť v České republice v rozmezí let 2012–2015. Byla hodnocena incidence, zastoupení jednotlivých kvasinkových druhů podle sledovaných let, podle věku a podle odborností. Dále byl posouzen vliv kolonizace a nakonec zda IC předcházela přítomnost toxigenního kmene Clostridium difficile ve stolici. U části izolovaných kmenů byly standardní metodikou stanoveny minimální inhibiční koncentrace (MIC) systémových antimykotik.Výsledky:
V průběhu sledovaného období bylo v zúčastněných laboratořích zachyceno 921 kvasinkových kmenů od 886 pacientů. Celková incidence IC na 1 000 přijatých pacientů byla 0,40 (rozmezí 0,21–1,22 podle pracovišť). Takřka polovina izolátů spadala do druhu Candida albicans (49,7 %), následovaná Candida glabrata (15,3 %) a Candida parapsilosis (11,2 %). Na onkologických odděleních výrazně převažovaly non-albicans druhy (71,6 %), na rozdíl od chirurgických (40,4 %) nebo interních (52,0 %) oborů. Více než 70,0 % pacientů bylo v době pozitivní kultivace hospitalizováno na jednotkách intenzivní péče (JIP) a 65,0 % nemocných bylo kolonizováno stejným druhem kvasinky, který byl později nalezen v hemokultuře. Pouze u 5,1 % pacientů z celkového počtu byla potvrzena předchozí přítomnost toxigenního kmene C. difficile ve stolici. Celkem bylo otestováno 56 kmenů kvasinek (z 921) a byla zaznamenána zvýšená MIC u azolů pro C. glabrata.Závěr:
Incidence kandidémií v České republice se ve sledovaném období výrazně neměnila a po C. albicans je druhou nejčastěji izolovanou kvasinkou v krvi C. glabrata.Klíčová slova:
epidemiologie – kandidémie – incidence – testování citlivosti k antimykotikůmÚVOD
Infekce krevního řečiště způsobené kvasinkovými organismy (kandidémie, hematogenní kandidové infekce) se řadí k poměrně častým komplikacím spojeným s nemocniční péčí. V závislosti na složení studované populace (děti, pacienti na JIP, hematoonkologičtí pacienti apod.) se kvasinky objevují jako třetí až čtvrtý nejčastěji izolovaný mikroorganismus z krve, obvykle po koaguláza-negativních stafylokocích, enterokocích, popř. enterobakteriích [1, 2, 3, 4, 5].
Navzdory zavedení nových antimykotik do klinické praxe (azoly třetí generace, echinokandiny) se kandidémie stále potýkají s vysokou mortalitou (nad 50 %) a celosvětově se incidence těchto infekcí spíše zvyšuje [6, 7, 8]. Nejčastěji uváděnými rizikovými faktory jsou antibiotická terapie, pobyt na JIP delší než 72 hodin, parenterální výživa, neutropenie, přítomnost centrálního žilního katetru, břišní chirurgie a léčba kortikosteroidy [9, 10]. Nově se ukazuje, že by rizikovým faktorem mohla být i předchozí infekce toxigenním kmenem Clostridium difficile [11].
Většina izolovaných kmenů spadá do rodu Candida, publikované práce zabývající se epidemiologií uvádějí jako převažujícího původce Candida albicans. Nicméně v procentuálním zastoupení různých druhů tohoto rodu existují geografické rozdíly – v Evropě a Severní Americe je převaha C. albicans zřetelnější než třeba v Jižní Americe a Asii, kde jsou častěji izolovány non-albicans druhy [12]. Stejně tak se liší tento poměr u různých skupin pacientů – novorozenci, hematoonkologičtí pacienti, diabetici apod. [13].
V neposlední řadě roste počet izolátů s rezistencí k flukonazolu či obecně k azolům, a dokonce i k echinokandinům [14].
Cílem této práce bylo zmapovat epidemiologickou situaci týkající se kandidémií v České republice za čtyřleté období a u vybraných kmenů stanovit minimální inhibiční koncentrace standardní mikrodiluční metodou podle EUCAST (European Committee on Antimicrobial Susceptibility Testing) [15]. Kromě možnosti okamžitého porovnání mezi ČR a jinými zeměmi mohou být naše výsledky v budoucnu využity ke stanovení trendů výskytu, rezistence apod. u této invazivní houbové infekce.
METODY
Do prezentované studie byla zařazena data za roky 2012–2015 získaná z jedenácti mikrobiologických pracovišť v České republice (Oddělení klinické mikrobiologie FN Brno; Ústav lékařské mikrobiologie 2. LF UK a FN Motol; Ústav lékařské biochemie a laboratorní diagnostiky Všeobecné fakultní nemocnice a 1. LF UK v Praze, Klinická mikrobiologie a ATB centrum; Laboratoř klinické mykologie, oddělení bakteriologie a mykologie, Zdravotní ústav se sídlem v Ostravě; Ústav mikrobiologie FN Plzeň; Laboratoř mykologie Zdravotního ústavu se sídlem v Ústí nad Labem; Ústav lékařské mikrobiologie 3. LF UK a FN Královské Vinohrady; Pracoviště parazitologie a mykologie Centrálních laboratoří Nemocnice České Budějovice; Ústav mikrobiologie LF UP v Olomouci; Oddělení klinické mikrobiologie Pracoviště laboratorních metod Institutu klinické a experimentální medicíny (IKEM); Oddělení lékařské mikrobiologie Krajské nemocnice T. Bati ve Zlíně). Základním vstupním kritériem pro zařazení do studie byla přítomnost kvasinky v kultivačním vyšetření materiálu z krevního řečiště (hemokultura) zaslaném na jmenovaná mikrobiologická oddělení či ústavy z klinických pracovišť. Přítomnost kvasinky v primárně sterilním materiálu znamená podle EORTC/MSG kritérií (European Organization for Research and Treatment of Cancer/ Mycoses Study Group) prokázanou invazivní houbovou infekci u imunokompromitovaných i imunokompetentních pacientů [16].
Design studie
Kromě druhu vykultivované kvasinky byl sledován věk v okamžiku pozitivní kultivace, diagnóza, pobyt na JIP nebo standardním oddělení a odbornost odesílajícího oddělení (ARO, hematoonkologie/onkologie, neonatologie, chirurgické a interní obory). Dále pak kolonizace stejným druhem kvasinky do 10 dnů před odběrem pozitivní hemokultury a nakonec, zda nebyl v době do 1 měsíce před odběrem pozitivní hemokultury u pacienta izolován toxigenní kmen C. difficile. Kolonizací se rozumí přítomnost kvasinky v dutině ústní, nosní, rektu apod.
V případě opakované izolace stejného druhu kvasinky byla za další epizodu kandidémie považována pozitivní kultivace krve s odstupem nejméně 21 dní.
Celkové počty infekcí byly relativizovány přepočtem na 1 000 hospitalizovaných pacientů na základě údajů jednotlivých pracovišť.
Mikrobiologické metody
Materiál byl zpracován podle standardních operačních postupů platných v zúčastněných laboratořích. Na kultivaci krve byly použity systémy Bactec™ (Becton, Dickinson and Company, USA) nebo BactAlert® (BioMérieux, Francie), pozitivní lahvičky byly vyočkovány na krevní agar (Merck, Německo; BioRad, Francie; Oxoid, Velká Británie; Trios, Česká republika) a/nebo Sabouraudův agar s antibiotiky (Conda, Španělsko; BioRad, Francie) a/nebo chromogenní médium (BioRad, Francie; Trios, Česká republika) a kultivovány 24–48 hodin, respektive 72 hodin při teplotě 35 ± 1 ºC, respektive 30 ± 1 ºC.
Získané izoláty kvasinek byly zařazeny do rodu a druhu proteomickou metodou MALDI-TOF MS (Matrix Assisted Laser Desorption Ionization – Time of Flight-Mass Spectroscopy – MALDI Biotyper, Bruker, Německo; Axima Performance, Shimadzu, Japonsko) nebo automatickým identifikačním systémem VITEK®2 (BioMérieux, Francie) nebo pomocí biochemických (ID 32C, API 20C AUX (BioMérieux, Francie), Auxacolor2 (BioRad, Francie) a mikro-morfologických (rýžový agar, cornmeal agar) testů.
U náhodně vybraných kmenů z různých pracovišť byla testována citlivost na amfotericin B, flukonazol, vorikonazol, itrakonazol, posakonazol, anidulafungin, kaspofungin a mikafungin standardní mikrodiluční metodou podle EUCAST. Izoláty kvasinek byly inkubovány na Sabouraudově dextrózovém agaru s chloramfenikolem (Trios, Česká Republika) při 35 ± 1 °C. Inokulum bylo připraveno z 24 ± 2 hodin starých kultur. Příprava destiček a testování citlivosti bylo provedeno metodikou popsanou v dokumentu EUCAST EDef 7.3 [15].
Přítomnost toxigenního kmene C. difficile ve stolici byla vyšetřena pomocí soupravy C. DIFF. QUIK CHEK COMPLETE® (Techlab, USA).
VÝSLEDKY
Do studie bylo zařazeno celkem 921 izolátů kvasinek od 886 pacientů z 11 pracovišť v České republice (obr. 1).
Obr. 1. Mikrobiologická pracoviště, která poskytla data do studie – rozložení v ČR Figure 1. Geographical distribution of the participating microbiological laboratories in the Czech Republic 
Základní charakteristika souboru je uvedena v tabulce 1.
Tab. 1. Charakteristika souboru Table 1. Patient characteristics 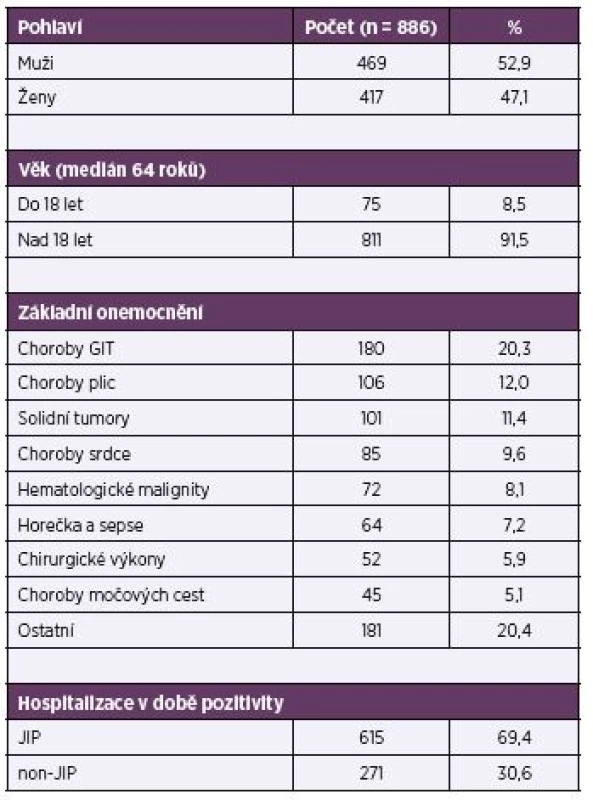
GIT – gastrointestinální trakt, JIP – jednotka intenzivní péče GIT – gastrointestinal tract, JIP (ICU) – intensive care unit V našem souboru mírně převažovali muži (52,9 %), věkové rozmezí všech zařazených pacientů bylo 0–102 roků, medián věku 64 roků. Jen v 8,5 % se jednalo o děti do 18 roků věku. Stran základní diagnózy v okamžiku záchytu pozitivní hemokultury převažovaly choroby gastrointestinálního traktu (20,3 %), následované onemocněními dýchacích cest (12,0 %) a solidními tumory (11,4 %).
Více než dvě třetiny pacientů byly hospitalizovány na JIP. Ze zbylých 271 nemocných bylo největší procento umístěno na interních odděleních (61,6 %).
Celková incidence kandidémií za sledované roky přepočítaná na 1 000 přijatých pacientů byla 0,40. Za jednotlivá pracoviště byla nejvyšší na IKEMu (1,02) a nejnižší v Nemocnici T. Bati ve Zlíně (0,21) – tabulka 2.
Tab. 2. Incidence kandidémií na 1000 přijatých pacientů Table 2. Incidence of candidemia per 1000 admissions 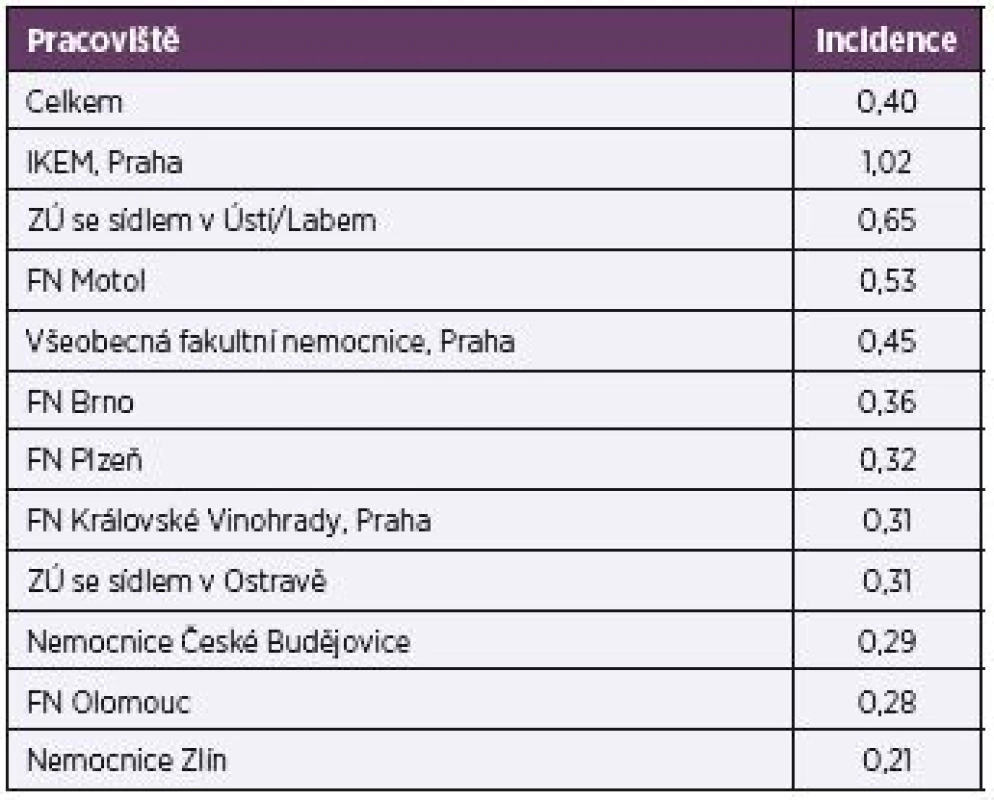
IKEM – Institut klinické a experimentální medicíny, FN – fakultní nemocnice, ZÚ – zdravotní ústav IKEM – Institute for Clinical and Experimental Medicine, FN – university hospital, ZÚ – public health institute Ze srovnání v jednotlivých letech vyplývá, že incidence kandidémií v ČR se drží zhruba na stejné úrovní – po nárůstu v roce 2013 dochází k mírnému poklesu (obr. 2).
Obr. 2. Celková incidence kandidémií v letech 2012–2015 v přepočtu na 1000 přijatých pacientů Figure 2. Overall incidence of candidemia per 1000 admissions in 2012–2015 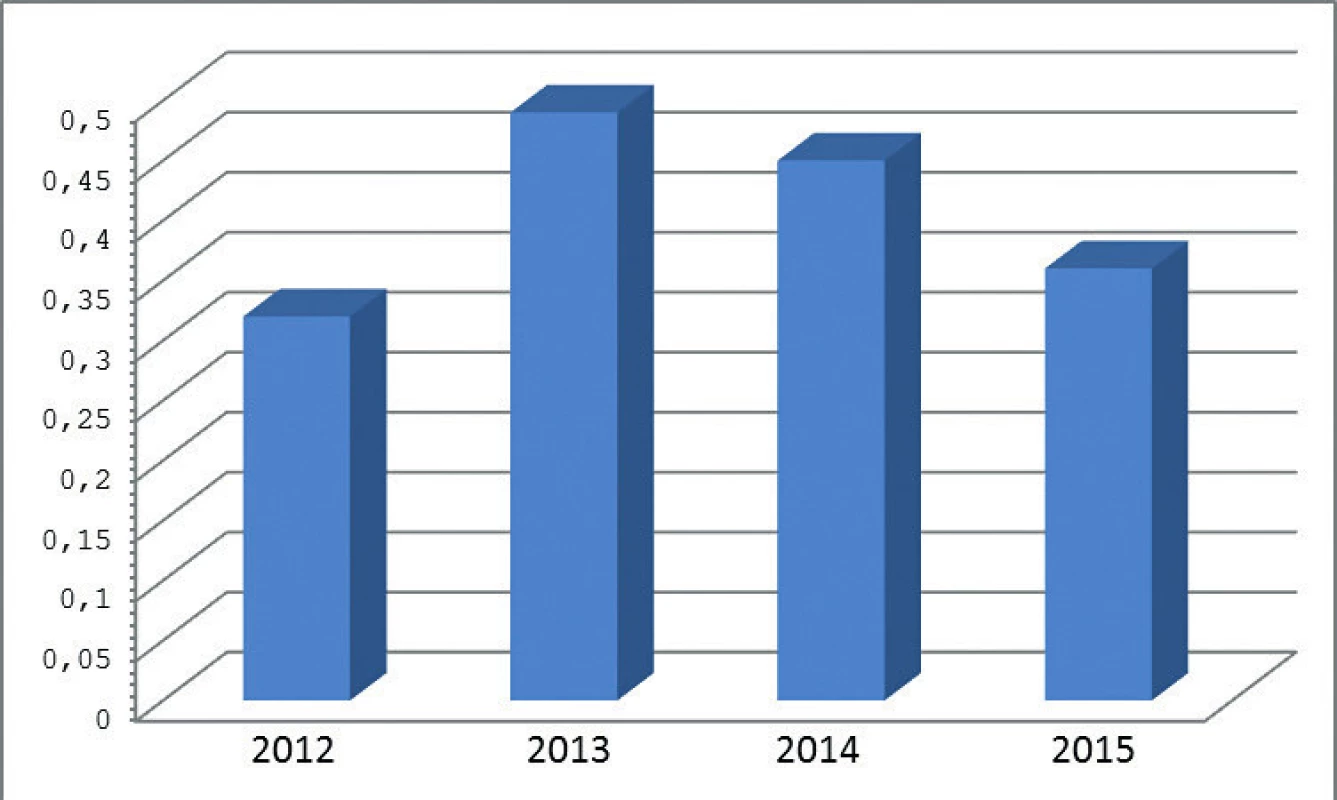
Nejčastěji vykultivovaným druhem byla C. albicans (49,7 %), celkově v tomto souboru velmi mírně převládala skupina non-albicans kandid (50,3 %) – tabulka 3.
Tab. 3. Rozložení izolovaných kmenů (celkově) Table 3. Distribution of isolated strains (overall) 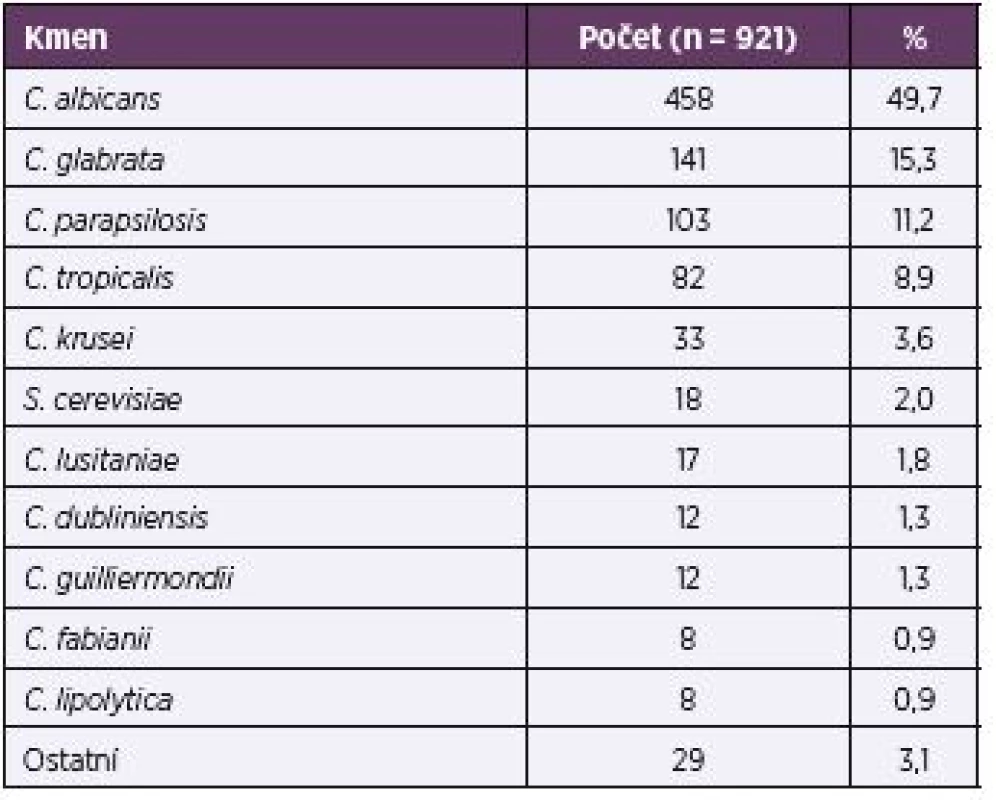
Ostatní: C. zeylanoides, C. rugosa, T. inkin, C. kefyr, T. asahii, K. ohmeri, C. utilis, C. pelliculosa, D. etchelsii Others: C. zeylanoides, C. rugosa, T. inkin, C. kefyr, T. asahii, K. ohmeri, C. utilis, C. pelliculosa, D. etchelsii Ve 35 případech (4,0 %) byla zaznamenána smíšená infekce dvěma kvasinkovými druhy.
Pokud bychom se soustředili jen na skupinu pacientů do 18 let, je pořadí vykultivovaných druhů odlišné – C. albicans převládá výrazněji (60,0 %), následuje Candida parapsilosis, Candida tropicalis a Candida lusitaniae (13,0 %, 9,0 % a 9,0 %). Mezi vzorky od 75 dětí byla Candida glabrata izolována jen jednou, jakkoliv v celém souboru se umístila na druhém místě.
Srovnání v zastoupení nejčastěji vykultivovaných druhů kvasinek u pacientů na JIP a na standardních odděleních ukazuje tabulka 4.
Tab. 4. Rozložení nejčastěji izolovaných kmenů na JIP a non-JIP v procentech Table 4. Distribution of the most common ICU and non-ICU strains in percentages 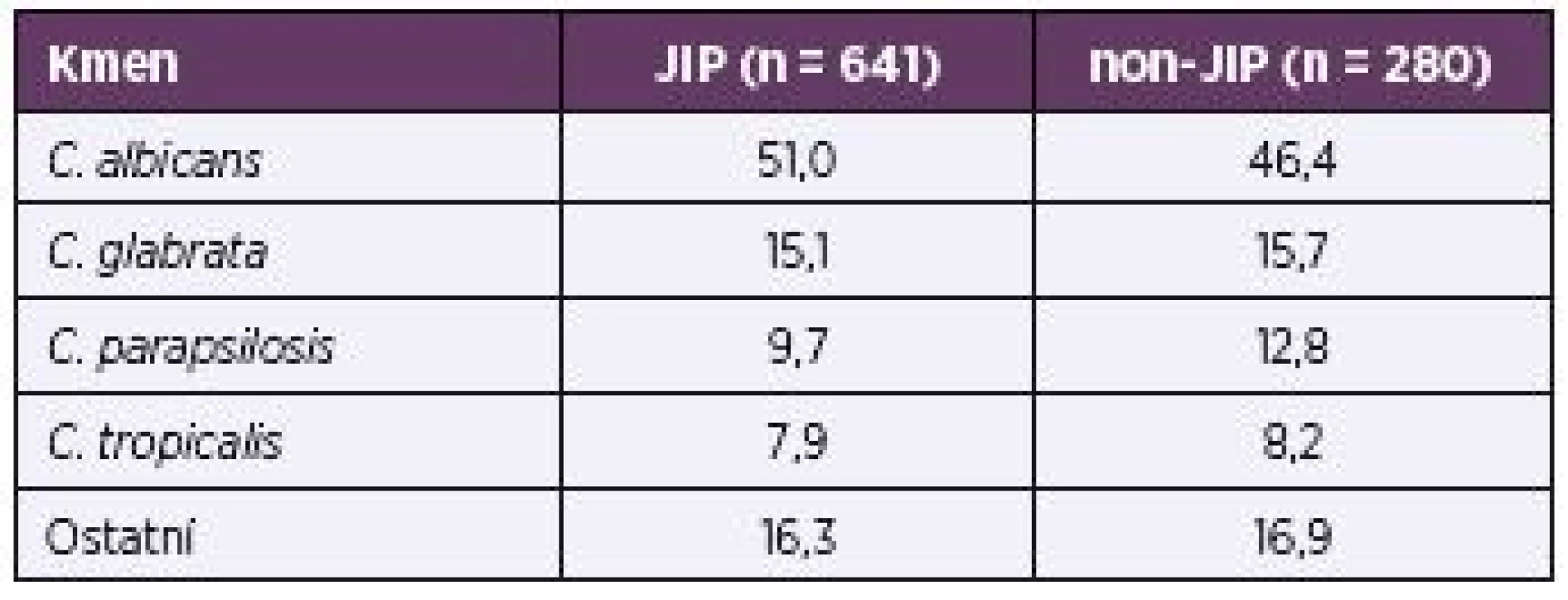
Ve vztahu k vybraným odbornostem (interní nebo chirurgické obory, ARO, hematoonkologie/onkologie, neonatologie) nejvíce převažovala C. albicans u pacientů chirurgických oborů (59,6 %), nejméně byl tento druh zastoupen na hematoonkologiích/onkologiích (28,4 %) – tabulka 5.
Tab. 5. Rozložení nejčastěji izolovaných kmenů podle odborností v procentech Table 5. Distribution of the most common strains, in percentages, by specialty 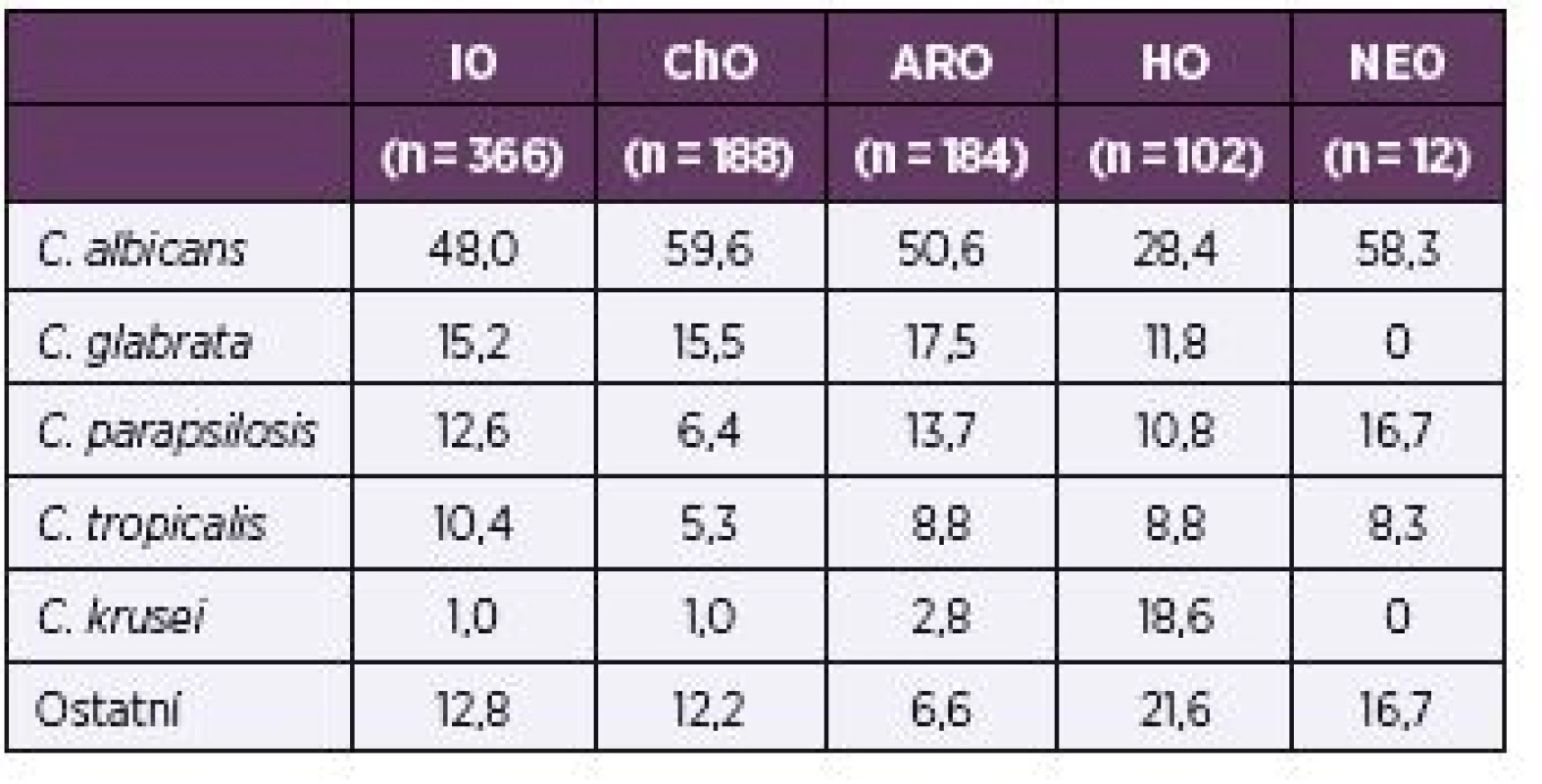
IO – interní obory, ChO – chirurgické obory, ARO – anesteziologicko-resuscitační oddělení, HO – hematoonkologie/onkologie, NEO – neonatologie IO – internal medicine specialties, ChO – surgical specialties, ARO (PACU) – postanesthesia care unit, HO – hemato-oncology/oncology, NEO – neonatology Rozložení vykultivovaných kmenů se během čtyř sledovaných let měnilo jen málo, mírně roste zastoupení non-albicans izolátů (obr. 3).
Obr. 3. Rozložení izolovaných kmenů v letech 2012–2015 Figure 3. Distribution of strains isolated in 2012–2015 
Informaci o předchozí kolonizaci stejným kmenem jako ten, který byl izolován z hemokultury se podařilo získat u 78,8 % pacientů. U zbývajících buď nebyl do 10 dnů před pozitivní hemokulturou odebrán žádný materiál pro zjištění osídlení kvasinkami, nebo tato informace nebyla k dispozici. Většina z těch, u kterých byly odběry provedeny, byla kolonizována stejným druhem kvasinky, který byl posléze nalezen v krvi (65,0 % vs. 35,0 %), a to obvykle jen na jednom místě (tab. 6).
Tab. 6. Kolonizace stejným kmenem, který byl izolován z hemokultury (jen vyšetření pacienti) Table 6. Colonization with the same strain as that isolated from blood culture (examined patients only) 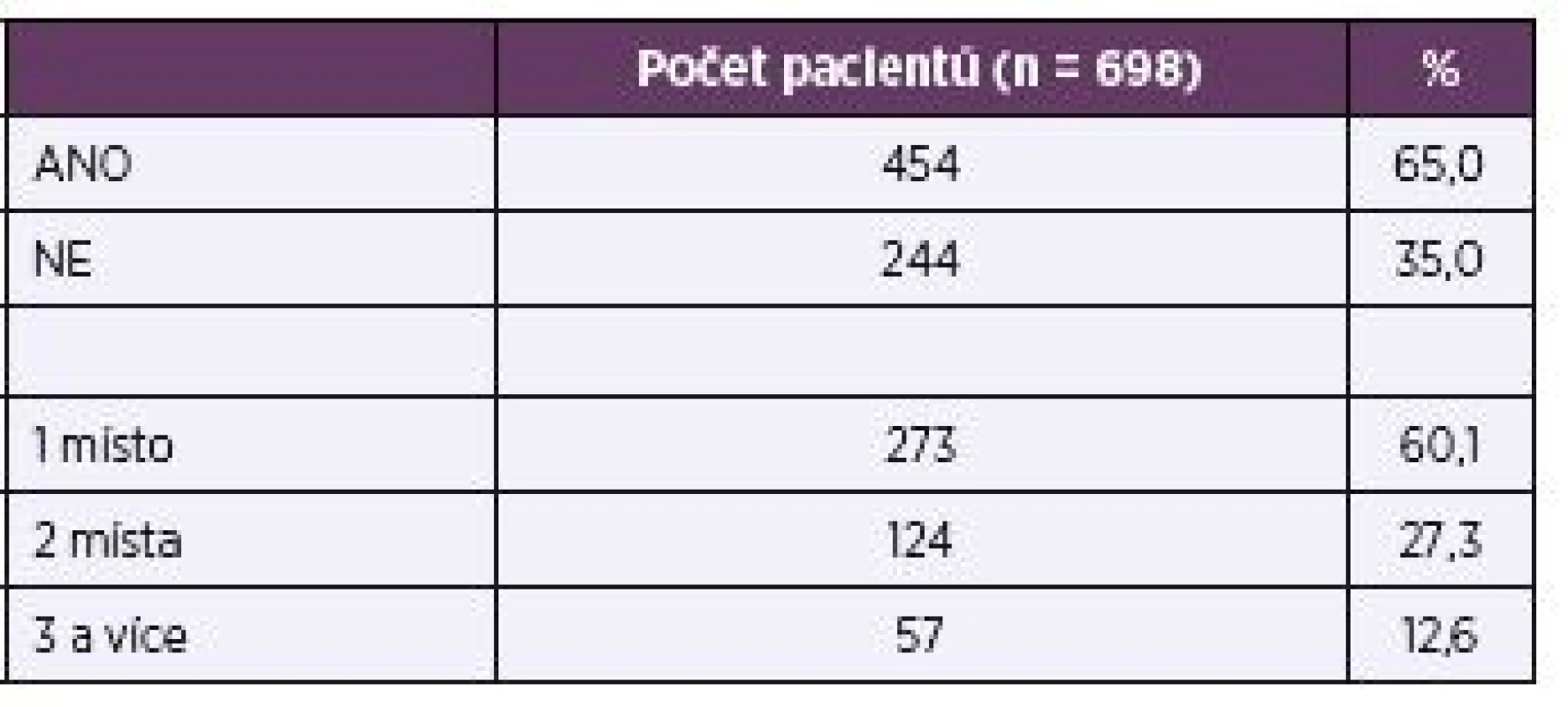
U 56 kmenů izolovaných z hemokultur od pacientů zařazených do tohoto souboru byla vyšetřena citlivost k 8 antimykotikům standardní mikrodiluční metodikou EUCAST. Přesnou polovinu testovaných kmenů tvořila C. albicans, následovaná C. glabrata (18,0 %) a C. tropicalis (14,0 %). Podle očekávání se jako nejproblematičtější jevila C. glabrata a její rezistence k azolům. Minimální inhibiční koncentrace u echinokandinů a amfotericinu B byly většinou nízké (tab. 7).
Tab. 7. Distribuce MIC u testovaných kmenů Table 7. Distribution of MICs for the strains tested 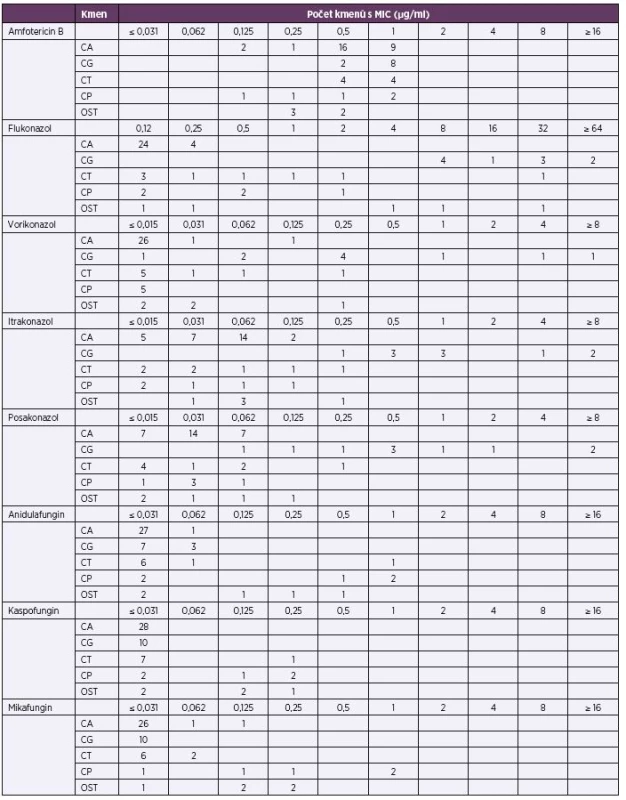
CA – C. albicans (n = 28), CG – C. glabrata (n = 10), CT – C. tropicalis (n = 8), CP – C. parapsilosis (n = 5), OST – ostatní C. guilliermondii (n = 2), C. lusitaniae (n = 1), C. dubliniensis (n = 1), Debaromyces sp. (n = 1) CA – C. albicans (n = 28), CG – C. glabrata (n = 10), CT – C. tropicalis (n = 8), CP – C. parapsilosis (n = 5), OST – others C. guilliermondii (n = 2), C. lusitaniae (n = 1), C. dubliniensis (n = 1), and Debaromyces sp. (n = 1) Posledním sledovaným parametrem byla předchozí infekce toxigenním C. difficile, což by se mohlo uplatnit jako rizikový faktor pro vznik invazivní kandidózy. U 474 (53,5 %) pacientů vyšetření buď nebylo provedeno (lze tedy předpokládat, že nemocný neměl klinické příznaky klostridiové kolitidy), anebo informace o výsledku nebyla k dispozici. Ze zbylé části souboru bylo 11,1 % pacientů pozitivních, nicméně z celkového počtu nemocných s kandidémií bylo pozitivních pouze 5,1 %.
DISKUSE
O epidemiologii invazivních kandidových infekcí na území České republiky byly v minulosti publikovány jen dvě práce [17, 18], což bylo hlavním impulsem pro vznik tohoto článku.
Nicméně je nutné si uvědomit, že výše prezentované výsledky nabízejí pohled na toto onemocnění pouze ze strany mikrobiologických laboratoří a neposkytují údaje o dalších závažných skutečnostech, jako jsou zvolená antimykotická terapie, použitá profylaxe, účinek léčby, mortalita apod.
Na úvod můžeme konstatovat, že při vzniku kandidémie zřejmě nehraje roli pohlaví pacientů. Pozorovali jsme mírnou převahu mužů (52,9 % mužů, 47,1 % žen) a v tomto se nelišíme od podobných studií – např. 51,8 % mužů ve skupině 137 kandidémií uvádějí brazilští autoři, 58 % mužů z 204 kandidémií zaznamenal Bassetti [10, 19].
Dalším sledovaným parametrem byl typ základního onemocnění. Jsme si vědomi, že diagnóza na žádance o mikrobiologické vyšetření nemusí zcela správně odrážet aktuální klinický stav pacienta. Nicméně nejčastěji byla uváděna některá z chorob gastrointestinálního traktu (více než v pětině případů), což by mohlo korespondovat s tím, že u invazivních kandidóz se za pravděpodobný zdroj kvasinek považuje právě gastrointestinální trakt a jeho porušení či nefunkčnost usnadní přechod mikroorganismů do krve. Podobné výsledky prezentuje i Berdal (35,0 % GIT) nebo Doi (18,9 % GIT) [10, 20].
K rizikovým faktorům pro vznik kandidémie patří pobyt na JIP a skoro 70 % pacientů z našeho souboru bylo v době stanovení diagnózy umístěno na jednotkách intenzivní péče. Naproti tomu globální analýza dat provedená za roky 2008–2009 v 79 centrech Ameriky a Evropy (1752 kandidémií) uvádí jen 44,5 % pacientů na JIP [21]. V práci Colomba et al. (1 392 epizod kandidémie) byly z jednotek intenzivní péče odeslány vzorky od 46,5 % pacientů a tato skupina měla ve srovnání se zbylými statisticky významnější mortalitu [6]. Studie francouzských autorů, shrnující data od 2 507 pacientů, udává podobný poměr – 48,1 % nemocných s kandidémií bylo v době diagnózy hospitalizováno na JIP a stejně jako v předchozí práci byla mortalita na JIP vyšší [7]. Asijská roční surveillance kandidémií z 25 nemocnic v různých státech upozorňuje na pouhý 23% výskyt kandidémií na JIP. Poukazuje tak na možný posun kandidémií z JIP směrem k všeobecné nemocniční populaci [22]. Vzhledem k tomu, že všechny citované práce byly multicentrické (stejně jako naše) je otázkou, zda vysoké procento pacientů na JIP v námi sledovaném vzorku populace způsobil jejich horší klinický stav, nebo zda se nějak výrazněji liší klinická kritéria pro překlad z běžného oddělení u nás a v zahraničí. Dalším důvodem pro odlišné procentuální počty kandidémií na JIP může být metodika počítání lůžek. Podle ECDC (European Centre for Disease Prevention and Control) se lůžkem na JIP rozumí lůžko s mechanickou ventilací, což neodpovídá praxi v České republice.
Naopak ve shodě s našimi výsledky je fakt, že autoři nenalezli významné rozdíly mezi JIP a non-JIP v zastoupení jednotlivých kvasinkových druhů [7, 21].
Celková incidence kandidémií v ČR v letech 2012–2015 je podle našich výsledků 0,40/1 000 hospitalizovaných pacientů. Arendrup cituje několik epidemiologických prací z Evropy či Ameriky a uvádí incidenci 0,19–2,30 [23]. Podobně italští autoři v období 2010–2014 pozorovali ve své nemocnici (monocentrická studie, 22 oddělení včetně 5 JIP) 1,5 infekcí v přepočtu na 1 000 přijatých pacientů [24]. Mnohem vyšší čísla lze pochopitelně očekávat v případech, kdy se studie týkají pouze JIP. Aguilar et al. uvádějí incidenci až 19,1 případů/1 000 přijatých pacientů a podobně vychází i práce amerických (10,0 kandidémií/1 000 přijatých) nebo indických autorů (6,5 kandidémií/1 000 přijatých) [25, 26, 27]. Z publikovaných údajů můžeme usoudit, že incidence kandidémií se liší jednak geograficky a jednak podle skladby zařazených pacientů. Poměrně vysoká incidence kandidémií v IKEM je logickým vyústěním toho, že IKEM coby vysoce specializované centrum soustřeďuje pacienty z celé republiky, kteří jsou překládáni z jiných zdravotnických zařízení. Mnohdy jde o pacienty komplikované, s řadou invazivních vstupů, pacienty, kteří jsou předléčeni celou řadou antibiotik. Ve srovnatelných velkých zdravotnických zařízeních s podobnou skladbou pacientů (FN Plzeň, FN Brno, VFN Praha, FN Královské Vinohrady) je incidence kandidémií podobná.
V zastoupení jednotlivých kvasinkových druhů nejsou zásadní rozdíly. Stejně jako v naší studii je ve většině publikovaných prací na prvním místě uvedena C. albicans a liší se až pořadí dalších kandid. Bassetti et al. udávají např.větší převahu C. albicans (60,3 % oproti našim 49,7 %), následované C. parapsilosis a C. glabrata (16,7 a 11,8 %) [19]. Ještě výrazněji převládá C. albicans v Norsku (77,0 %) [20]. Naopak v Brazílii tvoří C. albicans jen 34,3 % z celkového počtu izolátů, dalším nejčetnějším druhem je C. parapsilosis (24,1 %) a C. tropicalis (15,3 %) [10]. V souhrnné práci týkající se Severní Ameriky (2019 kandidémií) je C. albicans zastoupena ve 45,6 %, C. glabrata ve 26,0 % a C. parapsilosis v 15,7 % [13].
Spíše výjimečně se na prvním místě ocitne jiná kvasinka, jako např. C. tropicalis (28,6 %) v práci čínských autorů [28].
Z výše uvedeného je zřejmé, že rozložení různých kandidových druhů ovlivňuje hlavně lokální epidemiologická situace a našim výsledkům se nejvíce blíží Severní Amerika.
V podmínkách České republiky může být zajímavé srovnání s epidemiologickou studií Hamala et al. z let 2000 až 2006. Jejich práce analyzuje 1 141 kandidémií s obdobnou skladbou pacientů, jako v této práci (v obou případech přispívala daty skoro stejná pracoviště). Lze tedy říci, že zastoupení C. albicans u nás se za 10 let takřka nezměnilo (50,0 % vs. 49,7 %), na druhé místo se ze čtvrtého přemístila C. glabrata a C. parapsilosis se posunula na třetí místo [18]. Obdobně i Buchta et al. udávají ve 48,0 % jako původce infekce C. albicans [19].
Je možné se domnívat, že progresivní roli C. glabrata v současné době má na svědomí především selekce rezistentních kmenů působením azolové profylaxe, která se z hematoonkologií postupně dostává i na jiná oddělení.
Vliv profylaktické či empirické léčby se zřejmě odráží i na rozložení kvasinkových druhů podle jednotlivých odborností. V shodě s literaturou jsme pozorovali výraznou převahu non-albicans druhů na hematoonkologiích a onkologiích (71,6 %), na rozdíl od interních a chirurgických oborů, kde se původci infekce dělí zhruba na polovinu mezi C. albicans a non-albicans [13].
Co se týče dětí, Steinbach et al. analyzovali 227 kandidémií z evropských i amerických dětských center a jako nejčetnější etiologické agens označili C. albicans (44,0 %), následovanou C. parapsilosis (23,0 %) a C. glabrata (10,0 %) [29]. V našem případě (75 dětí), je zastoupení C. albicans vyšší (60,0 %) a na druhém místě se shodně objevuje C. parapsilosis.
Vztah mezi mikroflórou osídlující sliznice GIT a celkovým zdravotním stavem člověka je v poslední době velmi diskutované téma a kolonizace kvasinkami je už dlouho dobu považována za rizikový faktor pro rozvoj kandidémie [30, 31]. Nicméně přímý vztah mezi kolonizačními a invazivními kmeny je stále přezkoumáván a vzhledem k nejednoznačnosti výsledků není obecně doporučeno reagovat na přítomnost kvasinek na sliznicích profylaktickou či empirickou léčbou [32]. V naší studii bylo sice 65,0 % pacientů kolonizováno stejným druhem kvasinky, jaká byla později nalezena v hemokultuře, nicméně potvrzení, že se jedná o identický kmen, by bylo záležitostí dalšího výzkumu za účasti molekulárně biologických metod.
U 56 kmenů izolovaných z hemokultur jsme otestovali citlivost in vitro na osm celkově podávaných antimykotik. Ve shodě se studií Pfallera et al. jsme pozorovali zvýšenou rezistenci C. glabrata k azolům. V našem případě bylo k flukonazolu, posakonazolu a vorikonazolu rezistentních 20,0 %, 33,0 % a 33,0 % z deseti testovaných kmenů, v případě Pfallera 8,8 %, 3,5 % a 10,5 % z 571 kmenů [33]. Zaznamenali jsme 1 kmen C. tropicalis rezistentní k anidulafunginu (MIC = 1 µg/ml). Vzhledem k víceméně náhodnému výběru námi otestovaných kmenů a jejich malému počtu bude samozřejmě pro závazné závěry třeba další, systematičtější studie.
Z námi předkládaných výsledků dále nevyplývá, že by předchozí přítomnost toxigenního kmene C. difficile byla u pacientů s kandidémií výrazně častá. Pozitivních bylo pouze 46 pacientů (5,1 %) z celkového počtu. Russo et al. analyzovali skupinu 140 pacientů s klostridiovým průjmem a 35 z nich (25,0 %) mělo posléze pozitivní kultivaci kandidy z hemokultury [11]. Vzhledem k tomu, že design jejich studie je odlišný, nelze tato data příliš dobře srovnat.
ZÁVĚR
Z našich dat, byť ne zcela komplexních, můžeme vyvodit několik závěrů. Předně ten, že počet kandidémií v ČR nemá zásadně klesající tendenci a uvedená infekce tak zůstává i nadále významným problémem našeho zdravotnictví. Její incidence se v jednotlivých nemocnicích poměrně výrazně lišila, pravděpodobně v důsledku skladby pacientů a léčebných strategií. Dále je třeba mít na vědomí, že sledování lokální epidemiologické situace, a to včetně citlivosti či rezistence k antimykotikům a rizikových faktorů, může pomoci k časnému zahájení účinné terapie a tím ke zlepšení prognózy pacientů.
Do redakce došlo dne 18. 4. 2017.
Adresa pro korespondenci:
Mgr. Iva Kocmanová
Oddělení klinické mikrobiologie FN Brno
Jihlavská 20
625 00 Brno
e-mail: kocmanova.iva@fnbrno.cz
Zdroje
1. Wisplinghoff H, Cornely OA, Moser S, et al. Outcomes of nosocomial bloodstream infections in adult neutropenic patients: a prospective cohort and matched case-control study. Infect Control Hosp Epidemiol 2003;24(12):905–911.
2. Wisplinghoff H, Seifert H, Tallent SM, et al. Nosocomial bloodstream infections in pediatric patients in United States hospitals: epidemiology, clinical features and susceptibilities. Pediatr Infect Dis J 2003;22(8):686–691.
3. Wisplinghoff H, Bischoff T, Tallent SM, et al. Nosocomial bloodstream infections in US hospitals: analysis of 24,179 cases from a prospective nationwide surveillance study. Clin Infect Dis 2004;39(3):309–317.
4. Süner A, Karaoğlan I, Mete AO, et al. Assessment of bloodstream infections and risk factors in an intensive care unit. Turk J Med Sci 2015;45(6):1243–1250.
5. Berenger BM, Doucette K, Smith SW. Epidemiology and risk factors for nosocomial bloodstream infections in solid organ transplants over a 10-year period. Transpl Infect Dis 2016;18(2):183–190.
6. Colombo AL, Guimarães T, Sukienik T, et al. Prognostic factors and historical trends in the epidemiology of candidemia in critically ill patients: an analysis of five multicenter studies sequentially conducted over a 9-year period. Intensive Care Med 2014;40(10):1489–1498.
7. Lortholary O, Renaudat C, Sitbon K, et al. Worrisome trends in incidence and mortality of candidemia in intensive care units (Paris area, 2002-2010). Intensive Care Med 2014;40(9):1303–1312.
8. Bouza E, Muñoz P. Epidemiology of candidemia in intensive care units. Int J Antimicrob Agents 2008;32 Suppl 2:S87–91.
9. Garnacho-Montero J, Díaz-Martín A, Cayuela-Dominguez A. Management of invasive Candida infections in non-neutropenic critically ill patients: from prophylaxis to early therapy. Int J Antimicrob Agents 2008;32 Suppl 2:S137–141.
10. Doi AM, Pignatari AC, Edmond MB, et al. Epidemiology and Microbiologic Characterization of Nosocomial Candidemia from a Brazilian National Surveillance Program. PLoS One 2016;11(1):e0146909.
11. Russo A, Falcone M, Fantoni M, et al. Risk factors and clinical outcomes of candidaemia in patients treated for Clostridium difficile infection. Clin Microbiol Infect 2015;21(5):493.e491–494.
12. Falagas ME, Roussos N, Vardakas KZ. Relative frequency of albicans and the various non-albicans Candida spp among candidemia isolates from inpatients in various parts of the world: a systematic review. Int J Infect Dis 2010;14(11):e954–966.
13. Pfaller MA, Diekema DJ. Epidemiology of invasive mycoses in North America. Crit Rev Microbiol 2010;36(1):1–53.
14. Cleveland AA, Farley MM, Harrison LH, et al. Changes in incidence and antifungal drug resistance in candidemia: results from population-based laboratory surveillance in Atlanta and Baltimore, 2008–2011. Clin Infect Dis 2012;55(10):1352–1361.
15. Arendrup MC, Guinea J, Cuenca-Estrella M, et al and the Subcommittee on Antifungal Susceptibility Testing (AFST) of the ESCMID European Committee for Antimicrobial Susceptibility Testing (EUCAST). 2015. EUCAST Method for the determination of broth dilution minimum Inhibitory concentrations of antifungal agents for yeasts version 7.3. (December, 2015).
16. De Pauw B, Walsh TJ, Donnelly JP, et al. Revised definitions of invasive fungal disease from the European Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycoses Study Group (EORTC/MSG) Consensus Group. Clin Infect Dis 2008;46(12):1813–1821.
17. Buchta V, Kolar M, Bergerova T, et al. Výskyt potenciálně patogenních kvasinek v krvi a moči pacientů ve velkých nemocnicích v České republice. Klin Mikrobiol Inf Lék 1998; (4):10–17.
18. Hamal P, Kocmanova I, Jedlickova A, et al. Epidemiological analysis of candidemia in Czech tertiary care hospitals in 2000–2006. J Chemother 2007; 19(Suppl 3):S61–S62
19. Bassetti M, Merelli M, Ansaldi F, et al. Clinical and therapeutic aspects of candidemia: a five year single centre study. PLoS One 2015;10(5):e0127534.
20. Berdal JE, Haagensen R, Ranheim T, et al. Nosocomial candidemia; risk factors and prognosis revisited; 11 years experience from a Norwegian secondary hospital. PLoS One 2014;9(7):e103916.
21. Pfaller MA, Messer SA, Moet GJ, et al. Candida bloodstream infections: comparison of species distribution and resistance to echinocandin and azole antifungal agents in Intensive Care Unit (ICU) and non-ICU settings in the SENTRY Antimicrobial Surveillance Program (2008–2009). Int J Antimicrob Agents 2011;38(1):65–69.
22. Tan BH, Chakrabarti A, Li RY, et al. Incidence and species distribu-tion of candidaemia in Asia: a laboratory-based surveillance study. Clin Microbiol Infect 2015;21(10):946–953.
23. Arendrup MC. Epidemiology of invasive candidiasis. Curr Opin Crit Care 2010;16(5):445–452.
24. Barchiesi F, Orsetti E, Gesuita R, et al. Epidemiology, clinical characteristics, and outcome of candidemia in a tertiary referral center in Italy from 2010 to 2014. Infection 2016;44(2):205–213.
25. Aguilar G, Delgado C, Corrales I, et al. Epidemiology of invasive candidiasis in a surgical intensive care unit: an observational study. BMC Res Notes 2015;8 : 491.
26. Ng K, Schorr C, Reboli AC, et al. Incidence and mortality of sepsis, severe sepsis, and septic shock in intensive care unit patients with candidemia. Infect Dis (Lond) 2015;47(8):584–587.
27. Chakrabarti A, Sood P, Rudramurthy SM, et al. Incidence, characteristics and outcome of ICU-acquired candidemia in India. Intensive Care Med 2015;41(2):285–295.
28. Ma CF, Li FQ, Shi LN, et al. Surveillance study of species distribution, antifungal susceptibility and mortality of nosocomial candidemia in a tertiary care hospital in China. BMC Infect Dis 2013;13 : 337.
29. Steinbach WJ, Roilides E, Berman D, et al. Results from a prospective, international, epidemiologic study of invasive candidiasis in children and neonates. Pediatr Infect Dis J 2012;31(12):1252–1257.
30. León C, Alvarez-Lerma F, Ruiz-Santana S, et al. Fungal colonization and/or infection in non-neutropenic critically ill patients: results of the EPCAN observational study. Eur J Clin Microbiol Infect Dis 2009;28(3):233–242.
31. León C, Ruiz-Santana S, Saavedra P, et al. A bedside scoring system („Candida score“) for early antifungal treatment in nonneutropenic critically ill patients with Candida colonization. Crit Care Med 2006;34(3):730–737.
32. Pappas PG, Kauffman CA, Andes DR, et al. Clinical Practice Guideline for the Management of Candidiasis: 2016 Update by the Infectious Diseases Society of America. Clin Infect Dis 2016;62(4):e1–50.
33. Pfaller MA, Messer SA, Woosley LN, et al. Echinocandin and triazole antifungal susceptibility profiles for clinical opportunistic yeast and mold isolates collected from 2010 to 2011: application of new CLSI clinical breakpoints and epidemiological cutoff values for characterization of geographic and temporal trends of antifungal resistance. J Clin Microbiol 2013;51(8):2571–2581.
Štítky
Alergologie a imunologie Dermatologie Dětská dermatologie Hygiena a epidemiologie Infekční lékařství Mikrobiologie Laboratoř
Článek vyšel v časopiseEpidemiologie, mikrobiologie, imunologie
Nejčtenější tento týden
2018 Číslo 1- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Stillova choroba: vzácné a závažné systémové onemocnění
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
-
Všechny články tohoto čísla
- Virová hepatitida A – séroprevalence a proočkovanost v Jihomoravském kraji
- Human Rhinoviruses A9, A49, B14 and Echovirus 3, 9 among the patients with acute respiratory infection
- Lectins from Eichornia crassipens and Lemna minor may be involved in Vibrio Cholerae El Tor adhesion
- Nozokomiální kandidémie v České republice v letech 2012–2015: výsledky mikrobiologické multicentrické studie
- První záznamy o introdukci invazivního komára Aedes albopictus (Diptera, Culicidae) na území Čech
- Nová definice sepse (Sepsis-3): cíle, přednosti a kontroverze
- West Nile virus (linie 2) v komárech na jižní Moravě – očekávání prvních autochtonních lidských případů
- Opožděné blahopřání MUDr. Milanovi Kubínovi, DrSc., k 90. narozeninám
- Blahopřání k významnému životnímu výročí 95. narozenin RNDr. Evy Aldové, CSc.
- RNDr. Václav Rupeš, CSc. – 80 let
- Vzpomínka na významnou plzeňskou mikrobioložku MUDr. PhMr. Marii Valchovou
- Epidemiologie, mikrobiologie, imunologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Nová definice sepse (Sepsis-3): cíle, přednosti a kontroverze
- Nozokomiální kandidémie v České republice v letech 2012–2015: výsledky mikrobiologické multicentrické studie
- West Nile virus (linie 2) v komárech na jižní Moravě – očekávání prvních autochtonních lidských případů
- Virová hepatitida A – séroprevalence a proočkovanost v Jihomoravském kraji
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



