-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaVliv kyslíku na produkci endotoxinu u bakterií ze skupiny Bacteroides fragilis group izolovaných od pacientů s kolorektálním karcinomem
The effect of oxygen on endotoxin production in bacteria of the Bacteroides fragilis group isolated from patients with colorectal carcinoma
Objective:
The aim of the study was to draw attention to the risk posed by anaerobic bacteria of the Bacteroides fragilis (BAFR) group, isolated particularly from abdominal lesions, and to assess the possible role of these species in colorectal cancer. A correlation has previously been suggested between the detection of the bacteria of the genus Bacteroides in patients on a meat-based diet and intestinal and, in particular, colorectal cancer. Given that the species of the BAFR group are major producers of endotoxins, measurements and statistical analysis of endotoxin production were used to compare the Bacteroides strains isolated from clinical specimens of patients with colon cancer, rectal cancer, and other abdominal lesions.Materials and Methods:
Endotoxin production was detected in bacterial strains of the BAFR group (B. fragilis, B. thetaiotaomicron, B. distasonis, and B. vulgatus) isolated from clinical specimens of patients with rectal cancer, colon cancer, and intestinal cancer and was compared with that in strains from samples of patients with inflammatory conditions (anal abscess, appendicitis, skin abscess, etc.) under anaerobic and microaerophilic (with 5% of oxygen) culture conditions. The production of endotoxins was detected quantitatively using the Pyrosate LAL assay kit (Limulus Amoebocyte Lysate Test, BIOGENIX, CR) in four species of the BAFR group after anaerobic and microaerophilic culture. Five strains of each isolated Bacteroides species from each type of specimens were tested (in total 140 BAFR strains). The amount of endotoxin was given in endotoxin units per ml (EU/ml).Results:
Endotoxin production by bacteria under microaerophilic culture conditions was several times higher in comparison with strictly anaerobic culture.
The difference was statistically significant (F1.269 = 160, p <0.0001). As regards the effect of oxygen on endotoxin production, the amount of endotoxins produced under microaerophilic culture conditions (average 889.1 EU/ml) was 2.5 times as high as that observed under anaerobic culture conditions (358.2 EU/ml), regardless of the bacteroides species and diagnosis. These results suggest that the amount of free oxygen in the environment affects the amount of endotoxin generated by the Bacteroides strains.Conclusion:
The results show that endotoxin production by the Bacteroides strains under microaerophilic culture conditions is several times as high as that under strictly anaerobic culture conditions.KEYWORDS:
Bacteroides fragilis group – endotoxins – colorectal carcinoma
Autoři: D. Chmelař 1,2; M. Hájek 1,3; J. Janečková 4; J. Vobejdová 4; P. Martineková 1; A. Kašíková 1
Působiště autorů: Katedra biomedicínských oborů, Ústav mikrobiologie a imunologie, Lékařská fakulta Ostravské univerzity v Ostravě 1; Referenční laboratoř ČR pro anaerobní bakterie, Lékařská fakulta Ostravské univerzity v Ostravě 2; Centrum hyperbarické medicíny, Městská nemocnice Ostrava 3; Oddělení infekční diagnostiky, Litomyšlská nemocnice, Nemocnice Pardubického kraje 4
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 65, 2016, č. 2, s. 129-135
Kategorie: Původní práce
Souhrn
Cíl práce:
Cílem práce bylo upozornit na závažnost výskytu anaerobních bakterií skupiny Bacteroides fragilis (BAFR) group u lidí, zvláště v klinických materiálech z oblasti břicha, a na zjištění souvislostí s výskytem rakoviny tlustého střeva a konečníku. Již dříve byla vyslovena domněnka o korelaci mezi výskytem bakterií z rodu Bacteroides u pacientů preferujících masitou stravu a rakovinným onemocněním tenkého a především tlustého střeva a konečníku. Vzhledem k tomu, že bakteroidy ze skupiny BAFR group jsou významnými producenty endotoxinů, bylo k porovnání bakterií, izolovaných z různých klinických vzorků pacientů s karcinomem tlustého střeva, rekta a dalšími afekcemi v dutině břišní, použito měření a statistické vyhodnocení tvorby endotoxinů u jednotlivých kmenů izolovaných druhů bakteroidů.Materiál a metody:
Produkce endotoxinů byla stanovena u bakterií ze skupiny BAFR group (B. fragilis, B. thetaiotaomicron, B. distasonis a B. vulgatus), izolovaných z klinického materiálu pacientů s karcinomem rekta, tlustého a tenkého střeva, a porovnána se vzorky pacientů se zánětlivými afekcemi (anální absces, apendicitis, absces kůže) po jejich kultivaci v anaerobním i mikroaerofilním prostředí (s 5 % kyslíku). Tvorba endotoxinů byla prokazována kvantitativně pomocí gelové metody Pyrosate LAL testu (Limulus Amoebocyte Lysate Test, Biogenix, ČR) u 4 druhů bakteroidů ze skupiny BAFR group, kultivovaných v anaerobním a mikroaerofilním prostředí. Ve všech odebraných vzorcích bylo vyšetřeno vždy 5 kmenů každého izolovaného druhu bakteroidů (celkem 140 kmenů BAFR). Množství endotoxinu bylo detekováno v EU/ml – Endotoxin Units.Výsledky:
Produkce endotoxinů u bakterií kultivovaných v mikroaerofilním prostředí byla několikrát vyšší než v případě produkce u bakterií kultivovaných v přísně anaerobním prostředí. Tyto rozdíly v produkci endotoxinů byly statisticky významné ( F1,269 = 160, p < 0,0001). Pokud se týká vlivu kyslíku na produkci endotoxinů, tak produkce endotoxinu byla 2,5 krát vyšší po kultivaci bakteroidů v mikroaerofilních (v průměru 889,1 EU/ml) než v anaerobních (358,2 EU/ml) podmínkách, a to nezávisle na druhu bakteroidu a diagnóze. Tyto výsledky svědčí o tom, že množství volného objemu kyslíku v prostředí má vliv na množství vytvářeného endotoxinu.Závěr:
Výsledky produkce endotoxinů produkovaných těmito bakteriemi svědčí o tom, že produkce endotoxinů u bakterií kultivovaných v mikroaerofilním prostředí byla několikrát vyšší než v případě produkce u těchže bakterií kultivovaných v přísně anaerobním prostředí.KLÍČOVÁ SLOVA:
Bacteroides fragilis group – endotoxin – kolorektální karcinomÚVOD
Nejčastěji izolovanými původci anaerobních infektů u lidí i zvířat jsou bakteroidy ze skupiny Bacteroides fragilis (BAFR) group (B. fragilis, B. distasonis, B. thetaiotaomicron, B. vulgatus, B. ovatus). Jsou primárními vyvolavateli intraabdominálních abscesů. Potenciální patogenní účinek těchto anaerobních patogenů spočívá i ve tvorbě endotoxinů, které spouštějí mechanismus atypické imunitní odpovědi superantigenového typu, která většinou končí septickým šokem a smrtí pacienta. Tyto bakterie mají oproti ostatním bakteroidům a jiným bakteriím navíc důležitý faktor patogenity – endotoxin (lipopolysacharid). Ten vyvolává v hostitelském makroorganismu tvorbu abscesů. Stejně působí samotný purifikovaný endotoxin podaný experimentálním zvířatům. Endotoxiny produkované jinými gramnegativními bakteriemi tuto schopnost nemají. Endotoxiny bakterií BAFR group se vyznačují také silným mitogenním účinkem [4, 11].
Bakterie ze skupiny BAFR group se také mohou podílet na progresi nádorových onemocnění tenkého a tlustého střeva u lidí právě díky produkci svých endotoxinů a specifických metabolických produktů. Z tohoto důvodu bylo prováděno stanovení produkce endotoxinů právě u izolátů bakterií ze skupiny BAFR group získaných u pacientů s diagnózou nádorových onemocnění tenkého a tlustého střeva. Tyto bakterie se vyznačují specifickou tvorbou endotoxinů – lipopolysacharidů (LPS). Tvorba endotoxinů je experimentálně stanovována pomocí LAL testu jak kvalitativně, tak i kvantitativně (v EU/ml). Metoda LAL je založena na schopnosti bakteriálních endotoxinů vytvářet sraženinu, respektive gel v přítomnosti hemolymfy z ostrorepa amerického (Limulus polyphemus) [1].
Bakteroidy rostou v prostředí, kde hodnota redox potenciálu je minimálně – 42 mV při pH = 7. Tato hodnota je nezbytně nutná pro jejich izolaci a kultivaci [15]. Čisté kultury bakteroidů však mohou růst na půdách, jejichž redox potenciál je větší než +100 mV [7]. To svědčí o výrazné aeorotoleranci bakteroidů. Relativní aerotolerance většiny kmenů bakteroidů vůči kyslíku je zajištěna prostřednictvím produkce superoxidismutáz a kataláz. Bacteroides fragilis a Bacteroides distasonis produkují katalázu; u druhů Bacteroides thetaiotaomicron a Bacteroides ovatus produkují katalázu jen některé kmeny. Bacteroides vulgatus katalázu neprodukuje. S ohledem na tuto skutečnost se předpokládá, že relativní aerotolerance bakteroidů ke kyslíku může být jednou z hlavních příčin jejich virulence. Tuto domněnku potvrzuje skutečnost, že většina klinických izolátů bakteroidů jsou producenty kataláz, tedy jsou aerotolerantní, na rozdíl od bakteroidů izolovaných ze stolice. Kataláza katB, produkovaná kmeny Bacteroides fragilis, je vytvářená v pozdní fázi exponenciálního růstu a v kulturách vystavených oxidačnímu stresu po jejich přenesení z anaerobních do aerobních podmínek. Kataláza bakteroidů je homeoprotein, skládající se ze dvou identických bílkovinných podjednotek, každá o hmotnosti přibližně 650 kDa [23]. Kromě kataláz zajišťuje u bakteroidů zvládnutí oxidativního stresu a eliminuje toxické působení peroxidu vodíku dalších 28 bílkovinných látek o molekulové hmotnosti 12–79 kDa [22]. Jestliže je proteosyntéza těchto látek inhibována chloramfenikolem, přežití kmenů Bacteroides fragilis za zvýšené tenze kyslíku je limitováno [21]. Množství genů, které zajišťují produkci těchto látek, je spřaženo s oxidativním stresem.
V případě produkce endotoxinů u fakultativně anaerobních bakterií ze skupiny enterotoxinů ze skupiny Enterobacteriaceae a bakterií s oxidativním metabolismem ze skupiny Pseudomonadaceae byla zjištěna až stonásobně větší produkce endotoxinu než u anaerobních bakterií [10]. Vzhledem k tomu, že bakterie ze skupiny BAFR group mohou růst jak v anaerobním, tak i v anaerobním prostředí, bylo provedeno stanovení produkce endotoxinů u těchto bakterií po jejich kultivaci jak v anaerobním prostředí s nulovým objemem volného kyslíku, tak i v mikroaerofilním prostředí s 5 % volného objemu kyslíku.
MATERIÁL A METODY
Stanovení produkce endotoxinů bylo provedeno u bakterií ze skupiny BAFR group (B. fragilis, B. thetaiotaomicron, B. distasonis, B. vulgatus) izolovaných z klinického materiálu pacientů se 4 rakovinnými diagnózami (karcinom rekta, esovitého tračníku, tlustého a tenkého střeva) a porovnáno se vzorky pacientů se třemi nerakovinnými, zánětlivými afekcemi (anální absces, appendicitida, absces kůže). Ve všech odebraných vzorcích bylo paralelně vyšetřeno 5 kmenů každého izolovaného druhu bakteroidů (celkem 140 kmenů BAFR) po jejich kultivaci v anaerobním a mikroaerofilním prostředí. Testované kmeny B. fragilis, B. thetaiotaomicron a B. distasonis produkovaly katalázu. Kmeny Bacteroides vulgatus katalázu neprodukovaly. Kmeny bakterií ze skupiny Bacteroides fragilis group pocházely ze spádové oblasti Zdravotního ústavu se sídlem v Ostravě (regiony Moravskoslezského kraje) a z nemocničních oddělení Litomyšlské nemocnice, a.s. (Litomyšl, Polička, Svitavy).
Izoláty
Klinický materiál byl očkován klasickým postupem na povrch pevného Wilkins-Chalgrenova kultivačního média (Oxoid CM 619) a následně rozočkován křížovým roztěrem. Do hlavní očkovací čáry byly nakladeny disky sycené neomycinem (koncentrace 50 µg/ml) a nalidixinem (koncentrace 30 µg/ml) kvůli odstínění nežádoucí aerobní mikrobioty. Kultivace probíhala v anaerobní atmosféře (80 % dusíku, 10 % vodíku a 10 % oxidu uhličitého) v anaerobní stanici MACS 1000 (Don Whitley Scientific, Ltd., VB) a Bactron II. (Shel Lab, Sheldon Manufacturing, Inc.USA) a v mikroaerofilní atmosféře (5 % kyslíku, 75 % dusíku, 10 % vodíku a 10 % oxidu uhličitého) v soupravách CAMPY-kult (Mirako, ČR) po dobu 48 hodin při teplotě 36,5 °C. K určení izolovaných anaerobních bakterií ze skupiny BAFR group byly použity identifikační soupravy ANAEROtest 23 (Pliva-Lachema, ČR) a soupravy API 20 A (bioMérieux, Francie).
Stanovení produkce endotoxinů
Tvorba endotoxinů byla prokazována kvantitativně pomocí gelové metody Pyrosate LAL testu se zakomponovaným blokátorem glukanů (tzv. Glucashield) u kmenů bakteroidů ze skupiny BAFR group kultivovaných v anaerobním a v mikroaerofilním prostředí [9]. Množství endotoxinu bylo detekováno v EU/ml – Endotoxin Units.
Statistické zpracování
Data obsahu množství endotoxinu byla analyzována zobecněným lineárním modelem (GLM). Jelikož se rozptyl zvětšoval s průměrem, místo normálního rozložení bylo použito gamma rozložení. Maximální model, jenž obsahoval interakci dvou kategorických proměnných (diagnóza a druh bakterie), byl postupně zjednodušován. Pro porovnání byl použit F-test. Rozdíly mezi kategoriemi v minimálním modelu byly testovány post hoc použitím t-testu [3]. Analýza dat byla provedena v prostředí R (R Development Core Team) [20]. Data byla analyzována zobecněným lineárním modelem s gamma rozložením, jelikož se rozptyl zvětšoval se střední hodnotou. Lineární prediktor zahrnoval trojnou interakci mezi diagnózou, bakteroidem a kultivací. Maximální model byl zjednodušen odstraněním nevýznamných komponent (konkrétně trojné interakce a dvojných interakcí kultivace s ostatními faktory) a sloučením podobných úrovní faktoru diagnóza. Porovnání mezi úrovněmi sledovaných faktorů byla uskutečněna pomocí kontrastů. Kvalita výsledného modelu byla prověřena použitím diagnostických nástrojů. Analýza dat byla provedena v prostředí R [20].
VÝSLEDKY A DISKUSE
Výsledky stanovení produkce endotoxinů u bakterií BAFR group pomocí gelové metody Pyrosate jsou uvedeny v tabulkách 1–4. Ukázalo se, že vliv trojné interakce (KULTIVACE:BAKTEROID:DIAGNÓZA) a dvou dvojných (KULTIVACE:BAKTEROID a KULTIVACE:DIAGNÓZA) nebyl významný. Produkce endotoxinu tak byla významně ovlivněna kultivací (GLM, F1,269 = 160, p < 0,0001) a druhem bakteroidu v interakci s diagnózou (GLM, F18,251 = 3,4, p < 0,0001, graf 1). Pokud jde o typ kultivace, byla produkce endotoxinu 2,5krát vyšší v mikroaerofilních (v průměru 889,1 EU/ml) než v anaerobních (358,2 EU/ml) podmínkách, nezávisle na druhu bakteroida a diagnóze.
Tab. 1. Produkce endotoxinů u bakterií BAFR group izolovaných ze vzorků od nemocných s diagnózou karcinomů kultivovaných za anaerobních podmínek, metoda Pyrosate Table 1. Endotoxin production by bacterial strains of the BAFR group, isolated from clinical specimens of patients diagnosed with colorectal cancer, under anaerobic culture conditions, Pyrosate LAL assay 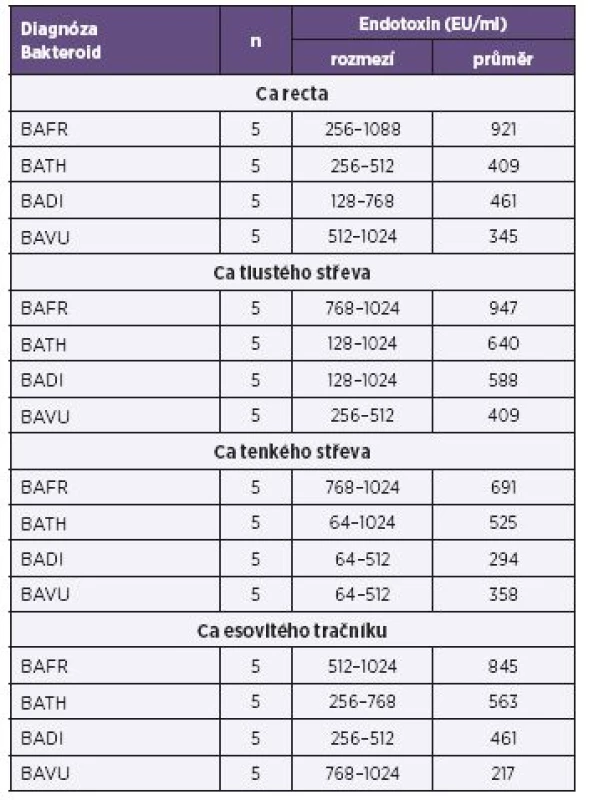
Vysvětlivky: BAFR – Bacteroides fragilis, BATH – Bacteroides thetaiotaomicron, BADI – Bacteroides distasonis, BAVU – Bacteroides vulgatus, Ca – karcinom Note: BAFR: Bacteroides fragilis; BATH: Bacteroides thetaiotaomicron; BADI: Bacteroides distasonis; BAVU: Bacteroides vulgatus; Ca: cancer Tab. 2. Produkce endotoxinů u bakterií BAFR group izolovaných ze vzorků od pacientů s diagnózou zánětlivých afekcí kultivovaných za anaerobních podmínek, metoda Pyrosate Table 2. Endotoxin production by bacterial strains of the BAFR group, isolated from clinical specimens of patients diagnosed with inflammatory, under anaerobic culture conditions, Pyrosate LAL assay 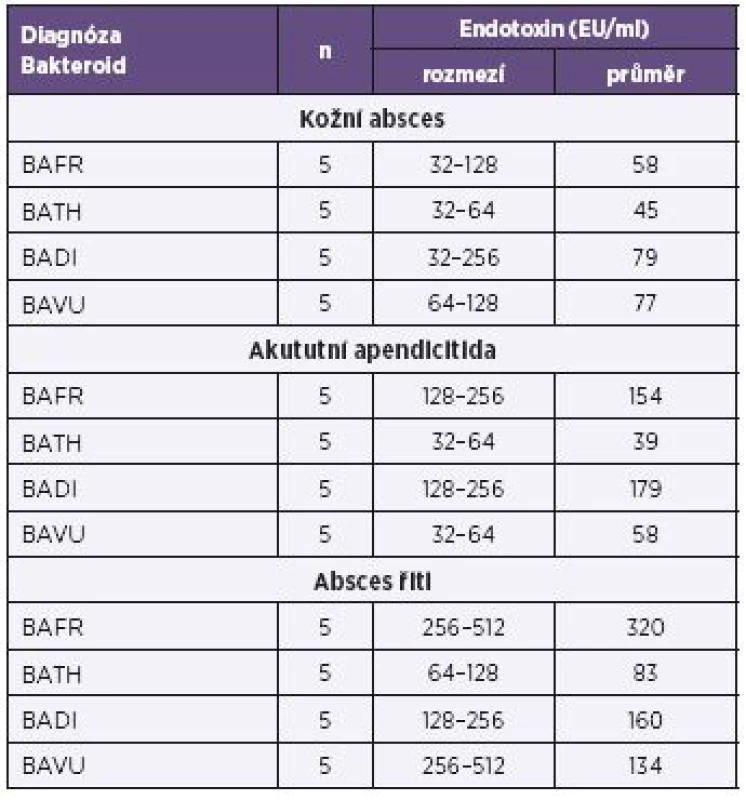
Vysvětlivky: BAFR – Bacteroides fragilis, BATH – Bacteroides thetaiotaomicron, BADI – Bacteroides distasonis, BAVU – Bacteroides vulgatus Note: BAFR: Bacteroides fragilis; BATH: Bacteroides thetaiotaomicron; BADI: Bacteroides distasonis; BAVU: Bacteroides vulgatus Tab. 3. Produkce endotoxinů u bakterií BAFR group izolovaných ze vzorků od nemocných s diagnózou karcinomů kultivovaných za mikroaerofilních podmínek, metoda Pyrosate Table 3. Endotoxin production by bacterial strains of the BAFR group, isolated from clinical specimens of patients diagnosed with cancers, under microaerofill culture conditions, Pyrosate LAL assay 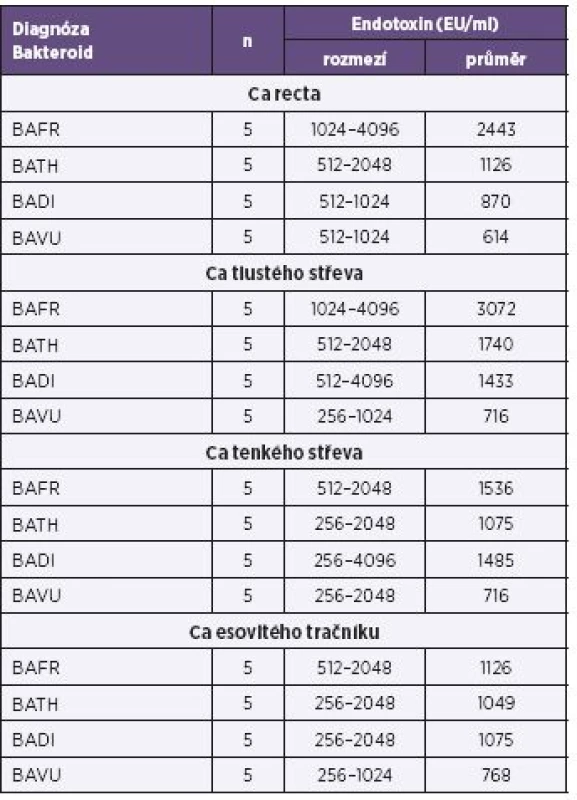
Vysvětlivky: BAFR – Bacteroides fragilis, BATH – Bacteroides thetaiotaomicron, BADI – Bacteroides distasonis, BAVU – Bacteroides vulgatus, Ca – karcinom Note: BAFR: Bacteroides fragilis; BATH: Bacteroides thetaiotaomicron; BADI: Bacteroides distasonis; BAVU:Bacteroides vulgatus; Ca: cancer Tab. 4. Produkce endotoxinů u bakterií BAFR group izolovaných ze vzorků od pacientů s diagnózou zánětlivých afekcí kultivovaných za mikroaerofilních podmínek, metoda Pyrosate Table 4. Endotoxin production by bacterial strains of the BAFR group, isolated from clinical specimens of patients diagnosed with cancers, under microaerofill culture conditions, Pyrosate LAL assay 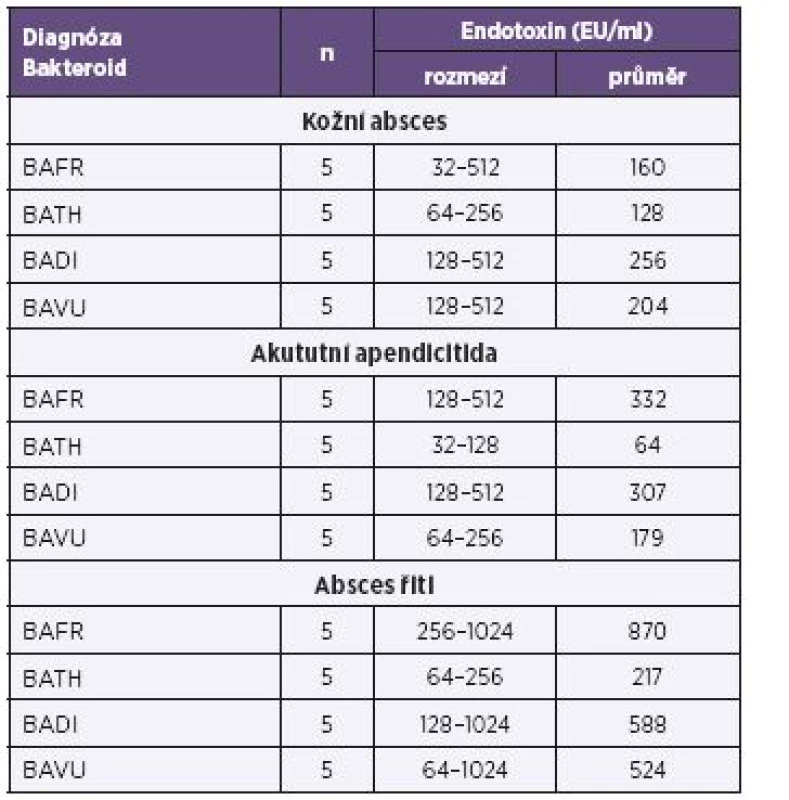
Vysvětlivky: BAFR – Bacteroides fragilis, BATH – Bacteroides thetaiotaomicron, BADI – Bacteroides distasonis, BAVU – Bacteroides vulgatus Note: BAFR: Bacteroides fragilis; BATH: Bacteroides thetaiotaomicron; BADI: Bacteroides distasonis; BAVU: Bacteroides vulgatus Graf 1. Porovnání průměrné produkce endotoxinu u čtyř bakteroidů a 7 diagnóz, metoda Pyrosate Fig. 1. Comparison of average endotoxin production by four Bacteroides species isolated from seven conditions, Pyrosate LAL assay 
Pokud jde o vliv diagnózy, byla produkce endotoxinu podobná pro všechny bakteroidy u diagnóz Ca rektum a Ca tlusté střevo (kontrast, p > 0,5). Podobná produkce byla zjištěna u všech bakteroidů s diagnózami Ca tenké střevo a Ca esovitý tračník (kontrast, p > 0,5). Tyto dvě skupiny (rektum + tlusté střevo versus tenké střevo + tračník) se mezi sebou významně nelišily (kontrast, p = 0,15). U všech karcinogenních diagnóz byla produkce endotoxinu významně vyšší než u nekarcinogenních diagnóz (kontrasty, p < 0,00). Mezi třemi nekarcinogenními diagnózami byl významný rozdíl v produkci endotoxinu čtyř bakteroidů (kontrasty, p < 0,0001): nejvyšší produkce napříč všemi bakteroidy byla u nekarcinogenních diagnóz u kmenů izolovaných z abscesů řiti.
Pokud jde o bakteroidy, jejich produkce endotoxinu byla významně odlišná pro všechny diagnózy (kontrasty, p < 0,0001). Nejvyšší produkci v průměru napříč všemi diagnózami měl B. fragilis, pak B. distasonis, B. thetaiotaomicron a nejmenší B. vulgatus.
Produkce endotoxinů u bakterií BAFR group zjištěné pomocí LAL testu svědčí o tom, že bakterie BAFR group izolované z rakovinných diagnóz by mohly sehrávat důležitou roli při vzniku a rozvoji rakovinných onemocnění tenkého a tlustého střeva u lidí [10]. Česká republika zaujímá vedoucí postavení ve světových statistikách incidence rakovinných onemocnění tenkého a tlustého střeva. Jen kolorektálním karcinomem (KRCA) je v ČR ročně postiženo kolem 8 000 osob a asi 5 000 osob na tuto chorobu umírá [20].
Řada autorů poukázala na skutečnost, že vrozená imunitní odpověď, zprostředkovávaná vazbou bílkovinných receptorů typu LBP na endotoxiny střevních bakterií, vede nejenom k eliminaci patogenních účinků mikroorganismů přítomných ve střevě, ale také se výrazným způsobem může podílet na rozvoji maligních onemocnění gastrointestinálního traktu [15, 18]. Během těžkých chronických infekcí, jakými jsou chronické gastroenteritidy vyvolávané helikobaktery v žaludku, idiopatická zánětlivá onemocnění střevní sliznice a tvorba abscesů, se mohou reparační procesy hojení zvrhnout v rakovinné bujení. Takovým způsobem se může vrozená obranyschopnost imunitního systému, LBP a TLR4 bílkovinné receptory a jimi zprostředkované signální dráhy významným způsobem podílet na progresi rakovinných onemocnění střevní sliznice tenkého a tlustého střeva. Spojovacím článkem mezi vrozenou imunitní reakcí zprostředkovávanou TLR4 proteiny a maligními procesy gastrointestinálního traktu může být aktivace nukleárního faktoru – kappa B a cyklooxygenázy-2 [2, 5].
Celou polovinu veškeré mikrobioty v tlustém střevě zastupují anaerobní gramnegativní bakterie, převážně bakterie ze skupiny BAFR group [9]. Výsledky práce autorů, zabývajících se možným podílem bakterií ze skupiny BAFR group na vzniku a progresi anaerobních infekcí ve střevě a jejich vlivem na rozvoj nádorových onemocnění tenkého a tlustého střeva, svědčí o tom, že dominantní úlohu hrají v tomto procesu především kmeny Bacteroides fragilis [10, 19]. Jejich práce svědčí o tom, že kmeny Bacteroides fragilis, tedy kmeny s velkou produkcí lipopolysacharidu, adherují mnohem lépe ke slizničnímu epitelu střeva než neopouzdřené kmeny Bacteroides fragilis a také ostatní druhy bakteroidů z této skupiny bakterií. Naprostá převaha kmenů ze skupiny BAFR group, izolovaných ze všech druhů klinických materiálů, zejména u maligních onemocnění, tento předpoklad potvrdila [10, 19].
Naše výzkumy potvrdily výsledky prací mnoha autorů, poukazující na závislost mezi přítomností anaerobních bakterií ze skupiny BAFR group a vznikem a případnou progresí rakovinných onemocnění tenkého a tlustého střeva u lidí. Bakteroidy ze skupiny BAFR group, izolované z rakovinných diagnóz, produkovaly statisticky významně větší množství endotoxinu než tytéž bakteroidy, izolované z nerakovinných diagnóz. Jakkoli je tento předpoklad překvapivý a zároveň i odvážný, je podmíněn a podložen celou řadou dalších faktorů. Bakterie ze skupiny BAFR group jsou bakteriemi hnilobného rozkladu. Způsobují rozklad bílkovin za vzniku četných meziproduktů, převážně histaminového typu (aminy, putresciny, kadaveriny). Již dříve byla prokázána korelace mezi výskytem těchto bakterií u pacientů preferujících masitou stravu a rakovinným onemocněním tenkého a především tlustého střeva a konečníku [19, 25]. Přítomnost těchto bakterií v tenkém i v tlustém střevě je podmíněna konzumací převážně masité stravy. Čím více masité stravy je konzumováno, tím více anaerobních bakterií bakterií ze skupiny BAFR group se podílí na jejím rozkladu. Tím také dramaticky stoupá množství endotoxinů, které svými antigenními a popř. i karcinogenními účinky mohou vyvolávat nejenom abscesy, ale i karcinomy, popř. urychlovat jejich růst [10].
Na druhé straně je nutné konstatovat, že samotné endotoxiny anaerobních bakterií ze skupiny BAFR group pravděpodobně nejsou samotnými primárními vyvolavateli rakoviny tlustého a tenkého střeva u lidí. Svou roli při tom sehrává také pravděpodobně i celá řada exotoxinů produkovaných kmeny bakteroidů. Z nich především enterotoxiny mohou mít případný vliv na progresi kolorektálního karcinomu [24, 26, 27]. Je třeba mít také na paměti, že lipopolysacharidy vyvolávají buď přímo, nebo zprostředkovaně nekrózu tumorů [28]. To je ale pravděpodobně jen jejich sekundární účinek. Rostoucí nádor, zvláště ve střevě, potřebuje pro svůj růst značné množství živin, kterých je ve střevě dostatek. Velká koncentrace živin, zvláště bílkovinné povahy, znamená také přítomnost velkého množství bakteroidů ze skupiny BAFR group, které se intenzivně množí a produkují velké množství endotoxinu a svými výraznými antigenními a unikátními biologickými účinky, které nebyly prokázány u jiných patogenních bakterií, se podílejí na dalším výrazném oslabení rakovinou již zdecimovaného imunitního systému pacienta, a sehrávají tak významnou roli v progresi těchto již probíhajících rakovinných onemocnění u lidí.
Velice významnou skutečností, ovlivňující růst, přežívání a také patogenitu bakteroidů v lidském tlustém střevě, je jejich aerotolerance. Bakterie ze skupiny BAFR group a i jiné druhy bakteroidů mají schopnost růstu v mikroaerofilním, až téměř aerobním prostředí. Z tohoto důvodu by mělo být revidováno jejich zařazení mezi striktní anaeroby [30]. Aerotolerance bakteroidů sehrává taktéž velice významnou roli při vzniku intraabdominálních abscesů. Intraabdominální abscesy vznikají v peritoneální dutině jako reakce na přítomnost bakterií po perforaci střeva. Jedná se převážně o polymikrobiální infekce, které vyvolává multifaktoriální odpověď hostitelského makroorganismu. Jsou aktivovány makrofágy, které produkují oxid dusný a další kyslíkaté radikály patřící do systému ROS [14]. Predominantní roli v těchto infekcích sehrávají bakterie ze skupiny BAFR group a hlavně jejich kapsulární polysacharidy, vyvolávající intraabdominální abscesy. Tato skutečnost je umožněna rezistencí těchto bakterií na oxidativní stres a taktéž jejich aerotolerancí. Je to zřejmé z toho důvodu, že stejně jako v tlustém střevě, ve kterém tato bakterie tvoří více než 50 % všech bakterií, tak i v peritoneální dutině je relativně dostatek kyslíku. V in vitro prováděných studiích bylo na základě studia specifických bílkovin produkovaných těmito bakteriemi zjištěno, že mobilizace antioxidativních mechanismů na oxidační stres umožňuje těmto bakteriím přežití. Analýza produktů exprese genů, odpovědných za tyto schopnosti, svědčí o tom, že se jedná o rychlou akutní odpověď, která eliminuje primární účinek kyslíkatých radikálů. Tyto studie taktéž ukazují, že to je nezbytné pro vznik krátkodobé i dlouhodobé rezistence vůči oxidačnímu stresu [31]. Transkripční faktor OxyR zprostředkovává tuto odpověď prostřednictvím tvorby několika detoxifikačně ochranných enzymů, které eliminují oxidační aktivitu kyslíkatých radikálů [30]. Tato včasná odpověď je nezbytná pro přežití těchto bakterií v situaci in vivo a pro vytváření intraabdominálních abscesů. Jestliže je OxyR regulon u těchto bakterií vypnut a nekontroluje oxidační stres, jeho funkci často „přebírá“ celá řada enzymatických systémů zajišťujících tzv. metabolickou odpověď na oxidační stres. Tyto specifické enzymy mohou velice účinně podporovat a zajišťovat redukční antioxidační účinek na kyslíkaté radikály a taktéž zajišťují dodatečnou energetickou kapacitu pro vznik této formy rezistence na oxidační stres. Základním předpokladem pro tuto formu metabolické eliminace kyslíkatých radikálů je represe genů, odpovědných za translaci a biosyntézu, která je v korelaci s okamžitou redukcí růstové rychlosti [30].
Aerotolerance a rezistence na oxidační stres, stejně jako schopnost tvorby abscesů, jsou fyziologickou adaptací bakterií ze skupiny BAFR group na jimi obývané, především mikroaerofilní niky, a podporuje jejich šance na přežití v mimostřevním prostředí, eventuálně v distální části tlustého střeva. Bakterie ze skupiny BAFR group mohou po penetraci tlustého střeva migrovat do intraabdominálního prostoru. Schopnost kolonizovat tento prostor je umožněna díky vysoce efektivní odpovědi těchto bakterií na oxidační stres. Velice důležitou roli sehrávají v tomto procesu thioly – thioredoxiny. Ty jsou důležité pro celou řadu buněčných procesů katalyzovaných širokou škálou enzymů a kódovaných antioxidačními thioredoxinovými geny trxA-trxG. Stejnou funkci plní vysoce účinná thioredoxin trxB reduktáza. Pro bakterie ze skupiny BAFR group sehrávají důležitou roli především trxA thioredoxinové geny, které jsou kontinuálně produkovány ve velkém množství bez ohledu na oxidační stres [22].
Aerotolerance výrazným způsobem přispívá k virulenci bakteroidů; umožňuje jim také přežívat s relativně vysokou koncentrací kyslíku mimo tradiční, bezkyslíkaté niky, jakým je např. tenké střevo. Bakterie ze skupiny BAFR group vyvinuly komplexní odpověď na oxidační stres, včetně produkce katalázy, která vede k expresi více než 28 bílkovinných enzymů jako odpověď na přítomnost kyslíku a peroxidu vodíku. Větina genů podmiňujících tuto expresi je regulována prostřednictvím LysR transkripčního OxyR regulátoru. Důležitou roli v tomto mechanismu sehrává na DNA bakteroidů se vázající Dps protein, který zajištuje jak na OxyR závislou, tak i na OxyR nezávislou regulaci oxidačního stresu [6]. U většiny aerobních druhů bakterií chrání DNA právě Dps proteiny před oxidačními účinky kyslíkatých radikálů.
Výsledky produkce endotoxinů produkovaných těmito bakteriemi svědčí také o tom, že produkce endotoxinů u těchto bakterií kultivovaných v mikroaerofilním prostředí byla mnohonásobně vyšší než v případě produkce týchž bakterií kultivovaných v přísně anaerobním prostředí. Tyto rozdíly v produkci endotoxinů byly statisticky významné (F1,269 = 160, p < 0,0001). Produkce endotoxinu byla 2,5krát vyšší po kultivaci v mikroaerofilních (v průměru 889, 1 EU/ml) než v anaerobních (358, 2 EU/ml) podmínkách, nezávisle na druhu bakteroida a diagnóze. Tyto výsledky svědčí o tom, že množství volného objemu kyslíku v kultivačním prostředí má vliv na množství vytvářeného endotoxinu.
Významnou roli při produkci endotoxinů v kyslíkatém prostředí sehrávají enzymy vyznačující se katalytickými účinky. Dominantní roli zde pravděpodobně sehrává enzym kataláza. Výmluvně o tom svědčí skutečnost, že produkce endotoxinů u bakteroidů Bacteroides vulgatus neprodukujících katalázu [10] byla v průměru 3,5krát menší než produkce týchž kmenů Bacteroides vulgatus produkujících katalázu.
ZÁVĚR
Výsledky produkce endotoxinů produkovaných těmito bakteriemi svědčí o tom, že produkce endotoxinů u těchto bakterií kultivovaných v mikroaerofilním prostředí byla několikrát vyšší než v případě produkce u bakterií kultivovaných v přísně anaerobním prostředí. Tyto rozdíly v produkci endotoxinů byly statisticky významné (F1,269 = 160, p < 0,0001). Pokud se týká vlivu kyslíku na produkci endotoxinů, tak produkce endotoxinu byla 2,5krát vyšší po kultivaci bakteroidů v mikroaerofilních (v průměru 889,1 EU/ml) než v anaerobních (358,2 EU/ml) podmínkách, nezávisle na druhu bakteroidu a diagnóze. Tyto výsledky svědčí o tom, že množství volného objemu kyslíku v prostředí má s největší pravděpodobností vliv na množství vytvářeného endotoxinu.
Do redakce došlo dne 22. 9. 2015.
Adresa pro korespondenci:
RNDr. Dittmar Chmelař, Ph.D.
Katedra biomedicínských oborů, Lékařská fakulta, Ostravská univerzita
Syllabova 19
703 00 Ostrava-Zábřeh
e-mail: dittmar.chmelar@osu.cz
Zdroje
1. Bang FA. Bacterial Disease of Limulus polyphemus. Bull J Hopkins Hosp, 1956;98 : 325–330.
2. Čižnár I. Toxíny gramnegatívnych črevných baktérií. Bratislava, VEDA, 1982, 15–69.
3. Crawley, MJ Statistical Computing. An Introduction to data analysis using S-Plus. Chichester, John Wiley and Sons, 2002.
4. Delahooke, DM, Barclay GR, Poxton IR. Tumor necrosis factor induction by an aqueous phenol-extracted lipopolysacchyride complex from Bacteroides species. Infect. Immun., 1995,63 : 840–846.
5. Fukata M, Abreu MT. Role of Toll-like receptors in gastrointestinal malignancies. Oncogene, 2008;27(2):234–243.
6. Gee JM, Rocha ER, Smith CJ. Examination of the Contributions of DPS to the Oxidative Stress response and Pathogenesis of the Oportunistic Pathogen, Bacteroides fragilis. The 9th Biennial Congress of ther Anaerobe Society of Americas, 2008.
7. Goldner M, Mingot M, Emond JP, Dublanchet A. Influence of different levels of redox potential on fermentative products formed by Bacteroides fragilis. Clin Ifect Dis, 1997;25 (Supl.):S147–S150.
8. Chmelař D. Gastrointestinální trakt – zdroj endogenních anaerobních infekcí. Správy klinickej mikrobiológie, 2001, (Supl. A):87–88. ISSN 1335-8219.
9. Chmelař D, Vrtný J. Produkce endotoxinu u bakterií Bacteroides fragilis group ve vztahu k onemocnění karcinomem tlustého střeva a rekta u lidí. Klin Mikrobiol Inf Lek, 2010;16(3):97–102.
10. Joiner KA, McAdam KP, Kasper DL. Lipopolysaccharides from Bacteroides fragilis are mitogenic for spleen cells from endotoxin responder and nonresponder mice. Infec. Immun, 1982;36(3):1139–1145.
11. Kozelská R. Průkaz endotoxinů u patogenních gramnegativních bakterií. Bakalářská práce, Katedra vyšetřovacích metod a lékařské biologie, Zdravotně sociální fakulta, Ostravská univerzita, 2006 : 29–32.
12. Krásová Z, Matušek A, Chmelař D. Hyperbaric oxygenation in the treatment of necrotizing fasciitis. Vnit. Lek, 1992;36 (7):640–644.
13. Lewis CJ, Coby BA. Oxidant production by APCs in response to glycoantigens. The Journal of Immunology, 2007;178 : 36–39.
14. Lien E, Ingalls RR. Toll-like receptors. Critical Care Medicine, 2002;30(1), Suppl:1–11.
15. Matušek A, Martínek L, Chmelař D, Krásová Z. Fournierova gangréna. Rozhledy v chirurgii, 1998;1 : 24–26.
16. Morris JG. Characteristics of anaerobic metabolism. In: Duerden, B. I, Drasar, B. S (eds). Anaerobes in Human Disease., London Edward Arnold, 1991 : 16–37.
17. Muta T, Takeshige K. Essential roles of CD14 and lipopolysaccharide-binding protein for activation of toll-like receptor (TLR)2 as well as TLR4 Reconstitution of TLR2 - and TLR4-activation by distinguishable ligands in LPS preparations. Eur J Biochem, 2001;268(16): 4580–4589.
18. Namavar F, Theunissen EB, Verweij-Van Vught AMJJ. Epidemiology of the Bacteroides fragilis group in the colonic flora of patients with colonic cancer. J Med Microbiol, 1989;29 : 171–176.
19. Petruželka L, Konopásek B. Klinická onkologie. Praha. Karolinum, 2003, ISBN 80-246-0395-0.
20. R Development Core Team. A language and environment for statistical computing. R Foundation for Statistical Computing, 2004, Vienna, Austria. Dostupné na www: < http://www.R-project.org>
21. Reott MA, Rocha ER, Parker AC, Smith CJ. Thioredoxins in Redox Maintenance and Survival During Oxidative Stress of Bacteroides fragilis. The 9th Biennial Congress of the Anaerobe Society of Americas, 2008.
22. Rocha ER, Selby T, Coleman JP, Smith CJ. Oxidative stress response in an anaerobe, Bacteroides fragilis: a role for catalase in protection against hydrogen peroxide. Journal of Bacteriology, 1996;178(23):6895–6903.
23. Rocha ER, Smith CJ. Role of the alkyl hydroperoxide reductase (ahpCF) gene in oxidative stress defense of the obligate Anaerobe Bacteroides fragilis. Journal of Bacteriology, 1999;181(18):5701–5710.
24. Rokosz A, Kruszewska D, Rouyan GS, Meisel-Mikołajczyk F. Detection of endotoxins and enterotoxins of Bacteroides fragilis in culture media. Med Dosw Mikrobiol, 1997; 49 (1–2):61–67.
25. Rokosz A, Meisel-Mikołajczyk F, Malchar C, Nowaczyk M, Górski A. Stimulation of adhesion molecules on vascular endothelium by capsular polysaccharide, lipopolysaccharide and components of lipopolysaccharide from Bacteroides thetaiotaomicron. Med Dosw Mikrobiol, 2000;52(3):275–282.
26. Sears CL. Enterotoxigenic Bacteroides fragilis:a rogue among symbiotes. Clin Microbiol Rev, 2009;22(2):349–369.
27. Sears CL, Geis AL, Housseau F. Bacteroides fragilis subverts mucosal biology: from symbiont to colon carcinogenesis. J Clin Invest, 2014;124(10): 4166–4172.
28. Shear M. Chemical Treatment of Tumors IX: reactions of mice with primary subcutaneous tumors. J Natl Cancer Inst, 1944; 4 : 461–476.
29. Smith CJ. The Bacteroides fragilis Oxidative Stress Response During Intra-Abdominal Infections. The 9th Biennial Congress of ther Anaerobe Society of Americas, 2008.
30. Tang YP, Dallas MM, Malamy MH. Characterization of the Bat I (Bacteroides aerotolerance) operon in Bacteroides fragilis isolation of a B. fragilis mutant with reduced aerotolerance and impaired growth in in vivo model systems. Mol Microbiol, 1999;32 : 139–149.
31. Vangelakos CG, Rhee K-J, Wu S, Gan C, Sears CL. Bacteroides fragilis and Other Bacteroides Species Demonstrate Marked Aerotolerance. The 9th Biennial Congress of ther Anaerobe Society of Americas, 2008.
Štítky
Hygiena a epidemiologie Infekční lékařství Mikrobiologie
Článek vyšel v časopiseEpidemiologie, mikrobiologie, imunologie
Nejčtenější tento týden
2016 Číslo 2- Stillova choroba: vzácné a závažné systémové onemocnění
- Jak souvisí postcovidový syndrom s poškozením mozku?
- Diagnostika virových hepatitid v kostce – zorientujte se (nejen) v sérologii
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
-
Všechny články tohoto čísla
- Multiple-locus variable number tandem repeat analýza souboru kmenů Bordetella pertussis v ČR z období 1967–2015: rozšíření varianty adaptované na proočkovanou populaci
- Zlepšení diagnostického přístupu použitím rekombinantních antigenů v detekci intratekální produkce protilátek IgM/IgG u dětí s lymeskou neuroboreliózou
-
Výskyt klíštěte obecného Ixodes ricinus a významných patogenů jím přenášených ve vybraných oblastech se zvýšeným počtem onemocnění klíšťovou encefalitidou v různých nadmořských výškách v České republice
Část I. Klíště obecné Ixodes ricinus a virus klíšťové encefalitidy - Vliv kyslíku na produkci endotoxinu u bakterií ze skupiny Bacteroides fragilis group izolovaných od pacientů s kolorektálním karcinomem
- Rozdíly ve fosforylaci Akt v CD4+ lymfocytech u patogenní a nepatogenní infekce SIV
- Popis familiární formy Creutzfeldt-Jakobovy nemoci
- Pamiatke Charlesa Nicolla, nositeľa Nobelovej ceny za fyziológiu a medicínu
- Kulaté narozeniny doc. Bohumíra Kříže
- Prestižní ocenění Světové organizace pro zdraví zvířat (OIE) získal letos za zásluhy v boji proti vzteklině poprvé v historii český veterinární lékař MVDr. Oldřich Matouch, CSc.
- Nové přístupy v kontrole vzestupu počtu onemocnění pertusí
- Pandemie infekce virem hepatitidy C
- Některé aspekty imunitního systému v patogenezi Alzheimerovy choroby
- Detekcia markerov bunkovej smrti ako nástroj na testovanie citlivosti baktérií na antibiotiká
- Molekulární a antigenní analýza hemaglutininu virů chřipky A H3N2 detekovaných v České republice v epidemické sezoně 2014/2015
- Epidemiologie, mikrobiologie, imunologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Popis familiární formy Creutzfeldt-Jakobovy nemoci
- Nové přístupy v kontrole vzestupu počtu onemocnění pertusí
-
Výskyt klíštěte obecného Ixodes ricinus a významných patogenů jím přenášených ve vybraných oblastech se zvýšeným počtem onemocnění klíšťovou encefalitidou v různých nadmořských výškách v České republice
Část I. Klíště obecné Ixodes ricinus a virus klíšťové encefalitidy - Vliv kyslíku na produkci endotoxinu u bakterií ze skupiny Bacteroides fragilis group izolovaných od pacientů s kolorektálním karcinomem
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



