-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Těžké kombinované imunodeficience
Severe combined immunodeficiencies
Severe Combined Immunodeficiencies (SCID) are a group of childhood diseases with a very serious prognosis. They occur with a frequency of 1 in 40–100,000 children under one year of age. Early diagnosis is the main prognostic factor for the success of therapy. If left untreated, it is fatal. Causal treatment is haematopoietic stem cell transplantation. Since January 2022, a pilot newborns screening project for SCID has been running in the Czech Republic.
This article presents case reports of two patients with SCID diagnosed in our department in 2021. The first is an 8-month-old boy hospitalized for bilateral pneumonia with respiratory insufficiency. Pneumocystis jiroveci was identified as the causative agent. The condition was preceded by a period of failure to thrive and laboratory findings of lymphopenia. Additional immunological examination revealed severe hypogammaglobulinemia with impaired specific antibody production and T lymphopenia with low activation tests. Genetic testing revealed an X-linked form of SCID (defect in the IL2 receptor gene; c.925-13>G). The boy was subsequently successfully transplanted.
Second case report of a 2-month-old girl hospitalized for severe infection with concurrent SARS-CoV-2 positivity with fatal outcome. Post mortem findings were generalized CMV infection, severe thymic dysplasia with absence of T lymphocytes. The cause was determined to be an autosomal recessive form of SCID with mutation of the IL7 receptor gene (biallelic defect NM_002185.5: c.132C >A, p. Ser44Arg, a c.514delG, p. Glu172Lysfs*10).
Keywords:
haematopoietic stem cell transplantation – SCID – early diagnostics – neonatal screening
Autoři: Záveská Dita 1,2; Pospíšilová Ilona 1; Bánszka Karin 1; Freiberger Tomáš 3; Grombiříková Hana 3; Králíčková Pavlína 2
Působiště autorů: Dětská klinika, Lékařská fakulta Univerzity Karlovy a Fakultní nemocnice Hradec Králové 1; Ústav klinické alergologie a imunologie, Lékařská fakulta Univerzity Karlovy a Fakultní nemocnice Hradec Králové 2; Centrum kardiovaskulární a transplantační chirurgie Brno 3
Vyšlo v časopise: Čes-slov Pediat 2023; 78 (2): 103-109.
Kategorie: Kazuistiky z praxe
doi: https://doi.org/10.55095/CSPediatrie2023/015Souhrn
Těžké kombinované imunodeficience (SCID, severe combined immunodeficiencies) jsou skupinou onemocnění dětského věku s velmi závažnou prognózou. Vykytují se s frekvencí 1 na 40 000–100 000 dětí do jednoho roku věku. Včasná diagnóza je hlavním prognostickým faktorem úspěchu terapie. Neléčené končí fatálně. Kauzální léčbou je transplantace hematopoetických kmenových buněk. Od ledna 2022 v České republice probíhá pilotní projekt novorozeneckého screeningu SCID.
Článek předkládá kazuistiky dvou pacientů se SCID diagnostikovaných v roce 2021 na našem pracovišti. První je 8měsíční chlapec přijatý pro bilaterální pneumonii s respirační insuficiencí. Jako původce byla stanovena Pneumocystis jiroveci. Stavu předcházelo období neprospívání a laboratorní nález lymfopenie. Doplněné imunologické vyšetření prokázalo těžkou hypogamaglobulinemii s poruchou tvorby specifických protilátek a T lymfopenii s nízkými aktivačními testy. Genetické vyšetření odhalilo X-vázanou formu SCID (defekt v genu pro receptor IL2; c. 925-13> G). Chlapec byl následně úspěšně transplantován.
Druhá kazuistika 2měsíčního děvčátka hospitalizovaného pro těžkou infekci při současné pozitivitě viru SARS-CoV-2 s fatálním koncem. Post mortem byla zjištěna generalizovaná CMV infekce, těžká dysplazie thymu s nepřítomností T lymfocytů. Jako příčina byla stanovena autozomálně recesivní forma SCID s mutací genu pro receptor IL7 (bialelický defekt NM_002185.5: c.132 C> A, p.Ser44Arg, a c.514delG, p.Glu172Lysfs*10).
Klíčová slova:
včasná diagnostika – SCID – novorozenecký screening – transplantace hematopoetických kmenových buněk
ÚVOD
Těžké kombinované imunodeficience představují nejzávažnější formy vrozených poruch imunity s incidencí mezi 1 : 40 000 až 100 000 u dětí do jednoho roku věku. V České republice jsou pro tento typ onemocnění transplantovány 1–2 případy ročně.(1) Klinicky se zpravidla poprvé manifestují fulminantní infekcí v novorozeneckém či kojeneckém věku. Jako život ohrožující stav toto vzácné onemocnění vyžaduje co nejčasnější diagnostiku k zajištění adekvátního managementu směřujícího k časné transplantaci kmenových buněk krvetvorby.(2) Primárně je narušen vývoj a/nebo funkce T lymfocytů.(3) Díky provázanosti specifické imunitní odpovědi a nezbytnosti správné funkce T lymfocytů pro vyzrávání B lymfocytů a tvorbu protilátek bývá zpravidla postižena i imunita humorální.(4) V některých případech mohou být postiženy i natural killer (NK) buňky či může být snížen počet granulocytů.(5)
Klinickými projevy jsou především závažné a komplikované infekce. Často probíhají atypicky, špatně odpovídají na léčbu a rychle progredují. Dominuje postižení respiračního či gastrointestinálního traktu a kůže.(6) K prvním projevům zpravidla dochází záhy po narození či v prvních měsících života. Na etiologii se nejčastěji podílejí viry, intracelulární a oportunní organismy (např. CMV, EBV, Pneumocystis jirovecii, Aspergilus fumigatus, Candida albicans).( 3) Očkování živými vakcínami může mít pro takto nemocné děti fatální následky vzhledem k možnosti vzniku infekce způsobené vakcinačním kmenem. Vznik tzv. BCG-itidy po očkování novorozenců bylo jedním z důvodů, proč bylo toto očkování v r. 2009 vyřazeno z povinného očkovacího kalendáře a je ponecháno pouze pro novorozence z rizikových skupin.(6) Z hlediska současného očkovacího kalendáře zvýšené riziko představuje očkování rotavirovou vakcínou, které u takto nemocných dětí vede k závažným průjmům s dlouhodobou perzistencí očkovacího kmene v organismu dítěte.(7)
Ostatní živé vakcíny jsou podávány ve věku, kdy by se již většina forem SCID měla manifestovat a riziko komplikací po vakcinaci je tak velmi malé. Časnou laboratorní známkou je perzistující lymfopenie v krevním obraze při současné vyloučení infekce virem HIV.(8) Dalšími známkami jsou nízké sérové koncentrace imunoglobulinů – IgG, IgM a IgA a někdy též subprotektivní hladiny specifických protilátek proti běžným patogenům (proti kapsulárním polysacharidovým antigenům Haemophilus influenzae typu B, polysacharidovému pneumokokovému kapsulárnímu antigenu a tetanickému toxinu proteinové povahy). Ve vyšetření buněčných subpopulací je patrna T lymfopenie, případně i B lymfopenie, absence naivních CD4+ a CD8+ T lymfocytů. Odpovědi lymfocytů v aktivačních testech jsou sníženy. Diagnostiku může komplikovat vznik tzv. maternálního přihojení T lymfocytů (maternofetální engaftment), kdy jsou v cirkulaci dítěte přítomny matčiny lymfocyty (většinou cytotoxické CD8+, méně často pomocné CD4+), které mohou způsobit reakci štěpu proti hostiteli s klinickými projevy dermatitidy, enteritidy a hepatopatie.(8)
Dle přítomnost či nepřítomnosti T a B lymfocytů lze SCID dělit na T-B - a T-B+, v obou případech s přítomností či bez přítomnosti NK buněk. K přesné cytometrické diagnostice se využívá standardizovaný EuroFlow SCID panel.(9)
Definitivní diagnóza je ve většině případů potvrzena geneticky. V současné době je známo přes sto genů, jejichž porucha vede k rozvoji SCID (tab. 1). Nejběžnější geneticky potvrzené formy SCID v celosvětovém měřítku jsou X-vázané s patogenní variací v IL2RG genu, dále SCID s absencí adenosindeaminázy či deficitem Artemis proteinu, děděné převážně autozomálně recesivně.(10) Při pozitivním nálezu je samozřejmostí doplnění vyšetření rodičů a případně sourozenců, jednak jako možných dárců hematopoetických kmenových buněk a jednak jako možných nositelů příčinné mutace. Výsledky lze využít v genetickém poradenství při plánování a vedení další gravidity (stanovení rizika pro potomstvo, preimplantační či prenatální diagnostika).
Tab. 1. Rozdělení SCID definované přítomností CD3 T lymfopenie, upraveno dle Tangye(16) 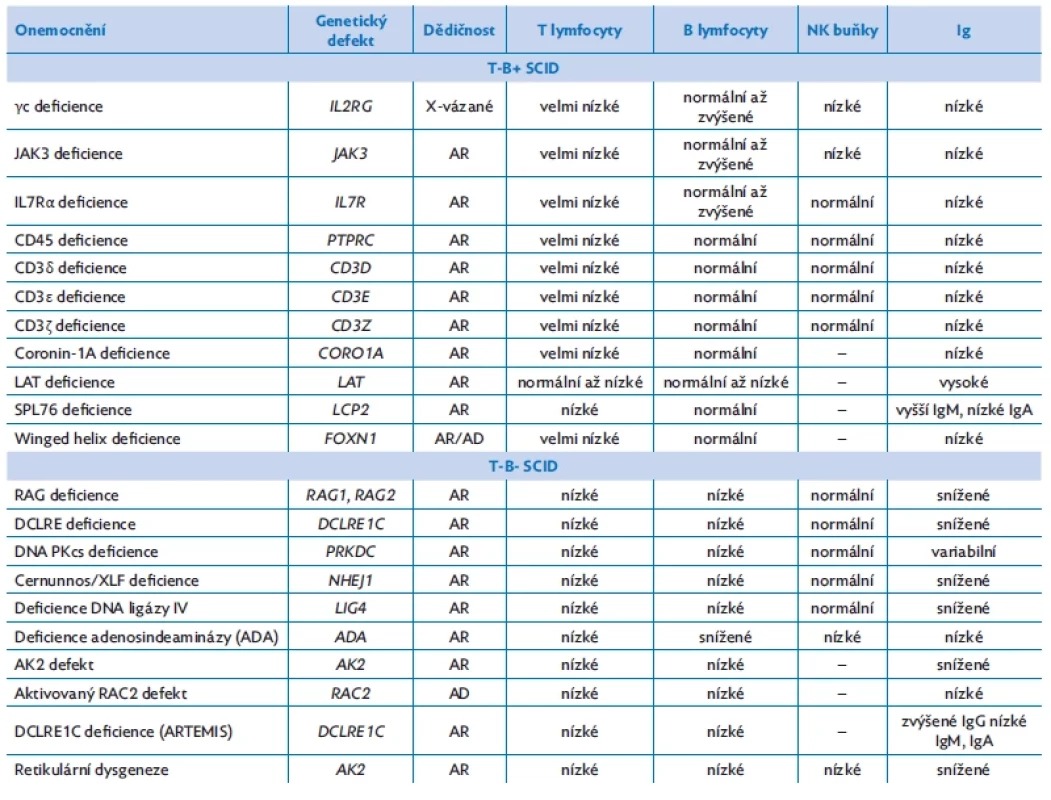
Včasnou a rychlou diagnostiku onemocnění ještě před jeho první manifestací může poskytnout pouze novorozenecký screening, který je v České republice prováděn od 1. ledna 2022, a to v režimu pilotního národního projektu.
KAZUISTIKA 1
Osmiměsíční chlapeček byl přijat překladem ze spádového dětského oddělení pro známky respirační insuficience při rozsáhlé oboustranné pneumonii nejasné etiologie. Chlapec byl narozený z druhé fyziologické gravidity, spontánně, v termínu. Očkován byl řádně dle platného kalendáře, s doplněním Bexsero (GSK Vaccines, Siena, Itálie) a Synflorix (GlaxoSmithKline Biologicals, Rixensart, Belgie) bez komplikací. Doposud byl kojen. Původním důvodem hospitalizace bylo odmítání stravy a únava dítěte. V průběhu hospitalizace došlo k rozvoji tachypnoe, záchvatů kašle a desaturací, proto byla zahájena perorální antibiotická terapie. Po převozu na JIP byl chlapec afebrilní, spontánně ventilující se 3 l kyslíku / min k udržení uspokojivých saturací. Objektivně dominovala tachypnoe a nález trubicovitého dýchání v levém horním plicním poli, výrazné perianální intertrigo. Dle percentilových grafů chlapec od přelomu 4.–5. měsíce neprospíval. Rodinná anamnéza stran úmrtí v kojeneckém věku či podezření na imunodeficit byla negativní. Laboratorně v krevním obraze a diferenciálním rozpočtu dominovala neutrofilie, lymfopenie 0,15 × 109/l (0,51–0,71 × 109/l), krevní plyny s hypoxemií, normokapnií, biochemicky elevace laktátdehydrogenázy, mírná elevace CRP 46,5 mg/l (0–5 mg/l). Na rtg plic byla zastižena rozsáhlá nehomogenní zastínění v obou plicních polích (obr. 1). UZ mozku a břicha bez patologie. Dle UZ hrudníku patrný lem volné tekutiny bazálně vpravo 3 mm. Sérologické vyšetření pertuse negativní ve třídách IgM i IgG, i přes proběhlou vakcinaci. R espirační panel ze stěru z nosohltanu a PCR covid-19 negativní. Adeno-, noro - a rotaviry negativní. Kultivace výtěru z krku a z rekta s nálezem běžné flóry. Antigen Streptoccocus pneumoniae a Legionella pneumophila z moči negativní. Pro suspektní imunodeficit byla zahájena parenterální antibiotická terapie cefalosporiny ve vysoké dávce a kortikoterapie. Druhý den hospitalizace přetrvávala tachydyspnoe se vzrůstajícími nároky na kyslík, v krevních plynech nadále hypoxemie a normokapnie. Kontrolní krevní obraz s leukocytózou s výskytem nezralých forem, trombocytóza, biochemicky pokles CRP. Potní test v normě. Imunologicky: nízká hladina IgG 1 g/l (3,4–12,5 g/l), IgM 0,34 g/l (0,15–1,23), IgA 0,19 g/l (0,02–2,94), subprotektivní hladiny specifických protilátek proti tetanu – méně než 0,02 mg/l (nad 2), hemofilu – méně než 1 mg/l (0,21–23,4) a pneumokoku – 4,3 mg/l (20–200). Při vyšetření lymfocytárních subpopulací průtokovou cytometrií prokázána výrazná T lymfopenie, odpovědi T a B lymfocytů v aktivačních testech za 24 a 48 hodin výrazně sníženy (pod 10 %). Laboratorní nálezy tak podporovaly možnou diagnózu SCID, proto byla odebrána krev na genetické vyšetření. Provedené CT vyšetření plic odhalilo rozsáhlé konsolidace v dorzálních částech plic, zastření charakteru mléčného skla subpleurálně vpravo ventrálně a v oblasti pravého apexu a vlevo v oblasti levého horního laloku, hyperinflace charakteru air-trappingu v pravém středním laloku (obr. 2 a 3). Intrakraniálně CT nález přiměřený věku. V celkové anestezii byla u hocha provedena bronchoskopie s bronchoalveolární laváží. Hlášená pozitivita beta-D glukanu ze séra pacienta a pozitivita Pneumocystis jirovecii ze stěru z nosohltanu, diagnóza potvrzena pozitivním záchytem Pneumocystis jirovecii v aspirátu z bronchoalveolární laváže ve vysoké kvantitě. Pokračováno v antibiotické terapii, terapii kortikoidy a zahájena terapie antimykotiky. Čtvrtý den pobytu pro přetrvávající tachypnoi a vyčerpání byl chlapeček naveden na HFNO s vysokým průtokem. V dalším průběhu klinický stav dítěte s mírnou regresí tachypnoe, byl obnoven plný enterální příjem cestou nazogastrické sondy s dobrou tolerancí.
Obr. 1. Rtg snímek hrudníku pacienta z kazuistiky č. 1 – rozsáhlé zastínění obou plic, maximum nálezu v levém horním laloku plic 
Obr. 2. a 3. CT vyšetření pacienta z kazuistiky č. 1 – rozsáhlé konsolidace v dorzálních částech plic, subpleurálně vpravo ventrálně a apikálně zastření charakteru mléčného skla, četné oblasti zastření charakteru mléčného skla v oblasti levého horního laloku plic, hyperinflace charakteru air-trappingu pravého středního laloku 
Na základě anamnézy neprospívání, lymfopenie a laboratorních nálezů bylo vysloveno podezření na SCID komplikovaný vznikem pneumocystové pneumonie. Bylo zahájeno profylaktické podávání antibiotik a imunoglobulinů v substitučních dávkách. Provedené genetické vyšetření následně prokázalo dosud nepopsanou variantu c. 925-13>G v genu IL2R, který se nachází na chromozomu X a kóduje γ řetězec společný pro řadu interleukinových receptorů. Varianta se nachází 13 bazí před 5 ҆ koncem posledního exonu a poškozuje autentické akceptorové místo sestřihu, tudíž s velkou pravděpodobností vede k poruše sestřihu a předčasnému ukončení syntézy peptidového řetězce. Defekty v tomto genu se manifestují u mužů jako SCID typu T-B+NK-.
K další péči byl pacient přeložen na Kliniku dětské hematologie a onkologie FN Motol, kde byl chlapec následně v květnu 2021 úspěšně transplantován od shodného nepříbuzného dárce. Od té doby je jeho stav dobrý a prognóza příznivá. Rodině bylo doporučeno genetické poradenství. Genetickým vyšetřením bylo zjištěno, že matka a sestra pacienta jsou přenašečkami tohoto onemocnění, riziko postižení je tedy u plodu mužského pohlaví 50 %, děvčátka budou s 50% pravděpodobností přenašečkami onemocnění.
KAZUISTIKA 2
Dvouměsíční děvčátko bylo taktéž přijato překladem ze spádového dětského oddělení pro oboustrannou bronchopneumonii při PCR pozitivitě SARS-CoV-2. Dítě bylo narozeno z 1. nekomplikované gravidity, spontánní porod v termínu, dosud neočkována. Rodinná anamnéza stran výskytu imunodeficitu byla i v tomto případě negativní. Vstupní laboratorní odběry s elevací zánětlivých parametrů, trombocytopenií a známkami hepatopatie. Objektivně byl zjištěn u dívky soor v dutině ústní a výrazné perianogenitální intertrigo. Zajištěna antibiotiky a antimykotiky, zavedena kortikoterapie. Pro vysoké nároky na kyslík byla záhy po přijetí zahájena podpora HFNO (průtok 9–10 l/min, FiO2 0,6–0,7). Na UZ břicha diagnostikována hraniční velikost jater. Kontrolní odběry se vzestupem trombocytů, bez známek koagulopatie. Vzhledem k významné pozitivitě SARS-CoV-2 N-Ag svědčící pro aktivní obraz replikace viru byla zahájena terapie rekonvalescentní plazmou a remdesivirem (off-label). Druhý den hospitalizace v odpoledních hodinách se u pacientky objevilo krvácení ze vpichů, enteroragie, laboratorně významná trombocytopenie. Ihned byl podán náplav trombocytů, transfuze erytrocytárního koncentrátu a zahájeno podávání diuretika. Krvácení ustalo, stav byl stabilizován. Třetí den hospitalizace byla zprvu dívenka stabilní, ventilační parametry měla uspokojivé, vnitřní prostředí bez známek rozvratu, zánětlivé markery a transaminázy poklesly. Pro výraznou elevaci NTproBNP bylo provedeno kontrolní UZ vyšetření srdce s nálezem incipientní dysfunkce levé komory, minimální kondenzace LDL plic, ascitu a hepatomegalie. Bezprostředně bylo zahájeno podávání dobutaminu, snaha o negativní tekutinovou bilanci. Ve večerních hodinách se u děvčátka znovu objevily známky hemoragické diatézy, došlo k výraznému zhoršení klinického stavu s nutností intubace dýchacích cest. I přesto byla ventilace velmi obtížná, s neuspokojivými parametry, z endotracheální kanyly odsávána čerstvá krev. Opakovaně byly pacientce podávány krevní deriváty. Na rtg snímku hrudníku byl prokázán obraz těžké plicní apoplexie (obr. 4 a 5). I přes intenzivní terapii a snahu o stabilizaci stavu se u dítěte 4. den hospitalizace rozvinul nezvratný kritický stav a nastal exitus letalis.
Obr. 4. a 5. Rtg snímky hrudníku a břicha pacientky z kazuistiky č. 2 – rozsáhlé zastínění plic s reziduálním projasněním podél pravé části mediastina a bazálně 
Post mortem při pitvě byla zjištěna dysplazie thymu s totální deplecí T lymfocytů a nepřítomnost T lymfocytů ve slezině. Dále bylo přítomno masivní diseminované postižení CMV infekcí ‒ postižení plic, myokardu, jater, sleziny, tračníku a ledvin. Na základě klinického průběhu a pitevního nálezu bylo vysloveno podezření na SCID. Následně provedené genetické vyšetření prokázalo bialelický defekt v genu IL7R, který kóduje receptor pro IL7. Byly detekovány dvě heterozygotní sekvenční varianty NM_002185.5: c.132C >A, p.Ser44Arg a c.514delG, p.Glu172Lysfs*10, vedoucí ke SCID s fenotypem T-B+NK+. Onemocnění spojená s defektem IL7R jsou děděna v autozomálně recesivním módu. Rodině bylo opět doporučeno genetické poradenství pro případnou následující graviditu. U obou rodičů byla prokázána 1 varianta, oba rodiče jsou tedy zdravými přenašeči onemocnění s rizikem postižení potomstva 25 % bez ohledu na pohlaví dítěte.
DISKUSE
Diagnostikovat u nemocného dítěte těžkou poruchu imunity včas je z hlediska další prognózy zcela zásadní. Podezření na SCID vyplývá z klinické manifestace a laboratorních vyšetření (tab. 2). Definitivní diagnóza je stanovena až geneticky. Ideálním stavem je odhalení tohoto onemocnění ještě před první infekční komplikací, což je jako jediný schopen zajistit novorozenecký screening. Ve Spojených státech, Kanadě a v některých státech Evropy již byl úspěšně zaveden. Podstatou je detekce správné tvorby T a B lymfocytů pomocí tzv. TREC/KREC metody.(5) Vyšetření se provádí ze suché kapky krve metodou PCR, kdy je stanovena přítomnost cirkulárních úseků DNA v rámci rekombinačního procesu při vzniku TCR, event. BCR receptorů na T a B lymfocytech.(11)
V České republice dosud nebylo toto vyšetření rutinně prováděno, avšak od 1. ledna 2022 je nově dostupné pro širokou veřejnost spolu se screeningem spinální muskulární atrofie v rámci pilotního projektu ministerstva zdravotnictví. Vyšetření přináší důležitou informaci o zdravotním stavu dítěte a může přispět k jeho úspěšné léčbě a v řadě případů i k záchraně života dítěte. Screeningové vyšetření těchto dvou onemocnění se provádí po předchozím písemném souhlasu matky z kapky krve odebrané z patičky novorozence mezi 48.–72. hodinou po narození, a to v rámci jednorázového odběru vzorků pro potřeby stávajícího novorozeneckého laboratorního screeningu vzácných geneticky podmíněných onemocnění. Při pozitivním nálezu je novorozenec následně vyšetřen imunologem dle spádu buď v Ústavu imunologie FN Motol v Praze či Ústavu klinické imunologie a alergologie FN u sv. Anny v Brně.(12)
V prezentovaných případech tato možnost ještě nebyla, a proto se děti do nemocnice dostaly až se známkami závažné infekce, v druhém případě s fatálními důsledky. V prvním případě však předcházely jisté varovné známky, kterým nebylo dopřáno zasloužené pozornosti. Jednalo se o neprospívání a přítomnost významného perianogenitálního intertriga v podstatě od narození. Z dokumentace vyplynulo, že lymfopenie v periferním krevním obraze byla u chlapce taktéž přítomna nějakou dobou před hospitalizací. V řadě případů se však na žádné varovné neinfekční známky nelze spoléhat. Pozitivní rodinná anamnéza je popisována pouze v malém počtu případů. Prvními projevy tak bývají závažné respirační infekce, chronické průjmy či soor v dutině ústní. Kůže bývá postižena těžkými formami dermatitidy připomínající atopický ekzém.(1)
Většina forem SCID je léčitelná pouze transplantací hematopoetických kmenových buněk. Ta vede k náhradě všech lymfoidních a myeloidních progenitorových buněk příjemce, které nesou kauzální mutaci onemocnění, buňkami dárce. Platí, že čím dříve je pacient transplantován, tím lepší má prognózu. A to díky menšímu množství již vzniklých komorbidit, menšímu riziku reaktivace CMV a dalším faktorům. Podpůrná terapie v předtransplantační době spočívá v antibiotické, antivirotické a antimykotické profylaxi a podávání substitučních dávek intravenózních či subkutánních imunoglobulinů.(6) Pokud bylo dítě očkováno BCG, je léčeno také antituberkulotiky.(1) Pacienti z ČR jsou transplantováni na Klinice dětské hematologie a onkologie FN Motol, kde byla první transplantace pacienta se SCID provedena již v roce 1995.(13)
Některé formy těžkých kombinovaných imunodeficiencí jsou léčitelné s využitím genové terapie, ve většině případů zatím pouze v rámci klinických studií. Výjimku tvoří preparát Strimvelis® (Orchard Therapeutics, Amsterodam, Nizozemsko), určený pro pacienty s deficiencí adenosindeaminázy, pro které není dostupný vhodný příbuzný dárce. Jeho podstatou je autologní frakce obohacená CD34+ buňkami transdukovanými retrovirovým vektorem, který kóduje humánní cDNA sekvenci adenosindeaminázy z lidských hematopoetických kmenových (CD34+) buněk. Přípravek je podán jednorázově a je určen výhradně pro autologní použití. I přesto že existuje určitá možnost poměrně závažných nežádoucích reakcí, jako jsou horečka, rozvoj autoimunitních komplikací nebo sporadický vznik leukemie, profity pro pacienta jsou nesporné.(14)
V případě zjištěné ageneze thymu existuje možnost transplantace thymu. V ČR byl tento zákrok poprvé úspěšně proveden v červnu r. 2017 ve FN Motol.(15)
Úloha genetika je významná nejen v období stanovení definitivní diagnózy, ale také v rámci vyšetření rodinných příslušníků s odhalením klinicky zdravých přenašečů a plánování dalších potomků v postižené rodině.
ZÁVĚR
SCID představují závažné vrozené defekty specifické imunity, které neléčené končí fatálně. Včasná diagnostika a adekvátní terapie jsou pro osud pacientů klíčové. Kauzální léčbou je transplantace hematopoetických kmenových buněk. Rutinní zavedení celoplošného screeningu SCID u novorozenců je zcela zásadní. Komplexní péče o tyto pacienty je v České republice na vynikající úrovni, a to díky mezioborové spolupráci našich pediatrů, imunologů, genetiků a hematologů.( 5)
Poděkování: MUDr. Renata Formánková, Ph.D., Klinika dětské onkologie a hematologie, FN Motol MUDr. Jan Kopřiva, Radiologická klinika, FN Hradec Králové
Korespondenční adresa:
MUDr. Dita Záveská
Sokolská 581
500 05 Hradec Králové
dita.zaveska@fnhk.czCes-slov Pediat 2023; 78(2): 103–109
Zdroje
1. Smíšek P, Janda A, Mejstříková E, et al. Atypická manifestace těžké vrozené munodeficience. Pediatr Praxi 2012; 13(2): 91–93.
2. Purkartová M, Formánková R, Hrušák O, et al. Severe combined immunodeficiency with atypical phenotype – case report. Čes Slov Pediat 2020; 75 : 356–361.
3. Bartůňková J, Šedivá A. Imunodeficience. Praha: Grada 2021.
4. Lebl J, Janda J, Pohunek P, et al. Klinická pediatrie. Praha: Galén 2012.
5. Klocperk A. Závažné buněčné imunodeficience. proLekare.cz. 2018.
6. Klocperk A, Bloomfield M, Šedivá A. Kombinované imunodeficience spojené se syndromickými příznaky. Čes Slov Pediat 2021; 76(4): 194–201.
7. De Francesco MA, Ianiro G, Monini M, et al. Persistent infection with rotavirus vaccine strain in severe combined immunodeficiency (SCID) child: is rotavirus vaccination in SCID children a Janus face? Vaccines 2019; 7 : 185.
8. Chapel H. Základy klinické imunologie. Praha: Triton 2018.
9. Kalina T, Bakardjieva M, Blom M, et al. EuroFlow standardized approach to diagnostic immunopheneotyping of severe PID in newborns and young children. Front Immunol 2020; 11 : 371.
10. Kohn LA, Kohn DB. Gene therapies for primary immune deficiencies. Front Immunol 2021; 12 : 648951.
11. Králíčková P. Primární imunodeficience – diagnostika a léčba. Pediatr Praxi 2021; 22 : 26–31.
12. UZIS. Dostupné na: https://nsc.uzis.cz/sma-scid/#tezka-kombinovana - -imunodeficience-SCID
13. Rozsíval P, Pařízková E, Králíčková P. Primární imunodeficity u dětí, současné možnosti léčby. Pediatr Praxi 2012; 13(3): 149–152.
14. EMA. Dostupné na: https://www.ema.europa.eu/en/medicines/human/ EPAR /strimvelis
15. Klocperk A, Sediva A. První transplantace thymu v České republice jako nová terapeutická možnost pro pacienty s kompletním syndromem. Alergie 2019; 2019 : 200–205.
16. Tangye SG, Al-Herz W, Bousfiha A, et al. Human inborn errors of immunity: 2022 update on the classification from the International Union of Immunological Societies Expert Committee. J Clin Immunol 2022.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2023 Číslo 2- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Stillova choroba: vzácné a závažné systémové onemocnění
-
Všechny články tohoto čísla
- Těžké kombinované imunodeficience
- Myokarditidy a kardiomyopatie
- Současné možnosti farmakoterapie dětské obezity
- Pediatrička Lenka Ťoukálková: Jsem týmová hráčka
- doc. MUDr. Michal Hladík, PhD., slávi 70 rokov
- Spomienka na veľkého pediatra – profesora Birčáka
- Pediatrická poezie
- Josef Čapek: Česající se
- Co jsme psali
- Wilhelm Conrad Röntgen (1845–1923): Sto let poté
- Hybridní zobrazení PET/MRI u pediatrických pacientů
- Moderné anatomické zobrazovanie v pediatrickej kardiológii pomocou CT angiokardiografie a 3D virtuálnych modelov srdca
- Příprava dítěte před vyšetřením magnetickou rezonancí
- Fetální magnetická rezonance – stručný přehled současného zobrazení a indikací
- Prenatální diagnostika ovariálních cyst, management a výsledky těhotenství
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Myokarditidy a kardiomyopatie
- Prenatální diagnostika ovariálních cyst, management a výsledky těhotenství
- Příprava dítěte před vyšetřením magnetickou rezonancí
- Současné možnosti farmakoterapie dětské obezity
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání






