-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Obrovskobuněčný fibroblastom: kazuistika
Giant cell fibroblastoma: a case report
Giant cell fibroblastoma is a rare locally aggressive tumor of subcutaneous mesenchymal tissue, occurring mostly on the trunk in young individuals with maximal incidence in the first decade of life. Local recurrences of giant cell fibroblastoma are common if marginally excised, however, distant metastases do not occur. Giant cell fibroblastoma was labelled as a juvenile variant of dermatofibrosarcoma protuberans (DFSP) due to quite frequent combination of both lesions, morphological similarities, identical immunoprofile, and shared gene fusion t(17;22) COL1A1-PDGFB. In this paper, we report a case of a young man with a slowly growing subcutaneous tumor in the groin. The tumor was excised and histological examination identified a mesenchymal tumor with variable cellularity, presence of multinucleated giant cells and pleomorphic spindle cells, which lined pseudovascular or angiectoid spaces. The CD34 immunohistochemistry showed strong positivity in all of these cells, whereas ERG was positive only in endothelial cells in true vessels. These findings led to a suspicion on giant cell fibroblastoma. Because of its borderline malignant behaviour and positive surgical margins, the lesion was subsequently reexcised. The molecular analysis identified the transcription product of gene fusion COL1A1-PDGFB and thus, final diagnosis was confirmed. The article includes review of the literature and brief historical overview of giant cell fibroblastoma concept as an unique entity.
Keywords:
dermatofibrosarcoma protuberans – giant cell – fibroblastoma – juvenile
Autoři: Jan Hrudka 1; Jan Hojný 2; Eva Leamerová; Radoslav Matěj 3 1,2,4
Působiště autorů: Ústav patologie 3. lékařské fakulty Univerzity Karlovy a Fakultní nemocnice Královské Vinohrady, Praha 1; Ústav patologie 1. lékařské fakulty Univerzity Karlovy a Všeobecné fakultní nemocnice, Praha 2; Klinika plastické chirurgie 3. lékařské fakulty Univerzity Karlovy a Fakultní nemocnice Královské Vinohrady, Praha 3; Ústav patologie a molekulární medicíny 3. lékařské fakulty Univerzity Karlovy a Fakultní Thomayerovy nemocnice, Praha 4
Vyšlo v časopise: Čes.-slov. Patol., 58, 2022, No. 3, p. 161-165
Kategorie: Původní práce
Souhrn
Obrovskobuněčný fibroblastom je vzácný lokálně agresivní nádor podkožních měkkých tkání. Vyskytuje se ponejvíce na trupu u mladých jedinců nejčastěji v první dekádě života. Nádor má tendenci lokálně recidivovat, vzdálené metastázy popsány nebyly. Vzhledem k poměrně časté kombinaci s dermatofibrosarcoma protuberans (DFSP), některým podobným morfologickým znakům, stejnému imunohistochemickému profilu a shodné genové fúzi t(17;22) COL1A1-PDGFB, byl obrovskobuněčný fibroblastom označen jako juvenilní forma DFSP. V této práci popisujeme případ mladého muže s pomalu rostoucím podkožním tumorem třísla, který byl excidován. Histologické vyšetření identifikovalo mezenchymální tumor s kolísající celularitou, účast obrovských vícejaderných buněk a pleomorfních vřetenitých buněk, které místy lemovaly tzv. pseudovaskulární či angiektoidní prostory. Imunohistochemie prokázala silnou CD34 pozitivitu všech těchto buněk, přičemž ERG byl pozitivní jen v endoteliích pravých kapilár. Nález vedl k suspekci na obrovskobuněčný fibroblastom, vzhledem k jeho semimaligní povaze a dosahu nádoru do linie excize byla léze opakovaně reexcidována. Molekulárně genetické vyšetření prokázalo transkripční produkt fúzního genu COL1A1-PDGFB, což vedlo k definitivnímu potvrzení diagnózy. Práce obsahuje rešerši literatury a stručný historický přehled vývoje konceptu obrovskobuněčného fibroblastomu jako samostatné jednotky.
Klíčová slova:
dermatofibrosarcoma protuberans – obrovskobuněčný – fibroblastom – juvenilní
Obrovskobuněčný fibroblastom je vzácný lokálně agresivní nádor podkožních měkkých tkání. Jedná se o juvenilní formu dermatofibrosarcoma protuberans (DFSP) vyskytující se u mladých jedinců (1). Výskyt je o něco častější u chlapců s mediánem věku 6 let. Klinicky imponuje jako pomalu rostoucí podkožní nebolestivá indurace v oblasti podkožních měkkých tkání trupu, třísla či podpažní jamky, vzácněji postihuje končetiny nebo hlavu a krk (2). Nádor vykazuje charakteristické histologické znaky s přítomností vícejaderných obrovských buněk a pseudovaskulárních prostor a pozitivní reakci v imunohistochemii CD34. Stejně jako častější DFSP je obrovskobuněčný fibroblastom definován přítomností fúzního genu COL1A1-PDGFB. V této práci prezentujeme případ mladého muže s podkožním tumorem třísla, jehož histologické a molekulární vyšetření vedlo k diagnóze obrovskobuněčného fibroblastomu.
POPIS PŘÍPADU
Devatenáctiletý muž přichází do chirurgické ambulance na polikliniku s tuhou rezistencí v podkoží podbřišku. Nález se dle klinického nálezu zpočátku jevil jako lipom – jednalo se o hmatný ne příliš tuhý posunlivý útvar v podkoží, nefixovaný ke spodině. Vypadal jako lipom, lehce vyklenoval kůži, která byla neporušená, bez změny barvy. Při výkonu bylo ale již hned jasné, že se o lipom nejedná, měl myxoidní charakter, nebyl zcela ohraničený, výběžky vybíhal do okolí. S rozpaky byla vyslovena suspekce na lymfadenopatii, rezistence byla excidována v lokální anestezii. K histopatologickému vyšetření byla v pufrovaném formolu zaslána nahnědlá částka rozměrů 38x25x16 mm, na povrchu s útržky tukově vazivové tkáně. Na řezu byla tkáň solidní a bělavě šedá. Materiál byl zpracován v celém rozsahu standardní histologickou technikou s formolovou fixací a zalitím do parafínu (formalin-fixed paraffin-embedded, FFPE). Parafínové bloky byly nakrájeny na mikrotomu, preparáty byly v první fázi obarveny hematoxylinem-eosinem.
Mikroskopicky zastihujeme neopouzdřený mezenchymální tumor s neostrým ohraničením vůči přilehlé tukové tkáni, nádor sestával z vřetenitých buněk a z obrovských vícejaderných buněk s basofilní cytoplazmou a hvězdicovitě/věnčitě uspořádanými jádry. Léze vykazovala kolísající buněčnost, většina rozsahu tumoru byla hypocelulární, místy však byly patrné hypercelulární okrsky. Stroma bylo převážně vazivové s místním myxoidním prosáknutím, fokálně s přítomnosti tzv. pseudovaskulárních prostor lemovaných nádorovými buňkami, některé pseudovaskulární prostory měly nepravidelně angulovaný parožnatý tvar (Obr. 1). Dále byly přítomné pravé cévy vystlané blandními endoteliemi. Ve stromatu byla řídká chronická zánětlivá celulizace. Nádor široce dosahoval do okrajů excize. Imunohistochemická reakce (Obr. 2) s CD34 (Roche, QBEnd/10, ready to use) byla difúzně silně cytoplazmaticky pozitivní v nádorových buňkách vřetenitých i obrovských a v buňkách výstelky pseudovaskulárních prostor i endotelií. Reakce s ERG (BioSB, EP111, 1 : 500) byla pozitivní jen v endoteliích pravých kapilár, nádorové buňky včetně výstelky pseudovaskulárních prostor byly negativní. Hladkosvalový aktin (ZetaCorp, 1A4, 1 : 1000) vykazoval pozitivitu ve stěně cév, nádorové buňky byly negativní. Desmin (BioSB, D33, 1 : 100) byl v nádoru negativní, pozitivní v ojedinělých větších cévách. S100 protein (DAKO, polyclonal, 1 : 6000) byl negativní, pozitivita byla přítomna jen v nenádorových nervech a adipocytech. CD68 (DAKO, PG-M1, 1 : 100) byl v nádorových buňkách negativní, pozitivní v reaktivní příměsi makrofágů. Reakce se STAT6 (CellMarque, ep325, 1 : 200) a ALK1 (Zytomed System, 5A4, 1 : 50) byly negativní. Proliferační aktivita Ki67 (ZeraCorp, Mib1, 1 : 200) byla přítomna průměrně v cca 5% nádorových buněk.
Obr. 1. histologické preparáty barvené hematoxylinem-eosinem zobrazující vřetenobuněčný tumor s kolagenním a částečně myxoidním stromatem a s kolísající celularitou (A, 40x). V hypercelulárních úsecích jsou patrné paralelně uspořádané blandní bazofilní vřetenité buňky vzhledu fibroblastů (B, 40x). Fokálně nacházíme obrovské vícejaderné buňky s věnčitě uspořádanými jádry, tzv. “floret-cells” (C, 40x). Ve stromatu jsou místy pseudovaskulární prostory lemované obrovskými buňkami a pleomorfními vřetenitými buňkami s hyperchromními jádry (D, 20x). 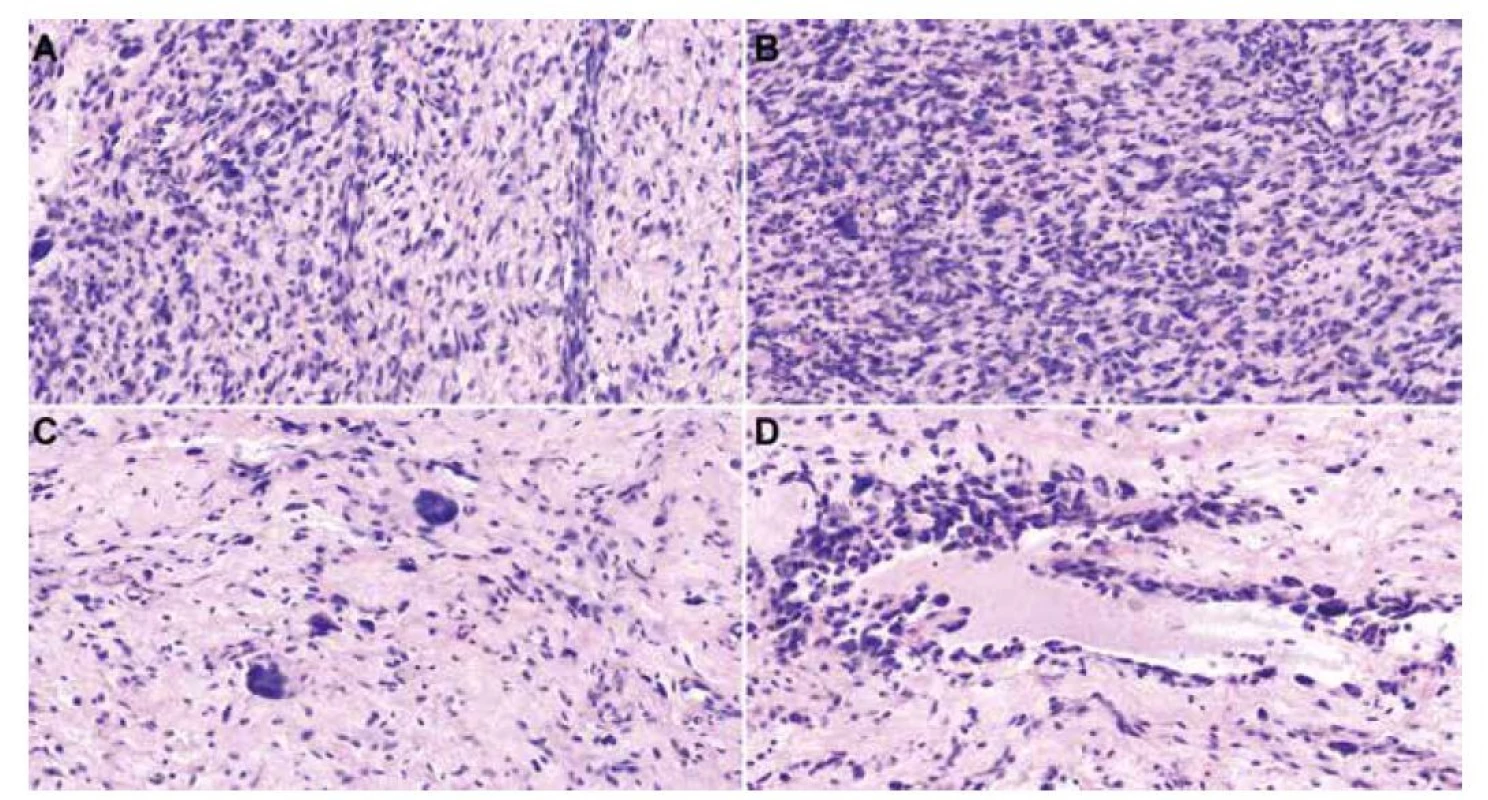
Obr. 2. Imunohistochemické vyšetření (20x) dokumentující silnou cytoplazmatickou pozitivitu CD34 ve vřetenitých buňkách, obrovských buňkách, ve výstelce pseudovaskulárních prostor (zelená šipka) i v pravém endotelu (červená šipka). ERG je pozitivní jen ve výstelce pravých kapilár (červená šipka), zatímco buňky pseudovaskulárních prostor jsou negativní (zelená šipka). Desmin je pozitivní v hladkosvalových buňkách kolem pravých cév (červená šipka), samotný nádor je negativní. S100 protein reaguje s periferními nervy v peritumorózních měkkých tkáních (žlutá šipka), nádor je negativní. 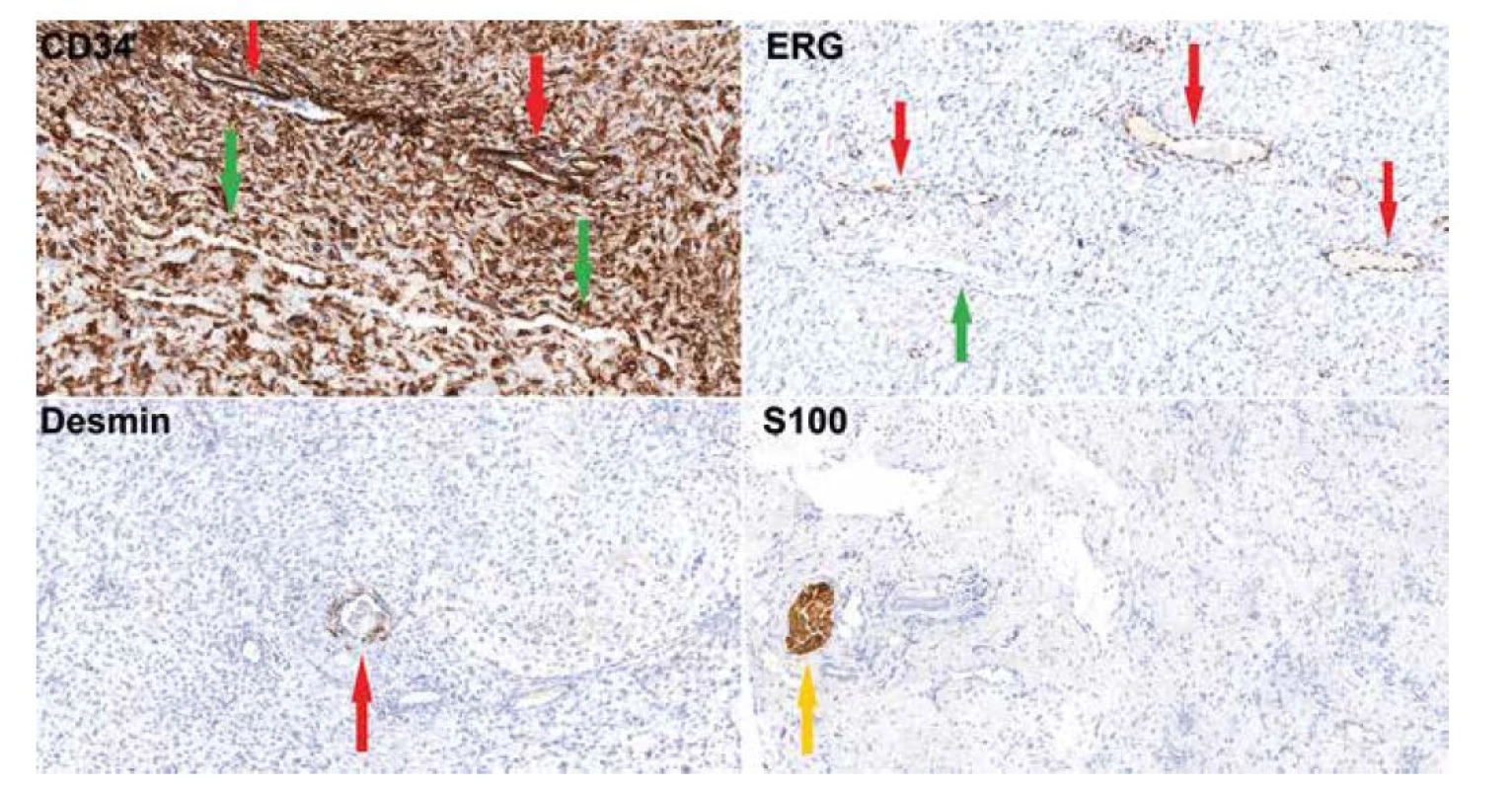
Popsaný nález jsme interpretovali jako mezenchymální měkkotkáňový tumor nejasné biologické povahy široce dosahující do okrajů excize. Na prvním místě jsme usuzovali na obrovskobuněčný fibroblastom/juvenilní variantu DFSP.
Byla doporučena reexcize a histopatologické vyšetření celé léze. K reexcizi byl pacient doporučen na kliniku plastické chirurgie ve Fakultní nemocnici Královské Vinohrady, kde byla provedena excize kůže a podkoží třísla v rozsahu 42x25x9 mm. Kromě jizvy a resorptivně-reparativního granulomatózního zánětu byla v podkoží zastižena rezidua nádoru shodné morfologie jako v předchozí excizi, opakovaně byla prokázána pozitivita CD34. Reziduum nádoru opět dosahovalo do spodiny excize, vzhledem k výrazné suspekci na nádor hraniční biologické povahy byla pacientovi doporučena a následně provedena další (již třetí) excize se širším bezpečnostním lemem. Byla reexcidována kůže a podkoží plochy 60x32 mm a výšky 18 mm, se 40 mm dlouhou jizvou na povrchu. Mikroskopicky byla nalezena buněčná jizva, reparativní změny a granulomy v okolí šicího materiálu, rezidua nádoru při kompletním zpracování materiálu již nalezena nebyla.
K definitivnímu potvrzení diagnózy obrovskobuněčného fibroblastomu byl materiál z první excize, kde bylo největší zastoupení nádorové tkáně, postoupen k molekulárně genetickému vyšetření. Z celých řezů parafínového bločku, ve kterém odpovídalo zastoupení nádorových buněk cca 90%, byla extrahována ribonukleová kyselina (RNA) dle standardního protokolu pomocí Quick-DNA/RNA FFPE kitu (ZymoResearch). Metodou masivního paralelního sekvenování nové generace (Next generation sequencing) bylo provedeno sekvenování nabohacených vybraných oblastí RNA. Vzorek RNA byl vyšetřen pomocí Archer FusionPlex Sarcoma kitu (ArcherDX) a sekvenován na platformě MiSeq (Illumina). Spektrum vyšetřovaných transkripčních variant a fúzí zahrnoval 26 genových cílů (ALK, CAMTA1, CCNB3, CIC, EPCI, EWSR, FOXO1, FUS, GLI1, HMBA2, JAZF1, MEAF6, MKL2, NCOA2, NTRK3, PDGFB, PLAG1, ROS1, SS18, STAT6, TAF15, TCF12, TFE3, TFG, USP6 a YWHAE) u kterých lze detekovat jakékoliv potencionálně přítomné fúzní partnery. Sekvenční data byla zpracována pomocí Archer Analysis 5.1.7. software. V celkové RNA byla detekována známá genová fúze COL1A1 (poslední detekovaný exon 25; NM_000088.3) - PDGFB (první detekovaný exon 2; NM_002608.2) v celkovém počtu 5797 čtení (zastoupení 76 %; https://cancer.sanger.ac.uk/cosmic/fusion/summary?id=533). Genetickým vyšetřením byl definitivně potvrzen obrovskobuněčný fibroblastom (Obr. 3). Sedm měsíců od první excize byl u pacienta proveden staging (počítačová tomografie hrudníku, břicha a malé pánve) bez průkazu nádorových metastáz. Pacient je nyní zcela bez obtíží a vzhledem k onkologické negativitě třetí excize je mu doporučeno sledování bez adjuvantní léčby.
Obr. 3. Schéma detekované genové fúze COL1A1-PDGFB. Modré boxy s popisky indikují exonové oblasti genů, modré čáry intronové oblasti genů. Červené tečky indikují začátek či konec exonové oblasti. Červené šipky nad boxy indikují oblasti nasedání primerů v PDGFB, jejichž amplikony potvrdily přítomnost fúze 
DISKUZE
Obrovskobuněčný fibroblastom poprvé popsali Shmookler a Enzinger roku 1982 ve formě abstraktu (3) a posléze společně s Weissovou v roce 1989 (3), kdy publikovali sestavu 28 nádorů z konzultačních případů, které byly původně diagnostikovány jako nejrůznější benigní i maligní léze - fibromyxom, benigní fibrózní tumor, fibromatóza, nodulární fasciitis, bizarní leiomyom, dermatofibrom, myxofibrom, benigní i maligní nádor z nervové pochvy, liposarkom či sarkom. Jednalo se o pacienty ve věku 4 měsíců do 55 let s nejvyšším výskytem v první dekádě života, klinicky se afekce manifestovala jako podkožní indurace různé velikosti postihující trup a méně často končetiny. Přibližně v polovině případů nádor po excizi recidivoval s časovým odstupem 7 až 28 měsíců. Iniciální mikroskopický popis byl ve shodě s naším případem. Obrovskobuněčný fibroblastom je neostře ohraničený tumor nepravidelného tvaru často s infiltrativními okraji s hlavní masou situovanou v podkožní tukové tkáni. Nádor často vrůstá z podkoží do dermis, vzácněji do svaloviny. Epidermis nad nádorem někdy vykazuje reaktivní změny charakteru akantózy, hyperkeratózy či papilomatózy. Samotný nádor vykazuje nepravidelné střídání hypercelulárních a hypocelulárních úseků, které jsou kolagenizované nebo myxoidní. Buněčnost sestává často z paralelně uspořádaných vřetenitých buněk blandního vzhledu s nízkou mitotickou aktivitou. V různém množství jsou přítomny pleomorfní vřetenité buňky s hyperchromními jádry a obrovské vícejaderné buňky s překrývajícími se věnčitě uspořádanými jádry na periferii buněk a s bazofilní cytoplazmou v centru. Autoři popsali diagnostické “sinusoidní prostory” štěrbinovitého a nepravidelného tvaru mezi kolagenními vlákny. Tyto pseudovaskulární nebo též “angiektoidní” prostory obsahují erytrocyty a jsou vystlané někdy nesouvislou vrstvou pleomorfních vřetenitých buněk či obrovských buněk. Bez užití imunohistochemických a molekulárních metod autoři postulovali příbuznost obrovskobuněčného fibroblastomu s DFSP na základě opakovaného pozorování nádorů se smíšenou morfologií obou jednotek, a označili tak obrovskobuněčný fibroblastom jako juvenilní formu DFSP. Úseky s morfologií konvenčního DFSP se vyskytují v cca 15 % případů (5). Raritně lze nalézt fibrosarkomovou komponentu, která značí agresivní transformaci (3), která byla popsána i v konvenčním DFSP, mimo jiné i recentně v tomto časopise (6). Fúze genů COL1A1-PDGFB charakterizující obrovskobuněčný fibroblastom i DFSP byla popsána v roce 1997 (7).
V minulosti se objevovaly i teorie, že obrovskobuněčný fibroblastom není pravý nádor, ale reaktivní proliferace provázející jiné léze. Karabela-Bouropoulou a spoluautoři publikovali sérii čtyř konzultačních případů; u dvou se jednalo o kombinaci s klasickým DFSP, jeden byl v čisté formě původně diagnostikovaný jako maligní fibrózní histiocytom a jeden jako maligní hemangiopericytom (8). Poslední zmíněný případ pak vykazoval pozitivitu CD34 a v průběhu času generalizoval a pacienta zahubil. Genová fúze NAB2-STAT6, charakterizující solitární fibrózní tumor (SFT) / hemangiopericytom, jejíž transkripční produkt lze vizualizovat imunohistochemicky, byla však popsána až později v roce 2013 (9, 10). Právě morfologická podobnost parožnatých cév a pseudovaskulárních prostor (oboje CD34 pozitivní) a tehdy neznámé vyšetření STAT6 mohlo snadno vést k záměně maligního hemangiopericytomu (dnes SFT) za obrovskobuněčný fibroblastom. Konstantní přítomnost fúze COL1A1-PDGFB v obrovskobuněčném fibroblastomu dává za pravdu prvnímu popisu této jednotky jako varianty DFSP, ačkoliv se zakládal čistě na morfologii (3). Tzv. obrovskobuněčný angiofibrom je histologickou variantou SFT a čistě morfologicky je prakticky neodlišitelný od obrovskobuněčného fibroblastomu, vzhledem k CD34+ imunoprofilu je pak bez vyšetření STAT6 snadné oba nádory zaměnit (11).
Během let od iniciálního popisu byla publikována řada kazuistik i soubory pacientů s obrovskobuněčným fibroblastomem v čisté formě (12-22) nebo v kombinaci s konvenčním DFSP (23-46), případně s jeho pigmentovanou variantou neboli Bednářovým tumorem (31). Byly popsány obrovskobuněčné fibroblastomy, jejichž lokoregionální recidivy měly morfologii DFSP (24, 40), dále DFSP recidivující s morfologií obrovskobuněčného fibroblastomu (26, 30) a jeden obrovskobuněčný fibroblastom s recidivou imponující jako Bednářův tumor (28) což dokumentuje histogenetickou příbuznost těchto jednotek. Existují též dva popisy případů, kdy byl obrovskobuněčný fibroblastom diagnostikován z tenkojehlové aspirační cytologie (47, 48), přičemž k diagnóze vedl nález obrovských vícejaderných buněk s věnčitě uspořádanými jádry.
K suspekci na obrovskobuněčný fibroblastom vede vedle klinických a epidemiologických charakteristik (věk a lokalizace) histologické vyšetření s výše popsaným obrazem. Obdobně jako u DFSP, pro diagnózu obrovskobuněčného fibroblastomu je klíčová imunohistochemická pozitivita CD34, konkrétně ve vřetenitých a v obrovských buňkách.
Mezi hlavní diferenciálně diagnostické alternativy patří kromě konvenčního DFSP již zmíněný SFT (zejména jeho zmíněná varianta obrovskobuněčný angiofibrom), dále myxofibrosarkom, liposarkom, endovaskulární papilární angioendotaliom (Dabské nádor), atypický fibrózní histiocytom (46), případně neurofibrom či schwannom s převažujícím obrazem Antoni B. SFT může svést na scestí podobností parožnatých cév s pseudovaskulárními/ sinusoidními prostory a konstantní CD34 pozitivitou jak vřetenitých buněk ve stromatu, tak výstelky cév/pseudocév. Zde může být nápomocná imunohistochemie endoteliálních markerů CD31 a ERG, která je v pravém endotelu vždy pozitivní, zatímco obrovské buňky tapetující pseudocévy jsou negativní, podobně jako v našem případě. Jak už bylo uvedeno, zásadní pro diagnózu SFT je imunohistochemická pozitivita STAT6, negativní pro DFSP i obrovskobuněčný fibroblastom. Myxofibrosarkom a liposarkom (zejména myxoidní) se vyskytují narozdíl od obrovskobuněčného fibroblastomu spíše u starších lidí a v hlubokých měkkých tkáních, pomoci může i jejich CD34 negativita. Endovaskulární papilární angioendoteliom obsahuje pravé cévní prostory vystlané endotelem, který je CD31 a ERG pozitivní. Endovaskulární proliferace bývají výrazně buněčné a papilární narozdíl od spíše chudé pseudovýstelky pseudocév obrovskobuněčného fibroblastomu. Dermatofibrom a jeho agresivnější varianty (atypický, celulární) bývají negativní v průkazu CD34. Měkkotkáňové tumory s neurální diferenciací (neurofibrom, schwannom) snadno odlišíme pomocí imunohistochemie S100, která je obvyklou součástí užívaných měkkotkáňových panelů. V případě pochybností či potřebě jednoznačné konfirmace je pak vhodné vyšetření přítomnosti genové fúze COL1A1-PDGFB in situ hybridizací nebo sekvenační analýzou, podobně jako tomu bylo v našem případě.
Klíčem k úspěšné terapii obrovskobuněčného fibroblastomu je excize se širokým lemem zdravé tkáně. Při kompletní excizi je lokální rekurence raritní (3). U nádorů inoperabilních či generalizovaných s fúzí COL1A1-PDGFB může pacient profitovat z biologické léčby imatinibem; tato léčba se používá u pacientů s pokročilým konvenčním DFSP. Fúzní gen COL1A1-PDGFB je obvykle součástí translokace t(17;22), následkem je aberantní exprese funkčního destičkového růstového faktoru B (PDGFB), který aktivuje receptor pro tento růstový faktor (PDGFR). Imatinib mesylát je inhibitor tyrosin kinázy, který receptor pro růstový faktor deaktivuje a vede k významné klinické regresi DFSP (49, 50). Vyšetření tohoto fúzního genu má tedy význam nejen diagnostický, ale i terapeuticko-indikační. Vzdálené metastázy čistého obrovskobuněčného fibroblastomu však podle provedené literární rešerše popsány nebyly. Patolog by měl zahrnout tuto vzácnou lézi do diferenciálně diagnostické rozvahy u vřetenobuněčných mezenchymálních nádorů měkkých tkání.
PODĚKOVÁNÍ
Práce byla podpořena Agenturou pro zdravotnický výzkum České republiky, výzkumný projekt NU21J-03-00019 a z výzkumného programu Univerzity Karlovy Cooperatio (Medical Diagnostics and Basic Medical Sciences).
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
MUDr. Jan Hrudka, Ph.D.
Ústav patologie 3. LF UK a FNKV
Šrobárova 1150/50, Praha 10, PSČ 100 34
tel: +420 267 16 2500
fax: +420 267 16 3002
email: jan.hrudka@lf3.cuni.cz
Zdroje
1. Povýšil C, Kodet R. Klasifikace nádorů. In: Povýšil C, Šteiner I. (Eds.) Obecná patologie. Galén, Praha, 2011 : 205.
2. Mentzel TDW, Pedeutour F. Giant cell fibroblastoma. In: WHO Classification of Tumours. Soft tissue and bone tumours (5th ed). Lyon (France): International Agency for Research on Cancer; 2020 : 98-99.
3. Shmookler BM, Enzinger FM, Weiss SM. Giant cell fibroblastoma. A juvenile form of dermatofibrosarcoma protuberans. Cancer 1989; 64(10): 2154-2161.
4. Díaz-Cascajo C, Borrego L, Bastida-Iñarrea J, Borghi S. Giant cell fibroblastoma. New histological observations. Am J Dermatopathol 1996; 18(4): 403-408.
5. Jha P, Moosavi C, Fanburg-Smith JC. Giant cell fibroblastoma: an update and addition of 86 new cases from the Armed Forces Institute of Pathology, in honor of Dr. Franz M. Enzinger. Ann Diagn Pathol 2007; 11(2): 81-88.
6. Hrudka J, Charvát M, Grossmann P, Kinkor Z. Dermatofibrosarcoma protuberans s fibrosarkomatózní transformací: kazuistika. Cesk Patol 2020; 56(2): 89-93.
7. Simon MP, Pedeutour F, Sirvent N, et al. Deregulation of the platelet derived growth factor B-chain gene via fusion with collagen gene COL1A1 in dermatofibrosarcoma protuberans and giant-cell fibroblastoma. Nat Genet 1997; 15(1): 95-98.
8. Karabela-Bouropoulou V, Liapi-Avgeri G, Mahera H, et al. Giant cell fibroblastoma: an entity or a reactive phenomenon? Pathol Res Pract 1999; 195(6): 413-419.
9. Robinson DR, Wu YM, Kalyana-Sundaram S, et al. Identification of recurrent NAB2 - STAT6 gene fusions in solitary fibrous tumor by integrative sequencing. Nat Genet 2013; 45(2): 180-185.
10. Chmielecki J, Crago AM, Rosenberg M, et al. Whole-exome sequencing identifies a recurrent NAB2-STAT6 fusion in solitary fibrous tumors. Nat Genet 2013; 45(2): 131-132.
11. Švajdler M, Michal M, Kinkor Z. Jaká je Vaše diagnóza? Giant cell angiofibroma (varianta solitárneho fibrózneho tumoru). Cesk Patol 2015; 51(3):126,127,132.
12. Abdul-Karim FW, Evans HL, Silva EG. Giant cell fibroblastoma: a report of three cases. Am J Clin Pathol 1985; 83(2): 165-170.
13. Fletcher CD. Giant cell fibroblastoma of soft tissue: a clinicopathological and immunohistochemical study. Histopathology 1988; 13(5): 499-508.
14. Rosen LB, Amazon K, Weitzner J, Resnick L. Giant cell fibroblastoma. A report of a case and review of the literature. Am J Dermatopathol 1989; 11(3): 242-247.
15. Bastian BC, Harms D, Kreipe HH, Hamm H, Bröcker EB. Das Riesenzellfibroblastom. Ein seltener Weichteiltumor des Kindesalters [Giant cell fibroblastoma. A rare soft tissue tumor in childhood]. Hautarzt 1996; 47(4): 299 - 303.
16. Kanai Y, Mukai M, Sugiura H, et al. Giant cell fibroblastoma. A case report and immunohistochemical comparison with ten cases of dermatofibrosarcoma protuberans. Acta Pathol Jpn 1991; 41(7): 552-560.
17. Tzen CY, Chen BF, Lu FH, Chang PY, Yang AH. Giant cell fibroblastoma: a case report. Zhonghua Yi Xue Za Zhi (Taipei) 1996; 57(6): 447-451.
18. Nguyen CM, Burch JM, Fitzpatrick JE, Peterson SL, Weston WL. Giant cell fibroblastoma in a child misdiagnosed as a dermatofibroma. Pediatr Dermatol. 2002; 19(1): 28-32.
19. Vargas-Gonzalez R, Solis-Coria A. Giant cell fibroblastoma in a 3-year-old boy. Pathol Oncol Res 2003; 9(4): 249-251.
20. Doric M, Radovic S, Babic M, et al. Giant cell fibroblastoma in a 4-year-old boy: a case report and review of the literature. Med Arh 2006; 60(6): 389-390.
21. Boukhechba M, Lamalmi N, Malihy A, Rouas L, Hamany ZA. Fibroblastome à cellules géantes inhabituel: à propos d’un cas [Unusual giant cell fibroblastoma: A case report]. Pan Afr Med J 2017; 28 : 263.
22. Maity P, Chatterjee U, Das M, Patra S. Recurrent giant cell fibroblastoma in an infant: a diagnostic challenge. Fetal Pediatr Pathol 2020 : 1-8.
23. Beham A, Fletcher CD. Dermatofibrosarcoma protuberans with areas resembling giant cell fibroblastoma: report of two cases. Histopathology 1990; 17(2): 165-167.
24. Alguacil-Garcia A. Giant cell fibroblastoma recurring as dermatofibrosarcoma protuberans. Am J Surg Pathol 1991; 15(8): 798-801.
25. Allen PW, Zwi J. Giant cell fibroblastoma transforming into dermatofibrosarcoma protuberans. Am J Surg Pathol 1992; 16(11): 1127 - 129.
26. Coyne J, Kaftan SM, Craig RD. Dermatofibrosarcoma protuberans recurring as a giant cell fibroblastoma. Histopathology 1992; 21(2): 184-187.
27. Michal M, Zámečník M. Giant cell fibroblastoma with a dermatofibrosarcoma protuberans component. Am J Dermatopathol 1992; 14(6): 549-552.
28. De Chadarévian JP, Coppola D, Billmire DF. Bednar tumor pattern in recurring giant cell fibroblastoma. Am J Clin Pathol 1993; 100(2): 164-166.
29. Perry DA, Schultz LR, Dehner LP. Giant cell fibroblastoma with dermatofibrosarcoma protuberans-like transformation. J Cutan Pathol 1993; 20(5): 451-454.
30. Pitt MA, Coyne JD, Harris M, McWilliam LJ. Dermatofibrosarcoma protuberans recurring as a giant cell fibroblastoma with subsequent fibrosarcomatous change. Histopathology 1994; 24(2): 197-198.
31. Zámečník M, Michal M. Giant-cell fibroblastoma with pigmented dermatofibrosarcoma protuberans component. Am J Surg Pathol 1994; 18(7): 736-740.
32. Michal M, Zámečník M. Ultrastructure of composite tumours consisting of giant cell fibroblastoma and dermatofibrosarcoma protuberans. Zentralbl Pathol 1995; 140(6): 415 - 420.
33. Dal Cin P, Sciot R, de Wever I, et al. Cytogenetic and immunohistochemical evidence that giant cell fibroblastoma is related to dermatofibrosarcoma protuberans. Genes Chromosomes Cancer 1996; 15(1): 73-75.
34. Goldblum JR. Giant cell fibroblastoma: a report of three cases with histologic and immunohistochemical evidence of a relationship to dermatofibrosarcoma protuberans. Arch Pathol Lab Med 1996; 120(11): 1052-1055.
35. Harvell JD, Kilpatrick SE, White WL. Histogenetic relations between giant cell fibroblastoma and dermatofibrosarcoma protuberans. CD34 staining showing the spectrum and a simulator. Am J Dermatopathol 1998; 20(4): 339-345.
36. Maeda T, Hirose T, Furuya K, Shirakawa K, Kobayashi K. Giant cell fibroblastoma associated with dermatofibrosarcoma protuberans: a case report. Mod Pathol 1998; 11(5): 491-495.
37. Silverman JS, Tamsen A. A cutaneous case of giant cell angiofibroma occurring with dermatofibrosarcoma protuberans and showing bimodal CD34+ fibroblastic and FXIIIa+ histiocytic immunophenotype. J Cutan Pathol 1998; 25(5): 265-270.
38. Galinier P, Scheiner C, Bardot J, et al. Giant - cell fibroblastoma and dermato fibro sarcoma protuberans: the same tumoral spectrum? Report of two cases of association in children. Eur J Pediatr Surg 2000; 10(6): 390 - 394.
39. Kholová I, Ryška A, Dědič K. Composite tumor consisting of dermatofibrosarcoma protuberans and giant cell fibroblastoma associated with intratumoral endometriosis. Report of a case. Pathol Res Pract 2001; 197(4): 263-267; discussion 269-270.
40. Cherradi N, Malihy A, Benkiran L, Barahioui M, Alhamany Z. Fibroblastome à cellules géantes récidivant sous forme de dermatofibrosarcome [Giant cell fibroblastoma recurring as dermatofibrosarcoma. A pediatric case report]. Ann Pathol 2002; 22(6): 465-468.
41. Wang J, Zhu X, Zhang R. [Giant cell fibroblastoma: a clinicopathologic analysis of seven cases]. Zhonghua Bing Li Xue Za Zhi 2002; 31(1): 38-41.
42. Terrier-Lacombe MJ, Guillou L, Maire G, et al. Dermatofibrosarcoma protuberans, giant cell fibroblastoma, and hybrid lesions in children: clinicopathologic comparative analysis of 28 cases with molecular data--a study from the French Federation of Cancer Centers Sarcoma Group. Am J Surg Pathol 2003; 27(1): 27 - 39.
43. Macarenco RS, Zamolyi R, Franco MF, et al. Genomic gains of COL1A1-PDFGB occur in the histologic evolution of giant cell fibroblastoma into dermatofibrosarcoma protuberans. Genes Chromosomes Cancer 2008; 47(3): 260-265.
44. Pascual A, Sánchez-Martínez C, Moreno C, et al. Dermatofibrosarcoma protuberans with areas of giant cell fibroblastoma in the vulva: a case report. Eur J Gynaecol Oncol 2010; 31(6): 685-689.
45. Warbrick-Smith J, Hollowood K, Birch J. Dermatofibrosarcoma protuberans recurring as a hybrid dermatofibrosarcoma/giant cell fibroblastoma in an adult: a case report. J Plast Reconstr Aesthet Surg 2010; 63(11): e785-7.
46. Braswell DS, Ayoubi N, Motaparthi K, Walker A. Dermatofibrosarcoma protuberans with features of giant cell fibroblastoma in an adult. J Cutan Pathol 2020; 47(4): 317-320.
47. Maitra A, Timmons CF, Siddiqui MT, Saboorian MH. Fine-needle aspiration biopsy features in a case of giant cell fibroblastoma of the chest wall. Arch Pathol Lab Med 2001; 125(8): 1091-1094.
48. Layfield LJ, Gopez EV. Fine-needle aspiration cytology of giant cell fibroblastoma: case report and review of the literature. Diagn Cytopathol 2002; 26(6): 398-403.
49. Labropoulos SV, Fletcher JA, Oliveira AM, Papadopoulos S, Razis ED. Sustained complete remission of metastatic dermatofibrosarcoma protuberans with imatinib mesylate. Anticancer Drugs 2005; 16(4): 461-466.
50. Labropoulos SV, Razis ED. Imatinib in the treatment of dermatofibrosarcoma protuberans. Biologics 2007;1(4): 347-353.
Štítky
Patologie Soudní lékařství Toxikologie
Článek 'NEUROPATOLOGIEČlánek 'NEFROPATOLOGIEČlánek 'HEPATOPATOLOGIEČlánek 'ORTOPEDICKÁ PATOLOGIEČlánek 'KARDIOPATOLOGIEČlánek 'HEMATOPATOLOGIEČlánek 'CYTODIAGNOSTIKAČlánek 'PATOLOGIE GITČlánek 'PATOLOGIE ORL OBLASTIČlánek 'PULMOPATOLOGIEČlánek 'UROPATOLOGIEČlánek Molekulárně patologické profilování vybraných nádorů centrálního nervového systému metodou MLPAČlánek Mukormykóza: kazuistika
Článek vyšel v časopiseČesko-slovenská patologie

2022 Číslo 3-
Všechny články tohoto čísla
- Novinky ve WHO klasifikaci nádorů CNS 2021
- … obor paleontologie se v roce 1989 otevíral jenom v Leningradě …
- 'NEUROPATOLOGIE
- 'NEFROPATOLOGIE
- 'HEPATOPATOLOGIE
- 'ORTOPEDICKÁ PATOLOGIE
- 'KARDIOPATOLOGIE
- 'HEMATOPATOLOGIE
- 'CYTODIAGNOSTIKA
- 'PATOLOGIE GIT
- 'PATOLOGIE ORL OBLASTI
- 'PULMOPATOLOGIE
- 'UROPATOLOGIE
- Novinky ve WHO klasifikaci nádorů centrálního nervového systému 2021
- Efektivní schéma využívané v diagnostice nádorů CNS
- Molekulárně patologické profilování vybraných nádorů centrálního nervového systému metodou MLPA
- Nádory CNS – klinické a radiologické aspekty
- Obrovskobuněčný fibroblastom: kazuistika
- Mukormykóza: kazuistika
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Novinky ve WHO klasifikaci nádorů centrálního nervového systému 2021
- Nádory CNS – klinické a radiologické aspekty
- Mukormykóza: kazuistika
- Obrovskobuněčný fibroblastom: kazuistika
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



