-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Vícečetná tumoriformní ložiska mozku jako první projev demyelinizačního onemocnění
Autoři: M. Petrášová 1,2; J. Kolčava 1,2; J. Kočica 1,2; P. Hložanka 2,3; P. Štourač 1,2
Působiště autorů: LF MU a FN Brno 1; Neurologická klinika FN Brno 2; Klinika radiologie a nukleární medicíny, FN Brno 3
Vyšlo v časopise: Cesk Slov Neurol N 2022; 85(1): 86-88
Kategorie: Dopisy redakci
doi: https://doi.org/10.48095/cccsnn202286Vážená redakce,
tumoriformní demyelinizace patří mezi vzácné formy RS, její diferenciální diagnostika může být obtížná, proto je nutno v první řadě vyloučit jiné diagnózy, jako jsou např. mozkový tumor či absces.
Ložiska na MR mozku větší než 2 cm v delší ose jsou pro RS značně netypická. Také přítomnost výrazného edému nebo sycení charakteru prstence či otevřeného prstence u takto velkých lézí budí podezření i na jinou etiologii [1]. U RS jde o raritní, tzv. tumoriformní formu. Prevalence se udává dle různých zdrojů 1–21/1 000 pacientů s RS [2,3]. Tyto léze se predilekčně nachází supratentoriálně, přičemž u více než poloviny pacientů se jedná o první projev demyelinizace [4]. Vzhledem k časté lokalizaci v lalocích a k rozsahu léze se často projeví těžším neurologickým deficitem jako afázií, hemiparézou či hemianopsií. Prvním symptomem může být i epileptický paroxysmus [5].
Prezentujeme případ 24leté pacientky, která přišla na Neurologickou kliniku pro týden se objevující ataky vertiga s následným rozvojem oslabení levostranných končetin. Neurologickým vyšetřením byla zjištěna lehká levostranná brachiokrurální hemiparéza a levostranná taktilní hemihypestezie (Expanded Disability Status Scale [EDSS] 3,5). Pacientka se dosud s ničím neléčila, užívala pouze hormonální antikoncepci. Z rodinné anamnézy bylo zjištěno, že dědeček pacientky měl RS, jinak se v rodině nevyskytovala autoimunitní či onkologická onemocnění. Bylo provedeno akutní vyšetření MR mozku a krční míchy s podáním kontrastní látky s nálezem vícečetných ložisek v pravé mozkové hemisféře s perifokálním edémem, expanzivními projevy a lehkým přesunem středočárových struktur (obr. 1). V diferenciální diagnostice byly zvažovány primární nádor či tumoriformní demyelinizace. Lumbální punkce byla nezánětlivá, byly prokázány dva oligoklonální pásy v séru i likvoru. MRZ (M – morbilli, R – rubella, Z – varicella zoster) reakce byla negativní. K vyloučení tumorózní etiologie se u pacientky provedlo onkologické screeningové došetření vč. odběru onkomarkerů, gynekologického vyšetření, UZ vyšetření břicha, prsů a skiagrafického vyšetření hrudníku, vše bez průkazu tumorózního origa. Odběr na autoimunitní protilátky prokázal pozitivní screening na antinukleární protilátky (titr 1 : 400), dle vyšetření revmatologem však pacientka nesplnila kritéria pro systémové onemocnění pojiva. Vyšetření protilátek anti-aquaporin 4 i anti-myelin oligodendrocytární glykoprotein bylo negativní. Průtoková cytometrie mozkomíšního moku byla bez známek malignity. Vizuální evokované potenciály byly oboustranně v normě.
Obr. 1. Iniciální MR mozku s gadoliniovou kontrastní látkou – sekvence (A) FLAIR transverzální, (B) T1 postkontrastně transverzální, (C) T1 postkontrastně koronální. Intraaxiální léze v pravé hemisféře s perifokálním edém a se sycením vzhledu přerušeného prstence.
FLAIR – fluid attenuated inversion recovery
Fig. 1. Initial brain MRI with gadolinium contrast agent – (A) transverse FLAIR, (B) transverse T1 contrast enhanced, (C) coronal T1 contrast enhanced sequencies. Intraaxial lesions in the right hemispehe with perifocal edema and saturation of the appearance of an open ring.
FLAIR – fluid attenuated inversion recovery
Pacientka byla léčena 5 g metylprednisolonu i.v. s postupnou normalizací neurologického nálezu a bylo doplněno vyšetření PET MR (v odstupu 1 měsíce od vstupní MR), které prokázalo částečnou regresi velikosti a sycení lézí vpravo charakteru open-ring a významný ústup edému (obr. 2). Byla zjištěna jen minimální aktivita 18F-fluorothymidinu (FLT), která může souviset i s nespecifickým porušením hematoencefalické bariéry a která nebudila podezření na proliferačně aktivní maligní lézi. Demyelinizace proto zůstala nadále nejpravděpodobnější diagnózou.
Obr. 2. PET MR (fúzní a T1 postkontrastní zobrazení) mozku s radiofarmakem 18F-fluorothymidinem ukazují nevýraznou aktivitu lézí (A, B). Kontrolní MR mozku (sagitální FLAIR sekvence), na snímcích nově typické periventrikulární léze (C). Perifokální edém tumoriformních demyelinizačních ložisek (zobrazení FLAIR sagitálně) (D) ve srovnání se zobrazením stejného řezu při vyšetření po roce a půl. Na snímku perifokální edém vymizel. Nově jsou zobrazeny drobné periventrikulární léze (E).
FLAIR – fluid attenuated inversion recovery
Fig. 2. Brain PET-MRI (fusion image of T1 contrast enhanced with FLT-PET) with the radiopharmaceutical 18F-fluorothymidine shows insignificant lesion activity (A, B). Dissemination in time (on follow-up MRI – transverse FLAIR sequence), with new typical periventricular lesions (C). Perifocal edema of tumefactive demyelinating lesion, on the right (D) comparison on control after a year and a half where the perifocal oedema disappeared and small periventricular lesions appeared (E) shown on FLAIR sequences.
FLAIR – fluid attenuated inversion recovery; FLT – 18F-fluorothymidine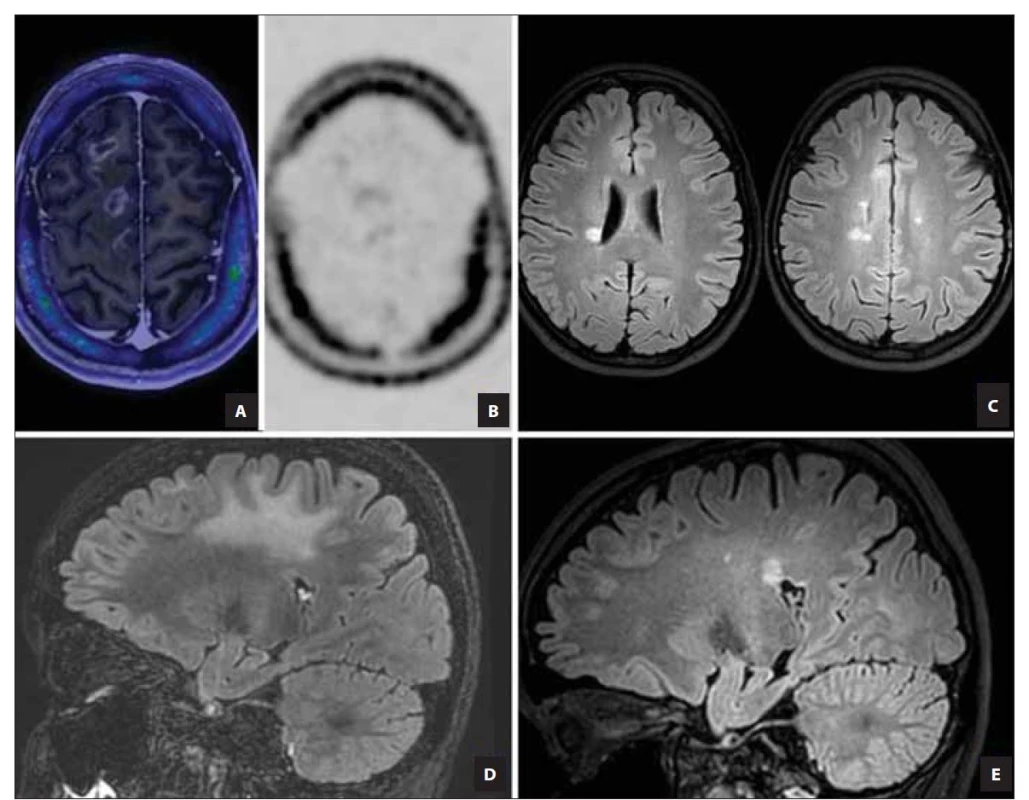
Z tohoto důvodu a také s ohledem na špatnou anatomickou dostupnost ložiska nebyla zvažovaná stereotaktická biopsie indikována.
Tumoriformní demyelinizace byla nejpravděpodobnější etiologií obtíží, a proto byla pacientce nasazena injekční léčba interferonem beta-1a, která byla následně pro hepatopatii zaměněna za glatiramer acetát. Na kontrolní MR mozku a krční míchy se prokázala významná regrese tumoriformních ložisek, a naopak přibylo pět demyelinizačních ložisek (čtyři supratentoriálně, jedno v krční míše) (obr. 2), čímž pacientka formálně naplnila McDonaldova kritéria 2017 [6].
Další potvrzení diagnózy a přechod do klinicky definitivní RS nastal u pacientky za 17 měsíců, ve věku 25 let, kdy prodělala relaps pravostranné retrobulbární neuritidy (EDSS 1,5), který byl léčen pulzem 3 g metylprednisolonu i.v. s částečným efektem, a pacientka byla, i z důvodu současné progrese radiografického nálezu, eskalována na léčbu kladribinem. Krátce po eskalaci prodělala pacientka další relaps onemocnění s allodyniemi a dysesteziemi levé dolní končetiny, který byl léčen pulzem 3 g metylprednisolonu i.v. již s plným efektem.
Pacientka je od poslední ataky (10 měsíců) stabilní, bez progrese neurologického deficitu, v jejím neurologickém nálezu trvá porucha zraku vpravo lehkého stupně a porucha termického čití na levé dolní končetině. EDSS pacientky je nyní 1,5 (zrakový a senzitivní funkční subsystém 1, jinak v normě).
Diferenciální diagnostika tumoriformní varianty RS zahrnuje jednak mozkové tumory (hlavně low-grade gliom, méně high-grade gliom, lymfom nebo metastatické postižení) či absces, ale také vzácnější varianty demyelinizace jako Schilderova choroba či koncentrická skleróza Baló. Jednou z patologií, které je třeba považovat za diferenciální diagnostiku, je také primární lymfom centrálního nervového systému [4].
Diagnostika této formy je obtížná především u pacientů s primozáchytem RS a bez dalších radiografických či klinických příznaků, které by nás směrovaly k demyelinizačnímu onemocnění a vyloučily tumorózní etiologii.
V diferenciální diagnostice mohou být nápomocny pokročilejší zobrazení MR, jako jsou např. difuzí vážené obrazy, MR spektroskopie či zobrazení PET. I přes výrazný pokrok v zobrazovacích metodách stále není možné v řadě případů jednoznačně stanovit diagnózu jen na základě zobrazovacích metod, a proto při nedostatečné terapeutické odpovědi nebo deterioraci stavu může být nutné přistoupit až k stereotaktické biopsii ložiska [4,7].
Z pohledu radiologa se tumoriformní demyelinizace projevuje na zobrazovacích metodách jako intraaxiální léze s expanzivními projevy, které bývají menší, než by odpovídalo velikosti léze [8]. Po podání kontrastní látky na MR se může objevit znak prstence, který bývá přerušen směrem k šedé hmotě a se sytící částí směřující k bílé hmotě. Tento znak pomůže odlišit abscesové kolekce a high-grade gliomy, které obvykle mají prstence sycení bez přerušení [8]. Znak přerušeného prstence se udává jako vysoce specifický, je ale třeba vzít v úvahu výrazně vyšší prevalenci výskytu gliomů a abscesů v populaci [1]. Low-grade gliomy se obvykle nesytí vůbec a mívají větší projevy expanze. PET může přispět k odlišení abscesů a high-grade gliomů, demyelinizační plaky jsou obecně považovány za metabolicky neaktivní v případě nejčastěji používaného radiofarmaka 18F-fluorodeoxyglukózy (FDG). Vyšetření mozku pomocí FDG bývá limitováno vzhledem k vysoké aktivitě pozadí, proto byla pacientka vyšetřena pomocí radiofarmaka FLT, které se nejvíce akumuluje v tkáních s vysokou proliferační aktivitou.
Vzhledem k nízké prevalenci tumoriformní demyelinizace nejsou jednoznačná prognostická data ani údaje o doporučované dlouhodobé imunomodulační léčbě těchto pacientů, některé práce doporučují neléčit takové pacienty fingolimodem, avšak data z větších souborů chybí [5]. Další práce naznačují, že pacienti s tumoriformními demyelinizačními lézemi mohou mít lepší prognózu ve srovnání s pacienty s RS bez těchto lézí [9,10]. Rozsáhlejší studie však pravděpodobně nebude možné provést vzhledem k nízké četnosti této formy.
U naší pacientky nebylo významně nápomocné vyšetření mozkomíšního moku ani vizuálních evokovaných potenciálů, a tak byla diagnóza primárně založena na radiografickém nálezu (MR a PET MR) a změně nálezů v čase. Podpůrným faktorem byla také pozitivní rodinná anamnéza.
Pacientka po prvním relapsu formálně nesplnila McDonaldova kritéria 2017 [6] a bylo na zvážení, zda pacientku léčit, či vyčkat dalšího klinického či radiografického průběhu onemocnění. Vzhledem k vysoké pravděpodobnosti demyelinizačního onemocnění a vyloučení jiných onemocnění jsme se rozhodli pacientku začít léčit co nejdříve.
Etické aspekty
Autoři prohlašují, že studie na lidských subjektech popsaná v manuskriptu byla provedena v souladu s etickými standardy příslušné komise (institucionální a národní) odpovědné za provádění klinických studií a Helsinskou deklarací z roku 1975, revidovanou v roce 2000. Pacientka podepsala informovaný souhlas a se zpracováním svého případu ve formě kazuistiky souhlasí. Rukopis byl přečten a schválen k publikaci všemi spoluautory a byly splněny požadavky na autorství.
Grantová podpora
Práce byla podpořena z prostředků MZ ČR – RVO (FNBr, 65269705) a projektem specifického výzkumu č. MUNI/A/1600/2020 z programu podpory studentských projektů na Masarykově univerzitě.
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem studie nemají žádný konflikt zájmů.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manu script met the ICMJE “uniform requirements” for biomedical papers.MUDr. Jan Kolčava, Ph.D.
Neurologická klinika
LF MU a FN Brno
Jihlavská 340/20
625 00 Brno
e-mail: kolcava.jan@fnbrno.cz
Přijato k recenzi: 23. 11. 2021
Přijato do tisku: 2. 2. 2022
Zdroje
1. Masdeu JC, Quinto C, Olivera C et al. Open-ring imaging sign: highly specific for atypical brain demyelination. Neurology 2000; 54 (7): 1427–1433. doi: 10.1212/wnl.54.7.1427.
2. Sánchez P, Meca-Lallana V, Barbosa A et al. Tumefactive demyelinating lesions of 15 patients: clinico-radiological features, management and review of the literature. J Neurol Sci 2017; 381 : 32–38. doi: 10.1016/ j.jns.2017.08.005.
3. Štourač P, Kolčava J, Keřkovský M et al. Progressive tumefactive demyelination as the only result of extensive diagnostic work-up: a case report. Front Neurol 2021; 12 : 701663. doi: 10.3389/fneur.2021.701663.
4. Frederick MC, Cameron MH. Tumefactive demyelinating lesions in multiple sclerosis and associated disorders. Curr Neurol Neurosci Rep 2016; 16 (3): 26. doi: 10.1007/s11910-016-0626-9.
5. Algahtani H, Shirah B, Alassiri A. Tumefactive demyelinating lesions: a comprehensive review. Mult Scler Relat Disord 2017; 14 : 72–79. doi: 10.1016/ j.msard.2017.04.003.
6. Thompson AJ, Banwell BL, Barkhof F et al. Diagnosis of multiple sclerosis: 2017 revisions of the McDonald criteria. Lancet Neurol 2018; 17 (2): 162–173. doi: 10.1016/S1474-4422 (17) 30470-2.
7. Gnanapavan S, Jaunmuktane Z, Baruteau KP et al. A rare presentation of atypical demyelination: tumefactive multiple sclerosis causing Gerstmann’s syndrome. BMC Neurol 2014; 14 : 68. doi: 10.1186/1471-2377-14-68.
8. Given CA, Stevens BS, Lee C. The MRI appearance of tumefactive demyelinating lesions. AJR Am J Roentgenol 2004; 182 (1): 195–199. doi: 10.2214/ajr.182.1.1820195.
9. Turatti M, Gajofatto A, Bianchi MR et al. Benign course of tumour-like multiple sclerosis. Report of five cases and literature review. J Neurol Sci 2013; 324 (1–2): 156–162. doi: 10.1016/j.jns.2012.10.026.
10. Hardy TA. Pseudotumoral demyelinating lesions: diagnostic approach and long-term outcome. Curr Opin Neurol 2019; 32 (3): 467–474. doi: 10.1097/WCO. 0000000000000683.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek Analytické a preanalytické aspekty stanovení lehkých řetězců neurofilament v biologických tekutináchČlánek EditorialČlánek Validace české jazykové verze dotazníků DN4 a PainDetect pro diagnostiku neuropatické bolestiČlánek Sakrální deaferentace a implantace sakrálního neurostimulátoru u pacienta s transverzální míšní lézíČlánek Anémie z nedostatku železa vykazující progresivní retinální, kochleární a cerebrální trombózuČlánek Poděkování recenzentům
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2022 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- Prof. MUDr. Zdeněk Kadaňka, CSc., osmdesátiletý
- Analytické a preanalytické aspekty stanovení lehkých řetězců neurofilament v biologických tekutinách
- Komentář k článku autorů Fialová et al Analytické a preanalytické aspekty stanovení lehkých řetězců neurofilament v biologických tekutinách
- Spontánní intrakraniální hypotenze
- Novinky v liečbe hlbokou mozgovou stimuláciou pri neurologických ochoreniach
- Editorial
- Poruchy čichu po transnazálních endoskopických operacích adenomu hypofýzy
- Výsledky chirurgické terapie meralgia paresthetica 15 pacientů
- Test-retest hodnocení spolehlivosti čichového testu (Odorized Markers Test)
- Česká verze nástroje Mini-BESTest a doporučení pro jeho klinické použití
- Validace české jazykové verze dotazníků DN4 a PainDetect pro diagnostiku neuropatické bolesti
- Vliv fluoxetinu na obnovu funkční nezávislosti u pacientů po akutní ischemické cévní mozkové příhodě a prognostické faktory
- Sakrální deaferentace a implantace sakrálního neurostimulátoru u pacienta s transverzální míšní lézí
- Lokalizovaná neurofibromatóza typu 1 v mozaice
- Anémie z nedostatku železa vykazující progresivní retinální, kochleární a cerebrální trombózu
- Vícečetná tumoriformní ložiska mozku jako první projev demyelinizačního onemocnění
- Cerebrální hyperperfuzní syndrom – vzácná komplikace revaskularizačního výkonu
- Poděkování recenzentům
- Dilatace skalpu podkožními expandéry před sekundární počítačově modelovanou kranioplastikou z porózního polyethylenu
- Zemřel doc. MUDr. Vilibald Vladyka, CSc.
- Zemřela doc. MUDr. Miluše Havlová, CSc.
- Odešel prim. MUDr. Hanuš Baš, CSc.
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Vícečetná tumoriformní ložiska mozku jako první projev demyelinizačního onemocnění
- Spontánní intrakraniální hypotenze
- Novinky v liečbe hlbokou mozgovou stimuláciou pri neurologických ochoreniach
- Analytické a preanalytické aspekty stanovení lehkých řetězců neurofilament v biologických tekutinách
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




