-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Novinky v liečbe hlbokou mozgovou stimuláciou pri neurologických ochoreniach
Deep brain stimulation advances in neurological diseases
Deep brain stimulation (DBS) is an established advanced treatment option for selected neurological disorders with failed conservative therapy. Present indications of DBS are Parkinson‘s disease, various types of dystonia and essential tremor. In recent years, the DBS indication spectrum of neurological disorders has broadened with epilepsy and other more experimental indications such as chronic cluster headache and other movement disorders (Tourette’s syndrome, Huntington’s disease). Technological hardware innovations are another important step. Almost all currently manufactured neurostimulators are MRI compatible and the longevity of batteries has significantly improved (manufacturer guarantees a longevity of 13 years and the experimental data predict up to 25 years). Directional leads became a standard practice enabling the shaping of the electrical fields and minimalization of stimulation-induced side effects. Deep brain stimulation is a safe and effective therapy option for medically refractory neurological disorders and we may predict further substantial advances in this field (time-saving automatic programming, minimalization and longevity of batteries, user-friendly patient programmers).
Keywords:
deep brain stimulation – stimulation parameters – technology innovation
Autoři: Z. Košutzká 1; A. Kušnírová 1; I. Straka 1; P. Matejička 1; G. Timárová 1; M. Minár 1; M. Kľoc 2; M. Novotný 3; P. Valkovič 1,4
Působiště autorů: II. neurologická klinika, LF UK a UN Bratislava, SR 1; Neurochirurgická klinika, UN – Nemocnica svätého Michala, Bratislava, SR 2; Neurochirurgická klinika LF UK, SZU a UN Bratislava. SR 3; Ústav normálnej a patologickej, fyziológie, Centrum experimentálnej, medicíny Slovenskej akadémie vied, Bratislava, SR 4
Vyšlo v časopise: Cesk Slov Neurol N 2022; 85(1): 24-30
Kategorie: Přehledný referát
doi: https://doi.org/10.48095/cccsnn202224Souhrn
Hlboká mozgová stimulácia (deep brain stimulation; DBS) je súčasťou pokročilej liečby vybraných neurologických ochorení, pri ktorých nie je dostatočne efektívna konzervatívna terapia. Etablovanými indikáciami sú Parkinsonova choroba, rôzne formy dystónie a esenciálny tras. V posledných rokoch sa rozšírilo indikačné spektrum DBS v rámci neurológie o vybrané formy epilepsie a v experimentálnej rovine prebiehajú klinické štúdie s využitím DBS pri chronickej klastrovej bolesti hlavy a ďalších extrapyramídových ochoreniach (Tourettov syndróm, Huntingtonova choroba). Ďalším posunom sú technologické inovácie v oblasti hardvéru. Prakticky všetky neurostimulátory sú kompatibilné s MR a životnosť batérie sa výrazne predĺžila (výrobca garantuje 13 rokov, ale experimentálne dáta predikujú životnosť pri nabíjateľných neurostimulátoroch až do 25 rokov). V rutinnej praxi sa začali používať tzv. smerovateľné elektródy, ktoré umožňujú presnejšie zacielenie elektrického poľa a minimalizáciu stimuláciou indukovaných nežiaducich účinkov. DBS je teda bezpečnou a efektívnou liečbou medicínsky refraktérnych neurologických ochorení a rýchlosť pokroku na tomto poli predpokladá ešte ďalšie zdokonalenie (automatizácia programovania, zmenšovanie a ďalšie predlžovanie životnosti batérie, jednoduchšia obslužnosť).
Klíčová slova:
hlboká mozgová stimulácia – stimulačné parametre – technologická inovácia
Úvod
Hlboká mozgová stimulácia (deep brain stimulation; DBS) je etablovanou liečebnou metódou v Čechách aj na Slovensku už viac ako 20 rokov. Za toto obdobie sa stala štandardnou súčasťou pokročilej liečby extrapyramídových ochorení a epilepsie. Experimentálne poznatky priniesli viaceré zaujímavé inovácie v oblasti nových indikácií, vylepšení hardvéru a prístupov, ktoré majú za cieľ zlepšiť účinnosť a bezpečnosť DBS, ako aj komfort pacienta.
Novšie indikácie hlbokej mozgovej stimulácie
Parkinsonova choroba (PCh), generalizované formy dystónie a esenciálny tras sú „najstaršími“ indikáciami DBS v neurológii. V posledných rokoch pribudlo veľa experimentálnych štúdií, ktoré rozširujú terapeutické možnosti o nové indikácie. Niektoré z nich získali tzv. CE mark (skratka Conformité Européenne – produkt spĺňa požiadavky Európskej únie na bezpečnosť), príkladom je epilepsia a obsedantno-kompulzívna porucha (obsessive-compulsive disorder; OCD). Iné ostávajú „OFF label” v experimentálnej fáze pokračujúcich klinických štúdií (Tourettov syndróm, Huntingtonova choroba, vybrané typy chronických bolestí hlavy a i.).
V Čechách a na Slovensku je relatívne novou DBS indikáciou tzv. refraktérna epilepsia (drug resistant epilepsy; DRE), ktorou trpí najmenej 30 % pacientov s epilepsiou. Resektívna epileptochirurgia je vhodná iba pre časť týchto pacientov, ostatní môžu profitovať z neurostimulačných metód. Prvé štúdie s použitím DBS pri epilepsii sa objavili už v 70. a 80. rokoch 20. storočia. Odvtedy bolo publikovaných mnoho štúdií o účinnosti a bezpečnosti DBS rôznych cieľov pri epilepsii (centromediálne jadro talamu, hipokampus, nucleus caudatus, subtalamické jadro [STN], zadný hypotalamus a cerebellum), ale väčšina bola realizovaná na malých nekontrolovaných súboroch pacientov s nehomogénnymi výsledkami [1]. Najčastejšie využívaným anatomickým cieľom v liečbe DRE je predná časť talamu (anterior nuclei of thalamus; ANT). Účinnosť talamickej stimulácie bola potvrdená výsledkami multicentrickej, dvojito zaslepenej kontrolovanej štúdie SANTE (Stimulation of the Anterior Nucleus of the Thalamus for Epilepsy) u 110 pacientov s fokálnou alebo sekundárne generalizovanou epilepsiou [2]. Výhodou ANT je jeho veľkosť, vzdialenosť cievnych štruktúr a rozsiahle zapojenia v šírení epileptických záchvatov cez limbický systém. V štúdii SANTE medián poklesu frekvencie záchvatov stúpal s dlhšou dobou stimulácie, bol 41 % po roku, 56 % po dvoch rokoch a 68 % po troch rokoch. V štúdii sa nevyskytli hemoragické komplikácie, u dvoch pacientov bol nárast frekvencie záchvatov, na úrovni 10 % sa vyskytli parestézie, infekcie a lokálna bolesť. Častejšie ako v kontrolnej skupine boli prítomné pamäťové problémy a depresia. Vo väčšine európskych krajín vrátane SR nie je podmienkou pre ANT zlyhanie vagovej stimulácie. Vo všeobecnosti je DBS pri epilepsii dobre tolerovaná a v súčasnosti ju možno odporučiť ako efektívnu metódu DBS u DRE.
Tourettov syndróm (TS) je ďalšie neuropsychiatrické ochorenie, pri ktorom pribúdajú dvojito-zaslepené randomizované klinické štúdie potvrdzujúce efektivitu a bezpečnosť terapie DBS, avšak aj naďalej ostáva experimentálnou indikáciou. V porovnaní s ostatnými DBS indikáciami sú dizajn a výstupy štúdií komplikované zložitejšou selekciou pacientov, nakoľko TS je klinicky značne heterogénne ochorenie. Vzhľadom na komplexnosť TS (kombinácia pohybových abnormalít a psychiatrickej symptomatiky) bolo realizovaných veľa klinických štúdií s využitím celej plejády anatomických cieľov (pozri prehľadový článok od Casagrande et al [3]). Najčastejšie využívanými cieľmi je talamus a interné palidum (internal globus pallidus; GPi). Retrospektívna štúdia z roku 2016 u pacientov s refraktérnym TS a psychiatrickými komorbiditami preukázala, že zacielenie elektród DBS v centromediálnych a parafascikulárnych jadrách talamu bolo asociované so zmiernením motorických tikov o 46 % a zmiernením vokálnych tikov o 52 % [4]. Okrem týchto pozitívnych výsledkov bolo stimuláciou v jadrách talamu dosiahnuté aj zlepšenie sociálneho, pracovného a vzdelávacieho fungovania pacientov, ako aj zmiernenie prejavov asociovanej OCD, úzkosti a depresie [5,6]. Bilaterálna stimulácia posteroventrálnej časti GPi sa pri TS preukázala ako efektívna pri zmiernení tikových prejavov spolu so zmiernením závažnosti komorbídnej depresie [7]. Nakoľko je GPi používané v pokročilej liečbe PCh, veľa centier sa rozhoduje pre implantáciu tejto „klasickej“ posteroventrálnej (motorickej) časti GPi. Ďalšou alternatívou je anteromediálna (limbická časť) a mediálna časť GPi s o niečo lepším efektom na neuropsychiatrické komorbidity [8]. Niekoľko štúdií s malým počtom participantov bolo zameraných na hodnotenie efektivity implantácie DBS s cieľom v nucleus accumbens a prednom ramienku capsula interna pri liečbe TS, pričom pri obidvoch bol preukázaný priaznivý účinok stimulácie na tiky a taktiež zníženie závažnosti OCD symptómov preukázateľné aj po 36 mesiacoch po implantácii DBS [9,10].
Ďalšou potenciálnou experimentálnou indikáciou DBS je Huntingtonova choroba (HCh), ktorá má len veľmi málo efektívnych terapeutických možností. Na základe doterajších údajov má najväčší potenciál stimulácia GPi. Vedie k signifikantnému zmierneniu chorey, zlepšeniu telesných aspektov kvality života [11] a dokonca k oddialeniu kognitívnej deteriorácie [12]. Výsledky však boli menej uspokojivé u pokročilých pacientov so závažnejšími príznakmi HCh [13]. V skorých štádiách HCh degenerujú prevažne striatálne neuróny projikujúce sa do externého palida (external pallidum; GPe), čo je pravdepodobne podkladom pre vznik kognitívneho deficitu pri HCh. Stimulácia GPe má v tomto prípade mierne lepší efekt na ovplyvnenie kognitívnych funkcií oproti zacieleniu v GPi. Všeobecne by sa dalo povedať, že stimulácia palidálneho systému spomaľuje deterioráciu kognitívnych funkcií a udržuje do istej miery kognitívne schopnosti na stabilnej úrovni [14].
Chronické klastrové bolesti hlavy sú ďalšou indikáciou DBS, ktorá by sa čoskoro mohla dostať do rutinnejšej praxe. Asi u 15 % pacientov klastrové bolesti hlavy nereagujú na medikamentóznu liečbu [15]. Najviac štúdií s DBS v terapii klastrových bolestí hlavy bolo zrealizovaných so stimuláciou zadného hypotalamu a ventrálnej tegmentálnej oblasti, avšak stále chýbajú väčšie štúdie s dvojitým zaslepením a randomizáciou. V prípade hypotalamickej DBS došlo u 60 % pacientov k redukcii bolesti minimálne o 50 % a u niektorých pacientov došlo až k úplnému vymiznutiu bolesti hlavy [16]. Zaujímavosťou je, že hoci pri hypotalamickej stimulácii zvyčajne nedochádza k podstatným zmenám vo funkciách riadených hypotalamom, odporúča sa monitorovať autonómne funkcie, koncentrácie hormónov, kardiovaskulárne funkcie, správanie, náladu a spánkový cyklus. V prípade stimulácie ventrálnej tegmentálnej oblasti, ktorá je podľa PET štúdií najviac aktívnou zónou pri ataku klastrovej bolesti hlavy, boli tiež zaznamenané obdobné výsledky, aj keď v štúdiách s prospektívnym nezaslepeným dizajnom. V štúdii londýnskej skupiny, ktorá využíva implantáciu elektród pod navigáciou MR a verifikáciou, bolo zaznamenané až 60% zlepšenie frekvencie atakov a 30% zlepšenie intenzity s mediánom sledovania 18 mesiacov [17].
Modulačný efekt DBS je využívaný aj v terapii chronickej bolesti, najčastejšie v indikácii postiktálneho talamického syndrómu, fantómovej bolesti a posttraumatických lézií brachiálneho plexu [18]. Už v roku 1977 bola publikovaná práca, v ktorej dokázali zmierniť chronickú bolesť u 6 prevažne onkologických pacientov implantovaním DBS do periventrikulárnej a periakveduktálnej šedej hmoty [19]. Všeobecne platí, že toto anatomické zacielenie je preferovaným cieľom pre nociceptívny typ bolesti a senzorický talamus je skôr efektívny v terapii neuropatickej bolesti [20]. Zaujímavým prístupom v liečbe bolestivého talamického syndrómu je implantácia elektród DBS do predného cingulátového kortexu. Nejde však o „priame“ ovplyvnenie dráhy bolesti, ale skôr o moduláciu kognitívnej a afektívnej zložky vnímania bolesti. V štúdiách s otvoreným sledovaním síce nenastalo signifikantné zlepšenie intenzity bolesti, ale výrazne sa zmiernil emočný distres, kvalita života a funkčnosť pacientov [21].
Načasovanie operačného zákroku implantácie elektród DBS
Implantácia elektród DBS sa zvažuje po vyčerpaní konzervatívnych možností, avšak aktuálnym trendom je indikácia pacientov v počiatočných štádiách zneschopnenia so zachovaným pracovným zaradením. Opodstatnenosť skoršej indikácie pacientov s PCh na DBS potvrdila štúdia EARLYSTIM [22], do ktorej boli zaradení mladší pacienti s relatívne kratšou dĺžkou trvania ochorenia a vo včasnejšom štádiu motorických komplikácií. V porovnaní s najlepšou medikamentóznou liečbou sa mali pacienti s DBS v zacielení STN lepšie prakticky vo všetkých hodnotených parametroch. Ďalším významným výstupom je dôležitosť kvality života pred operáciou, ktorá bola jediným prediktorom dobrého efektu operácie v dvojročnom sledovaní po operácii. Pacienti s relatívne zachovanou kvalitou života predoperačne mali teda najlepší objektívny aj subjektívny benefit z operácie [23]. Obdobné štúdie pri dystónii a trase neboli realizované, čo je pochopiteľné najmä z hľadiska komplikovanosti dizajnu pri týchto indikáciách. Prediktorové štúdie však naznačujú, že pacienti s kratším trvaním dystónie, najmä v prípade generalizovaných foriem, majú lepší pooperačný efekt DBS [24].
Novinky v perioperačnom manažmente pacienta s DBS
Odstránenie vlasov pred implantáciou DBS môže pôsobiť ako zdanlivo nepodstatná vec, avšak pre samotného pacienta je výrazným estetickým a psychologickým zásahom. Navyše sa nepotvrdila zvýšená prevalencia predpokladaných infekcií pri pacientoch so zachovanou vlasovou pokrývkou, preto stále viac centier preferuje tento prístup [25]. Samotný neurochirurgický zákrok sa realizuje pri väčšine indikácií v lokálnej anestéze, vzhľadom na potrebu neurofyziologickej verifikácie pozície elektródy a intraoperačný monitoring stimuláciou indukovaných nežiaducich účinkov. Aktuálnym trendom je implantácia v celkovej anestéze, resp. s krátkym odtlmením pacienta počas zákroku. Podávanie vybraných anestetík podľa príslušných dávkovacích vzorcov (dexmedetomidín, propofol a remifentanil) nemá signifikantný vplyv na kvalitu neurofyziologického monitoringu [26]. Ďalšou alternatívou zlepšujúcou komfort pacienta je bezrámový implantačný prístup, čiže pacient nemá hlavu zafixovanú v stereotaktickom ráme, ale má priamo na lebke pripevnené zameriavacie zariadenie. Výhodou je teda relatívne voľnejší pohyb hlavou a presnosť umiestnenia elektródy je porovnateľná s postupmi využívajúcimi stereotaktický rám [27]. Niektoré centrá s dostupnosťou zobrazovacích modalít na operačnej sále využívajú implantáciu elektród pod CT, MR, O-ramennou navigáciou, teda s vynechaním neurofyziologickej verifikácie pozície elektródy [28,29]. Presnosť a klinický benefit je opäť porovnateľný s operačnými technikami využívajúcimi intraoperačný neuromonitoring.
Technologické inovácie DBS hardvéru
Technologický pokrok v dizajne neurostimulátorov, elektród a stimulačných paradigiem zabezpečil zvýšenie účinnosti a minimalizáciu nežiadúcich účinkov stimulácie so sľubnými vyhliadkami do ďalších rokov (v prípade podrobnejšieho záujmu o aktuálne a hlavne budúce trendy technológií DBS, dávame čitateľovi do pozornosti publikáciu od Kraus et al [30]). Aktuálnym trendom je miniaturizácia veľkosti batérie pri zachovaní, resp. predĺžení jej životnosti. V porovnaní s kardiostimulátormi, ktoré sú aktuálne približne desaťkrát menších rozmerov ako konvenčne používané neurostimulátory s možnosťou priamej implantácie do srdca, je hlavnou prekážkou zmenšenia veľkosti relatívne vyššia intenzita stimulácie v prípade DBS. V súčasnosti si veľkosť batérie neurostimulátora vyžaduje umiestnenie do podkľúčnej oblasti resp. brucha, s čím súvisí potreba tunelizácie pre vstup extenčných káblov v celkovej anestézii. Vzhľadom na asociované hardvérové komplikácie (najmä infekcie a mechanické poškodenie) a zlepšenie celkového komfortu pacienta je snaha o umiestnenie miniaturizovaného neurostimulátora priamo do lebečnej kosti. Aktuálne je využívaný takýto typ neurostimulátora hlavne pri epilepsii [31] a prebiehajú klinické štúdie aj na pacientoch s PCh. V súčasnej dobe sú implantované neurostimulátory od všetkých výrobcov MR kompatibilné v prístrojoch do 1,5 T, ktoré však musia spĺňať presné nastavenie intenzity magnetizmu. Pred vyšetrením je stimuláciu nutné vypnúť, resp. dať do špeciálneho módu MR.
Doposiaľ fungovala väčšina batérií DBS na princípe konštantného napätia, ktorá je viac závislá na impedanciách tkaniva v tesnom okolí elektródy. Aktuálnym trendom sú neurostimulátory pracujúce na princípe konštantného prúdu, ktoré nie sú výraznejšie ovplyvnené odporom tkaniva v jeho blízkosti, stimulácia by tak mala byť stabilnejšia a efektívnejšia, a to aj v dlhodobom sledovaní [32]. Elektródy a neurostimulátory od firmy Boston Scientific využívajú technológiu tzv. nezávislých zdrojov konštantného prúdu („multiple independent current control“). Stimulácia tak môže byť presnejšie regulovaná na každom kontakte s možnosťou tvarovania elektrického poľa v prípade smerovateľných elektród, ktorým je možné rozšírenie terapeutického okna a minimalizácia nežiaducich účinkov. V tomto kontexte je veľmi dôležitá vizualizácia polohy elektródy a lokálnych anatomických pomerov. Na rekonštrukciu umiestnenia elektród sú k dispozícii rôzne softvérové platformy, ktoré sa používajú v klinickej praxi (Lead-DBS, Cicerone [Boston Scientific, Marlborough, MA, USA], Optivize [Medtronic, Dublin, Írsko], Neurotargeting LLC [Nashville, TN, USA]). Terapeutický efekt stimulácie je tak možné dosiahnuť aj pri suboptimálne umiestnených elektródach (kazuistika pacienta je uvedená na obr. 1). K dispozícii sú výpočtové a simulačné programy, ktoré dokážu vizualizovať veľkosť elektrického poľa v konkrétnych anatomických pomeroch na základe zadaných parametrov stimulácie („volume of tissue activated“). Na základe simulácie je možné vybrať najefektívnejšie stimulačné parametre. V klinickej praxi sa totiž často vyskytuje prestimulovanie pacientov. Zaujímavosťou je, že s využitím výpočtových modelov sa podarilo znížiť spotrebu elektrickej energie až o 60 % pri zachovaní priaznivého klinického efektu stimulácie [33]. Aktuálne však stále absentujú algoritmy, ktoré by ponúkli systematický prístup k programovaniu. Hľadanie optimálneho nastavenia tak môže byť časovo náročné a neefektívne. Oproti štandardným štvorkontaktovým elektródam a smerovateľným elektródam je možné využiť aj elektródy s ôsmimi kontaktmi, ktorými sa dá stimulovať väčšia oblasť a viac anatomických cieľov súčasne. Príkladom je stimulácia STN a substantia nigra pars reticulata, ktorú je možné využiť pri freezingu chôdze asociovanom s PCh [34].
Obr. 1. Vizualizácia suboptimálne uloženej ľavej elektródy u pacienta s Parkinsonovou chorobou – laterálnejšie a hlbšie umiestnenie (zelené – subtalamické jadro, červené –nucleus ruber, fialové – substantia nigra). U tohto pacienta sme využili tvarovanie elektrického poľa (modrou farbou) s presnejším nasmerovaním do oblasti senzorimotorickej časti subtalamického jadra s výraznym klinickým zlepšením. S láskavou pomocou Julie Dunnavant.
Fig. 1. Visualization of suboptimal electrode position in a patient with Parkinson´s disease – more lateral and deeper position (green – subthalamic nucleus, red – nucleus ruber, purple – substantia nigra). In this patient case, we used a directional lead with current shaping (in blue) focusing on the stimulation toward the sensorimotor part of the subthalamic nucleus with excellent clinical improvement. With the kind assistance of Julie Dunnavant.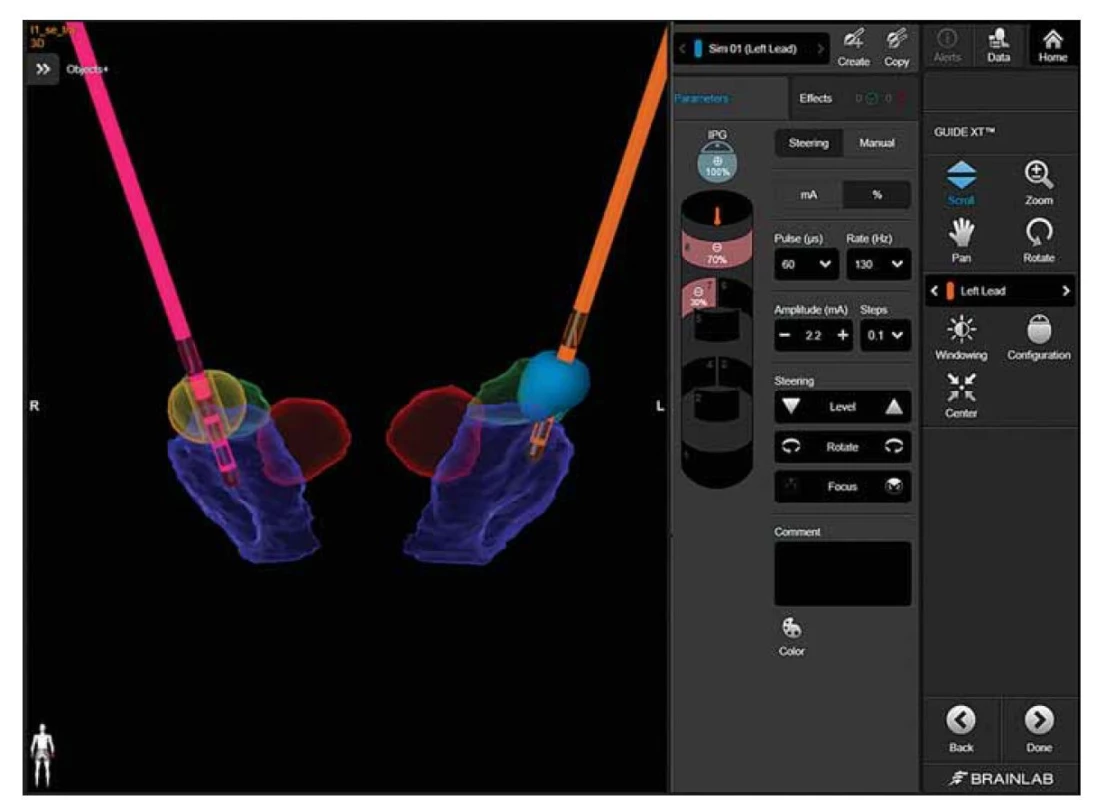
Neurostimulártory novej generácie umožňujú nastavenie nižšej pulzovej šírky (z konvenčných 60 µs na 30 µs). Takýto typ stimulácie umožňuje rozšírenie terapeutického okna a sa osvedčil napr. v manažmente porúch chôdze a reči asociovaných s PCh [35,36]. Ďalšou novinkou v stimulačných stratégiách je tzv. „interleaved” stimulácia, ktorá predstavuje alternujúcu stimuláciu dvoch kontaktov. Používa sa napr. pri potrebe zmiernenia dyskinéz [37] alebo pri využívaní dvoch kontaktov, pri ktorých je potrebná odlišná amplitúda [38]. Prehľad najdôležitejších technologických inovácií je uvedený na obr. 2.
Obr. 2. Hardvérové technologické inovácie hlbokej mozgovej stimulácie.
Fig. 2. Hardware technological innovations of deep brain stimulation.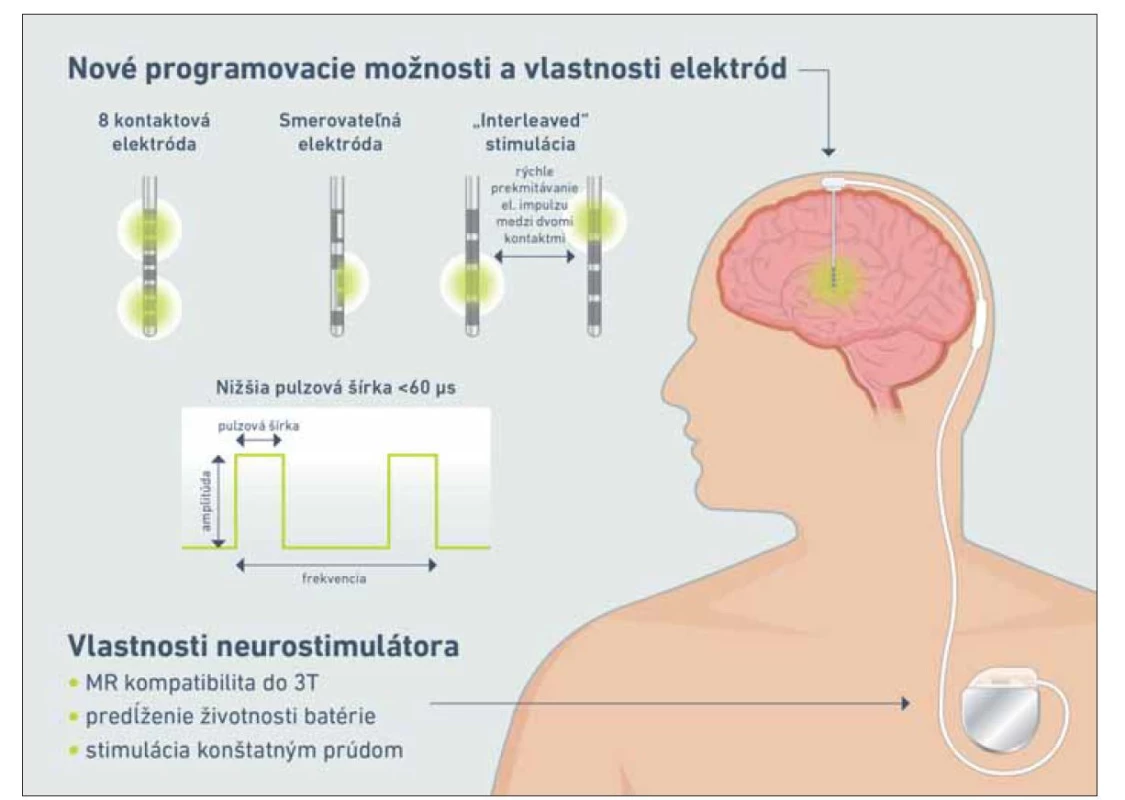
Adaptívna stimulácia („closed-loop“ systémy)
Napriek obrovskému technologickému a medicínskemu pokroku v posledných troch desaťročiach vo sfére DBS, terapeutický proces je stále odkázaný na používanie kontinuálnej stimulácie s manuálnym nastavením počas pravidelných vizít. Napr. v prípade PCh sa môže stav hybnosti dynamicky meniť počas dňa v súvislosti s perorálnou medikáciou. Vzhľadom na tieto obmedzenia je snaha o vyvinutie adaptívnej stimulácie (aDBS), ktorá by pracovala v uzavretej slučke („closed-loop“) s dynamickým prispôsobením stimulačných parametrov aktuálnym symptómom pacienta (princíp aDBS je ilustrovaný na obr. 3) [30]. Veľmi dôležitým krokom vo vývoji aDBS je výber vhodných biomarkerov reflektujúcich klinický stav pacienta. Ako biomarkery aDBS sa využívajú tzv. „local field potentials“ (LFP) snímané z implantovaných elektród v mozgu (elektródy slúžia súčasne ako snímacie aj stimulačné), alebo biomarkery snímané z periférie prostredníctvom elektromyografie či pomocou inerciálnych senzorov [39]. Pri LFP sa jedná o špecifické biosignály, ktoré predstavujú aktivitu veľkej populácie neurónov. Jedným zo sľubných LFP biomarkerov pre aDBS pri PCh je prítomnosť tzv. betaaktivity (s frekvenciou 13–35 Hz) oscilujúcej v okolí STN, v projekciách do bazálnych ganglií a kortexu. Patologická aktivita v pásme beta koreluje so zhoršením motorických funkcií a jej potlačenie, medikamentózne alebo pomocou DBS, vedie k zlepšeniu hybnosti [40,41]. Zvýšená betaaktivita vo frekvenčnom rozmedzí 13–35 Hz v STN alebo v GPi je pri PCh asociovaná s bradykinézou a rigiditou, avšak nie s tremorom. Je nutné zdôrazniť, že betaaktivita je zjavná a zosnímateľná v priebehu veľa rokov, čo je dobrým prediktorom dlhodobého využívania pre účely aDBS [42]. Hoci sa použitiu aDBS pri PCh venuje najviac pozornosti, v objekte záujmu ostávajú aj ostatné diagnózy liečené pomocou DBS. Vhodným biomarkerom LFP pre aDBS pri primárnej dystónii sa javia nízkofrekvenčné oscilácie s frekvenciou 4–12 Hz snímané elektródou z GPi [43]. V prípade sekundárnej dystónie, pri ktorej je všeobecne menej konzistentná úspešnosť terapie DBS, bola tiež identifikovaná elektrofyziologická aktivita s obdobnou frekvenciou 5–18 Hz [44]. Tieto výsledky by mohli byť potenciálne využité v personalizácii terapie DBS pri sekundárnych dystóniach, a tým aj k zlepšeniu výsledného klinického efektu. Pri esenciálnom tremore zatiaľ neboli objavené vhodné biomarkery LFP, ktoré by mohli hrať úlohu v aDBS. Pozornosť sa tu upriamuje skôr na periférne uložené senzory (elektromyografiu či inerciálne senzory), ktoré by poskytovali spätnú informáciu pre riadenie neurostimulátora.
Obr. 3. Princíp adaptívnej hlbokej mozgovej stimulácie na príklade pacienta s Parkinsonovou chorobou.
LFP – local field potentials
Fig. 3. Principles of adaptive deep brain stimulation in the context of a patient with Parkinson´s disease.
LFP – local field potentials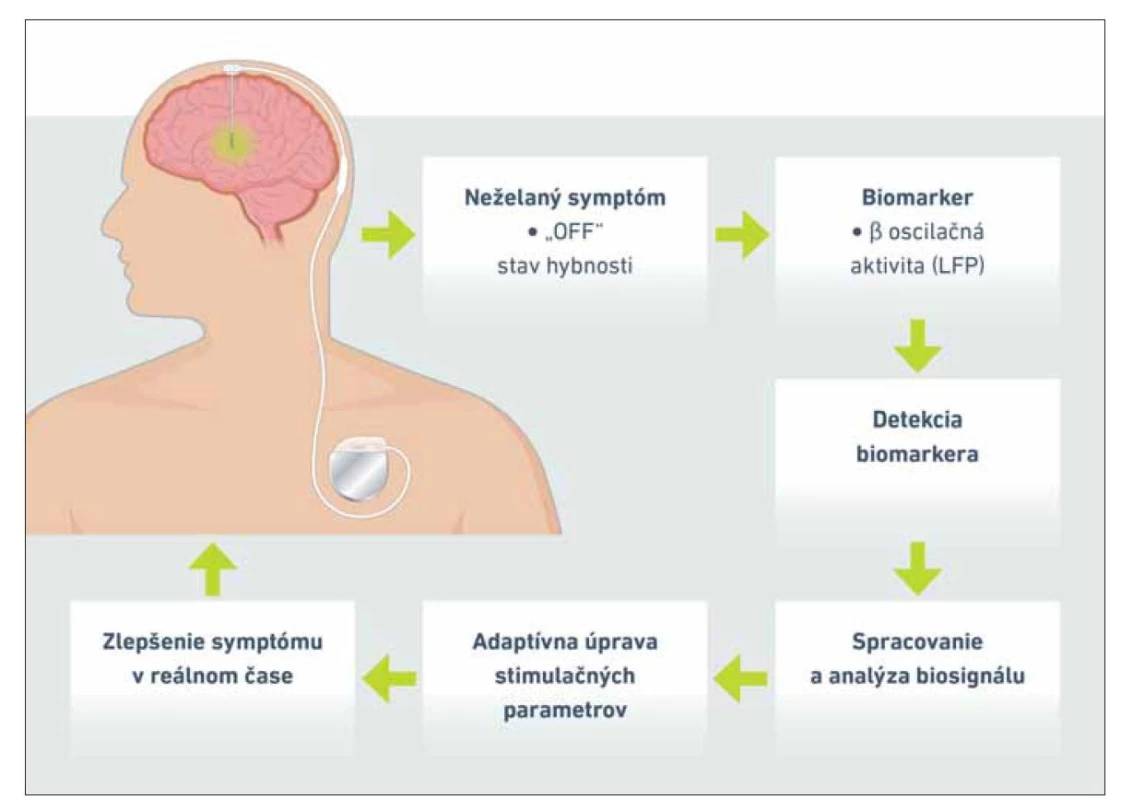
Využitie aDBS je zatiaľ v prevažne experimentálnej rovine, avšak je otázkou krátkeho času, kedy bude metódou neurostimulácie v rutinnej klinickej praxi. Najnovšou technologickou inováciou je platforma Percept PC (Medtronic, Dublin, Írsko), ktorá umožňuje nahrávanie LFP (tzv. „brainsensing“) a súčasné zaznamenávanie symptómov prostredníctvom pacientskeho programátora. Umožnená je tak korelácia neurofyziologických biomarkerov s pacientskou spätnou väzbou, čo môže pomôcť k optimalizácii stimulačných parametrov a medikamentóznej liečby. Nezanedbateľnou výhodou neurostimulátora tohto typu je menšia veľkosť, dlhšia výdrž batérie oproti predchádzajúcej generácii batérií a kompatibilita s 3T MR.
Využitie konektómu v optimalizácii DBS terapie
Dlhé roky sa predpokladalo, že DBS funguje na princípe lokálnej modulácie samotného cieľa, avšak štúdie z posledných rokov preukázali, že modulačné účinky sú distribuované aj na neuronálne siete a sú pre optimálny efekt DBS rovnako dôležité [45]. Tento posun v paradigme sa dokázal práve pomocou neurozobrazovacích štúdií s využitím ľudského konektómu, ktorý možno chápať ako matematické spracovanie vzťahov medzi jednotlivými anatomickými štruktúrami mozgu [46]. Tieto prepojenia sú charakterizované tzv. štrukturálnou a funkčnou konektivitou, čiže axonálnym a „pracovným” prepojením jednotlivých anatomických štruktúr a ich projekcií. Jej prínos má význam najmä pri skúmaní vzťahov medzi polohou elektródy a zlepšením symptómov. Napr. v prípade stimulácie v zacielení STN pri PCh, konektivita s primárnou motorickou kôrou vysvetľuje zlepšenie tremoru, bradykinézy so suplementárnou motorickou oblasťou (supplementary motor area; SMA), bradykinézy a rigidity so SMA aj prefrontálnym kortexom [47,48]. Na základe skúmania profilov konektivity elektród na normatívnych dátach je teda možné predikovať zlepšenie vybraných symptómov pacientov. Individualizované modely konektómov v kombinácii s klinickými premennými pacienta tak perspektívne umožní výber najvhodnejšieho anatomického umiestnenia elektródy [49].
Vyhliadky do budúcnosti
V nasledujúcich rokoch sa bude veľmi pravdepodobne rozširovať indikačné spektrum o nové neurologické ochorenia s presnejšou špecifikáciou selekčných kritérií pacientov a anatomických cieľov pre jednotlivé indikácie. Snáď najvýraznejší pokrok zaznamenáme v oblasti personalizácie DBS. Výber najvhodnejších stimulačných parametrov bude realizovaný prostredníctvom automatizovaných algoritmov na základe individuálnych charakteristík pacienta (predoperačný klinický stav pacienta, zobrazovacie vyšetrenie hlavy s polohou elektród a pooperačný klinický obraz). Personalizácia terapie DBS bude tak časovo menej náročná. Stimulácia bude aplikovaná v adaptívnom móde, prostredníctvom ktorého bude možnosť minimalizovať nežiadúce účinky a predĺžiť životnosť batérie. Vzhľadom na celkové zlepšenie terapie DBS v posledných rokoch, je možné predpovedať ďalší technologický pokrok, ktorý výrazne zefektívni manažment pacientov s DBS.
Konflikt záujmov
Autori deklarujú, že v súvislosti s predmetom štúdie nemajú žiadny konflikt záujmov.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.MUDr. Zuzana Košutzká, PhD.
II. neurologická klinika
LF UK a UN Bratislava
Limbová 5
833 05 Bratislava
Slovenská republika
e-mail: zuzanakosutzka@gmail.com
Přijato k recenzi: 25. 8. 2021
Přijato do tisku: 7. 2. 2022
Zdroje
1. Zangiabadi N, Ladino LD, Sina F et al. Deep brain stimulation and drug-resistant epilepsy: a review of the literature. Front Neurol 2019; 10 : 601. doi: 10.3389/fneur.2019. 00601.
2. Salanova V, Witt T, Worth R et al. Long-term efficacy and safety of thalamic stimulation for drug-resistant partial epilepsy. Neurology 2015; 84 (10): 1017–1025. doi: 10.1212/WNL.0000000000001334.
3. Casagrande SCB, Cury RG, Alho EJL et al. Deep brain stimulation in Tourette’s syndrome: evidence to date. Neuropsychiatr Dis Treat 2019; 15 : 1061–1075. doi: 10.2147/NDT.S139368.
4. Testini P, Zhao C, Stead M et al. Centromedian-parafascicular complex deep brain stimulation for Tourette syndrome: a retrospective study. Mayo Clin Proc 2016; 91 (2): 218–225. doi: 10.1016/j.mayocp.2015.11.016.
5. Kaido T, Otsuki T, Kaneko Y et al. Deep brain stimulation for Tourette syndrome: a prospective pilot study in Japan. Neuromodulation 2011; 14 (2): 123–128. doi: 10.1111/j.1525-1403.2010.00324.x.
6. Marano M, Migliore S, Squitieri F et al. CM-Pf deep brain stimulation and the long term management of motor and psychiatric symptoms in a case of Tourette syndrome. J Clin Neurosci 2019; 62 : 269–272. doi: 10.1016/j.jocn.2018.12.029.
7. Kefalopoulou Z, Zrinzo L, Jahanshahi M et al. Bilateral globus pallidus stimulation for severe Tourette’s syndrome: a double-blind, randomised crossover trial. Lancet Neurol 2015; 14 (6): 595–605. doi: 10.1016/S1474-4422 (15) 00008-3.
8. Viswanathan A, Jimenez-Shahed J, Carvallo JFB et al. Deep brain stimulation for Tourette syndrome: target selection. Stereotact Funct Neurosurg 2012; 90 (4): 213–224. doi: 10.1159/000337776.
9. Neuner I, Podoll K, Lenartz D et al. Deep brain stimulation in the nucleus accumbens for intractable Tourette’s syndrome: follow-up report of 36 months. Biol Psychiatry 2009; 65 (4): e5–6. doi: 10.1016/j.biopsych.2008.09.030.
10. Sachdev PS, Cannon E, Coyne TJ et al. Bilateral deep brain stimulation of the nucleus accumbens for comorbid obsessive compulsive disorder and Tourette’s syndrome. BMJ Case Rep 2012; 2012: bcr2012006579. doi: 10.1136/bcr-2012-006579.
11. Gonzalez V, Cif L, Biolsi B et al. Deep brain stimulation for Huntington’s disease: long-term results of a prospective open-label study. J Neurosurg 2014; 121 (1): 114–122. doi: 10.3171/2014.2.JNS131722.
12. Sanrey E, Macioce V, Gonzalez V et al. Does pallidal neuromodulation influence cognitive decline in Huntington’s disease? J Neurol 2021; 268 (2): 613–622. doi: 10.1007/s00415-020-10206-w.
13. Zittel S, Tadic V, Moll CKE et al. Prospective evaluation of Globus pallidus internus deep brain stimulation in Huntington’s disease. Parkinsonism Relat Disord 2018; 51 : 96–100. doi: 10.1016/j.parkreldis.2018.02.030.
14. Wojtecki L, Groiss SJ, Ferrea S et al. A prospective pilot trial for pallidal deep brain stimulation in Huntington’s disease. Front Neurol 2015; 6 : 177. doi: 10.3389/fneur.2015.00177.
15. Voigt AW, Gould HJ. Chronic daily headache: mechanisms and principles of management. Curr Pain Headache Rep 2016; 20 (2): 10. doi: 10.1007/s11916-016-0542-3.
16. Fontaine D, Vandersteen C, Magis D et al. Neuromodulation in cluster headache. Adv Tech Stand Neurosurg 2015; 42 : 3–21. doi: 10.1007/978-3-319-09066-5_1.
17. Akram H, Miller S, Lagrata S et al. Ventral tegmental area deep brain stimulation for refractory chronic cluster headache. Neurology 2016; 86 (18): 1676–1682. doi: 10.1212/WNL.0000000000002632.
18. Frizon LA, Yamamoto EA, Nagel SJ et al. Deep brain stimulation for pain in the modern era: a systematic review. Neurosurgery 2020; 86 (2): 191–202. doi: 10.1093/neuros/nyy552.
19. Hosobuchi Y, Adams JE, Linchitz R. Pain relief by electrical stimulation of the central gray matter in humans and its reversal by naloxone. Science 1977; 197 (4299): 183–186. doi: 10.1126/science.301658.
20. Levy R, Deer TR, Henderson J. Intracranial neurostimulation for pain control: a review. Pain Physician 2010; 13 (2): 157–165.
21. Levi V, Cordella R, D‘Ammando et al. Dorsal anterior cingulate cortex (ACC) deep brain stimulation (DBS): a promising surgical option for the treatment of refractory thalamic pain syndrome (TPS). Acta Neurochir (Wien) 2019; 161 (8): 1579–1588. doi: 10.1007/s00701-019-03975-5.
22. Schuepbach WMM, Rau J, Knudsen K et al. Neurostimulation for Parkinson’s disease with early motor complications. N Engl J Med 2013; 368 (7): 610–622. doi: 10.1056/NEJMoa1205158.
23. Schuepbach WMM, Tonder L, Schnitzler A et al. Quality of life predicts outcome of deep brain stimulation in early Parkinson disease. Neurology 2019; 92 (10): e1109–e1120. doi: 10.1212/WNL.0000000000007037.
24. Isaias IU, Alterman RL, Tagliati M. Outcome predictors of pallidal stimulation in patients with primary dystonia: the role of disease duration. Brain 2008; 131 (Pt 7): 1895–1902. doi: 10.1093/brain/awn120.
25. Gubler FS, Ackermans L, Kubben PL et al. Infections in deep brain stimulation: shaving versus not shaving. Surg Neurol Int 2017; 8 : 249. doi: 10.4103/sni.sni_172_17.
26. Grant R, Gruenbaum SE, Gerrard J. Anaesthesia for deep brain stimulation: a review. Curr Opin Anaesthesiol 2015; 28 (5): 505–510. doi: 10.1097/ACO.0000000000000230.
27. Krahulík D, Nevrlý M, Otruba P et al. O-arm navigated frameless and fiducial-less deep brain stimulation. Brain Sci 2020; 10 (10): 683. doi: 10.3390/brainsci10100683.
28. Aviles-Olmos I, Kefalopoulou Z, Tripoliti E et al. Long--term outcome of subthalamic nucleus deep brain stimulation for Parkinson’s disease using an MRI-guided and MRI-verified approach. J Neurol Neurosurg Psychiatry 2014; 85 (12): 1419–1425. doi: 10.1136/jnnp-2013-306907.
29. Krahulík D, Nevrlý M, Otruba P et al. Placement accuracy of deep brain stimulation electrodes using the NexFrame frameless system. Cesk Slov Neurol N 2017; 80/113 (2): 208–212. doi: 10.14735/amcsnn2017208.
30. Krauss JK, Lipsman N, Aziz T et al. Technology of deep brain stimulation: current status and future directions. Nat Rev Neurol 2021; 17 (2): 75–87. doi: 10.1038/s41582-020-00426-z.
31. Jarosiewicz B, Morrell M. The RNS system: brain-responsive neurostimulation for the treatment of epilepsy. Expert Rev Med Devices 2021; 18 (2): 129–138. doi: 10.1080/17434440.2019.1683445.
32. Bronstein JM, Tagliati M, McIntyre C et al. The rationale driving the evolution of deep brain stimulation to constant-current devices. Neuromodulation 2015; 18 (2): 85–88. doi: 10.1111/ner.12227.
33. Frankemolle AMM, Wu J, Noecker AM et al. Reversing cognitive-motor impairments in Parkinson’s disease patients using a computational modelling approach to deep brain stimulation programming. Brain 2010; 133 (Pt 3): 746–761. doi: 10.1093/brain/awp315.
34. Weiss D, Walach M, Meisner C et al. Nigral stimulation for resistant axial motor impairment in Parkinson’s disease? A randomized controlled trial. Brain 2013; 136 (Pt 7): 2098–2108. doi: 10.1093/brain/awt122.
35. Fabbri M, Natale F, Artusi CA et al. Deep brain stimulation fine-tuning in Parkinson’s disease: short pulse width effect on speech. Parkinsonism Relat Disord 2021; 87 : 130–134. doi: 10.1016/j.parkreldis.2021.05.007.
36. Kroneberg D, Ewert S, Meyer A-C et al. Shorter pulse width reduces gait disturbances following deep brain stimulation for essential tremor. J Neurol Neurosurg Psychiatry 2019; 90 (9): 1046–1050. doi: 10.1136/jnnp-2018-319427.
37. Kern DS, Picillo M, Thompson JA et al. Interleaving stimulation in Parkinson’s disease, tremor, and dystonia. Stereotact Funct Neurosurg 2018; 96 (6): 379–391. doi: 10.1159/000494983.
38. Miocinovic S, Khemani P, Whiddon R et al. Outcomes, management, and potential mechanisms of interleaving deep brain stimulation settings. Parkinsonism Relat Disord 2014; 20 (12): 1434–1437. doi: 10.1016/j.parkreldis.2014.10.011.
39. Beudel M, Cagnan H, Little S. Adaptive brain stimulation for movement disorders. Prog Neurol Surg 2018; 33 : 230–242. doi: 10.1159/000481107.
40. Fleming JE, Dunn E, Lowery MM. Simulation of closed-loop deep brain stimulation control schemes for suppression of pathological beta oscillations in Parkinson’s disease. Front Neurosci 2020; 14 : 166. doi: 10.3389/fnins.2020.00166.
41. Kühn AA, Kempf F, Brücke C et al. High-frequency stimulation of the subthalamic nucleus suppresses oscillatory b activity in patients with Parkinson’s disease in parallel with improvement in motor performance. J Neurosci 2008; 28 (24): 6165–6173. doi: 10.1523/JNEUROSCI.0282-08.2008.
42. Giannicola G, Rosa M, Servello D et al. Subthalamic local field potentials after seven-year deep brain stimulation in Parkinson’s disease. Exp Neurol 2012; 237 (2): 312–317. doi: 10.1016/j.expneurol.2012.06.012.
43. Piña-Fuentes D, Beudel M, Little S et al. Toward adaptive deep brain stimulation for dystonia. Neurosurg Focus 2018; 45 (2): E3. doi: 10.3171/2018.5.FOCUS18155.
44. Tsang EW, Hamani C, Moro E et al. Prominent 5–18 Hz oscillations in the pallidal-thalamic circuit in secondary dystonia. Neurology 2012; 78 (5): 361–363. doi: 10.1212/WNL.0b013e318245293f.
45. Horn A. The impact of modern-day neuroimaging on the field of deep brain stimulation. Curr Opin Neurol 2019; 32 (4): 511–520. doi: 10.1097/WCO.0000000000000679.
46. Van Essen DC, Ugurbil K, Auerbach E et al. The human connectome project: a data acquisition perspective. Neuroimage 2012; 62 (4): 2222–2231. doi: 10.1016/j.neuroimage.2012.02.018.
47. Akram H, Sotiropoulos SN, Jbabdi S et al. Subthalamic deep brain stimulation sweet spots and hyperdirect cortical connectivity in Parkinson’s disease. Neuroimage 2017; 158 : 332–345. doi: 10.1016/j.neuroimage.2017.07.012.
48. Horn A, Reich M, Vorwerk J et al. Connectivity predicts deep brain stimulation outcome in Parkinson disease. Ann Neurol 2017; 82 (1): 67–78. doi: 10.1002/ana.24974.
49. Elias GJB, Boutet A, Joel SE et al. Probabilistic mapping of deep brain stimulation: insights from 15 years of therapy. Ann Neurol 2021; 89 (3): 426–443. doi: 10.1002/ana.25975.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek Analytické a preanalytické aspekty stanovení lehkých řetězců neurofilament v biologických tekutináchČlánek EditorialČlánek Poděkování recenzentůmČlánek Validace české jazykové verze dotazníků DN4 a PainDetect pro diagnostiku neuropatické bolestiČlánek Sakrální deaferentace a implantace sakrálního neurostimulátoru u pacienta s transverzální míšní lézí
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2022 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Prof. MUDr. Zdeněk Kadaňka, CSc., osmdesátiletý
- Analytické a preanalytické aspekty stanovení lehkých řetězců neurofilament v biologických tekutinách
- Komentář k článku autorů Fialová et al Analytické a preanalytické aspekty stanovení lehkých řetězců neurofilament v biologických tekutinách
- Spontánní intrakraniální hypotenze
- Novinky v liečbe hlbokou mozgovou stimuláciou pri neurologických ochoreniach
- Editorial
- Poruchy čichu po transnazálních endoskopických operacích adenomu hypofýzy
- Výsledky chirurgické terapie meralgia paresthetica 15 pacientů
- Test-retest hodnocení spolehlivosti čichového testu (Odorized Markers Test)
- Česká verze nástroje Mini-BESTest a doporučení pro jeho klinické použití
- Validace české jazykové verze dotazníků DN4 a PainDetect pro diagnostiku neuropatické bolesti
- Vliv fluoxetinu na obnovu funkční nezávislosti u pacientů po akutní ischemické cévní mozkové příhodě a prognostické faktory
- Sakrální deaferentace a implantace sakrálního neurostimulátoru u pacienta s transverzální míšní lézí
- Lokalizovaná neurofibromatóza typu 1 v mozaice
- Anémie z nedostatku železa vykazující progresivní retinální, kochleární a cerebrální trombózu
- Vícečetná tumoriformní ložiska mozku jako první projev demyelinizačního onemocnění
- Cerebrální hyperperfuzní syndrom – vzácná komplikace revaskularizačního výkonu
- Poděkování recenzentům
- Dilatace skalpu podkožními expandéry před sekundární počítačově modelovanou kranioplastikou z porózního polyethylenu
- Zemřel doc. MUDr. Vilibald Vladyka, CSc.
- Zemřela doc. MUDr. Miluše Havlová, CSc.
- Odešel prim. MUDr. Hanuš Baš, CSc.
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Vícečetná tumoriformní ložiska mozku jako první projev demyelinizačního onemocnění
- Spontánní intrakraniální hypotenze
- Novinky v liečbe hlbokou mozgovou stimuláciou pri neurologických ochoreniach
- Analytické a preanalytické aspekty stanovení lehkých řetězců neurofilament v biologických tekutinách
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



