-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Radiologické nálezy u donošených novorozenců s hypoxicko-ischemickou encefalopatií
Radiological Findings in Term-neonates with Hypoxic-ischemic Encephalopathy
Aim:
The analysis of ultrasonographic and MRI brain findings in term neonates with hypoxic-ischemic encephalopathy referred for therapeutic hypothermia.Material and methods:
The study included 39 neonates (25 boys and 14 girls). In 32 cases (82%) US was done during the therapeutic hypothermia, in seven cases (18%) after it ‘s completition. The brain MRI was performed after the therapy in all cases. Subsequently the results from the imaging methods were analyzed.Results:
The most common pathological US findings were low value of the resistive index (53.1% during the hypothermia, 42.9% after it’s completition), the basal ganglia and thalamus injury (15.6% during the hypothermia, 28.6% after it’s completition) and diffuse increased echogenicity of the brain parenchyma (12.8% during the hypothermia). The dominant findings on the brain MRI were the basal ganglia and thalami injuries (82.1%), followed by cortical and subcortical lesions (35.9%) and changes of the posterior limb of the internal capsula (30.8%). The haemorrhage occured in high percentage (35.9%).Conclusion:
Pathological US brain findings in neonates with hypoxic-ischemic encephalopathy performed during the therapy and after the treatment were present in 68.7% and 57.1%, resp. MRI examinations depicted pathology in 82.1%.Key words:
hypoxic-ischemic encephalopathy – magnetic resonance imaging – neonate – ultrasonography
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Chinese summary - 摘要
缺氧缺血性脑病新生患儿放射学检查结果
目标:
超声检查(US)和MRI脑组织发现缺氧缺血性脑病的新生儿分为治疗性低温。
材料和方法:
该研究包括39名新生儿(25名男孩和14名女孩)。 32例(82%)超声检查在治疗低温期间完成,7例(18%)完成后完成。在所有情况下,在治疗后进行脑部MRI扫描。随后,分析了脑影像结果。
结果:
最常见的病理学超声检查研究结果是阻力指数(低体温53.1%,完成后为42.9%),基底神经节和丘脑损伤(低体温15.6%,完成完成后为28.6%);扩散增加脑实质的回声(12.8%在低体温)。脑MRI的主要发现是基底神经节和丘脑损伤(82.1%),其次是皮层和皮质下病变(35.9%),内囊囊后肢变化(30.8%)。出血发生率高达35.9%。
结论:
在治疗期间和治疗后进行的缺氧缺血性脑病的新生儿的超声检查大脑病理学发现分别为68.7%和57.1%。 MRI检查显示病变在82.1%。
关键词:
缺氧缺血性脑病 - 磁共振成像 - 新生儿超声检查
Autoři: L. Bakaj Zbrožková 1; J. Hálek 2,3; K. Michálková 1; M. Heřman 1
Působiště autorů: Radiologická klinika LF UP a FN Olomouc 1; Novorozenecké oddělení, FN Olomouc 2; Dětská klinika LF UP a FN Olomouc 3
Vyšlo v časopise: Cesk Slov Neurol N 2017; 80/113(3): 291-299
Kategorie: Původní práce
Práce byla podpořena grantem UP: IGA_LF_2016_004 a RVO: LF UP 61989592.
Souhrn
Cíl:
Analýza nálezů ultrasonografického a MR vyšetření mozku u donošených novorozenců s hypoxicko-ischemickou encefalopatií indikovaných k léčebné hypotermii.Soubor a metodika:
Soubor tvořilo 39 novorozenců, 25 chlapců a 14 děvčat. U 32 dětí (82 %) bylo ultrazvukové vyšetření vyhotoveno v průběhu léčebné hypotermie, u sedmi dětí (18 %) po jejím ukončení. MR vyšetření bylo u všech dětí realizováno po ukončení hypotermie. Následně byla provedena analýza výsledků ze zobrazovacích metod.Výsledky:
Mezi nejčastější patologie nalezené při UZ vyšetření patřily snížení hodnoty indexu rezistence (v průběhu hypotermie v 53,1 %, po jejím ukončení ve 42,9 %), poškození bazálních ganglií a thalamů (v průběhu hypotermie v 15,6 %, po jejím ukončení v 28,6 %) a difuzní zvýšení echogenity mozkového parenchymu (v průběhu hypotermie ve 12,8 %). Dominantním nálezem při MR vyšetření bylo postižení bazálních ganglií a thalamů (82,1 %), následovaly kortikální a subkortikální léze (35,9 %) a změny v zadních raméncích capsula interna (30,8 %). Vysoké procentuální zastoupení představovalo krvácení (35,9 %).Závěr:
Patologický nález na ultrazvukovém vyšetření mozku u novorozenců s hypoxicko-ischemickou encefalopatií zhotoveném v průběhu léčebné hypotermie byl přítomen v 68,7 %, po jejím ukončení v 57,1 %. Při MR vyšetření byl patologický nález detekován v 82,1 %.Klíčová slova:
hypoxicko-ischemická encefalopatie – magnetická rezonance – novorozenec – ultrasonografieÚvod
Hypoxicko-ischemická encefalopatie (HIE) je významná příčina morbidity a mortality u donošených novorozenců. Její incidence se uvádí v rozmezí 1–8 případů na 1 000 živě narozených dětí [1]. Asi 1/4 novorozenců s HIE, kteří inzult přežijí, má dlouhodobé následky, mezi které nejčastěji patří poruchy psychomotorického vývoje a epilepsie [2].
Diagnostika HIE se zakládá na klinickém obraze, laboratorních nálezech a elektroencefalografickém (EEG) vyšetření. Důležitou roli sehrávají i zobrazovací metody, ultrazvukové (UZ) a především MR vyšetření, které ze zobrazovacích metod dosahuje nejvyšší senzitivity a specificity v diagnostice HIE [3].
Nejspolehlivější terapeutickou metodou se v současnosti jeví řízená léčebná hypotermie [4,5]. Jacobs et al uvádí snížení mortality o 15 % a rizika vzniku mozkové obrny u dětí o 12 % [6]. Pro její zahájení je nutné splnění následujících podmínek:
- Novorozenec je donošený, tj. jeho gestační stáří je ≥ 36 týdnů a je možné zahájit terapii do 6 hod od porodu.
- Je prokázaná nebo velmi pravděpodobná perinatální asfyxie z klinického nebo laboratorního nálezu (skóre dle Apgarové v 10. min < 5, nutnost umělé plicní ventilace v 10. min, známky acidózy z pH pupečníkové nebo arteriální krve odebrané do 60 min od narození < 7, 0 a/ nebo „base excess“ ≥ 16 mmol do 60 min od narození).
- Je přítomna střední nebo těžká encefalopatie projevující se alterací vědomí (letargie, stupor, koma) společně s jedním z následujících klinických příznaků – hypotonie, abnormita reflexů (okulomotorický, pupilární reflex), chybění nebo oslabení sacího reflexu a křeče.
- Je přítomen patologický nález na amplitudou integrovaném elektroencefalografickém (aEEG) záznamu (křečová aktivita, středně abnormní záznam (Discontinuous Normal Voltage; DNV), těžce abnormní záznam – BS vzorec (Burst Supression), těžce abnormní záznam (Low Voltage; LW)) [7–11].
K zahájení léčebné hypotermie je vyžadován podepsaný informovaný souhlas od všech zákonných zástupců. Terapie je započata ihned, jakmile jsou splněna veškerá vstupní kritéria. Existují dva postupy, které zajistí hypotermii v centrálním nervovém systému (CNS): celotělové chlazení nebo selektivní chlazení hlavy. Na našem pracovišti se používá hypotermie s využitím celotělového ochlazení. Principem je rychlé snížení tělesné teploty novorozence na 33,5 °C a dále její udržování v malém rozmezí (33 – 34 °C) po dobu 72 hod. Dítě je v inkubátoru, chlazení je zajištěno cirkulací chlazené vody chladící podložkou. Po této době následuje postupné pomalé zvyšování tělesné teploty, obvykle ne rychlejší než o +0,5 °C/hod. Péče o novorozence zahrnuje kromě monitorace a udržování snížené tělesné teploty také zajištění analgosedace, rovnováhy vnitřního prostředí, umělé plicní ventilace, oběhové podpory, parenterální výživy a symptomatickou léčbu případných komplikací [12].
Ačkoli nález patologických změn na zobrazovacích metodách není zařazen mezi podmínky pro zahájení léčebné hypotermie, jsou zobrazovací metody využívány před zahájením léčby, v jejím průběhu i po jejím skončení. Rutinně se používá transfontaneální UZ, dopplerovská sonografie a MR [13 – 15].
Transfontaneální UZ je vhodný pro svoji snadnou dostupnost, rychlost, opakovatelnost, neinvazivitu a bezpečnost jako zobrazovací metoda první volby při podezření na patologii CNS a také k opakovaným, kontrolním vyšetřením. Je spolehlivá v zobrazení krvácení, periventrikulární leukomalácie (PVL) a hydrocefalu. Nevýhodou UZ vyšetření je jeho subjektivita a z toho plynoucí nízká úroveň shody v detekci a vyhodnocení nálezu mezi více vyšetřujícími a omezená přehlednost struktur při mozkové konvexitě a v oblasti mozkového kmene. Posledně jmenovanou nevýhodu lze částečně potlačit využitím všech přístupných vyšetřovacích oken.
UZ diagnostika HIE bývá v prvních dnech obtížná. Při vyšetření mozku před léčebnou hypotermií a v jejím průběhu můžeme nalézt obraz difuzního mozkového edému, který odpovídá akutní fázi generalizované mozkové ischemie. K typickým UZ známkám edému patří zvýšení echogenity parenchymu hemisfér, smazání kresby gyrů a mezilalokových fisur, stlačení a obtížná rozpoznatelnost komorového systému. Vývojem změn nabývá echogenita parenchymu skvrnitého charakteru, rozšiřuje se a zvyšuje se echogenita kůry, dochází k rozostření kresby gyrifikace, mírně se zvyšuje echogenita v oblasti bazálních ganglií a thalamů [16]. Prvotní cytotoxický otok mozku může být reverzibilní, při nezvratném průběhu ovšem může vyústit v některý z níže uvedených typů ischemického postižení mozkové tkáně.
UZ nálezy v následujících dnech – ke konci hypotermie a po jejím skončení – bývají většinou zřetelnější. Podle lokalizace se dělí na periferní a centrální [17]. K periferním patologickým stavům se řadí změny diferenciace šedé/ bílé hmoty mozkové (zvýšená, chybějící nebo kombinace obou) a změny echogenity kůry a subkortikální bílé hmoty v teritoriálních rozhraních zásobených předními, středními a zadními mozkovými tepnami (parasagitální hemisferální infarkty). Centrální změny zahrnují odlišnosti echogenity centrální šedé hmoty (bazální ganglia a thalamy), zadního raménka capsula interna, periventrikulární bílé hmoty mozkové, kalózního tělesa, hipokampů, dorzální části mozkového kmene, mozečku a změnu šířky komorového systému. V konečném stadiu se u nejtěžších případů rozvíjí obraz rozsáhlé multicystické encefalomalacie s difuzní atrofií [16].
U donošených novorozenců s HIE se může vzácně vyskytnout krvácení v komorovém systému, parenchymu mozku i mozečku [17 – 19].
Součástí UZ vyšetření mozku novorozenců je i dopplerovské vyšetření intrakraniálního tepenného toku se stanovením indexu rezistence (RI), který podává informace o mozkové perfuzi. U zdravých donošených novorozenců je intrakraniální krevní tok nízkoodporový a hodnoty RI se pohybují v rozmezí 0,65–0,85. U pacientů s HIE se zvyšuje jak systolická, tak především diastolická rychlostní komponenta spektrální křivky a RI je snížený [16]. Změny rychlostí mozkového průtoku (peak-systolic flow velocity, end-diastolic flow velocity) v průběhu 12 ± 2 hod života umožňují s vysokou senzitivitou (90 %) a negativní prediktivní hodnotou (94 %) předpovědět závažnost HIE a nepříznivého vývoje v 18 měsících [20]. Snížený RI (< 0,56) v 1.−3. dni života předpovídá nepříznivý vývoj ve 3 letech s 95% senzitivitou [18,19,21]. Jiní autoři uvádějí, že novorozenci s RI < 0,60 v období před hypotermií a v jejím průběhu buď zemřou, nebo budou mít závažné neurologické postižení ve věku 20−32 měsíců než ti s RI > 0,60 [22]. V nejtěžších případech postižení CNS RI nápadně stoupá a telediastolické rychlosti bývají nulové nebo můžeme v diastole pozorovat i obrácení směru toku [16].
MR je obecně používaná metoda k zobrazování patologií mozku u dětí i dospělých. U novorozenců s encefalopatií může objasnit příčinu neurologického deficitu, HIE nebo jiné mozkové léze (vrozené metabolické vady, vrozená či perinatálně získaná infekční onemocnění, vrozené malformace nebo závažná porodní trauma). V případě prokázané HIE může identifikovat její etiologii a dobu vzniku. Výsledky MR vyšetření mohou ovlivnit výběr dalších diagnostických vyšetření a terapeutického postupu a také se pokusit o prognózu [23].
Výhodou zobrazení MR oproti UZ je skvělý tkáňový kontrast, který umožní detekci i těch patologických ložisek, která by při UZ vyšetření nebyla patrná [17]. MR odhalí patologické léze v 75–100 % případů. Dále umožňuje určit jejich přesnou lokalizaci a rozsah [17,24].
Rozsah postižení CNS na MR u dětí s encefalopatií závisí na závažnosti a době trvání hypoperfuze. Při mírné hypoperfuzi dochází k redistribuci krevního toku do metabolicky aktivnějších oblastí, což se projeví ušetřením mozkového kmene, mozečku a centrální šedé hmoty. Při MR vyšetření mozku nacházíme postižení specifických oblastí kůry, nejčastěji kolem sulcus centralis, interhemisferické fisury a inzuly. Kortikální změny bývají doprovázeny i změnou intenzity signálu v přilehlé subkortikální bílé hmotě [25,26]. V případě středně těžké hypoxie je sledovatelný obraz stranově symetrických parasagitálních hemisferálních infarktů, při kterých dochází k odumření tkáně korové a podkorové zóny v teritoriálních rozhraních zásobených hlavními mozkovými tepnami [25,26]. Pro těžkou hypoxii jsou typické léze v oblastech se zvýšenou metabolickou aktivitou a vyšším stupněm myelinizace, nejčastěji v bazálních gangliích (putamen, globus pallidus), thalamu a zadním raménku capsula interna. Dále mohou být přítomny patologické léze v hipokampu, perirolandické lokalitě, oblasti kortikospinálního traktu a senzomotorického kortexu. V nejzávažnějších případech nacházíme i postižení mozkového kmene [25,26].
Nejčastěji detekovanými patologiemi na MR jsou u novorozenců s HIE léze bílé hmoty mozkové na rozhraní povodí velkých mozkových cév (parasagitální infarkty), bazálních ganglií a thalamů. Vzácnější jsou poškození kůry a zadního raménka capsula interna [27 – 29].
V posledních letech je snaha o přijetí MR jako metody první volby ke zhodnocení novorozenecké encefalopatie. Tomu brání jak vysoká cena vyšetření, tak v některých případech nemožnost transportovat novorozence na vyšetření pro jeho špatný klinický stav. Proto u novorozenců s HIE zůstává UZ vyšetření mozku zobrazovací metodou, která se stále provádí jako první [14,21,30].
Cílem našeho sdělení je analyzovat nálezy, které jsme získali při UZ a MR vyšetření mozku u donošených novorozenců s HIE indikovaných k řízené léčebné hypotermii.
Metodika
V období od 1/ 2010 do 5/ 2015 podstoupilo na Novorozeneckém oddělení FN Olomouc léčebnou hypotermii 39 donošených novorozenců, 25 chlapců a 14 děvčat. U všech dětí bylo radiology provedeno UZ a MR vyšetření mozku. U 32 dětí (82 %) bylo UZ vyšetření vyhotoveno v průběhu léčebné hypotermie, u sedmi dětí (18%) po ukončení terapie. MR vyšetření bylo u všech novorozenců zhotoveno po ukončení terapeutické hypotermie, která ve všech případech trvala 72 hod. Následně byla provedena analýza demografických charakteristik souboru a výsledků získaných z UZ a MR vyšetření mozku novorozenců.
Soubor pacientů
Soubor tvořilo 39 dětí, z toho 25 chlapců a 14 děvčat (tab. 1). Průměrný gestační věk byl 39 + 2 týdnů (35 + 4 až 41 + 6). Průměrná porodní váha byla 3 361 g (2 350−4 500 g). Průměrná hodnota skóre dle Apgarové byla v 1. min 2 (0−10), v 5. min 4 (0−10) a v 10. min života 5 (1−10). Průměrná hodnota pH krve (pupečníkové nebo arteriální s odběrem do 60 min od narození) byla 6,88 (6,65−7,24).
Tab. 1. Charakteristika novorozenců. 
Technické parametry UZ vyšetření
UZ vyšetření mozku bylo provedeno na UZ přístroji LOGIQ S5 a LOGIQ S7 Expert od firmy GE Healthcare s využitím sektorové sondy s nosnou sekvencí 8 – 10 MHz. Byly zhotoveny standardní obrazy v koronální, sagitální a parasagitální rovině. Přístupovým oknem byla velká fontanela, případně malá, sfenoidální nebo mastoidální fontanela. K optimalizaci obrazu jsme využili funkce gray-scale amplification gain (GSAG), time-gain compensation (TGC) a fokusace. Cílem bylo detailně zobrazit jak centrální oblast, tak co největší rozsah periferních částí mozku.
Pomocí dopplerovského vyšetření byl sejmut spektrální záznam krevního toku z ascendentní části a. cerebri anterior (ACA) zobrazené v sagitální středočárové rovině. Byly stanoveny rychlosti toku (Peak Systolic Velicity; PSV; a End-Diastolic Velocity; EDV) a RI. RI byl vypočten UZ přístrojem podle následujícího vzorce: PSV – EDV/PSV. Ke stanovení hyperemie mozkové tkáně byl použit barevný doppler a power doppler. Případná přítomnost trombózy splavů byla hodnocena pomocí klasického UZ (B mod) a dopplerovských technik.
Technické parametry MR vyšetření
MR vyšetření byla realizována na 1,5T MR přístroji Magnetom Avanto (Siemens, Erlangen, Německo) za použití 12kanálové hlavové cívky typu phase array. Vyšetřovací protokol obsahoval následující sekvence: T1 vážená sekvence v axiální a sagitální rovině, T1 TIRR a T2 BLADE sekvence v axiální rovině, zobrazení difuze (DWI) spolu s ADC mapami v axiální rovině a SWI zobrazení v axiální rovině. V případě podezření na trombózu splavu z výše uvedených sekvencí byla doplněna 2D time-of-flight MR venografie (MRV). Technické parametry jednotlivých sekvencí jsou uvedeny v tab. 2.
Tab. 2. Technické parametry použitých MR sekvencí. 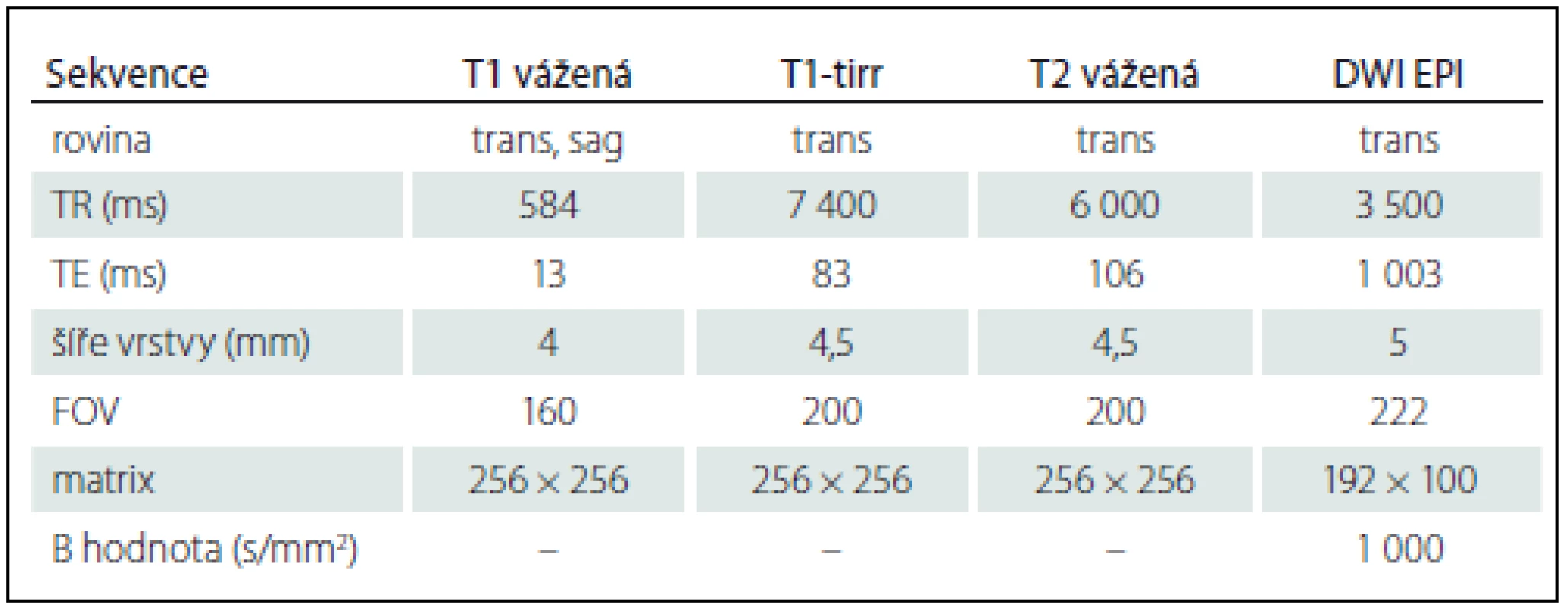
trans – transverzální rovina, sag – sagitální rovina, TR – time to repeat, TE – time to echo, FOV – field of view, EPI – echo-planar imaging, T1-tirr – T1-tirr zobrazení, DWI EPI – echoplanální zobrazení difluze. Princip hodnocení UZ a MR vyšetření
UZ vyšetření i výsledky UZ a MR společně hodnotili dva atestovaní radiologové specializující se na dětskou radiologii. UZ nález byl hodnocen jak během samotného vyšetřování, tak i po jeho ukončení prohlédnutím statických obrazů. MR vyšetření bylo orientačně zhodnoceno v průběhu náběru dat, v případě nutnosti byly zhotoveny doplňkové sekvence, a poté byl proveden definitivní popis vyšetření.
Výsledky
Ze 39 donošených novorozenců bylo 10 dětí (25,6 %) porozeno na Porodnicko-gynekologické klinice LF UP a FN Olomouc a 29 (74,4 %) se narodilo v jiném zdravotnickém zařízení a bylo převezeno na Novorozenecké oddělení FN Olomouc k terapii. Vaginálně bylo porozeno 22 dětí (56,4 %) a císařským řezem 17 (43,6 %). Průměrný čas od narození po zahájení hypotermie byl 3 hod a 49 min (25 min−6 hod). Průměrná doba hospitalizace činila 17,6 (6−40) dnů. Z celkového souboru přežilo 37 dětí (94,9 %), dvě děti (5,1 %) zemřely v období krátce po ukončení hypotermie.
U 32 dětí (82 %) bylo UZ vyšetření vyhotoveno v průběhu léčebné hypotermie, průměrně ve 3. dnu života (1.−4. den života), u sedmi dětí (18 %) po ukončení terapie, průměrně v 6. dnu života (5.−6. den života). Výsledky UZ vyšetření mozku jsou uvedeny v tab. 3. Patologický nález při UZ mozku zhotoveném v průběhu hypotermie byl přítomen v 68,7 % (22/32 případů), v ostatních případech se vyskytoval zcela fyziologický nález. Nejčastěji bylo detekováno snížení RI pod 0,60, v 53,1 % (17/32 případů) (obr. 1). Zvýšení echogenity difuzně v bílé hmotě mozkové (obraz „bright brain“) a léze v oblasti bazálních ganglií a thalamů měly stejné procentuální zastoupení – 15,6 % (5/ 32 případů) (obr. 2). Méně častěji, ve 12,5 % (4/ 32 případů), bylo zaznamenáno zvýšení RI nad 0,80 (obr. 2). Vzácněji se vyskytlo zvýšení echogenity v periventrikulární lokalizaci, ztráta diferenciace šedé/ bílé hmoty mozkové, krvácení do mozkového parenchymu a do komorového systému.
Obr. 1. Obr. 1. Duplexní dopplerovské UZ vyšetření mozku donošeného novorozence (chlapec, gestační stáří 41 + 0), sagitální rovina. Fig. 1. Duplex Doppler US of a term-neonatal brain (boy, gestational age 41 + 0), sagittal plane. 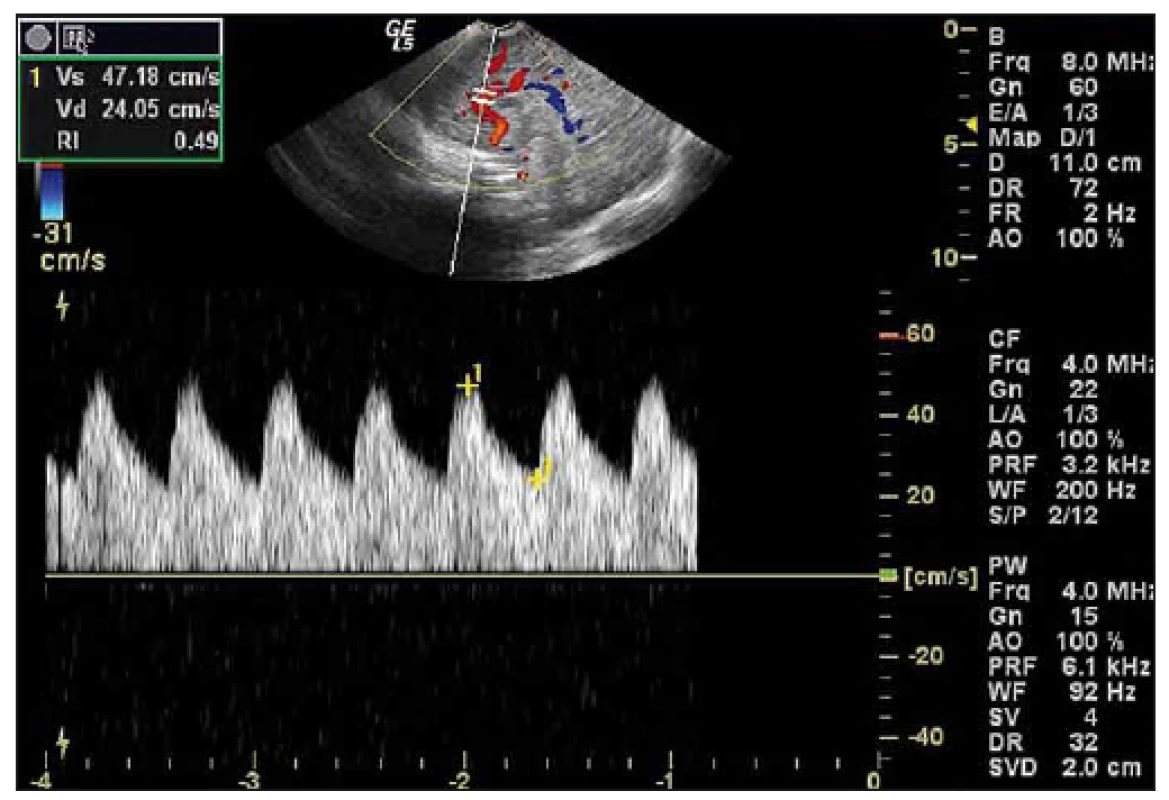
Záznam toku sejmut z a. cerebri anterior, hodnota RI je patologicky snížená na 0,49. Doppler curve with pathological value of RI 0,49 was detected in the anterior cerebral artery. Obr. 2. UZ vyšetření mozku donošeného novorozence (chlapec, gestační stáří 39 + 0) s těžkou HIE. Fig. 2. Cranial US of a term-neonatal brain (boy, gestational age 39 + 0) with severe HIE. 
Obr. 2A, B) UZ, koronální rovina. Mozková kůra je rozšířená a spolu s podkorovou bílou hmotou má zvýšenou echogenitu, kresba gyrů je smazaná, v oblasti thalamů jsou hyperechogenní ischemická ložiska, mozkový parenchym má skvrnitou echogenitu, je přítomno jemné cavum septi pellucidi, ve III. komoře je hyperechogenní hemoragický obsah. Obr. 2C) UZ, parasagitální rovina vedená pravou postranní komorou. Skvrnitá echogenita parenchymu je patrná ve frontálních, parietálních i okcipitálních lalocích. Obr. 2D) Duplexní dopplerovské vyšetření, sagitální rovina. Záznam toku sejmut z a. cerebri anterior, tvar křivky je patologicky změněný s velmi nízkou diastolickou komponentou, hodnota RI je patologicky zvýšená na 0,91. Fig. 2A, B) US, coronal plane. The cortex is widened and together with the subcortical white matter have higher echogenicity, depiction of the gyri is lost. there are hyperechogenic ischemic lesions in both thalami, echogenicity of the brain parenchyma is patchy, subtle cavum septi pellucidi, hyperechogenic hemorragic content in the third ventricle. Fig. 2C) US, parasagittal plane through the right lateral ventricle. Patchy echogenicity of the frontal, parietal and occipital lobes parenchyma. Fig. 2D) Duplex Doppler US, sagittal plane. Pathological shape of the Doppler curve detected on the anterior cerebral artery with very low diastolic component, pathological value of RI 0,91. Tab. 3. UZ nálezy u vyšetřovaných novorozenců. 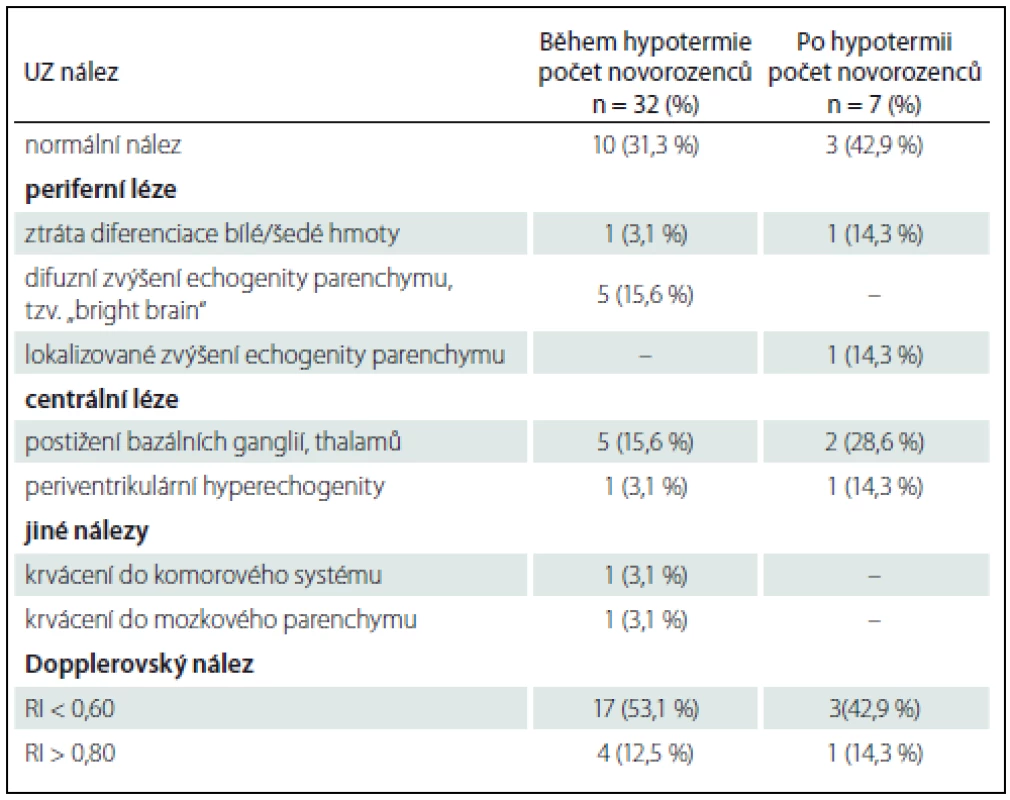
Procentuální zastoupení jednotlivých patologií nedává v součtu 100 %, protože u některých novorozenců byla zastoupena více než jedna patologie. RI – index rezistence. Při UZ mozku provedeném po ukončení léčebné hypotermie byl patologický nález zaznamenán v 57,1 % (4/7 případů). Nejčastěji bylo přítomno snížení RI pod 0,60 – ve 42,9 % (3/7 případů). Nižší zastoupení, 28,6 % (2/7 případů), představovaly léze v bazálních gangliích a thalamech. Méně často se vyskytlo zvýšení RI indexu nad 0,80, ztráta diferenciace šedé/bílé hmoty mozkové, zvýšení echogenity periventrikulárně a lokalizované zvýšení echogenity v bílé hmotě mozkové.
MR vyšetření bylo u všech novorozenců provedeno po ukončení terapeutické hypotermie, průměrně v 8. dnu života (4.−17. den života). Při MR vyšetření byl patologický nález přítomen v 82,1 % (32/39 případů). Zastoupení jednotlivých patologických jednotek je uvedeno v tab. 4. Dominantním nálezem bylo poškození bazálních ganglií a thalamů, které se vyskytlo v 82,1 % případů (32/39 případů) (obr. 3, 4). V 1/3 případů (14/39 případů) byly detekovány kortikální a subkortikální léze (obr. 5). Změny v zadních raménkách capsula interna, které se ve všech případech vyskytly spolu s poškozením hlubokých struktur šedé hmoty mozkové, představovaly 30,8% zastoupení (12/39 případů) (obr. 4). Ojediněle jsme zaznamenali edém mozku se známkami herniace (1/39 případů), pseudocysty v periventrikulární lokalizaci (1/39 případů) a trombózu žilních splavů (1/39 případů) (obr. 3).
Tab. 4. MR nálezy u vyšetřovaných novorozenců. 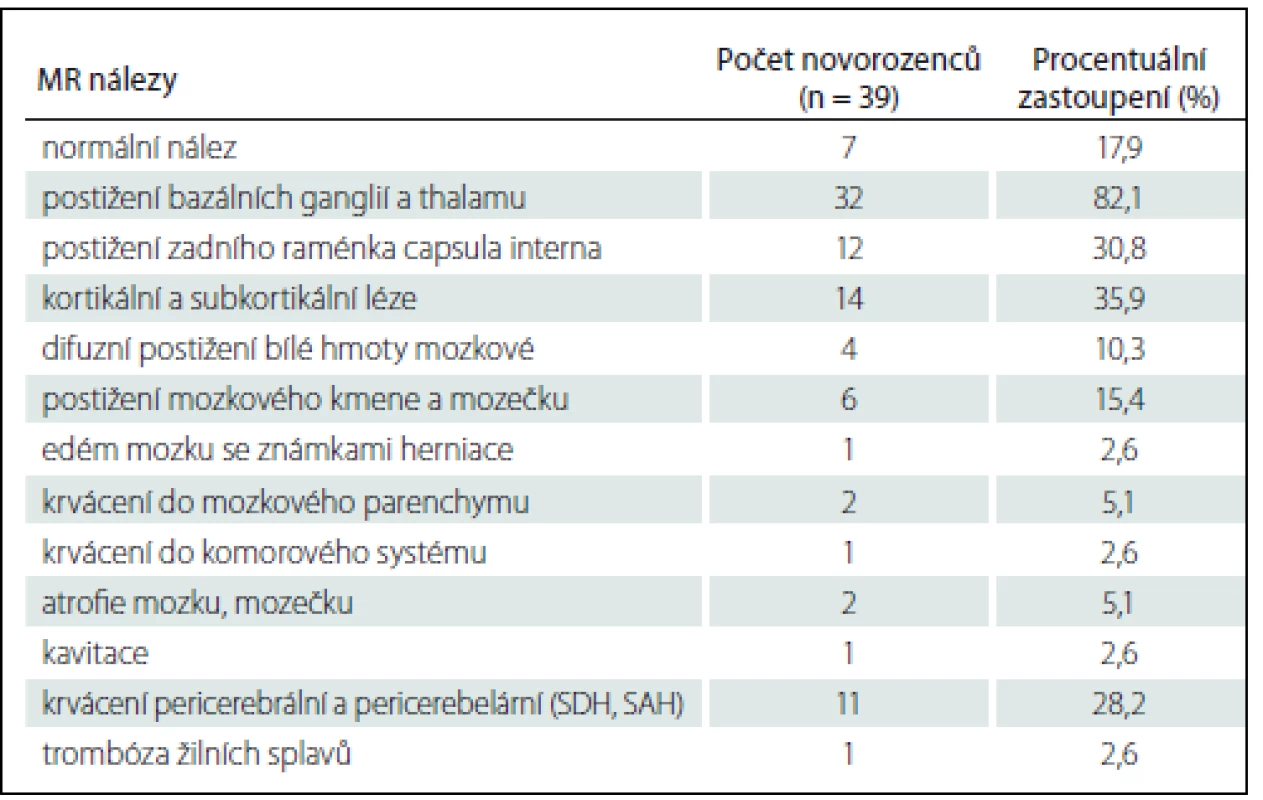
Procentuální zastoupení jednotlivých patologií nedává v součtu 100 %, protože u některých novorozenců byla zastoupena více než jedna patologie. SDH – subdurální hematom, SAH – subarachnoidální hematom. Obr. 3. MR vyšetření mozku donošeného novorozence (dívka, gestační věk 41 + 0), postižení bazálních ganglií, thalamů a bílé hmoty mozkové v okcipitálních lalocích při HIE spolu s trombózou sinus transversus oboustranně. Fig. 3. MRI of a term-neonatal brain (girl, gestational age 41 + 0), pathological lesions in the basal ganglia and thalami, ischemic changes in the white matter of the occipital lobes in a neonate with HIE and trombosis of the both sinus transversus. 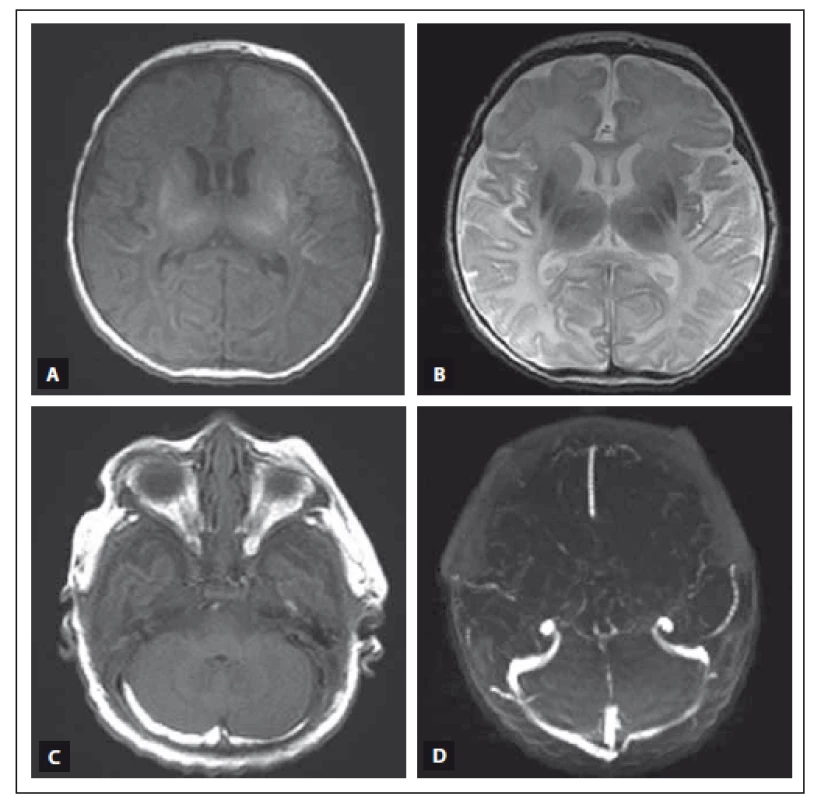
Obr. 3A) MR T1 vážený obraz, axiální rovina. V oblasti bazálních ganglií a thalamů je patologicky zvýšená intenzita signálu a bílá hmota v okcipitálních lalocích má mírně sníženou intenzitu signálu. Zadní raménko capsula interna má fyziologicky zvýšenou intenzitu signálu. Obr. 3B) MR T2 vážený obraz, axiální rovina. Patologicky snížená intenzita signálu bazálních ganglií a thalamů a zvýšená intenzita signálu bílé hmoty okcipitálních laloků. Zadní raménko capsula interna má fyziologicky sníženou intenzitu signálu. Obr. 3C) MR T1 vážený obraz, axiální rovina. V zadní jámě lební, retro- a paracerebelárně, extraaxiálně uložené hypersignální proužkovité léze odpovídající oboustranné trombóze sinus transversus. Obr. 3D) MR venogram, Time of fl ight technika, axiální rovina. Kontrolní vyšetření po léčbě, trombóza splavů již není přítomna. Fig. 3A) T1-weighted MRI, axial plane. Pathological high signal intensity in both basal ganglia and thalami and low signal intensity in the white matter of the occipital lobes. Physiological high signal intensity in the posterior limb of the capsula interna. Fig. 3B) T2-weighted MRI, axial plane. Pathological low signal intensity in both basal ganglia and thalami and high signal intensity in the white matter of the occipital lobes. Physiological low signal intensity in the posterior limb of the capsula interna. Fig. 3C) T1-weighted MRI, axial plane. There are stripelike, high signal intensity lesions in the posterior cerebral fossa, around and behind cerebellum and in the extraaxial space, corresponding to a thrombosis of both sinus transversus. Fig. 3D) MRI sinus venogram, time-of-fl ight technique, axial plane. Follow-up investigation after treatment, the thrombosis of both sinus transversus is absent. Obr. 4. MR vyšetření mozku donošeného novorozence (chlapec, gestační věk 39 + 3), postižení bazálních ganglií, thalamů, zadního raménka capsula interna oboustranně, kůry a bílé hmoty difuzně při těžké HIE. Fig. 4. MRI of a term-neonatal brain (boy, gestational age 39 + 3), pathological lesions in both basal ganglia, thalami, posterior limbs of the internal capsulae, cortex and white matter in a neonate with severe HIE. 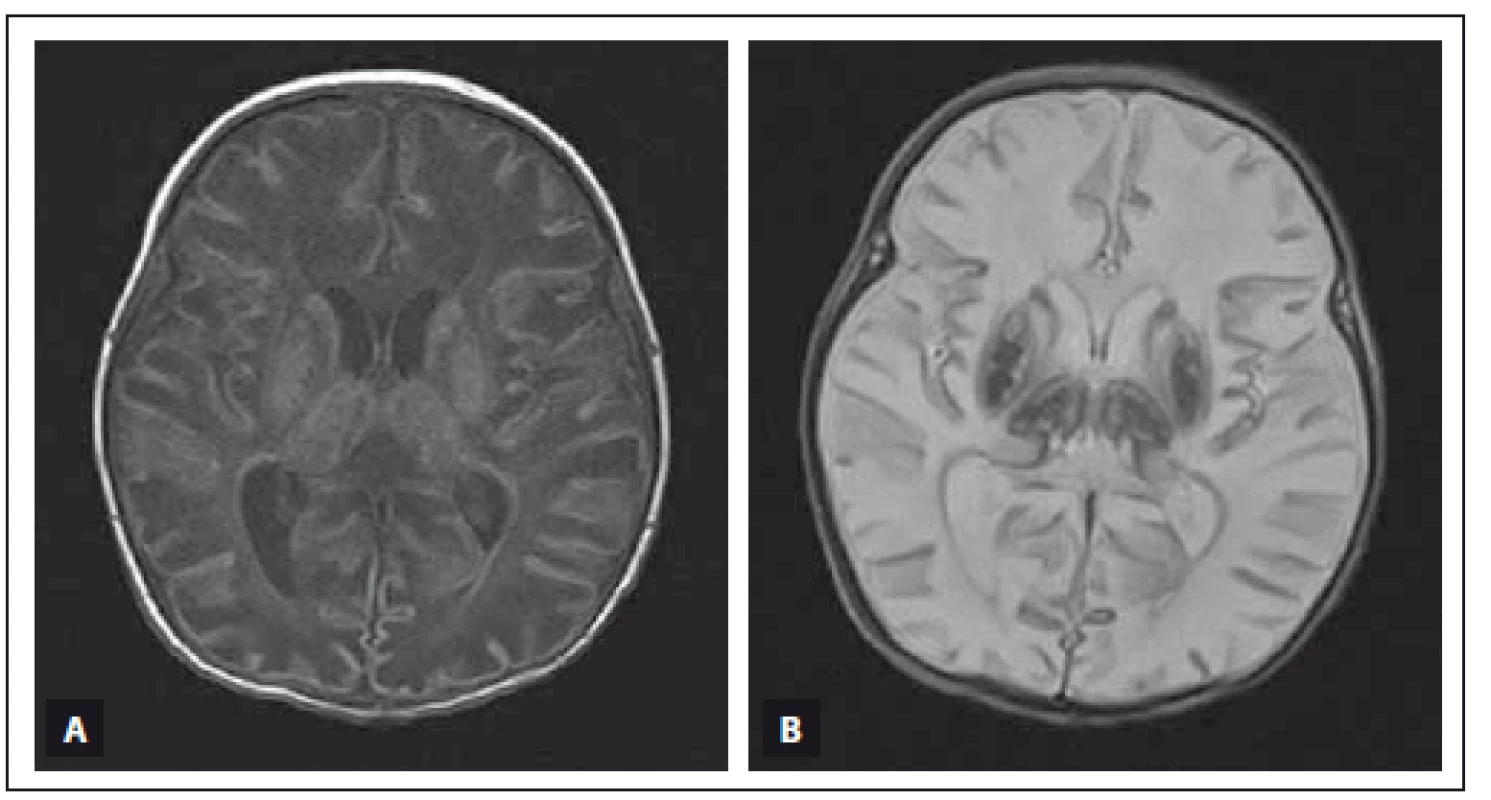
Obr. 4A) MR T1 vážený obraz, axiální rovina. Bazální ganglia, thalamy a kůra mají zvýšenou intenzitu signálu, zadní raménka capsula interna a bílá hmota mozková mají sníženou intenzitu signálu. Obr. 4B) MR T2 vážený obraz, axiální rovina. Bazální ganglia a thalamy mají výrazně sníženou intenzitu signálu, zadní raménka capsula interna a bílá hmota mozková mají zvýšenou intenzitu signálu. Fig. 4A) T1-weighted MRI, axial plane. Basal ganglia, thalami and cortex have high signal intensity, the posterior limb of both internal capsulae and white matter show low signal intensity. Fig. 4B) T2-weighted MRI, axial plane. Basal ganglia and thalami show very low signal intensity, the posterior limb of both internal capsulae and white matter show high signal intensity Obr. 5. MR vyšetření mozku donošeného novorozence (dívka, gestační věk 40 + 0), kortikální a subkortikální změny s ischemickým postižením bílé hmoty mozkové při těžké HIE. Fig. 5. MRI of a term-neonatal brain (girl, gestational age 40 + 0), cortical and subcortical lesions with ischaemic changes of the white matter in frontal and parietal lobes in severe HIE. 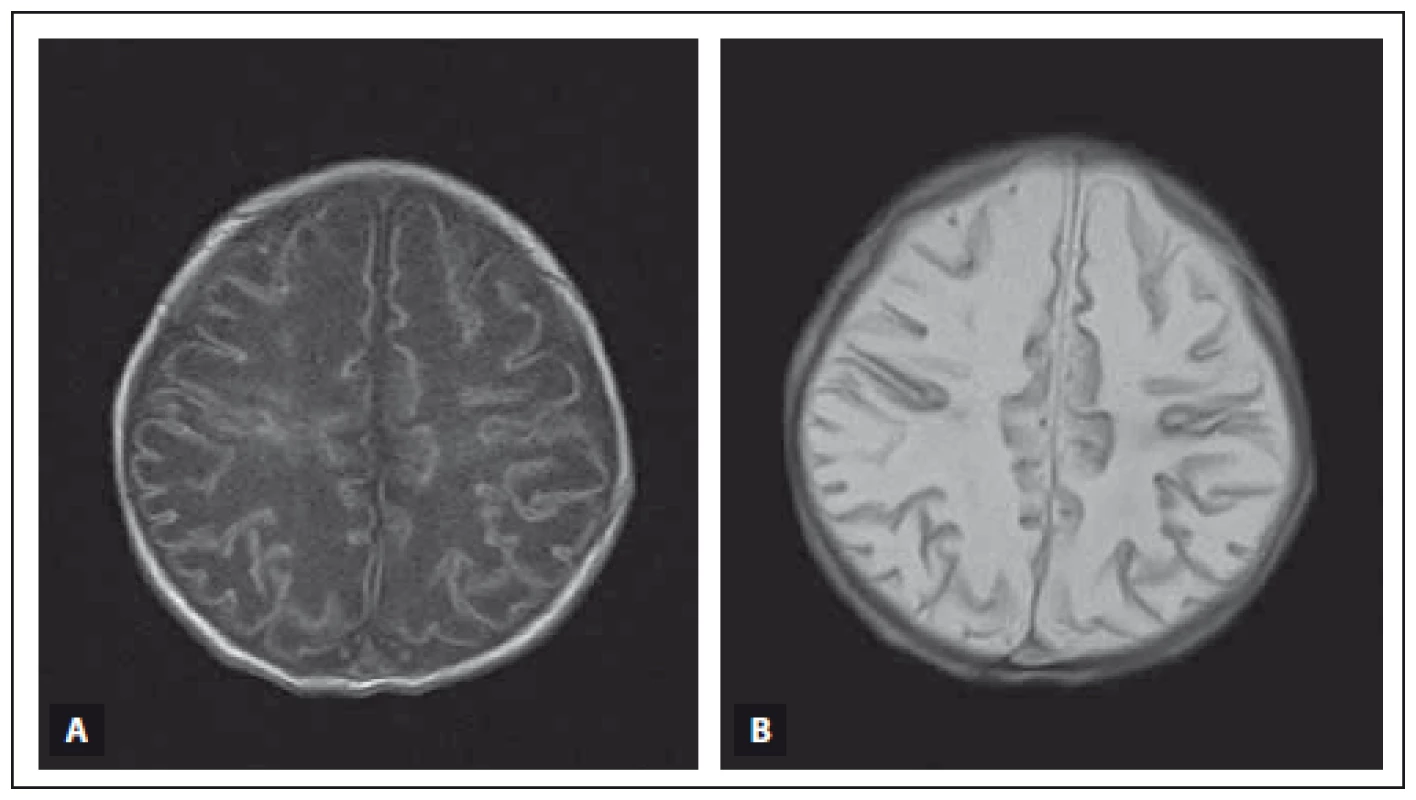
Obr. 5A) MR T1 vážený obraz, axiální rovina. Oboustranně frontoparietálně je patrná zvýšená intenzita signálu kůry a subkortikální bílé hmoty. Obr. 5B) MR T2 vážený obraz, axiální rovina. Kůra má sníženou intenzitu signálu, bílá hmota mozková má difuzně zvýšenou intenzitu signálu. Fig. 5A) T1-weighted MRI, axial plane. Pathological high signal intensity of the cortex and the subcortical white matter. Fig 5B) T2-weighted MRI, axial plane. Pathological low signal intensity of the cortex and high signal intensity of the white matter in the above mentioned areas. Vysoké procentuální zastoupení mělo krvácení (35,9 %). Pericerebrální a pericerebelární krvácení bylo přítomno nejvíce, ve 28,2 % (11/39 případů). Naproti tomu krvácení do mozkového parenchymu a komorového systému se vyskytovalo minoritně.
Diskuze
Naše práce se zabývá přehledem všech patologických nálezů z UZ vyšetření a MR vyšetření, se kterými jsme se setkali při vyšetření mozku donošených novorozenců s HIE, kteří podstoupili celotělovou léčebnou hypotermii ve FN Olomouc. Zahrnuje nejen jednotky patognomické pro HIE, ale i další vzácněji se vyskytující atypické léze.
Při UZ vyšetření mozku novorozenců provedeném v průběhu léčebné hypotermie byl normální nález přítomen v 1/3 našeho souboru (31,3 %, tj. 10/ 32 případů), po ukončení terapie u necelé 1/2 dětí (42,9 %, tj. 3/7 případů). Při MR vyšetření mozku zhotoveném průměrně v 8. dnu života byl podíl fyziologických nálezů nižší, jednalo se o méně než pětinu případů (17,9 %, tj. 7/39 případů). Naopak v multicentrické studii Barnetteho et al se uvádí vyšší procento normálních nálezů při MR vyšetření mozku (67,2 %, tj. 1 798/2 676 případů) zhotoveném v průměrně 6. dnu života, než při UZ vyšetření (32 %, tj. 642/ 2 006 případů) provedeném průměrně ve 2. dnu života [31]. Podobně uvádí Bokiniec et al častější výskyt normálního nálezu při MR vyhotoveném v období mezi 5. dnem a 5. týdnem života (27,6 %, tj. 8/29 případů) než při UZ vyšetření provedeném opakovaně v průběhu prvních 3 dnů života (17,2 %, tj. 5/ 29 případů) [32].
V našem souboru bylo při MR vyšetření nejčastějším patologickým nálezem postižení bazálních ganglií (globus pallidum a putamen) a thalamů (82,1 %, tj. 32/ 39 případů). Při UZ mozku zhotoveném v průběhu hypotermie se tato patologie vyskytla v 15,6 % (5/ 32 případů), po ukončení hypotermie ve 28,6 % (2/7 případů). Obdobně i Bokiniec et al uvádí jako nejčastější patologii patrnou při MR vyšetření postižení bazálních ganglií a thalamů, a to ve 31 % (9/ 29 případů), při UZ vyšetření ve 24,1 % (7/29 případů) [32]. V multicentrické studii Barnetteho et al se také nejčastěji zobrazily patologické léze ve strukturách hluboké šedé hmoty (bazálních gangliích a thalamech), při MR vyšetření u 22,4 % (603/ 2 690) případů a při UZ vyšetření u 7 % (140/2 006) případů [31].
V našem souboru byly při MR vyšetření zaznamenány ve 30,8 % (12/39 případů) změny signálu v zadním raménku capsula interna, což bylo vždy přítomno s postižením bazálních ganglií a thalamů. Výrazně nižší procento výskytu postižení zadního raménka capsula interna (4,2 %, tj. 114/2 690 případů) uvádí Barnette et al [31].
Kortikální změny s postižením přilehlé subkortikální bílé hmoty se v naší studii vyskytly u 35,9 % (14/39 případů), což je o 1/2 vyšší četnost než v práci Barnetteho (21,3 %, tj. 572/2 690 případů) [31] a 1,5krát vyšší výskyt než ve studii Bokiniece (13,8 %, tj. 4/ 29 případů) [32].
V 10,3 % (4/ 39 případů) byly v naší studii při MR vyšetření přítomny parasagitální infarkty; při porovnání s výsledky Barnetteho (10,7 %, tj. 285/ 2 665 případů) se jedná o stejné zastoupení [31].
Poškození mozkového kmene bylo při MR vyšetření zaznamenáno v našem souboru v 15,4 % (6/ 39 případů), ve studii Barnetteho se uvádí ve 4,7 % (126/ 2 690 případů) [31].
Většina autorů ve svých pracích uvádí výskyt pouze lézí patognomických pro HIE [25,26,33]. Li et al popisují i blíže neurčený typ krvácení, které není pro HIE obvyklé [34]. V novějších studiích Bokiniece [32] i Barnetteho [31] je již uveden i detailní popis jednotlivých typů krvácení s jejich výskytem jak při UZ, tak při MR vyšetření. Ve studii prvně jmenovaného autora bylo krvácení přítomno při MR vyšetření celkem v 62 % (18/ 29 případů) a při UZ ve 45 % (13/29 případů). O krvácení do mozkového parenchymu se při MR vyšetření jednalo ve 24 % (7/29 případů) a při UZ ve 20,7 % (6/29 případů), krvácení do parenchymu mozečku při MR ve 13,8 % (4/ 29 případů) a při UZ ve 3,5 % (1/ 29 případů), krvácení do komorového systému při MR ve 13,8 % (4/29 případů) a při UZ ve 20,7 % (6/29 případů) a extraaxiální krvácení (subdurální, epidurální a subarachnoidální krvácení) při MR v 10,3 % (3/29 případů), které při UZ vyšetření nebylo v této lokalitě detekováno. Ve studii Barnetteho bylo nalezeno krvácení při MR vyšetření ve 37 % (999/2 690 případů) a při UZ vyšetření v 16 % (320/2 006 případů) [31]. Z tohoto celkového počtu představovalo intraparenchymatózní krvácení (nespecifikované zda se jedná o mozkové nebo mozečkové) při MR vyšetření 10,8 % (292/ 2 690 případů) a při UZ vyšetření 4,5 % (90/ 2 006 případů), krvácení do komorového systému při MR 8,2 % (220/2 690 případů) a při UZ 8,5 % (171/2 006 případů) a extraaxiální krvácení při MR 18,1 % (487/ 2 690 případů) a na UZ vyšetření 2,9 % (59/2 006 případů). V našem souboru se vyskytlo krvácení při MR vyšetření ve 36 % (14/ 39 případů) a při UZ vyšetření zhotoveném v průběhu hypotermie v 6,2 % (2/ 32 případů). O krvácení do mozkového parenchymu šlo při MR v 5,1 % (2/39 případů) a při UZ vyšetření v 3,1 % (1/ 32 případů). Krvácení do mozečku přítomno nebylo. Shodný nález při MR i UZ vyšetření byl při detekci komorové hemoragie, a to v jednom případě (tj. 2,6 % při MR a 3,1 % při UZ vyšetření). Při porovnání s výsledky Bokiniece byl výskyt pericerebrálního a pericerebelárního krvácení při MR v našem souboru vyšší, a to 28,2 % (11/39 případů) [32].
Trombózu žilního splavu (sinus transversus a sinus sagittalis superior) jako vedlejší nález, který se může vyskytovat s hypoxicko-ischemickými změnami, jsme nalezli při MR vyšetření pouze v jednom případě (2,6 %). Při UZ vyšetření trombóza detekována nebyla. Téměř podobné zastoupení (6,9 %, tj. 2/ 29 případy) uvádí Bokiniec et al [33]. Ve studii Barnette et al byla při MR vyšetření cévní okluze přítomna ve stejném procentuálním zastoupení jako u Bokiniece, ovšem zde není přesněji uvedeno, zda se jednalo o žilní trombózu či tepenný uzávěr [31].
Závěr
Patologický nález při UZ mozku zhotoveném v průběhu hypotermie byl přítomen v 68,7 %, po ukončení hypotermie v 57,1 %. V obou skupinách bylo nejčastěji zaznamenáno snížení hodnoty RI, následované lézemi v oblasti bazálních ganglií a thalamů.
Při MR vyšetření provedeném po ukončení terapeutické hypotermie byl patologický nález přítomen v 82,1 %. Dominantním nálezem při MR vyšetření byly změny v bazálních gangliích a thalamech, následovány krvácením, kortikálními a subkortikálními lézemi, změnami v zadních raménkách capsula interna a difuzním poškozením bílé hmoty mozkové.
MUDr. Lenka Bakaj Zbrožková
Radiologická klinika
LF UP a FN Olomouc
I. P. Pavlova 6
779 00 Olomouc
e-mail: zbrozkova.l@seznam.cz
Přijato k recenzi: 18. 11. 2016
Přijato do tisku: 16. 1. 2017
Zdroje
1. Van Handel M, Swaab H, de Vries LS, et al. Long-term cognitive and behavioral consequences of neonatal encephalopathy following perinatal asphyxia: a review. Eur J Pediatr 2007;166(7):645 – 54.
2. Shankaran S. Neonatal encephalopathy: treatment with hypothermia. J Neurotrauma 2009;26(3):437 – 43. doi: 10.1089/ neu.2008.0678.
3. Barkovich AJ. The encephalopathic neonate: choosing the proper imaging technique. AJNR Am J Neuroradiol 1997;18(10):1816 – 20.
4. Jacobs SE, Morley CJ, Inder TE, et al. Whole-body hypothermia for term and near-term newborns with hypoxic-ischemic encephalopathy: a randomized controlled trial. Arch Pediatr Adolesc Med 2011;165(8):692−700.
5. Thoresen M, Whitelaw A. Therapeutic hypothermia for hypoxic-ischaemic encephalopathy in the newborn infant. Curr Opin Neurol 2005;18(2):111 – 6.
6. Jacobs SE, Berg M, Hunt R, et al. Cooling for newborns with hypoxic ischaemic encephalopathy. Cochrane Database Syst Rev 2013;(1):CD003311.
7. Shah PS. Hypothermia: a systematic review and meta-analysis of clinical trials. Semin Fetal Neonatal Med 2010;15(5):238 – 46. doi: 10.1016/ j.siny.2010.02.003.
8. Shankaran S, Laptook AR, Ehrenkranz RA, et al. Whole-body hypothermia for neonates with hypoxic-ischemic encephalopathy. N Engl J Med 2005;353(15):1574 – 84.
9. Azzopardi DV, Strohm B, Edwards AD, et al. Moderate hypothermia to treat perinatal asphyxial encephalopathy. N Engl J Med 2009;361(14):1349 – 58. doi: 10.1056/ NEJMoa0900854.
10. Edwards AD, Brocklehurst P, Gunn AJ, et al. Neurological outcomes at 18 months of age after moderate hypothermia for perinatal hypoxic ischaemic encephalopathy: synthesis and meta-analysis of trial data. BMJ 2010;340:c363. doi: 10.1136/ bmj.c363.
11. Gunn AJ, Wyatt JS, Whitelaw A, et al. Therapeutic hypothermia changes the prognostic value of clinical evaluation of neonatal encephalopathy. J Pediatr 2008;152(1):55 – 8.
12. Hálek J, Dubrava L, Kamtor L. Léčebná hypotermie v léčbě hypoxicko-iscchemické encefalopatie u novorozenců. Pediatr Praxi 2011;12(6):390 – 3.
13. Ment LR, Bada HS, Barnes P et al. Practice parameter: neuroimaging of the neonate: report of the Quality Standards Subcommittee of the American Academy of Neurology and the Practice Committee of the Child Neurology Society. Neurology 2002;58(12):1726 – 38.
14. Daneman A, Epelman M, Blaser S, et al. Imaging of the brain in full-term neonates: does sonography still play a role? Pediatr Radiol 2006;36(7):636 – 46.
15. Prager A, Roychowdhury S. Magnetic resonance imaging of the neonatal brain. Indian J Pediatr 2007;74(2):173 – 84.
16. Černoch Z, et al. Neuroradiologie. Hradec Králové: Nucleus HK 2000 : 585.
17. Dinan D, Daneman A, Guimaraes CV, et al. Easily overlooked sonographic findings in the evaluation of neonatal encephalopathy: lessons learned from magnetic resonance imaging. Semin Ultrasound CT MR 2014;35(6):627 – 51.
18. Stark JE, Seibert JJ. Cerebral artery Doppler ultrasonography for prediction of outcome after perinatal asphyxia. J Ultrasound Med 1994;13(8):595 – 600.
19. Jongeling BR, Badawi N, Kurinczuk JJ, et al. Cranial ultrasound as a predictor of outcome in term newborn encephalopathy. Pediatr Neurol 2002;26(1):37 – 42.
20. Ilves P, Lintrop M, Metsvaht T, et al. Cerebral blood-flow velocities in predicting outcome of asphyxiated newborn infants. Acta Paediatr 2004;93(4):523 – 8.
21. Epelman M, Daneman A, Kellenberger CJ, et al. Neonatal encephalopathy: a prospective comparison of head US and MRI. Pediatr Radiol 2010;40(10):1640 – 50. doi: 10.1007/ s00247-010-1634-6.
22. Gerner GJ, Burton VJ, Poretti A, et al. Transfontanellar duplex brain ultrasonography resistive indices as a prognostic tool in neonatal hypoxic-ischemic encephalopathy before and after treatment with therapeutic hypothermia. J Perinatol 2016;36(3):202 – 6. doi: 10.1038/ jp.2015.169.
23. Lawn JE, Lee AC, Kinney M, et al. Two million intrapartum-related stillbirths and neonatal deaths: where, why, and what can be done? Int J Gynaecol Obstet 2009;107(Suppl 1):5 – 19.
24. Triulzi F, Baldoli C, Righhini A. Neonatal hypoxic-ischemic encephalopathy. In: Tortori-Donati P, Rossi A, Biancheri R, eds. Pediatric Neuroradiology. Brain. Berlin: Springer-Verlag Heidelberg 2005 : 235 – 55.
25. Chao CP, Zaleski CG, Patton AC. Neonatal hypoxic-ischemic encephalopathy: multimodality imaging findings. Radiographics 2006;26(Suppl 1):159 – 72.
26. Shroff MM, Soares-Fernandes JP, Whyte H, et al. MR imaging for diagnostic evaluation of encephalopathy in the newborn. Radiographics 2010;30(3):763 – 80. doi: 10.1148/ rg.303095126.
27. Okereafor A, Allsop J, Counsell SJ, et al. Patterns of brain injury in neonates exposed to perinatal sentinel events. Pediatrics 2008;121(5):906 – 14. doi: 10.1542/ peds.2007-0770.
28. Jyoti R, O‘Neil R, Hurrion E. Predicting outcome in term neonates with hypoxic-ischaemic encephalopathy using simplified MR criteria. Pediatr Radiol 2006;36(1):38 – 42.
29. Miller SP, Ramaswamy V, Michelson D, et al. Patterns of brain injury in term neonatal encephalopathy. J Pediatr 2005;146(4):453 – 60.
30. Van Wezel-Meijler G, Steggerda SJ, Leijser LM. Cranial ultrasonography in neonates: role and limitations. Semin Perinatol 2010;34(1):28 – 38. doi: 10.1053/ j.semperi.2009.10.002.
31. Barnette AR, Horbar JD, Soll RF, et al. Neuroimaging in the evaluation of neonatal encephalopathy. Pediatrics 2014;133(6):1508 – 17.
32. Bokiniec R, Bekiesińska-Figatowska M, Rudzińska I, et al. Sonographic and MRI findings in neonates following selective cerebral hypothermia. Ginekol Pol 2014;85(12):933 – 8.
33. Heinz ER, Provenzale JM. Imaging findings in neonatal hypoxia: a practical review. AJR Am J Roentgenol 2009;192(1):41 – 7. doi: 10.2214/ AJR.08.1321.
34. Li J, Funato M, Tamai H, et al. Predictors of neurological outcome in cooled neonates. Pediatr Int 2013;55(2):169 – 76.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2017 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Myotonická dystrofie – jednota v různosti
- Je třeba léčit premotorické stadium Parkinsonovy nemoci?
- Je potrebné liečiť premotorické štádium Parkinsonovej choroby?
-
Komentář ke kontroverzím
Je potrebné liečiť premotorické štádium Parkinsonovej choroby? - Febrilní křeče – méně je někdy více
- Riziko poškození plodu v důsledku rentgenových výkonů u gravidních žen
- Vertebrogenní algický syndrom – medicína založená na důkazech a běžná klinická praxe. Existuje důvod něco změnit?
- Výsledky endokrinních funkcí hypofýzy po transsfenoidálních operacích afunkčních makroadenomů
- Radiologické nálezy u donošených novorozenců s hypoxicko-ischemickou encefalopatií
- Token test – validační studie české verze u osob vyššího věku a pacientů s neurodegenerativním onemocněním mozku
- Měření simulace – Test mince v ruce
- Efekty cílené orofaciální rehabilitace u pacientů s poruchou řečových funkcí po cévní mozkové příhodě
- Kvalita života u soběstačných pacientů po cévní mozkové příhodě
- Zobrazení difuzních tenzorů u pacientů s idiopatickým normotenzním hydrocefalem
- Anti-NMDAR protilátky u demyelinizačních onemocnění
- Úspěšná léčba meningoencefalitidy vyvolané Cryptococcus gattii Ommaya rezervoárem a intratékální injekcí amfotericinu B – kazuistika
- Diferenciální diagnostika bithalamické a palidální hypointenzity – kazuistika s mutací HEXB
- Pyridoxin dependentní epilepsie – kazuistiky
- Signifikantní edém mozku u neprasklé arteriovenózní malformace – kazuistika
- Klasifikace nádorů centrálního nervového systému – WHO 2016 Update
-
Analýza dat v neurologii
LXIII. Pozor na interpretaci ekologických (korelačních) studií – II. - Profesor MUDr. Karel Urbánek, CSc., slaví 80 let
- Karel Šonka šedesátiletý
- Recenze knih
- Dopis redakci
- Česká neurochirurgie byla nominována mezi 75 vybraných světových center na globální oslavě prof. Spetzlera
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Myotonická dystrofie – jednota v různosti
- Riziko poškození plodu v důsledku rentgenových výkonů u gravidních žen
- Vertebrogenní algický syndrom – medicína založená na důkazech a běžná klinická praxe. Existuje důvod něco změnit?
- Febrilní křeče – méně je někdy více
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



