-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
První zkušenosti s léčbou vedolizumabem u dětských pacientů s IBD
First experience of vedolizumab in paediatric IBD patients
Introduction: The humanised monoclonal anti-integrin antibody vedolizumab (VDZ) is approved for treatment of both Crohn’s disease (CD) and ulcerative colitis (UC) in adults. However, only retrospective data have been published for paediatric patients, mainly those in whom both conventional and anti-tumour necrosis factor treatment previously failed. Our study aimed to describe all paediatric patients treated with VDZ at our department since this drug became available.
Methods: We retrospectively evaluated both clinical and laboratory data (blood count, C-reactive protein (CRP) concentration and faecal calprotectin (CPT) concentration) of all patients (three with UC and three with CD) previously treated with VDZ at our department. Using a generalised linear mixed model, we searched for associations between VDZ treatment and laboratory markers.
Results: In the model including all patients, VDZ treatment was independently associated with a higher level of haemoglobin (OR 1.018; 95% CI 1.002–1.034) and had a borderline association with a lower level of thrombocytes. In the model including only patients with CD, there was a borderline association between VDZ treatment and a lower level of thrombocytes. In the model including only patients with UC, there were associations between VDZ treatment and the concentrations of CPT (OR 0.572; 95% CI 0.348–0.939), CRP (OR 0.917; 95% CI 0.868–0.969) and haemoglobin (OR 1.071; 95% CI 1.04–1.103).
Discussion: The associations between VDZ treatment and markers of disease activity found in our group of patients are in accordance with previously published data both in adults and a larger group of paediatric patients (N = 64). In that previous study, the authors reported that the CPT concentration significantly decreases during VDZ treatment in patients with UC and tends to decrease in patients with CD.
Conclusion: This study reports our first experience of treating paediatric patients with VDZ at our centre. Despite the relatively small number of patients, we demonstrated an independent association between VDZ treatment and improvement of laboratory markers of disease activity, especially in patients with UC.
Keywords:
vedolizumab – Crohn’s disease, pediatric – ulcerative colitis, pediatric – inflammatory bowel disase
Autoři: Bronský J.; Hradský O.
Působiště autorů: Pediatrická klinika 2. LF UK a FN Motol, Praha
Vyšlo v časopise: Gastroent Hepatol 2019; 73(3): 233-238
Kategorie: IBD: původní práce
doi: https://doi.org/10.14735/amgh2019csgh.info01Souhrn
Úvod: Humanizovaná monoklonální antiintegrinová protilátka vedolizumab (VDZ) byla u dospělých pacientů schválena pro léčbu jak Crohnovy choroby (CD – Crohn’s disease), tak ulcerózní kolitidy (UC – ulcerative colitis). U dětských pacientů byla zatím publikována jen retrospektivní data, a to především u těch, kteří již dříve selhali na konvenční léčbě i anti-tumor nekrotizující faktor terapii. Cílem naší práce bylo popsat sérii všech pediatrických pacientů, kteří byli doposud léčeni VDZ na našem pracovišti.
Metody: Retrospektivně jsme zhodnotili klinická a laboratorní data (krevní obraz, C-reaktivní protein (CRP), fekální kalprotektin (CPT)) od všech pacientů léčených VDZ na našem pracovišti (3 pacienti s UC a 3 s CD). Pomocí generalizovaného lineárního smíšeného modelu jsme hledali asociace mezi léčbou VDZ a laboratorními parametry.
Výsledky: V modelu zahrnujícím všechny pacienty byla s léčbou VDZ nezávisle asociována vyšší hladina hemoglobinu (odds ratio – OR 1,018; 95% CI 1,002–1,034) a hraničně i nižší hladina trombocytů. V samostatném modelu pro pacienty s CD byla s léčbou VDZ hraničně asociována pouze nižší hladina trombocytů. V modelu pro UC byla asociována hladina CPT (OR 0,572; 95% CI 0,348–0,939), CRP (OR 0,917; 95% CI 0,868–0,969) a hemoglobinu (OR 1,071; 95% CI 1,04–1,103).
Diskuze: Asociace mezi léčbou VDZ a parametry aktivity onemocnění zjištěné v našem souboru jsou v souladu s dříve publikovanými daty jak u dospělých, tak u většího množství dětských pacientů (n = 64), kde byl popsán významný pokles hladiny CPT v průběhu léčby u pacientů s UC a statisticky hraniční pokles u CD.
Závěr: Tento článek shrnuje naše první zkušenosti s léčbou dětských pacientů VDZ. I přes relativně malý počet pacientů se podařilo prokázat nezávislou asociaci mezi léčbou VDZ a zlepšením laboratorních parametrů, zejména u pacientů s UC.
Klíčová slova:
vedolizumab – Crohnova choroba v dětském věku – ulcerózní kolitida v dětském věku – zánětlivá střevní onemocnění
Úvod
Vedolizumab (VDZ) byl u dospělých pacientů schválen pro léčbu jak Crohnovy choroby (CD – Crohn’s disease), tak ulcerózní kolitidy (UC – ulcerative colitis). Jedná se o humanizovanou monoklonální protilátku, která se váže na integrin α4β7. Jeho účinnost byla prokázána klinickými studiemi
GEMINI 1 [1] a GEMINI 2 [2]. Přestože ve studii GEMINI 3, která zahrnovala dospělé pacienty s CD, u kterých již dříve selhala anti-tumor nekrotizující faktor (anti-TNF) terapie, nebyl v 6. týdnu nalezen rozdíl v podílu dosažení remise mezi pacienty léčenými VDZ a placebem [3], následující studie z běžné klinické praxe dokládají efektivitu jak při indukci remise, tak u udržovací léčby u UC i CD [4–6]. Z výše zmíněných dat lze odhadovat, že k efektu je třeba delšího času, a to zvláště u CD, kde někteří autoři doporučují hodnotit selhání až s odstupem 6 měsíců léčby VDZ [4]. Nově bylo také prezentováno přímé porovnání preparátů biologické léčby u pacientů se zánětlivým střevním onemocněním (IBD – inflammatory bowel disease), konkrétně VDZ a adalimumabu u dospělých pacientů s UC, kteří již selhali na konvenční léčbě. Dle těchto dat bylo klinické remise dosaženo v 52. týdnu u 31 % pacientů léčených VDZ a 23 % pacientů léčených adalimumabem [7].U dětských pacientů byla zatím publikována jen retrospektivní data, a to především u těch, kteří již dříve selhali na konvenční léčbě i anti-TNF terapii
[8–11]. Tato data ukazují, že VDZ je pravděpodobně efektivní v léčbě dětských IBD pacientů s o něco vyšší účinností ve skupině pacientů s UC [10]. V pediatrii je VDZ podáván v režimu off-label a vždy je vyžadováno schválení revizním lékařem. Cílem naší práce bylo popsat sérii všech pediatrických pacientů, kteří byli doposud léčeni VDZ na našem pracovišti.Soubor pacientů a metody
Retrospektivně jsme zhodnotili klinická a laboratorní data od všech pacientů léčených VDZ na našem pracovišti od uvedení léčiva na trh. Soubor tvořilo 6 pacientů. Podle aktuálně platných kritérií [12] byli 3 zařazeni jako UC, 3 jako CD. Jejich demografická a klinická charakteristika je popsána v tab. 1.
Tab. 1. Demografická a klinická charakteristika pacientů.
Tab. 1. Demographic and clinical characteristics of patients.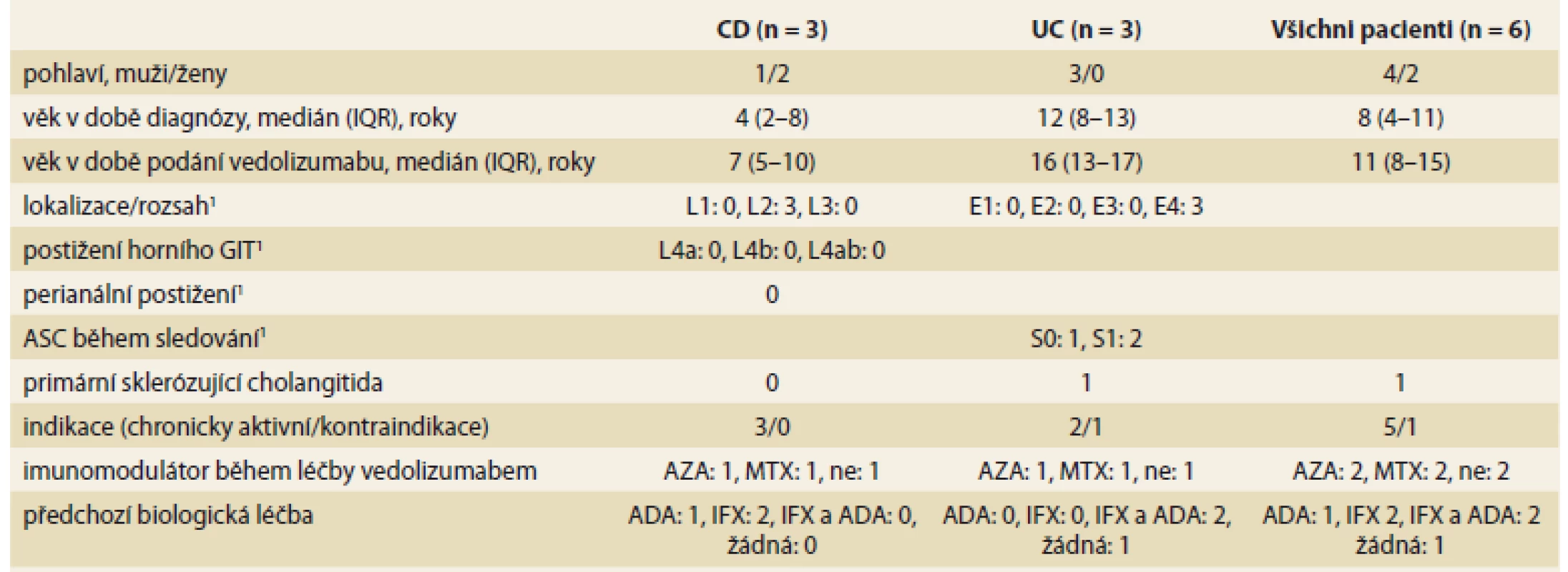
1 – dle Pařížské klasifikace [13] IQR – interkvartilové rozpětí, GIT – gastrointestinální trakt, ASC – akutní těžká kolitida, CD – Crohnova choroba, UC – ulcerózní kolitida, AZA – azathioprin, MTX – metotrexát, ADA – adalimumab, IFX – infliximab U všech pacientů byla získána všechna dostupná data koncentrace krevních destiček (n = 410), hemoglobinu (n = 389), C-reaktivního proteinu (CRP) (n = 415) z nemocniční databáze a dále všechny výsledky fekálního kalprotektinu (CPT) (n = 163) po celou dobu sledování na našem pracovišti. Současně byly shromážděny informace o typu onemocnění dle Pařížské klasifikace [13], o další léčbě pacienta před léčbou a při léčbě VDZ.
Ke statistickému zpracování a tvorbě obrázků byl použit statistický program R. Pomocí generalizovaného lineárního smíšeného modelu jsme hledali asociace mezi léčbou VDZ a laboratorními parametry (CPT, CRP, koncentrace trombocytů a hemoglobinu). CPT byl hodnocen v logaritmické škále.
Výsledky
Laboratorní markery v čase a léčba VDZ
V grafu 1 je uveden průběh hodnot CPT v čase u jednotlivých pacientů léčených VDZ. Z vizuálního hodnocení dat je patrno, že u většiny z nich došlo během léčby VDZ k poklesu hodnot. Pokles byl dlouhodobý, obvykle v řádu 1–2 let. Po přerušení léčby pokles u jednoho z pacientů pokračoval, u druhého došlo opět k vzestupu.
Graf 1. Průběh hladiny CPT u 6 pacientů před, během a po léčbě vedolizumabem. CPT je uveden v logaritmické škále.
Graph 1. The time course of CPT levels in 6 patients before, during and after treatment with vedolizumab. The CPT is shown on a logarithmic scale.
CRP bylo u našich pacientů z pohledu léčby VDZ hůře hodnotitelným markerem. U 3 ze 6 pacientů bylo CRP nízké i před léčbou, u 1 docházelo již před léčbou k poklesu, který na léčbě pokračoval. U 2 pacientů, u kterých CRP před léčbou stoupalo, došlo na terapii VDZ k jeho poklesu (ten pokračoval i po ukončení terapie) (graf 2).
Graf 2. Průběh hladiny sérového CRP u 6 pacientů před, během a po léčbě vedolizumabem.
Graph 2. The time course of serum CRP levels in 6 patients before, during and after treatment with vedolizumab.
Celkem 4 ze 6 pacientů měli před léčbou VDZ významnou trombocytózu. Pouze u 2 z nich došlo na léčbě VDZ k významnému poklesu trombocytů. U ostatních pacientů byly trombocyty stacionární nebo došlo k jejich vzestupu (graf 3).
Graf 3. Průběh počtu krevních destiček u 6 pacientů před, během a po léčbě vedolizumabem.
Graph 3. Progression of platelet counts in 6 patients before, during and after treatment with vedolizum
Hemoglobin u 5 ze 6 pacientů během terapie vzrostl, ale u všech sledovaných pacientů byly hodnoty hemoglobinu v průběhu celého sledování nad 100 g/ l (graf 4).
Graf 4. Průběh hladiny hemoglobinu u 6 pacientů před, během a po léčbě vedolizumabem.
Graph 4. The time course of haemoglobin levels in 6 patients before, during and after treatment with vedolizumab
Laboratorní ukazatele asociované s léčbou VDZ
V generalizovaném lineárním smíšeném modelu jsme hodnotili vztah léčby VDZ a jednotlivých laboratorních markerů i fenotypu onemocnění. V modelu zahrnujícím všechny pacienty byla s léčbou VDZ nezávisle asociována vyšší hladina hemoglobinu (odds ratio – OR 1,018; 95% CI 1,002–1,034) a hraničně i nižší hladina trombocytů (OR 0,998; 95% CI 0,996–1). Významně byla s léčbou asociována diagnóza UC (OR 5,02; 95% CI 1,914–13,168).
V samostatném modelu pro pacienty s CD byla s léčbou VDZ hraničně asociována pouze nižší hladina trombocytů (OR 0,998; 95% CI 0,996–1), zatímco v modelu pro UC bylo nalezeno několik významných nezávislých asociací – CPT (OR 0,572; 95% CI 0,348–0,939), CRP (OR 0,917; 95% CI 0,868–0,969) a hladina hemoglobinu (OR 1,071; 95% CI 1,04–1,103).
Diskuze
Účinnost VDZ byla u dospělých pacientů prokázána v řadě studií jak pro léčbu CD, tak UC, a to zejména u pacientů tzv. naivních k použití anti-TNF léčby, méně pak u pacientů, kteří již léčbu anti-TNF podstoupili [1–3]. V pediatrii není VDZ schválen, a proto jej v režimu off-label po schválení revizním lékařem používáme prakticky vždy až ve 2. (u UC) či 3. linii (CD, UC). Také v tomto kontextu je nutno pohlížet na výsledky získané od naší malé skupiny dětských pacientů. Jedná se o pacienty, u nichž byl VDZ nasazen po dlouhém průběhu předchozí terapie zahrnující jak obvyklou indukční léčbu (v pediatrii obvykle v 1. linii výlučnou enterální výživu), tak použití imunomodulátoru a následně anti-TNF. Při takto prolongovaném průběhu onemocnění, který zahrnuje řadu relapsů vyžadujících intenzifikaci léčby či u některých pacientů dokonce chronickou zánětlivou aktivitu obtížně ovlivnitelnou dosavadní medikací, nelze očekávat stejné výsledky jako u pacientů s krátkým průběhem nemoci nově indikovaných k biologické léčbě. U pacientů s déletrvajícím onemocněním se může vyskytnout řada faktorů, které brání úplné remisi, a jistě jsou přítomny i chronické pozánětlivé změny a trvalé poškození střeva např. fibrotickými změnami neovlivnitelnými běžnou protizánětlivou léčbou.
I přes tyto faktory se u našich pacientů podařilo prokázat asociaci léčby VDZ s poklesem zánětlivých markerů (CPT a CRP) či zlepšením dalších hematologických parametrů obvykle asociovaných s aktivitou IBD, jako je hladina hemoglobinu či míra trombocytózy. Tyto změny byly výraznější u pacientů s UC, což je v souladu s doposud publikovanými daty jak od dospělých, tak dětských pacientů poukazujících na lepší efektivitu VDZ právě u UC ve srovnání s CD [3–6,8–11]. Statisticky neprůkazná asociace u našich pacientů s CD může být také v důsledku malé statistické síly souboru.
Naše poznatky týkající se laboratorních ukazatelů aktivity zánětu jsou v souladu s doposud největší pediatrickou studií popisující retrospektivně 64 dětských pacientů s IBD léčených VDZ (jeden z našich pacientů byl dříve zařazen i do této multicentrické studie) [10]. V této studii byl prokázán trend k poklesu CRP po zahájení léčby (zejména u pacientů s UC), ale průměrné hodnoty CRP nebyly již před léčbou významně zvýšeny. U CPT byl pokles mezi hodnotou před léčbou a hodnotou v posledním bodě v průběhu sledování statisticky velmi významný, a to jak u celé skupiny IBD (p = 0,0006), tak zejména u podskupiny pacientů s UC (p = 0,0005). U pacientů s CD byl rozdíl hraničně statisticky nevýznamný (p = 0,06), ale z hodnocených dat je pokles patrný. Statistická nevýznamnost může být jak známkou horší efektivity VDZ u pacientů s CD, tak i menšího počtu pacientů v této skupině. Uvedená data jsou v souladu s našimi poznatky o asociaci mezi nízkou hladinou CPT a léčbou VDZ, zejména u pacientů s UC.
U podskupiny pacientů, kteří v uvedené studii podstoupili endoskopické vyšetření po zahájení léčby VDZ, byl patrný statisticky významný pokles endoskopického skóre jak u UC (UCEIS), tak u CD (SES-CD), ale pouze 3 ze 16 pacientů (19 %) dosáhli úplného slizničního hojení. V pediatrii nejsou z mnoha důvodů běžně prováděna kontrolní endoskopická vyšetření na léčbě a ani v našem souboru pacientů nebyla rutinně prováděna. Proto nemůžeme naše výsledky v tomto ohledu s výše uvedenou studií porovnat.
Ani data týkající se hladiny hemoglobinu či trombocytů nelze s našimi poznatky porovnat, neboť nebyla ve výše uvedené multicentrické studii hodnocena. Naše zjištění jsou však v souladu s obecně přijímaným principem, kdy anemie a trombocytóza jsou obvyklým obrazem aktivity IBD jak u dospělých, tak u dětských pacientů.
Závěr
Tento článek shrnuje naše první zkušenosti s léčbou dětských pacientů VDZ. I přes relativně malý počet pacientů se podařilo prokázat nezávislou asociaci mezi léčbou VDZ a zlepšením laboratorních parametrů, zejména u pacientů s UC.
Doručeno/: 1. 4. 2019
Přijato/: 9. 4. 2019
doc. MUDr. Ondřej Hradský, Ph.D.
Pediatrická klinika 2. LF UK a FN Motol, Praha
V Úvalu 84
150 06 Praha 5
Zdroje
1. Feagan BG, Rutgeerts P, Sands BE et al. Vedolizumab as induction and maintenance therapy for ulcerative colitis. N Engl J Med 2013; 369(8): 699–710. doi: 10.1056/ NEJMoa1215734.
2. Sandborn WJ, Feagan BG, Rutgeerts P et al. Vedolizumab as induction and maintenance therapy for Crohn’s disease. N Engl J Med 2013; 369(8): 711–721. doi: 10.1056/ NEJMoa1215739.
3. Sands BE, Feagan BG, Rutgeerts P et al. Effects of vedolizumab induction therapy for patients with Crohn’s disease in whom tumor necrosis factor antagonist treatment failed. Gastroenterology 2014; 147(3): 618–627e3. doi: 10.1053/ j.gastro.2014.05.008.
4. Dulai PS, Singh S, Jiang X et al. The real-world effectiveness and safety of vedolizumab for moderate-severe Crohn’s disease: results from the US VICTORY consortium. Am J Gastroenterol 2016; 111(8): 1147–1155. doi: 10.1038/ ajg.2016.236.
5. Stallmach A, Langbein C, Atreya R et al. Vedolizumab provides clinical benefit over 1 year in patients with active inflammatory bowel disease – a prospective multicenter observational study. Aliment Pharmacol Ther 2016; 44(11–12): 1199–1212. doi: 10.1111/ apt.13813.
6. Vivio EE, Kanuri N, Gilbertsen JJ et al. Vedolizumab effectiveness and safety over the first year of use in an IBD clinical practice. J Crohns Colitis 2016; 10(4): 402–409. doi: 10.1093/ ecco-jcc/ jjv226.
7. Schreiber S, Peyrin-Biroulet L, Loftus EV Jr et al. OP34 VARSITY: a double-blind, double-
-dummy, randomised, controlled trial of vedolizumab versus adalimumab in patients with active ulcerative colitis. J Crohns Colitis 2019; 13 (Suppl 1): S612–S613.8. Singh N, Rabizadeh S, Jossen J et al. Multi-center experience of vedolizumab effectiveness in pediatric inflammatory bowel disease. Inflamm Bowel Dis 2016; 22(9): 2121–2126. doi: 10.1097/ MIB.0000000000000865.
9. Schneider AM, Weghuber D, Hetzer B et al. Vedolizumab use after failure of TNF-alpha antagonists in children and adolescents with inflammatory bowel disease. BMC Gastroenterol 2018; 18(1): 140. doi: 10.1186/ s12876-018-0868-x.
10. Ledder O, Assa A, Levine A et al. Vedolizumab in paediatric inflammatory bowel disease: a retrospective multi-centre experience from the Paediatric IBD Porto Group of ESPGHAN. J Crohns Colitis 2017; 11(10): 1230–1237. doi: 10.1093/ ecco-jcc/ jjx082.
11. Conrad MA, Stein RE, Maxwell EC et al. Vedolizumab therapy in severe pediatric inflammatory bowel disease. Inflamm Bowel Dis 2016; 22(10): 2425–2431. doi: 10.1097/ MIB.000 0000000000918.
12. Birimberg-Schwartz L, Zucker DM, Akriv A
et al. Development and validation of diagnostic criteria for IBD subtypes including IBD-unclassified in children: a multicentre study from the pediatric IBD Porto Group of ESPGHAN. J Crohns Colitis 2017; 11(9): 1078–1084. doi: 10.1093/ ecco-jcc/ jjx053.13. Levine A, Griffiths A, Markowitz J et al. Pediatric modification of the Montreal classification for inflammatory bowel disease: the Paris classification. Inflamm Bowel Dis 2011; 17(6): 1314–1321. doi: 10.1002/ ibd.21493.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek Editorial 2019Článek Správná odpověď na kvíz
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2019 Číslo 3- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Editorial 2019
- K životnímu jubileu prof. MU Dr. Přemysla Friče, DrSc.
- Rektální léze odstraněná technikou endoskopické submukózní disekce
- Perkutánní endoskopická gastrostomie – doporučený postup České gastroenterologické společnosti ČLS JEP
- Periprocedurálne komplikácie POEM
- Průměrný adenom na koloskopii významně koreluje s mírou detekce adenomu, ale ne s mírou detekce polypu jak pro screening, tak pro všechny koloskopie
- Akutní komplikace hiátových hernií
- Časové intervaly pro přípravu střeva nízkoobjemovými roztoky
- První zkušenosti s léčbou vedolizumabem u dětských pacientů s IBD
- MALT lymfom žaludku, zajímavý endoskopický obraz
- Metastázy v žalúdku a duodene ako raritná príčina akútneho krvácania do horného gastrointestinálneho traktu
- Renální komplikace akutních a chronických onemocnění jater
- Díl III. – Epidemiologie idiopatických střevních zánětů v české populaci – časový vývoj a statistické predikce počtu pacientů
- Výběr z mezinárodních časopisů
- Kreditovaný autodidaktický test
- Správná odpověď na kvíz
- Hemové železo v substituci sideropenie a sideropenní anémie
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Akutní komplikace hiátových hernií
- Perkutánní endoskopická gastrostomie – doporučený postup České gastroenterologické společnosti ČLS JEP
- MALT lymfom žaludku, zajímavý endoskopický obraz
- Hemové železo v substituci sideropenie a sideropenní anémie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



